Агрохимия, 2023, № 2, стр. 79-86
Пробоподготовка QuEChERS при определении пестицидов в яблоках хромато-масс-спектрометрическим методом
А. З. Мухарлямова 1, *, М. В. Балымова 1, А. Г. Мухамметшина 1, К. Е. Буркин 1, Ф. А. Бекмуратова 1
1 Федеральный центр токсикологической, радиационной и биологической безопасности
420075 Казань, ул. Научный городок-2, Республика Татарстан, Россия
* E-mail: muharlyamova82@mail.ru
Поступила в редакцию 11.10.2022
После доработки 24.10.2022
Принята к публикации 15.11.2022
- EDN: MSZNTS
- DOI: 10.31857/S0002188123020114
Аннотация
Подобраны оптимальные условия газохроматографического анализа с масс-спектрометрическим детектированием (ГХ–МС), которые позволили получить удовлетворительное разделение и идентификацию некоторых хлорорганических (ХОП) и фосфорорганических (ФОП) пестицидов. Исследовано несколько сорбентов на этапе очистки экстракта с целью уменьшения матричного эффекта для достижения более высокой точности анализа. Проведена оценка полноты извлечения ХОП и ФОП из матрицы яблок на примере следующих пестицидов: гексахлорциклогексана (ГХЦГ, α-, β- и γ-изомеры), диметоата, фозалона, хлорпирифоса. Установлено, что наиболее эффективным оказалось применение сорбента Florisil в сочетании с MgSO4, которое позволило максимально снизить матричные эффекты и получить лучшие показатели степени извлечения исследованных аналитов. С помощью данного метода проведен мониторинг содержания остаточных количеств пестицидов в плодах яблонь разных сортов.
ВВЕДЕНИЕ
Яблоки – одни из наиболее распространенных фруктов, присутствующих в нашем рационе круглый год. Они содержат минимальный уровень сахара и богаты питательными веществами, включая пектин, витамины, минералы, антиоксиданты, флавоноиды, танины, дубильные вещества, каждый из которых необходим для нормального функционирования организма. Например, пектин помогает улучшить работу желудочно-кишечного тракта, а минералы нужны для метаболизирования избытка соли в организме [1]. Известно, что флавоноиды способны предотвращать развитие раковых клеток. Благодаря наличию антиоксидантов, которые сдерживают процессы окисления, и танинов, обладающих противовоспалительным действием, данный фрукт помогает предотвратить различные хронические заболевания, такие как астма и ишемическая болезнь сердца [2, 3]. Однако даже столь полезный фрукт может нанести вред здоровью человека при наличии в нем остаточных количеств ядохимикатов (инсектицидов, гербицидов, пиретроидов), которые применяют в сельском хозяйстве для защиты большинства культур от вредителей [4].
Пестициды – это вещества или смеси соединений, которые используют для борьбы с вредителями, включая насекомых, сорняки и микроорганизмы [5, 6]. Ежегодно во всем мире для борьбы с вредителями и болезнями многих фруктовых и овощных культур используется огромное количество пестицидов. По этой причине, помимо присутствия в окружающей среде, данные ядохимикаты часто оказываются и в пищевых продуктах [7, 8].
На сегодняшний день выращивание яблок в большинстве случаев не обходится без применения пестицидов, необходимых для обеспечения роста и сохранности урожая. Чрезмерное применение этих соединений может привести к наличию их остаточных количеств в плодах после сбора урожая [9]. Следует учитывать, что в сухих условиях и при низких температурах период полураспада пестицидов увеличивается. Их остаточные количества могут нанести значительный ущерб здоровью потребителей [10].
В связи с этим необходимо проводить контроль содержания остаточных количеств ядохимикатов в окружающей среде и пищевых продуктах. Для идентификации и количественной оценки применяемых пестицидов требуются быстрые и удобные методы определения, среди которых основными на сегодняшний день являются газовая (ГХ) и высокоэффективная жидкостная хроматография (ВЭЖХ) в сочетании с масс-спектрометрией (МС) [11, 12]. Одним из часто применяемых способов пробоподготовки проб при анализе остатков пестицидов является QuEChERS и его модификации, к преимуществам которых относится высокие пропускная способность образца и степень извлечения целевых аналитов, низкое потребление растворителя и короткое время анализа [13, 14]. При этом, несмотря на значительные преимущества, метод требует адаптации для каждого вида матриц, необходимо улучшать условия хроматографического разделения и пробоподготовки целевых аналитов для анализа остаточных количеств пестицидов различных классов.
Исходя из вышеизложенного, цель работы – адаптация способа QuEChERS при определении остаточных количеств пестицидов (в первую очередь хлорорганических (ХОП) и фосфорорганических (ФОП)) в образцах яблок с применением ГХ–МС.
МЕТОДИКА ИССЛЕДОВАНИЯ
Инструментальная часть. Работу проводили на газовом хроматографе “Хроматэк Кристалл 5000”, снабженном масс-спектрометрическим детектором, кварцевой капиллярной колонкой “Chromatec CR-5ms” 30 м × 0.25 мм × 0.25 мкм, и автоматическим дозатором пробы ДАЖ-2М 3D производства фирмы “Хроматэк” (Россия), с регистрацией масс-спектров электронной ионизации (энергия электронов 70 эВ) в диапазоне соотношений m/z = 35–600, при оптимальных условиях газохроматографического разделения (табл. 1). Обработку данных хромато-масс-спектрометрических анализов осуществляли с помощью программного обеспечения “Хроматэк Аналитик” и электронной библиотеки масс-спектров “NIST 2020” (США).
Таблица 1.
Режим работы газового хроматографа при анализе проб
| Параметр | Величина, условия |
|---|---|
| Температура испарителя и порта ввода | 280°С |
| Температура переходной линии | 270°С |
| Температура источника ионов | 230°С |
| Термостат колонок | начальная температура – 80°С, |
| выдержка при данной | |
| температуре – 2 мин, | |
| скорость подъема | |
| температуры – 10°С/мин, | |
| конечная температура – 280°С | |
| Ввод пробы | с делением потока 1:10 |
| Объем вводимой пробы | 1 мкл |
| Длительность анализа | 47 мин |
| Расход газа-носителя (He, 99.999%) | 1 мл/мин, постоянный поток |
Реагенты и объекты исследования. Использовали следующие аналитические стандарты: α-ГХЦГ, β-ГХЦГ, γ-ГХЦГ производства “ХромЛаб” (Россия), диметоат, фозалон, хлорпирифос производства НПК “БЛОК-1” (Россия), сульфат магния безводный, ацетат натрия, ацетонитрил марки “х.ч.”, PSA (сорбент, содержащий в качестве привитой группы алкиламин с двумя различными NH2-группами), Florisil (сорбент, являющийся силикатом магния).
Пробоподготовка. В качестве объектов исследования были отобраны образцы яблок различных сортов и стран происхождения урожая осени 2021 г. Подготовку проб к анализу осуществляли по классической методике QuEChERS (рис. 1). Статистическую обработку полученных результатов проводили с использованием пакета анализа данных Microsoft Exel.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Метод ГХ–МС был выбран для качественного и количественного определения содержания ХОП и ФОП в связи с его высокой чувствительностью, точностью и способностью детектировать низкие концентрации исследуемых пестицидов. При этом были проработаны различные вариации настройки масс-спектрометрического детектора и газового хроматографа с целью подбора оптимальных условий анализа. Предел количественного определения (ПКО) ХОП (ГХЦГ, α-, β- и γ- изомеры) составил 0.5 мкг/кг, ФОП (диметоат, фозалон, хлорпирифос) – 7.5 мкг/кг.
Для достижения поставленной цели исследования рассматривали влияние матричного эффекта на полноту извлечения пестицидов из экстракта яблок. В качестве эталонной матрицы были выбраны экстракты, предварительное исследование которых показало отсутствие остаточных количеств пестицидов класса ХОП и ФОП.
Способ пробоподготовки QuEChERS включает экстракцию ацетонитрилом с добавлением солей и следующую за ней стадию отчистки экстракта. При проведении последней были апробированы различные сочетания сорбентов PSA и Florisil с целью оптимизации процессов удаления сопутствующих веществ из конечного экстракта, оказывающих негативное влияние на уровень фонового шума и способных перекрывать сигналы хроматографических пиков целевых аналитов. В результате проведенных исследований наблюдали значительные матричные помехи при использовании картриджа с PSA + MgSO4. Добавление сорбента Florisil на стадии очистки привело к снижению фонового шума и уменьшению аналитических помех от матрицы.
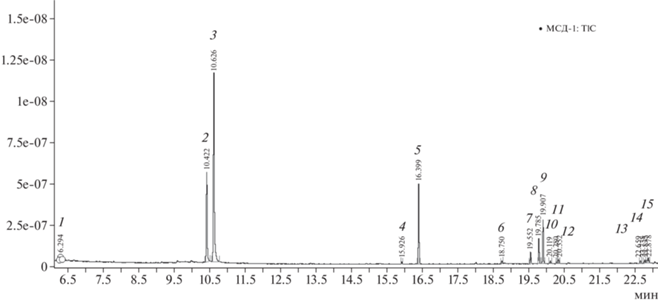
Ацетонитрильный экстракт матрицы, согласно полученным масс-спектрам, содержал небольшие количества соединений различных классов, включая производные многоатомных спиртов и жирных кислот (рис. 2).
Рис. 2.
Хроматограмма полного ионного тока ацетонитрильного экстракта из яблок, полученная способом QuEChERS и с применением картриджа Florisil + MgSO4 (1 – диоксим этандиола, 2, 3 – изомеры октандиола, 4, 5, 9, 11 – фаза капиллярной колонки, 6 – пальмитиновая кислота и ее производные, 7 – стеариновая кислота и ее производные, 8 – олеиновая кислота и ее производные, 10 – бензойной кислоты, 4-[7-(4-гептилфенил)-1,2,3,4-тетрагидро-1,3-диметил-2,4-диоксо-8H-имидазо [2,1-f]пурин-8-ил]-, 12, 13, 14 – неидентифицированные соединения, 15 – фенол, 2,2'‑метилен, бис[6-(1,1-диметилэтил)-4-метил-).
Исследования полноты извлечения проводили методом “введено–найдено” с использованием широко применяемых для защиты плодовых и плодово-ягодных культур хлорорганических (α-ГХЦГ, β-ГХЦГ, γ-ГХЦГ) и фосфорорганических пестицидов (диметоат, фозалон, хлорпирифос) (рис. 3). Образцы для проведения хроматографического исследования готовили в четырехкратной повторности. Идентификацию компонентов проводили по временам удерживания и характеристическим ионам в базе электронной библиотеки масс-спектров “NIST 2020” (рис. 4), количественное определение – методом абсолютной калибровки.
Рис. 3.
Хроматограмма полного ионного тока ацетонитрильного экстракта из яблок, полученная способом QuEChERS и с применением картриджа Florisil + MgSO4, предварительно контаминированного 6-ю пестицидами (0.1 мкг/мл).

Рис. 4.
Масс-спектры определяемых пестицидов: (а) – диметоат, (б) – хлорпирифос, (в) – фозалон, (г) – α-ГХЦГ, β-ГХЦГ и γ-ГХЦГ.

Установили, что при использовании на стадии очистки экстракта картриджа с PSA + MgSO4 полнота извлечения каждого из контаминантов была не высокой (табл. 2). Комбинирование сорбентов PSA + Florisil + MgSO4 позволило получить извлечение искомых аналитов >72%. Наиболее эффективным для фруктовых матриц оказалось применение Florisil + MgSO4, с помощью которого удалось получить высокие величины исследованного показателя (>81%). Таким образом, полученные результаты показали, что данный метод применим для анализа и количественного определения ХОП и ФОП в семечковых плодах.
Таблица 2.
Результаты полноты извлечения (стандартное отклонение, доверительный интервал) ХОП и ФОП из модельных образцов яблок (n = 4, P = 0.95)
| Cоединение | Полнота извлечения, % | Стандартное отклонение, % | Доверительный интервал, ± % | |
|---|---|---|---|---|
| PSA + MgSO4 | ||||
| ХОП | α-ГХЦГ | 75.3 | 0.07 | 0.16 |
| β-ГХЦГ | 73.6 | 0.14 | 0.29 | |
| γ-ГХЦГ | 69.5 | 0.10 | 0.22 | |
| ФОП | диметоат | 68.6 | 0.10 | 0.22 |
| фозалон | 71.7 | 0.20 | 0.43 | |
| хлорпирифос | 60.2 | 0.16 | 0.35 | |
| PSA + Florisil + MgSO4 | ||||
| ХОП | α-ГХЦГ | 85.4 | 0.18 | 0.38 |
| β-ГХЦГ | 78.2 | 0.10 | 0.21 | |
| γ-ГХЦГ | 83.7 | 0.12 | 0.26 | |
| ФОП | диметоат | 76.4 | 0.13 | 0.28 |
| фозалон | 83.8 | 0.19 | 0.41 | |
| хлорпирифос | 72.3 | 0.13 | 0.27 | |
| Florisil + MgSO4 | ||||
| ХОП | α-ГХЦГ | 91.3 | 0.09 | 0.19 |
| β-ГХЦГ | 86.7 | 0.07 | 0.15 | |
| γ-ГХЦГ | 88.1 | 0.04 | 0.08 | |
| ФОП | диметоат | 85.3 | 0.06 | 0.13 |
| фозалон | 89.4 | 0.06 | 0.12 | |
| хлорпирифос | 81.7 | 0.08 | 0.17 | |
В торгово-розничных сетях г. Казани были отобраны образцы яблок разных сортов и стран происхождения для определения содержания в них осточных количеств ХОП и ФОП с применением пробоподготовки QuEChERS и очисткой экстракта с использованием Florisil + MgSO4.
Как правило, импортные яблоки обрабатывают воском, что увеличивает сроки хранения данного продукта и улучшает товарный вид, придавая им глянцевый блеск. В исследованиях многих авторов отмечено, что яблоки, покрытые воском, в большинстве случаев содержат ядохимикаты. Например, в работе [15] представлены результаты исследования растительной продукции, в частности яблок, на содержание ХОП, в ходе которых были обнаружены остаточные количества α-ГХЦГ (0.08 мг/кг), β-ГХЦГ (0.08 мг/кг), ДДТ (0.007–0.04 мг/кг) и гептахлора (0.008–0.013 мг/кг). Также при исследовании яблочных выжимок [16] было выявлено наличие ГХЦГ (α-, β-, γ-изомеров) в количестве <0.03 мг/кг и ДДТ и его метаболитов в количестве <0.06 мг/кг.
Известно, что кожура яблок способна поглощать пестициды, которые с ее поверхности могут проникнуть внутрь плода. Таким образом, на внешней поверхности яблок, возможно, более высокое содержание пестицидов, что подтверждено исследованиями многих авторов [17–19]. В связи с этим в настоящей работе исследования мякоти и кожуры каждого образца были проведены отдельно. Образцы (мякоть, кожура) для проведения хроматографического анализа готовили в шестикратной повторности для каждого сорта.
В образцах яблок (мякоть и кожура), подвергшихся исследованию, остаточных количеств пестицидов не было выявлено на уровне чувствительности примененного метода (табл. 3). Исходя из полученных результатов можно заключить, что яблоки, подвергшиеся исследованию, были безопасными для здоровья потребителей.
Таблица 3.
Результаты ГХ–МС-определения содержания пестицидов в плодах яблонь различных сортов (n = 6, Р = 0.95)
| Объект исследования, сорт | Определяемое соединение | Найдено, мкг/кг | ПКО, мкг/кг |
|---|---|---|---|
| № 1 Грени Смит (мякоть, кожура) | ХОП | <0.5 | 0.5 |
| ФОП | <7.5 | 7.5 | |
| № 2 Роял Гала (мякоть, кожура) | То же | – | То же |
| № 3 Айдаред (мякоть, кожура) | |||
| № 4 Ред Делишес (мякоть, кожура) | |||
| № 5 Голден Делишес (мякоть, кожура) |
ЗАКЛЮЧЕНИЕ
Таким образом, показано, что использование пробоподготовки QuEChERS с последующим ГХ–МС-анализом является эффективным и надежным методом для одновременного определения ряда хлорорганических (ХОП) и фосфорорганических (ФОП) пестицидов в плодах яблони. В результате экспериментальной апробации различных сорбентов при пробоподготовке способом QuEChERS установлено, что использование на стадии очистки экстракта Florisil + MgSO4 способствовало эффективному удалению матричных помех и получению полноты извлечения в диапазоне от 81 до 91% в зависимости от исследованного аналита. Предлагаемый метод был успешно применен для определения остаточных количеств пестицидов в образцах яблок.
Список литературы
Rai S., Singh A.K, Srivastava A., Yadav S., Siddiqui M.H., Mudiam M.K.R. Comparative evaluation of QuEChERS method coupled to DLLME extraction for the analysis of multiresidue pesticides in vegetables and fruits by gas chromatography-mass spectrometry // Food Anal. Methods. 2016. V. 9. P. 2656–2669.
Dwivedi B.C., Tiwari H., Gaur V. Assessment of 27 pesticide residues in fruit juices & vegetables paste by gas chromatography with mass spectrometry (GC–MS) // Inter. J. Chem. Stud. 2017. V. 5 (1). P. 259–285.
Мотылева С.М. Полиэлементный состав плодов некоторых сортов яблони селекции ГНУ “ВНИИСПК” // Аграрн. вестн. Урала. 2010. № 9 (75). С. 66–70.
Golge O., Kabak B. Determination of 115 pesticide residues in oranges by high-performance liquid chromatography–triple-quadrupole mass spectrometry in combination with QuEChERS method // J. Food Composit. Anal. 2015. V. 41. P. 86–97.
De Sousa F.A., Guido Costa A.I., De Queiroz M.E.L.R., Teófilo R.F., Neves A.A., De Pinho G.P. Evaluation of matrix effect on the GC response of eleven pesticides by PCA // Food Chem. 2012. V. 135. P. 179–185.
Полякова Н.Н., Серая Л.Г., Сидоренко О.Д., Белошапкина О.О., Ларина Г.Е. Влияние применения гербицидов в питомнике древесных культур на биологическую активность почвы // Агрохимия. 2018. № 12. С. 35–41.
Лукаткин А.С., Семенова А.С., Лукаткин А.А. Влияние регуляторов роста на проявления токсического действия гербицидов на растения // Агрохимия. 2016. № 1. С. 73–95.
Norli H.R., Christiansen A.L., Stuveseth K. Analysis of non-cleaned QuEChERS extracts for the determination of pesticide residues in fruit, vegetables and cereals by gas chromatography-tandem mass spectrometry // Food Addit. Contam. 2015. V. 33. P. 1–13.
Мухарлямова А.З., Мухамметшина А.Г., Рахметова Э.Р. Мониторинг остаточных количеств пестицидов и микотоксинов в зерновых культурах / Сб. мат-лов Международ. научн.-практ. конф. “Наука, технологии, кадры – основы достижений прорывных результатов в АПК”. Казань, 2021. С. 77–85.
Сидоренко О.Д. Интегрированная защита сельскохозяйственных растений (VII Конгресс по защите растений, Сербия, 2014 г.) // Агрохимия. 2015. № 10. С. 90–93.
García-Reyes J.F., Hernando M.D., Ferrer C., Molina-Díaz A., Fernández-Alba A.R. Large scale pesticide multiresidue methods in food combining liquid chromatography–time-of-flight mass spectrometry and tandem mass spectrometry // Anal Chem. 2007. V. 79 (19). P. 7308–7323.
Pitoi M., Harmoko H., Tresnawati A., Pardede H.F., Ariyani M., Ridwan Y.S., Yusiasih R. Pesticide residues in fruits and vegetables in Indonesia: findings of five-year proficiency testing // Accred. Qual. Assur. 2022. V. 27 P. 181–193.
Bruzzoniti M.C., Checchini L., De Carlo R.M., Orlandini S., Rivoira L., Del Bubba M. QuEChERS sample preparation for the determination of pesticides and other organic residues in environmental matrices: a critical review // Analyt. Bioanalyt. Chem. 2014. V. 406 (17). P. 4089–5116.
Lehotay S.J., Son K.A., Kwon H., Koesukwiwat U., Fu W.S., Mastovska K., Hoh E., Leepipatpiboon N. Comparison of QuEChERS sample preparation methods for the analysis of pesticide residues in fruits and vegetables // J. Chromatogr. A. 2010. V. 1217 (16). P. 2548–2560.
Мырзапаязова С.Б., Полотов И.Ж., Сапаров К.К. Исследование содержания хлорорганических пестицидов в растительных продуктах // Вестн. Ошск. гос. ун-та. 2019. № 2. С. 13–16.
Перфилова О.В. Яблочные выжимки как источник биологически активных веществ в технологии продуктов питания // Новые технол. 2017. № 4. С. 65–71.
Климова Е.В. Определение содержания остатков пестицидов (в том числе из классов хлор-, фосфорорганических соединений, карбаматов, пиретроидов, триазолов, дикарбоксимидов, стробилуринов) в яблоках, выращенных в условиях традиционной (химической) и интегрированной систем защиты растений (Болгария) // Пищ. и перерабат. пром-ть. Реферат. журн. 2012. № 1. С. 179.
Dasika R., Tangirala S., Naishadham P. Pesticide residue analysis of fruits and vegetables // J. Environ. Chem. Ecotoxicol. 2012. V. 4 (2). P. 19–28.
El Hawari K., Mokh S., Al Iskandarani M., Halloum W., Jaber F. Pesticide residues in Lebanese apples and health risk assessment // Food Additiv. Contamin. Part B. 2019. V. 12 (2). P. 81–89.
Дополнительные материалы отсутствуют.



