Журнал аналитической химии, 2022, T. 77, № 8, стр. 742-747
Экспресс-определение некоторых бета-лактамных антибиотиков
А. В. Тумская a, *, И. В. Косырева a
a Саратовский национальный (исследовательский государственный университет имени Н.Г. Чернышевского
410012 Саратов, ул. Астраханская, 83, Россия
* E-mail: marakaeva_anastasiya@mail.ru
Поступила в редакцию 06.07.2021
После доработки 29.08.2021
Принята к публикации 30.08.2021
- EDN: RYDZEQ
- DOI: 10.31857/S0044450222080175
Аннотация
Разработаны экспресс-методики определения антибактериальных соединений группы β-лактамов амоксициллина и цефалексина на основе визуально-колориметрической и цветометрической оценки с применением камеры смартфона. В качестве индикаторной выбрана реакция нингидрина с аминогруппами антибиотиков. Оценено взаимодействие иммобилизованного нингидрина с гентамицином на поверхности твердой матрицы с помощью метода спектроскопии диффузного отражения. Исследована стабильность, а также влияние температуры и времени нагревания тест-средств на ход реакции. Получены цветовые шкалы для визуально-колориметрического определения амоксициллина и цефалексина. Построены линейные зависимости интенсивностей цветового канала Green цветовой модели RGB от логарифма концентрации антибиотика. Разработанные методики применены для анализа образцов лекарственных препаратов.
Антибиотики β-лактамного ряда (пенициллины и цефалоспорины) – одни из наиболее распространенных препаратов, обладающих широким спектром антибактериальной активности в отношении грамположительных и грамотрицательных микроорганизмов [1, 2]. Цефалоспорины, подобно пенициллинам, ингибируют транспептидазу белковой молекулы, участвующей в формировании структуры клеточной мембраны патогенных бактерий. Большинство препаратов данного класса соединений входит в перечень жизненно необходимых и важнейших лекарственных препаратов медицинского назначения [3]. Объектами настоящего исследования являются β-лактамы цефалексин (Ceph, I поколение) и амоксициллин (Amox, II поколение).
Для определения антибиотиков в различных объектах (биологических средах, лекарственных препаратах, пищевых продуктах) в основном используют спектрофотометрические, хроматографические, потенциометрические и иммуноферментные методы анализа [4, 5]. Для испытания на подлинность фармакопеи России Европейская и Британская фармакопеи рекомендуют методы ВЭЖХ- и ИК-спектроскопии.
В нашей стране существует более 150 зарубежных и отечественных аналогов препарата амоксициллина (в виде таблеток, капсул, суспензий и порошков для приготовления растворов), поэтому быстрый и дешевый скрининг лекарственных препаратов на предмет наличия фальсификатов и для оценки содержания основного вещества является актуальной задачей. Информация о тест-средствах для визуально-колориметрического и цветометрического определения амоксициллина и цефалексина в литературе отсутствует.
Цель настоящей работы состояла в разработке методики экспресс-определения амоксициллина и цефалексина с помощью индикаторных бумаг на основе иммобилизованного нингидрина. Широко распространен способ регистрации аналитического сигнала с помощью различных цифровых устройств: фото- и видеокамер, камер смартфонов [6, 7]. К преимуществам такого подхода можно отнести экономичность и простоту выполнения, возможность сохранения информации в электронном формате, а также возможность анализа жидких и твердых образцов. В настоящем исследовании показана перспективность регистрации аналитического сигнала камерой смартфона для полуколичественного определения некоторых бета-лактамных антибиотиков.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Объекты исследования. Применяли антибиотики β-лактамного ряда цефалексин и амоксициллин (Sigma Aldrich, США). Исходные растворы антибиотиков с концентрацией 8 и 16 мг/мл готовили растворением навески препарата в фосфатном буферном растворе (рН 7.4). Рабочие растворы готовили в день проведения эксперимента разбавлением исходного раствора.
Определяли содержание антибиотиков в лекарственных препаратах амоксициллина (форма выпуска – таблетки “АВВА Рус”, Россия, 250 мг) и цефалексина (форма выпуска – капсулы “Hemofarm”, Сербия, 500 мг). Для приготовления раствора с концентрацией 1 мг/мл навеску препарата растворяли в 25 мл дистиллированной воды, отделяли от нерастворимых компонентов фильтрованием.
Реактивы и материалы. Спиртовый 0.05 М раствор нингидрина (Реахим, Россия) готовили растворением навески препарата в этаноле.
В качестве матрицы для создания тест-средств применяли целлюлозную бумагу (фильтры обеззоленные “синяя лента”, ТУ 2642-001-13927158-2003). Для получения индикаторных бумаг фильтр размером 5 × 5 см погружали на 3 мин в свежеприготовленный спиртовый раствор нингидрина, высушивали на воздухе. Полученная индикаторная бумага имела белый цвет.
Оборудование и методы исследования. Спектры диффузного отражения регистрировали на двулучевом сканирующем спектрофотометре Shimadzu UV-1800 (Япония), диапазон измерения 200−800 нм, прибор укомплектован приставкой зеркального отражения. Измеренные значения диффузного отражения (R) пересчитывали в функцию Гуревича–Кубелки–Мунка (F) по формуле: F = (1 – R)2/(2R).
Спектры поглощения регистрировали на двулучевом сканирующем спектрофотометре Shimadzu UV-1800 (Япония), диапазон измерения 200−800 нм, интервал измерения 1 нм. Использовали pН-метр pH-150МА (Россия).
Методики. Для определения оптимальной температуры проведения тест-реакции готовили серию индикаторных бумаг, на которые наносили определяемый антибиотик с концентрацией 7 мг/мл, помещали на 10 мин в сушильный шкаф (SNOL 58/350, Литва) при температуре от 60 до 110°С. Далее тест-средство помещали в бокс размером 22 × 23 × 24 см c двумя полосками светодиодного освещения (5 V, 1 A), фотографировали 13-мегапиксельной камерой смартфона Redmi 6A.
Цветометрическую обработку изображений тест-средств осуществляли в программе Adobe Photoshop®. Для этого часть изображения усредняли с помощью фильтра “Аverage” и определяли интенсивность цветовых каналов.
Интервал ненадежности и предел обнаружения определяли по методике [8]: готовили три тест-шкалы с концентрациями антибиотика от 0.1 до 1.4 мг/мл с шагом Δс = 0.1 мг/мл. Присутствие аналита визуально оценивали 15 наблюдателей (n = 45). Определяли вероятность обнаружения антибиотика по формуле: P(ci) = ni/Ni, где P(ci) – вероятность обнаружения антибиотика, ni – число положительных ответов наблюдателей о появлении фиолетовой окраски тест-средства, Ni – общее число ответов.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Взаимодействие амоксициллина и цефалексина с нингидрином на поверхности бумаги. Выбор оптимальных условий экспресс-определения. Для качественной реакции на амоксициллин и цефалексин при создании тест-средств выбрали взаимодействие антибиотиков с нингидрином (Схема 1 ). Нингидрин (трикетогидринденгидрат) широко применяют при определении аминов, аминокислот и тиофена [9]. Маккалдин предположил [10], что реакции нингидрина с аминами, аминокислотами и иминокислотами протекают по одному и тому же механизму с образованием дикетогидриндилиден−дикетогидриндамина или пурпура Руэманна. Схема 1 иллюстрирует предполагаемый ход реакции амоксициллина и цефалексина с нингидрином, включающий окислительное дезаминирование первичной аминогруппы с последующей конденсацией восстановленного нингидрина с образованием окрашенного продукта реакции пурпурного цвета с λmax 560−570 нм.
Для исследования реакции на поверхности твердой матрицы применяли метод спектроскопии диффузного отражения. На рис. 1 представлены спектры диффузного отражения в виде функции Гуревича–Кубелки–Мунка (F) для систем амоксициллин/цефалексин–иммобилизованный нингидрин. Как видно, в спектрах изучаемых систем появляется полоса при 410–420 нм и широкая полоса с максимумом при 560–570 нм, что согласуется с данными [11, 12] для аналогичных систем.
Схема 1 . Схема взаимодействия антибиотиков с нингидрином.
Рис. 1.
Спектры диффузного отражения в виде функции Гуревича–Кубелки–Мунка для систем цефалексин–иммобилизованный нингидрин (1), амоксициллин–иммобилизованный нингидрин (2), иммобилизованный нингидрин (3) (сAmox = сCeph = 8 мг/мл, 90°C, 20 мин).

При подборе оптимальных условий экспресс-определения на поверхности целлюлозной матрицы исследовали влияние температуры и времени проведения реакции (рис. 2а, 2б). Для выбора оптимальной температуры проведения тест-реакции строили зависимость изменения интенсивностей цветового канала Green (ΔGreen) от температуры нагревания индикаторных бумаг по сравнению с контрольным образцом (рис. 2а). Как видно, с увеличением температуры нагревания от 60 до 100°С значения ΔGreen увеличиваются и при 100−110°С принимают максимальные значения. Зависимость изменения интенсивностей канала Green от времени нагревания тест-средств (рис. 2б) показала, что через 15–20 мин их значения достигают максимума, и окраска при этом максимальна.
Рис. 2.
Зависимости изменения интенсивностей цветового канала Green от температуры (а) и от времени нагревания (б) тест-средств: 1 – цефалексин, 2 – амоксициллин (сAmox = сCeph = 7 мг/мл, рН 7.4).

Визуально-колориметрическое определение. При тест-определении анализируемый раствор антибиотика наносили на индикаторную бумагу с иммобилизованным нингидрином, высушивали при 100 ± 2°С в течение 15 мин. Наблюдали появление фиолетового окрашивания, интенсивность которого увеличивалась с увеличением концентрации антибиотика. Концентрации антибиотиков для приготовления цветовой шкалы подбирали таким образом, чтобы ширина шага шкалы позволяла визуально распознавать изменение окраски двух ближайших концентраций и не приводила к бόльшей погрешности определения. В результате выбрали оптимальный шаг, при котором каждая последующая концентрация отличается от предыдущей в два раза.
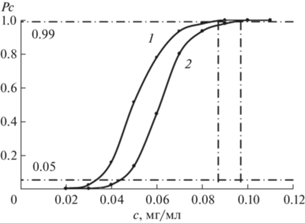
Предел обнаружения (ПО) определяли как правую границу интервала ненадежности (ИН) при вероятности обнаружения 99%. При определении интервала ненадежности строили зависимости вероятностей обнаружения (Рс) антибиотика от его концентрации (рис. 3). Для проверки гипотезы о законе распределения экспериментальных данных проанализировали зависимости функций нормального, логнормального, экспоненциального распределений и распределения экстремального значения первого рода (Вейбулла) от концентрации антибиотиков. Полученные значения коэффициентов корреляции уравнений прямых составляли ≥0.93, что подтверждает согласованность экспериментальных данных с функциями распределения и правильность выбранного диапазона ИН. Некоторые метрологические характеристики (диапазон определяемых содержаний (ДОС), ИН, ПО) разработанной методики визуальной оценки представлены в табл. 1.
Таблица 1.
Некоторые метрологические характеристики разработанных методик визуального определения цефалексина и амоксициллина
| Метрологическая характеристика, мг/мл | Антибиотик | |
|---|---|---|
| Сeph | Аmox | |
| ДОС | 0.125–8 | 0.125–16 |
| Интервал ненадежности (ИН) | 0.033–0.087 | 0.043–0.097 |
| Предел обнаружения (ПО) | 0.087 | 0.097 |
Цветометрическое определение. Цветометрическую обработку изображений тест-средств осуществляли в программе Adobe Photoshop®, для этого часть изображения усредняли с помощью фильтра “Аverage” и определяли интенсивность каналов модели RGB (Red-Green-Blue). Получили линейные зависимости интенсивностей каналов Red, Green и Blue от lgc и c (рис. 4).
Рис. 4.
Зависимости изменения интенсивности (ΔI) цветовых каналов Red (♦) Green (■), Blue (▲) от lgc цефалексина (а) и амоксициллина (б); от c (мг/мл) цефалексина (в) и амоксициллина (г).
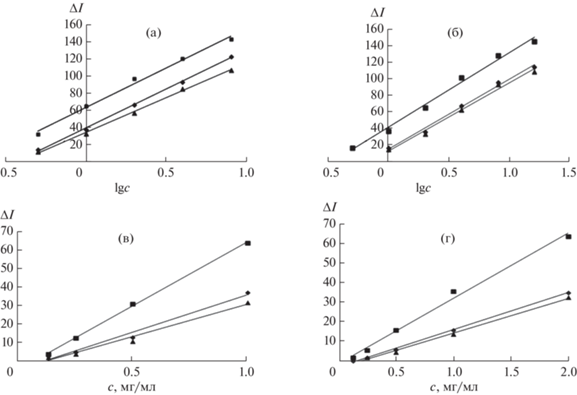
Таблица 2.
Уравнения, коэффициенты регрессии и диапазон линейности зависимостей изменения интенсивности цветовых каналов модели RGB от lg c/c
| Антибиотик | Зависимость | Диапазон линейности, мг/мл | Уравнение | Коэффициент регрессии |
|---|---|---|---|---|
| Сeph | Канал Red–lgс | 0.5–8 | y = 91x + 39 | 0.999 |
| Канал Blue–lgс | 0.5–8 | y = 81x + 34 | 0.998 | |
| Канал Green–lg с | 0.5–8 | y = 92x + 63 | 0.992 | |
| Канал Red–с | 0.125–1 | y = 40x – 4.6 | 0.983 | |
| Канал Blue–с | 0.125–1 | y = 35x – 4.3 | 0.981 | |
| Канал Green–с | 0.125–1 | y = 69x – 4.5 | 0.999 | |
| Аmox | Канал Red–lgс | 1–16 | y = 84x + 14 | 0.992 |
| Канал Blue–lgс | 1–16 | y = 82x + 12 | 0.990 | |
| Канал Green–lg с | 0.5–16 | y= 90x + 41 | 0.992 | |
| Канал Red–с | 0.125–2 | y = 20x – 2.7 | 0.999 | |
| Канал Blue–с | 0.125–2 | y = 18x – 3.3 | 0.998 | |
| Канал Green–с | 0.125–2 | y = 33x – 1.2 | 0.992 |
Для цефалексина зависимости интенсивностей цветовых каналов от lgс линейны в области 0.5–8 мг/мл и 0.125–1 мг/мл для зависимостей ΔI–с (рис. 4а, 4в). Для амоксициллина зависимости ΔI – lg с линейны в области 1–16 мг/мл (0.5–16 мг/мл для канала Green) и 0.125–2 мг/мл для зависимостей ΔI–с (рис. 4б, 4г). В качестве оптимального (по чувствительности и коэффициенту регрессии) выбрали канал Green при определении Сeph и Аmox. Предел обнаружения цефалексина составил 0.08 мг/мл, амоксициллина – 0.09 мг/мл.
По полученным цветовым шкалам строили профили лепестковых диаграмм (ЛД) в координатах цветовых каналов моделей RGB, CMYK, HSV (рис. 5а, 5б). Рассчитывали периметр (Р) и площадь (S) профилей ЛД в MS Excel по формулам: Р = √(а2 + b2 – 2аb cos(ab), S = a + b sin(ab), где a, b – стороны треугольника, cos(ab) – косинус угла между сторонами а, b, sin(ab) – синус угла между сторонами а, b.
Рис. 5.
Профили лепестковых диаграмм в координатах цветовых каналов R, G, B, C, M, K, V систем цефалексин (а), амоксициллин (б) – иммобилизованный нингидрин (с, мг/мл).

Получили линейные зависимости периметра (y = –292x + 748, r2 = 0.98 и y = –291x + 837, r2 = = 0.98) и площади (y = –39496x + 56166, r2 = 0.98 и y = –39849x + 67814, r2 = 0.98) от lgс(Сeph) и lgс(Аmox) соответственно. Данные могут быть применены при полуколичественном определении антибиотиков с пониженным пределом обнаружения 0.04 и 0.09 (0.10) мг/мл для зависимостей периметра и площади ЛД и с погрешностью определения, не превышающей 20%.
Определение антибиотиков в лекарственных препаратах. Разработанные варианты экспресс-определения антибиотиков апробированы для оценки их содержания в лекарственных препаратах (“Амоксициллин” таблетки, “Цефалексин” капсулы). Согласно фармакопейной статье (ФС “Цефалексин, капсулы”) содержание антибиотика должно находиться в пределах не менее 90.0% и не более 110.0% от заявленного количества цефалексина, т.е. 500 ± 50 мг; и не менее 90.0% и не более 110.0% амоксициллина, т.е. 250 ± 25 мг (ФС “Амоксициллин, таблетки”). При тест-определении содержания антибиотика каплю анализируемого раствора наносили на индикаторную бумагу, нагревают до 100°С и оценивали содержание антибиотика с помощью разработанных методик визуального и цветометрического определения, а также независимого спектрофотометрическим методом (СФМ) (табл. 3). При спектрофотометрическом определении применяли градуировочную зависимость оптической плотности при 262 нм от концентрации цефалексина и при 275 нм для амоксициллина.
Таблица 3.
Результаты (мг/мл) определения содержания антибиотиков в лекарственных препаратах (таблетки “Амоксициллин” и капсулы “Цефалексин”) разработанными экспресс-способами и спектрофотометрическим методом (n = 5, Р = 0.95)
| Заявлено в препарате, мг | Визуальная оценка | Цветометрическая оценка | СФМ | sr | |||||
|---|---|---|---|---|---|---|---|---|---|
| по каналу Green | sr | площадь ЛД | sr | периметр ЛД | sr | ||||
| Амоксициллин, 250 ± 25 мг | 250 ± 50 | 225 ± 30 | 0.09 | 225 ± 25 | 0.08 | 220 ± 30 | 0.08 | 245 ± 10 | 0.04 |
| Цефалексин, 500 ± 50 | 500 ± 50 | 525 ± 25 | 0.04 | 515 ± 50 | 0.10 | 525 ± 50 | 0.08 | 480 ± 20 | 0.05 |
Найденные в препаратах содержания амоксициллина и цефалексина согласуются с заявленными интервалами содержаний определяемых компонентов. Таким образом, полученные результаты свидетельствуют о том, что разработанные экспресс-методики можно применять для полуколичественного определения цефалексина и амоксициллина.
Финансовая поддержка работы осуществлялась в рамках гранта РФФИ (научный проект № 20-33-90020).
Список литературы
Арзамасцев А.П. Фармацевтическая химия. М.: ГЭОТАР-Медиа, 2004. 640 с.
Егоров Н.С. Основы учения об антибиотиках. М.: Наука, 2004. 528 с.
Распоряжение правительства РФ от 23 октября 2017 г. № 2323-р “Об утверждении перечня жизненно необходимых и важнейших лекарственных препаратов на 2018 г.”.
Kahsay G., Song H., Van Schepdael A., Cabooter D., Adams E. Hydrophilic interaction chromatography (HILIC) in the analysis of antibiotics // J. Pharm. Biomed. Anal. 2014. V. 87. P. 142.
Кулапина Е.Г., Баринова О.В., Кулапина О.И., Утц И.А., Снесарев С.В. Современные методы определения антибиотиков в биологических и лекарственных средах (обзор) // Антибиотики и химиотерапия. 2009. Т. 54. №. 9−10. С. 53.
Martinkova P., Brtnicky M., Kynicky J., Pohanka M. Fast and simple glucose assay based on filter paper as enzymes carrier using phone camera detection // Chem. Papers. 2018. V. 72. №. 11. P. 2719.
García A., Erenas M.M., Marinetto E.D., Abad C.A., de Orbe-Paya I., Palma A.J., Capitán-Vallvey L.F. Mobile phone platform as portable chemical analyzer // Sens. Actuators B: Chem. 2011. V. 156. №. 1. P. 350.
Холин Ю.В., Никитина Н.А., Пантелеймонов А.В., Решетняк Е.А., Бугаевский А.А., Логинова Л.П. Метрологические характеристики методик обнаружения с бинарным откликом. Х.: Тимченко, 2008. 128 с.
Файгль Ф. Капельный анализ органических веществ. М.: Госхимиздат, 1962. 836 с.
McCaldin D.J. The chemistry of ninhydrin // Chem. Rev. 1960. V. 60. №. 1. P. 39.
Frutos P., Torrado S., Perez-Lorenzo M.E., Frutos G. A validated quantitative colorimetric assay for gentamicin // J. Pharm. Biomed. Anal. 2000. V. 21. № 6. P. 1149.
Raza A., Ijaz A.S., Ahmad S. Development and application of spectrophotometric method for the determination of cefaclor in pharmaceutical formulations // Química Nova. 2009. V. 32. №. 5. P. 1180.
Дополнительные материалы отсутствуют.
Инструменты
Журнал аналитической химии