Биоорганическая химия, 2020, T. 46, № 6, стр. 736-745
Взаимодействие наночастиц SiFe с эпителиальными и лимфоидными клетками
Н. В. Шаронова 1, 2, Е. В. Свирщевская 3, А. А. Попов 1, Н. В. Карпов 1, Г. В. Тихоновский 1, А. Ю. Захаркив 1, С. В. Сизова 3, В. Ю. Тимошенко 1, С. М. Климентов 1, В. А. Олейников 1, 3, *
1 Национальный исследовательский ядерный университет “МИФИ”
115409 Москва, Каширское ш., 31, Россия
2 МИРЭА – Российский технологический университет (Институт тонких химических технологий имени М.В. Ломоносова)
119571 Москва, просп. Вернадского, 86, Россия
3 ФГБУН Институт биоорганической химии им. академиков М.М. Шемякина и Ю.А. Овчинникова РАН
117997 Москва, ул. Миклухо-Маклая, 16/10, Россия
* E-mail: voleinik@mail.ru
Поступила в редакцию 25.04.2020
После доработки 02.05.2020
Принята к публикации 10.05.2020
Аннотация
Кремний и наночастицы на его основе (SiNP) привлекают внимание исследователей в связи с биосовместимостью и ассимиляцией кремния тканями организма. Введение железа в состав SiNP (SiFeNP) позволяет использовать ферромагнитные свойства железа для детекции NP и возможности терапевтического использования SiFeNP. Целью данной работы являлся анализ взаимодействия SiFeNP с эпителиальными клетками (ЭК) COLO357 и SW620 и лимфоцитами периферической крови (ЛПК) человека. SiFeNP были получены методом лазерной абляции и разделены на NP1 и NP2 размером 100 и 150 нм соответственно. Анализ цитотоксичности, индукции апоптоза, продукции активных форм кислорода (АФК) и влияния на метаболизм лизосом SiFeNP проводили методами in vitro. Показали, что ЭК эффективно эндоцитировали оба типа NP, что приводило к увеличению гранулярности клеток. NP не вызывали апоптоза или некроза ЭК, накапливались в лизосомах, что приводило к снижению мембранного потенциала лизосом. В свою очередь, снижение уровня метаболизма ЭК приводило к постепенному (на 24 ч) повышению продукции АФК на 10–15%. При этом NP1 вызывали больше АФК, чем NP2, и больше накапливались в ЭК, что может быть результатом различия в размере частиц. SiFeNP не взаимодействовали с ЛПК. Таким образом, общая цитотоксичность SiFeNP не превышала 20%, что связано со снижением метаболизма лизосом и незначительной продукцией АФК.
ВВЕДЕНИЕ
Кремний входит в состав различных тканей организма, где накапливается в местах активного роста костей, в коже, различных мягких тканях. С возрастом количество кремния в организме снижается, что ведет к остеопорозу и артрозам. Снижение кремния также наблюдается при опухолевом процессе. В настоящее время разработан ряд способов получения наночастиц кремния (SiNP), пригодных для биологических приложений [1–3]. Распространенность и относительно невысокая стоимость материала, биодеградируемость и биосовместимость, возможность получения NP различной структуры делает кремний перспективным материалом для использования в разных областях науки, техники и медицины. В медицине кремний и частицы на его основе используются для доставки лекарств в опухоли [4–7] или для регенерации костной ткани [8, 9]. Есть исследования наночастиц кремния с малым содержанием оксида железа, полученных плазменным абляционным синтезом, показывающие возможность применения наночастиц кремния в МРТ-диагностике [10].
Показано, что введение некоторого количества железа позволяет визуализировать NP в клетках. Так, SiFeNP размером 1.5 нм методом ТЕМ обнаружили в мембране митохондрий [11]. Добавка железа в SiNP также усиливает продукцию АФК [11] по механизму реакции Фентона.
Одним из спорных вопросов является цитотоксичность NP различного состава, в том числе кремния [12]. Анализ литературных данных показал, что в диапазоне менее 1 мкг/мл SiNP не влияют на функциональную активность клеток; в диапазоне до 20 мкг/мл SiNP стимулируют пролиферацию клеток; при повышении концентрации in vitro до 80–120 мкг/мл наблюдается выраженная токсичность [13, 14]. Показано, что при высоких концентрациях механизм клеточной гибели под действием NP связан с изменением функции митохондрий, лизосом, эндоплазматического ретикулума, окислительным стрессом, что заканчивается апоптозом клеток [12]. Одним из механизмов токсичности может быть наличие силанольных групп, возникающих на поверхности SiNP и отвечающих за формирование АФК [15].
Анализ токсичности SiFeNP in vivo показал, что такие частицы в клинически значимых количествах (10–20 мг/кг) полностью ассимилируются без признаков токсичности [16]. Отсутствие значительной токсичности SiFeNP показано и in vitro [17]. Также токсичность может зависеть от состава NP и их размера [18, 19].
Целью данной работы являлся анализ механизмов цитотоксичности SiFeNP двух размеров для эпителиальных и лимфоидных клеток.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Взаимодействие SiFeNP с эпителиальными клетками
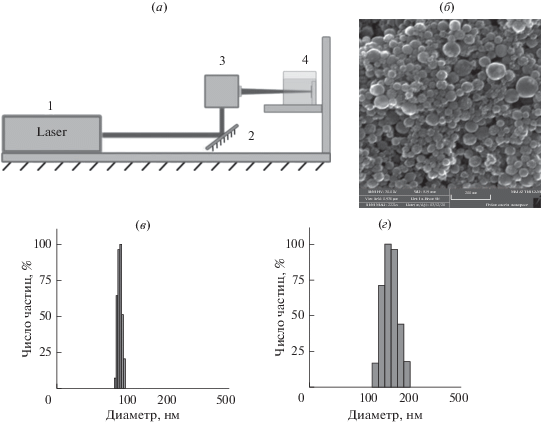
Схема получения наночастиц лазерной абляцией приведена на рис. 1а. Общий вид исходных SiFeNP, содержащих Si : Fe в соотношении 60 : 40, приведен на рис. 1б. Разделение исходных NP на частицы NP1 диаметром 96 ± 10 нм и NP2 диаметром 150 ± 25 нм (рис. 1в–1г) провели методом центрифугирования. Взаимодействие с клетками анализировали для NP1 и NP2 отдельно.
Рис. 1.
Получение и характеристика наночастиц SiFeNP. (а) Схематичное представление процесса лазерной абляции в жидкости. 1 – Yb:KGW лазер, 2 – зеркало, 3 – гальванометрический сканатор, 4 – кювета, наполненная жидкостью, и мишень. (б) ТЕМ изображение наночастиц SiFeNP. (в–г) Размер и полидисперсность NP1 (в) и NP2 (г).
Для определения общего характера взаимодействия SiFeNP с эпителиальными клетками использовали две линии клеток – рака поджелудочной железы COLO357 и рака толстой кишки SW620. Инкубация 24 ч клеток с SiFeNP приводила к эндоцитозу NP, что выражалось в повышении гранулярности, но не размера клеток (рис. 2а–2е). На линии SW620 уровень повышения гранулярности был достоверно выше для NP1, чем для NP2 (рис. 2ж), различий на линии COLO357 не было (рис. 2з).
Рис. 2.
Взаимодействие SiFeNP с эпителиальными клетками. (а–е) Распределение клеток SW620 (а–в) и COLO357 (г–е) по гранулярности (SSC) и размеру (FSC) до (а, г) и после инкубации 24 ч с NP1 (б, д) и NP2 (в, е). Кругом и овалом отмечены основные популяции клеток до и после инкубации с наночастицами. (ж–з) Гистограммы распределения по гранулярности клеток SW620 (ж) и COLO357 (з) до (серая гистограмма) и после инкубации 24 ч с NP1 (черная линия) и NP2 (серая линия). (и) Оптическая плотность (620 нм) клеток COLO357 и SW620 до (контроль) и после 24 ч инкубации с наночастицами NP1 и NP2.

Для количественной оценки эндоцитоза эпителиальные клетки после инкубации 24 ч с наночастицами снимали с подложки трипсином, отмывали физраствором, что позволяло удалить основное количество частиц с мембраны клеток. Отмытые клетки разносили по 96-луночному планшету и оценивали внутриклеточную локализацию наночастиц по поглощению видимого света (620 нм) (рис. 2и). Поглощение NP1 было несколько больше, чем NP2, но различие было недостоверным. В то же время, поглощение в культурах с NP1 и NP2 достоверно было выше, чем в контроле, что свидетельствует о внутриклеточной локализации наночастиц.
Цитотоксичность SiFeNP оценивали двумя методами: по оценке количества митохондрий в клетках после инкубации 72 ч с наночастицами (МТТ-тест) и по анализу клеток, включающих йодистый пропидий (PI) методом проточной цитометрии. Анализ методом МТТ предполагает, что вносимые реагенты не интерферируют с процессом восстановления красителя и не снижают количества и активности митохондрий в клетках, что может быть не так для наночастиц. Поэтому дополнительно использовали метод анализа по включению красителя PI, который проходит через мембрану поврежденных (апоптотических и некротических) клеток и встраивается в ДНК. Показали методом МТТ, что в широком диапазоне концентраций общая токсичность NP не превышала 20% (рис. 3а–3б). При этом на клетках линии COLO357 в диапазоне меньше 5 мкг/мл наночастицы стимулировали пролиферацию (рис. 3а), что раньше было показано и другими исследователями для SiNP [12]. Интересно, что пик токсичности наночастиц для клеток SW620 наблюдался не на максимальной концентрации, а в диапазоне около 5 мкг/мл (рис. 3б). Метод МТТ требует инкубации 72 ч для достижения значимых различий в количестве клеток, поскольку цикл деления эпителиальных клеток составляет около 24 ч.
Рис. 3.
Характеристика взаимодействия наночастиц SiFe с эпителиальными клетками. (а–г) Анализ дозозависимой цитотоксичности методом МТТ после инкубации 72 ч (а, б) и методом проточной цитометрии с использованием й-одистого пропидия (PI) (в, г) NP1 и NP2 на клетках COLO357 (а, в) и SW620 (б, г) после инкубации 24 ч.
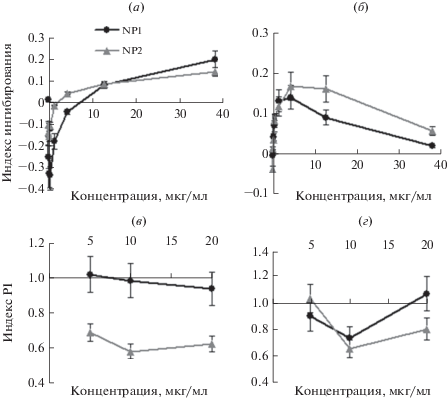
Раннюю токсичность можно определить уже через 24 ч методом проточной цитометрии. Анализ показал, что NP1 и особенно NP2 не только не вызывали гибели клеток, но и снижали долю спонтанного апоптоза и некроза в культурах ЭК (рис. 3в–3г). Соответственно, механизмы выявленной цитотоксичности не связаны с индукцией апоптоза в ЭК.
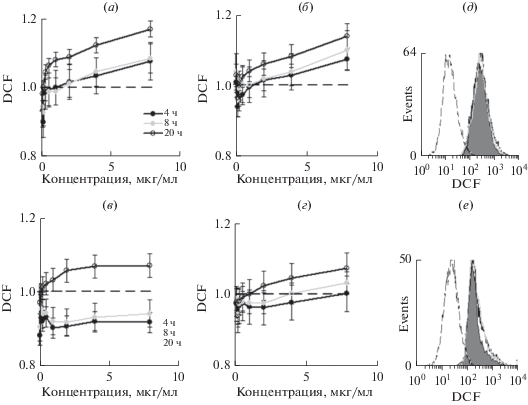
Одним из механизмов спонтанной гибели клеток в культурах является конститутивная продукция определенного уровня АФК. Для анализа продукции АФК под действием SiFeNP также использовали два метода: спектрофлуорометрию и проточную цитометрию при добавлении красителя DCF, переходящего под действием АФК из бесцветной во флуоресцентную форму. Показали, что инкубация ЭК с NP1 4–8 ч приводила к дозозависимому повышению синтеза АФК максимально на 5% от спонтанного уровня; через 20 ч АФК накапливались, но суммарный уровень не превышал 15% спонтанной продукции АФК (рис. 4а–4б). Инкубация ЭК c NP2 4–8 ч снижала спонтанную продукцию АФК, особенно это очевидно на клетках COLO357 (рис. 4в). Усиление продукции ЭК на 20 ч не превышало 5% от спонтанного уровня (рис. 4в–4г). Анализ внутриклеточной продукции АФК методом проточной цитометрии подтвердил отсутствие значительного эффекта SiFeNP на продукцию АФК (рис. 4д–4е).
Рис. 4.
Эффект наночастиц SiFe на продукцию активных форм кислорода (АФК). (а–г) Клетки COLO357 (а, в) и SW620 (б, г) инкубировали с наночастицами NP1 (а, б) или NP2 (в, г) 4, 8 или 24 ч в присутствии реактива DCF и анализировали внеклеточную продукцию АФК на планшетном ридере. (д–е) Анализ внутриклеточной продукции АФК методом цитометрии в клетках COLO357 (д) и SW620 (е); штриховой линией обозначен контроль до внесения DCF; серой гистограммой обозначен контроль; черной и серой линиями обозначены клетки после инкубации 4 ч с 20 мкг/мл NP1 и NP2 соответственно.
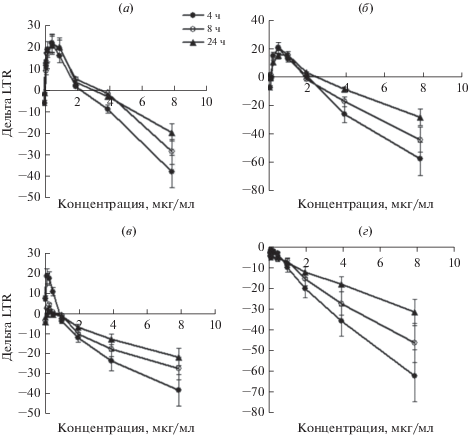
Визуально осадок ЭК после обработки трипсином и центрифугирования имел серый цвет в культурах с SiFeNP в отличие от белого осадка в контроле, что также регистрировалось по увеличению оптической плотности клеток (рис. 2и). Известно, что дзета-потенциал наночастиц железа, растворенных в воде, составляет +16–22 мВ [20], а наночастиц кремния в воде –35 мВ [21]. Дзета-потенциал SiFeNP составил –16 ± 3 мВ. Ранее нами было показано, что отрицательно заряженные частицы эффективно транспортируются в лизосомы [22]. Соответственно, SiFeNP после эндоцитоза ЭК транспортируются, скорее всего, в лизосомы. Заполнение лизосом наночастицами должно приводить к изменению мембранного потенциала. Изменение мембранного потенциала лизосом анализировали с помощью рН чувствительного красителя LTR. Повышение внутрилизосомального рН приводит к снижению мембранного потенциала и пропорциональному снижению свечения LTR. Показали, что как NP1, так и NP2 вызывали дозозависимое снижение мембранного потенциала лизосом ЭК (рис. 5). Частицы NP1 в концентрации меньше 2 мкг/мл вызывали выраженный стимулирующий эффект (рис. 5а, 5б); для NP2 эффект стимуляции был мало выражен (рис. 5в, 5г). Максимальный эффект наблюдался уже через 4 ч и достоверно снижался через 8 и 24 ч (рис. 5). Таким образом, SiFeNP транспортируются в лизосомы. Накопление наночастиц в лизосомах изменяет общий метаболизм клеток, что, в свою очередь, замедляет пролиферацию ЭК, в результате чего регистрируется снижение пролиферации клеток при определении методом МТТ (рис. 3).
Взаимодействие SiFeNP с лимфоцитами
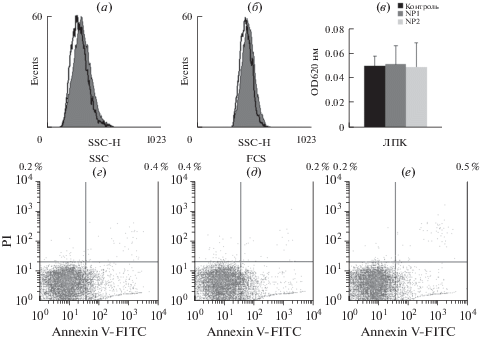
Лимфоциты периферической крови (ЛПК) не могут захватывать наночастицы по механизму эндоцитоза. В том случае, если есть рецепторное взаимодействие, наночастицы будут попадать в ЛПК. Анализ гранулярности и размера ЛПК после 48 ч инкубации с наночастицами показал отсутствие захвата NP1 (рис. 6а, 6б). Аналогичные данные получены и для NP2. Анализ оптической плотности клеток в видимом диапазоне также не показал захвата наночастиц ЛПК (рис. 6в). Дополнительно оценивали токсичность наночастиц для ЛПК методом анализа по связыванию аннексина V, для которого характерно связывание с клетками, находящимися на ранней стадии апоптоза. Показали отсутствие индукции апоптоза в ЛПК наночастицами (рис. 6г–6е). Клетки в стадии раннего апоптоза локализуются в правом нижнем квадранте, позднего апоптоза – в правом верхнем квандранте, некротические – в левом верхнем квадранте. Численные данные указаны по углам квадрантов. Соответственно, SiFeNP не взаимодействуют с ЛПК.
Рис. 6.
Анализ взаимодействия наночастиц SiFe с лимфоцитами периферической крови (ЛПК) человека. (а–б) Гранулярность (а) и размер (б) ЛПК до (серая гистограмма) и после инкубации 48 ч с наночастицами NP1. (в) Оптическая плотность (620 нм) ЛПК до (контроль) и после 24 ч инкубации с наночастицами NP1 и NP2. (г–е) Анализ индукции апоптоза ЛПК до (г) и после 48 ч инкубации с NP1 (д) и NP2 (е).”
Анализ литературы показал, что SiNP размером 2–16 нм способны взаимодействовать с ЛПК, что выражалось в повышении на Т-клетках экспрессии активационных маркеров CD26 и CD69, продукции интерферона гамма, но не продукции интерлейкинов (ИЛ) 2, 4 и 10 [23]. В этой же работе показано, что FeNP такого же размера не вызывали активации Т-клеток. С другой стороны, в работе Al Soubaihi с соавторами не выявили прямого действия кремниевых пластинок на ЛПК [24]. В работе Jiménez-Villarreal с соавторами провели анализ влияния SiNP и FeNP на фрагментацию ДНК в ЛПК после перорального введения частиц. Авторы показали увеличения доли ЛПК с фрагментированной ДНК [25]. Последние данные вызывают вопросы, поскольку после перорального введения наночастицы быстро попадают в желудок, откуда выводятся в ЖКТ и из организма. Нет данных, показывающих способность таких наночастиц попадать в кровь. В работе Zasonska с соавторами анализировали эффект SiFeNP размером 13 нм на пролиферативную активность ЛПК и продукцию ими цитокинов. Авторы показали минимальный эффект наночастиц [26]. Суммируя полученные нами и другими авторами данные, SiFeNP разного размера не оказывают значительного эффекта на ЛПК и не проникают в них.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Получение SiFeNP
Наночастицы SiFeNP были получены методом фемтосекундной (фс) лазерной абляции в жидкости, ранее разработанным нашей группой и использовавшимся для синтеза коллоидных растворов как неорганических [27], так и органических NP [28]. Схематическое изображение экспериментальной установки для лазерной абляции представлено на рис. 1а. Мишень из силицида железа FeSi2 (соотношение материала в мишени примерно составляло 60 : 40 по Si : Fe) облучалась излучением, генерируемым Yb:KGW лазером (длина волны 1030 нм, длительность импульса 270 фс, энергия импульса 30 мкДж, частота следования импульсов 100 кГц, диаметр пучка 3 мм, модель TETA 10, Авеста, Москва, Россия) и сфокусированным 75 мм линзой на поверхности мишени. Сама мишень во время лазерной абляции была зафиксирована в кварцевой кювете объемом 60 мл, заполненной ацетоном (“Ясхим”, ГОСТ 2768-84, чистота 99.5%). Толщина слоя жидкости перед мишенью составляла 5 мм. Длительность процесса абляции составляла 15 минут. Во время синтеза лазерный луч сканировал поверхность мишени со скоростью 4 м/с для предотвращения образования абляционных кратеров и увеличения эффективности процесса.
Выбор ацетона в качестве среды для приготовления SiFeNP обусловлен тем экспериментальным фактом [29], что материалы, склонные к образованию оксидов (в данном случае кремний и железо) при абляции в ацетоне практически не окисляются и образуют сферические наночастицы SiFe (рис. 1а), тогда как быстрое окисление при абляции в воде приводит к формированию значительного количества неструктурированных моно элементных оксидов в виде наноразмерных “хлопьев”.
Для разделения размерных фракций и необходимой для проведения биологических тестов смены растворителя с ацетона на воду использовался метод последовательного центрифугирования. На первом этапе было проведено центрифугирование (Eppendorf USA) исходного коллоидного раствора SiFeNP при 200 g в течении 30 минут. Осадок содержал наночастицы размером 150 нм. Редиспергирование этого осадка в воде привело к получению фракции NP2. Супернатант, оставшийся после первого шага, повторно центрифугировали при 2000 g в течении 30 минут. Осадок после второго шага центрифугирования содержал SiFeNP размером 100 нм. Редиспергирование этого осадка в воде привело к получению фракции NP1.
Размерные и морфологические свойства синтезированных SiFeNP обеих размерных фракций были определены с использованием сканирующего просвечивающего электронного микроскопа (TESCAN MAIA 3, Чешская республика), работающего при ускоряющих напряжениях 0.1–30 кВ. Образцы для электронной микроскопии были подготовлены путем размещения 1 мкл коллоидного раствора SiFeNP на подложке из германия и последующей сушки капли при нормальных условиях.
Определение размера и дзета-потенциала наночастиц
Диаметр NP определяли методом динамического светорассеяния (90 Plus Particle Size Analyzer, Brookhaven Instruments Corporation, Vernon Hills, IL, США). Все измерения проводились с использованием лазера 661 нм при комнатной температуре с углом рассеяния 90°. Дзета-потенциал (ζ) определяли с использованием идентичного оборудования с дополнительным аппаратом ZetaPALS.
Определение внутриклеточной локализации SiFeNP
Для определения внутриклеточной локализации ЭК после инкубации с наночастицами обрабатывали трипсином для суспендирования и, одновременно, освобождения от наночастиц, связанных с поверхностью ЭК. После центрифугирования осадки клеток в контроле имели белый, а в опыте с частицами – серый цвет, что показывает внутриклеточное накопление наночастиц. Для количественного определения суспензию в физрастворе разносили по лункам 96-луночного (Costar, USA) плоскодонного планшета и анализировали поглощение в видимом диапазоне при 620 нм на спектрофотометре (Multiscan FC, USA). Для анализа поглощения частиц суспензионными ЛПК клетки переводили в физраствор и разносили по лункам планшета для аналогичного анализа.
Клеточные линии
Карцинома поджелудочной железы человека COLO-357 и карцинома толстой кишки SW620 выращены в среде DMEM с добавлением 7% фетальной телячьей сыворотки (HyClone, США), пенициллин-стрептомицина и L-глютамина (все из ПанЭко, Москва, Российская Федерация) (культуральная среда). Клетки пассировали путем трипсинизации с использованием раствора трипсин/ ЭДТА (ПанЭко, Москва, Российская Федерация) два раза в неделю. ЛПК культивировали в среде на основе RPMI-1640 с теми же добавками.
МТТ-анализ
Цитотоксический эффект SiFeNP оценивали с помощью стандартного теста 3-(4,5-диметил-2-тиазолил)-2,5-дифенил-2Н-тетразолий бромида (МТТ, Сигма), описанного ранее [30]. Для постановки теста NP1 и NP2 разводили в широком диапазоне концентраций, начиная с 20 мкг/мл, в культуральной среде в 96-луночном плоскодонном планшете (Costar, USA) в 100 мкл. Клетки в количестве 10 тыс./лунку вносили во все лунки в 100 мкл. Планшеты инкубировали с CO2-инкубаторе (37°С, 5% СО2) в течение 72 ч. МТТ добавляли по 10 мкл/лунку (5 мг/мл) на последние 3 часа инкубации. После окончания инкубации культуральную среду стряхивали и вносили по 100 мл диметилсульфоксида для растворения формазана. Ингибирующий индекс (II) был рассчитан как II = [1 − (ODопыт/ODконтроль)], где OD–оптическая плотность растворенного формазана.
Проточная цитометрия
Все измерения проводили на проточном цитометре FACScan (BD, USA). Для оценки количества мертвых клеток в культурах с наночастицами клетки снимали с подложки трипсином, переводили в физраствор, в который добавляли 50 мкл йодистого пропидия (PI) (5 мкг/мл) и анализировали методами прямого (FSC) и бокового (SSC) светорассеяния для определения размера и гранулярности клеток соответственно в популяции отрицательных по PI клеток. Оценку доли мертвых клеток (положительных по PI) оценивали по свечению в красной области контрольных клеток и клеток после инкубации с наночастицами 24 ч. Подсчитывали отношение доли PI+ клеток в опыте к контролю (Индекс PI).
Анализ синтеза АФК проводили с использованием АФК-чувствительного красителя 2',7'-диацетат дихлордигидрофлуоресцеина (DCFH-DA или DCF) (Sigma Aldrich, USA). Исходно DCF бесцветный, в клетках гидролизуется клеточными эстеразами в присутствии перекиси водорода до флуоресцентного 2',7'-дихлорфлуоресцеина. Внутриклеточную продукцию оценивали в канале FL1.
Анализ апоптоза ЛПК, вызванного наночастицами, оценивали с помощью окраски клеток флуоресцеин-меченным аннексином V (BD, USA). Аннексин V обычно используется для обнаружения апоптотических клеток благодаря его способности связываться с фосфатидилсерином, маркером апоптоза, когда он находится на внешней стороне плазматической мембраны. В пробы также добавляли PI, что позволяет разделить апоптотические и некротические клетки. Результаты анализировали с помощью программного обеспечения WinMDI 2.8.
Анализ секреторных АФК
Для анализа секреторных АФК наночастицы разводили в широком диапазоне концентраций в 100 мкл культуральной среды на плоскодонных 96-луночных планшетах (Costar, USA). Клетки в количестве 10 тыс./лунку вносили во все лунки и оставляли инкубировать 4, 8 или 20 ч. DCF вносили вместе с клетками. Результат анализировали на флуоресцентном ридере Glomax Multi (Promega, USA) с фильтром 488 нм. Данные представлены как отношение оптической плотности в опыте к контролю, где 1 означает отсутствие эффекта.
Анализ лизосомального мембранного потенциала
Для анализа потенциала мембран лизосом использовали рН-чувствительный трекер лизосом LysoTracker® Red DND-99 (Life Technologies, USA). ЭК инкубировали с наночастицами 4, 8 и 24 ч аналогично как описано выше при определении АФК, трекер вносили на последние 30 мин инкубации. Результат анализировали на флуоресцентном ридере Glomax Multi (Promega, USA) с фильтром 525 нм. Данные приведены как разница оптической плотности в опыте минус контроль (Дельта LTR), где 0 означает отсутствие эффекта.
Выделение лимфоцитов периферической крови (ЛПК)
Кровь с добровольного согласия здоровых доноров забирали в вакуумные пробирки с ЭДТА (Vacplus, Россия). Кровь разводили в 2 раза физиологическим раствором (ФР), наслаивали на градиент фиколла (ПанЭко, Россия) и центрифугировали при 2.3 тыс. об./мин 20 минут. Лимфоциты из интерфазы отмывали 3 раза в ФР, подсчитывали количество клеток на камере Горяева и переводили в культуральную среду. ЛПК инкубировали с наночастицами в концентрации 10 мкг/мл 48 ч. Для анализа апоптоза клетки отмывали и переводили в ФР, метили аннексин V-ФИТЦ и анализировали на проточном цитометре как описано выше.
Список литературы
Lillo C.R., Natalia Calienni M., Gorojod R.M., Rivas A-iello M.B., Rodriguez Sartori D., Prieto M.J., Alonso S. del V., Kotler M.L, Gonzalez M.C., Montanari J. // Nanomedicine. 2018. V. 13. P. 1349–1370. https://doi.org/10.2217/nnm-2018-0010
Santos H.A., Mäkilä E., Airaksinen A.J., Bimbo L.M., Hirvonen J. // Nanomedicine. 2014. V. 9. P. 535–554. doi.org/https://doi.org/10.2217/nnm.13.223
Ischenko A.A., Fetisov G.V., Aslanov L.A. // Nanosilicon: Properties, Synthesis, Applications, Methods of Analysis and Control. CISP, CRC, Taylor&Francis group, NY, 2014, P. 714. https://doi.org/10.1201/b17170
Lei W., Sun C., Jiang T., Gao Y., Yang Y., Zhao Q., Wang S. // Mater. Sci. Eng. C Mater. Biol. Appl. 2019. V. 105. P. 110 103. https://doi.org/10.1016/j.msec.2019.110103
Lio D.C.S., Liu C., Oo M.M.S., Wiraja C., Teo M.H.Y., Zheng M., Chew S.W.T., Wang X., Xu C. // Nanoscale. 2019. V. 11. P. 17 041–17 051. https://doi.org/10.1039/C9NR06303J
Li S., Zhang Y., He X.W., Li W.Y., Zhang Y.K. // Talanta. 2020. V. 209. P. 120 552. https://doi.org/10.1016/j.talanta.2019.120552
Wu Y., Xu Z., Sun W., Yang Y., Jin H., Qiu L., Chen J., Chen J. // Mater. Sci. Eng. C Mater. Biol. Appl. 2019. V. 103. P. 109 831. https://doi.org/10.1016/j.msec.2019.109831
Jia Y., Zhang P., Sun Y., Kang Q., Xu J., Zhang C., Chai Y. // Nanomedicine. 2019. V. 21. P. 102 040. https://doi.org/10.1016/j.nano.2019.102040
Li T., Li X.L., Hu S.X., Wu J. // J. Photochem. Photobiol. B. 2019. V. 197. P. 111 515. https://doi.org/10.1016/j.jphotobiol.2019.111515
Kargina Y.V., Perepukhov A.M., Kharin A.Y., Zvereva E.A., Koshelev A.V., Zinovyev S.V., Maximychev A.V., Alykova A.F., Sharonova N.V., Zubov V.P., Gulyaev M.V., Pirogov Y.A., Vasiliev A.N., Ischenko A.A., Timoshenko V.Y. // Physica Status Solidi (A) Applications and Materials. 2019. V. 216. P. 1 800 897. https://doi.org/10.1002/pssa.201800897
Klein S., Wegmann M., Distel L.V.R., Neuhuber W., Kryschi C. // Biochem. Biophys. Res. Commun. 2018. V. 498. P. 855–861. https://doi.org/10.1016/j.bbrc.2018.03.070
Liu N., Tang M. // J. Appl. Toxicol. 2020. V. 40. P. 16–36. https://doi.org/10.1002/jat.3817
Li J., Yang H., Sha S., Li J., Zhou Z., Cao Y. // Ecotoxicol. Environ. Saf. 2019. V. 186. P. 109 770. https://doi.org/10.1016/j.ecoenv.2019.109770
Kim W., Kim W.K., Lee K., Son M.J., Kwak M., Chang W.S., Min J.K., Song N.W., Lee J., Bae K.H. // Int. J. Nanomedicine. 2019. V. 14. P. 7375–7387. https://doi.org/10.2147/IJN.S224183
Rubio L., Pyrgiotakis G., Beltran-Huarac J., Zhang Y., Gaurav J., Deloid G., Spyrogianni A., Sarosiek K.A., Bello D. // Part Fibre Toxicol. 2019. V. 16. P. 40. https://doi.org/10.1186/s12989-019-0325-1
Mendez N., Liberman A., Corbeil J., Barback C., Viveros R., Wang J., Wang-Rodriguez J., Blair S.L., Mattrey R., Vera D., Trogler W., Kummel A.C. // Nanomedicine. 2017. V. 13. P. 933–942.https://doi.org/10.1016/j.nano.2016.10.018
Singh M.P., Atkins T.M., Muthuswamy E., Kamali S., Tu C., Louie A.Y., Kauzlarich S.M. // ACS Nano. 2012. V. 6. P. 5596–5604. https://doi.org/10.1021/nn301536n
Napierska D., Rabolli V., Thomassen L.C., Dinsdale D., Princen C., Gonzalez L., Poels K.L., Kirsch-Volders M., Lison D., Martens J.A., Hoet P.H. // Chem. Res. Toxicol. 2012. V. 25. P. 828–837. https://doi.org/10.1021/tx200361v
Bhattacharjee S., Rietjens I.M., Singh M.P., Atkins T.M., Purkait T.K., Xu Z., Regli S., Shukaliak A., Clark R.J., Mitchell B.S., Alink G.M., Marcelis A.T., Fink M.J., Veinot J.G., Kauzlarich S.M., Zuilhof H. // Nanoscale. 2013. V. 5. P. 4870–4883. https://doi.org/10.1039/c3nr34266b
Svetlichnyi V.A., Shabalina A.V., Lapin I.N., Goncharova D.A., Kharlamova T.S., Stadnichenko A.I. // Applied Surface Science. 2019. V. 467–468. P. 402–410. https://doi.org/10.1016/j.apsusc.2018.10.189
Baati T., Al-Kattan A., Esteve M.A., Njim L., Ryabchikov Y., Chaspoul F., Hammami M., Sentis M., Kabashin A.V., Braguer D. // Sci. Rep. 2016. V. 6. P. 25 400. https://doi.org/10.1038/srep25400
Zubareva A.A., Shcherbinina T.S., Varlamov V.P., Svirshchevskaya E.V. // Nanoscale. 2015. V. 7. P. 7942–7952. https://doi.org/10.1039/c5nr00327j
Vis B., Hewitt R.E., Faria N., Bastos C., Chappell H., Pele L., Jugdaohsingh R., Kinrade S.D., Powell J.J. // ACS Nano. 2018. V. 12. P. 10 843–10 854. https://doi.org/10.1021/acsnano.8b03363
Al Soubaihi R.M., Furesi G., Saoud K.M., Al-Muhtaseb S.A., Khatat A.E., Delogu L.G. // Colloids Surf B Biointerfaces. 2018. V. 172. P. 779–789. https://doi.org/10.1016/j.colsurfb.2018.09.022
Jiménez-Villarreal J., Rivas-Armendáriz D.I., Arellano Pérez-Vertti R.D., Olivas Calderón E., García-Garza R., Betancourt-Martínez N.D., Serrano-Gallardo L.B., Morán-Martínez J. // Genet. Mol. Res. 2017. V. 16. https://doi.org/10.4238/gmr16019206
Zasonska B.A., Líškova A., Kuricova M., Tulinska J., Pop-Georgievski O., Čiampor F., Vavra I., Dušinska M., Ilavska S., Horvathova M., Horák D. // Croat. Med. J. 2016. V. 57. P. 165–178. https://doi.org/10.3325/cmj.2016.57.165
Al-Kattan A., Nirwan V., Popov A., Ryabchikov Y., Tselikov G., Sentis M., Fahmi A., Kabashin A.V. // Int. J. Mol. Sci. 2018. V. 19. P. 1563. https://doi.org/10.3390/ijms19061563
Lim C.K., Popov A., Tselikov G., Heo J., Pliss A., Kim S., Kabashin A.V., Prasad P.N. // Advanced Optical Materials. 2018. V.6. P. 1 800 164. https://doi.org/10.1002/adom.201800164
Popov A., Tselikov G., Dumas N., Berard C., Metwally K., Jones N., Al-Kattan A., Larrat B., Braguer D, Mensah S., Da silva A., Estève M.A., Kabashin A.V. // Sci. Rep. 2019. V. 9. P. 1194. https://doi.org/10.1038/s41598-018-37519-1
Mosmann T. // J. Immunol. Methods. 1983. V. 65. P. 55–63. https://doi.org/10.1016/0022-1759(83)90303-4
Дополнительные материалы отсутствуют.
Инструменты
Биоорганическая химия