Биология внутренних вод, 2020, № 3, стр. 299-305
Особенности антиоксидантной глутатионовой системы в тканях черноморского двустворчатого моллюска Cerastoderma glaucum (Сardiidae)
О. Л. Гостюхина *
Федеральный исследовательский центр “Институт биологии южных морей им. А.О. Ковалевского”
Российской академии наук
Севастополь, Россия
* E-mail: gostolga@yandex.ru
Поступила в редакцию 15.03.2019
После доработки 23.05.2019
Принята к публикации 10.09.2019
Аннотация
Исследованы антиоксидантная глутатионовая система и уровень перекисного окисления липидов в тканях черноморского двустворчатого моллюска сердцевидки Cerastoderma glaucum (Bruguière, 1789). В гепатопанкреасе, жабрах и ноге моллюска определяли активность глутатионпероксидазы, глутатионредуктазы, уровень восстановленного глутатиона и перекисное окисление липидов. Показатели антиоксидантной глутатионовой системы у сердцевидки имели выраженную тканевую специфику. В гепатопанкреасе наибольшая активность глутатионпероксидазы в 1.7–4.2 раза превышала таковую в жабрах и ноге моллюска. В жабрах зарегистрирован наименьший уровень восстановленного глутатиона, что в 2.1–2.3 раза ниже, чем в остальных тканях, наибольшая активность глутатионредуктазы была выше в 3.1–5.8 раза. В ноге сердцевидки уровень восстановленного глутатиона не уступал таковому в гепатопанкреасе, а активность глутатионпероксидазы и глутатионредуктазы была в 1.7–4.2 раза ниже, чем в других тканях.
ВВЕДЕНИЕ
Морские двустворчатые моллюски-фильтраторы – организмы наиболее устойчивые к действию широкого ряда стрессирующих факторов водной среды (Фокина и др., 2011; Gostyukhina, Andreenko, 2019; Livingstone, 2001; Manduzio et al., 2005; Trevisan et al., 2016). К ним относят колебания температуры воды, уровня кислорода, солености, состава и доступности пищи в связи с сезонами года, приливно-отливными явлениями, а также воздействие хищников, загрязняющих веществ и другие (Livingstone, 2001; Manduzio et al., 2005; Morozov et al., 2017; Welker et al., 2013).
Известно, что влияние стресс-факторов реализуется преимущественно через развитие в клетке окислительного стресса, способного нарушать структуру и функции белков, липидов, нуклеиновых кислот, углеводов (Окислительный…, 2006; Gostyukhina, Golovina, 2013; Lushchak, 2011; Welker et al., 2013). Двустворчатые моллюски выработали ряд адаптаций, позволяющих им в условиях ОС сохранять полноценный метаболизм. Среди них особое место занимают системы АО защиты, участвующие в поддержании необходимого баланса между про- и антиоксидантными процессами, в том числе АГС (Livingstone, 2001; Lushchak, 2011; Manduzio et al., 2005; Regoli, Giuliani, 2014; Regoli, Principato, 1995; Welker et al., 2013).
У двустворчатых моллюсков выделяют виды c разной устойчивостью к ОС. К одним из наиболее устойчивых организмов Черного моря относят представителей массовых видов моллюсков – сердцевидку Cerastoderma glaucum (Bruguière, 1789), мидию Mytilus galloprovincialis (Lamarck, 1819), анадару Anadara kagoshimensis (Tokunaga, 1906) и др. Однако резистентность этих моллюсков к ОС может быть обусловлена разными, специфическими для каждого вида, особенностями АО системы, связанными с их экологическим и физиолого-биохимическим статусом. В частности, большое значение в работе АО системы моллюсков имеют тканевые особенности, физиологическое состояние моллюсков, соотношение вклада ферментного и низкомолекулярного звена (Истомина и др., 2011; Климова, Чуйко, 2015; Gostyukhina, Andreenko, 2019; Gostyukhina, Golovina, 2013; Livingstone, 2001; Lushchak, 2011), а также соотношение ключевых показателей АО защиты и ОС (Edge et al., 2012). Показаны различия в функционировании АО комплекса и для особей близких видов (дрейссен) (Климова, Чуйко, 2015) или одного вида (на примере мидии) с учетом цветовой морфы или степени пигментации тканей моллюсков (Gostyukhina, 2013).
Основная масса исследований связана с определением ответных реакций АО комплекса двустворчатых моллюсков на действие тех или иных природных и антропогенных факторов, что, безусловно, имеет практическую ценность для экодиагностики (Livingstone, 2001; Macías-Mayorga et al., 2015; Manduzio et al., 2005; Nardi et al., 2018; Regoli, Principato, 1995). Гораздо меньше доля сравнительных исследований с целью выявления конститутивных черт АО системы, специфических у разных видов моллюсков, что во многом определяет соответствующую устойчивость этих видов к ОС. Так, в АО защите мидии отмечено преобладание ферментного звена, в то время как у анадары – совместная работа низкомолекулярного и ферментного звеньев АО комплекса (Gostyukhina, Andreenko, 2019). Установлены три типа реагирования на гипоксию у пяти видов моллюсков, обитающих при разном кислородном режиме, – увеличение, падение и неизменный уровень АО активности (Истомина и др., 2011), что связывают с колебанием уровня кислорода при приливно-отливных явлениях. Обнаружены различия у других моллюсков с разной устойчивостью к ОС – эврибионтной мидии Грэя Crenomytilus grayanus (Dunker, 1853) и стеноксифильного гребешка Mizuhopecten yessoensis (Jay, 1857) (Belcheva et al., 2016). Зарегистрированы различия в уровне АО параметров у близких видов – дрейссен Dreissena polymorpha (Pallas, 1771) и D. bugensis (Andrusov, 1897) из Рыбинского водохранилища (Климова, Чуйко, 2015), а также гребешков Adamussium colbecki (Smith, 1902) и Pecten jacobaeus (L., 1758) из разных биотопов (Viarengo et al., 1995).
Цель работы – определить особенности антиоксидантной глутатионовой системы и ПОЛ у сердцевидки Cerastoderma glaucum, моллюска с высокой устойчивостью к окислительному стрессу.
МАТЕРИАЛ И МЕТОДЫ ИССЛЕДОВАНИЯ
Объектом исследования были взрослые особи сердцевидки C. glaucum с длиной раковины 25–28 мм. Моллюсков собирали одновременно в начале мая 2018 г. в условно чистой акватории – прибрежной зоне бухты Казачья Черного моря около г. Севастополь (44°34′30′′ с.ш., 33°24′45′′в.д.) на глубине 0.5–0.7 м, количество особей в выборке – 15–17.
Моллюсков выдерживали в аквариумах с проточной морской водой в течение 2–3 сут для снятия стресса после транспортировки. Ткани гепатопанкреаса, жабр и ноги гомогенизировали при температуре 0–4°С стеклянным гомогенизатором Поттера-Эльвейема (стекло-тефлон). Гомогенаты центрифугировали при 3200 g в течение 15 мин с помощью рефрижераторной центрифуги К-23D (Германия). В полученных супернатантах активность ГП определяли по накоплению GSSG и выражали в мкмоль GSSG/(мин · мг белка), активность ГР – по уменьшению уровня НАДФН в нмоль НАДФН/(мин · мг белка) (Переслегина, 1989). Содержание GSH оценивали по образованию комплекса с аллоксановым реактивом в гомогенатах, приготовленных на основе 5%-ного раствора метафосфорной кислоты. Уровень GSH выражали в мкг/г ткани (Путилина, 1982). Интенсивность ПОЛ оценивали по образованию ТБК-активных продуктов и выражали в мкмоль МДА/г ткани (Ohkawa et al., 1979). Оптическую плотность растворов определяли на спектрофотометре СФ-2000. Активность ферментов измеряли при температуре 25°С. Достоверность полученных различий оценивали с помощью U-критерия Манна–Уитни. Различия считали статистически значимыми при р ≤ 0.05.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
Содержание ПОЛ во всех исследованных тканях сердцевидки было близким по значению (табл. 1). Показатели АГС, напротив, имели выраженную тканевую специфику. Наименьший уровень GSH зарегистрирован в жабрах сердцевидки, в гепатопанкреасе и ноге моллюска значения были выше в 2.1–2.3 раза (р ≤ 0.05) (табл. 1). В гепатопанкреасе выявлена наибольшая активность ГП, что в 1.7–4.2 раза выше (р ≤ 0.01), чем в жабрах и ноге моллюска (табл. 1). Наиболее высокая активность ГР обнаружена в жабрах сердцевидки, различия с гепатопанкреасом и ногой были 3.1–5.8 раза (р ≤ 0.001) (табл. 1). Известно, что интенсивность ПОЛ и АО активность в клетке находятся в состоянии постоянного динамического равновесия (Edge et al., 2012; Livingstone, 2001; Lushchak, 2011). Одним из показателей такого равновесия считают отношение уровня GSH и ПОЛ (содержание МДА) – GSH/MДA (Edge et al., 2012), отражающее интенсивность АО процессов и ПОЛ. Высокие значения коэффициента GSH/ MДA (>5) зарегистрированы в тканях гепатопанкреаса и ноги, в жабрах он был в >2 раза ниже (табл. 1).
Таблица 1.
Показатели антиоксидантной глутатионовой системы и ПОЛ у Сerastoderma glaucum
| Показатель | Гепатопанкреас | Жабры | Нога |
|---|---|---|---|
| ПОЛ (по содержанию ТБК-активных продуктов), мкмоль МДА/г ткани | 24.2 ± 4.9 | 27.3 ± 7.2 | 21.5 ± 4.3 |
| GSН, мкг/г ткани | 132.5 ± 25.1 | 58.1 ± 3.3 | 125.1 ± 30.8 |
| Активность ГП, мкмоль GSSG/(мин мг белка) | 62.3 ± 9.6 | 37.0 ± 6.3 | 14.7 ± 1.1 |
| Активность ГР, нмоль/(мин мг белка) | 527.6 ± 88.3 | 1642.2 ± 283.5 | 280.2 ± 49.7 |
| GSН/МДА | 5.46 | 2.12 | 5.81 |
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Для более полного представления об особенностях АГС сердцевидки нами проведен сравнительный анализ полученных у этого вида данных с таковыми у других черноморских двустворчатых моллюсков – анадары Anadara kagoshimensis (Tokunaga, 1906) и мидии Mytilus galloprovincialis (Lamarck, 1819), имеющих, как и сердцевидка, высокую устойчивость к ОС (Gostyukhina, 2013; Gostyukhina, Andreenko, 2019; Gostyukhina, Golovina, 2013).
У анадары и мидии наблюдались выраженная тканевая специфика ПОЛ и снижение этого показателя в ряду тканей гепатопанкреас‒жабры–нога. По абсолютным величинам сердцевидка существенно уступала анадаре и мидии как по уровню ПОЛ – в 3.2–16.3 раза (р ≤ 0.01–0.001) (рис. 1а), так и по уровню GSH. Здесь наиболее выраженные различия обнаружены между сердцевидкой и анадарой – в 3.5–5.5 раза (р ≤ 0.01–0.001) в жабрах и ноге, а между сердцевидкой и мидией – только в ноге, в 1.6 раза (р ≤ 0.05) (рис. 1б). В активности ГП наибольшие различия между моллюсками выявлены в гепатопанкреасе – у сердцевидки активность фермента в 3.4–6.7 раза превышала (р ≤ 0.05–0.001) таковую у анадары и мидии (рис. 1в). Обнаружены существенные межвидовые различия и в активности ГР – у сердцевидки она была больше в 12.5–12.7 раза (р ≤ 0.001) в жабрах и в 2.3–5.6 раза (р ≤ 0.01) – в ноге и гепатопанкреасе, чем у двух других видов (рис. 1г).
Рис. 1.
Содержание продуктов ПОЛ (a), глутатиона (б) и активность ГП (в), ГР (г) в тканях сердцевидки (1), анадары (2) и мидии (3): Г – гепатопанкреас, Ж – жабры, Н – нога. * Значимые различия между видами (p ≤ 0.05–0.001, n = 15–17).
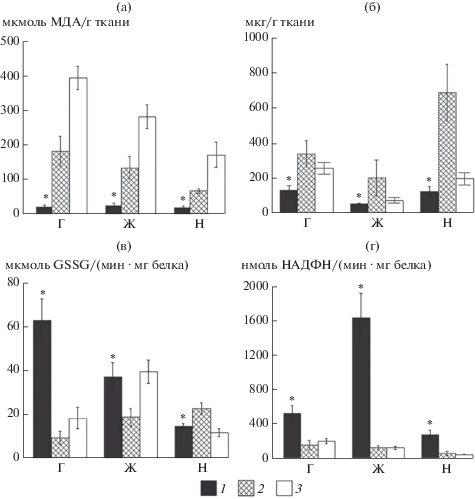
Для оценки уровня АО-активности и ПОЛ у разных видов моллюсков рассчитан коэффициент GSH/MДA в тканях сердцевидки, анадары и мидии (табл. 2). Наиболее высокие значения коэффициента GSH/MДA получены для тканей сердцевидки. В гепатопанкреасе и жабрах C. glaucum коэффициент был в 3.0–8.4 и в 1.4–7.9 раза выше, чем у анадары и мидии. В тканях ноги подобные различия наблюдали только между сердцевидкой и мидией – в 5.1 раза, исключение – нога анадары, где этот коэффициент был самым высоким и равен 9.9.
Таблица 2.
Значения коэффициента GSH/MДA в тканях двустворчатых моллюсков C. glaucum, A. kagoshimensis и M. galloprovincialis
| Ткани | Сердцевидка | Анадара | Мидия |
|---|---|---|---|
| Гепатопанкреас | 5.46 | 1.83 | 0.65 |
| Жабры | 2.12 | 1.47 | 0.27 |
| Нога | 5.81 | 9.91 | 1.14 |
Об особенностях функционирования АГС в тканях сердцевидки позволяет судить соотношение содержания GSH и активности глутатион-зависимых ферментов, их соотношение с интенсивностью ПОЛ в тканях, а также сопоставление полученных величин с таковыми в тканях других видов. На фоне одинаково низкого уровня ПОЛ во всех исследованных тканях сердцевидки наблюдали разное состояние АГС, отличающееся от такового у мидии и анадары. Наиболее выраженные различия обнаружены в жабрах.
В жабрах сердцевидки на фоне наименьшего уровня GSH наблюдали наиболее высокую из всех ее тканей активность ГР и сравнительно высокую активность ГП. Известно, что активность ГП и скорость инактивации перекиси водорода напрямую зависят от содержания в клетке GSH (Кулинский, Колесниченко, 2009). Очевидно, глутатион активно используется в качестве кофактора ГП в реакциях инактивации пероксида водорода и гидроперекисей, а высокоактивная ГР наращивает ресурс этого метаболита (Окислительный…, 2006). Несмотря на высокую активность ГР, содержание GSH остается минимальным среди всех исследованных тканей сердцевидки. Предположительно, это связано с частичной инактивацией глутатиона вследствие ряда причин, среди которых можно выделить следующие.
Возможны высокие и отчасти невосполнимые затраты глутатиона при замещении им функции ГП. Филогенетическое сравнение показало, что роль ГП в АО защите двустворчатых моллюсков не столь велика, как у млекопитающих. По-видимому, в случае недостаточной активности ГП ее функции могут быть замещены другими антиоксидантами, в том числе глутатионом (Livingstone, 2001; Regoli, Principato, 1995).
Кроме того, низкое содержание GSH в жабрах сердцевидки, очевидно, сопровождается повышением уровня окисленного глутатиона, который в условиях ОС может реагировать с сульфгидрильными группами белков, образуя с ними смешанные дисульфиды (Кулинский, Колесниченко, 2009). В этом случае GSSG выводится из цикла восстановления GSH, что может служить одной из причин низкого уровня GSH в жабрах, несмотря на высокоактивную ГР.
Высокую величину соотношения восстановленного и окисленного глутатиона (GSH/GSSG) считают критически важной для эффективной работы АО системы в клетке (Кулинский, Колесниченко, 2009; Regoli, Giuliani, 2014). Следовательно, более низкий, чем у анадары, уровень GSH, выявленный нами в жабрах сердцевидки, и, вероятно, более низкое отношение GSH/GSSG могут быть связаны с высоким уровнем окислительных процессов у C. glaucum, несмотря на низкий уровень ПОЛ. В дальнейшем это может привести к росту чувствительности и снижению устойчивости жабр моллюска к ОС, что подтверждается и более низким значением коэффициента GSH/МДА в жабрах сердцевидки, чем в других тканях.
Нельзя исключить, что в жабрах сердцевидки АО функция глутатиона дополняется другими антиоксидантами – например, СОД, которая способна инактивировать ряд тех же субстратов, что и глутатион, а не только супероксидный анион-радикал. Это согласуется и с представлением о взаимозаменяющих свойствах элементов АО комплекса (Окислительный…, 2006).
Известно, что гипоксия стимулирует генерацию АФК (Фокина и др., 2011; Lushchak, 2011; Welker et al., 2013), истощает пул GSH и усиливает окислительное повреждение (Кулинский, Колесниченко, 2009). Так как особи исследованных видов – бентосные организмы, то они могут периодически испытывать дополнительные риски дефицита кислорода. В отличие от мидии, прикрепляющейся к субстратам, анадара и сердцевидка способны неглубоко зарываться в грунт (Borzykh, Zvereva, 2015; Velez et al., 2016), что создает дополнительную гипоксическую нагрузку на их организм. В таких условиях устойчивость особей этих видов к ОС обусловлена рядом специфических черт их метаболизма. Известно, что устойчивость анадары, во многом определяется наличием гемоглобина (Borzykh, Zvereva, 2015), особой организацией энергетического метаболизма (Golovina et al., 2016), а также активным участием в АО защите как ферментного, так и низкомолекулярного звена (Gostyukhina, Andreenko, 2019). У сердцевидки, вероятно, велика роль АГС и специфики соотношения ее параметров с уровнем ПОЛ – на фоне более низкого, чем у анадары и мидии, уровня ПОЛ выше активность ГП (гепатопанкреас, жабры) и ГР (все ткани), что свидетельствует о конститутивно более высокой, чем у анадары и мидии, активности АГС. По-видимому, это служит адаптацией тканей сердцевидки к обитанию в среде с периодическим дефицитом кислорода. Наличие конститутивно более активной АО системы считают одной из стратегий устойчивости водных животных к ОС (Welker et al., 2013).
Состояние АГС сердцевидки, возможно, связано и с действием загрязнения при накоплении поллютантов в донных осадках. Известно, что жабры наиболее чувствительны к ОС при действии поллютантов в силу их структуры и функции фильтрации (Regoli, Principato, 1995; Trevisan et al., 2016). Кроме того, высокий уровень ПОЛ – широко распространенный маркер ОС у гидробионтов, в том числе двустворчатых моллюсков (Livingstone, 2001; Lushchak, 2011; Morozov et al., 2017; Regoli, Giuliani, 2014). Однако имеются сведения, что уровень ПОЛ может оставаться неизменным при загрязнении (Edge et al., 2012). В связи с этим, низкий уровень ПОЛ во всех тканях сердцевидки позволяет рассматривать особенности АГС моллюска как маркер ОС при действии поллютантов. Ответные реакции АГС у моллюсков при загрязнении могут быть разнонаправленными. Так, под действием тяжелых металлов отмечено снижение уровня GSH (Cossu et al., 2000; Regoli, Principato, 1995), однако, активность ферментов не менялась (Regoli, Principato, 1995). Органические загрязнители также ведут к снижению уровня GSH и активности АО ферментов у моллюсков (Cossu et al., 2000). Уменьшение ресурса GSH при загрязнении нередко сочетается как с усилением интенсивности ПОЛ (Cossu et al., 2000), так и с понижением активности ГП и ГР (Cossu et al., 2000; Kidd, 1997). Изменения в состоянии АГС моллюсков при загрязнении показаны и в других работах (Macías-Mayorga et al., 2015; Nardi et al., 2018). Авторы связывают это с формированием адаптаций со стороны АГС моллюсков в условиях ОС или в начале его развития.
Межвидовое сравнение выявило существенно более низкое, чем у анадары, но близкое к мидии, содержание GSH в жабрах сердцевидки. Эти различия могут быть связаны с наличием у анадары гемоглобина, в защите которого важна роль глутатиона (Golovina et al., 2016). Отличия в уровне GSH в жабрах у сердцевидки и мидии, с одной стороны, и анадары – с другой, дополнительно подтверждают выводы о большой роли глутатиона в АО защите гемоглобинсодержащего моллюска, сделанные ранее как нами (Gostyukhina, 2013; Gostyukhina, Andreenko, 2019; Gostiukhina, Golovina, 2013), так и другими авторами. Так, в жабрах анадары Броутона уровень GSH был выше, чем у моллюсков, не имеющих гемоглобина, – мидии, устрицы, гребешка (Истомина и др., 2011).
С одной стороны, в жабрах сердцевидки состояние АГС более напряженное по сравнению с мидией и анадарой, т.к. на фоне активных ГР и ГП ресурс GSH – самый низкий. Вместе с тем, подобное состояние АГС жабр сердцевидки может указывать и на высокую устойчивость этого моллюска к ОС, так как уровень продуктов ПОЛ одинаков во всех исследованных тканях и существенно ниже, чем у анадары и мидии. Этот вывод согласуется с результатами, показавшими, что жабры двустворок осуществляют важную барьерную функцию между организмом и внешней средой, и в их защите от ОС ведущую роль играет глутатион и АГС в целом (Trevisan et al., 2016).
В гепатопанкреасе сердцевидки наблюдаем сравнительно высокое содержание GSH и активность ГР, а также максимально активную из всех тканей моллюска ГП. Такое соотношение показателей АГС свидетельствует об активном участии GSH в работе ГП, а также об активном ресинтезе этого метаболита, что способствует поддержанию его ресурса на относительно высоком уровне. Подобный АО профиль в гепатопанкреасе моллюсков отмечают и в ряде исследований (Gostyukhina, Andreenko, 2019; Livingstone, 2001; Regoli, Principato, 1995). Такое состояние АГС типично для гепатопанкреаса – основного органа метаболизма, где высок уровень генерации АФК из-за накопления ксенобиотиков и при их детоксикации в процессе работы ферментов биотрансформации, а также в связи с высоким уровнем обмена веществ в целом. Следовательно, функции гепатопанкреаса предполагают конститутивно повышенный уровень ПОЛ (Livingstone, 2001; Regoli, Principato, 1995), что, очевидно, способствует и активной работе АГС.
Сравнение соотношения компонентов АГС в гепатопанкреасе трех видов обнаружило сходную картину. У сердцевидки и мидии высокий ресурс GSH отмечен на фоне высокой или средней активности ГП и ГР, а у анадары все три показателя в гепатопанкреасе имели средние величины по сравнению с другими тканями. Это отражает достаточно сбалансированное соотношение между скоростью окисления и восстановления глутатиона.
Сопоставление соотношения показателей АГС в тканях ноги у трех видов моллюсков выявило его сходный характер у сердцевидки и мидии, что выражалось в высоком содержании GSH при низкой активности обоих ферментов – ГП и ГР (по сравнению с остальными тканями у каждого из видов). Это указывает на невысокую интенсивность инактивации АФК с помощью ГП и означает, что глутатион не столь активно окисляется и, как следствие, нет необходимости в его интенсивном ресинтезе. Такой АО профиль согласуется с особенностями структуры и функции мышечной ткани: более низкой интенсивностью метаболизма, и в том числе окислительных процессов, чем в жабрах и гепатопанкреасе. Нога анадары, напротив, выделялась наибольшим уровнем GSH при высоко активной ГП, но низкой активности ГР. Как отмечено, это может быть обусловлено наличием у анадары гемоглобина, в АО защите которого участвует глутатион (Borzykh, Zvereva, 2015; Golovina et al., 2016). Поддержанию высокого ресурса GSH может способствовать и большое содержание в тканях ноги анадары каротиноидов, инактивирующих ряд АФК наряду с АО системой (Gostyukhina et al., 2013).
Известно, что между интенсивностью ПОЛ и АО активностью в клетке существует динамическое равновесие, что определяется особенностями экологии, физиологии и биохимии вида (Истомина и др., 2011; Климова, Чуйко, 2015; Edge et al., 2012; Lushchak, 2011). Один из критериев такого равновесия – соотношение уровня GSH и ПОЛ (содержание МДА), отражающее интенсивность АО процессов и ПОЛ (Edge et al., 2012). Полученные нами коэффициенты GSH/MДA свидетельствуют о более высоком АО потенциале во всех исследованных тканях сердцевидки по сравнению с мидией и анадарой и сдвиге баланса между ПОЛ и АО системой в сторону АО защиты. Исключение составила нога анадары, отличавшаяся чрезвычайно высоким ресурсом глутатиона и, как следствие, самым высоким значением коэффициента.
Выводы. Показатели антиоксидантной глутатионовой системы у сердцевидки имеют выраженную тканевую специфику. В гепатопанкреасе моллюска сравнительно высокие содержание глутатиона и активность ГР сочетаются с наибольшей из исследованных тканей активностью ГП. В жабрах сердцевидки при минимальном содержании глутатиона наблюдалась максимальная активность ГР и сравнительно высокая активность ГП. В ноге моллюска, напротив, высокий ресурс глутатиона выявлен на фоне относительно низкой активности ферментов ГП и ГР. Межвидовое сравнение показало, что во всех исследованных тканях сердцевидки уровень ПОЛ существенно ниже, чем у мидии и анадары. Состояние АГС в тканях Cerastoderma glaucum в целом отражает преобладание АО активности над интенсивностью ПОЛ по сравнению с таковыми у мидии и анадары. Это указывает на высокую адаптированность сердцевидки к окислительному стрессу при обитании в донных биотопах.
Список литературы
Истомина А.А., Довженко Н.В., Бельчева Н.Н., Челомин В.П. 2011. Активность антиоксидантных ферментов у разных видов моллюсков в условиях гипоксии/аноксии // Вестник Московского государственного областного университета. № 3. С. 12.
Климова Я.С., Чуйко Г.М. 2015. Антиоксидантный статус пресноводных двустворчатых моллюсков Dreissena polymorpha и D. bugensis (Dreissenidae, Bivalvia) из Волжского плёса Рыбинского водохранилища // Поволжский экологический журнал. № 1. С. 33.
Кулинский В.И., Колесниченко Л.С. 2009. Система глутатиона 1. Синтез, транспорт глутатионтрансферазы, глутатионпероксидазы // Биомед. химия. Т. 55. Вып. 3. С. 255.
Окислительный стресс. 2006. Прооксиданты и антиоксиданты. Москва: Фирма “Слово”.
Переслегина И.А. 1989. Активность антиоксидантных ферментов слюны здоровых детей // Лабораторное дело. № 11. С. 20.
Путилина Ф.Е. 1982. Определение содержания восстановленного глутатиона в тканях // Методы биохимических исследований. Ленинград: Изд-во ЛГУ. С. 183.
Фокина Н.Н., Нефедова З.А., Немова Н.Н. 2011. Биохимические адаптации морских двустворчатых моллюсков к аноксии (обзор) // Труды Карельского НЦ РАН. № 3. С. 121.
Belcheva N.N., Dovzhenko N.V., Istomina A.A. et al. 2016. The antioxidant system of the Gray’s mussel Crenomytilus grayanus (Dunker, 1853) and the Japanese scallop Mizuhopecten yessoensis (Jay, 1857) (Mollusca: Bivalvia) // Russ. J. Mar. Biol. V. 42 № 6. P. 489. https://doi.org/10.1134/S106307401606002X
Borzykh O.G., Zvereva L.V. 2015. Mycobiota of the bivalve mollusk Anadara broughtoni (Schrenck, 1867) from various parts of Peter the Great Bay, Sea of Japan // Russ. J. Mar. Biol. V. 41. № 4. P. 321. https://doi.org/10.1134/S1063074015040033
Cossu C., Doyotte A., Babut M. et al. 2000. Antioxidant biomarkers in freshwater bivalves, Unio tumidus, in response to different contamination profiles of aquatic sediments // Ecotoxicol. Environ. Saf. V. 45. № 2. P. 106. https://doi.org/10.1006/eesa.1999.1842
Edge K., Johnston E., Roach A., Ringwood A. 2012. Indicators of environmental stress: cellular biomarkers and reproductive responses in the Sydney rock oyster (Saccostrea glomerata) // Ecotoxicology. V. 21. P. 1415. https://doi.org/10.1007/s10646-012-0895-2
Golovina I.V., Gostyukhina O.L., Andreyenko T.I. 2016. Specific metabolic features in tissues of the ark clam Anadara kagoshimensis Tokunaga, 1906 (Bivalvia: Arcidae), a Black Sea invader // Russian Journal of Biological Invasions. V. 7. № 2. P. 137. https://doi.org/10.1134/S2075111716020065
Gostyukhina O.L. 2013. Comparative characteristics of the antioxidant glutathione complex in the black sea molluscs Mytilus galloprovincialis Lam. and Anadara inaequivalvis Br. // J. Evol. Biochem. Physiol. V. 49. № 1. P. 59. https://doi.org/10.1134/S0022093013010076
Gostyukhina O.L., Andreenko T.I. 2019. Tissue Metabolism and the State of the Antioxidant Complex in the Black Sea Mollusks Anadara kagoshimensis (Tokunaga, 1906) and Mytilus galloprovincialis Lamarck, 1819 with Different Tolerances to Oxidative Stress // Russ. J. Mar. Biol. V. 45. № 3. P. 211. https://doi.org/10.1134/S1063074019030039
Gostiukhina O.L., Golovina I.V. 2013. Comparative analysis of antioxidant complex of the Black Sea mollusks Mytilus galloprovincialis, Anadara inaequivalvis and Crassostrea gigas // Hydrobiol. J. V. 49. № 3. P. 77. https://doi.org/10.1615/hydrobj.v49.i3.70
Gostyukhina O.L., Soldatov A.A., Golovina I.V., Borodina A.V. 2013. Content o of carotenoids and the state of tissue antioxidant enzymatic complex in bivalve mollusc Anadara inaequivalvis Br. // J. Evol. Biochem. Physiol. V. 49. № 3. P. 309. https://doi.org/10.1134/S0022093013030055
Kidd P. 1997. Glutathione: systemic protectant against oxidative and free radical damage // Alt. Med. Rev. V. 2. P. 155.
Livingstone D.R. 2001. Contaminant-stimulated reactive oxygen species production and oxidative damage in aquatic organisms // Mar. Pollut. Bull. V. 42. № 8. P. 656. https://doi.org/10.1016/s0025-326x(01)00060-1
Lushchak V. 2011. Environmentally induced oxidative stress in aquatic animals // Aquat. Toxicol. V. 101. № 1. P. 13. https://doi.org/10.1016/j.aquatox.2010.10.006
Macías-Mayorga D., Laiz I., Moreno-Garrido I., Blasco J. 2015. Is oxidative stress related to cadmium accumulation in the Mollusc Crassostrea angulata? // Aquat. Toxicol. V. 161. P. 231. https://doi.org/10.1016/j.aquatox.2015.02.007
Manduzio H., Rocher B., Durand F. et al. 2005. The point about oxidative stress in mollusks (Review) // ISJ. V. 91. № 2. P. 91.
Morozov A.A. Chuiko G.M., Yurchenko V.V. 2017. Annual variations in hepatic antioxidant defenses and lipid peroxidation in a temperate fish, common bream Abramis brama (L.) // International Aquatic Research. V. 9. № 3. P. 249. https://doi.org/10.1007/s40071-017-0176-z
Nardi A., Benedetti M., Fattorini D., Regoli F. 2018. Oxidative and interactive challenge of cadmium and ocean acidification on the smooth scallop Flexopecten glaber // Aquat. Toxicol. V. 196. P. 53. https://doi.org/10.1016/j.aquatox.2018.01.008
Nogueira L., Garcia D., Trevisan R. et al. 2015. Biochemical responses in mussels Perna perna exposed to diesel B5 // Chemosphere. V. 134. P. 210. https://doi.org/10.1016/j.chemosphere.2015.04.034
Ohkawa H., Ohishi N., Yagi K. 1979. Assay for lipid peroxides in animal tissues by thiobarbituric acid reaction // Analyt. Biochem. V. 95. № 1. P. 351. https://doi.org/10.1016/0003-2697(79)90738-3
Regoli F., Giuliani M. 2014. Oxidative pathways of chemical toxicity and oxidative stress biomarkers in marine organisms // Mar. Environ. Res. V. 93. P. 106. https://doi.org/10.1016/j.marenvres.2013.07.006
Regoli F., Principato G. 1995. Glutathione, glutathione-dependent and antioxidant enzymes in mussel, Mytilus galloprovincialis, exposed to metals under field and laboratory conditions: implications for the use of biochemical biomarkers // Aquat. Toxicol. V. 31. P. 143. https://doi.org/10.1016/0166-445X(94)00064-W
Trevisan R., Mello D., Delapedra G. et al. 2016. Gills as a glutathione-dependent metabolic barrier in Pacific oysters Crassostrea gigas: Absorption, metabolism and excretion of a model electrophile // Aquat. Toxicol. V. 173. P. 105. https://doi.org/10.1016/j.aquatox.2016.01.008
Velez C., Pires A., Leandro S. et al. 2016. The use of Cerastoderma glaucum as a sentinel and bioindicator species: take-home message // Ecological indicators. V. 62. P. 228. https://doi.org/10.1016/j.ecolind.2015.10.051
Viarengo A., Canesi L., Garcia Martinez P. et al. 1995. Pro-oxidant processes and antioxidant defence systems in the tissues of the Antarctic scallop (Adamussium colbecki) compared with the Mediterranean scallop (Pecten jacobaeus) // Comp. Biochem. Physiol., Part B: Biochem. Mol. Biol. V. 111. № 1. P. 119. https://doi.org/10.1016/0305-0491(94)00228-M
Welker A.F., Moreira D.C., Campos E.G., Hermes-Lima M. 2013. Role of redox metabolism for adaptation of aquatic animals to drastic changes in oxygen availability // Comp. Biochem. Physiol., Part A: Molec. Integr. Physiol. V. 165. № 4. P. 384. https://doi.org/10.1016/j.cbpa.2013.04.003
Дополнительные материалы отсутствуют.
Инструменты
Биология внутренних вод


