Биология внутренних вод, 2023, № 4, стр. 527-540
Состояние изолированных популяций пеляди Coregonus peled горных озер Алтая по гистологическим показателям и элементному составу хрусталика глаза
А. Л. Никифоров-Никишин a, Д. Л. Никифоров-Никишин a, Н. И. Кочетков a, *
a Московский государственный университет технологий и управления им. К.Г. Разумовского,
факультет биотехнологий и рыбного хозяйства
Москва, Россия
* E-mail: 9150699@mail.ru
Поступила в редакцию 28.10.2022
После доработки 16.01.2023
Принята к публикации 14.02.2023
- EDN: SBUOMR
- DOI: 10.31857/S0320965223040186
Аннотация
Рассмотрено состояние популяции аборигенного вида рыб в трех озерах горного Алтая. Анализ возраста и массы рыб показал, что в исследуемых водоемах в условиях олиготрофных горных озер популяции пеляди Coregonus peled Gmelin, 1788 демонстрировали различную динамику роста. Возрастной состав рыб различался в водоемах: так, в оз. Кеделю-Коль присутствовали особи четырех возрастных групп (от 1+ до 4+), а в оз. Киделю были только годовики. Гистологическое исследование печени и жабр рыб выявило отсутствие значительных аномалий паразитарной и токсикологической природ. Расчет гистопатологического индекса показал, что распространенность и выраженность патологических отклонений достоверно меньше (p < 0.05) в оз. Киделю. Изучение элементного состава хрусталиков пеляди позволило подтвердить отсутствие значительного уровня загрязнения исследуемых водоемов и высокое качество водной среды. Присутствие в отдельных образцах следовых количеств тяжелых металлов может быть связано с геоморфологическими особенностями региона, участвующими в формировании гидрохимического состава воды исследуемых озер. Полученные в исследовании данные свидетельствуют, что популяции пеляди в изолированных горных озерах Алтая по ряду признаков проявляют различную степень угнетения.
ВВЕДЕНИЕ
Республика Алтай – труднодоступный район Российской Федерации, находящийся рядом с границей Китая и Монголии, где сохранились уникальные природные комплексы, включающие изолированные горные озера с уникальной аборигенной ихтиофауной (Голубцов и др., 2007). Низкая антропогенная нагрузка и отсутствие промысла позволяют сохраняться популяциям некоторых видов рыб почти в неизменной форме в течение длительного времени. При этом каждый водоем может отличаться уникальным гидрохимическим составом водной среды и геоморфологическими особенностями (Sutorikhin et al., 2020). Несмотря на низкую антропогенную нагрузку, основной источник которой туризм (Puzanov et al., 2020), в данных водоемах могут присутствовать загрязнения природного происхождения (эрозия горных пород) и определенный техногенный фон в результате стока воды с большой территории водосбора.
В Улаганском районе Республики Алтай расположено более десятка озер разного размера, глубины и степени трофности (Попов, 2013). Несмотря на близкое расположение озер, они могут значительно различаться по источникам питания и водосборной площади, химическому составу водной среды (Семенова, 1969) и составу гидробионтов ихтиофауны (Вершинин и др., 1981; Конунова, Малков, 2010).
В отдельных горных озерах Алтая обитает лишь несколько видов рыб, большая часть которых, по-видимому, появилась в результате интродукции. Основные работы по вселению новых видов проводили в 1970-х гг. (Гундризер, 1967; Вершинин и др., 1979) и к настоящему времени интродуцированные виды полностью ассимилировались или погибли, не выдержав конкуренции. Во время проведения рыбоводно-акклиматизационных работ водоемы были либо обезрыблены, либо обладали обеденным видовым составом ихтиофауны (Гундризер, 1967).
На данный момент в изученных водоемах горного Алтая встречаются алтайский осман Потанина (Oreoleuciscus potanini Kessler, 1879) и пелядь (Coregonus peled Gmelin, 1789). Пелядь – наиболее распространенный вид сиговых рыб горного Алтая, образующий многочисленные формы и группировки в зависимости от экологических условий (Журавлев, Ломакин, 2013). Среди интродуцированных видов следует отметить щуку (Esox lucius) и радужную форель (Oncorhynchus mykiss), зарыбление которых в водоемы проводилось с целью развития туризма. Вселение этих видов могло значительно повлиять на состояние популяций местных видов рыб. Водоемы, рассматриваемые в данной работе, возможно, также подвергались зарыблению в 1970–1980-х гг., а в последнее время частными предпринимателями согласно программе “Развитие аквакультуры Республики Алтай”. По этим причинам исследование рыбоводно-биологических и гистологических показателей аборигенных популяций рыб в таких водоемах позволит рассматривать возможность их использования в качестве природных резерватов для автохтонной ихтиофауны.
Для оценки степени загрязнения водоемов токсикантами неорганической природы, можно исследовать микроэлементный состав хрусталиков как индикатора текущего и отдаленного загрязнения водоемов (Simakov et al., 2021). Распределение элементов, если они присутствуют в водной среде, носит равномерный характер. Тяжелые металлы накапливаются как в ядре хрусталика, так и в коре линзы глаза (Konz et al., 2014). При этом, соотношение макроэлементов хрусталика считают показателем метаболизма и состояния рыбы (Young et al., 2022).
Гистопатологическое исследование органов и тканей рыб при оценке состояния популяций – важный показатель токсического и стрессового воздействий (Oost et al., 2003; Phrompanya et al., 2021). Такие исследования позволяют определить состояние здоровья, а также признаки патологических нарушений и заболеваний. Патологические изменения могут выступать показателем филогенетического происхождения, принадлежности к трофическим группам, качества и предпочтения среды обитания (Sales et al., 2017).
Цель работы – исследование изолированных групп (популяций) пеляди в некоторых озерах горного Алтая по морфометрическим и гистологическим параметрам; оценка накоплений токсических элементов в инертных тканях рыб в результате фонового загрязнения.
МАТЕРИАЛ И МЕТОДЫ ИССЛЕДОВАНИЯ
Район исследований. Изучали ихтиофауну трех озер, расположенных в горной части Республики Алтай Улаганского района: оз. Кеделю-Коль (50°51′, 87°66′), оз. Малый Эгистукель (50°49′, 87°65′), оз. Киделю (50°51′, 87°66′) (рис. 1). Гидрохимические параметры воды различались во всех исследуемых озерах. Гидрохимический анализ воды проводили по общепринятым методикам (Алекин, 1970; Справочник…, 1989). Результаты гидрохимического исследования представлены в табл. 1.
Рис. 1.
Месторасположение исследуемых озер в границах Республики Алтай, РФ. 1. – оз. Кеделю-Коль, 2 – оз. Малый Эгистукель, 3 – оз. Киделю.
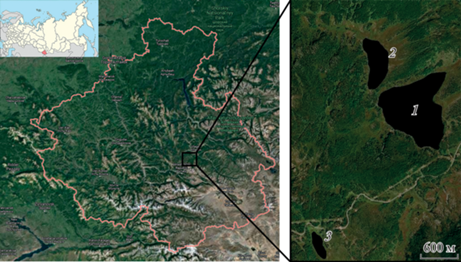
Таблица 1.
Гидрохимические параметры воды из исследуемых водоемов
| Озеро | dH | рН | Хлориды | НСО3 | S${\text{O}}_{4}^{{2 - }}$ | N${\text{H}}_{4}^{ + }$ | Nа+ + K+ | Са2+ | Мg2+ | Сумма ионов |
|---|---|---|---|---|---|---|---|---|---|---|
| мг/л | ||||||||||
| Кеделю-Коль | 0.8 | 6.2 | 6.0 | 49.0 | 6.2 | 0.4 | 6.9 | 10.0 | 3.6 | 82.1 |
| Малый Эгистукель | 0.6 | 7.3 | 6.7 | 36.6 | 7.4 | 0.59 | 5.5 | 8.0 | 6.0 | 70.7 |
| Киделю | 1.0 | 6.6 | 4.0 | 92.0 | 9.0 | 0.1 | 18.0 | 26.1 | 1.0 | 150.2 |
Объект исследования. Рыб отлавливали в сентябре 2021 г. жаберными сетями (размер ячеи 18–80 мм) в разных точках акватории озер. Из каждого исследуемого озера отбирали особей пеляди различного размерного и возрастного составов.
У каждой рыбы измеряли следующие показатели: стандартная длина (SL), масса тела, возраст рыбы по чешуе (Правдин, 1966). Также оценивали состояние зрелости гонад и содержимое кишечника (Руководство…, 1961). Помимо этого, проводили ихтиопатологический осмотр, направленный на выявление паразитов и признаков бактериальных инфекций.
Гистологическое исследование. У четырех особей пеляди из каждого озера различного размерного и возрастного состава (табл. 2) отбирали печень и жабры для оценки возможного токсического воздействия и выявления общего состояния тканей. Группы рыб из различных исследуемых водоемов получили следующие условные обозначения для использования на рисунках: в оз. Кеделю-Коль – PL1, оз. Малый Эгистукель – PL2, oз. Киделю – PL3.
Таблица 2.
Размерно-массовые показатели пеляди, выловленной в исследуемых озерах
| Возраст, лет | Стандартная длина, мм |
Cv, % | Масса, г | Cv, % | n |
|---|---|---|---|---|---|
| оз. Кеделю-Коль | |||||
| 1+ | 203.0 | – | 104.0 | – | 1 |
| 2+ | 219.6 ± 5.3 | 3.6 | 144.0 ± 8.7 | 8.5 | 3 |
| 3+ | 230.8 ± 2.4 | 4.0 | 166.6 ± 5.5 | 12.9 | 16 |
| 4+ | 236 | – | 169.0 | – | 1 |
| оз. Малый Эгистукель | |||||
| 0+ | 138.1 ± 0.7 | 1.7 | 36.0 ± 0.4 | 3.8 | 46 |
| 1+ | 143.1 ± 1.6 | 2.5 | 39.1 ± 1.0 | 6.1 | 6 |
| оз. Киделю | |||||
| 1+ | 219.9 ± 2.3 | 3.3 | 111.2 ± 2.1 | 5.8 | 10 |
Ткани фиксировали в 4%-ном нейтральном формалине в течение 24 ч при комнатной температуре. Далее ткань дегидратировалась в серии градуированных спиртов и заливалась в парафин. Срезы в 4 мкм окрашивали гематоксилин эозином (H&E) и исследовали под световым микроскопом. Приготовление и окраску гистологических препаратов проводили по (Suvarna et al., 2018).
Морфометрию жабр и печени пеляди, органов, отражающих качество окружающей среды, исследовали для сравнения измеряемых показателей у рыб из каждого озера. Измеряли следующие морфометрические параметры: длину и ширину вторичных ламелл, расстояние между вторичными ламеллами, толщину интраламилярного эпителия, площадь, периметр и диаметр ядра гепатоцита, площадь цитоплазмы, отношение площади ядра к площади цитоплазмы гепатоцита.
Для оценки распространенности и выраженности гистопатологических изменений использовали полуколичественный метод оценки по работе (Bernet et al., 1999). Суть метода заключается в бальной оценке отдельных гистопатологических нарушений, относящихся к четырем паттернам реакции: нарушения циркуляции (HIcd), регрессивные (связанные с атрофией органов) (HIrc) и прогрессивные (связанные с гипертрофией) (HIpc) изменения, воспалительные реакции (HIir). Данные альтерации оценивали индивидуально с помощью балльного показателя, варьирующегося от 0 (неизмененный) до шести (существенные изменения, представленные диффузно). Расчеты индексов гистологических изменений представлены в формулах (1) и (2):
(1)
${{I}_{{{\text{орг}}\,{\text{рп}}}}} = \sum\limits_{{\text{алт}}} {\left( {{{a}_{{{\text{орг}}\,{\text{рп}}\,\,{\text{алт}}}}}{{w}_{{{\text{орг}}\,{\text{рп}}\,\,{\text{алт}}}}}} \right);} $(2)
${{I}_{{{\text{орг}}}}} = \sum\limits_{{\text{рп}}} {\sum\limits_{{\text{алт}}} {\left( {{{a}_{{{\text{орг}}\,{\text{рп}}\,\,{\text{алт}}}}}{{w}_{{{\text{орг}}\,{\text{рп}}\,\,{\text{алт}}}}}} \right),} } $где aорг рп алт – балл альтерации паттерна реакции для органа; wорг рп алт – фактор важности альтерации паттерна реакции для органа; Iорг рп – гистопатологический индекс паттерна реакции для органа; Iорг рп – суммарный гистопатологический индекс для органа.
Для каждой альтерации назначается свой фактор важности, варьирующийся от 1 до 3, отражающий степень влияния патологического отклонения на функцию органа (табл. 3). Финальный балл рассчитывается путем умножения выставленного балла на фактор важности. Сумма данных баллов для каждого отдельного паттерна или органа реакции позволяет получить финальный индекс.
Таблица 3.
Гистопатологии в жабрах и печени пеляди и их фактор важности при расчете гистопатологического индекса
| Паттерн реакции | Функциональная составляющая ткани | Альтерация | Фактор важности Wорг рп алт |
|---|---|---|---|
| Печень | |||
| Воспалительные реакции | Ткань печени | Присутствие маланомакрофагов | 1b |
| Агрегация макрофагов | 2c | ||
| Мононуклеарный инфильтрат | 2a | ||
| Прогрессивные изменения | Гепатоциты | Гипертрофия цитоплазмы | 1c |
| Гипертрофия ядра | 1c | ||
| Нарушения циркуляции | Синусоиды печени | Дилатация синусоидных капилляров | 1a, b |
| Регрессивные изменения | Гепатоциты | Некроз | 3a |
| Пикнотические ядра/некроз одиночной клетки | 2a, b | ||
| Жабры | |||
| Воспалительные реакции | Комплекс ткани жаберного аппарата | Присутствие эозинофильных гранулоцитов | 1c |
| Прогрессивные изменения | Вторичные ламеллы | Гипертрофия эпителия | 2a |
| Слияние ламелл | 2a | ||
| Нарушения циркуляции | Вторичные ламеллы | Гиперемия | 1a |
| Дилатация жаберных ламелл | 1a | ||
| Регрессивные изменения | Вторичные ламеллы | Отслоение/десквамация эпителия | 1a, b |
| Расширение кончиков вторичных ламелл | 1b | ||
| Искривление ламелл | 1b | ||
Элементный состав хрусталика. Элементный состав хрусталика измеряли у трех особей пеляди из каждого исследуемого озера методом рентгеновского энергодисперсионного микроанализа на двухлучевом сканирующем электронном микроскопе (Zeiss CrossBeam 340 with a Schottky cathode) с использованием детектора X-Max 80 Oxford Instruments. Для обеспечения достоверности полученных результатов и уменьшения погрешности измерений проводили предварительную калибровку детектора на стандартных образцах при пониженных ускоряющих напряжениях 7.5 и 10 кВ. Кроме того, в процессе измерений учитывали осажденную на поверхность углеродную пленку толщиной 25 нм. Сигнал, вносимый атомами пленки, вычитали из общего сигнала образца с помощью специализированного программного обеспечения.
Статистический анализ. Сравнение различных параметров в исследовании, подходящих под нормальное распределение, проводили с использованием односторонней статистической модели ANOVA с последующим пост-хок тестом Тьюки. Если данные не соответствовали нормальному распределению, применяли непараметрический метод Крускела–Уоллиса, значения при p < 0.05 принимали как статистически достоверные. Для определения нормальности распределения данных использовали тест Шапиро–Уилка.
Статистическую обработку данных проводили с помощью программного обеспечения GraphPad Prism версии 9.0 (GraphPad, San Diego, CA, USA).
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
Размерно-массовые показатели рыб. Пелядь, обитающая во всех трех водоемах, имела значительные различия в возрастном и размерном составе вследствие разного объема кормовой базы исследуемых озер. Наиболее крупная особь пеляди поймана в оз. Кеделю-Коль, ее возраст достигал 4+ лет, масса – 236 г (рис. 2). В озерах Малый Эгистукель и Киделю пелядь представляли сеголетки и годовики, особи более старших возрастов не найдены. При этом, скорость роста в первые годы была значительно больше, чем в последующие (табл. 2). Годовики в оз. Кеделю-Коль достигают массы ~200 г, после чего их рост почти останавливается. Самый низкий прирост отмечен в оз. Малый Эгистукель, где максимальная масса годовиков была 143.1 г.
Ихтиопатологические исследования. Ихтиопатологический осмотр показал почти полное отсутствие паразитов и бактериальных поражений у ихтиофауны. У отдельных особей пеляди старших возрастных групп выявлены единичные случаи поражения жабр сосальщиками рода Gyrodactylidae.
Из непаразитических поражений отмечены единичные случаи нарушения созревания отдельных ооцитов у самок пеляди на IV–V стадии созревания. Наполнение желудочно-кишечного тракта пеляди было средним, основа пищевого кома – изоподы. В третьем озере у части особей в кишечнике помимо изопод и насекомых найдены мальки рыб. Состояние печени обоих исследуемых видов рыб было нормальным, вне зависимости от пола. Степень отложения жировой ткани в теле рыбы значительно колебалась в зависимости от возраста и пола.
Гистология. Исследование гистологической структуры жабр позволило выявить наличие незначительных морфологических изменений в структуре ткани. Жабры пеляди включали первичные и вторичные ламеллы. Первичные ламеллы являются частью жаберных дуг и состоят из хрящевой ткани. Снаружи первичные ламеллы покрыты недифференцированными базальными клетками, среди которых встречаются хлоридные клетки. Вторичные ламеллы включают эпителиальные клетки, расположенные на базальной мембране, поддерживаемой столбчатыми клетками. Также на вторичных ламеллах располагаются хлоридные и бокаловидные клетки. В лакунах, ограниченных столбчатыми клетками, встречаются эритроциты.
В оз. Кеделю-Коль в жабрах пеляди обнаружено расширение дистальных концов вторичных ламелл и отслоение респираторного эпителия (рис. 3a, 3б). Помимо этого, на некоторых участках среза жабр отмечено искривление вторичных лемелл и гипертрофия базальных клеток. На некоторых участках жабр гипертрофированные базальные клетки приводили к слиянию вторичных ламелл.
Рис. 3.
Гистология жабр Coregonus peled из различных исследуемых озер. ГХ – гиалиновый хрящ; Хо – хондроциты; НБК – недифференцированная базальная клетка; МК – мукоидная клетка; ХК – хлоридная клетка; Ги – гипертрофия эпителия; Te – телеангиэктазия; ОЭ – отслоение эпителия; Па – паразит; СЛ – слияние ламелл; ДЛ – расширение кончиков вторичных ламелл; ИЛ – искривление ламелл. Здесь и на рис. 4, окраска H&E.
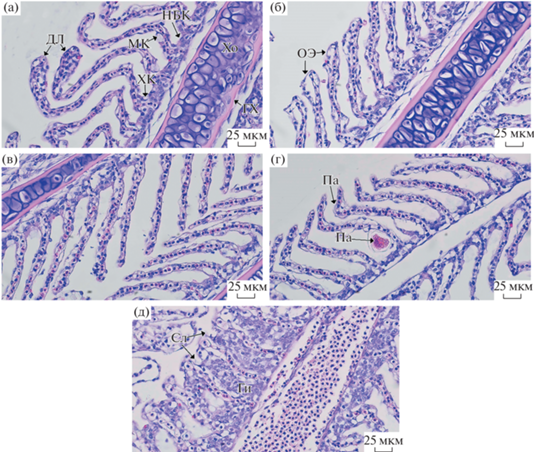
Жабры пеляди оз. Малый Эгистукель обладали схожими патологическими отклонениями. Так, на всех исследуемых препаратах отмечено отслоение респираторного эпителия и очаги искривления вторичных ламелл (рис. 3в, 3г), а также отдельные участки жаберного эпителия, поврежденного жаберными сосальщиками (предположительно Gyrodactylidae sp.). Гиперплазия базальных клеток не выявлена.
В печени пеляди можно было различить равномерно окрашенные гепатоциты с округлым ядром и дифференцированным ядрышком (рис. 4a). По всей площади паренхимы печени располагались синусоидные капилляры и сосуды портальной системы печени. Также, в печени отчетливо видны желчные протоки, состоящие из призматического эпителия, соединительной ткани и гладкого мышечного слоя.
Рис. 4.
Гистология тканей печени Coregonus peled из различных исследуемых озер: а – ядро гепатоцита (ЯГ) и синусоидный каппиляр (Си); б, в – очаг базофилии (ОБ) и некроз гепатоцитов (Не) в печени рыб из оз. Кеделю-Коль; г, д – некроз одиночной клетки (НОК) и вакуолизация (Ва) у пеляди из оз. Малый Эгистукель; е – одиночные некротические гепатоциты у пеляди из оз. Киделю.
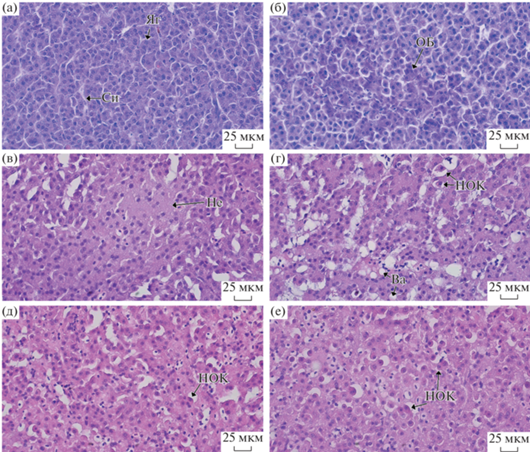
В печени рыб из оз. Кеделю-Коль отмечены очаги базофильных клеток (рис. 4б). Помимо этого, на отдельных участках печени найдены очаги пикноза и некроза гепатоцитов (рис. 4в). Достоверных морфометрических изменений в данной группе не обнаружено.
У пеляди из оз. Малый Эгистукель по всей площади паренхимы печени встречались одиночные некротические клетки (пер. single cell necrosis) (рис. 4г, 4д). Данные клетки имели уплотненную цитоплазму с выраженной эозинофильной окраской и пикнотические/фрагментированные, ацентрично расположенные ядра. Так, в данной группе были отмечены вакуоли, преимущественно расположенные вблизи аггрегатов лимфоцитов. В данной группе также не выявлено достоверных отличий морфометрических параметров.
Для печени пеляди из оз. Киделю характерны сходные гистопатологические изменения. На некоторых участках обнаружены очаги инфильтрации лейкоцитами. По всей площади органа расположены одиночные некротические гепатоциты (рис. 4е), как и у рыб из этого озера. Значение морфометрических параметров ядра гепатоцита и отношение площади ядра и цитоплазмы были достоверно меньше (p < 0.05; рис. 5a–5г), чем у других исследуемых групп.
Рис. 5.
Гистоморфометрические параметры печени и жабр Coregonus peled: площадь ядра гепатоцита (a); периметр ядра гепатоцита (б); диаметр ядра гепатоцита (в); отношение площади цитоплазмы к ядру (г); толщина интраламмилярного эпителия (д); длина вторичных ламелл (е). Здесь и на рис. 6 и 7 данные представлены в виде Mean ± SD, разные буквы указывают на статистически значимую разницу между группами; PL1 – Кеделю-Коль; PL2 – Малый Эгистукель; PL3 – oз. Киделю.
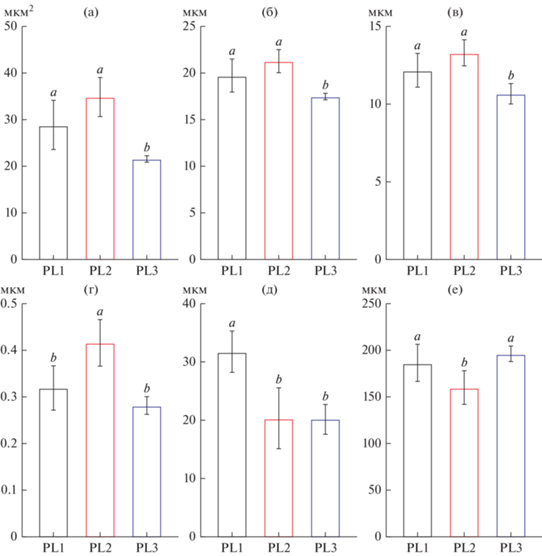
Морфометрические изменения жабр показали, что у пеляди из оз. Кеделю-Коль толщина базальных клеток была достоверно (p < 0.05) выше, чем у рыб из других озер (рис. 5д). Достоверных отличий по другим морфометрическим параметрам обнаружено не было.
В оз. Киделю также наблюдали минимальное количество морфологических изменений вторичных ламелл (искривление, расширение дистальных концов). Морфометрические измерения показали, что рыбы из этого озера обладают достоверно наибольшей (p < 0.05) длиной вторичных ламелл (рис. 5е).
Расчет гистологического индекса показал, что в жабрах пеляди исследуемых озер наибольший вклад в индекс органа вносят прогрессивные (HIpc) и регрессивные (HIrc) паттерны реакции. При этом индекс прогрессивных изменений был достоверно меньше в оз. Киделю (p < 0.05; рис. 6a). Наиболее выраженными изменениями у рыб из озер Кеделю-Коль и Малый Эгистукель были гипертрофия эпителия и слияние ламелл. Достоверных отличий по другим паттернам реакции не обнаружено. Общий гистопатологический индекс органа достоверно отличался у пеляди из оз. Киделю (p < 0.05; рис. 6б).
Рис. 6.
Гистопатологический индекс (HI) жабр (а, б) и печени (в, г) Coregonus peled из различных исследуемых озер (б, г). Нарушение ткани (HI) классифицировали по четырем паттернам реакции: регрессивные (HIrc) и прогрессивные (HIpc) изменения; нарушения циркуляции (HIcd); воспалительные реакции (HIir).
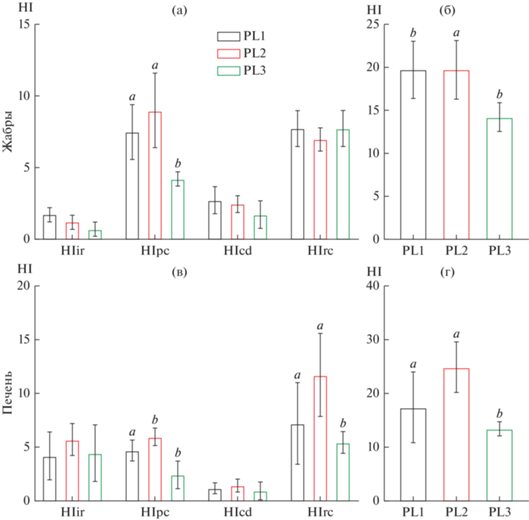
При расчете гистопатологического индекса установлено, что доминирующим паттерном реакции был индекс регрессивных изменений (HIrc) (рис. 6в). Во всех исследуемых группах регрессивные изменения выражались в апоптозе/некрозе одиночных клеток и очагов некроза гепатоцитов. При этом значение индекса в оз. Киделю было достоверно меньше (p < 0.05; рис. 6в), чем у рыб из оз. Малый Эгистукель. Также у данной группы выявлены достоверные различия по индексу прогрессивных изменений (p < 0.05). Итоговый индекс органа был достоверно выше у пеляди из оз. Малый Эгистукель (p < 0.05; рис. 6г).
Микроэлементный состав хрусталика. Для изучения процессов биоаккумуляции токсических компонентов водной среды проводили микроэлементный анализ хрусталиков глаза рыб, как наиболее инертного вида ткани, в которой токсиканты могут сохраняться в течение длительного периода.
В пробах хрусталиков глаза рыб из озер Кеделю-Коль и Малый Эгистукель флуктуации микроэлементов были незначительны (рис. 7a), что указывает на отсутствие видимого антропогенного воздействия. У исследуемых рыб обнаруженные элементы (за исключением кислорода и углерода) для озер Кеделю-Коль, Малый Эгистукель и Киделю были 1.2, 1.41 и 0.9% массы хрусталика соответственно. Значительную массовую долю в хрусталике пеляди представляют сера (от 41.86% в PL3 до 71.3% в PL2) и фосфор (от 12.46% в PL3 до 7.19 в PL2). Также найдены высокие концентрации катионов кальция, калия и натрия, следовые количества никеля и алюминия зарегистрированы у рыб из всех исследуемых озер.
Рис. 7.
Элементный состав хрусталика особей Coregonus peled из исследуемых озер: а ‒ относительный вес элементов хрусталика (представлен в трех повторностях), б ‒ относительный вес серы, в ‒ фосфора, г ‒ натрия, д ‒ калия.
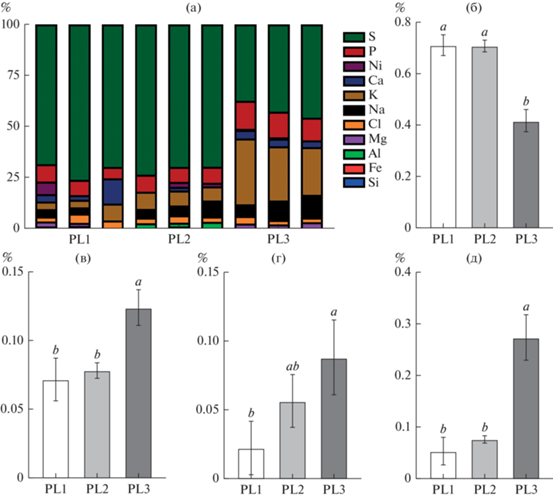
Достоверные отличия в микроэлементном составе хрусталика отмечены в оз. Киделю (PL3). Так, у пеляди из данного водоема массовая доля серы была достоверно меньше, чем в других озерах (p < 0.05; рис. 7б), а концентрация фосфора, натрия и калия достоверно превышала (p < 0.05; рис. 7в, 7г, 7д) таковую у PL1 и PL2.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Полученные данные свидетельствуют, что популяции пеляди в изолированных горных озерах Республики Алтай проявляют различную степень угнетения по ряду признаков. Ихтиофауна исследуемых озер, помимо пеляди включала также Oncorhynchus mykiss (оз. Кеделю-Коль) и Oreoleuciscus potanini (оз. Киделю). Это дает возможность предложить интродукцию рыб, имеющих рыбохозяйственное значение, но не гарантирует успешность данных мероприятий. Только в одном из исследуемых озер присутствовал недавно интродуцированный вид – радужная форель (отдельные экземпляры).
Установлено, что в оз. Кеделю-Коль пелядь представлена различными возрастными и размерными группами, а в озерах Киделю и Малый Эгистукель встречались особи не старше одного года. Воспроизводство пеляди в данных водоемах возможно за счет единичных половозрелых особей или попадания из других водоемов в максимально половодные годы. Отсутствие взрослых особей и низкий темп роста, вероятно, обусловлен следующими факторами: возможное наличие заморов в зимний период времени в результате более высокой минерализации; недостаточная кормовая база; конкуренция с другими видами рыбы (Oncorhynchus mikiss в оз. Кеделю-Коль и османа Потанина Oreoleuciscus potanini в оз. Киделю). Для изолированных озер крайнего севера у сиговых также отмечено уменьшение темпов роста с возрастом (Шестаков, 2021; Матковский, 2022). Малое развитие кормовой базы в исследуемых горных озерах, вероятно, обусловлено низкими температурами и недостаточным количеством нутриентов в воде (Bezmaternykh et al., 2020; Yermolaeva, Fetter, 2020). Осман Потанина, преимущественно распространенный в верхних течениях р. Обь и ее притоках (Golubtsov et al., 1999), появился в исследуемых водоемах (оз. Киделю) в результате неконтролируемого зарыбления местным населением (Журавлев, Ломакин, 2013).
Клинический осмотр рыб показал нормальное состояние внутренних органов во всех исследуемых озерах. У рыб PL2 и PL3 обнаруживались единичные поражения жабр невидоспецифичными паразитами. При этом исследование органов и тканей рыб показало полное отсутствие патологий инфекционной природы в оз. Кеделю-Коль.
В жабрах патологические отклонения в основном выражались в прогрессивных изменениях. Гипертрофия базальных клеток и слияние вторичных ламелл, преимущественно отмечаемые в группах PL1, – часть адаптивной реакции органа (Cerqueira, Fernandes, 2002). В других работах также продемонстрирован обратимый характер таких изменений жаберной ткани вследствие действия малых концентраций токсикантов или изменения абиотических условий среды (Koroleva, Kashulin, 2016). В свою очередь, при сильном повреждении жаберной ткани отмечено увеличение площади мукоидных клеток и угнетение секреторной активности хлоридных клеток, а также признаков воспаления (Reis et al., 2009; Fanta et al., 2003) как части защитного механизма. В данном исследовании подобных морфологических изменений ни в одной из групп не обнаружено. Таким образом, на основании полученных данных можно предположить, что повреждения жабр носили локальный характер и оказывали минимальное влияние на респираторную функцию органа.
Одной из основных причин гипертрофии базального эпителия также могли быть паразитарные инвазии, часто распространенные в естественных водоемах и приводящие к прогрессивным изменениям и нарушениям циркуляции (Fu et al., 2017). Следует отметить, что для загрязненных водоемов частота воспалительных и морфологических (в т.ч. нарушение архитектуры хрящевой ткани) нарушений жабр в разы выше, чем в относительно чистых, где гистопатологические нарушения в основном ассоциированы с пролиферативными изменениями (Wood, Eom, 2021; Gashkina et al., 2022). Наименьшее количество изменений морфологии жабр обнаружено в оз. Киделю (PL3), что, вероятнее всего, связано c возрастом рыб (1+).
Среди других морфологических отклонений следует отметить искривление и расширение дистальных концов вторичных ламелл у большей части исследуемых рыб, чаще всего связанные с механическими повреждениями или паразитарными патологиями.
В печени пеляди из исследуемых озер присутствовал ряд незначительных патологических отклонений. Среди всех исследуемых рыб наиболее часто встречались изменения регрессивного характера, в частности, пикноз и некроз отдельных гепатоцитов. Наличие отдельных очагов некроза в паренхиме печени не всегда связано с токсическим воздействием или нарушением в метаболизме организма, а также может быть вызвано с существенными изменениями в условиях существования (сезонные изменения, изменения кормовой базы, степень созревания). Наиболее часто некротические очаги отмечали в группах PL1 и PL2 (подтверждено расчетом гистопатологического индекса).
Наличие участков вакуолизации жировой природы может быть связано как с воздействием токсикантов (Marty et al., 2003; Wolf et al., 2015), так и с активным питанием рыб. Так, в сентябре (время контрольного вылова) у Salmonidae и других рыб происходит накопление жировых запасов в брюшной полости и в тканях печени (Wolf et al., 2013). Ограничение кормовой базы, вероятно, привело к тому, что характерное для этого сезона накопление липидов и гликогена в гепатоцитах печени встречалось не у всех особей пеляди.
В печени пеляди из озер Малый Эгистукель и Киделю обнаружены одиночные гепатоциты с некрозом. Данный тип патологических нарушений можно отнести к апоптозу, однако, согласно исследованию ряда авторов (Thoolen et al., 2010), данные нарушения не всегда могут быть отнесены к регулируемому процессу клеточной гибели. В связи с этим, в нашей работе данное явление охарактеризовано нейтральным термином – “некроз одиночной клетки”. Появление данных поражений в тканях печени может быть как следствием влияния внешних факторов (поллютантов), так и признаком процессов обновления печеночной ткани. В ряде работ (Agamy et al., 2012; Marigomez et al., 2006) отмечены подобные нарушения в печени, обычно обусловленные воздействием токсикантов либо неудовлетворительными условиями среды обитания.
Обнаруженные очаги эозинофилии клеток у пеляди из оз. Кеделю-Коль, по сообщениям ряда авторов (Mikaelian et al., 1998; Myers et al., 1998), могут быть признаками преднеопластических и неопластических изменений. Данные морфологические нарушения найдены у рыб из пресных и морских вод (Costa et al., 2009) и могут быть ассоциированы с расширением и пролиферацией капилляров печени, а также ядерной аномалией гепатоцитов.
Измерение содержания элементного состава в хрусталиках пеляди коррелирует с качеством воды изученных водных объектов. Наибольшим изменениям подвержены уровни серы, фосфора и калия. Причем, в озерах Кеделю-Коль и Малый Эгистукель сера – наиболее распространенный элемент хрусталиков (кроме кислорода и углерода), в оз. Киделю уровень содержания серы падает, а уровень калия возрастает. Наиболее вероятная причина таких изменений – отличие гидрохимического состава воды исследуемых водоемов. При этом выявленные уровни тяжелых металлов и других небиогенных элементов неопасны для здоровья ихтиофауны во всех исследуемых водоемах. Исследования ряда авторов (Исаков, Селюков, 2010; Selyukov, 2012; Shuman et al., 2019) показали, что высокое содержание тяжелых металлов в воде может быть причиной серьезных гистопатологических изменений и нарушения репродуктивной функции пеляди.
В результате проведенных в сентябре 2021 г. полевых и лабораторных исследований следует отметить, что исследуемые водоемы – уникальные резервуары автохтонной ихтиофауны с низкой антропогенной нагрузкой. По мнению авторов, использование водоемов для рыборазведения малоцелесообразно, но их значение для сохранения изолированных популяций представляет как научный, так и практический интерес. Существующие там рыбы могут служить для интродукции в другие водоемы, так как пелядь обладает важным рыбохозяйственным значением (Shuman et al., 2019), как и другие сиговые рыбы (Kahilainen et al., 2003; Hayden et al., 2013).
Выводы. Исследование ихтиофауны изолированных водоемов горного Алтая показало обедненность ее состава, а ключевыми представителями выступают пелядь и осман Потанина. Гидрологические показатели близкорасположенных водоемов могут отличаться, что, вероятно, оказывает влияние на кормовую базу и скорость роста пеляди как наиболее хорошо представленного вида. Наиболее благоприятные условия для роста пеляди в оз. Кеделю-Коль, где встречались все возрастные группы данного вида. В озерах Малый Эгистукель и Киделю условия существования пеляди менее благоприятны, так как для рыб из этих водоемов характерно отсутствие старших возрастных групп. Из этого следует, что, скорее всего, пелядь всех исследуемых водоемов относится к одной популяции, а зарыбление озер Малый Эгистукель и Киделю происходит за счет миграции рыбы в полноводные годы. Обнаруженные патологические отклонения в жабрах преимущественно носили прогрессивный характер (гипертрофия базального эпителия и искривлении ламелл). В печени изменения выражены в регрессивных нарушениях – в очагах некроза и некрозе одиночных клеток. Морфометрические измерения и подсчет гистопатологического индекса позволил установить, что наибольшая встречаемость и распространенность патологий отмечены в оз. Малый Эгистукель, наименьшая – в оз. Киделю. Изучение элементного состава хрусталика показало, что состав его элементов коррелирует с гидрохимическими условиями среды. Содержание токсичных элементов в хрусталике носило следовой характер во всех исследуемых озерах.
Список литературы
Алекин О.А. 1970. Основы гидрохимии. Л.: Гидрометеоиздат.
Вершинин В.К., Зимин А.Г., Коновалова О.С. 1981. Особенности биологии пеляди Coregonus peled (Gmelin), вселенной в озера Горного Алтая // Исследования планктона, бентоса и рыб Сибири. Томск: Изд-во Томск. гос. ун-та. С. 66.
Вершинин В.К., Гундризер А.Н., Зимин А.Г. 1979. Биология муксуна и пеляди, интродуцированных в озера Горного Алтая // Биологические ресурсы Алтайского края и пути их рационального использования. Барнаул: Тез. докл. к конф. Алтайское кн. изд-во. С. 121.
Голубцов А.С., Малков Н.П. 2007. Очерк ихтиофауны Республики Алтай: систематическое разнообразие, распространение и охрана. М.: Тов-во науч. изданий КМК.
Гундризер А.Н. 1967. Состояние рыболовства и возможности рыбоводноакклиматизационных работ в Горном Алтае // Вопросы сельскохозяйственного рыбоводства и гидробиологии Западной Сибири. Барнаул: Тез. докл. к конф. Алтайское кн. изд-во. С. 90.
Журавлев В.Б., Ломакин С.Л. 2013. История акклиматизации и современный состав ихтиофауны сиговых рыб Каракудюрских озер Улаганского района Республики Алтай // Алтайский зоол. журн. № 7. С. 3.
Исаков П.В., Селюков А.Г. 2010. Сиговые рыбы в экосистеме Обской губы. Тюмень: Тюмен. гос. ун-т. EDN TJQGVN.
Конунова А.Н., Малков Н.П. 2010. Ихтиофауна водоемов Улаганского плато (Восточный Алтай) // Биоразнообразие, проблемы экологии Горного Алтая и сопредельных регионов: настоящее, прошлое, будущее: Матер. Второй междунар. конф. 20–24 сентября. С. 52.
Матковский А.К. 2022. Рост муксуна Coregonus muksun в различных условиях водности р. Обь // Биология внутр. вод. № 3. С. 278. https://doi.org/10.31857/S0320965222030147
Попов П.А. 2013. О характере распределения рыб на территории Горного Алтая // Вестн. Томск. гос. ун-та. Биология. № 2 (22). С. 141.
Правдин И.Ф. 1966. Руководство по изучению рыб. Москва: Пищ. пром-сть.
Руководство по изучению питания рыб в естественных условиях. 1961. М.: Изд-во АН СССР.
Семенова В.А. 1969. Ресурсы поверхностных вод СССР: Гидрологическая изученность. Т. 15. Вып. 1. Ч. 1. Л.: Гидрометеоиздат.
Справочник по гидрохимии. 1989. Л.: Гидрометеоиздат.
Шестаков А.В. 2021. Размерно-возрастная структура и рост сиговых рыб (Coregonidae) арктического оз. Иони (Восточная Чукотка) // Биология внутр. вод. № 2. С. 171.https://doi.org/10.31857/S0320965221010125
Agamy E. 2012. Histopathological liver alterations in juvenile rabbit fish (Siganus canaliculatus) exposed to light Arabian crude oil, dispersed oil and dispersant // Ecotoxicol. Environ. Saf. V. 75. P. 171. https://doi.org/10.1016/j.ecoenv.2011.09.010
Antunes A.M., Rocha T. L., Pires F. S. 2017. Gender-specific histopathological response in guppies Poecilia reticulata exposed to glyphosate or its metabolite aminomethylphosphonic acid // J. Appl. Toxicol. V. 37. № 9. P. 1098. https://doi.org/10.1002/jat.3461
Bernet D., Schmidt H., Meier W. 1999. Histopathology in fish: proposal for a protocol to assess aquatic pollution // J. Fish Dis. V. 22. № 1. P. 25. https://doi.org/10.1046/j.1365-2761.1999.00134.x
Bezmaternykh D.M., Vdovina O.N. 2020. Altitudinal zonality and natural zoning as factors of bottom invertebrate communities formation in lakes of Western Siberia and Russian Altai // Limnol. Freshw. Biol. P. 908. https://doi.org/10.31951/2658-3518-2020-A-4-908
Cerqueira C.C.C., Fernandes M.N. 2002. Gill tissue recovery after copper exposure and blood parameter responses in the tropical fish Prochilodus scrofa // Ecotoxicol. Environ. Saf. V. 52. № 2. P. 83.
Costa P.M., Diniz M.S., Caeiro S. et al. 2009. Histological biomarkers in liver and gills of juvenile Solea senegalensis exposed to contaminated estuarine sediments: a weighted indices approach // Aquat. Toxicol. V. 92. №3. P. 202. https://doi.org/10.1006/eesa.2002.2164
Fanta E., Rios F. S.A., Romão S. et al. 2003. Histopathology of the fish Corydoras paleatus contaminated with sublethal levels of organophosphorus in water and food // Ecotoxicol. Environ. Saf. V. 54. № 2. P. 119. https://doi.org/10.1016/S0147-6513(02)00044-1
Fu D., Bridle A., Leef M. et al. 2017. Hepatic expression of metal-related genes and gill histology in sand flathead (Platycephalus bassensis) from a metal contaminated estuary // Mar. Environ. Res. V. 131. P. 80. https://doi.org/10.1016/j.marenvres.2017.09.014
Gashkina N.A., Moiseenko T. I., Shuman L.A. et al. 2022. Biological responses of whitefish (Coregonus lavaretus L.) to reduced toxic impact: Metal accumulation, haematological, immunological, and histopathological alterations // Ecotoxicol. Environ. Saf. V. 239. P. 113659. https://doi.org/10.1016/j.ecoenv.2022.113659
Golubtsov A.S., Berendzen P.B., Annett C.A. 1999. Morpholohical variation and taxonomic status of the Altai osman Oreoleuciscus from the upper reaches of the Ob River system // J. Fish Biol. V. 54. P. 879. https://doi.org/10.1111/j.1095-8649.1999.tb02039.x
Hayden B., Harrod C., Kahilainen K.K. 2013. The effects of winter ice cover on the trophic ecology of whitefish (Coregonus lavaretus L.) in subarctic lakes // Ecol. Freshw. Fish. V. 22. № 2. P. 192. https://doi.org/10.1111/eff.12014
Kahilainen K., Lehtonen H., Könönen K. 2003. Consequence of habitat segregation to growth rate of two sparsely rakered whitefish (Coregonus lavaretus (L.)) forms in a subarctic lake // Ecol. Freshw. Fish. V. 12. № 4. P. 275. https://doi.org/10.1046/j.1600-0633.2003.00029.x
Konz I., Fernández B., Fernández M. L. et al. 2014. Quantitative bioimaging of trace elements in the human lens by LA-ICP-MS // Anal. and Bioanal. Chem. V. 406. № 9. P. 2343. https://doi.org/10.1007/s00216-014-7617-y
Koroleva I.M., Kashulin N.A. 2016. Histopathological cha-racteristics of coregonus fishes under the impact of metal industry // Contemp. Problems Ecol. V. 9. № 2. P. 210. https://doi.org/10.1134/S1995425516020049
Marigomez I., Soto M., Cancio I. et al. 2006. Cell and tissue biomarkers in mussel, and histopathology in hake and anchovy from Bay of Biscay after the Prestige oil spill (Monitoring Campaign 2003) // Mar. Pollution Bulletin. V. 53. № 5–7. P. 287. https://doi.org/10.1016/j.marpolbul.2005.09.026
Marty G.D., Hoffmann A., Okihiro M.S. et al. 2003. Retrospective analysis: bile hydrocarbons and histopathology of demersal rockfish in Prince William Sound, Alaska, after the Exxon Valdez oil spill // Mar. Environ. Res. V. 56. № 5. P. 569. https://doi.org/10.1016/S0141-1136(03)00043-6
Mikaelian I., de Lafontaine Y., Ménard C. et al. 1998. Neoplastic and nonneoplastic hepatic changes in lake whitefish (Coregonus clupeaformis) from the St. Lawrence River, Quebec, Canada // Environ. Health Perspect. V. 106. № 4. P. 179. https://doi.org/10.1289/ehp.98106179
Myers M.S., Johnson L.L., Hom T. et al. 1998. Toxicopathic hepatic lesions in subadult English sole (pleuronectes vetuls) from Puget Sound, Washington, USA: relationships with other biomarkers of contaminant exposure // Mar. Environ. Res. T. 45. № 1. P. 47. https://doi.org/10.1016/S0141-1136(97)00021-4
Phrompanya P., Panase P., Saenphet S. et al. 2021. Histopathology and oxidative stress responses of Nile tilapia Oreochromis niloticus exposed to temperature shocks // Fish. Sci. V. 87. № 4. P. 491. https://doi.org/10.1007/s12562-021-01511-y
Puzanov A.V., Bezmaternykh D.M., Kirillov V.V. et al. 2020. Ecosystem features and environmental problems of lake Teletskoye (Republic of Altai) // Limnol. Freshw. Biol. P. 624. https://doi.org/10.31951/2658-3518-2020-A-4-624
Reis A.B., Sant’Ana D.D. M.G., Azevedo, J.F.D. et al. 2009. The influence of the aquatic environment in tanks sequetially interconnected with PVC pipes on the gill epithelium and lamellas of tilapia (Oreochromis niloticus) // Pesquisa Veterinaria Brasileira. V. 29. P. 303. https://doi.org/10.1590/S0100-736X2009000400005
Sales C.F., Silva R.F., Amaral M.G. et al. 2017. Comparative histology in the liver and spleen of three species of freshwater teleost // Neotropical Ichthyol. V. 15. https://doi.org/10.1590/1982-0224-20160041
Selyukov A.G. 2012. Morphofunctional transformations in fishes of the middle and lower Ob’basin under increasing anthropogenic influence // J. Ichthyol. V. 52. № 8. P. 547. https://doi.org/10.1134/S0032945212040108
Shuman L.A., Selyukov A.G., Nekrasov I.S. et al. 2019. Histopathology and changes of reproductive parameters in peled, Coregonus peled, from the Lower Ob Basin // Russ. J. Ecol. V. 50. № 4. P. 372. https://doi.org/10.1134/S1067413619040143
Simakov I., Nikiforov-Nikishin A., Nikiforov-Nikishin D. et al. 2021. Amphibian and fish eye lens used as biomarker of remote and chronic environmental contamination // Ecologica Montenegrina. V. 45. P. 72. https://doi.org/10.37828/em.2021.45.11
Sutorikhin I.A., Samoylova S.Y., Kolomeitsev A.A. et al. 2020. Hydrometeorological conditions and water regime of the lake Krasilovskoye (Altai krai) in 2013–2017 // Environmental Dynamics and Global Climate Change. V. 11. № 1. P. 49. https://doi.org/10.17816/edgcc34019
Suvarna K.S., Layton C., Bancroft J.D. 2018. Bancroft’s theory and practice of histological techniques E-Book. Amsterdam: Elsevier.
Thoolen B., Maronpot R.R., Harada T. et al. 2010. Proliferative and nonproliferative lesions of the rat and mouse hepatobiliary system // Toxicol. Pathol. V. 38. № 7. Suppl. P. 5S. https://doi.org/10.1177/0192623310386499
Van der Oost R., Beyer J., Vermeulen N.P.E. 2003. Fish bioaccumulation and biomarkers in environmental risk assessment: a review // Environ. Toxicol. Pharmacol. V. 13. № 2. P. 57. https://doi.org/10.1016/S1382-6689(02)00126-6
Wolf J.C., Baumgartner W.A., Blazer V.S. et al. 2015. Nonlesions, misdiagnoses, missed diagnoses, and other interpretive challenges in fish histopathology studies: a guide for investigators, authors, reviewers, and readers // Toxicol. Pathol. V. 43. № 3. P. 297. https://doi.org/10.1177/0192623314540229
Wolf J.C., Wolfe M.J. 2005. A brief overview of nonneoplastic hepatic toxicity in fish // Toxicol. Pathol. V. 33. № 1. P. 75. https://doi.org/10.1080/01926230590890187
Wood C.M., Eom J. 2021. The osmorespiratory compromise in the fish gill // Com. Biochem. Physiol. Part A. V. 254. P. 110895. https://doi.org/10.1016/j.cbpa.2021.110895
Yermolaeva N.I., Fetter G.V. 2020. The modern state of zooplankton in Altai high mountain lakes // Limnol. Freshw. Biol. P. 760. https://doi.org/10.31951/2658-3518-2020-A-4-760
Young M.J., Larwood V., Clause J.K. et al. 2022. Eye lenses reveal ontogenetic trophic and habitat shifts in an imperiled fish, Clear Lake hitch (Lavinia exilicauda chi) // Can. J. Fish and Aquat. Sci. V. 79. № 1. P. 21. https://doi.org/10.1139/cjfas-2020-0318
Дополнительные материалы отсутствуют.
Инструменты
Биология внутренних вод



