Ботанический журнал, 2023, T. 108, № 12, стр. 1100-1118
Развитие женских репродуктивных структур у видов Boechera (brassicaceae) при половом и апомиктичном способах репродукции
Г. Ю. Виноградова 1, *, Н. В. Синельникова 2, **, К. М. Ташкин 3, ***, В. Б. Брюхин 1, ****
1 Ботанический институт им. В.Л. Комарова РАН
197022 Санкт-Петербург, ул. Проф. Попова, 2, Россия
2 Институт биологических проблем Севера Дальневосточного отделения РАН
685000 Магадан, ул. Портовая, 18, Россия
3 Университет Чанаккале Онсекиз Март
17100 Чанаккале, Турция
* E-mail: vinogradova-galina@binran.ru
** E-mail: meks_mag@mail.ru
*** E-mail: kmtaskin@comu.edu.tr
**** E-mail: vbrukhin@gmail.com
Поступила в редакцию 02.11.2023
После доработки 06.11.2023
Принята к публикации 07.11.2023
- EDN: ZFORQW
- DOI: 10.31857/S0006813623120104
Аннотация
Представлены результаты сравнительного эмбриологического исследования двух видов из рода Boechera (B. falcata и B. stricta), для которых характерен половой способ репродукции, и древнего природного гибрида (B. stricta × B. retrofracta) – линии М4В с апомиктичным способом репродукции. Дана детальная характеристика развития семязачатка исследуемых растений, показано значительное сходство этого процесса, а также общий план строения сформированного семязачатка: орто-кампилотропный, битегмальный, медионуцеллятный. Развитие зародышевого мешка у B. falcata и B. stricta соответствует моноспорическому Polygonum-типу; в семязачатках растений линии M4B преимущественно образуется апомиктичный нередуцированный женский гаметофит в результате диплоспории Taraxacum-типа. Небольшая часть семязачатков у этой линии формирует редуцированный зародышевый мешок с участием мейоза, но в отличие от B. falcata и B. stricta после второго мейотического деления формируется триада мегаспор, из которых функциональной является халазальная. В семязачатках апомиктичной линии М4В часто наблюдалось недоразвитие внутреннего интегумента, что скоррелировано с остановкой развития мегаспороцита и зародышевого мешка и их последующей деструкцией. Вероятно, данное нарушение связано с гибридной природой линии, а не с апомиксисом. У апомиктичной линии М4В зародыш формируется партеногенетически, но для его развития необходим эндосперм, который, по-видимому, развивается только после тройного слияния (оплодотворения слившихся полярных ядер спермием). В отсутствии эндосперма происходит гибель зародыша и остановка развития семени.
Род Boechera Á. Löve et D. Löve (сем. Brassicaceae) включает 110 видов, представленных многолетними или двулетними растениями, распространенными преимущественно на территории Северной Америки (Koch et al., 1999, 2003; Kiefer et al., 2009; Osadtchiy et al., 2017). Один из двух видов, произрастающих на территории России – Boechera falcata (Turcz.) (= Arabis turczaninowii Ledeb.), является эндемиком Восточной Сибири и Дальнего Востока; его происхождение, согласно данным по молекулярным маркерам, некоторые авторы связывают с возможной миграцией предковых форм из Северной Америки в Сибирь через Берингов пролив (Al-Shehbaz, 2005; Kiefer et al., 2009; Alexander et al., 2013). Ранее представителей рода Boechera относили к роду Arabis L. на основании близких морфологических признаков; однако кариологические исследования показали различия в числе хромосом, что привело Á. Löve и D. Löve (1976) к разделению рода Arabis (s.l.) на виды Нового Света с х = 7 (выделенные в род Boechera) и виды Старого света с х = 8 (оставшиеся в роде Arabis). Последующие молекулярно-филогенетические исследования показали, что эти два рода относятся к различным кладам на филогенетическом древе семейства Brassicaceae (Koch et al., 2000; Beilstein et al., 2010; Nikolov et al., 2019; Hendriks et al., 2023).
В таксономическом отношении род Boechera очень сложен, так как его представители – преимущественно автогамные межвидовые гибриды (аллодиплоиды), образующие агамные комплексы, для которых характерно как апомиктичное, так и половое воспроизведение (Kantama et al., 2007; Beck et al., 2012; Aliyu et al., 2013; Alexander et al., 2015; Li et al., 2017; Brukhin, 2017; Brukhin et al., 2019). В отличие от апомиктов других покрытосеменных растений, являющихся полиплоидами (Asker, Jerling, 1992), у представителей рода Boechera апомиксис встречается не только у полиплоидных (чаще всего триплоидных 2n = 3x = 21) форм, но и у диплоидных растений (Böcher, 1951; Alexander et al., 2015; Li et al., 2017); реже могут формироваться апомиктичные тетраплоиды (Schranz et al., 2005; Aliyu et al., 2010).
Апомиксис у представителей рода Boechera представлен, главным образом, диплоспорией Taraxacum-типа, при которой происходит нарушение первого деления мейоза и формируется реституционное ядро; второе деление мейоза приводит к образованию диады нередуцированных клеток. Дальнейшее развитие халазальной клетки диады приводит к формированию зародышевого мешка той же плоидности, что и материнское растение (Böcher, 1951; Naumova et al., 2001; Taşkin et al., 2004; Windham et al., 2015; Osadtchiy et al., 2017; Brukhin et al., 2019; Mateo de Arias et al., 2020). У некоторых видов отмечена диплоспория Antennaria-типа, при которой происходит замена мейоза на митоз и в результате после деления мегаспороцита сразу формируется 2-ядерный зародышевый мешок, который также имеет нередуцированное число хромосом, как и материнское растение (Carman et al., 2019). Также наряду с диплоспорией у некоторых представителей Boechera наблюдается апомиксис в форме апоспории: апоспорические инициали и образующиеся из них гаметофиты могут располагаться в нуцеллусе рядом c тетрадами мегаспор или диадами (Carman et al., 2019). Нередуцированные яйцеклетки в апомиктических зародышевых мешках, как правило, формируют зародыш партеногенетически. Эндосперм образуется путем оплодотворения (псевдогамия), хотя в некоторых случаях отмечалось автономное образование эндосперма (Naumova et al., 2001; Voigt et al., 2007).
В природных популяциях, формирующих агамные комплексы и интрогрессивные гибриды, частота апомиксиса может варьировать в зависимости от условий произрастания и роли половых видов в гибридизации (материнское или отцовское растение) (Li et al., 2017; Rushworth et al., 2018; Rushworth, Mitchell-Olds, 2021). Boechera – единственный род в сем. Brassicaceae, где проявление апомиксиса у некоторых видов и линий достигает 98% (Aliyu et al., 2010). Среди других родов Brassicaceae единичные случаи апомиксиса зарегистрированы у небольшого числа видов из родов Erysimum L. (Mulligan, 1966), Parrya R. Br. (Mosquin, Hayley, 1966), Draba L. (Mulligan, Findlay, 1970; Jordon-Thaden et al., 2013), Phoenicaulis Nutt. ex Torr. et A. Gray (Mandáková et al., 2021), Polyctenium Greene и Sandbergia Greene (Mandáková et al., 2020).
Высокая частота встречаемости апомиксиса у представителей рода Boechera, имеющих близкое родственное положение к роду Arabidopsis Heynh., дает возможность изучения апомиксиса с точки зрения молекулярно-генетической регуляции (Schranz et al., 2006; Kantama et al., 2007; Sharbel et al., 2009; 2010; Corral et al., 2013; Mau et al., 2013; Schmidt et al., 2014; Kliver et al., 2018; Bakin et al., 2022). У Boechera идентифицировано несколько генов, ассоциированных с апомиксисом (Corral et al., 2013; Mau et al., 2013; Bakin et al., 2022). Кроме того, отсеквенированы и собраны геномы двух половых видов B. stricta (Li et al., 2017) и B. retro-fracta (Kliver et al., 2018), а также геномы двух природных апомиктических линий, М4В (NCBI Bioproject PRJNA774175) и ES517 (NCBI Bioproject PRJNA765627), при этом геном М4В собран до диплоидного уровня хромосом. Таким образом, последние два вида являются первыми апомиктами с полностью собранным геномом и представляют особый интерес для изучения. Кариологические исследования выявили связь апомиксиса и генов, ассоциированных с ним, с наличием аберрантных гетерохроматиновых хромосом Het, Het’ и Del у некоторых апомиктичных анеуплоидных линий Boechera (Sharbel et al., 2004, 2005; Kantama et al., 2007; Mandáková et al., 2015; 2020; Mau et al., 2022).
Изучение апомиксиса показало, что, несмотря на высокий процент образования апомейотических зародышевых мешков, количество завязавшихся семян у апомиктичных линий было значительно ниже, по сравнению с линиями, для которых характерен половой способ репродукции. Это может быть связано с тем, что у апомиктов мейоз сопровождается аномалиями, приводящими к нарушению развития семян (Mateo de Arias et al., 2020). Кроме того, нарушение развития семян может быть обусловлено гибридной природой многих апомиктов (Rushworth, Mitchell-Olds, 2021), а также развитием эндосперма, зависящим во многом от плоидности полярных ядер и спермиев (Voigt-Zielinski et al., 2012; Mau et al., 2021). Однако, до сих пор причины гибели семязачатков и семян у апомиктичных видов Boechera в процессе их развития остаются слабо изученными.
Настоящее исследование посвящено изучению развития женских репродуктивных структур у трех видов Boechera, для которых характерно половое и апомиктичное воспроизведение, с целью выявления некоторых факторов, обусловливающих появление аномалий в развитии семязачатков.
МАТЕРИАЛ И МЕТОДЫ ИССЛЕДОВАНИЯ
Семена Boechera falcata были собраны с растений возраста 7–10 лет в естественных местах обитания: петрофитное несомкнутое сообщество из Artemisia gmelinii Weber ex Stechm. и B. falcata на склоне южной экспозиции крутизной 45° (Тенькинский район Магаданской области, в 10 км к юго-востоку от села Оротук – 62°01′50.586″ N, 148°38′46.591″ E). Растения B. falcata – травянистые многолетники высотой до 60 см; стебли голые, зеленые с сизоватым оттенком; стеблевые листья продолговатые, цельные или зубчатые, стеблеобъемлющие, длиной до 2 см; нижние листья, собранные в розетку, – плоские, овально-продолговатые, зубчатые, длиной до 3.5 см, густо опушены двураздельными волосками; цветение в конце первой декады июня, цветки в щитковидных кистях; лепестки розово-фиолетовые, длиной до 9 мм; стручки узкие, свисающие вниз, слегка серповидно изогнутые, длиной до 8 см и шириной 2–3 мм.
Семена B. stricta были собраны с растений, произрастающих в горах на северо-западе США, морфология растений описана ранее (Schranz et al., 2007; Li et al., 2017 и др.). Семена природного апомиктичного гибрида B. stricta × B. retrofracta (M4B) были собраны с растений, произрастающих в горах округа Южный Лемхай, штат Айдахо, США (Lemhi County, State of Idaho, USA), 44°36′07″ N, 113°35′ 07″ E, к западу от пика Гунсайт (Gunsight Peak), в долине горной реки Эйттайм-Крик. Семена B. stricta и гибрида M4B были любезно предоставлены профессором Т. Митчеллом-Олдсом (T. Mitchell-Olds) из университета Дьюка (Duke University, Durham, North Carolina, USA).
Семена всех трех видов проращивали согласно методике M.E. Schranz (Schranz et al., 2005; 2006). Сначала семена выдерживали на влажной фильтровальной бумаге в темноте в течение 3 недель с холодной стратификацией (+4°C) для снятия покоя. Затем чашки Петри с семенами переносили в ростовую камеру с температурой +21°С в условия 16-часового светового дня. Проросшие семена переносили в почвенную смесь. Цветение растений происходило через 6 недель после обработки холодом.
Бутоны, цветки и завязи на разных стадиях развития были зафиксированы в FAA (формалин : ледяная уксусная кислота : 70% этиловый спирт в соотношении 7 : 7 : 100) в течение 7 дней, после чего материал был отмыт 70% этиловым спиртом и использовался либо для приготовления постоянных препаратов и их анализа методом световой микроскопии (СМ), либо для исследования тотальных семязачатков с помощью метода просветления и оптики интерференциально-дифференционного контраста (DIC).
Обработка материала и приготовление препаратов проводились по общепринятой цитоэмбриологической методике (Pausheva, 1980). Срезы толщиной 8–10 мкм были сделаны на микротоме Microm HM 325 (Carl Zeiss, Germany). Окраску препаратов проводили гематоксилином по Эрлиху с подкраской алциановым синим. Анализ препаратов проводили с помощью микроскопа Axio Imager Z1 (Carl Zeiss, Germany) ЦКП БИН РАН; фотографии выполнены цифровой камерой Axiocam MRc5 и обработаны ПО Zen Blue Editor (Carl Zeiss, Germany).
Для просветления семязачатков завязи выделяли из бутонов и цветков и помещали их в просветляющую жидкость – 10% раствор хлоралгидрата на ночь (Barykina et al., 2004). Далее для приготовления временных препаратов завязи помещали на предметное стекло в каплю глицерина, выделяли семязачатки и накрывали их покровным стеклом. Выделение завязей и семязачатков проводили под стереомикроскопом Stemi 2000 (Carl Zeiss, Germany). Просветленные семязачатки анализировали с помощью микроскопа AxioPlan 2 (Carl Zeiss, Germany) в режиме DIC (дифференциально-интерференционный контраст).
РЕЗУЛЬТАТЫ
Развитие семязачатка у всех трех исследованных видов происходит в целом единообразно. Различия проявляются в способе репродукции: у Boechera falcata, изученной впервые в нашем исследовании, отмечен только половой способ репродукции, как и у B. stricta, что в целом подтверждает более ранние исследования этого вида (Aliyu et al., 2010: Rojek et al., 2018). Для линии M4B, также ранее не изученной эмбриологически, показано преимущественно апомиктичное развитие женского гаметофита.
Развитие женских репродуктивных структур у Boechera falcata и B. stricta
В завязи длиной около 0.5 мм на плаценте инициируется около 30 примордиев семязачатков. При удлинении завязи до 0.7–1.0 мм в семязачатках начинается инициация интегументов за счет деления клеток эпидермального слоя, причем закладка внутреннего интегумента происходит раньше наружного. В это же время начинается дифференциация археспориальной клетки в апикальной части субэпидермального слоя нуцеллуса. Граница заложения интегументов расположена ниже уровня археспориальной клетки, вследствие того, что изначально примордий представляет собой сильно вытянутый бугорок. Археспориальная клетка в процессе развития трансформируется в мегаспороцит, который быстро увеличивается в размерах. В семязачатке, где интегументы только инициируются, мегаспороцит представлен крупной вытянутой в продольном направлении клеткой, ядро в которой занимает преимущественно центральное положение; цитоплазма плотная, без видимых вакуолей (рис. 1, 1; 2, 1). В единичных случаях у обоих видов формируются два мегаспороцита в одном семязачатке. Также изредка отмечено образование париетальной клетки, расположенной над мегаспороцитом (рис. 1, 2).
Рис. 1.
Развитие семязачатка и женского гаметофита у Boechera falcata. 1–2 – формирование мегаспороцита в семязачатке без париетальной клетки (1) и с париетальной клеткой (2); 3 – образование диады клеток после первого деления мейоза; 4 – тетрада мегаспор, сформированная после мейоза; 5 – тетрада мегаспор в ходе развития семязачатка, рост халазальной функциональной мегаспоры и дегенерация трех микропилярных мегаспор; 6 – функционирование наряду с халазальной микропилярной мегаспоры в тетраде; 7 – образование двуядерных клеток из субмикропилярной и эпихалазальной мегаспор тетрады; 8 – четырехядерный зародышевый мешок (ядра указаны стрелками, на халазальном полюсе второе ядро не показано, так как расположено на следующем срезе); 9 – строение сформированного зародышевого мешка на микропилярном полюсе: две синергиды, яйцеклетка, занимающая латеральное положение, и микропилярное полярное ядро центральной клетки, 9а – халазальный полюс зародышевого мешка с тремя антиподами и халазальным полярным ядром центральной клетки. a – антипода, ch m – халазальная мегаспора, e c – яйцеклетка, i i – внутренний интегумент, m m – микропилярная мегаспора, mc – мегаспороцит, n – нуцеллус, o i – наружный интегумент, p c – париетальная клетка, p n – полярное ядро, pp – постаменто-подиум, s – синергида. Масштабная линейка: 10 мкм.
Fig. 1. Development of the ovule and female gametophyte in Boechera falcata. 1–2 – development of the megasporocyte in the ovule without a parietal cell (1) and with a parietal cell (2); 3 – dyad of cells after the first meiotic division; 4 – tetrad of megaspores after the second meiotic division; 5 – growth of the chalazal functional megaspore and degeneration of three micropylar megaspores of tetrad during development of the ovule; 6 – functioning of micropylar along with the chalazal megaspore in the tetrad; 7 – development of binucleate cells from submicropylar and epichalazal megaspores of the tetrad; 8 – four-nucleate embryo sac (nuclei are indicated by arrows, the second nucleus at the chalazal pole is not shown since it is located in the next section); 9 – structure of the formed embryo sac at the micropylar pole: two synergids, the egg cell occupying a lateral position, and the micropylar polar nucleus of the central cell, 9а – chalazal pole of the embryo sac with three antipodals and the chalazal polar nucleus of the central cell. a – antipodals, ch m – chalazal megaspore, e c – egg cell, i i – inner integument, m m – micropylar megaspore, mc – megasporocyte, n – nucellus, o i – outer integument, p c – parietal cell, p n – polar nucleus, pp – postamento-podium, s – synergid. Scale bar: 10 μm.
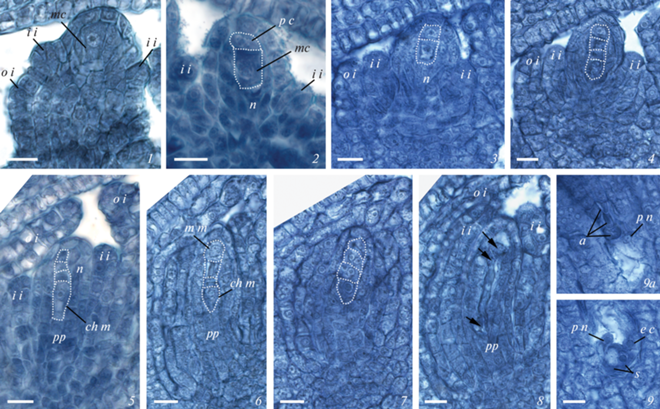
При дальнейшем росте завязи ее плацента продолжает формировать семязачатки: в завязях длиной 1.5–2.0 мм их количество достигает 50. Семязачатки несколько увеличиваются в размере, преимущественно за счет роста их базальной части; начинается небольшой изгиб семязачатка. Интегументы становятся 2-слойными; внутренний и наружный интегументы примерно равны по длине и достигают половины длины нуцеллуса у B. falcata (рис. 1, 3, 4), у B. stricta они остаются короткими (рис. 2, 2, 3). На этой стадии развития семязачатка у обоих видов мегаспороцит приступает к мегаспорогенезу.
Рис. 2.
Развитие семязачатка и женского гаметофита у Boechera stricta. 1–6 – строение семязачатка на стадии мегаспороцита (1); диады клеток, сформированных после первого мейоза (2); тетрады мегаспор (3); дифференциации халазальной мегаспоры (4); двуядерного зародышевого мешка (5), видны дегенерирующие микропилярные клетки тетрады; зрелого зародышевого мешка (6), на микропилярном полюсе которого расположен яйцевой аппарат с двумя синергидами и яйцеклеткой, а также вторичное ядро центральной клетки, на халазальном – три антиподы. 1–5 – DIC, 6 – CM. a – антипода, ch m – халазальная мегаспора, d m – дегенерирующие мегаспоры, e c – яйцеклетка, e s – зародышевый мешок, f – фуникулус, h – гипостаза, i i – внутренний интегумент, mc – мегаспороцит, n – нуцеллус, o i – наружный интегумент, p n – полярное ядро, pp – постаменто-подиум, s – синергида. Масштабная линейка: 10 мкм.
Fig. 2. Development of the ovule and female gametophyte in Boechera stricta. 1–6 – structure of the ovule at the stage of megasporocyte (1); dyad of cells resulted from the first meiotic division (2); tetrad of megaspores (3); differentiation of the chalazal megaspore (4); binucleate embryo sac (5), degenerating micropylar cells of the tetrad are visible; mature embryo sac (6), on the micropilar pole there is an egg apparatus with two synergids and an egg cell, as well as a secondary polar nucleus of the central cell, on the chalazal pole there are three antipodals. 1–5 – DIC, 6 – LM. a – antipodals, ch m – chalazal megaspore, d m – degenerating megaspores, e c – egg cell, e s – embryo sac, f – funiculus, h – hypostase, i i – inner integument, mc – megasporocyte, n – nucellus, o i – outer integument, p n – polar nucleus, pp – postamento-podium, s – synergid. Scale bar: 10 μm.
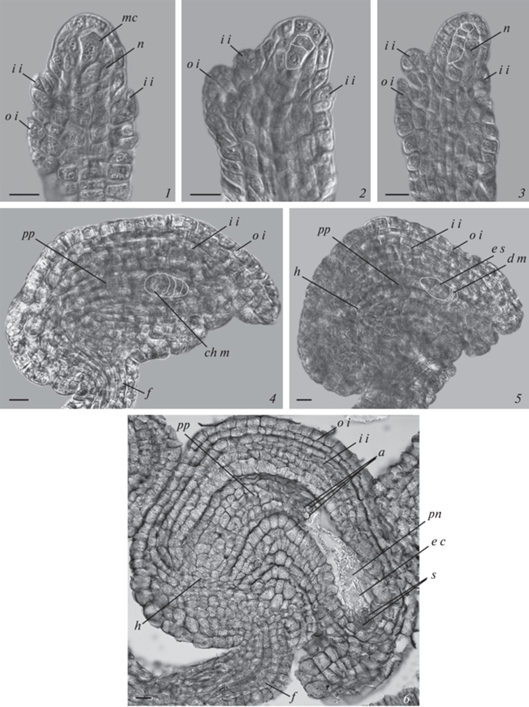
Мегаспорогенез и развитие зародышевого мешка соответствует моноспорическому Polygonum-типу, при котором два последовательных деления мейоза и сопровождающих их процессов цитокинеза приводят к образованию тетрады редуцированных мегаспор (рис. 1, 3, 4; 2, 2, 3).
После завершения мейоза и образования мегаспор (в завязях длиной 2.4–3.5 мм) семязачаток начинает активно расти, изгибается, становится геми-кампилотропным, по типизации И.И. Шамрова (Shamrov, 2008; 2017). По мере роста семязачатка мегаспоры претерпевают изменения – халазальная клетка тетрады увеличивается в размере и становится функциональной мегаспорой, тогда как мегаспоры, расположенные над ней, начинают дегенерировать (рис. 1, 5; 2, 4). У B. falcata часто самая апикальная клетка тетрады долго остается жизнеспособной (рис. 1, 6) и, возможно, может развиваться дальше. В одном случае отмечено образование двух 2-ядерных зародышевых мешков из соседних мегаспор одной тетрады (рис. 1, 7). Однако, как правило, развитие гаметофита происходит из халазальной мегаспоры, в цитоплазме которой появляются вакуоли, в дальнейшем эта клетка претерпевает три митотических деления, которые приводят к формированию ценоцитного зародышевого мешка – после первого деления 2‑ядерного (рис. 2, 5), затем 4-ядерного (рис. 1, 8).
Ко времени формирования 2-ядерного зародышевого мешка в семязачатке значительно увеличивается халаза и базальная часть нуцеллуса, образующая единую структуру постаменто-подиума, клетки латерального слоя нуцеллуса начинают дегенерировать. Внутренний интегумент, как правило, полностью обрастает нуцеллус, при этом становится 2–3-слойным, а в микропилярной части 3–4-слойным. Наружный интегумент остается 2-слойным, но в микропилярной части утолщается до 5–6 слоев. Микропиле сформировано обоими интегументами (экзо-эндостом) (рис. 2, 5).
Третий, последний, митоз в зародышевом мешке сопровождается клеткообразованием. В результате формируется 3 клетки яйцевого аппарата (2 синергиды и яйцеклетка) на микропилярном полюсе; 3 клетки антипод на халазальном полюсе и центральная клетка с двумя полярными ядрами, сначала расположенными у полюсов (рис. 1, 9, 9а). В процессе созревания зародышевого мешка клетки яйцевого аппарата приобретают специфические черты, характерные для синергид и яйцеклетки. Синергиды у изученных видов крупные, с базально расположенным ядром и вакуолью, занимающей апикальное положение; в базальной части также присутствует нитчатый аппарат (рис. 1, 9; 2, 6). Яйцеклетка имеет хорошо выраженную полярность с апикально расположенным ядром и крупной вакуолью в базальной части. Яйцеклетка, как правило, занимает латеральное положение по отношению к синергидам (рис. 1, 9; 2, 6). Полярные ядра в процессе созревания зародышевого мешка сближаются и сливаются вблизи яйцевого аппарата, образуя крупное вторичное ядро центральной клетки (рис. 2, 6). Антиподы у изученных видов мелкие, с плотной цитоплазмой и небольшим ядром, располагаются, как правило, рядом друг с другом (рис. 1, 9а; 2, 6). У B. falcata антиподы могут сохраняться до первых делений в эндосперме, у B. stricta антиподы часто дегенерируют до оплодотворения.
На стадии зрелого зародышевого мешка, готового к оплодотворению (завязи 4.4–6.3 мм в длину), семязачатки еще больше увеличиваются в размерах, становятся еще более изогнутыми (орто-кампилотропными). На этой стадии нуцеллус практически полностью разрушается в микропилярной и латеральных частях, но значительно увеличивается в базальной области, причем в этой зоне его клетки становятся более крупными, вытянутыми и содержат плотную цитоплазму и крупные ядра. Наружный интегумент остается 2-слойным (за исключением его микропилярной области), а внутренний – становится массивным, 5–6-слойным; в клетках его внутренней эпидермы начинается морфологическая дифференциация, связанная с увеличением плотности цитоплазмы этих клеток, а также их растяжением в радиальном направлении, что позволяет предположить приобретение этими клетками функции интегументального тапетума и их активное участие в транспорте веществ. Морфологическая дифференциация этих клеток усиливается на последующих этапах развития семени (в период раннего эмбриогенеза и эндоспермогенеза).
Мы не проводили специальных исследований по процессу оплодотворения. Однако в завязях раскрытых цветков B. falcata во всех семязачатках уже наблюдалось развитие зиготы или 2-клеточного зародыша и присутствовали 2–4 ядра эндосперма, что указывает на нормальное протекание процесса оплодотворения у этого вида. К сожалению, у B. stricta стадий развития зародыша и эндосперма не было обнаружено, по причине малого количества зафиксированного материала в период цветения.
Развитие женских репродуктивных структур у линии М4В
Развитие структур семязачатка у линии М4В происходит таким же образом, как у B. falcata и B. stricta. Отличительной особенностью является преобладание апомиктичного способа репродукции, что связано с образованием диплоспорического нередуцированного зародышевого мешка и партеногенетическим развитием зародыша (что также было показано при анализе семян методом проточной цитометрии – неопубл. данные).
Вступление мегаспороцита в мейоз у этой линии происходит так же рано, как и у B. falcata и B. stricta, когда в семязачатке только начинается развитие интегументов (рис. 3, 1, 2). Нормальное протекание мейоза и образование редуцированных мегаспор в семязачатках линии М4В наблюдалось относительно редко (6.7%) и происходило с образованием триады мегаспор в результате отсутствия второго деления мейоза в микропилярной клетке диады (рис. 3, 3). Нарушение мейоза, проявляющееся в формировании реституционного ядра в первом его делении и образовании диады нередуцированных клеток после второго деления (Taraxacum-тип диплоспории) отмечено более часто (35.6%) (рис. 3, 4). Также следует отметить, что большая часть мегаспороцитов у линии М4В не завершала мейоз (57.7% всех исследованных мегаспороцитов) (рис. 3, 5). Кроме того, в некоторых семязачатках мегаспороцит, а также диады имели признаки деструкции (пикноз ядер, сжатие цитоплазмы, деформация клетки) (рис. 3, 6). Количественное соотношение присутствующих на данной стадии мегаспороцитов, диад и триад показано в таблице 1.
Рис. 3.
Варианты развития зародышевого мешка у апомиктичной линии Boechera–M4B. 1–4 – строение семязачатка на стадии мегаспороцита (1); диады клеток, сформированных после деления мегаспороцита (2); триады мегаспор, сформированных после мейоза (3); диады клеток, сформированных после апомейоза (4); 5 – остановка развития мегаспороцита при продолжающемся росте семязачатка; 6 – дегенерирующие клетки диады в семязачатке; 7 – семязачаток на стадии двуядерного зародышевого мешка; 8 – остановка развития гаметофита на стадии диады при продолжающемся росте семязачатка; 9 – диада клеток в семязачатке с коротким внутренним интегументом; 10 – двуядерный зародышевый мешок с нарушенной полярностью в семязачатке с коротким внутренним интегументом; 11 – дегенерация гаметофита (показан стрелкой) в продолжающем развитие семязачатке. 1–11 – DIC. e s – зародышевый мешок, f – фуникулус, h – гипостаза, i i – внутренний интегумент, mc – мегаспороцит, n – нуцеллус, o i – наружный интегумент, pp – постаменто-подиум. Масштабная линейка: 10 мкм.
Fig. 3. Variants of embryo sac development in the apomictic accession Boechera–M4B. 1–4 – structure of the ovule at the stage of megasporocyte (1); dyad of cells formed after the megasporocyte division (2); triad of megaspores formed after meiosis (3); diplosporous dyad formed after apomeiosis (4); 5 – arrest of megasporocyte development with continuing growth of the ovule; 6 – degenerating cells of the dyad in the ovule; 7 – ovule at the stage of binucleate embryo sac; 8 – arrest of gametophyte development at the dyad stage with continuing growth of the ovule; 9 – dyad of cells in the ovule with a short inner integument; 10 – binucleate embryo sac with disturbed polarity in the ovule with a short inner integument; 11 – degeneration of the gametophyte (indicated by the arrow) in the ovule continuing development. 1–11 – DIC. e s – embryo sac, f – funiculus, h – hypostase, i i – inner integument, mc – megasporocyte, n – nucellus, o i – outer integument, pp – postamento-podium. Scale bar: 10 μm.
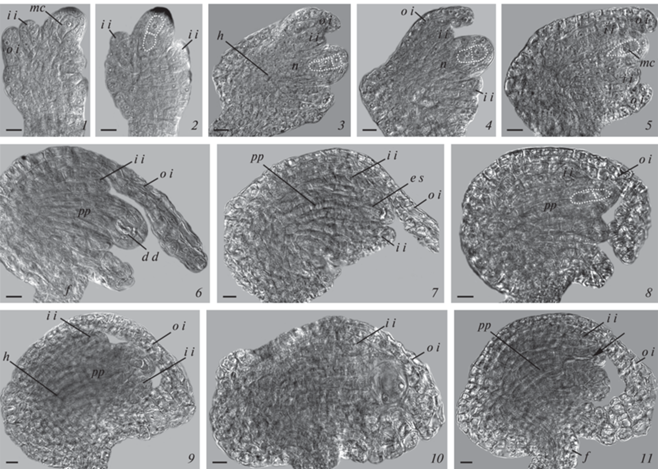
Таблица 1.
Количественное соотношение семязачатков/семян на разных стадиях развития женского гаметофита в процессе роста завязи у апомиктичной линии Boechera – М4В Table 1. Quantitative ratio of ovules/seeds at different stages of female gametophyte development during ovary growth in the apomictic accession Boechera – M4B
| Длина завязи (мм) Ovary length (mm) |
Количество исследованных завязей (шт.) Number of studied ovaries (pcs.) |
Количество исследованных семязачатков (шт.) Number of studied ovules (pcs.) |
Количество семязачатков/семян (шт.) Number of ovules/seeds (pcs.) |
||||||
|---|---|---|---|---|---|---|---|---|---|
| с мегаспороцитом with megasporocyte |
с диадой клеток with dyad of cells |
с триадой мегаспор with triad of megaspores |
с 2- или
4-ядерным зародышевым мешком with bi- or four-nucleate embryo sac |
со зрелым зародышевым мешком with mature embryo sac |
с зародышем и эндоспермом with embryo and endosperm |
с зародышем и без эндосперма with embryo, without endosperm |
|||
| 0.6–1.0 | 3 | 89 | 89 | 0 | 0 | 0 | 0 | 0 | 0 |
| 1.5–2.0 | 5 | 239 | 138 (6*) | 85 (5*) | 16 | 0 | 0 | 0 | 0 |
| 2.4–3.0 | 2 | 78 | 15 (12*) | 22 (2*) | 0 | 41 | 0 | 0 | 0 |
| 3.2–3.5 | 2 | 69 | 19* | 10* | 0 | 7* | 33 | 0 | 0 |
| 4.4–6.3 | 4 | 148 | 25* | 16* | 0 | 23* | 79 | 4 | 1 |
| 8.3–12.0 | 5 | 319 | 51* | 17* | 0 | 47* | 161 | 26 | 16 |
| 20.2–28.6 | 2 | 108 | 0 | 0 | 0 | 0 | 95* | 7 | 6 |
Происхождение зародышевого мешка у М4В (из халазальной клетки триады, сформированной путем нормального мейоза, или халазальной клетки диады, образовавшейся в результате диплоспорического развития) на ценоцитной стадии трудно определить, так как располагающиеся над 2-ядерным зародышевом мешком остатки мегаспор невозможно подсчитать из-за их практической полной деструкции (рис. 3, 7). Однако, учитывая малую долю формирования в семязачатках триад мегаспор после мейоза у этой линии, можно предположить, что большинство развивающихся зародышевых мешков имеют апомиктичную природу.
Следует подчеркнуть, что в нашем материале завязи линии М4В характеризовались высокой степенью остановки развития женского гаметофита на стадиях мегаспороцита, диады или 2‑ядерного зародышевого мешка (табл. 1). Например, в завязи длиной 2.4 мм наблюдалось примерно равное количество 2-ядерных зародышевых мешков (21) и диад (20), оставшиеся семязачатки из 55 исследованных содержали мегаспороциты (14), остановившиеся в развитии, из которых 11 имели явные признаки деструкции. В завязи 3.0 мм из 23 исследованных семязачатков 17 содержали 2‑ядерный зародышевый мешок, 3 – 4‑ядерный зародышевый мешок, 2 – дегенерирующую диаду клеток, 1 – дегенерирующий мегаспороцит. Несмотря на присутствие в семязачатках разных стадий развития гаметофита, внешне семязачатки были одинаковыми и не уступали друг другу в степени развития (рис. 3, 7, 8). Однако, следует отметить, что часть семязачатков с отстающими в развитии мегаспороцитами или диадами отличалась от других более коротким внутренним интегументом, который обрастал нуцеллус не полностью (рис. 3, 9). Возможно, это cвязано с нарушениями в развитии гаметофита (остановкой развития и последующей дегенерацией). В некоторых случаях недоразвитие внутреннего интегумента сопряжено с нарушениями полярности 2-ядерного зародышевого мешка, который разрастался в микропилярной части семязачатка до наружного интегумента (рис. 3, 10). По-видимому, частая остановка развития гаметофита, приводящая к его дегенерации (рис. 3, 11), значительно снижает число жизнеспособных семязачатков на ранних этапах их развития.
Сформированный и зрелый зародышевый мешок у линии М4В имеет такую же структурную организацию, как у B. falcata и B. stricta. В качестве отличительной особенности можно выделить лишь очень раннюю дегенерацию антипод (в зрелом зародышевом мешке наблюдаются лишь остатки этих клеток). Также следует отметить, что в некоторых сформированных семязачатках отмечались зародышевые мешки, расширенные в своей микропилярной части и находящиеся в этой области в контакте с наружным интегументом (нуцеллус к этому времени разрушен) по причине недоразвития внутреннего интегумента. В ходе созревания уже сформированные зародышевые мешки в ряде семязачатков подвергаются деструкции, что снижает общую численность жизнеспособных семязачатков. Так, в завязях из раскрытых цветков из 148 исследованных семязачатков только у 79 наблюдались зрелые зародышевые мешки, в остальных наблюдались дегенерирующие гаметофиты на ценоцитной стадии, диады и мегаспороциты (табл. 1). Кроме того, в 5 семязачатках наблюдался 2-клеточный зародыш и 4–6-ядерный эндосперм; в одном семязачатке – зародыш в отсутствии эндосперма (присутствовало вторичное ядро центральной клетки), что, вероятно, указывает на его партеногенетическое происхождение, поскольку при нормальном развитии семени после оплодотворения эндосперм всегда развивается раньше зародыша (Poddubnaya-Arnoldi, 1976; Shishkinskaya et al., 2004). Эндосперм, вероятно, формировался в результате оплодотворения, так как завязи данной длины были выделены из раскрывшихся цветков, в которых пыльники были частично вскрыты. Происхождение зародыша в семенах с эндоспермом установить сложно, поскольку он может развиваться и партеногенетически (в случае развития диплоспорического зародышевого мешка) или после оплодотворения (в случае формирования редуцированного зародышевого мешка после мейоза). Специальных исследований развития семян не проводилось. В отсутствии эндосперма семена не завершают свое развитие: зародыш дегенерирует и семена прекращают свой рост, внутренние и наружные ткани семени также подвергаются деструкции. Процесс оплодотворения полярных ядер зародышевого мешка и дальнейшее развитие эндосперма, вероятно, в целом, является триггером для развития семени, поскольку семязачатки, в которых зародышевый мешок не переходит к формированию зародыша и эндосперма, прекращают свой рост. Так, в плодах (стручках) длиной 8.3–12.0 мм, наблюдалась большая доля (86.8%) не завязавшихся семян, которые не содержали зародышей (табл. 1).
ОБСУЖДЕНИЕ
Проведенное исследование показало, что в целом развитие семязачатка у видов Boechera происходит сходно с таковым у других изученных видов Brassicaceae (Iljina, 1962; Rodionova, 1966, 1979; Shamrov, 2002a), и сформированный семязачаток имеет однотипное строение, за исключением более массивного по толщине внутреннего интегумента у некоторых родов (Lunaria L., Eruca Mill., Hesperis L. – Belyaeva, Rodionova, 1983). Сформированный семязачаток у исследованных видов орто-кампилотропный, медионуцеллятный, битегмальный (по типизации И.И. Шамрова – Shamrov, 2008; 2017). В более ранних исследованиях семязачатки у видов Brassicaceae (Brassica campestris L. – Ahuia, Bhaduri, 1956; Brassica juncea Czern et Coss. – Sulbha, 1957; Diplotaxis tenuifolia DC. – Belyaeva et al., 1978; Berteroa incana (L.) DC. – Belyaeva, Fursa, 1979) относили к тенуинуцеллятному типу. Однако, И.И. Шамров (Shamrov, 2002a, b) на примере Capsella bursa-pastoris показал, что семязачаток у представителей Brassicaceae относится к медионуцеллятному типу, так как у него присутствует более одного слоя клеток в латеральной части нуцеллуса и развивается относительно массивная базальная часть (как у крассинуцеллятных семязачатков), преобразующаяся в постаменто-подиум; для тенуинуцеллятных семязачатков, как правило, характерно наличие однослойного нуцеллуса, окружающего зародышевый мешок (Shamrov, 2008).
Некоторые авторы указывают на наличие тенденции к крассинуцеллятному типу семязачатка в трибе Boechereae (Mandáková et al., 2020), так как у растений этой трибы на ранних стадиях развития семязачатка (во время дифференциации мегаспороцита) иногда образуется париетальная клетка. Авторы подчеркивают, что париетальная клетка формируется не во всех семязачатках и частота ее появления может варьировать. Например, у видов Phoenicaulis париетальная клетка была отмечена у 70% семязачатков (Mandáková et al., 2021), а у видов Boechera эта клетка встречается у менее, чем 50% семязачатков (Naumova et al., 2001; Carman et al., 2019). У исследованных нами видов Boechera также иногда происходило образование париетальной клетки (менее, чем у 5% исследованных семязачатков).
Появление париетальной клетки в отдельных семязачатках завязи характерно и для других родов Brassicaceae – Lunaria, Eruca, Hesperis, Macro-podium R. Br. (Rodionova, 1966a, b, 1971a, c, 1976), Alliaria Kuntze (Belyaeva, Fursa, 1982), Brassica L. (Sulbha, 1957, Iljina, 1962), причем авторы также подтверждают непостоянство ее образования. Г.Б. Родионова (Rodionova, 1966a, 1971a, 1978) предполагала, что наличие париетальной клетки связано с выборочностью дифференциации спорогенной клетки (мегаспороцита) в нуцеллусе на самых ранних стадиях ее развития, то есть деление субэпидермальной клетки в некоторых случаях приводило к образованию париетальной клетки и расположенной под ней спорогенной, либо, наоборот, после деления расположенная под эпидермой клетка становилась спорогенной, а ниже лежащая становилась клеткой нуцеллуса; в последнем варианте париетальная клетка, как таковая, не формировалась. Такое предположение было сделано на основании данных по развитию семязачатка у Hesperis steveniana DC, у которого в некоторых случаях развивались два мегаспороцита, лежащие не рядом друг с другом (как у других представителей Brassicaceae), а один над другим.
Сложно сказать, насколько верно данное предположение. Возможно, за париетальную клетку можно принять микропилярную клетку диады, сформированную после первого асимметричного деления мейоза. Как показывают наши данные по развитию семязачатка, у Boechera мегаспорогенез начинается очень рано, когда интегументы только начинают формироваться и еще не доходят до середины нуцеллуса. Первое деление мейоза, как известно, проходит очень быстро, и, как было показано нами у Boechera falcata, структура семязачатка практически не меняется со времени присутствия в нем мегаспороцита до образования тетрады мегаспор. Клетки нуцеллуса на этой стадии довольно крупные, в результате чего высока вероятность спутать клетки диады (клетки, расположенные одна под другой) с мегаспороцитом и находящейся над ним париетальной клеткой. Идентификация с помощью окраски на каллозу, окружающую мегаспороцит и продукты мейоза, возможно, будет не совсем точна, так как слой каллозы часто имеет прерывистую структуру и ее отложение может варьировать у разных мегаспороцитов, что было показано у Boechera stricta (Rojek et al., 2018). Поэтому, однозначный ответ на вопрос о присутствии париетальной клетки над мегаспороцитом у видов Boechera и других Brassicaceae может дать только применение маркеров, точно идентифицирующих спорогенные клетки, которых в настоящее время еще очень мало (Tucker et al., 2012; Lora et al., 2017) и, возможно, они не будут универсальными для всех видов.
Образование двух мегаспороцитов отмечалось, как в нашем материале, так и у других видов Boechera (Carman et al., 2019). По-видимому, это свойственно большинству представителей семейства Brassicaceae, так как формирование 2–3 спорогенных клеток отмечено для ряда видов Brassica (Iljina, 1962) и Hesperis (Rodionova, 1966), а для некоторых родов (Cardamine L., Sysimbrium Pall., Erysimum L.) описан многоклеточный археспорий (Vandendries, 1909, 1912; Rodionova, 1971b). В редких случаях отмечалось формирование двух зародышевых мешков, например, у ряда видов Arabis (Czapik, 1974), происхождение которых осталось неустановленным. По предположению автора, они могут быть производными дополнительных мегаспороцитов или результатом развития нескольких мегаспор. У Boechera развитие нескольких мегаспор тоже возможно, у B. falcata нами было отмечено длительное сохранение одной из микропилярных мегаспор, а также наличие 2-ядерных клеток в тетраде мегаспор. Двух зрелых зародышевых мешков мы не наблюдали в нашем исследовании, но нельзя исключать возможность их развития.
Зародышевый мешок у исследованных видов Boechera развивается, как и у других исследованных видов Brassicaceae согласно моноспорическому Polygonum‑типу. Зрелый зародышевый мешок 7-клеточный, 7-ядерный, типичного строения для многих Brassicaceae. Однако следует обратить внимание на некоторые различия в поведении антипод у исследованных нами видов: тогда как у B. stricta и B. falcata антиподы сохраняются относительно долго (у B. falcata они еще присутствуют на стадии 2–4-ядерного эндосперма), у апомиктичной линии М4В антиподы разрушаются еще до стадии зрелого зародышевого мешка. Возможно, это связано с гибридной природой этой линии или диплоспорическим развитием большинства развивающихся зародышевых мешков.
Для нормального формирования зародышевого мешка очень важна скоррелированность процессов его развития с окружающими тканями спорофита (Gerassimova-Navashina, 1958; Batygina, 2002). Об этом свидетельствуют полученные данные по развитию женских репродуктивных структур у Boechera. Наиболее выраженные корреляции можно наблюдать на следующих стадиях:
1) Стадия мегаспорогенеза, заканчивающаяся образованием тетрады (триады), проходит очень быстро и соответствует, как правило, незначительному росту семязачатка (базальная часть еще не изгибается, интегументы не достигают середины нуцеллуса). Наличие у апомиктичной линии на этой стадии диады клеток не всегда означает, что она сформирована без редукционного деления.
2) Стадия тетрады является достаточно продолжительной и сопровождается значительными структурными преобразованиями в семязачатке, связанными с ростом нуцеллуса и интегументов. Только на этой стадии, когда интегументы полностью обрастают нуцеллус, можно определить, какой зародышевый мешок будет развиваться – диплоспорический (если на этой стадии присутствует диада клеток) или половой (если формируется тетрада/триада мегаспор).
Очень важной особенностью развития семязачатка является сопряженное развитие интегументов и гаметофита. Нарушения в развитии внутреннего интегумента, выявленные у апомиктичной линии М4В, по-видимому, приводят к остановке развития мегаспороцита, так как в семязачатке с коротким интегументом чаще наблюдалась дегенерация мегаспороцита, хотя остальные ткани семязачатка (нуцеллус и наружный интегумент) продолжали расти, и в целом не отличались по размерам от других семязачатков завязи. В некоторых семязачатках с коротким внутренним интегументом развитие гаметофита может продолжаться, в таких семязачатках наблюдались диады клеток (часто тоже с признаками дегенерации), или 2-ядерные зародышевые мешки с нарушением размеров и полярности ядер, или даже зрелые зародышевые мешки с разросшейся микропилярной частью и клетками яйцевого аппарата аномальной формы и топографии. О скоррелированности этих процессов и важности развития внутреннего интегумента для развития женского гаметофита свидетельствуют и данные по мутантам Arabidopsis thaliana (L.) Heynh. bel, ino, ant, sin1, которые показали, что гены, участвующие в регуляции развития интегументов, оказывают влияние на развитие мегаспороцита, который у данных мутантов не способен развиваться и вступать в мегаспорогенез (Ray et al., 1996; Sieber et al., 2004; Wang et al., 2008). Следует подчеркнуть, что среди исследованных нами видов Boechera такие нарушения были отмечены только у апомиктичной гибридной линии М4В, что, вероятно, может указывать на сопряженность апомиксиса (отсутствия мейоза) и процессов формирования семязачатка, в частности, развития внутреннего интегумента.
Диплоспорическое развитие зародышевого мешка (апомиксис) среди исследуемых нами видов было отмечено только у линии М4В с частотой 35.6%), у видов B. falcata и B. stricta нарушений в мейозе и развитии зародышевого мешка не отмечалось. Хотя некоторые авторы полагают, что даже у половых видов (например, B. stricta) в редких случаях могут проявляться признаки апомиксиса: диплоспория и партеногенез (Aliyu et al., 2010; Rojek et al., 2018).
Хотя у линии М4В преобладает гаметофитный апомиксис в форме диплоспории, половой способ репродукции также присутствует (в некоторых семязачатках происходит редукционное деление), что свидетельствует о неполной пенетрантности апомиксиса в этой линии. Кроме того, была отмечена частая остановка развития гаметофита, что, возможно, связано не с апомиктичным способом репродукции, а с гибридной природой этой линии. Также для этой линии характерна низкая завязываемость семян, что связано не только с большим процентом дегенерации гаметофита в ходе развития (особенно на ранних стадиях), но, по-видимому, и с отсутствием эндосперма, для развития которого необходимо оплодотворение полярных ядер (псевдогамия). Хотя некоторые исследователи отмечали возможность автономного развития эндосперма у апомиктичных линий Boechera (Naumova et al., 2001; Voigt et al., 2007; Aliyu et al., 2010), у линии М4В такого не наблюдалось. Однако, для однозначного ответа о независимом от оплодотворения развитии эндосперма необходимо специальное исследование, направленное на изучение процессов развития семени при наличии и отсутствии опыления/оплодотворения.
ЗАКЛЮЧЕНИЕ
Таким образом, исследование показало, что низкая завязываемость семян у апомиктичной линии М4В может быть связана с рядом факторов, действующих при развитии семязачатка и семени. Наиболее важные из них следующие: 1) неспособность некоторых мегаспороцитов вступать или завершать мейоз (что, вероятно, коррелирует с нарушениями в развитии внутреннего интегумента); 2) неспособность некоторых апомиктичных диад мегаспор продолжать развитие; 3) нарушение полярной миграции ядер в ценоцитном гаметофите и закономерностей их делений; 4) отсутствие тройного слияния и образования эндосперма в семенах.
Список литературы
Ahuja Y.R., Bhaduri P.N. 1956. The embryology of Brassica campestris var. toria. – Phytomorphology. 6: 63–67.
Alexander P.J., Windham M.D., Beck J.B., Al-Shehbaz I.A., Allphin L., Bailey C.D. 2013. Molecular phylogenetics and taxonomy of the genus Boechera and related genera (Brassicaceae: Boechereae). – Syst. Bot. 38 (1): 192–209. https://doi.org/10.1600/036364413x661917
Alexander P.J., Windham M.D., Beck J.B., Al-Shehbaz I.A., Allphin L., Bailey C.D. 2015. Weaving a tangled web: divergent and reticulate speciation in Boechera fendleri sensu lato (Brassicaceae; Boechereae). – Syst. Bot. 40 (2): 572–596. https://doi.org/10.1600/036364415x688745
Aliyu O.M., Schranz E., Sharbel T.F. 2010. Quantitative variation for apomixis components in the genus Boechera. – Am. J. Bot. 97 (10): 1719–1731. https://doi.org/10.3732/ajb.1000188
Aliyu O.M., Seifert M., Corral J.M., Fuchs J., Sharbel T.F. 2013. Copy number variation in transcriptionally active regions of sexual and apomictic Boechera demonstrates independently derived apomictic lineages. – The Plant Cell. 25 (10): 3808–3823. https://doi.org/10.1105/tpc.113.113860
Al-Shehbaz I.A. 2005. Nomenclatural notes on Eurasian Arabis (Brassicaceae). – Novon. 15 (4): 519–524.
Asker S.E., Jerling L. 1992. Apomixis in Plants. Boca Raton, FL. 320 p.
Bakin E., Sezer F., Özbilen A., Kilic I., Uner B., Rayko M., Taşkin K.M., Brukhin V. 2022. Phylogenetic and expression analysis of CENH3 and APOLLO genes in sexual and apomictic Boechera species. – Plants (Basel). 11 (3): article 387 (P. 1–17). https://doi.org/10.3390/plants11030387
[Barykina et al.] Барыкина Р.П., Веселова Т.Д., Девятов А.Г., Джалилова Х.Х., Ильина Г.М., Чубатова Н.В. 2004. Справочник по ботанической микротехнике. Основы и методы. М. 312 с.
Batygina T.B. 2002. Ovule and seed viewed from reliability of biological systems. – In: Embryology of flowering plants. Terminology and concepts. Vol. 1. Generative organs of flower. Enfield (NH, USA). P. 214–217.
Beck J.B., Alexander P.J., Allphin L., Al-Shehbaz I.A., Rushworth C., Bailey C.D. et al. 2012. Does hybridization drive the transition to asexuality in diploid Boechera (Brassicaceae)? – Evolution. 66 (4): 985–995. https://doi.org/10.1111/j.1558- 5646.2011.01507.x
Beilstein M.A., Nagalingum N.S., Clements M.D., Manchester S.R., Mathews S. 2010. Dated molecular phylogenies indicate a Miocene origin for Arabidopsis thaliana. – Proc. Natl. Acad. Sci. U.S.A. 107 (43): 18724–18728. https://doi.org/10.1073/pnas.0909766107
[Belyaeva et al.] Беляева Л.Ю., Чайка К.А., Фурса М.С. 1978. Розвиток пiляка, насiнного зачатка i гаметогенез Diplotaxis tenuifolia DC. – Укр. бот. журн. 35 (2): 175–179.
[Belyaeva, Fursa] Беляева Л.E., Фурса Н.С. 1982. Эмбриология Alliaria officinalis (Brassicaceae). I. Формирование мужских и женских структур цветка и изучение состава их флавоноидов. – Бот. журн. 67 (7): 959–968.
[Belyaeva, Fursa] Беляева Л.Ю., Фурса М.С. 1979. Формування чоловичих i жiночих структур квiтки Berteroa incana (L.) DC. – Укр. бот. журн. 36 (6): 574–577.
[Belyaeva, Rodionova] Беляева Л.Е., Родионова Г.Б. 1983. Семейство Brassicaceae. – В кн.: Сравнительная эмбриология цветковых растений. Phytolaccaceae – Thymelaeaceae. Л. С. 154–164.
Böcher T.W. 1951. Cytological and embryological studies in the amphiapomictic Arabis holboellii complex. – Det Kongelige Danske Videnskabernes Selskab. Biol. Skrif. 6: 1–59.
Brukhin V. 2017. Molecular and genetic regulation of apomixis. – Russian Journal of Genetics. 53 (9): 943–964. https://doi.org/10.1134/S1022795417090046
Brukhin V., Osadtchiy J.V., Florez-Rueda A.M., Sme-tanin D., Bakin E., Nobre M.S. et al. 2019. The Boechera genus as a resource for apomixis research. – Front. Plant Sci.10: article 392 (P. 1–19). https://doi.org/10.3389/fpls.2019.00392
Carman J.G., Mateo de Arias M., Gao L., Zhao X., Kowallis B., Sherwood D.A., et al. 2019. Apospory in addition to diplospory is common in Boechera where it may facilitate speciation by recombination-driven apomixis-to-sex reversals. – Front. Plant Sci. 10: article 724 (P. 1–14). https://doi.org/10.3389/fpls.2019.00724
Corral J.M., Vogel H., Aliyu O.M., Hensel G., Thiel T., Kumlehn J., et al. 2013. A conserved apomixis-specific polymorphism is correlated with exclusive exonuclease expression in premeiotic ovules of apomictic Boechera species. – Plant Physiol. 163 (4): 1660–1672. https://doi.org/10.1104/pp.113.222430
Czapik R. 1974. Embryology of five species of the Arabis hirsuta complex. – Acta Biol. Cracov. Ser. Bot. 17: 13–25.
[Gerassimova-Navashina] Герасимова-Навашина Е.Н. 1958. О гаметофите и об основных чертах развития и функционирования воспроизводящих элементов у покрытосеменных растений. – Проблемы ботаники. 3: 125–167.
Hendriks K.P., Kiefer C., Al-Shehbaz I.A., Bailey C.D., van Huysduynen A.H., Nikolov L.A. et al. 2023. Global Brassicaceae phylogeny based on filtering of 1,000-gene dataset. – Current Biology. 33 (19): 4052–4068. https://doi.org/10.1016/j.cub.2023.08.026
[Iljina] Ильина Г.М. 1962. Эмбриологическое исследование горчицы Brassica juncea (L.) Czern. – Вестник Моск. ун-та. 1: 34–45.
Jordon-Thaden I.E., Al-Shehbaz I.A., Koch M.A. 2013. Species richness of the globally distributed, arctic–alpine genus Draba L. (Brassicaceae). – Alpine Bot. 123: 97–106. https://doi.org/10.1007/s00035-013-0120-9
Kantama L., Sharbel T.F., Schranz M.E., Mitchell-Olds T., de Vries S., de Jong H. 2007. Diploid apomicts of the Boechera holboellii complex display large-scale chromosome substitutions and aberrant chromosomes. – Proc. Natl. Acad. Sci. U.S.A. 104 (35): 14026–14031. https://doi.org/10.1073/pnas.0706647104
Kiefer C., Dobeš C., Koch M.A. 2009. Boechera or not? Phylogeny and phylogeography of eastern North American Boechera species (Brassicaceae). – Taxon. 58 (4): 1109–1121. https://doi.org/10.1002/tax.584005
Kliver S., Rayko M., Komissarov A., Bakin E., Zhernakova D., Prasad K. et al. 2018. Assembly of the Boechera retrofracta genome and evolutionary analysis of apomixis-associated genes. – Genes (Basel). 9 (4): article 185 (P. 1–16). https://doi.org/10.3390/genes9040185
Koch M.A., Bishop J., Mitchell-Olds T. 1999. Molecular systematic and evolution of Arabidopsis and Arabis. – Plant Biol. 1 (5): 529–537. https://doi.org/10.1111/j.1438-8677.1999.tb00779.x
Koch M.A., Haubold B., Mitchell-Olds T. 2000. Comparative evolutionary analysis of chalcone synthase and alcohol dehydrogenase loci in Arabidopsis, Arabis, and related genera (Brassicaceae). – Mol. Biol. Evol. 17 (10): 1483–1498. https://doi.org/10.1093/oxfordjournals.molbev.a026248
Koch M.A., Dobeš C., Mitchell-Olds T. 2003. Multiple hybrid formation in natural populations: Concerted evolution of the internal transcribed spacer of nuclear ribosomal DNA (ITS) in North American Arabis divaricarpa (Brassicaceae). – Mol. Biol. Evol. 20 (3): 338–350. https://doi.org/10.1093/molbev/msg046
Li F.W., Rushworth C.A., Beck J.B., Windham M.D. 2017. Boechera microsatellite website: an online portal for species identification and determination of hybrid parentage. – Database. 2017: baw169. https://doi.org/10.1093/database/baw169
Lora J., Herrero M., Tucker M.R., Hormaza J.I. 2017. The transition from somatic to germline identity shows conserved and specialized features during angiosperm evolution. – New Phytol. 216 (2): 495–509. https://doi.org/10.1111/nph.14330
Löve A., Löve D. 1976. Nomenclatural notes on arctic plants. ‑ Bot. Not. 128: 497–523.
Mandáková T., Schranz M.E., Sharbel T.F., de Jong H., Lysak M.A. 2015. Karyotype evolution in apomictic Boechera and the origin of the aberrant chromosomes. – Plant J. 82 (5): 785–793. https://doi.org/10.1111/tpj.12849
Mandáková T., Hloušková P., Windham M.D., Mitchell-Olds T., Ashby K., Price B., Carman J., Lysak M. 2020. Chromosomal evolution and apomixis in the cruciferous tribe Boechereae. – Front. Plant Sci. 11: article 514 (P. 1–17). https://doi.org/10.3389/fpls.2020.00514
Mandáková T., Ashby K., Price B.J., Windham M.D., Carman J.G., Lysak M.A. 2021. Genome structure and apomixis in Phoenicaulis (Brassicaceae; Boechereae). – J. Syst. Evol. 59 (1): 83–92. https://doi.org/10.1111/jse.12555
Mateo de Arias M., Gao L., Sherwood D.A., Dwivedi K.K., Price B.J. Jamison M. et al. 2020. Whether gametophytes are reduced or unreduced in angiosperms might be determined metabolically genes. – Genes. 11: article 1449 (P. 1–38). https://doi.org/10.3390/genes11121449
Mau M., Corral J.M., Vogel H., Melzer M., Fuchs J., Kuhlmann, M., et al. 2013. The conserved chimeric transcript UPGRADE2 is associated with unreduced pollen formation and is exclusively found in apomictic Boechera species. – Plant Physiol. 163 (4): 1640–1659. https://doi.org/10.1104/pp.113.222448
Mau M., Liiving T., Fomenko L., Goertzen R., Pac-zesniak D., Böttner L. et al. 2021. The spread of infectious asexuality through haploid pollen. – New Phytol. 230 (2): 804–820. https://doi.org/10.1111/nph.17174
Mau M., Mandáková T.M., Ma X., Ebersbach J., Zou L., Lysak M.A., Sharbel T.F. 2022. Evolution of an apomixis-specific allele class in supernumerary chromatin of apomictic Boechera. – Front. Plant. Sci. 13: article 890038 (P. 1–17). https://doi.org/10.3389/fpls.2022.890038
Mosquin T., Hayley D.E. 1966. Chromosome numbers and taxonomy of some Canadian arctic plants. – Can. J. Bot. 44 (9): 1209–1218. https://doi.org/10.1139/b66-132
Mulligan G.A. 1966. Chromosome numbers of the family Crucifereae III. – Can. J. Bot. 44(3): 309–319. https://doi.org/10.1139/b66-037
Mulligan G.A., Findlay J.N. 1970. Sexual reproduction and agamospermy in the genus Draba. – Can. J. Bot. 48 (2): 269–271. https://doi.org/10.1139/b70-040
Naumova T.N., van der Laak J., Osadtchiy J., Matzk F., Kravtchenko A., Bergervoet J., et al. 2001. Reproductive development in apomictic populations of Arabis holboellii (Brassicaceae). – Sex. Plant Reprod. 14 (4): 195–200. https://doi.org/10.1007/s00497-001-0118-0
Nikolov L.A., Shushkov P., Nevado B., Ga X., Al-Shehbaz I.A., Filatov D., et al. 2019. Resolving the backbone of the Brassicaceae phylogeny for investigating trait diversity. – New Phytol. 222 (3): 1638–1651. https://doi.org/10.1111/nph.15732
[Osadtchiy] Осадчий Я.В., Наумова Т.Н., Брюхин В.Б. 2017. Апомиксис в роде Boechera (Brassicaceae): текущее состояние проблемы. – Бот. журн. 102 (12): 1587–1607.
[Pausheva] Паушева З.П. 1980. Практикум по цитологии растений. М. 255 с.
[Poddubnaya-Arnoldi] Поддубная-Арнольди В.А. 1976. Цитоэмбриология покрытосеменных растений. Основы и перспективы. М. 508 с.
Ray A., Lang J.D., Golden T., Ray S. 1996. SHORT INTEGUMENT (SIN1), a gene required for ovule development in Arabidopsis, also controls flowering time. – Development. 122 (9): 2631–2638. https://doi.org/10.1242/dev.122.9.2631
[Rodionova] Родионова Г.Б. 1966а. Мегаспорогенез у Hesperis steveniana DC. – Вестник Моск. ун-та. 5: 68–72.
[Rodionova] Родионова Г.Б. 1966b. Эмбриологическое исследование Eruca sativa Lam. – Вестник Моск. ун-та. 1: 61–68.
[Rodionova] Родионова Г.Б. 1971а. Эмбриологическое исследование Hesperis steveniana DC. – В кн.: Морфология цветковых растений. М. С. 34–54.
[Rodionova] Родионова Г.Б. 1971b. Эмбриологическое развитие Erysimum pannonicum Crantz. – Вестник Моск. ун-та. 5: 52–57.
[Rodionova] Родионова Г.Б. 1971c. Эмбриология Lunaria annua L. – Вестник Моск. ун-та. 4: 59–63.
[Rodionova] Родионова Г.Б. 1976. Эмбриологическое развитие Macropodium (Pall.) R. Br. из семейства крестоцветных. – В кн.: Рост растений и пути его регулирования. М. С. 126–139.
[Rodionova] Родионова Г.Б. 1978. О развитии кроющих клеток в семействе крестоцветных. – В кн.: Тезисы докладов VI Делегатского съезда ВБО. Л. С. 110.
[Rodionova] Родионова Г.Б. 1979. Развитие женских эмбриональных структур, эндосперма и зародыша у свербиги восточной. – Бюл. Гл. бот. сада. 113: 90–96.
Rojek J., Kapusta M., Kozieradzka-Kiszkurno M., Majcher D., Gorniak M., Sliwinska E., et al. 2018. Establishing the cell biology of apomictic reproduction in diploid Boechera stricta (Brassicaceae). – Ann. Bot. 122 (4): 513–539. https://doi.org/10.1093/aob/mcy114
Rushworth C.A., Windham M.D., Keith R.A., Mitchell-Olds T. 2018. Ecological differentiation facilitates fine-scale coexistence of sexual and asexual Boechera. – Am. J. Bot. 105 (12): 2051–2064. https://doi.org/10.1002/ajb2.1201
Rushworth C.A., Mitchell-Olds T. 2021. The evolution of sex is tempered by costly hybridization in Boechera (rock cress) – J. Heredity. 112 (1): 67–77. https://doi.org/10.1093/jhered/esaa041
Schmidt A., Schmid M.W., Klostermeier U.C., Qi W., Guthörl D., Sailer C. et al. 2014. Apomictic and sexual germline development differ with respect to cell cycle, transcriptional, hormonal and epigenetic regulation. – PLoS Genet. 10 (7): article e1004476 (P. 1–21). https://doi.org/10.1371/journal.pgen.1004476
Schranz M.E., Dobes C., Koch M.A., Mitchell-Olds T. 2005. Sexual reproduction, hybridization, apomixis, and polyploidization in the genus Boechera (Brassicaceae). – Am. J. Bot. 92 (11): 1797–1810. https://doi.org/10.3732/ajb.92.11.1797
Schranz M.E., Kantama L., De Jong H., Mitchell-Olds T. 2006. Asexual reproduction in a close relative of Arabidopsis: a genetic investigation of apornixis in Boechera (Brassicaceae). – New Phytol. 171 (2): 425–438. https://doi.org/10.1111/j.1469-8137.2006.01765.x
Schranz M.E., Windsor A.J., Song B.H., Lawton-Rauh A., Mitchell-Olds T. 2007. Comparative genetic mapping in Boechera stricta, a close relative of Arabidopsis. – Plant Physiol. 144 (1): 286–298. https://doi.org/10.1104/pp.107.096685
[Shamrov] Шамров И.И. 2002а. Морфогенез семязачатка и семени у Capsella bursa-pastoris (Brassicaceae) в связи с особым способом формирования эндотелия. – Бот. журн. 87(2): 1–18.
Shamrov I.I. 2002b. Ovule and seed study in Capsella bursa-pastoris (Brassicaceae) with a peculiar endothelium formation pattern. – Acta Biol. Cracov. Ser. Bot. 44: 79–90.
[Shamrov] Шамров И.И. 2008. Семязачаток цветковых растений: структура, функции, происхождение. М. 350 с
[Shamrov] Шамров И. И. 2017. Морфологические типы семязачатков цветковых растений. – Бот. журн. 102 (2): 129–146.
Sharbel T.F., Voigt M.L., Mitchell-Olds T., Kantama L., De Jong H. 2004. Is the aneuploid chromosome in an apomictic Boechera holboellii a genuine B chromosome? – Cytogenet. Genome Res. 106 (2–4): 173–183. https://doi.org/10.1159/000079284
Sharbel T.F., Mitchell-Olds T.M., Dobes C., Kantama L., de Jong H. 2005. Biogeographic distribution of polyploidy and B chromosomes in the apomictic Boechera holboellii complex. – Cytogenet. Genome Res. 109 (1–3): 283–292. https://doi.org/10.1159/000082411
Sharbel T.F., Voigt M.L., Corral J.M., Thiel T., Varshney A., Kumlehn J. et al. 2009. Molecular signatures of apomictic and sexual ovules in the Boechera holboellii complex. – Plant J. 58 (5): 870–882. https://doi.org/10.1111/j.1365-313X.2009.03826.x
Sharbel T.F., Voigt M.L., Corral J.M., Galla G., Kumlehn J., Klukas C. et al. 2010. Apomictic and sexual ovules of Boechera display heterochronic global gene expression patterns. – Cell. 22 (3): 655–671. https://doi.org/10.1105/tpc.109.072223
[Shishkinskaya et al.] Шишкинская Н.А., Юдакова О.И., Тырнов В.С. 2004. Популяционная эмбриология и апомиксис у злаков. Саратов. 145 с.
Sieber P., Gheyselinck J., Gross-Hardtl R., Laux T., Grossniklaus U., Schneitz K. 2004. Pattern formation during early ovule development in Arabidopsis thaliana. – Dev. Biol. 273 (2): 321–334. https://doi.org/10.1016/j.ydbio.2004.05.037
Sulbha K. 1957. Embryology of Brassica juncea Czern & Coss. – J. Indian Bot. Soc. 36 (3): 292–301.
Tucker M.R., Okada T., Hu Y., Scholefield A., Taylor J.M., Koltunow A.M. 2012. Somatic small RNA pathways promote the mitotic events of megagametogenesis during female reproductive development in Arabidopsis. – Development. 139 (8): 1399–1404. https://doi.org/10.1242/dev.075390
Taşkin K.M., Turgut K., Scott R.J. 2004. Apomictic deve-lopment in Arabis gunnisoniana. – Israel J. Plant Sci. 52 (2): 155–160. https://doi.org/10.1560/L3DE-FMVY-1XCQ-QRY5
Vandendries R. 1909.Contribution à l’étude du développement de l’ovule dans les Crucifèrs. – Cellule. 25: 412–459.
Vandendries R. 1912. Contribution à l’étude du développement de l’ovule dans les Crucifèrs. 2. L’archesporium dans le genre Cardamine. – Cellule. 28: 215–225.
Voigt M.L., Melzer M., Rutten T., Mitchell-Olds T., Sharbel T.F. 2007. Gametogenesis in the apomictic Boechera holboellii complex: the male perspective. – In: Apomixis: Evolution, mechanisms and perspectives. Rugell: A.R.G. Gantner Verlag. P. 236–257.
Voigt-Zielinski M.L., Piwczynski M., Sharbel T.F. 2012. Differential effects of polyploidy and diploidy on fitness of apomictic Boechera. – Sex. Plant Reprod. 25 (2): 97–109. https://doi.org/10.1007/s00497-012-0181-8
Wang H., Liu Y., Bruffett K., Lee J., Hause G., Walker J.C., Zhang S. 2008. Haplo-insufficiency of MPK3 in MPK6 mutant background uncovers a novel function of these two MAPKs in Arabidopsis ovule development. – Plant Cell. 20 (3): 602–613. https://doi.org/10.1105/tpc.108.058032
Windham M.D., Beck J.B., Li F.-W., Allphin L., Carman J.G., Sherwood D.A. et al. 2015. Searching for diamonds in the apomictic rough: a case study involving Boechera lignifera (Brassicaceae). – Syst. Bot. 40 (4): 1031–1044. https://doi.org/10.1600/036364415x690076
Дополнительные материалы отсутствуют.
Инструменты
Ботанический журнал


