Цитология, 2020, T. 62, № 9, стр. 662-671
Опыт применения лектинов для оценки изменений состава углеводов поверхностного аппарата тимоцитов мыши на ранних и поздних стадиях апоптоза
М. К. Серебрякова 1, И. В. Кудрявцев 1, Э. Балкан 2, А. В. Полевщиков 1, *
1 Институт экспериментальной медицины
197376 Санкт-Петербург, Россия
2 Лаборатория молекулярной биологии Университета Джелал Баяр
45030 Маниса, Турция
* E-mail: ALEXPOL512@yandex.ru
Поступила в редакцию 27.05.2020
После доработки 12.06.2020
Принята к публикации 13.06.2020
Аннотация
Процесс апоптоза является важным элементом созревания и дифференцировки Т-лимфоцитов. Работа посвящена анализу изменений состава олигосахаридов гликокаликса тимоцитов мышей линии CBA в ходе апоптоза, индуцированного введением гидрокортизона. Использована панель из 23 меченных флуоресцеинизотиоцианатом лектинов, специфичных к маннозе, маннозе и глюкозе, галактозе, N-ацетил-D-галактозамину, N-ацетил-D-глюкозамину, фукозе и остаткам N-ацетилнейраминовой кислоты. Методом проточной цитометрии оценивали связывание лектинов с тимоцитами интактных мышей и мышей после введения гидрокортизона. На основании результатов окрашивания метиловым эфиром тетраметилродамина и 7-аминоактиномицином D клетки были разделены на живые тимоциты и тимоциты в раннем и позднем апоптозе. Результаты указывают на неодинаковую плотность и гетерогенность олигосахаридов в гликокаликсе, значительная часть которых утрачивается уже в раннем апоптозе. Живые клетки несут во внешних структурах гликокаликса углеводы, содержащие в концевом положении остатки галактозы и N‑ацетил-D-галактозамина. При переходе тимоцитов в поздний апоптоз усиливается связывание всех лектинов, кроме специфичного к фукозе. Примембранный слой гликокаликса отличается высокой плотностью и большим разнообразием олигосахаридных структур, сохраняющихся на стадии позднего апоптоза тимоцитов.
Процесс созревания и дифференцировки Т-лимфоцитов в тимусе протекает в непосредственном контакте тимоцитов разной степени зрелости с клетками стромы. От момента переноса в тимус полустволовой CD34+-клетки (общего предшественника лимфоидного ряда) и до выхода из тимуса наивных CD4+-Т-хелперов и CD8+ цитотоксических Т-лимфоцитов все этапы созревания и дифференцировки тимоцитов протекают в ассоциации с клетками-няньками, составляющими основу кортикального тимического эпителия, и дендритными клетками и макрофагами медуллы. Гликокаликс мембраны тимоцитов принимает непосредственное участие в процессах их распознавания адгезионными молекулами клеток стромы тимуса и макрофагами, отвечающими за элиминацию погибающих в ходе селекции тимоцитов. Причиной гибели тимоцитов является запуск в них апоптоза – механизма, играющего ключевую роль в удалении Т-клеток, не прошедших позитивный или негативный этапы селекции.
Уровень апоптоза в тимусе является одним из важных показателей процессов, происходящих во время дифференцировки тимоцитов. В ходе последовательных этапов селекции, связанной прежде всего с формированием сначала β-, а затем α-цепи Т-клеточного рецептора элиминируется по некоторым оценкам до 95% незрелых тимоцитов (Старская, Полевщиков, 2013). Считается, что не более 5% от числа незрелых дважды позитивных (CD4+CD8+) клеток имеет шанс перейти в состояние зрелых SP-тимоцитов (single positive cells CD4+CD8– или CD4–CD8+) и переместиться в медуллу с последующим выходом в кровоток (Palmer, 2003). Это утверждение косвенно подтверждается данными о крайне низком количестве зрелых Т-клеток, выходящих из тимуса на периферию, на фоне высокого пролиферативного потенциала тимоцитов на разных стадиях их созревания (Scollay et al., 1980; Egerton et al., 1990).
Стоит отметить, что реально наблюдаемый уровень апоптоза в интактном тимусе не всегда совпадает с теоретическими данными. Так, проведенные с использованием метода проточной цитофлуориметрии исследования эмбрионального тимуса крыс показали, что уровень апоптоза в данном органе достигает своего максимума на 18-е сут эмбрионального развития и составляет лишь 25% от общего числа тимоцитов, после чего снижается до 5% и сохраняется на этом уровне (Мельникова и др., 2006). Аналогичные данные были получены и для мышей, у которых уровень апоптоза незрелых субпопуляций тимоцитов был гораздо ниже, чем зрелых SP-клеток (в среднем 4–6% против 13–15%), в то время как пролиферативная активность незрелых DP-лимфоцитов (double positive cells CD4+CD8+), напротив, была гораздо выше, чем SP (Старская и др., 2015).
Гистологическая картина интактного тимуса также не подтверждает массового характера апоптоза (Surh, Sprent, 1994). Однако присутствие макрофагов в областях скопления апоптотических телец оставляет место для предположения, что низкий уровень фиксируемого в тимусе апоптоза может быть следствием быстрого удаления гибнущих клеток.
В настоящее время рассматривается несколько альтернативных сценариев, дающих возможное объяснение не столь глобальной картины гибели тимоцитов. Так, в 2013 г. была предложена модель асимметричной гибели тимоцитов CD4+ и CD8+, согласно которой гибнет 74% подвергающихся селекции клеток, однако собственно селективный сигнал получает только 25% клеток, находящихся на стадии ранних DP (Sinclair et al., 2013).
Результаты расчетов, приведенные другой группой исследователей, показывают, что вероятность гибели тимоцитов в кортексе еще на стадии ранних DP составляет более 65% (Sawicka et al., 2014). Почти 92% оставшихся клеток уничтожаются в кортексе в результате негативной селекции, 4.5% получают возможность дифференцироваться в SP-тимоциты CD4+ и 3.5% – в SP-тимоциты CD8+. Повторная негативная селекция в медулле приводит к гибели CD4+-SP-тимоцитов с вероятностью 8.5%, а CD8+-SP-тимоцитов – с вероятностью 32% (Sawicka et al., 2014). Столь разнородные данные говорят о необходимости дополнительных исследований процессов, происходящих в тимусе, в частности оценки уровня апоптоза клеток различных популяций тимуса.
Одной из общепринятых моделей, используемых для изучения процессов апоптоза в тимусе in vivo, является стресс-индуцированная атрофия тимуса, вызванная введением животным глюкокортикоидов и приводящая к развитию акцидентальной трансформации тимуса (Старская, Полевщиков, 2013). Высокие дозы глюкокортикоидов, вырабатываемых в организме в ответ на стресс (либо вводимых путем инъекции) также вызывают массовую гибель клеток тимуса (Cohen, Duke, 1984). При этом разные субпопуляции тимоцитов демонстрируют неодинаковую степень чувствительности к воздействию глюкокортикоидов. Самыми восприимчивыми являются DP-клетки, большая часть которых (от 70 до 90%) гибнет в результате введения животным высоких доз гидрокортизона или дексаметазона (Screpanti et al., 1989).
Одним из результатов воздействия глюкокортикоидов на тимоциты оказывается изменение молекулярного состава плазматической мембраны и гликокаликса (Cima et al., 2004; Iwamori, Iwamori, 2005). Запуск апоптоза в DP-тимоцитах приводит к снижению экспрессии таких маркеров как CD4, CD8, CD24 и CD45. Одновременно с этим наблюдается усиление экспрессии маркеров CD25, CD69 и Т-клеточного рецептора у части популяции (Kishimoto et al.; 1995).
Исследование углеводных компонент мембраны является очень важным шагом к пониманию многих процессов, происходящих в клетке. Одним из подходов к изучению изменения экспрессии тех или иных углеводных детерминант является использование лектинов. Свыше 50 лет эти молекулы применяются для изучения популяционного состава и функций иммунокмпетентных клеток и, несмотря на совершенствование технологии получения моноклональных антител, продолжают использоваться до сих пор (Hellström et al., 1976; Balcan, 2016). При этом чаще всего лектины выступают в роли поликлональных антигенов или митогенов (конканавалин А, фитогемагглютинин, лектины гороха, чечевицы, фитолакки, красной и черной бузины и другие) или в качестве маркеров тех или иных клеток на разных стадиях их дифференцировки (лектины арахиса, виноградной улитки, зародышей пшеницы, нарцисса, клещевины, картофеля). Тем не менее, для анализа состава гликокаликса Т-лимфоцитов на разных стадиях дифференцировки лектины используются нечасто (Balcan, 2016; Серебрякова и др., 2019б).
Цель настоящей работы заключалась в оценке возможности использования панели лектинов различной углеводной специфичности для оценки изменений состава олигосахаридов гликокаликса тимоцитов мыши на ранних и поздних стадиях апоптоза.
МАТЕРИАЛ И МЕТОДИКА
Животные. В качестве объектов исследования были использованы самки мышей линии CBA массой 18–20 г, полученные из питомника Рапполово (Ленинградская обл.), в количестве 80 шт. Животных содержали в стандартных условиях по температуре и освещенности (12/12 ч) при неограниченном доступе к воде и пище.
Лектины. В работе исследовали 22 лектина растительного происхождения и 1 лектин животного происхождения (табл. 1). Все меченные флуоресцеинизотиоцианатом лектины были приобретены у НПК “Лектинотест” (Украина).
Таблица 1.
Источники и специфичность использованных в работе лектинов
| Название | Источник | Обозначение |
|---|---|---|
| Лектины, специфичные к маннозе (αDMan) | ||
| Лектин подснежника | Galanthus nivalis L. | GNA |
| Лектин амариллиса (Hippeastrum hybrid agglutinin) | Amaryllis sp. L. | HHA |
| Лектин нарцисса | Narcissus pseudonarcissus L. | NPA |
| Лектин купены многоцветной (Polygonatum multiflorum root agglutinin) | Polygonatum multiflorum L. | PMRA |
| Лектин белоцветника весеннего | Leucojum vernum L. | LVA |
| Лектин крокуса | Crocus vernus L. | CVA |
| Лектин банана | Musa balbisiana Colla | MBA |
| Лектины, специфичные к маннозе и глюкозе (αDMan/αDGlс) | ||
| Лектин из канавалии мечевидной (Конканавалин А) | Canavalia ensiformis (L.) DC. | ConA |
| Лектин из семян гороха | Pisum sativum L. | PSA |
| Лектин из семян чечевицы | Lens culinaris Medik. | LCA |
| Лектины, специфичные к N-ацетил-D-глюкозамину (GlcNAc) | ||
| Лектин из семян фасоли (фитогемагглютинин) | Phaseolus vulgaris L. | PHA |
| Лектин из клубней картофеля | Solanum tuberosum L. | STA |
| Лектин корневища крапивы | Urtica dioica L. | UDA |
| Агглютинин зародышей пшеницы (Wheat Germ Agglutinin) | Triticum aestivum L. | WGA |
| Лектины, специфичные к N-ацетил-D-галактозамину (GalNAc) | ||
| Агглютинин виноградной улитки | Helix pomatia L. | HPA |
| Лектин коры акации желтой (Caragana Arborescens Bark Agglutinin) | Caragana arborescens Lam. | CABA |
| Лектин семян лимской фасоли (Lima Bean Agglutinin) | Phaseolus lunatus L. | LBA |
| Лектин из семян клещевины (рицин) | Ricinus communis L. | RCA |
| Лектины, специфичные к галактозе (βDGal) | ||
| Лектин из семян арахиса (Peanut Agglutinin) | Arachis hypogaea L. | PNA |
| Лектин омелы белой | Viscum album L. | VAA |
| Лектины, специфичные к N-ацетилнейраминовой кислоте (NAcNeu) | ||
| Лектин коры бузины черной | Sambucus nigra L. | SNA |
| Лектин коры бузины красной | Sambucus racemosa L. | SRA |
| Лектин, специфичный к фукозе (αLFuc) | ||
| Лектин коры бобовника анагиролистного (Laburnum Anagyroides Bark Agglutinin) | Laburnum anagyroides Medik. | LABA |
Реагенты. В работе использовали: потенциал-зависимый липофильный митохондриальный краситель метиловый эфир тетраметилродамина (TMRM) (Invitrogen, США) для выявления ранних стадий апоптоза; ДНК-связывающий краситель 7-аминоактиномицин D (7AAD) (BioLegend, США) для выявления поздних стадий апоптоза; забуференный физиологический раствор (ФР), представляющий собой 0.14 М раствор NaCl, 1 л которого содержал 0.2 г KCl, 1.44 г Na2HPO4, 0.24 г KH2PO4, pH 7.4, (Биолот, Санкт-Петербург) и к которому добавляли 2% эмбриональной телячьей сыворотки (ЭТС; Биолот, Санкт-Петербург) для уменьшения неспецифических взаимодействий; суспензию гидрокортизона для инъекций, 25 мг/мл (Gedeon Richter, Венгрия).
Выделение тимоцитов. Животных умерщвляли путем цервикальной дислокации и сразу же извлекали тимус. Тимоциты получали с помощью гомогенизатора Поттера, клеточную суспензию каждого тимуса фильтровали через нейлоновый фильтр и дважды отмывали избытком ФР путем центрифугирования при 330 g в течение 8 мин при охлаждении до 15°С. Клеточный осадок ресуспендировали и переводили в 3 мл ФР, получая рабочую суспензию тимоцитов (Серебрякова и др., 2019а).
Индукция апоптоза тимоцитов мышей. У части животных индуцировали апоптоз тимоцитов путем внутрибрюшинного введения 2.5 мг гидрокортизона в объеме 0.5 мл ФР за 3 или 6 ч до эксперимента.
Оценка уровня апоптоза при помощи проточной цитометрии. Использовали методику, основанную на применении метилового эфира тетраметилродамина (TMRM). Этот краситель относится к категории так называемых митохондриальных зондов – веществ, спонтанно проникающих через плазматическую мембрану и специфически накапливающихся в митохондриях живых клеток. В таких клетках краситель обладает высоким уровнем флуоресценции. При запуске апоптоза мембранный потенциал митохондрий снижается, в результате чего зонд выходит в цитоплазму, что приводит к снижению флуоресценции. Таким образом, общий пул клеток может быть разделен на живые, обладающие яркой флуоресценцией (TMRM+), и клетки в апоптозе, начиная с его ранних стадий (TMRM–) (Lee et al., 2001). Для разделения ранних и поздних стадий апоптоза производили окраску ДНК-связывающим красителем 7AAD, проникающим только в клетки с поврежденной мембраной (Lesley et al., 1988). Нарушение целостности плазмалеммы является одним из характерных признаков гибели клетки, в равной степени позднего апоптоза и некроза. Проникновение 7AAD в ядро и связывание с ДНК позволяет на основании параметров флуоресценции выделить фракцию клеток в позднем апоптозе из общего апоптозного пула, определяемого по TMRM-свечению.
Окрашивание проводили по методике, описанной ранее (Серебрякова и др., 2019а). Кратко: к 100 мкл рабочей суспензии тимоцитов добавляли раствор меченого лектина и красителя TMRM в конечной концентрации 5 и 0.075 мкг/мл соответственно. После внесения реагентов клетки инкубировали 20 мин в темноте при 37°С. Далее образцы отмывали избытком ФР, содержащего 2% ЭТС, путем центрифугирования (330 g, 8 мин, 15°С). Полученный осадок ресуспендировали в 100 мкл ФР. К суспензии добавляли 10 мкл красителя 7AAD, создавая конечную концентрацию 1 мкг/мл, и инкубировали пробы в темноте еще 5 мин. Затем образцы разводили ФР до объема 250 мкл и анализировали на проточном цитометре Navios™ (Beckman Coulter, США). Для каждого образца собирали не менее 30 000 одиночных клеток. Клеточные агрегаты исключали путем учета данных по времени нахождения частицы в точке детекции на осях прямого или бокового светорассеяния.
По результатам цитометрического анализа путем логического гейтирования выделяли три популяции тимоцитов: живые (TMRM+7AAD–), клетки на стадии раннего апоптоза (TMRM–7AAD–) и клетки на стадии позднего апоптоза (TMRM–7AAD+) (рис. 1). У этих популяций оценивали (и выражали в %) уровень позитивных по каждому лектину клеток у интактных (контрольных) животных (столбцы А на рис. 2–6), а также у животных через 3 и 6 ч после введения гидрокортизона (соответственно столбцы В и С на рис. 2–6). Негативным контролем по каждому животному считали клетки, прошедшие все этапы пробоподготовки, но без внесения растворов лектинов.
Рис. 1.
Гейтирование тимоцитов при окрашивании красителями TMRM и 7AAD. Проточная цитометрия. По горизонтали – уровень флуоресценции при окрашивании TM-RM, усл. ед.; по вертикали – уровень флуоресценции при окрашивании 7AAD, усл. ед. Квадранты: 1 – живые клетки (TMRM+7AAD–); 2 – ранний апоптоз (TMRM–7AAD–); 3 – поздний апоптоз (TMRM–7AAD+).

Рис. 2.
Связывание Man-специфичных лектинов с тимоцитами. Лектины: 1 – подснежника (GNA), 2 – амариллиса (HHA), 3 – нарцисса (NPA), 4 – купены (PMRA), 5 – белоцветника (LVA), 6 – крокуса (CVA), 7 – банана (MBA). На рис. 2–6: по горизонтали – живые клетки (A), клетки в раннем апоптозе через 3 ч после введения гидрокортизона (B) и клетки в позднем апоптозе через 6 ч после введения гидрокортизона (C); по вертикали – доля меченных лектином клеток, %; n ≥ 4 для каждой точки; *различия с живыми клетками достоверны при P < 0.05.
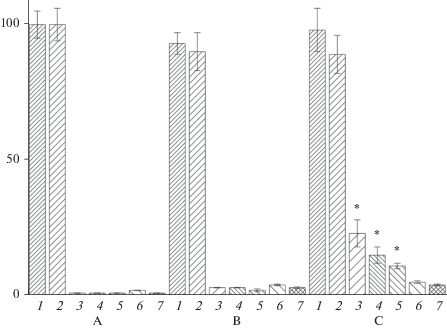
Рис. 3.
Связывание Man/Glc-специфичных лектинов с тимоцитами. Лектины: 1 – Конканавалин А (ConA), 2 – гороха (PSA), 3 – чечевицы (LCA).

Рис. 4.
Связывание GlcNAc-специфичных лектинов с тимоцитами. Лектины: 1 – семян фасоли (PHA), 2 – картофеля (STA), 3 – крапивы (UDA), 4 – зародышей пшеницы (WGA).

Рис. 5.
Связывание GalNAc-специфичных лектинов с тимоцитами. Лектины: 1 – виноградной улитки (НРА), 2 – желтой акации (САВА), 3 – лимской фасоли (LBA), 4 – клещевины (RCA).

Рис. 6.
Связывание лектинов других специфичностей с тимоцитами. Лектины: 1 – арахиса (PNA), 2 – омелы белой (VAA); 3 – бузины черной (SNA), 4 – бузины красной (SRA); 5 – бобовника анагиролистного (LABA).

Статистический метод. Вычисляли среднее арифметическое и ошибку среднего. Сравнение выборок производили с помощью t-критерия Стьюдента. Обработку данных вели при помощи пакета программ и приложений Microsoft Office Excel (Microsoft, США). Во всех экспериментах различия между контролем и экспериментом считали статистически достоверными при P < 0.05.
РЕЗУЛЬТАТЫ
Полученные данные свидетельствуют, что связывание лектинов различной лигандной специфичности с тимоцитами зависит от их жизнеспособности и стадии апоптоза, что может быть использовано для оценки изменений состава полисахаридов гликокаликса тимоцитов в ходе апоптотического процесса (рис. 2–6).
Man-специфичные лектины. В работе использовали 7 растительных Man-специфичных лектинов: подснежника, амариллиса, белоцветника весеннего, нарцисса, купены многоцветной, крокуса и банана (рис. 2). Лектины подснежника и амариллиса, специфичные к α(1-3)Man в терминальном положении и имеющие сходную структуру, показывают одинаковое, почти 100%-ное связывание со всеми тимоцитами, вне зависимости от популяции и жизнеспособности клеток (рис. 2, столбцы 1 и 2). Способность к связыванию с тимоцитами остальных лектинов этой группы, напротив, зависит от жизнеспособности клеток. Если в популяции живых клеток всего около 1% тимоцитов окрашивается Man-специфичными лектинами, то при развитии раннего апоптоза их доля возрастает до 2–4%, а при позднем апоптозе – до 15–23% клеток способны к взаимодействию с лектинами этой специфичности. Примером такой динамики связывания являются лектины нарцисса и купены (рис. 2, столбцы 3 и 4 соответственно).
Man/Glc-специфичные лектины. На рис. 3 приведены результаты оценки связывания с тимоцитами тетрамерных лектинов бобовых, специфичных к маннозе и глюкозе: конканавалина А, лектинов гороха и чечевицы. Для этих лектинов характерен низкий уровень связывания с живыми клетками и его повышение по мере развития апоптоза. При этом, если в случае конканавалина А и лектина гороха происходит дальнейшее усиление связывания с тимоцитами при переходе клеток из раннего в поздний апоптоз (от 6 до 34% позитивных по лектину клеток в случае конканавалина А (рис. 3, столбец 1) и от 7 до 21% в случае лектина гороха (рис. 3, столбец 2)), то для лектина чечевицы сразу после появления у клетки ранних признаков апоптоза связывание повышается (от 1% для живых клеток до 8% в раннем апоптозе (рис. 3, столбец 3)) и в дальнейшем меняется незначительно при вхождении тимоцитов в поздний апоптоз.
Специфичные к N-ацетил-D-глюкозамину лектины. Также рост доли меченых клеток наблюдается и при связывании лектинов этой группы с тимоцитами в позднем апоптозе. Если в случае лектина картофеля этот прирост по сравнению с живыми клетками оказывается как минимум 13-кратным (рис. 4, столбец 2), то для фитогемагглютинина – одного из классических митогенов лимфоидных клеток млекопитающих – он уже 25-кратный (рис. 4, столбец 1). Два других лектина этой группы – крапивы и зародышей пшеницы – показывают сходную 9-кратную амплитуду прироста доли меченых тимоцитов в позднем апоптозе (рис. 4, столбцы 3 и 4 соответственно). Стоит отметить, что в случае лектина зародышей пшеницы достоверный прирост числа связавшихся с ним тимоцитов (до 70%) достигается только в этой точке, в отличие от остальных лектинов этой группы.
Специфичные к N-ацетил-D-галактозамину лектины. На рис. 5 приведены результаты оценки взаимодействия тимоцитов со специфичными к GalNAc лектинами из виноградной улитки, желтой акации, лимской фасоли и клещевины. Связывание лектина улитки с клетками тимуса мало зависит от их жизнеспособности и оказывается высоким, хотя и снижается для клеток в раннем апоптозе (рис. 5, столбец 1). Три остальных лектина этой специфичности демонстрируют почти идентичный уровень связывания с тимоцитами: до 1% в случае живых клеток, 2–6% клеток, находящихся в раннем апоптозе и 19–23% тимоцитов в позднем апоптозе (рис. 5, столбцы 2–4). Достоверным оказывается только прирост в последнем случае, а максимальную амплитуду (от следового связывания в случае живых клеток до 23% тимоцитов в позднем апоптозе) демонстрирует лектин клещевины рицин (рис. 5, столбец 4).
Gal-cпецифичные лектины. Динамика связывания лектинов этой специфичности оказывается несхожей (рис.6, столбцы 1 и 2). Лектин арахиса является одним из немногих, чьe связывание с тимоцитами снижается при развитии раннего апоптоза и повышается при развитии позднего апоптоза (от 81% в случае живых клеток до 56% в раннем апоптозе (P < 0.05) и вновь повышается до 90% в позднем апоптозе через 6 ч после введения гидрокортизона). Напротив, лектин омелы одинаково связывается с живыми тимоцитами и клетками в раннем апоптозе (по 3% популяции), сильнее окрашивая клетки в позднем апоптозе (18%, P < 0.05).
NANA-cпецифичные лектины. Лектины черной и красной бузины показывают сходную динамику окрашивания тимоцитов разной жизнеспособности: слабо связываясь с живыми клетками (до 1% популяции), они активнее взаимодействуют с тимоцитами в раннем апоптозе (2% в случае бузины красной и 15% в случае бузины черной), а максимально – при переходе тимоцитов в поздний апоптоз (15 и 55% соответственно), проявляя очевидную тропность к нежизнеспособным клеткам (рис.6, столбцы 3 и 4 соответственно).
Fuc-cпецифичный лектин из коры бобовника анагиролистного (рис.6, столбец 5) обладает минимальной во всей панели исследованных лектинов способностью к связыванию с тимоцитами (менее 0.1% для живых клеток и до 4% клеток в позднем апоптозе).
ОБСУЖДЕНИЕ
В предшествующих публикациях мы анализировали возможность использования лектинов растительного и животного происхождения для оценки уровня апоптоза тимоцитов (Серебрякова и др., 2019а) и типирования субпопуляций тимоцитов мыши (Серебрякова и др., 2019б). Приведенные выше данные могут дать важную информацию о структуре и характере изменений олигосахаридных компонентов гликокаликса тимоцитов мыши на разных стадиях апоптотического процесса.
Изучение изменений состава гликокаликса при апоптозе не является магистральным направлением исследований этого процесса. Гораздо чаще изучаются и оцениваются изменения объема и формы клетки (включая утрату микроворсинок, ресничек и других структур), конденсацию хроматина в ядре и диссоциацию ядрышек, фрагментацию ядра и формирование апоптотических телец, уровень активности каспаз, про- и антиапоптотических белков, митохондриальный потенциал, степень разрушения внутриклеточных мембран и уровень активности сериновых протеаз и трансглютаминазы цитоплазмы, разрушение цитоскелета и изменение состава липидов плазмалеммы и, наконец, изменения в структуре ДНК, степень ее фрагментации (Кудрявцев и др., 2012).
Тем не менее, изменение гликозилирования плазматической мембраны сопровождает различные процессы, протекающие в клетке, в том числе и запуск апоптоза. В литературе имеются данные об изменении связывания различных лектинов с тимоцитами разной степени зрелости, а также клетками, находящимися на разных стадиях апоптоза (London et al., 1978; Raedler et al., 1982; Bilyy et al., 2004). При анализе полученных результатов также следует принять во внимание, что сами лектины в большинстве своем также являются гликопротеинами (Лахтин, 1987), поэтому окрашивание ими клеток может быть связано как с распознаванием лектином структур гликокаликса, так и, наоборот, со связыванием рецепторов мембраны тимоцита с гликозилированным лектинами (Полевщиков, 1996).
Приведенные на рис. 2–6 результаты доказывают, что связывание практически всех лектинов с тимоцитами усиливается по мере перехода клеток в поздний апоптоз и дает основания предполагать, что в ходе апоптоза на поверхности клеток проявляются разные углеводные структуры, не выявляемые на жизнеспособных клетках из-за их маскировки структурами гликокаликса. Так, многие углеводные детерминанты замаскированы сиаловыми кислотами (Alvarez et al., 1999). Сиализация является последним этапом модификации гликопротеинов, и многие осуществляющие его сиалотрансферазы локализованы в транс-цистернах аппарата Гольджи (Roth et al., 1985; Bast et al., 1992). Нарушение работы аппарата Гольджи в результате запуска апоптоза может являться одной из причин появления на поверхности тимоцитов гликопротеинов и гликолипидов, не прошедших последний этап гликозилирования (Wyllie, 1980; Morris et al., 1984).
Низкий уровень связывания ряда лектинов с тимоцитами в позднем апоптозе (лектины крокуса, банана и бобовника анагиролистного, рис. 2, 6) свидетельствует о том, что усиление окрашивания другими лектинами носит специфический характер и связано с открытием новых детерминант. Однако есть бóльшие основания предполагать неспецифический характер связывания в случае лектинов подснежника и амариллиса, уровень окрашивания которыми (90% клеток и более) не зависит от жизнеспособности тимоцитов (рис. 2).
Результаты исследования согласуются с классическими данными. Так, в течение многих лет в работе с Т-лимфоцитами человека и животных в качестве митогенов используются конканавалин А и фитогемагглютинин, которые вызывают перекрестную сшивку мембранных рецепторов с последующими кэппингообразованием, активацией и (по меньшей мере, однократным) прохождением клеточного цикла. Полученные в работе результаты указывают на низкий уровень связывания специфичного к Man/Glc конканавалина А (около 1%) и специфичного к N-ацетил-D-глюкозамину фитогемагглютинина (около 5% клеток) с живыми клетками, однако этот уровень возрастает до 5–6% после вхождения тимоцитов в обратимую стадию раннего апоптоза (рис. 3 и 4). Последний результат полностью согласуется с морфологическим анализом их связывания с Т-клетками человека, проведенным с помощью меченых лектинов и последующей авторадиографией (Stobo, 1972), либо с использованием современного иммунопероксидазного способа идентификации помеченных клеток (Balcan, 2016).
Результаты также позволяют уточнить роль сиаловых кислот как одного из главных компонентов гликокаликса живых клеток, маскирующих лежащие ниже олигосахариды (Alvarez et al., 1999). Вопреки укоренившимся представлениям о сиаловых кислотах как главных компонентах гликокаликса, лектины черной и красной бузины связываются всего с 1% живых тимоцитов, однако по мере развития апоптоза доля окрашенных клеток быстро и неуклонно возрастает (рис. 6, столбцы 3, 4). Принимая во внимание, что термин “N-ацетилнейраминовая кислота” в действительности охватывает семейство 9-членных карбоксилированных сахаров, включающее свыше 30 разных молекул (Pilatte et al., 1993), можно предположить, что лигандами обоих использованных в работе лектинов бузины были олигосахариды, не характерные для наружных структур гликокаликса живых тимоцитов. Одновременно это не отменяет смены профиля олигосахаридов семейства NANA по ходу созревания и дифференцировки тимоцитов (Gillespie et al., 1993; Krishna, Varki, 1997; Wu et al., 1997), равно как и появления новых лигандов при обнажении базальных структур гликокаликса в позднем апоптозе.
На основании полученных данных можно утверждать, что внешние структуры гликокаликса живых тимоцитов содержат ограниченный набор олигосахаридов, содержащих N-ацетил-D-галактозамин и D-галактозу в концевом положении, которые утрачиваются уже в раннем апоптозе. На это указывает окрашивание лектинами виноградной улитки и арахиса (рис. 5 и 6). Вероятно, по этой причине эти лектины на протяжении многих лет использовались в лектиногистохимии для выявления созревающих тимоцитов (Hellström et al., 1976; London et al., 1978). Специфичные к N-ацетил-D-галактозамину структуры тимоцитов играют важную роль в созревании этих клеток, поскольку через них опосредуется заякоревание тимоцитов к клеткам-нянькам, что подтверждается изменением активности цитоплазматических гликозилтрансфераз GalNAc-T1 и GalNAc-T2 (Alvarez et al., 2006).
Примембранный слой гликокаликса, по-видимому, отличается большим разнообразием олигосахаридных структур, которые в значительной степени сохраняются на стадии позднего апоптоза, что подтверждается наличием лигандов для почти всех использованных лектинов, а также согласуется с результатами прямых морфологических исследований (Schulte, Spicer, 1985; Reitsma et al., 2007).
Таким образом, оценка связывания меченых лектинов с клетками с использованием метода проточной цитометрии способна дать важную информацию как о динамике изменений состава гликокаликса тимоцитов в ходе апоптоза, так и о его структуре в целом.
Список литературы
Кудрявцев И.В., Головкин А.С., Зурочка А.В., Хайдуков С.В. 2012. Современные методы и подходы к изучению апоптоза в экспериментальной биологии. Медицинская иммунология. Т. 14. № 6. С. 461. (Kudryavtsev I.V., Golovkin A.S., Zurochka A.V., Khaidukov S.V. 2012. Modern technologies and approaches to apoptosis studies in experimental biology Med. Immunol. (Meditsinskaya immunologiya). V. 14. P. 461.)
Лахтин В.М. 1987. Лектины в исследовании белков и углеводов. Итоги науки и техники. Сер. Биотехнология. М.: ВИНИТИ. Т. 2. С. 1. (Lakhtin V.M. 1987. Lectins in the study of proteins and carbohydrates. Results of science and technology. Ser. Biotechnol. M.: VINITI. V. 2. P. 1)
Мельникова В.И., Афанасьева М.А., Сапожников А.М., Захарова Л.А. 2006. Динамика апоптоза и пролиферации в тимусе и селезенке крыс в перинатальном онтогенезе. Онтогенез. Т. 37. № 4. С. 286. (Melnikova V.I., Afanasyeva M.A., Sapozhnikov A.M., Zakharova L.A. 2006. Dynamics of apoptosis and proliferation in rat thymus and spleen during perinatal development. Rus. J. Develop. Biol. (Ontogenez). V. 37. P. 237.)
Полевщиков А.В. 1996. Лектины в защитных реакциях хордовых животных. Иммунология. Т. 17. № 1. С. 48. (Polevshchikov A.V. 1996. Lectins in the defense reactions of chordates. Immunol. (Immunologiya). V. 17. P. 48.)
Серебрякова М.К., Доценко А.А., Кудрявцев И.В., Полевщиков А.В. 2019а. Скрининг панели лектинов для оценки стадий апоптоза тимоцитов мыши. Медицинский академический журн. Т. 19. № 3. С. 57. (Serebriakova M.K., Dotsenko A.A., Kudryavtsev I.V., Polevshchikov A.V. 2019. Lectin panel screening for evaluating of murine thymocytes apoptosis stages. Medical Academic J. (Meditsinskiy Akademicheskiy Zhurnal). V. 19. P. 57.)
Серебрякова М.К., Кудрявцев И.В., Полевщиков А.В. 2019б. Цитометрическая оценка связывания лектинов с различными популяциями тимоцитов мыши. Иммунология. Т. 40. № 6. С. 41. (Serebriakova M.K., Kudryavtsev I.V., Polevshchikov A.V. 2019. Cytometric assessment of lectins binding to various populations of murine thymocytes. Immunol. (Immunologiya). V. 40. P. 41.)
Старская И.С., Кудрявцев И.В., Гусельникова В.В.,Серебрякова М. К., Полевщиков А.В. 2015. Уровень апоптоза Т‑лимфоцитов, созревающих в интактном тимусе. ДАН. Т. 462. № 2. С. 238. (Starskaya I.S., Kudryavtsev I.V., Guselnikova V.V., Serebriakova M.K., Polevshchikov A.V. 2015. Apoptosis Level in Developing T Cells in the Thymus. Doklady Biochem. Biophys. (Doklady Akademii Nauk). V. 462. P. 163.)
Старская И.С., Полевщиков А.В. 2013. Морфологические аспекты атрофии тимуса при стрессе. Иммунология. Т. 34. № 5. С. 271. (Starskaya I.S., Polevshchikov A.V. 2013. Morphological aspects of thymic atrophy under stress. Immunol. (Immunologiya). V. 34. P. 271.)
Alvarez G., Lascurain R., Hernández-Cruz P., Tetaert D., Degand P., Gorocica P., Chávez, R. 2006. Differential O-glycosylation in cortical and medullary thymocytes. Biochim. Biophys. Acta. V. 1760. P. 1235.
Alvarez G., Lascurain R., Pérez A., Degand P., Montaño L.F., Martinez-Cairo S., Zenteno, E. 1999. Relevance of sialoglycoconjugates in murine thymocytes during maturation and selection in the thymus. Immunol. Invest. V. 28. P. 9.
Balcan E. 2016. Quantitative approach to lectin-based glycoprofiling of thymic tissuesin the control- and the dexamethasone-treated mice. Tissue and Cell. V. 48. P. 168.
Bast B.J., Zhou L.J., Freeman G.J., Colley K. J., Ernst T.J., Munro J.M., Tedder T.F. 1992. The HB-6, CDw75, and CD76 differentiation antigens are unique cell-surface carbohydrate determinants generated by the beta-galactoside alpha 2, 6-sialyltransferase. J. Cell. Biol. V. 116. P. 423.
Bilyy R.O., Antonyuk V.O., Stoika R.S. 2004. Cytochemical study of role of α-d-mannose-and β-d-galactose-containing glycoproteins in apoptosis. J. Mol. Hist. V. 35. P. 829.
Cima I., Corazza N., Dick B., Fuhrer A., Herren S., Jakob S., Ayuni E., Mueller C., Brunner T. 2004. Intestinal epithelial cells synthesize glucocorticoids and regulate T cell activation. J. Exp. Med. V. 200. P. 1635.
Cohen J.J., Duke R.C. 1984. Glucocorticoid activation of a calcium-dependent endonuclease in thymocyte nuclei leads to cell death. J. Immunol. V. 132. P. 38.
Egerton M., Scollay R., Shortman K. 1990. Kinetics of mature T‑cell development in the thymus. PNAS. V. 87. P. 2579.
Gillespie W., Paulson J.C., Kelm S., Pang M., Baum L.G. 1993. Regulation of alpha 2,3-sialyltransferase expression correlates with conversion of peanut agglutinin (PNA)+ to PNA-phenotype in developing thymocytes. J. Biol. Chem. V. 268. P. 3801.
Hellström U., Hammarström S., Dillner M.L., Perlmann H., Perlmann P. 1976. Fractionation of human blood lymphocytes on Helix pomatia A haemagglutinin coupled to sepharose beads. Scand. J. Immunol. V. 5. P. 45.
Iwamori M., Iwamori Y. 2005. Changes in the glycolipid composition and characteristic activation of GM3 synthase in the thymus of mouse after administration of dexamethasone. Glycoconj. J. V. 22. P. 119.
Kishimoto H., Surh C.D., Sprent J. 1995. Upregulation of surface markers on dying thymocytes. J. Exp. Med. V. 181. P. 649.
Krishna M., Varki A. 1997. 9-O-Acetylation of Sialomucins: A Novel Marker of Murine CD4 T Cells that Is Regulated during Maturation and Activation. J. Exp. Med. V. 185. P. 1997.
Lee C.K., Kim J.K., Kim Y., Lee M.K., Kim K., Kang J.K., Han S.S. 2001. Generation of macrophages from early T progenitors in vitro. J. Immunol. V. 166. P. 5964.
Lesley J., Schulte R., Trotter J., Hyman R. 1988. Qualitative and quantitative heterogeneity in Pgp-1 expression among murine thymocytes. Cell. Immunol. V. 112. P. 40.
London J., Berrih S., Bach J.F. 1978. Peanut agglutinin I. A new tool for studying T lymphocyte subpopulations. J. Immunol. V. 121. P. 438.
Morris R.G., Hargreaves A.D., Duvall E., Wyllie A.H. 1984. Hormone-induced cell death. 2. Surface changes in thymocytes undergoing apoptosis. Am. J. Pathol. V. 115. P. 426.
Palmer E. 2003. Negative selection – clearing out the bad apples from the T-cell repertoire. Nat. Rev. Immunol. V. 3. P. 383.
Pilatte Y., Bignon J., Lambré C.R. 1993. Sialic acids as important molecules in the regulation of the immune system: pathophysiological implications of sialidases in immunity. Glycobiol. V. 3. P. 201.
Raedler A., Raedler E., Becker W.M., Arndt R., Thiele H.G. 1982. Subcapsular thymic lymphoblasts expose receptors for soy bean lectin. Immunology. V. 46. P. 321.
Reitsma S., Slaaf D.W., Vink H., van Zandvoort M.A., oude Egbrink M.G. 2007. The endothelial glycocalyx: composition, functions, and visualization. Eur. J. Physiol. V. 454. P. 345.
Roth J., Taatjes D.J., Lucocq J.M., Weinstein J., Paulson J.C. 1985. Demonstration of an Extensive Trans-tubular Network Continuous with the Golgi Apparatus Stack That May Function in Glycosylation. Cell. V. 43. P. 287.
Sawicka M., Stritesky G., Reynolds J., Abourashchi N., Lythe G., Molina-Paris C., Hogquist K. 2014. From pre-DP, post-DP, SP4, and SP8 thymocyte cell counts to a dynamical model of cortical and medullary selection. Front. Immunol. V. 15. P. 1.
Schulte B.A., Spicer S.S. 1985. Histochemical methods for characterizing secretory and cell surface sialoglycoconjugates. J. Histochem. Cytochem. V. 33. P. 427.
Scollay R.G., Butcher E.C., Weissman I.L. 1980. Thymus cell migration: quantitative aspects of cellular traffic from the thymus to the periphery in mice. Eur. J. Immunol. V. 10. P. 210.
Screpanti I., Morrone S., Meco D., Santoni A., Gulino A., Paolini R., Frati, L. 1989. Steroid sensitivity of thymocyte subpopulations during intrathymic differentiation. Effects of 17 beta-estradiol and dexamethasone on subsets expressing T cell antigen receptor or IL-2 receptor. J. Immunol. V. 142. P. 3378.
Sinclair C., Bains I., Yates A.J., Seddon B. 2013. Asymmetric thymocyte death underlies the CD4:CD8-T-cell ratio in the adaptive immune system. PNAS. V. 110. P. 2905.
Stobo J.D. 1972. Phytohemagglutinin and concanavalin A: Probes for murine “T” cell activation and differentiation. Immunol. Rev. V. 11. P. 60.
Surh C.D., Sprent J. 1994. T-cell apoptosis detected in situ during positive and negative selection in the thymus. Nature. V. 372. P. 100.
Wu W., Punt J.A., Granger L., Sharrow S.O., Kearse K.P. 1997. Developmentally regulated expression of peanut agglutinin (PNA)-specific glycans on murine thymocytes. Glycobiol. V. 7. P. 349.
Wyllie A.H. 1980. Glucocorticoid-induced thymocyte apoptosis is associated with endogenous endonuclease activation. Nature. V. 284. P. 555.
Дополнительные материалы отсутствуют.


