Электрохимия, 2019, T. 55, № 4, стр. 424-435
Дисперсные кобальтсодержащие углеродные носители и платиновые электрокатализаторы на их основе
Л. М. Скибина a, *, **, Д. К. Мауэр a, В. А. Волочаев a, В. Е. Гутерман a
a Южный федеральный университет
Ростов-на-Дону, ул. Садовая, 105, Россия
* E-mail: skibina@sfedu.ru
** E-mail: anibiks@yandex.ru
Поступила в редакцию 26.09.2018
После доработки 10.11.2018
Принята к публикации 26.11.2018
Аннотация
Электроосаждением на углерод марки Vulcan ХС72, находящийся в суспензии, получены материалы, содержащие от 3.1 до 7.7% кобальта. Методами термогравиметрии и рентгенофазового анализа изучены состав и размер кристаллитов СоО, образующихся в результате окисления кобальта в процессе фильтрования и сушки материалов, в зависимости от условий электролиза и состава электролита. Показано, что максимальное количество кобальта удается осадить из электролитов, содержащих, наряду с сульфатом кобальта, добавки сульфатов меди и никеля. Расчеты по уравнению Шеррера показали, что увеличение содержания СоО приводит к уменьшению диаметра зерен, размер которых находится в нанодиапазоне. Анализ данных рентгенографических и электрохимических исследований свидетельствует об образовании в ходе боргидридного синтеза комбинированных катализаторов, содержащих, наночастицы твердого раствора Pt3Co. Лучший из полученных PtCo/C-материалов продемонстрировал существенно более высокие активность в реакции электровосстановления кислорода (РВК) и стабильность по сравнению с коммерческим Pt/C-катализатором, содержащим близкое количество платины.
ВВЕДЕНИЕ
Разработка и совершенствование новых источников энергии, таких как топливные элементы (ТЭ), является одним из ключевых направлений, которые в будущем позволят значительно сократить использование ископаемых источников энергии. Известно, что платина проявляет наиболее высокую каталитическую активность в реакциях электроокисления водорода, электровосстановления кислорода и в нанесенном на углерод состоянии используется в качестве электрокатализатора в низкотемпературных TЭ [1]. Однако высокая стоимость и естественный дефицит Pt представляют собой проблему с точки зрения промышленного использования таких материалов. Наряду с потребностью в повышении активности катализатора, коммерческому применению платины в ТЭ способствовало бы повышение стабильности катализатора в процессе работы ТЭ [2].
Характеристики платиносодержащих катализаторов зависят от состава, размера, формы и тонкой структуры наночастиц (НЧ) платины [3, 4]. Для их улучшения часто используют легирование платины переходными металлами (Ni, Fe, Co, Cr, V, Mn и др.). Многие исследователи указывают на более высокую активность бинарных и тройных сплавов Pt с 3d-переходными металлами в РВК, чем для чистой Pt [5–9]. Снижение содержания платины в катализаторе и повышение его стабильности также может быть достигнуто путем частичной замена платины другими металлами [2, 10, 11]. В частности, значительный интерес представляют сплавы Pt–Co и Pt–Ni из-за их относительно высокой активности в РВК [12, 13], а также приемлемой стабильности в кислых средах [14]. Повышение активности электрокатализаторов на основе легированной платины может быть объяснено геометрическими факторами (уменьшение расстояния связи Pt–Pt) [15], электронными факторами (увеличение вакантности d-электрона) [16], изменением структуры поверхности [14] или растворением более окисляемого легирующего компонента [17]. На основании анализа взаимосвязи активности материалов в РВК и атомного расстояния Pt–Pt в зависимости от содержания Со в сплаве были рассчитаны оптимальные атомные соотношения Pt : Co, которые составили около 3 : 1 [18]. Согласно [19], максимальную каталитическую активность в РВК и минимальную поляризацию показали электрокатализаторы Pt–Co при атомном соотношении Pt : Co около 1 : 7, однако такие материалы удалось получить довольно сложным методом низкотемпературного восстановления смеси прекурсоров формиатом натрия. В работах [20, 21] повышение каталитической активности поверхностей сплава Pt3Ni и Pt3Co по сравнению с чистой Pt связывают с ингибированием при потенциалах выше 0.8 В образования Pt–OHад на участках Pt, окруженных “окисленными” атомами Ni и Co.
Способ, обычно используемый для получения электрокатализаторов Pt–Co/C, состоит в осаждении и восстановлении прекурсоров кобальта на предварительно образованном платиноуглеродном носителе, за которым следует восстановление кобальта при высокой температуре и сплавление металлов [17, 23, 24]. В работах [22, 25–27] были опробованы низкотемпературные методы приготовления Pt–Co/C-материалов путем одновременного восстановления платины и кобальта из их соединений. Так, в работе [26] углеродсодержащие катализаторы, содержащие Pt и Pt–Co, получали путем восстановления соответствующих металлов с помощью NaBH4 при комнатной температуре во избежание спекания частиц металла, которое происходит, когда синтез катализатора проводят при высоких температурах. В исследовании [27] методами низкотемпературного жидкофазного синтеза, аналогичного описанному в работе [26], были получены наноструктурные материалы PtxCo/C и PtxNi/C со средним диаметром НЧ от 4.2 до 2.6 нм и содержанием металлов от 27 до 40 мас. %. Установлено, что более высокие удельные характеристики имеют катализаторы с соотношением Pt–Co и Pt–Ni, соответствующим 1 : 1. Однако дальнейшая постобработка в кипящей 1 М H2SO4 ведет к росту НЧ и снижению удельных характеристик катализатора [26]. Учитывая, что химическое восстановление платины проходит с использованием сильного восстановителя, а с другой стороны – что наночастицы кобальта нестабильны в окружающей среде, можно первоначально получать нанесенный на углерод оксид кобальта, а уже затем проводить восстановление четырехвалентный платины и кобальта из его оксида для формирования биметаллических наночастиц. Одним из возможных способов получения таких материалов является электроосаждение на высокодисперсный углеродный носитель кобальта с последующим нанесением платины, что должно привести к одновременному присутствию в катализаторе НЧ обоих металлов.
В настоящее время методы формирования биметаллических наночастиц приобретают особую актуальность, учитывая результаты ранее проведенных исследований [22–28], продемонстрировавших высокую каталитическую активность бинарных сплавов на основе платины (в том числе с кобальтом) в РВК. Ранее был предложен оригинальный метод электрохимического нанесения платины на дисперсные частицы углерода [29]. Данный метод получил свое развитие для электроосаждения наночастиц олова, превращающихся в оксид SnO2 при последующем взаимодействии со средой [30, 31].
С учетом вышеизложенного, целью настоящей работы является получение наноструктурных CoxOy/C-материалов и синтез на их основе платиносодержащих катализаторов, исследование состава и электрохимического поведения как комбинированных носителей, так и синтезированных на их основе платиновых катализаторов, а также оценка стабильности полученных электрокатализаторов по результатам вольтамперометрического стресс-тестирования.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Для электроосаждения кобальта на дисперсный углеродный носитель, находящийся в суспензии, использовали стеклографитовый анод и медный катод, погруженные в суспензию из 0.5 г углеродного порошка Vulcan-XC-72R в 50 мл электролитов кобальтирования следующего состава: CoSO4 · 7H2O – 500 г/л, NaCl – 15, Н3ВО3 – 45, CoSO4 · 7H2O – 80 г/л, NiSO4 · 7H2O – 40 г/л, CuSO4 – 1 г/л, H3BO3 – 40 г/л и подключенные к источнику постоянного тока. Суспензию предварительно диспергировали ультразвуком. Опыт проводили при постоянном перемешивании для гомогенизации системы. После электроосаждения суспензию отфильтровывали на воронке Бюхнера через фильтр “синяя лента”, промывали дистиллированной водой, помещали фильтр с материалом в чашку Петри и оставляли в сушильном шкафу. В процессе пребывания Co/C в электролите, его фильтрования и высушивания происходило окисление наночастиц металлического кобальта, вследствие чего материал, полученный после завершения электролиза, представлял собой CoO/C (смотрите раздел “Результаты и обсуждение”).
Для осаждения платины на CoO/C-материалы использовали методику, боргидридного синтеза, описанную в [32]. Для определения количества кобальта и платины в синтезированных материалах использовали метод термического анализа: определяли массу веществ, остающихся в тигле после полного окисления углерода в результате 30-минутного нагревания при 800°С в воздушной атмосфере 5–10 мг Co3O4/C или Pt/(Co3O4/C). Кобальт при нагревании в муфельной печи образует оксид Co3O4, поэтому результаты термогравиметрии пересчитывали на чистый металл по формуле:
(1)
$\begin{gathered} \omega ({\text{Co}}) = \\ = \frac{{[m({\text{C}}{{{\text{o}}}_{{\text{3}}}}{{{\text{O}}}_{4}}) \cdot {\text{M}}({\text{Co}})]}}{{[m({\text{C}}{{{\text{o}}}_{{\text{3}}}}{{{\text{O}}}_{4}}) \cdot M({\text{C}}{{{\text{o}}}_{{\text{3}}}}{{{\text{O}}}_{4}}) + m({\text{C}}) \cdot M({\text{C}}{{{\text{o}}}_{{\text{3}}}}{{{\text{O}}}_{4}})]}}. \\ \end{gathered} $При термогравиметрическом определении платины расчет проводили с учетом массы ранее нанесенного на носитель оксида кобальта, по формуле:
(2)
$\omega ({\text{Pt}}) = \frac{{[m(о с т а т к а ) - m({\text{C}}{{{\text{o}}}_{{\text{3}}}}{{{\text{O}}}_{4}})]}}{{[m(н а в е с к и )]}}.$Для определения состава образцов и размера наночастиц (кристаллитов) CoO и Pt использовали метод порошковой дифракции на лабораторном источнике, автоматическом монокристальном дифрактометре ARLX’TRA с геометрией по Бреггу–Брентано. Типичные установки: 40 кВ, 35 мА, шаг сканирования 0.02 град в координатах 2θ. Скорость съемки от 4–8 град/мин для определения фазового состава, до 2 град./мин для более прецизионных измерений: положение пиков и их угловое уширение. Фазовый анализ проводили на основе данных, полученных из открытых источников, в том числе с использованием Crystallography Open Database (COD) [33].
Анализ рентгенограмм проводили с использованием пакета обработки данных SciDavIs, определяя методом аппроксимации функцией Лоренца положение пиков, их ширину на половине высоты (FWHM) и площадь. По дифрактограммам определяли средний размер кристаллитов как для платины, используя отражение (111), так и для оксида кобальта(II), пик (111). Определение среднего диаметра кристаллитов по формуле Шеррера (4) проводили как это описано в [34], подставляя cоответствующее значение ширины пика на половине его максимальной высоты (FWHM):
где λ − длина волны монохроматического излучения; FWHM − ширина пика на половине высоты (в радианах); Dhkl − средняя толщина “стопки” отражающих плоскостей в области когерентного рассеяния, т.е. средний диаметр кристаллитов; θ – угол отражения; K = 0.89 – постоянная Шеррера. Для учета инструментального уширения дифрактометр предварительно калибровали с использованием стандартного образца, в качестве которого применяли пластину из поликристаллического отожженного α-кварца с размером зерен от 2 до 4 микрон.Электрохимические измерения проводили в стандартной трехэлектродной ячейке при температуре 25°С. Потенциалы в работе приведены относительно обратимого водородного электрода (ОВЭ). Исследуемый катализатор наносили на торец вращающегося дискового электрода в виде каталитических “чернил”, как это описано в [35]. Для предварительной стандартизации электрода проводили 100 циклов развертки потенциала со скоростью 100 мВ/c в диапазоне 0.03–1.20 В. Для определения электрохимической активной площади поверхности (ЭХАП) применяли метод циклической вольтамперометрии. В качестве электролита использовали раствор 0.1 М HClO4, который в течение 30 мин продували аргоном перед началом опыта и далее при регистрации циклических вольтамперограмм (ЦВА). Расчет количества электричества при определении ЭХАП проводили по ранее описанной методике [34], интегрируя соответствующие области электрохимической адсорбции и десорбции водорода на ЦВА в координатах “ток–время” с использованием программного обеспечения AfterMath компании Pine Research Instrumentation. При этом учитывали фоновый ток, пошедший на заряд/разряд двойного электрического слоя. Таким образом, заряд был рассчитан как среднее значение количества электричества, соответствующего областям электрохимической адсорбции и десорбции водорода на платине, после вычитания количества электричества, затраченного на заряжение двойного электрического слоя. Все измерения ЭХАП были проведены при температуре 23 ± 2°С. Расчет проводили по формуле:
где Q – среднее значение (полусумма) количеств электричества (мкКл), затраченных на электрохимическую адсорбцию и десорбцию водорода; m – масса платины на электроде (г); 210 мкКл/см2 – количество электричества, необходимое для окисления монослоя атомарного водорода на 1 см2 истинной поверхности платины.После определения ЭХАП материалов проводили исследование их активности в реакции восстановления кислорода при скорости вращения электрода 1600 об/мин, предварительно зарегистрировав линейную вольтамперограмму в атмосфере аргона для дальнейшего “вычитания” ее из линейных вольтамперограмм, полученных в атмосфере кислорода, что позволяло учесть влияние побочных процессов: I = ${{I}_{{{{{\text{O}}}_{{\text{2}}}}}}}$ – IAr. Измерения проводили с использованием вращающегося дискового электрода в стандартной трехэлектродной ячейке с использованием 0.1 М HClO4 в качестве фонового электролита. Перед началом измерений для насыщения электролита кислородом через рабочий раствор продували О2 в течение 40 мин. Вольтамперограммы регистрировали в направлении от 0.02 до 1.2 В при скорости развертки потенциала 20 мВ с–1 и скоростях вращения дискового электрода: 400, 600, 1000, 1600 и 2400 об./мин. Потенциалы пересчитывали на шкалу обратимого водородного электрода (RHE) и корректировали на омическую составляющую электролита (R = 26 Ом).
Стабильность катализаторов оценивали методом вольтамперометрического циклирования в трехэлектродной ячейке в диапазоне потенциалов 0.6–1.4 В со скоростью развертки 100 мВ/с. Такой режим стресс-теста лучше соответствует работе топливного элемента в режиме “старт–стоп” [36], позволяет быстро установить различия в стабильности исследуемых катализаторов, а также дает возможность сопоставления результата с литературными данными [36–38]. Циклирование проводили в 0.1 М растворе HClO4 в атмосфере Ar при 25°C в течение 2000 циклов, при этом после каждых 100 циклов регистрировали две циклические вольтамперограммы (при скорости развертки потенциала 20 мВ/с, диапазон потенциалов – 0.03 до 1.26 В). По второй ЦВА проводили расчет ЭХАП так, как это описано ранее. Стабильность оценивали по изменению соотношения ЭХАПj/ЭХАП0, где j – число проведенных циклов стресс-теста (ЭХАП2000/ ЭХАП0).
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
На первом этапе исследования необходимо было подобрать такие условия электроосаждения (состав электролита кобальтирования, сила тока и продолжительность электролиза), которые позволяли бы получать материалы, содержащие не менее 5 мас. % кобальта. Учитывая пониженную термодинамическую стабильность металлических наночастиц по сравнению с объемной фазой, мы изначально исходили из предположения о том, что значительная часть образующихся в процессе электролиза наночастиц кобальта будет окисляться компонентами электролита (растворенный кислород, вода). Как будет показано ниже, фактическим продуктом электролиза, действительно, являлся композиционный материал, представлявший собой наночастицы оксида кобальта, нанесенные на микрочастицы углеродной сажи.
Варьирование состава электролита кобальтирования и условий электролиза позволило получить ряд двухкомпонентных систем и выявить основные закономерности формирования кристаллитов кобальта, подвергающихся последующему окислению компонентами среды, на поверхности частиц углеродного носителя. Результаты анализа состава полученных материалов приведены в табл. 1.
Таблица 1.
Зависимость массовой доли осажденного кобальта* от состава электролита и условий электролиза (количество пропущенного электричества Q = = 33.6 А мин)
| № | Название образца | I, А | τ, мин | ω(Co), мас. % |
|---|---|---|---|---|
| 1 | Co/C_1 | 0.5 | 67.2 | 0 |
| 2 | Co/C_2 | 1.6 | 21 | 3.1 |
| 3 | Co/C_3 | 1.0 | 33.6 | 4.8 |
| 4 | Co/C_4 (рН < 3) | 1.6 | 21 | 5.9 |
| 5 | Co/C_5 | 0.8 | 42 | 7.7 |
| 6 | Co/C_6 | 1.2 | 28 | 7.1 |
| 7 | Co/C_7 | 1.4 | 24 | 4.8 |
| 8 | Co/C_8 (рН > 3) | 1.6 | 21 | 4.4 |
При минимальной силе тока, равной 0.5 А, кобальта в образцах обнаружено не было (табл. 1, образец Co/C_1). Низкое содержание металла (≈3%) в образце, полученном из стандартного электролита кобальтирования (Co/C_2), а также высокий расход реактивов показали нецелесообразность применения данной системы. Снижение силы тока и увеличение времени электролиза (Q = const) способствовали некоторому увеличению содержания Co в материале (Со/C_3). Подкисление электролита приводило к снижению напряжения на ванне и дальнейшему росту содержания кобальта в материале до 5.9 мас. % (Co/C_4). При снижении силы тока до 0.8 A на углеродный носитель осаждалось максимальное в условиях опыта количество кобальта (образец Co/C_5), дальнейшее же увеличение тока вновь приводило к снижению содержания металла в углеродном носителе (образцы Co/C_5–Co/C_8). Наилучшие результаты с точки зрения достижения высокого содержания кобальта в полученном материале дал электролит состава (г/л): CoSO4 – 80; NiSO4 – 40; H3BO3 – 40; CuSO4 – 1 (табл. 1, образцы Co/C_3–Co/C_8). Из данной системы были получены материалы с содержанием кобальта от 4.4 до 7.7 мас. % металла. Таким образом, можно утверждать, что при токах ниже 0.5 A осаждения кобальта не происходит. Стандартный электролит кобальтирования не дал удовлетворительных результатов. Наиболее подходящим оказался электролит, состав которого приведен выше, и токовый интервал от 0.8 до 1.2 А, в котором были получены образцы с максимальным содержанием кобальта. При I > 1.2 A, так же как и при подкислении электролита, наблюдалось бурное выделение водорода, что приводило к снижению массовой доли осаждаемого металла. Побочная реакция выделения водорода была основной причиной снижения выхода по току кобальта в ходе электролиза.
Согласно результатам рентгенофазового анализа (рис. 1), в образцах Co/C_3–Co/C_8 преимущественно присутствует фаза CoO. Дифрактограммы образцов, полученных в различных условиях и содержащих различное количество оксида кобальта, качественно идентичны (рис. 1), поэтому для дальнейших исследований были выбраны 2 системы с содержанием кобальта 5.9 (Co/C_4) и 7.7 (Co/C_5) мас. % кобальта. Интенсивность пиков на дифракторгамме образца Co/C_5 несколько выше, так как он содержит большее количество CoО. Дополнительные слабо выраженные пики на рентгенограммах с большой долей вероятности можно отнести к смеси оксидов кобальта (рис. 1). Исходя из полученных дифрактограмм, по ширине характерного пика при 2θ = 36.4 был рассчитан средний размер кристаллитов оксида кобальта: для образца Co/C_5 он оказался равен 58 нм и для Co/C_4 – 98 нм. Таким образом, рост силы тока и присутствие в электролите небольших количеств кислоты (образец Co/C_4, табл. 1) приводили к укрупнению кристаллитов, образовавшихся в процессе электроосаждения. Отмеченная тенденция может быть полезна при выборе условий проведения электроосаждения металлов на дисперсный носитель.
Для уточнения состава полученных материалов для одного из них была снята циклическая вольтамперограмма (100 циклов) в растворе хлорной кислоты. На ЦВА образца с содержанием кобальта 7.7 мас. % (Co/C_5) (рис. 2) зафиксированы анодные пики, которые, судя по величине потенциала (Е = 0.4 В), обусловлены окислением металлического кобальта до кобальта(III) с образованием растворимого соединения. Полученные результаты свидетельствуют о присутствии кристаллитов металлического кобальта в образце, что позволяет говорить о неполном окислении образующихся при электроосаждении кристаллитов кобальта до CoО. С учетом формирования на поверхности углерода достаточно крупных кластеров CoО (от 58 до 98 нм) можно предположить, что окислению подвергаются только поверхностные атомы кобальта с образованием межатомных связей Co–О, тогда как внутри сохраняются неокисленные кристаллиты кобальта, т.е. образуется система по типу оболочка–ядро. Отсутствие отражений, характерных для металлического кобальта на соответствующих дифрактограммах (рис. 1), можно объяснить малыми количествами металлической фазы в материале.
Рис. 2.
Циклическая вольтамперограмма (100 циклов), полученные в ходе предобработки образца CoО/C (Co/C_5) в хлорной кислоте.

Растворение Co и постепенное вымывание растворимого соединения Co(III) из слоя, нанесенного на поверхность стеклографитового электрода, обусловливает постепенное уменьшение анодных пиков ЦВА в ходе циклирования (рис. 2). Пики на катодных кривых связаны с восстановлением CoО до Co (обратимый потенциал превращения в кислой среде равен 0.166 В). Поскольку количество CoО в пористом поверхностном слое снижается от цикла к циклу, катодные пики в процессе измерений также уменьшаются. Согласно диаграмме Пурбе, в кислой среде в изученной области потенциалов наиболее устойчивой формой существования кобальта является Co+2.
Для уточнения состава полученных материалов, а также для оценки их химической стабильности была проведена обработка Co/С_5-материала в хлорплатиновой кислоте, не содержащей восстановителя. Учитывая предположение о наличии в образцах металлического кобальта, интересно было проверить возможность осаждения платины на комбинированный носитель методом контактного обмена. Дифрактограммы обработанного образца и углеродного носителя Vulcan ХС72 представлены на рис. 3а. Очевидно, что на кривой обработанного образца появляется дополнительный пик, который, судя по величине 2θ, можно отнести к Pt(0) или к твердому раствору PtCo [39]. Появление кристаллитов платины в составе материала возможно в результате контактного замещения металлического кобальта платиной (восстановления платины металлическим кобальтом) и/или за счет окисления кобальта(II) до кобальта(III). В то же время интенсивность соответствующего платине отражения мала, и, следовательно, ее количество в образующемся материале тоже невелико. Слабая выраженность пика платины на дифрактограмме свидетельствует о невозможности формирования достаточного количества наночастиц этого металла на поверхности носителя методом контактного замещения кобальта. Поэтому для получения платинокобальтовых катализаторов был выбран метод боргидридного синтеза.
Рис. 3.
Рентгеновская дифрактограмма (а) углерода Vulcan ХС72 (1) и образца Co/C_5 (7.7% Co) (2), а также (б) его циклическая вольтамперограмма (2-й цикл) после обработки при перемешивании в растворе H2PtCl6

Циклическая вольтамперограмма обработанного в хлорплатиновой кислоте образца (рис. 3б) тоже отличается от ЦВА до обработки (рис. 2). На ней отсутствуют пики окисления кобальта и/или оксида кобальта(II), но появляются пики в водородной области, что может быть связано с адсорбцией и десорбцией атомарного водорода на/с поверхности наночастиц платины.
Проведенные эксперименты демонстрируют сложный характер превращений, протекающих на поверхности комбинированных носителей, содержащих металлический кобальт и оксид кобальта(II), в процессе химического осаждения на них наночастиц платины. Однако совместный анализ данных вольтамперометрии и рентгенофазового анализа позволяют сделать вывод, что в присутствии такого сильного восстановителя, как боргидрид натрия, даже в случае частичного растворения соединений кобальта, высока вероятность последующего совместного восстановления кобальта и платины с образованием наночастиц твердого раствора, содержащего оба металла.
По результатам анализа состава и структуры полученных CoO/C-образцов, в качестве исходных носителей для осаждения наночастиц платины были выбраны 2 материала с содержанием кобальта 5.9 (Co_4) и 7.7 (Co_5) мас. %. Состав и структура катализаторов, полученных после осаждения платины, были изучены методами рентгеновской дифрактометрии и термогравиметрии. В качестве образца сравнения был использован коммерческий Pt/C-электрокатализатор HiSPEC3000, дифрактограмма которого приведена на рис. 4 вместе с дифрактограммами образцов PtCo/C_4 и PtCo/C_5. По полуширине характерных пиков на соответствующих рентгенограммах были рассчитаны средние размеры НЧ платины (табл. 2).
Таблица 2.
Некоторые характеристики электрокатализаторов
| Образец | ω(Pt), % | Состав (расчет по закону Вегарда) | Средний размер кристаллитов Pt (PtCo), нм | ЭХАПм2/г (Pt) | Масс-активность, А/г (Pt) (при Е = 0.9 В) | Уд. кинет. ток,
А/м2 (Pt) (при Е = 0.9 В) |
E1/2, В (1600 об/мин) | Число электронов |
|---|---|---|---|---|---|---|---|---|
| PtCo/C_4 | 17 | ~Pt3Co | 2.1 ± 0.2 | 84 ± 10 | 152 | 1.80 | 0.90 | 3.9 |
| PtCo/C_5 | 14 | ~Pt3Co | 2.3 ± 0.2 | 94 ± 10 | 286 | 2.83 | 0.92 | 3.8 |
| JM20 | 20 | Pt | 2.2 ± 0.2 | 105 ± 10 | 128 | 1.22 | 0.89 | 4.2 |
Отметим, что на дифрактограммах образцов PtCo/C_4 и PtCo/C_5 отсутствуют отражения, характерные для оксидов кобальта. В то же время для них характерно смещение отражений платины в область больших значений углов 2θ (рис. 4а, 4б), что свидетельствует о формировании сплава платина-кобальт [27]. Следствием формирования разупорядоченного твердого раствора платины и кобальта является уменьшение параметра решетки образцов PtCo/C_4 (3.822 Å) и PtCo/C_5 (3.823 Å) по сравнению с чистой платиной (3.923 Å). Более точно концентрацию металла можно вычислить, экстраполяцией на графике зависимости величины параметра решетки от содержания металлов по закону Вегарда [40]. Результаты расчетов среднего размера металлических наночастиц (кристаллитов) и состава твердого раствора Pt–Co (по закону Вегарда) приведены в табл. 2. По-видимому, при нанесении платины на CoO/C-материалы, одновременно с химическим восстановлением платины(IV) боргидридом натрия происходит также восстановление кобальта(II) из его оксида. В результате на поверхности углеродного носителя формируются биметаллические наночастицы твердого раствора платина-кобальт.
Весьма интересным представляется сравнение результатов циклической вольтамперометрии полученных PtCo/C-образцов с таковыми для исходного CoO/C-материала (рис. 2). Циклические вольтамперограммы PtCo/C-материалов имеют характерную для платиноуглеродных систем форму (рис. 5), но различаются величинами токов и закономерностью их изменения в ходе предобработки. Очевидно, что вид всех полученных зависимостей существенно отличается от ЦВА для бесплатинового материала (рис. 2): на них отсутствуют пики растворения металлического кобальта (при Е = 0.4 В), что косвенно подтверждает формирование однофазной системы (твердого раствора) Pt–Co [39].
Рис. 5.
Циклические вольтамперограммы (100 циклов), полученные в ходе предобработки PtCo/C-материалов: а – PtCo/C_4; б – PtCo/C_5; в – JM20.
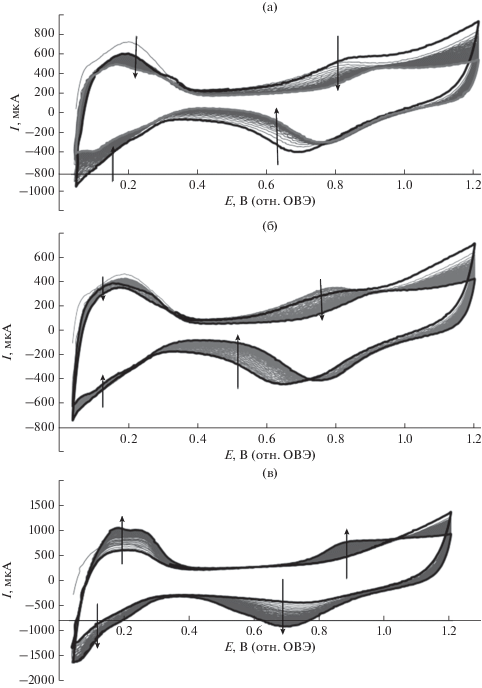
Согласно полученным результатам, на вольтамперных кривых (рис. 5) также отсутствуют пики, связанные с превращениями оксида кобальта(II), что хорошо коррелирует с данными рентгеновской дифрактометрии (рис. 4). Зато появляются характерные пики в водородной и кислородной областях. Вид полученных ЦВА (рис. 5) характерен для наноструктурных Pt/C- и PtM/C-электрокатализаторов, нанесенных на Vulkan XC-72. Несмотря на некоторое отличие состава образцов, они демонстрируют очень похожее поведение в ходе стандартизации. Так, для кобальтсодержащих образцов (рис. 5а, 5б) величины анодных и катодных токов, так же, как и площадь циклической вольтамперограммы, несколько снижаются в процессе стандартизации, происходит сдвиг характерных пиков в кислородной области в сторону положительных значений, что свидетельствует об изменениях в структуре катализатора. Возможно, реорганизация поверхностного слоя катализатора, из которого в ходе циклирования растворяются рентгеноаморфные оксиды кобальта, является причиной сужения двойнослойной области на кривых (рис. 5а, 5б).
В ходе стандартизации коммерческого образца JM20 (рис. 5в), в отличие от PtCo/C, отмечено расширение площади ЦВА в ходе предобработки; на кривых появляются более четкие максимумы в водородной и кислородной областях, наблюдается увеличение анодного и катодного тока. Все это свидетельствует об очистке и разработке поверхности платины.
Циклические вольтамперограммы стандартизированных электродов, по которым был произведен расчет ЭХАП (смотрите раздел “Экспериментальная часть”), представлены на рис. 6, а величины ЭХАП, рассчитанные по водородной области ЦВА, приведены в табл. 2. Несмотря на разные условия электроосаждения кобальта и некоторое отличие его содержания в образцах, ход кривых двух PtCo/C-материалов идентичен (рис. 6, кривые 1 и 2). Для коммерческого образца характерно существенное расширение двойнослойной области и увеличение удельных токов во всем диапазоне потенциалов (рис. 6, кривая 3). С учетом этих особенностей расчетная величина ЭХАП у JM20 и PtCo/C_5 оказалась достаточно высока (94–105 м2/г). Величина ЭХАП, рассчитанная для образца PtCo/C_4, была несколько меньше (84 м2/г), что может быть обусловлено более выраженной агрегацией наночастиц PtCo в этом материале (табл. 2).
Рис. 6.
Циклические вольтамперограммы (2-й цикл) PtCo/C-материалов: 1 – PtCo/C_4; 2 – PtCo/C_5; 3 – JM20.

Таким образом, PtCo/C-катализаторы в процессе предобработки (рис. 5а, 5б) и вольтамперограммы, зарегистрированные на стандартизированной поверхности изученных материалов (рис. 6), демонстрируют сходное поведение. Величина ЭХАП синтезированных PtCo/C-катализаторов, рассчитанная по водородной области ЦВА, изменяется в пределах от 84 до 94 м2/г в зависимости от условий синтеза и содержания кобальта в образцах CoO/C (табл. 2). Достаточно высокая ЭХАП полученных биметаллических катализаторов позволяет ожидать их высокой каталитической активности в РВК.
Сравнение потенциодинамических кривых, полученных на вращающемся электроде для Pt‒Co/C-электрокатализаторов (рис. 7), показало, что наибольшей активностью в РВК обладает образец PtCo/C_5, синтезированный на основе оксидноуглеродного материала с максимальным содержанием кобальта (7.7 мас. %). Согласно расчету, проведенному по закону Вегарда, он содержит фазу твердого раствора Pt3Co (табл. 2). Именно на этом образце РВК начинается при наиболее положительных потенциалах (рис. 7, кривая 2), для него характерно самое высокое значение потенциала полуволны (табл. 2).
Рис. 7.
Зависимость удельной скорости электровосстановления кислорода от потенциала электрода на образцах: 1 – PtCo/C_4; 2 – PtCo/C_5; 3 – JM20. Скорости развертки потенциала – 20 мВ/с, вращения диска – 1600 об/мин. 0.1 М HClO4, атмосфера O2.

Результаты обработки потенциодинамических кривых в координатах Коутецкого–Левича (1/i‒ω–0.5) позволяют разделить кинетическую и диффузионную составляющие тока по уравнению:
(5)
${1 \mathord{\left/ {\vphantom {1 i}} \right. \kern-0em} i} = {1 \mathord{\left/ {\vphantom {1 {{{i}_{{\text{k}}}}}}} \right. \kern-0em} {{{i}_{{\text{k}}}}}} + {1 \mathord{\left/ {\vphantom {1 {{{i}_{{\text{d}}}}}}} \right. \kern-0em} {{{i}_{{\text{d}}}}}} = {1 \mathord{\left/ {\vphantom {1 {{{i}_{{\text{k}}}}}}} \right. \kern-0em} {{{i}_{{\text{k}}}}}} + {1 \mathord{\left/ {\vphantom {1 {B{{\omega }^{{0.5}}}}}} \right. \kern-0em} {B{{\omega }^{{0.5}}}}},$Действительно, наибольшей активностью обладает образец PtCo/C_5, содержащий максимальное количество кобальта. Экстраполяция i–1,ω–0.5-прямой на ось ординат дает самое высокое значение кинетического тока именно для этого катализатора (табл. 2). Несмотря на близкие значения ЭХАП образца PtCo/C_5 и коммерческого материала, кобальтсодержащий катализатор обладает масс-активностью в РВК, более, чем в 2 раза превышающей активность образца JM20: 286 против 128 А/г (табл. 2). Возможной причиной повышенной активности данного образца в РВК может быть образование на поверхности углеродного носителя биметаллической системы оптимального состава/структуры, представляющей собой наночастицы твердого раствора состава Pt3Co, обладающего наиболее высокой ЭХАП. Масс-активность образца PtCo/C_4 в РВК оказалась близка к активности коммерческого материала JM20 (табл. 2, рис. 7, кривые 1, 3). Расчет количества электронов (n), участвующих в электрохимической стадии, показал, что для всех исследованных катализаторов величина n находится в интервале 3.8–4.2, что свидетельствует о 4-электронном разряде молекул кислорода.
Эксперименты по оценке стабильности образцов PtCo/C-катализаторов, проведенные в “жестком” режиме стресс-тестирования (см. раздел “Экспериментальная часть”), показали снижение их ЭХАП после 2000 циклов: с 84 до 49 м2/г для образца PtCo/C_4 (~42% от начальной величины) и с 94 до 83 для PtCo/C_5 (~12% от начальной величины) (табл. 3). Коммерческий Pt/C-электрокатализатор при этом подвергается значительно большей деградации: всего за 500 циклов его ЭХАП изменялась от 93 до 16 м2/г (Pt) [41]. Кроме снижения ЭХАП в ходе стресс-тестов наблюдался закономерный сдвиг потенциала полуволны в отрицательную область, поэтому масс-активность катализаторов после завершения стресс-теста была измерена при более низком потенциале – 0.80 В. По результатам измерений (рис. 8, табл. 3), образец с меньшим содержанием кобальта (PtCo/C_4) демонстрирует меньшую масс-активность, что согласуется с его более выраженной деградацией (табл. 2, 3). Таким образом, эксперименты, проведенные в режиме “жесткого” вольтамперометрического стресс-тестирования (диапазон потенциалов 0.6–1.4 В), показали, что лучший из полученных каталитических материалов PtCo/C_5 почти в 5 раз стабильнее, чем коммерческий платиноуглеродный образец JM20.
Таблица 3.
Характеристики (PtCo/C)-катализаторов после стресс-тестирования по сравнению с коммерческим материалом JM20 (диапазон потенциалов 0.6–1.4 В)
| Образец | Количество циклов | ЭХАП, м2/г | Масс-активность, А/г (Pt) при Е = 0.8 В (ОВЭ) | E1/2, В (ω = 1600 об/мин) | t, °C | Относительная стабильность, % |
|---|---|---|---|---|---|---|
| PtCo/C_4 | 2000 | 49 ± 6 | 122 | 0.86 | 25 | 58 |
| PtCo/C_5 | 2000 | 83 ± 10 | 163 | 0.87 | 25 | 88 |
| JM20 [41] | 500 | 16 ± 2 | – | – | 23 | 17 |
Рис. 8.
Потенциодинамические кривые электровосстановления кислорода на электродах: 1 и 3 – образец PtCo_4/C; 2 и 4 – образец PtCo_5/C; 1 и 2 – до испытаний; 3 и 4 – после испытаний на стабильность (2000 циклов). Скорости развертки потенциала – 20 мВ/с, вращения диска – 1600 об./мин. 0.1 М HClO4, атмосфера O2.

Мы полагаем, что предварительное формирование оксида кобальта на поверхности углеродного носителя способствует неоднородному распределению компонентов при последующем образовании Pt-Co-наночастиц (сегрегации платины в их поверхностных слоях). Закрепление биметаллических наночастиц на поверхности углеродного носителя может быть более прочным, чем в случае наночастиц чистой платины [42]. Все это, по-видимому, и обусловливает более высокую стабильность PtCo/C-катализаторов по сравнению с Pt/C.
ЗАКЛЮЧЕНИЕ
Вариация состава электролита и режима электролиза при электроосаждении кобальта на диспергированный углерод позволило получить серию материалов Co(CоО)/С c содержанием кобальта от 4.4 до 7.7 мас. %. Эти материалы преимущественно содержат оксид Co(II) и небольшие количества металлического кобальта, что дает основание сделать предположение о формировании в ходе электролиза сложно организованных наночастиц: кобальт, покрытый его оксидом CoО, по типу оболочка–ядро.
Использование полученных Co(CоО)/С-материалов в качестве носителей в процессе боргидридного восстановления Pt(IV) позволило получить платиносодержащие катализаторы, с массовой долей платины от 14 до 17 мас. %. Синтезированные Pt3Co/C-электрокатализаторы демонстрируют высокую электрохимически активную площадь поверхности (84–94 м2/г) и масс-активность в РВК, значительно превышающую соответствующую масс-активность коммерческого катализатора JM20.
Образование платинокобальтовых наночастиц на поверхности микрочастиц углерода приводит к существенному росту не только активности, но и стабильности электрокатализатора по сравнению с Pt/C. Cтабильность лучшего из полученных материалов PtCo/C_5 в режиме “жесткого” вольтамперометрического стресс-тестирования (диапазон потенциалов 0.6–1.4 В) превышает стабильность коммерческого Pt/C-образца JM20 почти в 5 раз.
Таким образом, легирование платины кобальтом в рамках оригинальной методики синтеза катализаторов повышает не только активность в РВК, но и стабильность катализаторов. Преимущества предложенного метода синтеза наноструктурированных электрокатализаторов заключаются в формировании частиц твердого раствора Pt3Co в ходе химического восстановления платины и оксида кобальта, предварительно сформированного на поверхности комбинированного носителя. Это приводит к образованию биметаллических наночастиц твердого раствора платина-кобальт, поверхность которых предположительно обогащена платиной. По-видимому, такой способ синтеза и обусловленные им особенности структуры катализатора и архитектуры биметаллических наночастиц, так же, как и позитивное влияние самого легирующего компонента, обеспечивают высокие активность и стабильность PtCo/C_5-катализатора в сравнении с коммерческим образцом Pt/C.
Каталитически активные материалы, исследованные в настоящей работе, получены в рамках выполнения государственного задания Министерства образования и науки РФ (проект № 13.3005.2017/4.6). Изучение электрохимического поведения PtCo/C-электрокатализаторов выполнено при поддержке РНФ (проект № 16-19-10115).
Список литературы
Guo, Q.Y., Zhang, J.H., Goddard, L., Huang, W.A., and Duan, X.F., Ultrafine jagged platinum nanowires enable ultrahigh mass activity for the oxygen reduction reaction, Science, 2016, vol. 354, p. 1414.
Thompsett, D., Catalysts for the Proton Exchange Membrane Fuel Cell. Handbook of Fuel Cells. Fundamentals, Technology and Applications. V. 3 Eds. Vielstich W. N.Y.: Wiley, 2003, p. 6.
Алексеенко, А.А., Беленов, С.В., Волочаев, В.А., Новомлинский И.Н., Гутерман В.Е. Cu@Pt/C катализаторы: синтез, структура, активность в реакции электровосстановления кислорода. Конденсированные среды и межфазные границы. 2016. Т. 18. № 4. С. 460.
Yang, H., Platinum-based electrocatalysts with core-shell nanostructures, Angewandte Chemie International Edition, 2011, vol. 50, no. 12, p. 2674.
Marković, N.M., Schmidt, T.J., Stamenković, V., and Ross, P.N., New Electrocatalysts for Fuel Cells, Fuel Cells, 2001, vol. 1, p. 105.
Paulus, U.A., Wokaun, A., Scherer, G.G., Schmidt, T.J., Stamenković, V., Marković, N.M., and Ross, P.N., Oxygen reduction on high surface area Pt-based alloy catalysts in comparison to well defined smooth bulk alloy electrodes, Electrochim. Acta, 2002, vol. 47, p. 3787.
Gasteiger, H.A., Kocha, S.S., Sompalli, B., and Wagner, F.T., Activity benchmarks and requirements for Pt, Pt-alloy, and non-Pt oxygen reduction catalysts for PEMFCs, Appl. Catal, B. Environ, 2005, vol. 56, p. 9.
Koh, S., Hahn, N., Yu, C., and Strasser, P., Effects of Composition and Annealing Conditions on Catalytic Activities of Dealloyed Pt–Cu Nanoparticle Electrocatalysts for PEMFC, J. Electrochem. Soc, 2008, vol. 155, p. 1281.
Wadayama, T., Yoshida, H., Ogawa, K., Todoroki, N., and Yamada, Y., Outermost Surface Structures and Oxygen Reduction Reaction Activities of Co/Pt(111) Bimetallic Systems Fabricated Using Molecular Beam Epitaxy, Phys. Chem. C, 2011, vol. 115, p. 18589.
Hubert, A., Gasteiger, Shyam, S., Kocha, Bhaskar, Sompalli, and Frederick, T., Wagner, Activity benchmarks and requirements for Pt, Pt-alloy, and non-Pt oxygen reduction catalysts for PEMFCS, Applied Catalysis B: Environmental, 2005, vol. 56, p. 9.
Antolini, E., Formation, microstructural characteristics and stability of carbon supported platinum catalysts for low temperature fuel cells, Journal of Materials Science, 2003, vol. 38, p. 2995.
Guo, S., Li, D., Zhu, H., Zhang, S., Markovic, N.M., Stamenkovic, V.R., and Sun S., FePt and CoPt Nanowires as Efficient Catalysts for the Oxygen Reduction Reaction, Chem. Int. Ed, 2013, vol. 52, p. 3465.
Jiang, K., Zhao, D., Guo, S., Zhang, X., Zhu, X., Guo, J., Lu, G., and Huang, X., Efficient oxygen reduction catalysis by subnanometer Pt alloy nanowires, Sci. Adv, 2017, vol. 3, e.1601705.
Munoz, M., Ponce, S., Zhang, G.R., and Etzold, B.J.M., Size-controlled PtNi nanoparticles as highly efficient catalyst for hydrodechlorination reactions, Appl. Catal. B: Environ, 2016, vol. 192, p. 1.
Jalan, V.M. and Taylor, E.J., Importance of Interatomic Spacing in Catalytic Reduction of Oxygen in Phosphoric Acid, J. Electrochem. Soc, 1983, vol. 130, p. 2299.
Toda, T., Igarashi, H., Uchida, H., and Watanabe, M., Enhancement of the Electroreduction of Oxygen on Pt Alloys with Fe, Ni, and Co, J. Electrochem. Soc, 1999, vol. 146, p. 3750.
Beard, B.C. and Ross, P.N., The Structure and Activity of Pt–Co Alloys as Oxygen Reduction Electrocatalysts, J. Electrochem. Soc. 1990. vol. 137, p. 3368.
Paffett, M.T., Berry, J.G., and Gottesfeld, S., Oxygen Reduction at Pt0.65Cr0.35, Pt0.2Cr0.8 and Roughened Platinum, J. Electrochem. Soc, 1988, vol. 135, p. 1431.
Xiong, L., Kannan, A.M., and Manthiram. A., Pt–M (M = Fe, Co, Ni and Cu) electrocatalysts synthesized by an aqueous route for proton exchange membrane fuel cells, Electrochem. Commun, 2002, vol. 4, p. 898.
Stamenkovic, V., Schmidt, T.J., Ross, P.N., and Markovic, N.M., Surface Composition Effects in Electrocatalysis: Kinetics of Oxygen Reduction on Well-Defined Pt 3 Ni and Pt 3 Co Alloy Surfaces, J. Phys. Chem, 2002, vol. 106, p. 11970.
Stamenkovic, V., Schmidt, T.J., Ross, P.N., and Markovic, N.M., Surface segregation effects in electrocatalysis: kinetics of oxygen reduction reaction on polycrystalline Pt3Ni alloy surfaces, J. Electroanal. Chem, 2003, V. 191, p. 554.
Salgado, J.R.C., Antolini, E., and Gonzalez, E.R., Structure and Activity of Carbon-Supported Pt−Co Electrocatalysts for Oxygen Reduction, J. Phys. Chem. B, 2004, vol. 108, p. 17767.
Min, M., Cho, J., Cho, K., and Kim, H., Particle size and alloying effects of Pt-based alloy catalysts for fuel cell applications, Electrochim. Acta, 2000, vol. 45, p. 4211.
Shukla, A.K., Neergat, M., Bera, P., Jayaram, V., and Hegde, M.S. Catalyst electrode preparation for PEM fuel cells by electrodeposition, J. Electroanal. Chem, 2001, vol. 111, p. 504.
Neergat, M., Shukla, A.K., K.S., and Gandhi, K.S., Effects of Heat Treatment on the Catalytic Activity and Methanol Tolerance of Carbon-Supported Platinum Alloys, J. Appl. Electrochem, 2001, vol. 31, p. 373.
Antolini, E., Formation of carbon-supported PtM alloys for low temperature fuel cells: a review, Mater. Chem. Phys, 2003, vol. 78, p. 563.
Гутерман, А.В., Пахомова, Е.Б., Гутерман, В.Е., Кабиров, Ю.В., Григорьев, В.П. Синтез наноструктурированных катализаторов PtxNi/С и PtxCo/С и их активность в реакции электровосстановления кислорода. Неорганические материалы. 2009. Т. 45. № 7. С. 829.
Moffat, T.P., Mallett, J.J., and Hwang, Sun-Mi., Oxygen Reduction Kinetics on Electrodeposited Pt, Pt100 −xNix, and Pt100 −xCox, Journal of The Electrochemical Society, 2009, vol. 156, p. B238.
Гутерман, В.Е., Новомлинский, И.Н., Алексеенко, А.А., Беленов, С. В., Цветкова, Г.Г., Балакшина, Е.Н. Способ получения катализатора с наноразмерными частицами платины, Патент РФ на изобретение, № 2616190(Россия), 13.04.2017 г., с. 16.
Гутерман, В.Е., Новомлинский, И.Н, Скибина, Л.М, Мауэр, Д.К. Способ получения наноструктурного материала оксида олова на углеродном носителе, Патент РФ на изобретение, № 2656914, 7.06.2018 г.
Kuriganova, A.B., Leontyeva, D.V., Ivanov, S., Bund, A., and Smirnova, N.V., Electrochemical dispersion technique for preparation of hybrid MOx–C supports and Pt/MOx–C electrocatalysts for low temperature fuel cells, J. Appl. Electrochem, 2016, vol. 46, p. 1245.
Alekseenko, A.A., Guterman, V.E., Volochaev, V.A., and Belenov, S.V. Effect of wet synthesis conditions on the microstructure and active surface area of Pt/C catalysts, Inorganic Materials, 2015, vol. 51, p. 1248.
Gražulis, S., Daškevič, A., Merkys, A., and Chateigner A., Crystallography Open Database (COD): an open-access collection of crystal structures and platform for world-wide collaboration, Nucleic Acids Research, 2012, vol. 40, p. 420.
Guterman V.E., Lastovina T.A., Belenov S.V., Tabachkova N.Yu., Vlasenko V.G., Khodos I.I., and Balakshina E.N. PtM/C (M = Ni, Cu, or Ag) Electrocatalysts: Effects of Alloying Components on Morphology and Electrochemically Active Surface Areas, J. Solid State Electrochem, 2014, vol. 18(5), p. 1307.
Kirakosyan, S.A., Alekseenko, A.A., Guterman, V.E., Volochaev, V.A., and Tabachkova, N.Yu., Effect of CO atmosphere on morphology and electrochemically active surface area in the synthesis of Pt/C and PtAg/C electrocatalysts, Nanotechnologies in Russia, 2016, vol. 11, № 5, p. 287.
Hasche, Frederic, Oezaslan, Mehtap, and Strasser, Peter, Activity, Stability, and Degradation Mechanisms of Dealloyed PtCu3 and PtCo3 Nanoparticle Fuel Cell Catalysts, Chem.Cat.Chem, 2011, vol. 3, p. 1805.
Hodnik, Nejc, Jozinovi, Barbara, Zorko, Milena, and Gaberek, Miran, Stability of Commercial Pt/CLow Temperature Fuel Cell Catalyst: Electrochemical IL-SEM Study, Acta Chim. Slov., 2014, vol. 61, p. 280.
Alekseenko, A.A., Moguchikh, E.A., Safronenko, O.I., and Guterman, V.E., Durability of de-alloyed PtCu/C electrocatalysts, Int. J. Of Hydrogen Energy, 2018, vol. 43 (51), p. 22885.
Козинкин, А.В., Власенко, В.Г., Куликова, О.В. и др. Электронное и атомное строение наноструктурных катализаторов платина-кобальт. Ж. структ. Химии. 2011. Т. 52. C. S79.
Гутерман, В.Е., Пустовая, Л.Е., Гутерман, А.В., Высочина, Л.Л. Боргидридный синтез Ptx-Ni/C катализаторов и исследование их активности в реакции электровосстановления кислорода. Электрохимия. 2007. Т. 43. № 9. С. 1147.
Могучих, Е.А., Алексеенко, А.А., Гутерман, В.Е. и др. Влияние состава и структуры PtCu/C электрокатализаторов на их стабильность при различных условиях стресс-тестирования. Электрохимия. 2018. Т. 54. № 11. С. 976.
Alekseenko, A.A., Guterman, V.E., Belenov, S.V., Menshikov, V.S., et al., Pt/C electrocatalysts based on the nanoparticles with the gradient structure, Int. J. of Hydrogen Energy, 2018, vol. 43, p. 3676.
Дополнительные материалы отсутствуют.




