Электрохимия, 2019, T. 55, № 5, стр. 515-522
Пористые наносферы LiMn2O4 в качестве материалов для катодов с длительным сроком службы для литий-ионных аккумуляторов высокой мощности
Сяолин Цуй a, b, c, Хуися Фен a, b, c, *, Цзинлян Лю c, Фенцзюянь Тан c, Хонлян Ли c
a Государственная ключевая лаборатория перспективных технологий и повторного использования цветных металлов, Технологический университет Ланчжоу
730050 Ланчжоу, Китай
b Школа материаловедения и инженерного дела, Технологический университет Ланчжоу
730050 Ланчжоу, Китай
c Колледж нефтехимической технологии, Технологический университет Ланчжоу
730050 Ланчжоу, Китай
* E-mail: judylut@gmail.com
Поступила в редакцию 21.04.2017
После доработки 09.11.2017
Принята к публикации 09.11.2017
Аннотация
Пористые сферы LiMn2O4 легко изготавливали из прекурсоров – сфер MnCO3 и MnO2 – и охарактеризовывали их структуру и эффективность в качестве катода в литий-ионном аккумуляторе. Наличие пор со средним размером около 50 нм во всех микросферах LiMn2O4 было подтверждено при помощи сканирующей электронной микроскопии (СЭМ) и измерений адсорбции–десорбции N2. Электрохимические исследования показывают, что синтезированный продукт отличается меньшей электрохимической поляризацией, более быстрой кинетикой интеркаляции иона Li и более высокой электрохимической стабильностью. Для него характерны отличная максимальная скорость заряда/разряда и циклируемость: обратимая разрядная емкость составляет 71 мА ч г−1 в режиме 5 C при сохранении емкости более 92% в режиме 0.5 C после 100 циклов. Отличные характеристики синтезированного продукта связаны с его особой структурой: это пористые вторичные сферические частицы, состоящие из первичных монокристаллических наночастиц. Наночастицы снижают диффузионный путь иона Li и повышают количество мест для внедрения/извлечения лития; поры обеспечивают пространство для амортизации изменения объема в процессе заряда–разряда, а монокристаллические наночастицы обеспечивают наилучшую стабильность шпинели. С учетом отличных электрохимических характеристик и легкого синтеза предлагаемые пористые сферы LiMn2O4 могут быть конкурентоспособным перспективным катодным материалом для высокоэффективных литий-ионных аккумуляторов.
ВВЕДЕНИЕ
Литий-ионные аккумуляторы широко применяются в электронных устройствах, таких как мобильные телефоны, цифровые камеры и ноутбуки, благодаря своей высокой удельной энергии и отличной циклируемости, однако они слишком дороги для широкомасштабного применения, например, в качестве источников питания электроустройств, по сравнению со свинцово-кислотными аккумуляторами [1, 2]. Шпинель LiMn2O4, благодаря низкой стоимости и экологичности, рассматривается как один из наиболее перспективных материалов катодов следующего поколения литий-ионных аккумуляторов [3–5]. Однако для LiMn2O4 характерно снижение емкости и низкая циклируемость вследствие растворения марганца и Ян–Теллеровского искажения [6–9]. Для улучшения стабильности LiMn2O4 использовали допирование [10–12] и нанесение покрытий [13–15], но эти стратегии приводили к потере емкости.
Другие подходы к улучшению характеристик катодов LiMn2O4 недавно были сосредоточены на снижении размера частиц до наноуровня [16–18]. Наночастицы обеспечивали меньший путь диффузии ионов Li+ в объеме LiMn2O4 и повышенную площадь контакта с электролитом для переноса электронов, что приводило к улучшенным максимальным скоростям заряда–разряда. Однако менее плотная упаковка наночастиц должна приводить к меньшей удельной объемной энергии, если не применять особые методы уплотнения [19].
Недавно был использован метод контролируемой кристаллизации для синтеза микросфер шпинели LiMn2O4 [20]. Вообще говоря, порошок LiMn2O4, состоящий из сферических частиц, может обеспечивать более высокую насыпную плотность благодаря плотной упаковке, которая позволяет улучшить удельную объемную энергию по сравнению с наночастицами нерегулярной формы [21]. Однако твердые сферы отличаются очень длинными путями транспорта ионов и электронов по сравнению с наночастицами, поскольку электролит не может свободно проникать во внутреннее пространство твердых сфер. Таким образом, катодный материал из пористых микросфер, представляющих собой плотноупакованные нанокристаллиты, образующие трехмерные электронные и ионные каналы, должен обладать идеальной структурой [22]. Поры обеспечивают пространство для компенсации структурных напряжений вследствие процессов внедрения/извлечения ионов Li+ и снижают напряжение в решетке, вызванной Ян–Теллеровским искажением при циклировании, что приводит к улучшенной циклируемости.
Гуо и соавторы использовали новый подход с применением самостоятельных шаблонов для изготовления твердосферной шпинели LiMn2O4 с насыпной плотностью до 2.67 г см–3. Однако прекурсор Mn3O4 изготавливали при помощи гидротермического метода и прокаливали при более высокой температуре, 1100°С. Этот процесс неудобен для промышленного применения [23]. В этой работе мы сообщаем о пористых сферах LiMn2O4, состоящих из нанокристаллитов, полученных методом простого осаждения, для применения в качестве материала катода для перезаряжаемых литиевых аккумуляторов. Для характеризации их структуры применяли рентгенодифракционный анализ, СЭМ и измерения адсорбции–десорбции N2. Важно, что, как ожидается, синтезированный продукт LiMn2O4 без допирования катионами или нанесения покрытия на поверхность, будет благодаря пористой структуре демонстрировать более высокие электрохимические характеристики, такие как отличная максимальная скорость заряда–разряда и долгосрочная циклируемость. Поэтому мы использовали электрохимические измерения для объяснения этих характеристик.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Изготовление пористых сфер LiMn2O4 включает три стадии. Во-первых, были изготовлены сферические MnCO3 и Mn(OH)2 путем простого метода осаждения с применением Mn(Ac)2 · 4H2O (квалификация для анализа) в качестве источника марганца и Na2CO3–NaOH (8 : 1 по молярной массе) в качестве осадителей. Mn(Ac)2 · 4H2O (0.04 М) и Na2CO3–NaOH (0.045 М) по отдельности растворяли в дистиллированной воде. Затем оба раствора нагревали при перемешивании до 90°C. После полного растворения Mn(Ac)2 и Na2CO3–NaOH к раствору Mn(Ac)2 добавляли раствор Na2CO3–NaOH. При этом раствор становится молочно-белым, что указывало на первичное формирование сфер MnCO3 и Mn(OH)2. Во-вторых, добавляли 20 мл H2O2 (30 вес. %) к этому молочно-белому раствору, получая черный раствор с ионами марганца в высокой степени окисления. Смесь выдерживали в течение 3 ч, затем полученные порошки отделяли, промывали несколько раз дистиллированной водой и сушили на воздухе при 120°C в течение 24 ч. В-третьих, смеси MnCO3, MnO2 и LiNO3 в молярном отношении 2 : 1.05 (Mn : Li) соответствующим образом измельчали в агатовой ступке с применением этанола в качестве диспергатора и сушили при 80°C и окончательно прокаливали при 700°C в течение 10 ч при скорости нагрева 5°C мин−1 на воздухе, получая пористые сферы LiMn2O4 (обозначаемые как ПС LiMn2O4). Для сравнения синтезировали агрегированные сферы LiMn2O4 (обозначаемые как АС LiMn2O4) путем прокаливания смеси электролитического диоксида марганца и LiNO3 при 700°C в течение 10 ч.
Морфологию материалов изучали при помощи сканирующей электронной микроскопии (СЭМ, JSM-5600, Япония) и просвечивающей электронной микроскопии (ПЭМ, FEI Tecnai G2 F20). Кристаллическую структуру образцов анализировали при помощи рентгенодифракционного анализа (Rigaku, D/Max-2400) с излучением CuKα (40 кВ, 150 мА, шаг 0.02°/с). Распределение размеров пор определяли при помощи метода Брунауэра–Эмметта–Теллера (BET, Micromeritics ASAP 2020 M) при температуре жидкого азота (77 K).
Электрод для электрохимических измерений изготавливали путем смешивания 84 вес. % активного вещества с 8 вес. % ацетиленовой сажи и 8 вес. % поливинилидендифторида (PVDF) в качестве связующего. Эти материалы диспергировали в 1-метил-2-пирролидиноне (NMP) и полученную суспензию наносили на алюминиевую фольгу, которую использовали в качестве противоэлектрода во время электрохимических измерений. Использовали плоский круглый аккумулятор CR2032, который собирали в наполненном аргоном перчаточном боксе; изготовленный электрод применяли в качестве катода, литиевую фольгу – в качестве анода, Celgard 2400 – в качестве сепаратора и 1.0 М LiPF6 в этиленкарбонате (EC)/диметилкарбонате (DMC) (1 : 1 по объему) – в качестве электролита.
Тест на заряд–разряд осуществляли при помощи системы Landt (Landt CT2001A, Ухань, Китай). Элементы циклировали между 3.5 и 4.3 В (отн. Li/Li+) при 25°C. Годографы электрохимического импеданса для положительного электрода измеряли при помощи трехэлектродных ячеек (отрицательный и положительный электроды, соответственно, использовали в качестве рабочих электродов, а пластины лития использовали и как противоэлектроды, и как электрод сравнения) при помощи электрохимического анализатора CHI660C (Шанхай, Китай). Измерения импеданса, соответственно, проводили для полностью делитированного состояния при 4.3 В для полуэлементов LiMn2O4/Li. На каждый электрод накладывали синусоидальное возмущение потенциала амплитудой 5 мВ в диапазоне частот от 100 кГц до 10 мГц.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
На рис. 1а–1г приведены изображения СЭМ и дифрактограмма электронной дифракции на отдельных участках (SAED) (рис. 1ж) образца ПС LiMn2O4, а также для сравнения изображения СЭМ АС LiMn2O4 (рис. 1д, 1е). Изображение СЭМ в низком разрешении (рис. 1а) показывает, что продукт состоит из однородных сфер со средним диаметром 750 нм (рис. 1б), которые очевидно получены из прекурсора MnCO3. На рис. 1в показано, что сферы LiMn2O4 пористые и состоят из первичных наночастиц размером 200 нм. В то же время, дифрактограмма SAED для ПС LiMn2O4 указывает, что все точки дифракции центросимметричны, что является убедительным доказательством монокристалличности наноматериалов. Сечение разломанной сферы на рис. 1г также показывает, что по всему объему сферы LiMn2O4 распределено значительно количество пор, образующих соединенные между собой трехмерные каналы. Как показано на рис. 1д и 1е порошки АС LiMn2O4 состоят из нерегулярных агломератов с размером частиц около 250 нм.
Рис. 1.
Фотографии СЭМ (а–г) и электронной дифракции на отдельных участках (SAED), (ж) ПС LiMn2O4 и фотографии СЭМ (д, е) АС LiMn2O4.

Дифрактограммы свежеприготовленного катода показаны на рис. 2. Дифракционные пики соответствуют структуре кубической шпинели LiMn2O4 (JCPDS № 35-0782, Fd3m, пространственная группа 227). В соответствии с дифракционными данными был рассчитан параметр решетки для пористого LiMn2O4, a = 8.25124 Å; насыпная плотность составляет около 1.79 г см–3. Результаты хорошо согласуются с относительными значениями из литературы [24, 25]. Острые и интенсивные дифракционные пики также говорят о высокой степени кристалличности и высокой чистоте продуктов. Это свидетельствует об успешном приготовлении чистой фазы порошков LiMn2O4 из таких прекурсоров, как сферы MnCO3 и MnO2, при помощи обычной твердофазной реакции. Из рис. 2 также можно видеть, что преобладающие плоскости hkl, такие как 111, 311, 400, – это плоскости, обладающие наиболее высокой термодинамической стабильностью, что ясно указывает на то, что приготовленная при помощи данного метода кристаллическая структура LiMn2O4 более устойчива [26].
Для определения распределения размеров пор и площади поверхности по методу БЭТ измеряли изотермы адсорбции и десорбции на образце ПС LiMn2O4. На рис. 3 показана изотерма адсорбции–десорбции N2 и кривая распределения размеров пор (вставка). Для пористых ПС LiMn2O4 площадь поверхности по БЭТ равна примерно 5.46 м2 г−1, а средний диаметр пор по BJH составляет около 50 нм. Кроме того, кривые свидетельствуют об обилии мезопор в пористых ПС LiMn2O4, что хорошо согласуется с данными изображений СЭМ. Данные говорят о том, что пористые сферы LiMn2O4 обладают большой площадью контакта с электролитом и, таким образом, могут обеспечить интенсивный поток ионов лития через границу раздела [27].
Рис. 3.
Изотерма адсорбции/десорбции азота и график распределения Барретта–Джойнера–Халенда (BJH) размеров пор (вставка) для ПС LiMn2O4.

Были изучены электрохимические характеристики пористых сфер LiMn2O4 в качестве катодного материала для литий-ионного перезаряжаемого аккумулятора. На рис. 4а показана типичная зарядно-разрядная кривая для ПС LiMn2O4 и АС LiMn2O4 в режиме 0.1 C между 3.5 и 4.3 В. Как зарядные, так и разрядные кривые явно демонстрируют по два плато напряжения, отвечающие двум различным процессам внедрения (или извлечения) иона лития [28]. Один из них соответствует извлечению ионов лития из половины тетраэдрических центров с взаимодействием Li–Li, а другой – извлечению из другой половины тетраэдрических центров без взаимодействия Li–Li [29–32]. Разность потенциалов около 100 мВ между этими двумя процессами извлечения связана с отталкиванием между ионами лития [32, 33]. При 0.1 C (1 C = 148 мА ч г−1) между 3.5 и 4.3 В исходная удельная разрядная емкость катода ПС LiMn2O4 и АС LiMn2O4 составляет 138.7 и 130.9 мА ч г−1, соответственно.
Рис. 4.
Электрохимические характеристики ПС LiMn2O4 и АС LiMn2O4: (а) исходные кривые заряда–разряда при 0.1 C; (б) дифференциальная емкость при 0.1 C; (в) максимальная скорость заряда–разряда; (г) циклируемость при комнатной температуре при 0.5 C.
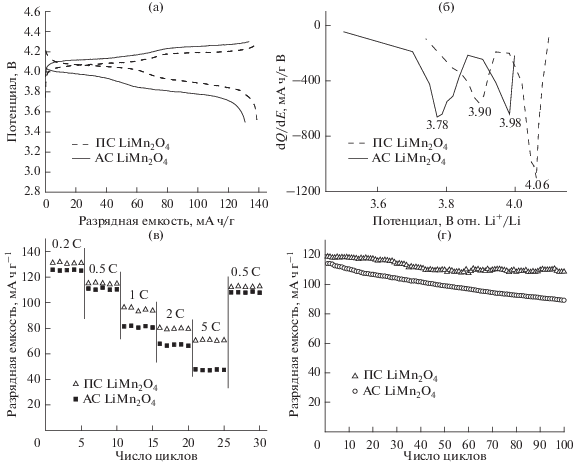
Для дальнейшего анализа разрядных потенциалов на рис. 4б показана дифференциальная емкость (dQ/dV отн. потенциала элемента), полученная из гальваностатической разрядной кривой. Можно видеть, что эти два пика соответствуют плато на разрядных кривых на рис. 4б. Потенциалы разряда для элемента ПС LiMn2O4/Li составляют 3.90 и 4.06 В, соответственно, а в случае элемента АС LiMn2O4 /Li – 3.78 и 3.98 В для 0.1 C, соответственно. Из рис. 4б очевидно, что средние плато разряда элемента ПС LiMn2O4/Li выше, чем в случае элемента АС LiMn2O4/Li. Кроме того, доля емкости на плато разряда при 4.06 В для элемента ПС LiMn2O4/Li равна 69.5%, а доля емкости на плато разряда при 3.98 В для элемента ПС LiMn2O4/Li равна 29.6%. Можно заключить, что для элемента ПС LiMn2O4/Li характерна более низкая электрохимическая поляризация. Иначе говоря, по сравнению с АС LiMn2O4 ПС LiMn2O4 обеспечивают более высокое рабочее напряжение и более привлекательны для применения в больших накопителях энергии, требующих более высокой удельной мощности, как в случае электромобилей и гибридных электромобилей.
На рис. 4в проведено сравнение максимальной скорости заряда–разряда ПС LiMn2O4 и АС LiMn2O4 при режиме заряда/разряда от 0.2 до 5 C. ПС LiMn2O4 очевидно демонстрируют более медленный спад емкости с увеличением скорости разряда. Наблюдается медленно спадающая зависимость вплоть до 5 C достижением разрядной емкости 71 мА ч г−1. Напротив, было найдено, что емкость АС LiMn2O4 быстро снижалась при высокой скорости разряда, она составляла только 47 мА ч г−1 при 5 C. После 20 циклов с постоянно меняющейся скоростью разряда разрядная емкость ПС LiMn2O4 все еще составляет 113 мА ч г−1 при возвращении в режим 0.5 C; однако АС LiMn2O4 в том же режиме демонстрируют емкость, равную всего лишь 108 мА ч г−1. Хорошее сохранение емкости в случае ПС LiMn2O4 после циклирования при постоянно меняющейся скорости разряда говорит о том, что их структура стабильна. Очевидно, отличная максимальная скорость заряда/разряда связана с высокопористой структурой и большой активной площадью поверхности. Поры позволяют электролиту попадать внутрь и повышать площадь контакта между наночастицами и электролитом при внедрении/извлечении лития, а наноразмер частиц снижает диффузионный путь иона лития внутри частиц. Такое поведение совпадает с данными анализа СЭМ и БЭТ.
На рис. 4г показана циклируемость ПС LiMn2O4 и АС LiMn2O4 в режиме 0.5 C. После 100 циклов в режиме 0.5 C разрядная емкость ПС LiMn2O4 все еще сохранялась на уровне 92% от первого цикла, что гораздо больше, чем 78% сохраняемой емкости в случае АС LiMn2O4. Отличная циклируемость ПС LiMn2O4 связана с их особой архитектурой. Внутреннее пространство сфер может компенсировать изменения объема во время процессов внедрения/извлечения лития и может снижать напряжение в решетке, вызванное Ян–Теллеровским искажением при циклировании, тогда как монокристалличность обеспечивает наилучшую стабильность структуры.
На рис. 5 показаны годографы электрохимического импеданса аккумуляторов для различных образцов электродов в полностью делитированном состоянии при 4.3 В (запирающее напряжение процесса разряда для элементов LiMn2O4/Li). На графике по горизонтальной оси отложена действительная компонента импеданса (Z '), а по вертикальной оси – мнимая компонента импеданса (Z "). Годографы представляют собой сочетание депрессированной полуокружности в области высоких и средних частот и наклонной линии в низкочастотной области. Отсечка на оси Z ' соответствует омическому сопротивлению (Rs); из полуокружности можно определить сопротивление миграции иона лития (Rf) через многослойные поверхностные пленки и сопротивление переноса заряда (Rct) в области высоких и средних частот. Как следует из рис. 5, Rct для ПС LiMn2O4 очевидно ниже, чем в случае образца АС LiMn2O4. Более высокое сопротивление переноса заряда (Rct) элемента АС LiMn2O4 означает большую потерю емкости в режимах высокой скорости заряда/разряда, что хорошо согласуется с емкостными данными различных режимов разряда. Кроме того, наклонная линия в низкочастотной области, связанная с диффузией иона лития в частицах LiMn2O4, отвечает импедансу Варбурга (σw) [34]. Для вычисления коэффициента диффузии иона лития DLi+ использовали следующее упрощенное уравнение [35]:
Значения DLi+ в ПС LiMn2O4 и АС LiMn2O4, рассчитанные согласно приведенному выше уравнению и рис. 5, равны 1.948 × 10–9 и 1.068 × × 10–9 см2 с–1, соответственно. Таким образом, пористый LiMn2O4 обеспечивает более быструю кинетику интеркаляции ионов Li.
Вычислены параметры импедансных спектров и определены параметры эквивалентной схемы при помощи программного пакета Z View, как показано на рис. 5.
ЗАКЛЮЧЕНИЕ
В данной статье представлены пористые сферы LiMn2O4 с отличной максимальной скоростью заряда/разряда и циклируемостью при использовании в качестве катода литий-ионного аккумулятора. Пористые сферы LiMn2O4, состоящие из монокристаллических сфер, были успешно синтезированы с применением в качестве прекурсоров сфер MnCO3 и MnO2. Наличие пор со средним размером около 50 нм во всех микросферах LiMn2O4 и распределение размеров пор было подтверждено при помощи СЭМ и измерений адсорбции–десорбции N2. Исследование заряда–разряда показало, что для элемента ПС LiMn2O4/Li характерна более низкая электрохимическая поляризация, и он может обеспечить большее рабочее напряжение. Он обладает обратимой разрядной емкостью 71 мА ч г−1 в режиме 5 C при сохранении емкости более 92% в режиме 0.5 C после 100 циклов. Отличные характеристики связаны с особой архитектурой синтезированного LiMn2O4. Наночастицы снижают диффузионный путь иона Li и повышают количество мест для внедрения/извлечения лития; поры обеспечивают пространство для амортизации изменения объема в процессе заряда–разряда, а монокристалличность обеспечивает наилучшую стабильность шпинели. С учетом отличных электрохимических характеристик и легкого синтеза предлагаемые пористые сферы LiMn2O4 могут быть конкурентоспособным перспективным катодным материалом для высокоэффективных литий-ионных аккумуляторов для применения в ближайшем будущем в электромобилях и гибридных электромобилях.
Список литературы
Farmann, A. and Sauer, D.U., A comprehensive review of on-board State-of-Available-Power prediction techniques for lithium-ion batteries in electric vehicles, J. Power Sources, 2016, vol. 329, p. 123.
Lin, D., Liu, Y., and Cui, Y., Reviving the lithium metal anode for high-energy batteries, Nature Nanotech., 2017, vol. 12, p. 194.
Mao, F.X., Guo, W., and Ma, J.M., Research progress on design strategies, synthesis and performance of LiMn2O4-based cathodes, RSC Adv., 2015, vol. 5, p. 105248.
Xu, G., Liu J., Zhang, C., Cui, G., and Chen, L., Strategies for improving the cyclability and thermo-stability of LiMn2O4-based batteries at elevated temperatures, J. Mater. Chem. A, 2015, vol. 3, p. 4092.
Liu, Q.L., Wang, S.P., Tan, H.B., Yang, Z.G., Zeng, J., et al., Preparation and doping mode of doped LiMn2O4 for Li-ion batteries, Energies, 2013, vol. 6, p. 1718.
Li, B., Wang, Y., Rong, H., Wang, Y., Liu, J., Xing, L., Xu, M., and Li, W., A novel electrolyte with the ability to form a solid electrolyte interface on the anode and cathode of a LiMn2O4/graphite battery, J. Mater. Chem. A, 2013, vol. 1, p. 12954.
Yang, L.D., Xie, J., Cao, G.S., and Zhao, X.B., Single-crystalline LiMn2O4 nanotubes synthesized via template-engaged reaction as cathodes for high-power lithium ion batteries, Adv. Funct. Mater., 2011, vol. 21, p. 348.
Wang, J.G., Jin, D.D., Liu, H.Y., Zhang, C.B., Zhou, R., Shen, C., Xie, K.Y., and Wei, B.Q., All-manganese-based Li-ion batteries with high rate capability and ultralong cycle life, Nano Energy, 2016, vol. 22, p. 524.
Lee, S., Cho, Y., Song, H.K., Lee, K.T., and Cho, J., Carbon-coated single-crystal LiMn2O4 nanoparticle clusters as cathode material for high-energy and high-power lithium-ion batteries, Angew. Chem. Int. Ed. Engl., 2012, vol. 51, p. 8748.
Xiong, L., Xu, Y., Tao, T., and Goodenough, J.B., Synthesis and electrochemical characterization of multi-cations doped spinel LiMn2O4 used for lithium ion batteries, J. Power Sources, 2012, vol. 199, p. 214.
Dai, K., Mao, J., Li, Z., Zhai, Y.C., Wang, Z.H., Song, X.Y., Battaglia, V., and Liu, G., Microsized single-crystal spinel LAMO for high-power lithium ion batteries synthesized via polyvinylpyrrolidone combustion method, J. Power Sources, 2014, vol. 248, p. 22.
Jiang, Q.Q., Liu, D.D., Zhang, H., and Wang, S., Plasma-assisted sulfur doping of LiMn2O4 for high-performance lithium-ion batteries, J. Phys. Chem. C, 2015, vol. 119, p. 28776.
Zhao, J., Qu, G., Flake, J.C., et al., Low temperature preparation of crystalline ZrO2 coatings for improved elevated-temperature performances of Li-ion battery cathodes, Chem. Commun., 2012, vol. 48, p. 8108.
Zhang, C.C., Liu, X.Y., Su, Q.L., Wu, J.H., Huang, T., and Yu, A.S., Enhancing electrochemical performance of LiMn2O4 cathode material at elevated temperature by uniform nanosized TiO2 coating, ACS Sustain. Chem. Eng., 2017, vol. 5, p. 640.
Patel, R.L., Park, J., and Liang, X.H., Ionic and electronic conductivities of atomic layer deposition thin film coated lithium ion battery cathode particles, RSC Adv., 2016, vol. 6, p. 98768.
Yang, G.R., Wang, L., Wang, J.N., and Yan, W., Tailoring the morphology of one-dimensional hollow LiMn2O4 nanostructures by single-spinneret electrospinning, Mater. Lett., 2016, vol. 177, p. 13.
Hung, I.M., Yang, Y.C., Su, H.J., and Zhang, J., Influences of the surfactant on the performance of nano-LiMn2O4 cathode material for lithium-ion battery, Ceram. Int., 2015, vol. 41, p. S779.
Jiang, H., Fu, Y., Hu, Y.J., Yan, C.Y., Zhang, L., Lee, P. S., and Li, C.Z., Hollow LiMn2O4 Nanocones as superior cathode materials for lithium- ion batteries with enhanced power and cycle performances, Small, 2014, vol. 10, p. 1096.
Wang, F.X., Xiao, S.Y., Zhu, Y.S., Chang, Z., Hu, C.L., Wu, Y.P., and Holze, R., Spinel LiMn2O4 nanohybrid as high capacitance positive electrode material for supercapacitors, J. Power Sources, 2014, vol. 246, p. 19.
Li, J., Zhang, X., Peng, R.F., Huang, Y.J., Guo, L., and Qi, Y.C., LiMn2O4/graphene composites as cathodes with enhanced electrochemical performance for lithium-ion capacitors, RSC Adv., 2016, vol. 6, p. 54866.
Li, S., Wei, X.G., Chang, Z.R., Chen, X.N., Yuan, X.Z., and Wang, H.J., Facile fabrication of LiMn2O4 microspheres from multi-shell MnO2 for high-performance lithium-ion batteries, Mater. Lett., 2014, vol. 135, p. 75.
Deng, J.Q., Pan, J., Yao, Q.R., Wang, Z.M., Zhou, H.Y., and Rao, G.H., Porous core-shell LiMn2O4 microellipsoids as high-performance cathode materials for Li-ion batteries, J. Power Sources, 2015, vol. 278, p. 370.
Guo, D.L., Chang, Z.R., Tang, H.W., Li, B., Xu, X.H., Yuan, X.Z., and Wang, H.J., Electrochemical performance of solid sphere spinel LiMn2O4 with high tap density synthesized by porous spherical Mn3O4, Electrochim. Acta, 2014, vol. 123, p. 254.
Zhou, Y.B., Deng, Y.F., Yuan, W.H., and Chen, G.H., Synthesis of spinel LiMn2O4 microspheres with durable high rate capability, Trans. Nonferrous Met. Soc., 2012, vol. 22, p. 2541.
Tang, H., Chang, Z., Zhao, H., Yuan, X.Z., Wang, H.J., and Gao, S.Y., Effects of precursor treatment on the structure and electrochemical properties of spinel LiMn2O4 cathode, J Alloy. Compd., 2013, vol. 566, p. 16.
Ragavendran, K., Chou, H.L., Lu, L., Lai, M.O., Hwang, B.J., Ravi Kumar, R., Gopukumar, S., Emmanuel, B., Vasudevan, D., and Sherwood, D., Crystal habits of LiMn2O4 and their influence on the electrochemical performance, Mater. Sci. Eng. B, 2011, vol. 176, p. 1257.
Arico, A.S., Bruce, P., Scrosati, B., Tarascon, J.M., and Van, S.W., Nanostructured materials for advanced energy conversion and storage devices, Nat. Mater., 2005, vol. 4, p. 366.
Ouyang, C., Shi, S., Wang, Z., Huang, X., and Chen, L., Experimental and theoretical studies on dynamic properties of Li ions in LixMn2O4, Solid State Commun., 2004, vol. 130, p. 501.
Sun, W., Cao, F., Liu, Y., Zhao, X., Liu, X., and Yuan, J., Nanoporous LiMn2O4 nanosheets with exposed {111} facets as cathodes for highly reversible lithium-ion batteries, J. Mater. Chem., 2012, vol. 22, p. 20962.
Goodenough, J.B. and Kim, Y., Challenges for Rechargeable Li Batteries, Chem. Mater., 2010, vol. 22, p. 587.
Hosono, E., Kudo, T., Honma, I., Matsuda, H., and Zhou, H., Synthesis of single crystalline spinel LiMn2O4 nanowires for a lithium ion battery with high power density, Nano Lett., 2009, vol. 9, p. 1045.
Goodenough, J.B. and Park, K.S., The Li-ion rechargeable battery: a perspective, J. Am. Chem. Soc., 2013, vol. 135, p. 1167.
Ellis, B.L., Lee, K.T., and Nazar, L.F., Positive electrode materials for Li-ion and Li-batteries, Chem. Mater., 2010, vol. 22, p. 691.
Striebel, K.A., Sakai, E., and Carins, E.J., Impedance studies of the thin film LiMn2O4/electrolyte interface, J. Electrochem. Soc., 2002, vol. 149, p. A 61.
Jin, Y.C. and Duh, J.G., Kinetic study of high voltage spinel cathode material in a wide temperature range for lithium ion battery, J. Electrochem. Soc., 2017, vol. 164, p. A735.
Дополнительные материалы отсутствуют.
Инструменты
Электрохимия




