Журнал физической химии, 2021, T. 95, № 10, стр. 1474-1480
Коэффициенты активности в системах тетрахлорэтилен–н-алкан
И. Г. Яковлев a, *, И. К. Гаркушин a, А. В. Колядо a
a Самарский государственный технический университет
443100 Самара, Россия
* E-mail: yakovlev.ivan.g@gmail.com
Поступила в редакцию 06.03.2021
После доработки 20.03.2021
Принята к публикации 22.03.2021
Аннотация
Проведено сравнение теоретических методов и экспериментального исследования положения эвтектик в двухкомпонентных системах, состоящих из тетрахлорэтилен и н-алканов с числом атомов углерода от 10 до 20. Приведены данные по составу эвтектик, их температурам плавления и коэффициентам активности каждого компонента, рассчитанные тремя методами: по данным эксперимента, методом UNIFAC и модифицированным методом UNIFAC Dortmund. Теоретически исследованы равновесия фаз “жидкость–твердое тело” по уравнению Шредера и методами UNIFAC и модифицированный UNIFAC Dortmund. Приведены экспериментальные данные, полученные методом ДТА. Определены относительные отклонения температуры плавления и состава эвтектик, полученные каждым расчетным методом, от эксперимента.
Алканы нормального строения и их галогенпроизводные широко применяются в качестве растворителей в химической, лакокрасочной, полимерной промышленности. Данные вещества используются как однокомпонентные растворители, так и в составе композиций из двух и более компонентов. Вместе с тем, в настоящее время является актуальной задачей поиск новых составов растворителей, которые можно применять в условиях крайнего севера и которые будут отличаться избирательностью и эффективностью. Поиск новых растворителей ведут в том числе через исследование равновесия фаз “жидкость–твердое тело” и “жидкость–пар” в смесях из двух и более компонентов. Такие исследования зачастую сопряжены с большим количеством экспериментальных работ, которые требуют дорогостоящего оборудования и значительного количества времени. Для сокращения объема экспериментальных исследований разработаны методы прогнозирования равновесия фаз: уравнение Шредера, ASOG, метод Вильсона, UNIFAC, его модификации и т.д. В настоящей работе рассматриваются уравнение Шредера как уравнение расчета для идеальных систем, метод UNIFAC и модифицированный метод UNIFAC Dortmund. Метод UNIFAC и его модификация под названием UNIFAC Dortmund разработаны достаточно давно (метод UNIFAC Dortmund впервые был представлен в 1987 году [1]) и они широко применяются при химическом и нефтехимическом проектировании, а также в научных целях. Среди работ, использующих указанные методы можно привести [2, 3], где описывается применение относительно ионных жидкостей. Помимо этого, описывается применение метода UNIFAC для расчета температуры вспышки [4] и свойств сверхкритической воды [5]. Метод UNIFAC также применяется в работах [6–24] как для расчета равновесия “жидкость–твердое тело”, так и для равновесия “жидкость–пар”.
Кроме оригинального метода UNIFAC и метода UNIFAC Dortmund разработан метод UNIFAC Lei, который применяется в работах [25–27].
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Целью работы является анализ данных по системам тетрахлорэтилен – н-алкан с числом атомов углерода от 10 до 20, в связи с этим, работа формировалась на основе уже полученных экспериментальных данных. Экспериментальные данные были получены методом дифференциального термического анализа (ДТА) и детально описаны в работах [28–36]. Основные параметры эксперимента: исследования проводили на аппарате DSC-500 в диапазоне температур от минус 70 до плюс 30°С, измерительную ячейку нагревали со скоростью 4 К/мин, точность измерения температуры составляла ±0.25°С. В качестве хладагента применяли сухой лед. Массы исследуемых навесок смесей составляли от 0.015 до 0.020 г. Для исследования применяли реактивы с содержанием основного вещества не менее 99%.
ТЕОРИЯ МЕТОДА
Согласно работе [28] перед экспериментальными исследованиями проводили прогнозирование характеристик фазовых равновесий в исследуемых системах с помощью уравнения Шредера:
(1)
$~\ln {{x}_{i}} = \frac{{{{\Delta }_{{{\text{пл}}}}}{{H}_{i}}(T - {{T}_{{{\text{пл}},~i}}})}}{{R{{T}_{{{\text{пл}},~i}}}T}},$При расчете по уравнению Шредера раствор считали идеальным и поэтому коэффициенты активности компонентов принимали равными 1.
Данное уравнение описывает ход ликвидуса системы со стороны как первого, так и второго компонента. Пересечение кривых ликвидуса дает точку эвтектики. Для нахождения эвтектики необходимо решить систему, составленную из уравнений Шредера, относительно хi и Т:
(2)
$\left\{ \begin{gathered} \ln {{x}_{1}} = \frac{{{{\Delta }_{{{\text{пл}}}}}{{H}_{1}}({{T}_{{\text{e}}}} - {{T}_{{{\text{пл}},~1}}})}}{{R{{T}_{{{\text{пл}},~1}}}{{T}_{{\text{e}}}}}}, \hfill \\ \ln {{x}_{2}} = \frac{{{{\Delta }_{{{\text{пл}}}}}{{H}_{2}}({{T}_{{\text{e}}}} - {{T}_{{{\text{пл}},~2}}})}}{{R{{T}_{{{\text{пл}},~2}}}{{T}_{{\text{e}}}}}}, \hfill \\ 1 = {{x}_{1}} + {{x}_{2}}, \hfill \\ \end{gathered} \right.$Методика построения фазовой диаграммы с использованием уравнения Шредера приведена в работах [37–40]. Для расчета коэффициентов активности компонентов систем в составе эвтектики в настоящей работе использовали модифицированное уравнение Шредера с введением в него коэффициента активности:
Теоретически коэффициент активности компонента определяли с помощью методов UNIFAC [41] и UNIFAC Dortmund [1]. Оба этих метода UNIFAC основываются на уравнении:
где $\gamma _{i}^{C}$ – комбинаторная часть коэффициента активности, $\gamma _{i}^{R}$ – остаточная часть коэффициента активности. Подробный расчет комбинаторной части $\gamma _{i}^{C}$ и остаточной части $\gamma _{i}^{R}$ коэффициента активности приведен в [39] и [1, 40–49]. Актуальные значения параметров по методу UNIFAC Dortmund доступны в [50].Отличия одного метода от другого достаточно существенны и включают в себя разные принципы расчета параметров группового взаимодействия и разные параметры групп. Группы атомов, на которые разбивали изучаемые соединения при расчете методами UNIFAC и UNIFAC Dortmund, представлены в табл. 1 и 2.
Таблица 1.
Группы атомов по методу UNIFAC
| Компонент | Группа | Количество групп |
|---|---|---|
| Тетрахлорэтилен | Cl-1 | 4 |
| C=C | 1 | |
| н-Алкан | CH3 | 2 |
| CH2 | От 8 до 18 |
Таблица 2.
Группы атомов по методу UNIFAC Dortmund
| Компонент | Группа | Количество групп |
|---|---|---|
| Тетрахлорэтилен | Cl(C=C) | 4 |
| C=C | 1 | |
| н-Алкан | CH3 | 2 |
| CH2 | От 8 до 18 |
Экспериментальные значения коэффициентов активности рассчитывали, используя данные по температурам и составам экспериментально изученных смесей. По этому методу коэффициент активности определялся на основании уравнения Шредера:
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
На основании полученных результатов, были составлены табл. 3−6, в которых приведены значения коэффициентов активности, а также характеристики эвтектик для каждой системы.
Как видно из табл. 3, наименьшая средняя ошибка при прогнозировании температуры эвтектики наблюдается для модифицированного метода UNIFAC Dortmund. Оригинальный метод UNIFAC показывает среднее отклонение больше, чем уравнение Шредера, данные по которому получены исходя из предположения идеальной природы смесей. Среднее относительное отклонение для нечетных систем больше, чем для четных, что может быть объяснено наличием полиморфного перехода у н-алканов с нечетным числом атомов углерода. В данных системах полиморфный переход выше температуры эвтектики (к примеру, для н-тридекана температура полиморфного перехода 255 К [51], а эвтектика в системе с тетрахлорэтиленом имеет температуру 243.55 К), но приведенные методы не учитывают влияние полиморфизма.
Таблица 3.
Температуры эвтектик
| Система | Экспери-мент, К | Метод Шредера, К | Относительное отклонение от эксперимента, % | Метод UNIFAC, К | Относительное отклонение от эксперимента, % | Метод UNIFAC Dortmund, К | Относительное отклонение от эксперимента, % |
|---|---|---|---|---|---|---|---|
| Четные системы | |||||||
| С2Cl4 – н-С10Н22 | 236.15 | 228.34 | 3.31 | 225.82 | 4.38 | 235.08 | 0.45 |
| С2Cl4 – н-С12Н26 | 244.85 | 240.53 | 1.76 | 235.19 | 3.95 | 245.46 | 0.25 |
| С2Cl4 – н-С14Н30 | 247.95 | 246.93 | 0.41 | 242.74 | 2.10 | 249.17 | 0.49 |
| С2Cl4 – н-С16Н34 | 250.15 | 249.65 | 0.20 | 245.01 | 2.05 | 250.35 | 0.08 |
| С2Cl4 – н-С18Н38 | 250.65 | 250.35 | 0.12 | 247.53 | 1.24 | 250.55 | 0.04 |
| С2Cl4 – н-С20Н42 | 250.75 | 250.50 | 0.10 | 248.70 | 0.82 | 250.60 | 0.06 |
| Среднее отклонение по всем системам | 0.98 | 2.42 | 0.23 | ||||
| Нечетные системы | |||||||
| С2Cl4 – н-С11Н24 | 231.91 | 228.26 | 1.57 | 225.06 | 2.95 | 236.05 | 1.79 |
| С2Cl4 – н-С13Н28 | 243.55 | 239.41 | 1.70 | 234.40 | 3.76 | 244.77 | 0.50 |
| С2Cl4 – н-С15Н32 | 247.75 | 245.54 | 0.89 | 239.19 | 3.46 | 248.44 | 0.28 |
| С2Cl4 – н-С17Н36 | 249.82 | 248.64 | 0.47 | 243.12 | 2.68 | 249.92 | 0.04 |
| С2Cl4 – н-С19Н40 | 250.65 | 249.75 | 0.36 | 245.83 | 1.92 | 250.40 | 0.10 |
| Среднее отклонение по всем системам | 1.00 | 2.95 | 0.54 | ||||
Согласно табл. 4, среднее относительное отклонение мольной доли тетрахлорэтилена меньше всего по методу Шредера, тогда как оригинальный метод UNIFAC показал наибольшее как максимальное, так и среднее отклонение. В нечетных системах отклонение мольной доли тетрахлорэтена от эксперимента также, как и с температурой эвтектики, возрастает. Исключением является модифицированной метод UNIFAC, где наоборот отклонение снижается.
Таблица 4.
Мольная доля тетрахлорэтилена в эвтектике
| Система | Экспери-мент, мол. доля | Метод Шредера, мол. доля | Относительное отклонение от эксперимента, % | Метод UNIFAC, мол. доля | Относительное отклонение от эксперимента, % | Метод UNIFAC Dortmund, мол. доля | Относительное отклонение от эксперимента, % |
|---|---|---|---|---|---|---|---|
| Четные системы | |||||||
| С2Cl4 – н-С10Н22 | 0.55 | 0.61 | 11.48 | 0.78 | 42.54 | 0.74 | 35.23 |
| С2Cl4 – н-С12Н26 | 0.79 | 0.80 | 0.98 | 0.87 | 9.82 | 0.90 | 13.61 |
| С2Cl4 – н-С14Н30 | 0.92 | 0.92 | 0.45 | 0.93 | 1.54 | 0.97 | 5.91 |
| С2Cl4 – н-С16Н34 | 0.98 | 0.98 | 0.51 | 0.95 | 2.56 | 0.99 | 1.74 |
| С2Cl4 – н-С18Н38 | 0.99 | 0.99 | 0.32 | 0.97 | 2.10 | 1.00 | 0.73 |
| С2Cl4 – н-С20Н42 | 0.99 | 1.00 | 0.40 | 0.98 | 1.31 | 1.00 | 0.60 |
| Среднее отклонение по всем системам | 2.36 | 9.98 | 9.64 | ||||
| Нечетные системы | |||||||
| С2Cl4 – н-С11Н24 | 0.56 | 0.60 | 6.57 | 0.79 | 40.32 | 0.76 | 34.99 |
| С2Cl4 – н-С13Н28 | 0.87 | 0.78 | 10.03 | 0.87 | 0.35 | 0.90 | 3.81 |
| С2Cl4 – н-С15Н32 | 0.95 | 0.90 | 4.86 | 0.91 | 3.81 | 0.96 | 1.48 |
| С2Cl4 – н-С17Н36 | 0.97 | 0.96 | 1.52 | 0.94 | 3.57 | 0.99 | 1.15 |
| С2Cl4 – н-С19Н40 | 0.99 | 0.98 | 0.71 | 0.96 | 2.93 | 1.00 | 0.61 |
| Среднее отклонение по всем системам | 4.74 | 10.19 | 8.41 | ||||
Как видно из табл. 5 и 6, коэффициент активности тетрахлорэтилена с увеличением числа атомов углерода у н-алкана стремится к 1, т. е. к состоянию для идеальных систем. В свою очередь коэффициент активности н-алкана напротив увеличивается с возрастанием числа атомов углерода в молекуле н-алкана и достигает 3.5659 в методе UNIFAC Dortmund для системы тетрахлорэтилен – н-C20H42. В целом для метода UNIFAC Dortmund характерны более высокие коэффициенты активности для н-алкана, что приводит к уменьшению величины ошибки при прогнозировании температуры плавления эвтектики (табл. 3).
Таблица 5.
Коэффициент активности тетрахлорэтилена в эвтектике
| Система | Экспери-мент | Метод UNIFAC | Метод UNIFAC Dortmund |
|---|---|---|---|
| Четные системы | |||
| С2Cl4 – н-С10Н22 | 1.3396 | 0.7205 | 0.9603 |
| С2Cl4 – н-С12Н26 | 1.1198 | 0.8242 | 0.9850 |
| С2Cl4 – н-С14Н30 | 1.0300 | 0.9118 | 0.9977 |
| С2Cl4 – н-С16Н34 | 1.0153 | 0.9370 | 0.9998 |
| С2Cl4 – н-С18Н38 | 1.0100 | 0.9673 | 1.0000 |
| С2Cl4 – н-С20Н42 | 1.0100 | 0.9808 | 1.0000 |
| Нечетные системы | |||
| С2Cl4 – н-С11Н24 | 1.1800 | 0.7123 | 0.9624 |
| С2Cl4 – н-С13Н28 | 0.9953 | 0.8094 | 0.9839 |
| С2Cl4 – н-С15Н32 | 1.0000 | 0.8623 | 0.9958 |
| С2Cl4 – н-С17Н36 | 1.0088 | 0.9096 | 0.9993 |
| С2Cl4 – н-С19Н40 | 1.0100 | 0.9433 | 0.9999 |
Таблица 6.
Коэффициент активности н-алкана в эвтектике
| Система | Экспери-мент | Метод UNIFAC | Метод UNIFAC Dortmund |
|---|---|---|---|
| Четные системы | |||
| С2Cl4 – н-С10Н22 | 1.4241 | 1.5138 | 2.3405 |
| С2Cl4 – н-С12Н26 | 1.3321 | 0.9780 | 2.9228 |
| С2Cl4 – н-С14Н30 | 1.0400 | 0.4340 | 3.2845 |
| С2Cl4 – н-С16Н34 | 1.0650 | 0.2491 | 3.4365 |
| С2Cl4 – н-С18Н38 | 0.7700 | 0.0969 | 3.5172 |
| С2Cl4 – н-С20Н42 | 0.5300 | 0.0419 | 3.5659 |
| Нечетные системы | |||
| С2Cl4 – н-С11Н24 | 1.1000 | 1.5664 | 2.4246 |
| С2Cl4 – н-С13Н28 | 2.1098 | 1.0402 | 2.9790 |
| С2Cl4 – н-С15Н32 | 2.3300 | 0.6609 | 3.2833 |
| С2Cl4 – н-С17Н36 | 1.9878 | 0.3380 | 3.4468 |
| С2Cl4 – н-С19Н40 | 1.8100 | 0.1510 | 3.5307 |
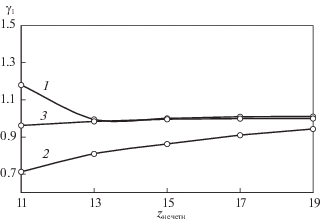
По рис. 1–4, особенно по рис. 2 и 4, заметно, что коэффициенты активности, рассчитанные каждым методом, значительно отличаются друг от друга. Это может быть объяснено разным математическим аппаратом каждого метода, так как методы UNIFAC и UNIFAC Dortmund по-разному оценивают вклады каждой конкретной группы, о чем сообщается в [1].
Рис. 1.
Коэффициент активности тетрахлорэтилена в эвтектике в четных системах: 1 – по данным эксперимента, 2 – по методу UNIFAC, 3 – по методу UNIFAC Dortmund.

Рис. 2.
Коэффициент активности н-алкана в эвтектике в четных системах: 1 – по данным эксперимента, 2 – по методу UNIFAC, 3 – по методу UNIFAC Dortmund.

ВЫВОДЫ
1. Для двойных систем, состоящих из тетрахлорэтилена, наименьшее среднее отклонение температуры плавления эвтектик показывает метод UNIFAC Dortmund: 0.23% для систем с н-алканом с четным числом атомов углерода и 0.54% для систем с н-алканов с нечетным числом атомов углерода. Оригинальный метод UNIFAC напротив показывает наибольшее среднее отклонение 2.42% и 2.95% соответственно.
2. Наименьшее отклонение по составу эвтектики показывает уравнение Шредера 2.36% и 4.74% для четных и нечетных систем соответственно, в то время как методы UNIFAC и UNIFAC Dortmund имеют значительно большие средние отклонения.
3. Среднее относительное отклонение по всем изученным методам меньше для четных систем по сравнению с нечетными. Вероятно, это связано с наличием полиморфизма у н-алканов с нечетным числом атомов углерода.
Авторы выражают благодарность С.И. Яковлевой за помощь в подготовке и оформлении статьи.
Список литературы
Weidlich U., Gmehling J. // Ind. Eng. Chem. Res. 1987. № 26. P. 1372.
Paduszyński K., Domańska U. // Fluid Phase Equilibria. 2013. V. 353. P. 115. https://doi.org/10.1016/j.fluid.2013.06.025
Nebig S., Gmehling J. // Fluid Phase Equilibria. 2010. V. 294. Issues 1–2. P. 206. https://doi.org/10.1016/j.fluid.2010.02.010
Débora Costa do Nascimento, Natália Daniele Dorighello Carareto, Antonio Marinho Barbosa Neto, et al. // Fuel. 2020. V. 281. P. 118717. https://doi.org/10.1016/j.fuel.2020.118717
Fornari T., Stateva R.P., Señorans F.J. et al. // J. of Supercritical Fluids. 2008. V. 46. Issue 3. P. 245. https://doi.org/. 2007.11.017.https://doi.org/10.1016/j.supflu
Bahadur I., Pal A., Gmehling J. et al. // J. of Chemical Thermodynamics. 2015. V. 90. P. 92. https://doi.org/10.1016/j.jct.2015.06.023
Nebig S., Liebert V., Gmehling J. // Fluid Phase Equilibria. 2009. V. 277. Issue 1. P. 61. https://doi.org/10.1016/j.fluid.2008.11.013
Nebig S., Bölts R., Gmehling J. // Ibid. 2007. V. 258. Iss. 2. P. 168. https://doi.org/10.1016/j.fluid.2007.06.001
Klauck M., Silbermann R., Metasch R. et al. // Ibid. 2012. V. 314. P. 169.https://doi.org/10.1016/j.fluid.2011.09.010
González J.A., García de la Fuente I., Cobos J.C. // Ibid. 1999. V. 154. Issue 1. P. 11. https://doi.org/10.1016/S0378-3812(98)00421-X
González J.A., Garciéde la Fuentá I., Cobos J.C. // Ibid. 2000. V. 168. Issue 1. P. 31. https://doi.org/10.1016/S0378-3812(99)00326-X
María Dolores Robustillo M.D., Castello Branco Almeida Bessa L., Pedro de Alcântara Pessôa Filho // Ibid. 2021. V. 530. P. 112874. https://doi.org/10.1016/j.fluid.2020.112874
Rabhi F., Pietro T.D., Mutelet F., Sifaoui H. // J. of Molecular Liquids. 2021. V. 325. P. 115231.
Zini L.P., Staudt P.B., Rafael de P. Soares. // Fluid Phase Equilibria. 2021. P. 112942.
Xin K., Roghair I., Gallucci F., Martin van Sint Annaland. // J. of Molecular Liquids. V. 325. 2021. P. 115227. https://doi.org/10.1016/j.molliq.2020.115227
Zhang X., Li M., Hu Y., Liu Z., Mo S. // Chinese J. of Chemical Engineering. 2020. https://doi.org/10.1016/j.cjche.2020.11.019
Bazooyar B., Shaahmadi F., Anbaz M.A., Jomekian A. // J.of Molecular Liquids. V. 322. 2021. P. 114972. https://doi.org/10.1016/j.molliq.2020.114972
Balchandani S., Singh R. // Ibid. 2020. P. 114713. https://doi.org/10.1016/j.molliq.2020.114713
Farouk T.I., Won S.H., Dryer F.L. // Proceedings of the Combustion Institute. 2020. https://doi.org/10.1016/j.proci.2020.06.200.
Silveira C.L., Galvão A.C., Robazza W.S., Feyh J.V.T. // Fluid Phase Equilibria. 2021. p. 112970. https://doi.org/10.1016/j.fluid.2021.112970
Robustillo M.D., Larissa Castello Branco Almeida Bessa, Pedro de Alcântara Pessôa Filho. // Fluid Phase Equilibria. V. 530. 2021. P. 112874. https://doi.org/10.1016/j.fluid.2020.112874
Assis G.P., Rafael Henrique Lazzari Garcia, Derenzo S., Bernardo A. // J. of Molecular Liquids. V. 323. 2021. P. 114617. https://doi.org/10.1016/j.molliq.2020.114617
Sikorski P., Huerga A.C., González J.A., Królikowski M., Hofman T. // Ibid. V. 318. 2020. P. 114265. https://doi.org/10.1016/j.molliq.2020.114265
Zhang T., Li A., Xu X. et al. // J. of Chemical Thermodynamics. V. 152. 2021. P. 106284. https://doi.org/10.1016/j.jct.2020.106284
Wang Z., Liu S., Jiang Y. et al. // Green Energy & Environment. 2020. https://doi.org/10.1016/j.gee.2020.12.021
Liu S., Wang Z., Zhu R. et al. // Ibid. 2020. https://doi.org/10.1016/j.gee.2020.12.022
Jiang Y., Wang Z., Lei Z., Yu G. // Chemical Engineering Science. V. 230. 2021. P. 116186. https://doi.org/10.1016/j.ces.2020.116186
Дорохина Е.В. Фазовые равновесия в системах тетрахлорэтен – н-алканы: Дис. … канд. хим. наук. Саратов. 2012. 135 с.
Garkushin I.K., Dvoryanova E.M., Aphanasieva O.U. // Abstarcts of the XVII International conference of chemical thermodynamica in Russia: in 2 volumes. 2009. V. 1. P. 337.
Дорохина Е.В., Колядо А.В., Мощенский Ю.В. // Химия: сборник науч. трудов. – Самара: Самар. гос. техн. ун-т, 2009. С. 40.
Дорохина Е.В., Колядо А.В., Гаркушин И.К. // Журн. “Бутлеровские сообщения”. 2011. Т. 25. № 8. С. 51.
Дорохина Е.В., Колядо А.В. // IX Международное Курнаковское совещание по физико-химическому анализу: тез. докл. Пермь, 2010. С. 95.
Дорохина Е.В., Колядо А.В., Гаркушин И.К. // Химия: сборник науч. трудов. Самара: Самар. гос. техн. ун-т, 2009. С. 47.
Дорохина Е.В., Колядо А.В., Гаркушин И.К. // Проблемы теоретической и экспериментальной химии: тез. докл. ХХ Рос. молодеж. науч. конф., посвящ. 90-летию Урал. гос. ун-та им А.М. Горького, Екатеринбург, 20−24 апр. 2010 г. Екатеринбург: Из-во Урал. ун-та, 2010. С. 319.
Дорохина Е.В., Колядо А.В., Гаркушин И.К. // Изв. Саратовского ун-та. Серия Химия. Биология. Экология. 2011. Т. 11. Вып. 1. С. 31.
Дорохина Е.В., Колядо А.В., Гаркушин И.К. и др. // Башкирский химический журнал. 2010. Т. 17. Вып. 3. С. 30.
Гаркушин И.К., Дорохина Е.В., Колядо А.В. // Журн.“Бутлеровские сообщения”. 2009. Т. 16. № 3. С. 41.
Гаркушин И.К., Колядо А.В., Дорохина Е.В. Расчет и исследование фазовых равновесий в двойных системах из органических веществ. Екатеринбург: УрО РАН, 2011. С. 191.
Морачевский А.Г., Смирнова Н.А., Пиотровская Е.М. и др. Термодинамика равновесия жидкость – пар. Ленинград : Химия, 1989. стр. 344.
Gmehling J., Li J., Schiller M. // Ind. Eng. Chem. Res. 1993. № 32. P. 178.
Gmehling J., Lohmann J., Jakob A., Li J., Joh R. // Ind. Eng. Chem. Res. 1998. № 37. P. 4876.
Gmehling J., Wittig R., Lohmann J., Joh R. // Ibid. 2002. № 41. P. 1678.
Wittig R., Lohmann J., Joh R., Horstmann, Gmehling J. // Ibid. 2001. № 40. P. 5831.
Lohmann J., Joh R., Gmehling J. // Ibid. 2001. № 40. P. 957.
Lohmann J., Gmehling J. // J. Chem. Eng. Jpn. 2001. № 34. P. 43.
Wittig R., Lohmann J., Gmehling J. // AIChE Journal. 2003. V. 49. № 2. P. 530.
Jakob A., Grensemann H., Lohmann J., Gmehling J. // Ind. Eng. Chem. Res. 2006. № 45. P. 7924.
Hector T., Gmehling J. // Fluid Phase Equilib. 2014. № 371. P. 82.
Constantinescu D., Gmehling J. // J. Chem. Eng. Data. 2016. № 61 (8). P. 2738.
http://unifac.ddbst.de/modified-unifac.html. Дата обращения 11.01.2021.
Domalski E.S., Hearing E.D. // J. Phys. Chem. Ref. Data. 1996. V. 25. № 1. https://doi.org/10.1063/1.555985
Дополнительные материалы отсутствуют.
Инструменты
Журнал физической химии