Журнал физической химии, 2022, T. 96, № 5, стр. 634-638
Синергетический эффект при протекании электрокаталитической реакции получения водорода в присутствии 2,2'-бипиридина
О. Ю. Ганц a, Л. А. Климаева a, Д. Б. Чугунов a, А. В. Мажорова a, А. В. Долганов a, *, А. В. Князев b
a Национальный исследовательский Мордовский государственный университет им. Н П. Огарева
430005 Саранск, Россия
b Национальный исследовательский Нижегородский государственный университет им. Н.И. Лобачевского
Нижний Новгород, Россия
* E-mail: dolganov_sasha@mail.ru
Поступила в редакцию 16.10.2021
После доработки 16.10.2021
Принята к публикации 20.10.2021
- EDN: VTFZMD
- DOI: 10.31857/S0044453722050120
Аннотация
Исследованы электрокаталитические свойства 2,2'-бипиридина в присутствии кислот различной природы (HBF4, HClO4, TsOH, CF3COOH), а также природа возникновения синергетического эффекта. Показано, что величина pKa используемых кислот существенно влияет на механизм протекающих реакций. На основе электрохимических и электрокаталитических данных, полученных при помощи метода циклической вольтамперометрии и препаративного потенциостатического электролиза, предложены основные механизмы электрокаталитического получения молекулярного водорода в зависимости от природы кислот, а также рассчитаны термодинамические и кинетические параметры рассматриваемых систем.
В последние десятилетия водород активно рассматривается как альтернативное топливо, обладающее рядом преимуществ перед традиционными источниками энергии [1–3]. Соответственно, краеугольным камнем в современной энергетике можно по праву считать разработки в области создания высокоэффективных, относительно дешевых и крупномасштабных каталитических систем по получению молекулярного водорода [4]. К настоящему времени разработано большое количество комплексов переходных металлов, обладающих достаточной каталитической активностью, однако больший интерес представляет создание уникальных систем, исключающих применение дорогостоящих металлов [5–7]. В качестве примера можно привести полифторированные комплексы порфирина, в присутствии которых потенциал восстановления сопоставим с металлокомплексными аналогами [8]. Тем не менее, число подобных систем мало, и вопрос их создания и подробного исследования остается открытым.
Известно, что введение основного атома в состав катализатора приводит к существенному повышению электрокаталитической активности в реакциях генерации молекулярного водорода [9]. Так, был проведен большой цикл исследований электрокаталитических свойств пиридина и других органических систем [10]. Многообещающие результаты указанных работ позволяют сделать вывод об огромном потенциале органических систем подобного типа в электрокаталитических процессах получения молекулярного водорода.
Ранее коллективом авторов были предложены безметальные электрокатализаторы, отличающиеся по ряду характеристик – устойчивости, доступности, экологичности – от всех известных катализаторов на основе переходных металлов [11–13]. В продолжение описанных выше идей в данной работе рассмотрены электрокаталитические свойства 2,2'-бипиридина:
Предположено, что объединение двух пиридиновых фрагментов, соединенных между собой в орто-положении, будет способствовать возникновению синергетического эффекта, который в корне меняет механизм генерации водорода с бимолекулярного элиминирования на мономолекулярную реакцию. Это позволит снять кинетическое ограничение, накладываемое на бимолекулярную стадию, лимитирующую в реакции получения молекулярного водорода в присутствии производных пиридина.ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Все электрохимические измерения проводили в специальной трехэлектродной ячейке (20 мл) при помощи цифрового потенциостата-гальваностата GAMRY REFERENCE 3000 (Канада), подключенного к персональному компьютеру. В качестве рабочего электрода использовали стеклоуглеродный электрод (S = 0.0314 см2); вспомогательный электрод – платиновый, электрод сравнения – стандартный хлоридсеребрянный (E0 = 0.33В (CH3CN) vs Fc/Fc+). Как фоновый электролит использовали 0.1 М раствор (н‑C4H9)4N)BF4. Для исследования механизма и кинетики электрокаталитической реакции получения молекулярного водорода в присутствии бипиридинов применяли метод циклической вольтамперометрии (ЦВА); оценку эффективности каталитического процесса и устойчивости каталитических систем проводили с помощью препаративного потенциостатического электролиза.
Концентрация катализатора во всех случаях составляла 1 × 10–3 моль/л. При проведении электролиза брали 100-кратный избыток кислоты.
Рабочий электрод очищали ацетоном после каждого измерения, трехэлектродную ячейку также промывали дистиллированной водой и ацетоном. Измерения проводили при комнатной температуре. Все растворы предварительно деаэрировали аргоном.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Для изучения электрохимических характеристик 2,2'-бипиридина использовали метод циклической вольтамперометрии (ЦВА). Как видно из вольтамперограммы (рис. 1), соединение редоксактивно в катодной области, в анодной области электрохимическая активность не наблюдается. Отметим образование двух одноэлектронных необратимых волн при потенциалах –1.65 и –1.95 В. Это свидетельствует о последовательном восстановлении каждого из пиридиновых колец с образованием неустойчивых во времени анион-радикалов.
Рис. 1.
Вольтамперограмма 2,2'-бипиридина (С = 1 × × 10–3 М, СУ, 0.1 В/с, CH3CN, 0.1 М Bu4NBF4, Ag/AgCl/KClaq).

Свойства 2,2'-бипиридина исследовали в присутствии кислот различной природы, (HBF4, HClO4, TsOH, CF3COOH) которые использовали в качестве источников H+. Заметно, что добавление растворов сильных кислот (рKа(CH3CN) HBF4) = 1.8; рKа(CH3CN) HClO4) = 2.1) приводит к значительной трансформации исходной ЦВА-кривой (рис. 2).
Рис. 2.
Вольтамперограммы 2,2'-бипиридина в отсутствие (1,–) и в присутствии 1 (2,–), 2 (3,–), 3 (4,–), 4 (5,–) мМ HBF4 (а) и HClO4 (б) (СУ, 0.1 В/с, CH3CN, 0.1 М Bu4NBF4, Ag/AgCl/KClaq).

В обоих случаях отмечается смещение исходных волн в анодную область $E_{p}^{c}$ = –0.56 и –0.58 В соответственно. Кроме того, последовательное добавление кислоты приводит к линейному росту тока вплоть до полного сглаживания второго пика.
Идентичность значений потенциалов образующихся пиков позволяет сделать вывод о единстве протекающих процессов. Итак, в случае системы “2,2'-бипиридин – сильная кислота” можно считать возможным следующий механизм протекания электрокаталитической реакции получения молекулярного водорода:
Вероятно, происходит протонирование образующегося при восстановлении одного из пиридиновых колец радикала по атому азота, приводящее к формированию катион-радикала. Последующее восстановление интермедиата способствует протеканию электрокаталитической реакции. Представленный механизм в полной мере отражает возможность осуществления синергетического эффекта – в этом случае реализуется предполагаемое замещение бимолекулярного элиминирования на мономолекулярное постадийное восстановление водорода. Это становится возможным в отсутствие стерических затруднений во вращении вокруг связи С–С между пиридиновыми фрагментами, при невозможности протекания побочных процессов и химической трансформации интермедиата и, судя по всему, снижении энергетического барьера процесса.
В случае использования слабых кислот, таких как п-толуолсульфоновая (рKа (CH3CN) = 8.5) и трифторуксусная (рKа (CH3CN) = 10.6), наблюдается совершенно другой вид ЦВА-кривой, соответственно предполагается иной путь протекания процесса (рис. 3).
Рис. 3.
Вольтамперограммы 2,2'-бипиридина в отсутствие (1,–) и в присутствии 1 (2,–), 2 (3,–), 3 (4,–), 4 (5,–) мМ TsOH (а) и CF3COOH (б) (СУ, 0.1 В/с, CH3CN, 0.1 М Bu4NBF4, Ag/AgCl/KClaq).
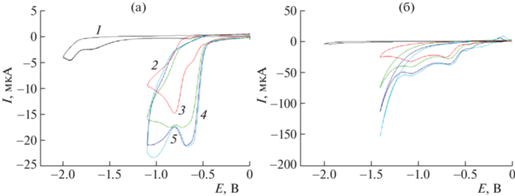
В случае добавления п-толуолсульфоновой кислоты наблюдается смещение исходных пиков в анодную область ($E_{p}^{c}$ = –0.70 и –0.82 В соответственно). Интересно отметить, что увеличение концентрации кислоты в растворе приводит к росту тока в первом пике и существенной трансформации второго – по достижении концентрации кислоты 2 мМ значение тока в пике выходит на плато. Впрочем, далее виден рост тока при потенциале –1.1 В. Как и следовало ожидать, при использовании трифторуксусной кислоты можно также отметить смещение исходных волн в анодную область. На первый взгляд, нельзя сразу сказать о единообразии протекающих процессов, но, как отмечается на вольтамперограмме, значения потенциалов пиков совпадают с полученными при использовании TsOH ($E_{p}^{c}$ = –0.71 и –1.1 В соответственно). Вероятнее всего, в ходе электрокаталитической реакции, в случае п-толуолсульфоновой кислоты, в отличие от трифторуксусной кислоты, происходит накопление промежуточного соединения – образование иного интермедиата.
В данном случае предполагаемый механизм описывается диспропорционированием образовавшегося в результате ступенчатого восстановления катиона до бирадикала с последующим элиминированием молекулярного водорода. Больший энергетический барьер процесса обусловливает смещение волн в более катодную область относительно ситуаций с сильными кислотами.
На основании полученных результатов, можно сделать следующие выводы: добавление кислот к ацетонитрильному раствору 2,2'-бипиридина приводит к протеканию электрокаталитической реакции получения водорода, однако механизм процессов варьируется в зависимости от природы используемой кислоты. Довольно неожиданно, что значение рKа кислоты не оказывает серьезного влияния на значения тока (рис. 4).
Рис. 4.
Зависимости силы тока (I) от концентрации добавляемых кислот (С(Н+); 2,2'-бипиридин, СУ, CH3CN, 0.1 М Bu4NBF4, Ag/AgCl/KClaq).

В дополнение нами был выполнен препаративный потенциостатический электролиз при значениях потенциалов первых полуволн [14], результаты указаны в табл. 1. Это позволило понять, обладают ли исследуемые системы достаточной устойчивостью, а также оценить эффективность протекающих электрокаталитических процессов. Данные табл. 1 позволяют подтвердить электрокаталитическую активность 2,2'-бипиридина в присутствии всех указанных кислот, так как в отсутствие катализатора восстановительный процесс не наблюдается. Наибольшая активность проявляется в случае HBF4 и постепенно убывает в ряду HClO4 – TsOH – CF3COOH. Тем не менее, полученные экспериментальные данные не могут быть удовлетворительными. Вероятнее всего, быстрая потеря каталитической активности связана с протеканием побочных химических процессов. Одним из возможных путей решения этой проблемы может быть введение объемных акцепторных заместителей в орто- и пара-положения 2,2'-бипиридина для экранирования реакционноспособных интермедиатов.
Таблица 1.
Значения TON, TOF и количества водорода, образующегося в ходе каталитической реакции в присутствии 2,2'-бипиридина и различных кислот, по результатам десятиминутного препаративного электролиза
| Кислота | E1/2, В | [H2], моль | TON | TOF, с–1 |
|---|---|---|---|---|
| HBF4 | 0.55 | 6.17 × 10–3 | 6.17 | 1.03 × 10–2 |
| HClO4 | 0.55 | 5.84 × 10–3 | 5.84 | 9.73 × 10–3 |
| TsOH | 0.71 | 1.87 × 10–5 | 1.87 × 10–3 | 3.12 × 10–5 |
| CF3COOH | 0.71 | 1.23 × 10–5 | 1.23 × 10–3 | 2.05 × 10–5 |
Таким образом, изучены и описаны безметальные электрокаталитические системы на основе 2,2'-бипиридина и кислот различной природы (HBF4, HClO4, TsOH, CF3COOH). В частности, рассмотрены основные параметры протекающих процессов, определены возможные промежуточные соединения, термодинамические и кинетические характеристики исследуемых систем; также рассмотрено влияние кислот на каталитическую активность. На основании полученных данных предложены основные механизмы электрокаталитического восстановления молекулярного водорода, а также подтверждена возможность возникновения синергетического эффекта. Результаты работы могут быть полезны при дальнейшем исследовании электрокаталитических систем на основе органических гетероциклических соединений, в особенности бипиридинов, которые могут быть модифицированы с целью повышения эффективности процесса.
Работа выполнена при финансовой поддержке Российского фонда фундаментальных исследований (код проекта № 19-33-90094).
Список литературы
Turner J.A. // Sci. 2004. V. 305. P. 972. https://doi.org/10.1126/science.1103197
Sherif S.A., Barbir F., Veziroglu T.N. // Sol Energy. 2005. V. 78. P. 647. https://doi.org/10.1016/j.solener.2005.01.002
Dincer Ibrahim // Int. J. Hydrogen Energ., 2012. V. 37. P. 1954. https://doi.org/10.1016/j.ijhydene.2011.03.173
Zheng Y., Jiao Y., Zhu Y. et al. // Nat Commun., 2014. V. 5. P. 1. https://doi.org/10.1038/ncomms4783
Pantani O., Anxolabehere-Mallart E., Aukauloo A. et al. // Electrochem. Commun., 2007. V. 9. P. 54. https://doi.org/10.1016/j.elecom.2006.08.036
Cao J.P., Fang T., Fu L.Z. et al. // Int. J. Hydrogen Energy, 2014. V. 39. P. 10980. https://doi.org/10.1016/j.ijhydene.2014.05.082
Tang C., Zhang R., Lu W. et al. // Angew. Chem. Int. Ed., 2016. V. 37. P. 1127. https://doi.org/10.1002/anie.201608899
Wu Y., Rodríguez-López N., Villagrán D. // Chem. Sci. 2018. V. 9. P. 4689. https://doi.org/10.1039/c8sc00093j
Artero V., Fontecave M. // Coord Chem Rev. 2005. V. 249. P. 1518. https://doi.org/10.1016/j.ccr.2005.01.014
Mairanovskii S.G. // Russ. Chem. Rev. 1964. V. 33. P. 118. https://doi.org/10.1016/S0022-0728(63)80149-7
Dolganov A.V., Tanaseichuk B.S., Moiseeva D.N. et al. // Electrochem. Commun., 2016. V. 68. P. 59. https://doi.org/10.1016/j.elecom.2016.04.015
Dolganov A.V., Tanaseichuk B.S., Yurova V.Y. et al. // Int. J. Hydrogen Energy. 2019. V. 44. P. 21495. https://doi.org/10.1016/j.ijhydene.2019.06.067
Dolganov A.V., Tanaseichuk B.S., Pryanichnikova M.K. et al. // J. Phys. Org. Chem. 2019. V. 32. P. 3930. https://doi.org/10.1002/poc.3930
Roberts J.A.S., Bullock R.M. // Inorg. Chem., 2013. V. 52. P. 3823. https://doi.org/10.1021/ic302461q
Дополнительные материалы отсутствуют.
Инструменты
Журнал физической химии




