Журнал физической химии, 2022, T. 96, № 6, стр. 888-894
Механизм сорбции ионов двухвалентной меди на поверхности частиц бетонной крошки
В. М. Юрк a, *, Е. С. Коковина a, Ж. В. Шалыгина a
a Уральский федеральный университет
Екатеринбург, Россия
* E-mail: v.yurk@yandex.ru
Поступила в редакцию 09.09.2021
После доработки 12.12.2021
Принята к публикации 14.12.2021
- EDN: ZQCRUV
- DOI: 10.31857/S0044453722060334
Аннотация
Рассмотрен механизм адсорбции ионов двухвалентной меди из водных растворов на поверхности бетонных частиц. Получена изотерма адсорбции, относящаяся к L-типу. Определена величина предельной емкости сорбента (20.43 мг/г). Для установления механизма протекающего процесса адсорбции полученная изотерма обработана по уравнениям моделей Ленгмюра, Темкина, Фрейндлиха и Дубинина–Радушкевича. По значениям коэффициента детерминации установлено, что экспериментальные данные лучше всего описываются уравнением Ленгмюра, что указывает на формирование мономолекулярного слоя на поверхности частиц бетона. Сделан вывод, что энергия адсорбции Ea = 9.64 кДж/моль соответствует процессу хемосорбции. Ввиду того, что бетон имеет щелочную реакцию, параллельно адсорбции выявлена нейтрализация кислых модельных растворов. Экспериментально доказано, что процесс адсорбции меди на поверхности частиц бетона превалирует. Согласно полученным данным, на поверхности частиц в результате протекающего гидролиза сорбируются гидроксокомплексы меди.
Тяжелые металлы – одни из самых опасных загрязнителей окружающей среды. Попадая в природные объекты, их соединения ведут себя как токсиканты и экотоксиканты, негативно воздействуя не только на отдельные живые организмы, но и на экосистему в целом. К тому же тяжелые металлы обладают биокумулятивным эффектом.
Основные источники поступления тяжелых металлов в окружающую среду – сточные воды и объекты размещения отходов, которые оказывают негативное воздействие на почвы, поверхностные и подземные воды. В настоящее время продолжаются поиски оптимальных и недорогих решений по защите природных сред от указанных загрязнителей. Наибольшее распространение находят сорбционные методы очистки вследствие простоты аппаратурного оформления и большого выбора адсорбентов. В качестве сорбентов могут использоваться различные материалы, в том числе модифицированные или переработанные промышленные и сельскохозяйственные отходы, как например активированные угли из органических и коммунальных отходов [1, 2], зола уноса [3], красный шлам металлургических предприятий [4], глины [5]. Преимущества отходов – их дешевизна, большие объемы и доступность, благодаря которым все чаще многие исследователи предлагают подобные материалы для очистки водных сред от различных загрязнителей. Наиболее привлекательны сорбенты на основе неорганических минеральных материалов, обладающих пористой структурой и хорошо поддающихся измельчению, среди которых особо выделяются отходы строительных материалов, в частности бой бетона и цемента [6].
В последние годы появляется множество исследований сорбционных свойств минеральных строительных отходов, с результатами которых можно ознакомиться в обзорах [7, 8]. Нами в предыдущих исследованиях также показана эффективность использования сорбционного слоя из бетонной крошки для удаления из водной среды ионов тяжелых металлов в их смеси [9].
Преимущества минерального компонента строительных отходов (бетон, цемент, шамотный кирпич, гипс и прочие строительные материалы) – развитая поверхность и пористость [10]. Высокие сорбционные свойства подобных материалов также обеспечивают присутствие в их составе оксида кальция, кремнезема и гидрата силиката кальция, активно участвующих в иммобилизации металлов за счет формирования в растворе малорастворимых соединений (CaO) и координационных связей (C–S–H) [11, 12].
В литературе достаточно широко освещены различные способы использования строительных отходов, в частности бетона, для очистки сточных вод и защиты почв от ионов тяжелых металлов, однако до сих пор отсутствует информация о механизмах сорбции. Эти данные необходимы для прогнозирования сорбционных и защитных свойств материала и оценки вероятности вторичного загрязнения среды, что особенно актуально при использовании отходов в качестве геохимических барьеров.
В связи с этим цель настоящей работы – изучение сорбционных свойств суспензии на основе отхода бетонной крошки по отношению к ионам двухвалентной меди, а также описание механизмов, по которым происходит взаимодействие металла с поверхностью сорбента.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
В качестве сорбента использовали образцы смеси строительных отходов, большую часть которой составлял бой бетона. Как известно, состав бетона может несколько варьироваться в зависимости от марки, однако основные его компоненты – SiO2 и CaO, содержание которых составляет более 60 мас. %. Для приготовления сорбента использовали фракцию с размером частиц менее 0.5 мм. Материал не подвергали предварительной обработке.
Используемые в работе реактивы Cu(NO3)2 ⋅ 3H2O, Ca(OH)2 соответствовали марке “х.ч.” и “ч.д.а.”. Для установления необходимых значений pH модельных растворов применяли стандарт-титры HCl и NaOH. Приготовление растворов и промывку сорбента осуществляли с использованием дистиллированной воды.
Эксперименты по адсорбции проводили в стационарном режиме. Образцы сорбента массой 1 г вносили в конические колбы с 50 мл рабочего раствора нитрата меди (II) концентрацией от 0.05 до 1.00 г/л и перемешивали в течение 20 мин при скорости 160 об./мин на шейкере WU-4 (фирма PREMED, Польша). По завершению процесса сорбции суспензию бетона отфильтровывали и промывали дистиллированной водой. Остаточную концентрацию ионов двухвалентной меди в фильтрате определяли в соответствии с ГОСТ 4388-72 (суммарная погрешность определения меди не превышала ±25% при доверительной вероятности 0.95) на спектрофотометре ПЭ-5400ВИ (фирма ПРОМЭКОЛАБ, Россия) и с использованием инверсионного вольтамперометрического анализатора “ИВА” с трехэлектродной электрохимической ячейкой (фирма НПВП “ИВА”, Россия). Условия проведения измерений методом ИВА: фоновый электролит 0.12 М HCl, потенциал накопления Енак = –0.8 В, время накопления tнак = 30 с. Все опыты проводили при комнатной температуре (22 ± 1°С).
Расчет адсорбционной емкости проводили по формуле:
где С0 – концентрация ионов меди (II) в исходном растворе, мг/л; С – равновесная концентрация ионов меди (II) в фильтрате, мг/л; V – объем раствора, из которого ведется сорбция, л; m – масса адсорбента, г.Для описания экспериментальных данных и установления природы адсорбционного взаимодействия между частицами бетона и медью использовали наиболее известные модели равновесной адсорбции – уравнения Ленгмюра, Фрейндлиха, Темкина и Дубинина–Радушкевича.
Модель Ленгмюра наиболее распространена и описывает мономолекулярную адсорбцию. В общем виде описывается уравнением:
где А – величина адсорбции, мг/г; Xm – максимальная емкость адсорбированного монослоя сорбента, мг/г; b – константа адсорбционного равновесия, которая описывает свободную энергию адсорбции, л/мг, С – равновесная концентрация меди, мг/л.Изотерма адсорбции Фрейндлиха не ограничивается только монослоем, а описывает многослойную адсорбцию с неравномерным распределением теплоты адсорбции и сродства по гетерогенной поверхности:
где ${{K}_{f}}$ и $1{\text{/}}n$ – постоянные уравнения Фрейндлиха, Kf соответствует относительной адсорбционной способности адсорбента, а n указывает на интенсивность адсорбции.Изотерма Темкина учитывает косвенные взаимодействия адсорбата с поверхностью адсорбента:
где R – универсальная газовая постоянная; Т – температура, К; KT – константа равновесия, л/мг; bT – константа, указывающая на взаимодействие между адсорбентом и адсорбатом, кДж/моль.Уравнение Дубинина–Радушкевича имеет следующий вид:
где ε и β – потенциал Поляни (мг/г) и емкость насыщения (моль2/Дж2); β используется для определения средней энергии адсорбции моля адсорбата E по уравнению: $E = 1{\text{/}}\sqrt { - 2\beta } $.ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
На рис. 1 приведена изотерма адсорбции ионов Cu2+ на поверхности частичек бетона в диапазоне исходных концентраций нитрата меди от 0.2 до 1.0 г/л. Форма полученной изотермы относится к L-типу, поскольку при содержании меди в растворе ⁓0.4 г/л достигается предел адсорбционной емкости, и дальнейшее увеличение концентрации соли не приводит к продолжению процесса. Подобный вид изотерм описывает мономолекулярную адсорбцию, при которой наличие предела может быть связано с образованием ионами меди больших ассоциатов, занимающих вакантные центры и препятствующих с увеличением концентрации дальнейшему протеканию процесса.
Рассчитанная по уравнению (1) величина предельной адсорбции ионов меди (II) для бетона составила 20.43 мг/г. Полученное значение емкости монослоя соизмеримо с аналогичными значениями для других сорбентов на основе промышленных отходов. Так, активированные углеродные сорбенты на основе целлюлозного сырья имеют сорбционную емкость по ионам меди до 16.6 мг/г, рН 3–5 [13], а отходы рисовой шелухи – 19.61 мг/г при рН от 5.73 до 5.55 [14]. Неорганические сорбенты из бентонитовой глины обладают адсорбционной емкостью 0.17 ммоль/г в кислой среде [15]. В работе [16] рассматривали альтернативный сорбент из кератинсодержащих отходов птицеводства, для которых величина предельной адсорбции по меди составила 26.7 мг/г без предварительной обработки материала. Более высокая величина сорбционной емкости данного сорбента по сравнению с бетонной крошкой может быть связана с большей величиной удельной поверхности и формированием прочных комплексов ионов двухвалентной меди с кератином. Также намного лучше сорбируют ионы тяжелых металлов модифицированные нанокомпозитные сорбенты, например, углеродные нанотрубки, которые имеют емкость по ионам меди (II) 40.9 [17] и 47.39 [18] мг/г при рН 6, что также обусловлено более высокой удельной поверхностью материала.
Как показывает проведенный сравнительный анализ, чаще всего адсорбцию ионов меди проводят в кислой среде, при значении рН рабочего раствора не более 6.0. В подобных условиях и при небольших начальных концентрациях ионы меди находятся преимущественно в виде катиона Cu2+, т.е. степень гидролиза еще не так высока. В наших экспериментах при добавлении бетонной суспензии в кислый модельный раствор нитрата меди (II) наблюдалось резкое увеличение рН до 8.5, что, вероятнее всего, вызвано растворением оксида кальция, входящего в состав бетона, и образованием гидроксида Ca(OH)2, повышающего щелочность среды. Таким образом, происходила нейтрализация, в результате которой обычно формируются гидроксокомплексы металла. Ввиду того, что процессы адсорбции и нейтрализации металла в растворе происходят параллельно, необходимо было определить, какой из них превалирует в рассматриваемых условиях.
Для ответа на этот вопрос был проведен ряд экспериментов по сравнению степени очистки модельных растворов от ионов меди (II) суспензией бетона и наиболее часто используемыми нейтрализаторами – 1 М растворами NaOH и гашенной извести Ca(OH)2 (без введения суспензии бетона). Данные соединения популярны при нейтрализации кислых стоков, к тому же раствор гашенной извести должен повторять условия, которые могут формироваться в модельном растворе при вымывании оксида кальция с поверхности бетонных частичек.
В указанной серии экспериментов регулировали величину рН рабочего раствора перечисленными реагентами и сравнивали равновесную концентрацию меди в фильтрате после отделения осадка гидроксида (в случае использования NaOH) и порошка реагента (при добавлении гашенной извести или бетонной суспензии). Следует отметить, что при добавлении бетона величину рН регулировали не изменением массы материала, а 0.1 М раствором NaOH после внесения навески бетона в рабочий раствор.
Как видно из данных табл. 1, экспериментальные значения остаточных концентраций для трех серий опытов не равны между собой, и характер их изменения в зависимости от рН среды также различен. Так при рН от 7 до 8 меньшая остаточная концентрация ионов меди в фильтрате наблюдается при нейтрализации модельного раствора гидроксидом натрия. В щелочной среде, при рН 10 и выше, эффективность реагентов NaOH и Ca(OH)2 снижается, что может быть связано с растворением осадка гидроксида меди в избытке гидроксид-ионов. При этом эффективность суспензии бетона не снижается. Хуже всего происходит извлечение ионов меди гашеной известью: при рН 11.8 остаточная концентрация меди равна 4.627 мг/л. При этом в случае использования бетонной суспензии при рН 11.6 величина Сост составляет 0.287 мг/л, что существенно ниже. Это указывает на действие дополнительного механизма извлечения металла из раствора. Полученные результаты экспериментов дополнительно подтверждают параллельный процесс адсорбции металла на поверхности бетонных частичек, который также протекает и в сильнощелочной среде.
Таблица 1.
Результаты опытов нейтрализации раствора с ионами Cu2+
| Реагент | рН | Сост(Cu2+), мг/л |
|---|---|---|
| Суспензия Ca(OH)2 | 7.9 | 3.045 ± 0.337 |
| 10.5 | 0.466 ± 0.025 | |
| 11.8 | 4.627 ± 0.662 | |
| NaOH | 7.6 | 0.414 ± 0.043 |
| 10.5 | 0.218 ± 0.032 | |
| 11.4 | 2.301 ± 0.331 | |
| Суспензия бетона | 7.6 | 1.569 ± 0.266 |
| 10.3 | 0.164 ± 0.047 | |
| 11.6 | 0.287 ± 0.035 |
Таким образом, извлечение меди из раствора происходит в основном за счет адсорбции на поверхности бетона, однако результаты опытов приводят к выводу о природе сорбируемых частиц. Поскольку нейтрализация очищаемого раствора будет происходить в любом случае при добавлении бетона, а рН в некоторых случаях может достигать 12, то гидроксокомплексы ионов меди будут неизбежно образовываться. Вероятнее всего, в момент внесения сорбента в раствор и повышения величины рН вначале формируются гидроксокомплексы меди, а затем они сорбируются на поверхности частиц бетона. Также, в соответствии с результатами работы [19], гидролиз и комплексообразование катионов переходных металлов в растворе могут происходить на поверхности кремнийсодержащих материалов, к которым также относится бетон (содержание SiO2 может достигать 50%). Следовательно, влияние механизма адсорбции можно считать превалирующим, при этом адсорбатом выступает не ион Cu2+, а гидроксокомплекс.
Для дальнейшего изучения механизма сорбции была проведена серия экспериментов, в которой варьировали параметры процесса и наблюдали их влияние на количество извлеченного металла. Рассматривали влияние таких параметров, как время контакта сорбента и адсорбата, массы сорбента и рН рабочего раствора, которое регулировали путем введения раствора NaOH до внесения в раствор бетона.
Приведенные в табл. 2 результаты экспериментов позволяют сделать два основных вывода о течении процесса. Во-первых, рН рабочего раствора практически не влияет на количество извлеченного металла. Сорбент одинаково эффективно работает как в кислой, так и в щелочной среде. Так как величину рН регулировали до внесения в раствор навески бетона, то предположение о том, что в рассматриваемых условиях частички бетона покрываются не катионами двухвалентной меди, а ее гидроксокомплексами, находит дополнительное подтверждение. Во-вторых, процесс адсорбции протекает достаточно быстро: уже к 10 минуте достигается предельная величина адсорбции. Высокая скорость процесса может быть обусловлена формированием прочных связей между адсорбентом и адсорбатом, ввиду чего равновесие системы довольно быстро смещается в сторону концентрирования меди на поверхности бетонных частиц.
Таблица 2.
Результаты исследования сорбции Cu2+ бетонной суспензии при 22°С и C0(Сu2+) = 0.4 г/л (m – масса сорбента)
| № | рН | m, г | τ, мин | А, мг/г |
|---|---|---|---|---|
| 1 | 2.10 | 1 | 20 | 20.44 |
| 2 | 4.40 | 1 | 20 | 20.13 |
| 3 | 6.06 | 1 | 20 | 20.55 |
| 4 | 8.76 | 1 | 20 | 21.23 |
| 5 | 10.50 | 1 | 20 | 21.26 |
| 6 | 11.50 | 1 | 20 | 21.07 |
| 7 | 5.48 | 0.20 | 20 | 13 |
| 8 | 6.28 | 0.40 | 20 | 14.4 |
| 9 | 6.33 | 0.60 | 20 | 21.9 |
| 10 | 7.98 | 0.80 | 20 | 24.77 |
| 11 | 8.64 | 1.00 | 20 | 24.12 |
| 12 | 10.10 | 1.20 | 20 | 23.9 |
| 13 | 8.75 | 1 | 5 | 17.13 |
| 14 | 8.59 | 1 | 10 | 20,22 |
| 15 | 8.74 | 1 | 20 | 19.94 |
| 16 | 8.91 | 1 | 30 | 20.07 |
Для аналитического описания полученной изотермы и оценки природы адсорбционных сил использовали наиболее известные уравнения равновесной адсорбции – Ленгмюра, Фрейндлиха, Темкина и Дубинина–Радушкевича. Возможность использования данных моделей для описания процесса адсорбции на границе поверхностей “жидкость–твердое тело” было описано в [20, 21]. Также указанные уравнения широко используются для характеристики изотерм адсорбции различными алюмосиликатами и модифицированными бетонами [22–27].
На рис. 2 приведены линейные формы изотерм сорбции двухвалентной меди на поверхности частиц бетона, а в табл. 3 – рассчитанные параметры для каждой из рассмотренных моделей. По значениям коэффициента детерминации установлено, что лучше всего сорбция двухвалентной меди на поверхности частиц бетонной крошки в водном растворе описывается уравнениями Ленгмюра и Дубинина–Радушкевича, и в наименьшей степени – уравнениями Темкина и Фрейндлиха.
Рис. 2.
Результаты обработки изотермы адсорбции двухвалентной меди по уравнениям моделей Ленгмюра (а), Фрейндлиха (б), Темкина (в), Дубинина–Радушкевича (г).
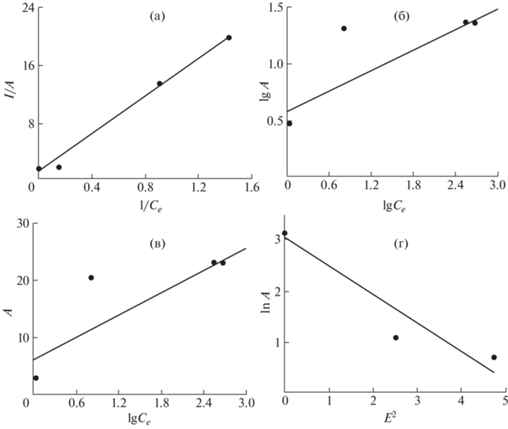
Таблица 3.
Параметры адсорбционного процесса, рассчитанные по моделям Ленгмюра, Фрейндлиха, Темкина и Дубинина–Радушкевича
| Модель | Параметры | ||
|---|---|---|---|
| Ленгмюра | Xm, мг/г | b, л/мг | R2 |
| 29.88 | 0.103 | 0.9923 | |
| Фрейндлиха | Kf, мг/г | n, мг/л | R2 |
| 3.80 | 3.326 | 0.7426 | |
| Темкина | Kt, л/мг | B, кДж/моль | R2 |
| 9.02 | 0.3808 | 0.7929 | |
| Дубинина–Радушкевича | Qt, мг/г | Eа, кДж/моль | R2 |
| 20.90 | 9.64 | 0.9360 | |
Величина предельной емкости монослоя Xm, полученная по уравнению Ленгмюра, составила 29.88 мг/г, что несколько больше определенного по представленной на рис. 1 изотерме адсорбции значения; константа равновесия b = 0.1033 л/мг. Согласно теории Ленгмюра, высокое значение Xm при одновременно низкой величине коэффициента b характерно для сорбентов с высокой адсорбционной способностью к адсорбату, что соответствует высокой эффективности очистки водных растворов от ионов меди.
Несмотря на то, что адсорбция меди на бетоне хорошо описывается уравнением Ленгмюра, в этой модели отсутствует какая-либо информация, позволяющая оценить механизм адсорбции. Для этих целей удобнее использовать уравнение Дубинина–Радушкевича, которое содержит параметр K, с помощью которого возможно установить природу силы взаимодействия между адсорбатом и адсорбентом. Параметр K связан с энергией адсорбции следующим уравнением:
Если значение Еа лежит в диапазоне от 8 до 16 кДж/моль, то следует полагать, что процесс адсорбции протекает по механизму хемосорбции, т.е. с образованием достаточно прочных связей с поверхностью адсорбента. Согласно результатам проведенных нами расчетов (табл. 3), в рассматриваемых условиях энергия адсорбции равна 9.64 кДж/моль, что соответствует химической природе возникающих сил. В таком случае сорбированные частицы достаточно крепко прикрепляются к поверхности сорбента.
Таким образом, адсорбция ионов меди на поверхности бетона происходит с формированием монослоя, который ввиду формирования щелочной среды представлен преимущественно гидроксокомплексами меди. В соответствии с результатами исследования [28], в котором рассматривались природа и структура гидроксокомплексов меди, можно предположить, что поверхность бетона ввиду происходящего в растворе гидролиза покрывается слоем полиядерных комплексов. Согласно результатам [19], связь комплексов с поверхностью осуществляется через силанольные группы кремнезема (также один из основных компонентов бетона). Формирующиеся при этом моно- и бидентантные гидроксокомплексы имеют достаточно высокие значения константы устойчивости: величина $\lg K$ = 5.18 для комплекса SiOMeOH и 5.98 – для SiOMe(OH)(H2O)$_{{(n--1)}}$. Образование подобных поверхностных комплексов соответствует механизму хемосорбции.
Полученные результаты дополнительно подтверждают высокую сорбционную способность бетонной крошки по отношению к двухвалентой меди. Прочное связывание соединений меди на поверхности бетонных частиц за счет возникающих химических сил обусловливает применение этого материала в качестве сорбента для очистки водных сред. При таком механизме остается открытым вопрос о возможности регенерации сорбента и повторном его использовании. Однако вследствие дешевизны и доступности материала, а также больших объемов, его можно использовать в случаях, не требующих многократной эксплуатации, например, при ликвидации аварийных разливов растворов солей металлов или формировании геохимических барьеров.
Список литературы
Pap S., Šolević Knudsen T., Radonić J. et al. // J. Cleaner Production. 2017. V. 162. P. 958. https://doi.org/10.1016/j.jclepro.2017.06.083
Agasti N. // Current Research in Green and Sustainable Chemistry. 2021. V. 4. P. 100088. https://doi.org/10.1016/j.crgsc.2021.100088
Arthi D., Michael Ahitha Jose J., Edinsha Gladis E.H. et al. // Materials Today: Proceedings. 2021. V. 45. P. 1794. https://doi.org/10.1016/j.matpr.2020.08.738
Dawn S.S., Vishwakarma V. // Chemosphere. 2021. V. 273. P. 129677. https://doi.org/10.1016/j.chemosphere.2021.12967
Du H., Zhong Zh., Zhang B. et al. //Ibid. 2021. V. 280. P. 130714. https://doi.org/10.1016/j.chemosphere.2021.130714
Shirvani M., Kalbasi M., Shariatmadari H. et al. // Ibid. 2006. V. 65. P. 2178. https://doi.org/10.1016/j.chemosphere.2006.06.002
Ho H.J., Iizuka A., Shibata E. // J. Cleaner Production. 2021. V. 284. P. 124785. https://doi.org/10.1016/j.jclepro.2020.124785
Chen Q.Y., Tyrer M., Hills C.D. et al. // Waste Management. 2009. V. 29. P. 390. https://doi.org/10.1016/j.wasman.2008.01.019
Yurk V.M., Zaytsev O.B., Zaytseva A.V., Malahova N.A. // Chimica Techno Acta. 2021. V. 8. № 1. P. 20218112.https://doi.org/10.15826/chimtech.2021.8.1.12
Iizuka A., Takahashi M., Nakamura T., Yamasaki A. // Ind. Eng. Chem. Res. 2014. V. 53. P. 4046. https://doi.org/10.1021/ie402176t
Biswal B.K., Chen Zh., Yang En-H. // Chem. Engng J. 2019. V. 360. P. 1082. https://doi.org/10.1016/j.cej.2018.10.155
Chen Q.Y., Tyrer M., Hills C.D. et al. // Waste Management. 2009. V. 29. Is. 1. P. 390. https://doi.org/10.1016/j.wasman.2008.01.019
Гимаева А.Р., Валинурова Э.Р., Игдавлетова Д.К., Кудашева Ф.Х. // Сорбционные и хроматографические процессы. 2011. Т. 11. Вып. 3. С. 350.
Шевелева И.В., Холомейдик А.Н., Войт А.В., Земнухова Л.А. // Химия растительного сырья. 2009. № 4. С. 171.
Костин А.В., Мосталыгина Л.В., Бухтояров О.И. // Сорбционные и хроматографические процессы. 2012. Т. 12. Вып. 6. С. 949.
Шайхиев И.Г., Шайхиева К.И. // Вестн. Казанск. технолог. ун-та. 2015. Т. 18. № 2. С. 445.
Ali I., Burakov A.E., Melezhik A.V. et al. // Materials Science inc. Nanomaterials & Polymers. 2019. V. 4. P. 12708. https://doi.org/10.1002/slct.201902657
Burakov A.E., Galunin E.V., Burakova I.V. et al. // Ecotoxicology and Environmental Safety. 2018. V. 48. P. 702. https://doi.org/10.1016/j.ecoenv.2017.11.034
Власова Н.Н. // Поверхность. 2009. Т. 16. № 1. С. 4.
Адсорбция из растворов на поверхности твердых тел: Пер. с англ. / Под ред. Г. Парфита, Г. Рочестера. М.: Мир, 1986. 488 с.
Фролов Ю.Г. Курс коллоидной химии. Поверхностные явления и дисперсные системы. Учебник для вузов. 2-е изд., перераб. и доп. М.: Химия, 1988. 464 с.
Zhu Ji-H., Wu X.-Ya., Mohamed I.M.A., Xing F. // Chem. Phys. Lett. 2022. V. 786. P. 139186. https://doi.org/10.1016/j.cplett.2021.139186
Kang S., Lee J., Park S.-M. et al. // Chemosphere. 2020. V. 259. P. 127494. https://doi.org/10.1016/j.chemosphere.2020.127494
Ma Z., Xue R., Li J.-S. et al. // Environmental Pollution. 2021. V. 277. P. 116776 https://doi.org/10.1016/j.envpol.2021.116776
Kang S., Lee J., Park S.-M. et al. // Chemosphere. 2020. V. 259. P. 127494. https://doi.org/10.1016/j.chemosphere.2020.127494
Senol Z.M., Uluso U. // Chem. Eng. J. 2010. V. 162. P. 97. https://doi.org/10.1016/j.cej.2010.05.005
Thanos A.G., Katsou E., Malamis S. et al. // Applied Clay Sci. 2017. V. 147. P. 54. https://doi.org/10.1016/j.clay.2017.05.040
Fedorova E.A., Maskaeva L.N., Markov V.F. et al. // Russ. J. Phys. Chem. A. 2019. V. 93. № 5. P. 970. https://doi.org/10.1134/S0036024419050091
Дополнительные материалы отсутствуют.
Инструменты
Журнал физической химии



