Физиология растений, 2023, T. 70, № 5, стр. 451-460
Молекулярно-генетические основы устойчивости подсолнечника к заразихе
М. А. Лебедева a, *, М. С. Ганчева a, М. Р. Лосев a, А. А. Крутикова b, К. В. Племяшов c, Л. А. Лутова a
a Санкт-Петербургский государственный университет, кафедра генетики и биотехнологии
Санкт-Петербург, Россия
b Всероссийский научно-исследовательский институт генетики и разведения сельскохозяйственных животных
Санкт-Петербург, Россия
c Санкт-Петербургский государственный университет ветеринарной медицины
Санкт-Петербург, Россия
* E-mail: m.a.lebedeva@spbu.ru
Поступила в редакцию 21.02.2023
После доработки 27.02.2023
Принята к публикации 28.02.2023
- EDN: WWJIVN
- DOI: 10.31857/S0015330323600158
Аннотация
Заразиха кумская, или подсолнечная (Orobanche cumana Wallr.) является облигатным паразитическим растением, специфично поражающим подсолнечник и способным вызвать значительные потери его урожая. В связи с этим получение устойчивых к заразихе сортов подсолнечника представляет важную для сельского хозяйства задачу. Селекция подсолнечника на устойчивость к заразихе была начата еще в начале XX в. Важная заслуга в этом принадлежит советским селекционерам. Однако получение новых устойчивых сортов подсолнечника сопровождалось появлением новых вирулентных рас заразихи, которые преодолевали действие генов устойчивости. Для ряда генетических локусов подсолнечника, определяющих устойчивость к заразихе, было определено местоположение на генетической карте, но лишь для некоторых из них были установлены вероятные гены-кандидаты и описан возможный молекулярный механизм их действия. Кроме того, в недавнее время были получены транскриптомные данные для устойчивых и чувствительных к заразихе сортов подсолнечника, что также позволяет приблизиться к пониманию молекулярных основ формирования устойчивости. Рассмотрению молекулярно-генетических механизмов устойчивости подсолнечника к заразихе, выявленных на основании данных по картированию локусов устойчивости и определению вероятных генов-кандидатов, а также данных транскриптомных исследований, и посвящен наш обзор.
ВВЕДЕНИЕ
Подсолнечник (Helianthus annuus L.) – четвертая по значимости масличная культура в мире. Урожайность подсолнечника падает при заражении различными паразитами, наибольший урон среди которых наносит заразиха подсолнечная (кумская) (Orobanche cumana Wallr.). Заразиха является облигатным паразитическим растением, не вырабатывающим хлорофилл, в связи с чем жизненно важным для нее становится контакт с растением-хозяином. Первое упоминание заражения заразихой подсолнечника относится к концу XIX в., когда в России начали активно выращивать подсолнечник, и заразиха, ранее паразитирующая на полыни видов Artemisia maritima incana Schm и A. austriaca Jacq., переключилась на новый вид растения-хозяина. O. сumana проявляет высокую специфичность в отношении подсолнечника, который является единственной сельскохозяйственной культурой, поражаемой заразихой этого вида. Это отличает O. cumana от других паразитических растений из рода Orobanche, имеющих более широкий спектр растений-хозяев как среди сельскохозяйственных культур, так и среди представителей дикой природы [1]. Основным средством борьбы с заразихой является селекция подсолнечника на устойчивость к ней. Первый заразихоустойчивый сорт подсолнечника (Круглик 7-15-163) был выведен на Кубани в 1916 г. В.С. Пустовойтом методом многократного индивидуального отбора [2]. Впоследствии было получено еще несколько сортов, устойчивых к заразихе и при этом характеризующихся высокими показателями хозяйственно ценных признаков [2]. Однако уже к концу 1920-х гг. эти сорта оказались неустойчивыми к новой расе заразихи, поразившей поля в Краснодарском крае, Ростовской и Воронежской областях. Таким образом, были дифференцированы две расы заразихи: раса A, к которой устойчивы первые выведенные заразихоустойчивые сорта подсолнечника, и раса B, к которой данные сорта оказались не устойчивыми [2, 3]. С этого началась гонка между селекционерами и заразихой. Каждый успех селекционеров в получении новых устойчивых сортов подсолнечника сопровождался появлением новых вирулентных рас заразихи, которые преодолевали действие генов устойчивости. На данный момент выделяют уже восемь рас заразихи, названных A, B, C, D, E, F, G и H, при этом доминирующей на большинстве полей Российской Федерации является раса G [4]. В связи с этим, генетическую устойчивость подсолнечника к заразихе можно рассматривать как “вертикальную”, возникающую к определенной расе (или определенному биотипу, выделяемому в пределах конкретной расы). По-видимому, такая устойчивость в каждом случае обусловлена возникновением доминантных мутаций в отдельных генах и определяется взаимодействием “ген-на-ген”: взаимодействием между геном устойчивости хозяина и геном авирулентности растения-паразита [1]. Это отличает взаимоотношения O. cumana с подсолнечником от взаимоотношений других представителей рода Orobanche с их растениями-хозяевами, у которых устойчивость в большинстве случаев является “горизонтальной”, не обладающей расовой специфичностью [1, 5]. Гены подсолнечника, определяющие устойчивость к расам заразихи, принято обозначать как Or (от Orobanche resistance). Так, Vranceanu с соавт. [6] было предложено использовать обозначения Or1–Or5 для генов, определяющих устойчивость к известным на тот момент расам заразихи А–Е. В дальнейшем сходным образом были названы гены, обеспечивающие устойчивость к расам заразихи F и G (гены Or6 и 7 соответственно). Однако следует отметить, что расы заразихи могут быть неоднородны и включать комплекс биотипов, отличающихся, в том числе, и по географическому распространению, и устойчивость к ним может определяться различными генами [3]. Лишь небольшое число генов подсолнечника, определяющих устойчивость к заразихе, было картировано, и предполагаемый молекулярный механизм действия был определен лишь для некоторых из них. Обсуждению этих механизмов и будет уделено основное внимание в настоящем обзоре.
Для начала рассмотрим жизненный цикл заразихи подсолнечной и основные этапы ее взаимоотношений с растением-хозяином.
ЖИЗНЕННЫЙ ЦИКЛ ЗАРАЗИХИ ПОДСОЛНЕЧНОЙ
Заразиха (Orobanche) – род паразитических растений из семейства Заразиховые (Orobanchaceae). Представители рода относятся к голопаразитам, т.е. они неспособны к фотосинтезу и в питании полностью зависят от растения-хозяина. Род Заразиха включает в себя более 200 видов, каждый из которых паразитирует на своем спектре хозяев. O. cumana является высокоспецифичным паразитом подсолнечника, способным уничтожить до 100% урожая. Поскольку подсолнечник – важная сельскохозяйственная культура, комплексное изучение паразитических отношений подсолнечника и заразихи представляется крайне важным.
Заразиха подсолнечная – высокопродуктивный вид: одно растение образует несколько тысяч крошечных семян почти микроскопического размера, которые распространяются на большие расстояния ветром или за счет прикрепления к другим объектам, в т.ч. к семенам подсолнечника [7]. Семя заразихи сохраняет жизнеспособность многие годы (до 20 лет) и прорастает только в присутствии потенциального хозяина, корни которого вырабатывают стимулятор прорастания семени заразихи [8]. Известно, что за прорастание семян паразитических растений ответственны фитогормоны стриголактоны, выделяемые корнями растения-хозяина. Основными стриголактонами, выделяемыми подсолнечником, являются оробанхила ацетат, 5-деоксистригол, а также сесквитерпеновые лактоны [9]. Кроме того, в корнях подсолнечника были выявлены 5-сорголактон и оробанхол [10]. Показано, что специфическим индуктором прорастания семян заразихи O. cumana является сесквитерпеновый лактон дегидрокостус-лактон, выделяемый корнями заразихи [8]. Кроме того, способность стимулировать прорастания семян заразихи описана для ряда других сесквитерпеновых лактонов [11], а также для неканонического стриголактона – гелиолактона [12].
После индукции прорастания зародышевым корнем растения формируется апрессорий – структура для прикрепления к корню подсолнечника. Клетки корня подсолнечника вырабатывают низкомолекулярные сигнальные вещества, индуцирующие формирование гаустории (haustoria-inducing factors, HIFs) [13]. Как было показано для ряда паразитических растений, в роли факторов, индуцирующих рост гаустории, выступает диметокси-p-бензохинон (ДМБХ), а также ряд других структурно родственных хинонов, которые, предположительно, могут возникать в результате разрушения лигнина клеточной стенки-растения хозяина [14]. Однако, в отношении O. cumana обработка ДМБХ не оказывала стимулирующего эффекта на рост и развитие гаустории, вызывая некроз корешка [15]. Гаустория – это структура, формируемая корнем заразихи для проникновения в осевой цилиндр корня подсолнечника [16]. Между проводящими системами паразита и хозяина устанавливается структурная связь, и заразиха использует питательные вещества, транспортируемые по проводящим тканям корня подсолнечника. C внешней стороны, в области прикрепления к корню подсолнечника, ткани проростка заразихи разрастаются с образованием так называемого “клубенька” (англ. tubercle), в котором происходит накопление питательных веществ. Впоследствии клубенек дает начало генеративным побегам, выходящими на поверхность почвы [16]. Цветки у заразихи подсолнечной мелкие и невзрачные, с изогнутым трубчатым венчиком. O. cumana относится к самоопылителям, однако способна и к перекрестному опылению [17]. В целом, в жизненном цикле заразихи можно выделить следующие стадии: 1) прорастание семени под индуцирующим влиянием веществ из корней подсолнечника; 2) формирование апрессория и прикрепление к корню растения-хозяина; 3) прорастание корешка заразихи (который на этом этапе многие исследователи называют гаусторией) сквозь клетки коры корня подсолнечника; 4) установление структурной связи между проводящими системами (ксилемой и флоэмой) корня заразихи и подсолнечника (формирование собственно гаустории); 5) образование заразихой “клубеньков” в области прикрепления у поверхности корня подсолнечника; 6) формирование из клубеньков генеративных побегов с цветками; 6) самоопыление заразихи и формирование нового поколения семян (рис. 1).
Рис. 1.
Схема жизненного цикла заразихи подсолнечной и возможные механизмы формирования устойчивости. Описанные в литературе примеры устойчивости связаны с блоком развития гаустории в тканях корня подсолнечника и некрозом гаустории, а также с блоком развития клубенька заразихи на этапе после установления контакта проводящих систем подсолнечника и заразихи. В частности, устойчивость на этапе проникновения гаустории в кору корня определяется геном Or7, кодирующим рецепторную киназу с доменом LRR, вероятно, задействованную в рецепции эффекторного белка, выделяемого заразихой и в запуске иммунного ответа. Устойчивость на этом же этапе также контролируется локусом OrDeb2, среди генов-кандидатов для которого описаны гены, кодирующие рецепторные белки с доменом LRR, но лишенные киназного домена, а также гены, кодирующие рецептор-подобные белки с кинзаными доменами, но лишенные экстраклеточного домена LRR. Такие белки могут работать в комплексах и узнавать эффекторные белки, выделяемые заразихой. Кроме того, среди вероятных кандидатов локуса Or5, описан ген, кодирующий белок NLR, относящийся к классу иммунных рецепторов, узнающих внутриклеточные эффекторные белки и активирующих иммунный ответ. Устойчивость на этапе после установления контакта проводящих систем подсолнечника и заразихи описана, в частности, для локуса OrSII, гены-кандидаты для которого еще не определены.
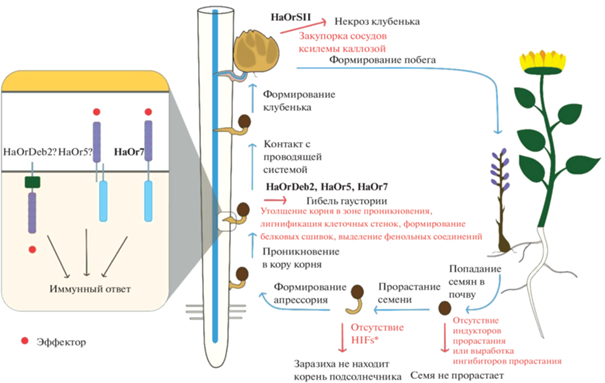
Устойчивость растения-хозяина к заразихе может формироваться на нескольких стадиях заражения – на этапе прорастания семени заразихи до прикрепления к корню подсолнечника; на этапе прорастания гаустории сквозь ткани корня растения-хозяина в направлении к его проводящему цилиндру; на этапе установления соединения гаустории с проводящей системой хозяина, а также на этапе развития клубенька заразихи. Возможным механизмом устойчивости может быть снижение выработки корнями подсолнечника индукторов прорастания семян заразихи, однако в природе такого рода устойчивые формы не были описаны [18]. Кроме того, на интенсивность прорастания семян заразихи может влиять выработка ингибиторов прорастания, в частности, кумарина, относящегося к фитоалексинам [19]. Описан целый ряд примеров возникновения устойчивости к заразихе, связанных с подавлением роста гаустории в коре корня подсолнечника и ее некрозом, а также с предотвращением формирования функционирующей гаустории [20]. Так, при развитии некоторых вариантов устойчивости в месте контакта с корнем заразихи клетки суберинизируются и лигнифицируются, формируются поперечные белковые сшивки между клеточными стенками соседних клеток, выделяются фенольные соединения, токсичные для заразихи [21]. Показана роль пероксидаз, образующихся в клетках зародышевого корня заразихи, в лигнификации клеточных стенок коры корня подсолнечника [20]. Пероксидазы заразихи взаимодействуют с фенольными соединениями, которые выделяются клетками корня подсолнечника, в результате чего запускается лигнификация их клеточных стенок. При этом расы заразихи, не продуцирующие пероксидазы (например, раса D), могут быть способны проникать в ткани растения-хозяина и формировать гаустории [20]. Кроме того, в ряде случаев, когда заразиха уже смогла проникнуть к осевому цилиндру растения-хозяина и сформировать функциональную гаусторию, может происходить закупоривание сосудов ксилемы корня подсолнечника каллозой в месте взаимодействия проводящих тканей паразита и хозяина, что приводит к отмиранию развивающихся клубеньков заразихи. В частности, возникновение устойчивости на этом этапе связывают с повышением уровня экспрессии гена синтазы каллозы HaGSL1 [22].
Для эффективной борьбы с заразихой подсолнечной необходимо понимание того, какие молекулярные механизмы могут определять такую устойчивость. Приблизиться к их расшифровке помогли работы по картированию и идентификации генов, определяющих устойчивость к заразихе, исследования спектров экспрессирующихся генов, различающихся у устойчивых и чувствительных к заразихе форм, а также работы по выявлению ассоциированных с устойчивостью к заразихе QTL-локусов (quantitative trait locus, локусов количественных признаков).
ВЫЯВЛЕНИЕ ГЕНОВ УСТОЙЧИВОСТИ ПОДСОЛНЕЧНИКА К ЗАРАЗИХЕ МЕТОДОМ ПОЗИЦИОННОГО КЛОНИРОВАНИЯ
Для многих устойчивых к заразихе форм подсолнечника, полученных в результате селекции, был изучен характер наследования признака устойчивости. В большинстве случаев устойчивость к заразихе наследуется как доминантный моногенный признак. В частности, было показано, что устойчивость к расам A–E [6, 23, 24], F [25] и G [26] наследуется как моногенный доминантный признак. Однако, некоторые варианты устойчивости наследуются как доминантные признаки, контролируемые двумя генами [27]. Кроме того, в ряде случае устойчивость к заразихе наследовалась как рецессивный признак, контролируемый одним геном (устойчивость к расам E–G [28]) или двумя генами (устойчивость к расе F [29]).
Для ряда локусов устойчивости к заразихе были проведены эксперименты по картированию на хромосомах подсолнечника. Так, одним из первых был картирован локус Or5, определяющий устойчивость к расе E, который был локализован в теломерном участке третьей хромосомы [30]. Конкретный ген-кандидат для этого локуса так и не был выявлен. В работе Radwan с соавт. [31] было высказано предположение о том, что локус Or5 может быть колокализован с геном, кодирующим белок NLR (nucleotide binding site (NBS) leucine-rich repeat (LRR)): один из генов, кодирующих NLR был идентифицирован как раз в области теломерного/околотеломерного участка третьей хромосомы. Белки NLR известны как иммунные рецепторы, участвующие в распознавании эффекторных молекул фитопатогенов. Значительная часть R-генов растений, определяющих устойчивость растений к фитопатогенам в системе “ген-на-ген”, как было показано в последние годы, кодирует как раз белки NLR, узнающие специфические эффекторы фитопатогенов и запускающие иммунные реакции в организме растения-хозяина (ETI, effector triggered immunity) [32]. Впоследствии были картированы локусы, ассоциированные с устойчивостью к расам B, D и F (гены Or2, Or4 и Or6), которые также были локализованы на третьей хромосоме [33]. Но конкретные гены, определяющие устойчивость к заразихе, в этих исследованиях также не были идентифицированы. Ген Or7 стал первым и к настоящему времени единственным геном, для которого было осуществлено точное картирование, позволившее выявить его молекулярную природу [34].
Обуславливающий устойчивость к расе F заразихи ген Or7 был локализован на седьмой хромосоме и успешно клонирован в работе Duriez с соавт. [34]. Ген Or7 (HanXRQChr07g0202981), как оказалось, кодирует рецепторную киназу с лейцин-богатыми повторами. У сортов подсолнечника, чувствительных к заразихе, был обнаружен преждевременный стоп-кодон в гене Or7, приводящий к отсутствию трансмембранного и киназного домена у кодируемого этим геном белка. У сортов подсолнечника, устойчивых к расе F заразихи, такой преждевременный стоп-кодон в гене Or7 отсутствует, таким образом, у них ген Or7 кодирует полноразмерный рецепторный белок. Растения подсолнечника с полноразмерным белком Or7 были устойчивы к заражению заразихой: у них наблюдался блок на этапе установления соединения с проводящей системой паразита. Важно отметить, что рецептор Or7 обладает значительным сходством по последовательности с “иммунным” рецептором XA21 риса, наличие которого обуславливает устойчивость к бактериальному патогену Xanthomonas oryzae pv. oryzae. Рецепторная киназа XA21 риса узнает эффекторный пептид, продуцируемый X. oryzae, приводящий к активации иммунного ответа у растения-хозяина и формированию устойчивости к фитопатогену [35]. Интересно, что продуцируемый X. oryzae пептид, названный RaxX (required for activation of XA21-mediated immunity X) схож по последовательности с пептидным гормоном PSY1 резуховидки Arabidopsis thaliana, относящимся к группе сульфатированных регуляторных пептидов [35]. Можно предположить, что белок Or7 также функционирует по схожему принципу и может участвовать в рецепции гипотетического сульфатированного пептида – фактора авирулентности, выделяемого заразихой и запускающего иммунный ответ у подсолнечника (рис. 1). Такого рода реакции относят к так называемому эффектор-индуцируемому иммунитету (effector-triggered immunity), который лежит в основе принципа “ген-на-ген” при взаимодействии растений с фитопатогенами [36]. Однако, к настоящему времени механизм действия рецепторной киназы Or7 подсолнечника остается не изученным, и ее лиганд выявлен не был.
Для локуса OrSII (System II resistance), определяющего устойчивость к расам заразихи F и G, также были проведены работы по картированию [37, 38]. Этот локус был получен от устойчивой инбредной линии подсолнечника PHSC1102, созданной компанией Pioneer Hi-Bred International (США) в 2008 г. [37]. Он был картирован на четвертой хромосоме подсолнечника. Локус OrSII определяет устойчивость к заразихе на этапе формирования функциональной гаустории: у устойчивых растений происходит установление контакта с проводящей системой хозяина, формируются клубеньки, из которых развиваются побеги, останавливающиеся в дальнейшем развитии [38]. Гистологический анализ позволил выявить накопление фенольных соединений в клубеньках, формируемых заразихой на корнях устойчивой линии, что, по мнению авторов, может обуславливать остановку роста растения-паразита на корнях устойчивых форм [38]. Однако, молекулярную природу гена OrSII и механизм его действия в формировании устойчивости к заразихе еще предстоит выявить.
OrDeb2 – еще один локус устойчивости к заразихе, который был картирован у подсолнечника. OrDeb2 локализован на четвертой хромосоме в области, охватывающей 1.38 млн п.н., и включающей 41 аннотированный ген [39]. Среди них выявлено девять генов, кодирующих киназы, а также шесть генов, кодирующих малые белки теплового шока. В пределах этого участка обнаружен кластер генов, кодирующих рецептор-подобные белки, содержащие домены LRR, но лишенные цитоплазматического киназного домена, а также рецептор-подобные белки, не содержащие экстраклеточного домена, но с одним или более киназным доменом. По мнению авторов, эти гены могут являться кандидатами на роль гена OrDeb2. Ближайшими гомологами киназ, закодированных в области локуса OrDeb2, у других растений являются рецептор-подобные белки из группы FERONIA и другие рецепторные киназы с малектин-подобным доменом [39]. Локус OrDeb2, обуславливающий устойчивость к заразихе, был получен при скрещивании с диким предком подсолнечника, Helianthus debilis subsp. tardiflorus, и введен в линию подсолнечника, названную DEB2, устойчивую к трем расам заразихи – E, F и G [26, 39]. Устойчивость к O. cumana, определяемая локусом OrDeb2, обусловлена нарушением проникновения заразихи в ткани корня растения-хозяина, так , как и в случае Or7-опосредованной устойчивости. В большинстве случаев, как было показано с помощью гистологического анализа, рост корешка заразихи останавливался в коре корня хозяина и не проникал в эндодерму [39]. По предположению авторов, такая остановка в формировании гаустории может быть связана с образованием изоляционного слоя из клеток коры вокруг тканей паразита, утолщением клеточных стенок клеток коры и накоплением в них суберина, или же с выделением клетками подсолнечника фенольных веществ, токсичных для заразихи, поскольку подобные процессы были отмечены и для других случаев устойчивости к заразихе, описанных в литературе [39].
ВЫЯВЛЕНИЕ QTL-ЛОКУСОВ, АССОЦИИРОВАННЫХ С УСТОЙЧИВОСТЬЮ ПОДСОЛНЕЧНИКА К ЗАРАЗИХЕ, И СВЯЗАННЫХ С НИМИ ГЕНОВ-КАНДИДАТОВ
В работе Louarn с соавт. [40] была проведена масштабная работа по картированию в геноме подсолнечника QTL-локусов, определяющих устойчивость к заразихе. Авторы использовали 101 рекомбинантную инбредную линию подсолнечника, полученную от потомков скрещивания между родительскими линиями HA89 и LR1 (сама линия LR1 изначально была получена от межвидового гибрида H. annuus и дикорастущего вида H. debilis) [40]. Данные инбредные линии были охарактеризованы по признакам устойчивости к расам F и G заразихи. В качестве показателей устойчивости авторы оценивали несколько параметров, свидетельствующих об устойчивости на разных стадиях развития паразитизма: долю “несовместимых прикреплений” (incompatible attachments), проявляющихся визуально в виде потемнений в области контакта корешка заразихи и корня растения-хозяина в случае активации устойчивости на этапе развития гаустории; долю некротизированных клубеньков, образующихся при включении механизмов устойчивости уже после развития гаустории; установление контакта проводящих систем паразита и хозяина и формирование клубенька, а также число появившихся надземных побегов заразихи в полевых экспериментах. Родительские формы различались по доле выявленных “несовместимых прикреплений”: их процент был выше у линии LR1 (46.51%) по сравнению с линией HA89 (3.51%), что свидетельствует о большей устойчивости к заразихе линии LR1, при этом образования некротизированных клубеньков не были отмечено у обеих родительских линий [40]. Интересно, что для линии LR1 ранее было показано закупоривание сосудов ксилемы подсолнечника каллозой в результате повышенной экспрессии гена синтазы каллозы HaGSL1 в области контакта с гаусторией заразихи [22]. Среди рекомбинантых инбредных линий подсолнечника были выявлены линии с высоким процентом “несовместимых прикреплений” (>50%), а также линии, образующие некротизированные клубеньки с частотой 50–60%, что свидетельствует о наличии у них механизмов устойчивости к заразихе, проявляющихся на разных стадиях паразитизма. Всего в данном исследовании было выявлено 17 QTL-локусов, определяющих устойчивость к расам F и G заразихи O. cumana, распределенных по девяти хромосомам подсолнечника. Среди возможных генов-кандидатов, колокализованных с QTL, авторы выделяют ген, кодирующий белок NBS-LRR (nucleotide-binding site leucine-rich repeat, NLR), ранее охарактеризованный в работе [31]. Этот ген оказался колокализован с локусом QTL на хромосоме 15, который определяет повышенное число “несовместимых прикреплений” при заражении расой F. Кроме того, среди возможных генов-кандидатов авторы отмечают также три гена, кодирующих белки CC-NBS-LRR (coiled-coil NLR), колокализованные с локусами QTL, которые определяют устойчивость к заразихе на разных стадиях развития: 1) способность к подавлению роста гаустории расы F в случае QTL на хромосоме 15, 2) способность к подавлению роста клубенька расы F в случае QTL на хромосоме 17, 3) снижение числа надземных побегов заразихи в полевых экспериментов в случае QTL на хромосоме 13) [40]. Таким образом, гены, кодирующие NBS-LRR и CC-NBS-LRR, могут быть задействованы в формировании устойчивости к заразихе как на стадии установления контакта гаустории с проводящей системой подсолнечника, так и на стадии развития клубенька. Участие белков NLR в установлении расоспецифичной устойчивости было показано ранее для взаимоотношений вигны и поражающего ее растения-паразита стриги Striga gesnerioides [41]. Устойчивость вигны сорта B301 к определенным расам стриги зависела от наличия функционального продукта гена RSG3-301, кодирующего белок NLR, – выключение этого гена приводило к потери устойчивости. При этом у устойчивого сорта вигны происходил блок на этапе установления соединения проводящих систем стриги и растения-хозяина, а также наблюдалась реакция сверхчувствительности в месте контакта и, как следствие, некроз тканей растения-паразита [41].
Секвенирование генома подсолнечника [42], накопление данных об однонуклеотидных полиморфных локусах (SNP, single nucleotide polymorphism) у различных линий и сортов в недавнем времени позволили провести полногеномный поиск ассоциаций (GWAS, genome wide association study) для признака устойчивости к заразихе. В исследовании Calderón-González с соавт. [43] в анализ были взяты 104 линии подсолнечника с различным уровнем устойчивости к трем популяциям O. cumana: к популяции расы F, собранной в Испании (так называемая раса FGV (от Guadalquivir Valley, долина реки Гвадалквивир), расы EFR, собранной во Франции, и расы GTK, собранной в Турции. В этом исследовании наиболее значимые ассоциации с признаком устойчивости к заразихе были обнаружены для SNP, расположенных в двух участках третьей хромосомы подсолнечника. Первый участок, длиной 5.2 млн п.н., включающий SNP, ассоциированные с устойчивостью к расам E и F заразихи, содержал ряд генов, кодирующих белки-транспортеры и переносчики, в частности, транспортер сахаров семейства SWEET, транскрипционные факторы из семейств C3H и AS2-LOB, а также ряд других белков. Второй участок, длиной 6.7 млн п.н., включал SNP, ассоциированные с устойчивостью к расе F. Важно отметить, что ранее с помощью методов позиционного картирования в теломерном участке третьей хромосомы был локализован ген Or5 [30], но область локализации Or5, по данным Calderón-González с соавт. [43], лежала за пределами участков третьей хромосомы, которые были ассоциированы с признаком устойчивости к заразихе. Кроме того, ранее Imerovski с соавт. [44] методом генетического картирования выявил в пределах третьей хромосомы также два локуса, or3.1 и or3.2, определяющие устойчивость к заразихе (оценивалась устойчивость к расе G из Сербии). Как отмечает Calderón-González с соавт. [43], эти локусы находятся как раз вблизи тех участков третьей хромосомы, которые показали наиболее значимые ассоциации с признаком устойчивости в их исследовании. Кроме того, Akhtouch с соавт. [45] также ранее картировали один из локусов устойчивости к расе F, наследуемой как рецессивный признак, в третьей хромосоме. По данным Calderón-González с соавт. [43], этот локус находится рядом с участком размером в 6.7 млн п.н., выявленном в их исследовании [43]. Таким образом, с помощью различных подходов удалось обнаружить схожие участки в геноме подсолнечника, ответственные за формирование признака устойчивости к заразихе. Кроме того, Calderón-González с соавт. [43] также выявили ряд ассоциаций признака устойчивости к заразихе и с SNP на других хромосомах: 5, 10, 13, 15 и 16 [43]. Так, рядом с SNP на хромосоме 16, демонстрирующим значимую ассоциацию с признаком устойчивости к расе G, обнаружен ген, кодирующий этилен-зависимый транскрипционный фактор ERF114.
Более детальное изучение функций генов-кандидатов, расположенных в областях генома, выявленных с помощью GWAS в работе Calderón-González с соавт. [43], позволит лучше понять молекулярные основы взаимодействия подсолнечника с заразихой.
ВЫЯВЛЕНИЕ ГЕНОВ, ОПРЕДЕЛЯЮЩИХ УСТОЙЧИВОСТЬ ПОДСОЛНЕЧНИКА К ЗАРАЗИХЕ, С ПОМОЩЬЮ МЕТОДОВ ТРАНСКРИПТОМНОГО АНАЛИЗА
При сравнении профиля экспрессии генов устойчивого и чувствительного к заразихе сортов подсолнечника в работе Sisou с соавт. [46] были выявлены гены, дифференциально экспрессирующиеся при взаимодействии с заразихой. Авторы анализировали профили экспрессии генов до воздействия заразихи и на пятый день после “заражения” заразихой (нанесения на корни подсолнечника семян заразихи, предварительно стерилизованных и обработанных GR24 – синтетическим аналогом стриголактонов для индукции прорастания семян). В работе сравнивали чувствительный сорт (‘D.Y.3’) и устойчивый к заразихе сорт подсолнечника (‘EMEK3’), у которого происходил блок развития гаустории в клетках коры корня в связи с их лигнификацией. Среди дифференциально экспрессирующихся генов были выявлены гены, для которых ранее было показано участие в ответе на заражение патогенами. Это гены, кодирующие β-1,3-эндоглюканазу, β-глюканазу и этилен-зависимый транскрипционный фактор ERF4. В частности, у устойчивого к заразихе сорта наблюдалась пониженная экспрессия гена ERF4. Для A. thaliana было показано, что мутация в гене ERF4 обуславливала устойчивость к грибу Fusarium oxysporum, тогда как сверхэкспрессия этого гена вызывала подавление экспрессии генов, задействованных в ответе на стресс [47]. У устойчивого к заразихе сорта подсолнечника также была увеличена экспрессия генов, кодирующих ферменты β-глюканазы, разрушающие β-глюканы – компоненты клеточной стенки растений. Предполагается, что β-глюканазы растения-хозяина могут разрушать клеточные стенки заразихи, что приводит к высвобождению эффекторных молекул, запускающих иммунные реакции в корне подсолнечника, в частности, накопление лигнина и других фенольных соединений в месте проникновения паразита. В результате этого заразихе не удается установить соединение с сосудистой системой хозяина, что приводит к некрозу тканей паразита [46].
Кроме того, в недавнем исследовании Huang с соавт. [48] был проведен транскриптомный анализ проростков подсолнечника линии HZ2399, устойчивой к расе F заразихи, по сравнению с контрольной линией, не обладающей устойчивостью. В этой работе были проанализированы самые ранние этапы взаимодействия подсолнечника с заразихой: от 4 до 72 ч после внесения семян заразихи к проросткам подсолнечника. В проростках устойчивой линии авторы выявили увеличение уровней экспрессии генов, ответственных за взаимодействие растений с фитопатогенами, биосинтез фенил-пропаноидных соединений, MAP-киназный сигналинг, гормональный сигналинг, биосинтез флавоноидов и пероксидазную активность. Среди генов с повышенной активностью в проростках устойчивой линии подсолнечника авторы выделили три гена, увеличение уровня экспрессии которых было подтверждено с помощью ОТ-ПЦР в реальном времени: 4CL2 (ген 4-кумарат:CoA лигазы, участвующей в биосинтезе фенил-пропаноидных соединений), EDS1 (Enhanced Disease Susceptibility 1, кодирующий белок, участвующий в иммунном сигнальном пути, опосредованном внутриклеточными иммунными рецепторами NLR (nucleotide-binding/leucine-rich-repeat)), а также ген TGA3 (кодирующий транскрипционный фактор, опосредующий активацию экспрессии генов в ответ на действие салициловой кислоты). По мнению авторов, эти гены могут играть ключевую роль в формировании устойчивости подсолнечника к заразихе [48]. Однако, для понимания механизмов устойчивости к заразихе, необходимо также знание того, на каком именно этапе при заражении устойчивой линии HZ2399 наблюдается блок развития паразита.
ЗАКЛЮЧЕНИЕ
Большинство описанных форм устойчивости подсолнечника к заразихе относится к так называемой “вертикальной” устойчивости, формирующейся по отношению к определенным расам заразихи. Такая устойчивость развивается по механизму, известному как “ген-на-ген”, основанному на взаимодействии между продуктами гена устойчивости хозяина и гена авирулентности растения-паразита. Как было показано для различных примеров взаимодействия растений с фитопатогенами, в системе “ген-на-ген” в большинстве случаев ген растения-хозяина, определяющий устойчивость, кодирует рецептор, способный распознавать специфический эффекторный белок, кодируемый геном авирулентности фитопатогена. Распознавание эффекторного белка фитопатогена рецептором растения-хозяина запускает так называемый специфический эффектор-опосредованный иммунитет (ETI), включающий развитие реакции сверхчувствительности и формирование системной устойчивости к фитопатогену [36].
Только для одного локуса подсолнечника, Or7, был клонирован ген, ответственный за формирование устойчивости к заразихе [34]. Им оказался ген, кодирующий рецепторную киназу с лейцин-богатыми повторами, имеющую высокое сходство с ранее охарактеризованным иммунным рецептором риса XA21 [34, 35]. Для других локусов устойчивости были определены вероятные гены-кандидаты, колокализованные с ними. Так, в области локуса OrDeb2 были гены, кодируюшие рецептор-подобные белки – лишенные экстраклеточного домена белки с одним или более киназным доменом, а также белки с доменами LRR, лишенные цитоплазматического киназного домена [39]. Такие рецептор-подобные белки могут работать в рецепторных комплексах и осуществлять рецепцию эффекторных белков, выделяемых растений паразитом. Кроме того, для ряда QTL-локусов подсолнечника была показана колокализация с генами, кодирующими белки NLR [40], представляющими собой ключевые иммунные рецепторы, узнающие эффекторные белки фитопатогенов и запускающие специфический иммунный ответ в организме растения-хозяина. Более того, было отмечено, что локус Or5 также колокализован с геном, кодирующим белок NLR [31]. Эти данные подтверждают предположение о том, что гены, продукты которых задействованные в рецепции эффекторных белков заразихи и запуске специфического иммунитета, являются ключевыми регуляторами “вертикальной” устойчивости подсолнечника, формирующейся к определенным расам заразихи. У описанных форм подсолнечника, устойчивость которых, как предполагается, может определяться генами таких иммунных рецепторов, узнающих эффекторные белки заразихи, наблюдается развитие устойчивости на этапе роста гаустории в тканях корнях подсолнечника до ее прикрепления к проводящей системе растения-хозяина (рис. 1). Таким образом, именно на этом этапе, вероятно, происходит специфическое распознавание эффекторных молекул заразихи, способных индуцировать иммунитет в организме растения-хозяина.
Исследование транскриптомов и протеомов разных рас заразихи подсолнечной на этапе ее прорастания в корень растения-хозяина должно способствовать получению новых данных о молекулярной природе эффекторных белков заразихи и способствовать более глубокому пониманию механизмов устойчивости подсолнечника к заразихе, а также разработке новых способов борьбы с этим паразитическим растением.
Работа выполнена при поддержке Министерства науки и высшего образования Российской Федерации в соответствии с договором № 075-15-2022-322 от 22.04.2022 о предоставлении гранта в форме субсидий из федерального бюджета Российской Федерации. Грант был предоставлен на государственную поддержку создания и развития Научного центра мирового уровня “Агротехнологии будущего”.
Авторы благодарны Додуевой Ирине Евгеньевне за ценные замечания и обсуждение материала в ходе подготовки рукописи.
Авторы заявляют об отсутствии конфликта интересов. Настоящая статья не содержит каких-либо исследований с участием людей и животных в качестве объектов.
Список литературы
Velasco L., Pérez-Vich B., Fernández-Martínez J.M. Research on resistance to sunflower broomrape: an integrated vision // OCL. 2016. https://doi.org/10.1051/ocl/2016002
Хатнянский В.И. История селекции подсолнечника в России на устойчивость к заразихе // Масличные культуры. Научно-технический бюллетень Всероссийского научно-исследовательского института масличных культур. 2020. Т. 3. С. 147. https://doi.org/10.25230/2412-608X-2020-3-183-147-156
Антонова Т.С., Стрельников Е.А., Гучетль С.З., Челюстникова Т.А. Разнообразие форм заразихи на подсолнечнике на юге России // Защита и карантин растений. 2014. Т. 11. С. 45.
Антонова Т.С., Арасланова Н.М., Саукова С.Л., Ивебор М.В. К вопросу о засоренности полей в регионах РФ семенами заразихи (Orobanche Cumana Wallr.) – облигатного паразита подсолнечника // Вестник российской сельскохозяйственной науки. 2022. Т. 4. С. 29. https://doi.org/10.31857/2500-2082/2022/4/29-32
Pérez-Vich B., Velasco L., Rich P.J., Ejeta G. Marker-assisted and physiology-based breeding for resistance to root parasitic Orobanchaceae // Parasitic Orobanchaceae / Eds. Joel D., Gressel J., Musselman L. Berlin, Heidelberg: Springer. 2013. P. 369. https://doi.org/10.1007/978-3-642-38146-1_21
Vranceanu A.V., Tudor V.A., Stoenescu F.M., Pirvu N. Virulence groups of Orobanche cumana Wallr.[root parasite], differential hosts and resistance sources and genes in sunflower // Proc. 9th Int. Sunflower Conf., Torremolinos, Malaga (Spain), 8–13 June 1980. Ministerio de Agricultura, Servicio de Publicaciones Agrarias, 1981.
Fernández-Martínez J.M., Pérez-Vich B., Velasco L. Sunflower Broomrape (Orobanche cumana Wallr.) // Sunflower / Eds. Martínez-Force E., Dunford N.T., Salas J.J. AOCS Press, 2015. P. 129. https://doi.org/10.1016/B978-1-893997-94-3.50011-8
Joel D.M., Chaudhuri S.K., Plakhine D., Ziadna H., Steffens J.C. Dehydrocostus lactone is exuded from sunflower roots and stimulates germination of the root parasite Orobanche cumana // Phytochemistry. 2011. V. 72. P. 624. https://doi.org/10.1016/j.phytochem.2011.01.037
Yoneyama K., Xie XiaoNan, Kisugi T., Nomura T., Sekimoto H., Yokota T., Yoneyama K. Characterization of strigolactones exuded by Asteraceae plants // Plant Growth Regul. 2011. V. 65. P. 495. https://doi.org/10.1007/s10725-011-9620-z
Bharti N., Tripathi S., Bhatla S.C. Photomodulation of strigolactone biosynthesis and accumulation during sunflower seedling growth // Plant Signal Behav. 2015. V. 10: e1049792. https://doi.org/10.1080/15592324.2015.1049792
Raupp F.M., Spring O. New Sesquiterpene Lactones from Sunflower Root Exudate as Germination Stimulants for Orobanche cumana // J. Agric. Food Chem. 2013. V. 61. P. 10481. https://doi.org/10.1021/jf402392e
Ueno K. Furumoto T., Umeda S., Mizutani M., Takikawa H., Batchvarova R., Sugimoto Y. Heliolactone, a non-sesquiterpene lactone germination stimulant for root parasitic weeds from sunflower // Phytochemistry. 2014. V. 108. P. 122. https://doi.org/10.1016/j.phytochem.2014.09.018
Thorogood C.J., Hiscock S.J. Compatibility interactions at the cellular level provide the basis for host specificity in the parasitic plant Orobanche // New Phytol. 2010. V. 186. P. 571. https://doi.org/10.1111/j.1469-8137.2009.03173.x
Goyet V., Wada S., Cui S., Wakatake T., Shirasu K., Montiel G., Simier P., Yoshida S. Haustorium Inducing Factors for Parasitic Orobanchaceae // Front. Plant Sci. 2019. V. 10. P. 1056. https://doi.org/10.3389/fpls.2019.01056
Fernández-Aparicio M., Masi M., Cimmino A., Evidente A. Effects of Benzoquinones on Radicles of Orobanche and Phelipanche Species // Plants. 2021. V. 10. P. 746. https://doi.org/10.3390/plants10040746
Rispail N., Dita M.A., González-Verdejo C., Pérez-de-Luque A., Castillejo M.A., Prats E., Román B., Jorrín J., Rubiales D. Plant resistance to parasitic plants: molecular approaches to an old foe // New Phytol. 2007. V. 173. P. 703. https://doi.org/10.1111/j.1469-8137.2007.01980.x
Rodríguez-Ojeda M.I., Fernández-Martínez J.M., Velasco L., Pérez-Vich B. Extent of cross-fertilization in Orobanche cumana Wallr. // Biol Plant. 2013. V. 57. P. 559. https://doi.org/10.1007/s10535-012-0301-1
Höniges A., Wegmann K., Ardelean A. Orobanche resistance in sunflower // Helia. 2008. V. 31. P. 1. https://doi.org/10.2298/HEL0849001H
Serghini K., Pérez de Luque A., Castejón-Muñoz M., García-Torres L., Jorrín J.V. Sunflower (Helianthus annuus L.) response to broomrape (Orobanche cernua Loefl.) parasitism: induced synthesis and excretion of 7-hydroxylated simple coumarins // J. Exp. Bot. 2001. V. 52. P. 2227. https://doi.org/10.1093/jexbot/52.364.2227
Antonova T.S., Terborg S.J. The role of peroxidase in the resistance of sunflower against Orobanche cumana in Russia // Weed Research. 1996. V. 36. P. 113. https://doi.org/10.1111/j.1365-3180.1996.tb01807.x
Echevarría-Zomeño S., Pérez-de-Luque A., Jorrín J., Maldonado A.M. Pre-haustorial resistance to broomrape (Orobanche cumana) in sunflower (Helianthus annuus): cytochemical studies // J. Exp. Bot. 2006. V. 57. P. 4189. https://doi.org/10.1093/jxb/erl195
Letousey P., de Zélicourt A., Vieira Dos Santos C., Thoiron S., Monteau F., Simier P., Thalouarn P., Delavault P. Molecular analysis of resistance mechanisms to Orobanche cumana in sunflower // Plant Pathol. 2007. V. 56. P. 536. https://doi.org/10.1111/j.1365-3059.2007.01575.x
Бурлов В.В., Костюк С.В. Бурлов В.В., Костюк С.В. Наследование устойчивости к местной расе заразихи (Orobanche cumana Wallr.) у подсолнечника // Генетика. 1976. Т. 12. С. 44.
Погорлецкий Б.К., Гешеле Э.Э. Об иммунитете подсолнечника к заразихе // Генетика. 1975. Т. 11. С. 18.
Pacureanu-Joita M., Veronesi C., Raranciuc S., Stanciu D. Parasite-host plant interaction of Orobanche cumana Wallr. (Orobanche cernua Loefl) with Helianthus annuus // Proc. 16th Int. Sunflower Conf., Fargo, ND, USA, Aug. 29–Sept. 2. 2004. P. 171.
Velasco L., Perez-Vich B., Yassein A., Jan C., Fernandez-Martinez J.M. Inheritance of resistance to sunflower broomrape (Orobanche cumana Wallr.) in an interspecific cross between Helianthus annuus and Helianthus debilis subsp. tardiflorus // Plant Breeding. 2012. V. 131. P. 220. https://doi.org/10.1111/j.1439-0523.2011.01915.x
Pacureanu-Joita M., Raranciuc S., Stanciu D., Sava E., Nastase D. Virulence and aggressiveness of sunflower broomrape (Orobanche cumana Wallr.) populations in Romania // HELIA. 2009. V. 32. P. 111. https://doi.org/10.2298/hel0951111p
Imerovski I., Dimitrijević A., Miladinović D., Dedić B., Jocić S., Kočiš Tubić N., Cvejić S. Mapping of a new gene for resistance to broomrape races higher than F // Euphytica. 2016. V. 209. P. 281. https://doi.org/10.1007/s10681-015-1597-7
Akhtouch B., Muñoz-Ruz J., Melero-Vara J.M., Fernández-Martínez J.M., Domínguez J. Inheritance of resistance to race F of broomrape in sunflower lines of different origins // Plant Breeding. 2002. V. 121 (3). P. 266. https://doi.org/10.1046/j.1439-0523.2002.00701.x
Tang S., Heesacker A., Kishore V.K., Knapp S.J. Genetic Mapping of the Or5 gene for resistance to Orobanche race E in sunflower // Crop Sci. 2003. V. 43. P. 1021. https://doi.org/10.2135/cropsci2003.1021
Radwan O., Gandhi S., Heesacker A., Whitaker B., Taylor C., Plocik A., Kesseli R., Kozik A., Michelmore R.W., Knapp S.J. Genetic diversity and genomic distribution of homologs encoding NBS-LRR disease resistance proteins in sunflower // Mol. Genet. Genomics. 2008. V. 280. P. 111. https://doi.org/10.1007/s00438-008-0346-1
van Wersch S., Tian L., Hoy R., Li X. Plant NLRs: The Whistleblowers of Plant Immunity // Plant Communications. 2020. V. 1. P. 100016. https://doi.org/10.1016/j.xplc.2019.100016
Imerovski I., Imerovski I., Dimitrijević A., Miladinović D., Dedić B., Jocić S., Kovačević B., Obreht D. Identification of PCR markers linked to different Or genes in sunflower // Plant Breeding. 2013. V. 132. P. 115. https://doi.org/10.1111/pbr.12022
Duriez P., Vautrin S., Auriac M.C., Bazerque J., Boniface M.C., Callot C., Carrère S., Cauet S., Chabaud M., Gentou F., Lopez-Sendon M., Paris C., Pegot-Espagnet P., Rousseaux J.C., et al. A receptor-like kinase enhances sunflower resistance to Orobanche cumana // Nat Plants. 2019. V. 5. P. 1211. https://doi.org/10.1038/s41477-019-0556-z
Pruitt R.N., Joe A., Zhang W., Feng W., Stewart V., Schwessinger B., Dinneny J. R., Ronald P. C. A microbially derived tyrosine-sulfated peptide mimics a plant peptide hormone // New Phytol. 2017. V. 215. P. 725. https://doi.org/10.1111/nph.14609
Shafikova T.N., Omelichkina Y.V. Molecular–genetic aspects of plant immunity to phytopathogenic bacteria and fungi // Rus. J. Plant Physiol. 2015. V. 62. P. 571-585. https://doi.org/10.1134/S1021443715050143
Hassan E.S.A.R.S., Hoeft E., Li Z., Tulsieram L. Genetic markers for Orobanche resistance in sunflower (US Patent Publication US/2008/0178325 A1). 2008.
Martín-Sanz A., Pérez-Vich B., Rueda S., Fernández-Martínez J.M., Velasco L. Characterization of post-haustorial resistance to sunflower broomrape // Crop Sci. 2020. V. 60. P. 1188. https://doi.org/10.1002/csc2.20002
Fernández-Aparicio M., Del Moral L., Muños S., Velasco L., Pérez-Vich B. Genetic and physiological characterization of sunflower resistance provided by the wild-derived OrDeb2 gene against highly virulent races of Orobanche cumana Wallr // Theor. Appl. Genet. 2022. V. 135. P. 501. https://doi.org/10.1007/s00122-021-03979-9
Louarn J., Boniface M.C., Pouilly N., Velasco L., Pérez-Vich B., Vincourt P., Muños S. Sunflower resistance to broomrape (Orobanche cumana) is controlled by specific QTLs for different parasitism stages // Front. Plant Sci. 2016. V. 7. P. 590. https://doi.org/10.3389/fpls.2016.00590
Li J., Timko M.P. Gene-for-gene resistance in Striga-cowpea associations // Science. 2009. V. 325. P. 1094. https://doi.org/10.1126/science.117475
Badouin H., Gouzy J., Grassa C.J., Murat F., Staton S.E., Cottret L., Lelandais-Brière C., Owens G.L., Carrère S., Mayjonade B., Legrand L., Gill N., Kane N.C., Bowers J.E., et al. The sunflower genome provides insights into oil metabolism, flowering and Asterid evolution // Nature. 2017. V. 546. P. 148. https://doi.org/10.1038/nature22380
Calderón-González Á., Pérez-Vich B., Pouilly N., Boniface M.C., Louarn J., Velasco L., Muños S. Association mapping for broomrape resistance in sunflower // Front. Plant Sci. 2023. V. 13. P. 1056231. https://doi.org/10.3389/fpls.2022.1056231
Imerovski I., Dedić B., Cvejić S., Miladinović D., Jocić S., Owens G.L., Kočiš Tubić N., Rieseberg L.H. BSA-seq mapping reveals major QTL for broomrape resistance in four sunflower lines // Mol. Breeding. 2019. V. 39. P. 41. https://doi.org/10.1007/s11032-019-0948-9
Akhtouch B., Akhtouch B., del Moral L., Leon A., Velasco L., Fernández-Martínez J.M., Pérez-Vich B. Genetic study of recessive broomrape resistance in sunflower // Euphytica. 2016. V. 209. P. 419. https://doi.org/10.1007/s10681-016-1652-z
Sisou D., Tadmor Y., Plakhine D., Ziadna H., Hübner S., Eizenberg H. Biological and transcriptomic characterization of pre-haustorial resistance to sunflower broomrape (Orobanche cumana W.) in sunflowers (Helianthus annuus) // Plants. 2021. V. 10. P. 1810. https://doi.org/10.3390/plants10091810
McGrath K.C., Dombrecht B., Manners J.M., Schenk P.M., Edgar C.I., Maclean D.J., Scheible W.R., Udvardi M.K., Kazan K. Repressor- and activator-type ethylene response factors functioning in jasmonate signaling and disease resistance identified via a genome-wide screen of Arabidopsis transcription factor gene expression // Plant Physiol. 2005. V. 139. P. 949. https://doi.org/10.1104/pp.105.068544
Huang Q., Lei Z., Xiang L., Zhang W., Zhang L., Gao Y. Transcriptomic analysis of sunflower (Helianthus annuus) roots resistance to Orobanche cumana at the seedling stage // Horticulturae. 2022. V. 8. P. 701. https://doi.org/10.3390/horticulturae8080701
Дополнительные материалы отсутствуют.
Инструменты
Физиология растений


