Известия РАН. Серия биологическая, 2020, № 4, стр. 411-422
Влияние кверцетина на метаболизм и поведенческие реакции мышей с нормальной и нарушенной рецепцией лептина
С. А. Апрятин 1, В. А. Шипелин 1, Н. В. Трусов 1, К. В. Мжельская 1, Н. В. Кирбаева 1, Х. С. Сото 1, Н. А. Ригер 1, И. В. Гмошинский 1, *
1 Федеральный исследовательский центр питания, биотехнологии и безопасности пищи
109240 Москва, Устьинский пр., 2/14, Россия
* E-mail: gmosh@ion.ru
Поступила в редакцию 22.08.2018
После доработки 22.08.2019
Принята к публикации 22.08.2019
Аннотация
Изучено влияние потребления кверцетина (Q) на поведенческие реакции, интегральные и метаболические показатели у самцов мышей линий db/db, генетически склонных к развитию ожирения, и мышей C57Bl/6J, получающих рацион с избыточной энергетической ценностью. Определены сила хватки передних лап, состояние поисковой активности, тревожности и кратковременной памяти, интегральные и биохимические показатели, уровни лептина, грелина и IL-10. Выявлены различия между двумя экспериментальными моделями ожирения в ответе интегральных, биохимических показателей и поведенческих реакций мышей на потребление Q, которые объясняются нокаутом у db/db гена Lepr, кодирующего рецептор лептина, вследствие чего его нейротропные и регуляторные функции не могут у них адекватно реализоваться. Обнаружены эффекты Q, которые следует учитывать при обосновании доз и сроков применения этого нутрицевтика в клинической практике.
Поддержание постоянства массы тела (МТ) человека и млекопитающих в условиях качественно разнообразного питания осуществляется комплексом механизмов, среди которых ведущую роль играет нейрогуморальная регуляция пищевого поведения со стороны центральной нервной системы (ЦНС). Выделяют два контура такой регуляции, из которых первый, так называемый гомеостатический, опосредуется реакцией нейронов дугообразных ядер гипоталамуса на поступающие от периферических тканей гормональные сигналы, такие как адипокины − лептин и грелин (Hsu et al., 2015; Deck et al., 2017). Второй, так называемый гедонистический, контур обусловлен получением удовольствия от процесса питания. Он реализуется в высших отделах головного мозга, непосредственно связанных со вкусовым анализатором, и опосредован активностью каннабиноидных и опиоидных рецепторов, а также их эндогенных лигандов, воспроизводящих действие соответствующих психоактивных веществ (Bojanowska, Ciosek, 2016). Стойкие изменения в обоих регуляторных контурах могут привести к извращению влияния вкусной и высококалорийной пищи на уровень аппетита и насыщения, а также к дисбалансу между энергетической ценностью рациона и энерготратами, приводящему к развитию алиментарного ожирения и метаболического синдрома. Взаимодействие этих контуров сложное. Важную роль в нем может играть развитие системного воспаления, приводящего к снижению чувствительности клеток организма к инсулину и лептину (Ouchi et al., 2011).
В качестве перспективных средств, позволяющих повлиять на центральные механизмы энергетического гомеостаза, осуществить коррекцию их нарушений, в настоящее время рассматриваются минорные биологически активные вещества (БАВ) пищи, принадлежащие к группе биофлавоноидов, в частности кверцетин (Q) – 3,3',4',5,7-пентагидроксифлавон. Согласно ряду экспериментальных данных, полученных с использованием in vivo моделей (Kobori et al., 2011; Panchal et al., 2012), и клинических наблюдений (Edwards et al., 2007) потребление Q в дозах, характерных для его содержания в пищевых продуктах, может облегчать симптомы метаболического синдрома, вызванного потреблением избытка легкоусвояемых углеводов. Предполагается, что действие Q на организм связано с эффектами активации транскрипционных факторов PPAR-γ, SREBP1 и AMPk (Castrejón-Tellez et al., 2016). Вместе с тем возможная эффективность Q при коррекции центральных нарушений, приводящих к развитию ожирения, исследована недостаточно.
Один из эффективных способов проследить влияние БАВ на активность ЦНС − изучение поведенческих реакций лабораторных животных (нейромоторики, уровня локомоторной и поисковой активности, тревожности, краткосрочной и долговременной памяти). При этом желательно получить результаты с помощью экспериментальных моделей как минимум двух типов: у животных мутантных или нокаутных линий с генетически детерминированным ожирением, развивающимся при потреблении сбалансированного рациона, и у животных обычных линий, для рациона которых характерна избыточная энергетическая ценность (Wong et al., 2016).
Цель работы − изучение влияния Q на поведенческие реакции, отдельные интегральные и метаболические показатели у самцов двух линий мышей: db/db с нокаутом гена, кодирующего рецептор лептина Lepr, склонных к спонтанному развитию ожирения, и мышей линии C57Bl/6J, получающих гиперкалорийный высокоуглеводно-высокожировой рацион (ВУВЖР).
МАТЕРИАЛЫ И МЕТОДЫ
Исследования проводили на 24 самцах мышей (возраст 8−10 нед, средняя исходная МТ 40.2 ± 3.2 г) линии db/db, полученных из питомника ИЦиГ СО РАН (Россия), и 32 самцах мышей инбредной линии C57Bl/6J того же возраста (средняя исходная МТ 21.1 ± 0.2 г), полученных из питомника филиала “Столбовая” (Научный центр биомедицинских технологий ФМБА России).
Животные были разделены на три группы (1−3) равной численности (N = 8) для db/db и четыре группы (4−7; N = 8) для С57Bl/6J. В течение 47 сут мыши 1-й и 4-й групп получали контрольный сбалансированный полусинтетический рацион для грызунов по AIN93M, 2-й и 3-й групп − такой же рацион с добавкой Q из расчета 25 и 100 мг/кг МТ соответственно, 5-й группы − высокожировой (30% жиров) рацион с 20% фруктозы вместо воды (ВУВЖР), 6-й и 7-й групп – ВУВЖР и добавку Q в дозах 25 и 100 мг/кг МТ соответственно. Рационы, воду и раствор фруктозы предоставляли животным в режиме неограниченного свободного доступа. Мышей содержали по 1 (C57Bl/6J) или 2 (db/db) особи в клетках из поликарбоната при 12/12-часовом режиме освещения и температуре воздуха 22 ± 1°С. Ежедневно фиксировали количество съеденного корма и выпитых жидкостей и рассчитывали удельное энергопотребление и дозу Q. МТ определяли еженедельно на электронных весах с точностью ±0.1 г. Общее время кормления животных экспериментальными рационами составило 47 сут.
Оценку состояния мышечного тонуса мышей проводили с помощью определения силы хватки передних лап на 28-е сут эксперимента. Степень выраженности эмоциональной реакции страха и тревоги, поисковой активности, двигательную активность (подвижность), оценивали в тесте “приподнятый крестообразный лабиринт” (ПКЛ) на 9-е (тест 1) и 43-и (тест 2) сут эксперимента. Показатели краткосрочной памяти животных изучали в тесте “условный рефлекс пассивного избегания” (УРПИ) на 37-е и 38-е сут (тесты 0 и 1 соответственно). Во всех случаях использовали лабораторное оборудование, средства видеоконтроля и программное обеспечение производства фирмы “Panlab Harvard Apparatus” (Испания). Методики экспериментов были детально описаны ранее (Апрятин и др., 2018).
Работу с животными выполняли в соответствии с Приказом Министерства здравоохранения Российской Федерации № 199 н от 01.04.2016 г. “Об утверждении правил надлежащей лабораторной практики”. Дизайн эксперимента был одобрен Комитетом по этике ФИЦ питания и биотехнологии (протокол № 4 от 20.04.2017 г.).
Выведение животных из эксперимента осуществляли на 47-е сут путем обескровливания из нижней полой вены под эфирной анестезией. Массу органов, забрюшинной и бурой жировой ткани определяли на лабораторных весах с точностью ±0.01 г; относительную массу внутренних органов рассчитывали в процентах МТ. Кровь собирали в пробирки с антикоагулянтом 1.0%-ным раствором гепарина в 0.15 М NaCl (1 : 10 по объему), плазму отделяли центрифугированием, после чего исследовали биохимические показатели (содержание глюкозы, триглицеридов, холестерина и др.) на биохимическом анализаторе Konelab 20i (Финляндия) по стандартным методикам, а ткже содержание лептина, грелина и IL-10 на мультиплексном анализаторе Luminex 200 (Luminex Corporation, США) с использованием наборов Bio-Plex Mouse Diabetes Panel 8-Plex и Bio-Plex Pro Mouse Cytokine Grp I Panel 23-Plex (Bio-Rad Laboratories, Inc. USA).
Статистическую обработку проводили с использованием критерия χ2 для альтернативных показателей, одно- и многофакторного дисперсионного анализа для оценки наличия влияния различных факторов и силы этого влияния (η), двустороннего t-теста Стьюдента c поправкой Левина (Levene) на неравенство выборочных дисперсий, непараметрических критериев Вилкоксона и Манна−Уитни для парных сравнений опытных групп при уровне значимости p < 0.05.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
На протяжении периода кормления экспериментальными рационами отмечалась гибель трех из восьми мышей db/db во 2-й и пяти из восьми в 3-й группе, получавших Q в дозах 25 и 100 мг/кг МТ (p < 0.05 при сравнении групп 1 и 3). При вскрытии павших животных было отмечено наличие острой циркуляторной дисфункции легких и миокарда. Все животные остальных опытных групп выжили, имели нормальный внешний вид и систематически прибавляли в МТ. Среднее энергопотребление, выраженное в ккал/(г МТ · сут), у мышей db/db имело тенденцию к нарастанию на протяжении эксперимента и достоверно не различалось между группами. Мыши C57Bl/6J 5-й группы, потреблявшие ВУВЖР, характеризовались достоверно (p < 0.05) повышенным удельным энергопотреблением по сравнению с контрольной группой 4 (рис. 1а, б). При этом добавление Q достоверно снижало этот показатель в группе 6 и на уровне тенденции в группе 7.
Рис. 1.
Динамика энергопотребления мышами db/db (а) и C57Bl/6J (б). * − различие с группой 4 достоверно, # − различие с группой 5 достоверно, t-тест Стьюдента для попарно-связанных среднегрупповых значений. 1–7 группы мышей.

По окончании эксперимента мыши db/db группы 1 демонстрировали выраженные фенотипические признаки ожирения и имели достоверно бóльшую МТ, массу печени и белой (забрюшинной) жировой ткани по сравнению с мышами C57Bl/6J, получавшими контрольный рацион (рис. 2). Это свидетельствует о спонтанном развитии ожирения у первой из этих линий животных. Введение Q в рацион мышей db/db не оказывало влияния на интегральные показатели, за исключением возрастания массы забрюшинного жира в группе 2.
Рис. 2.
Интегральные показатели мышей (M ± m) по окончании эксперимента. а − масса тела; б − относительная масса печени; в − относительная масса забрюшинного (белого) жира; г − относительная масса бурого (межлопаточного) жира. Различие достоверно (p < 0.05, t-тест Стьюдента и/или критерий Манна−Уитни): * − с группой 1; # − с группой 4; ** − с группой 5. Численность групп 1−7: 8, 5, 3, 5, 5, 6, 7 животных соответственно; для рис. 2−5.

У мышей C57Bl/6J группы 5, получавших ВУВЖД, МТ и масса жировой ткани достоверно не отличалась от контроля, а масса печени была даже снижена, что указывает на резистентность самцов этой линии к развитию алиментарного ожирения и совпадает с ранее полученными данными (Мжельская и др., 2018). Мыши C57Bl/6J, получавшие ВУВЖД и Q, характеризовались дальнейшим снижением массы печени, повышением массы белого жира (группа 6) и снижением запасов бурого жира (группа 7).
Для мышей db/db контрольной группы были характерны достоверно и значительно бóльшие по сравнению с мышами C57Bl/6J, получавшими сбалансированный рацион, уровни циркулирующего лептина и отмечалась тенденция к снижению уровня грелина, в результате чего значение отношения лептин : грелин (L/Ghr) было повышено у них более чем на порядок (рис. 3). В сопоставимых условиях у мышей линии db/db был также достоверно повышен по сравнению с C57Bl/6J уровень IL-10 .
Рис. 3.
Уровни (M ± m) грелина (а) и лептина(б) и их отношение(в), а также уровень IL-10(г) в плазме крови мышей по окончании эксперимента. Различие достоверно (p < 0.05, t-тест Стьюдента и/или критерий Манна−Уитни): * − с группой 1; # − с группой 4; (#) − p < 0.1.
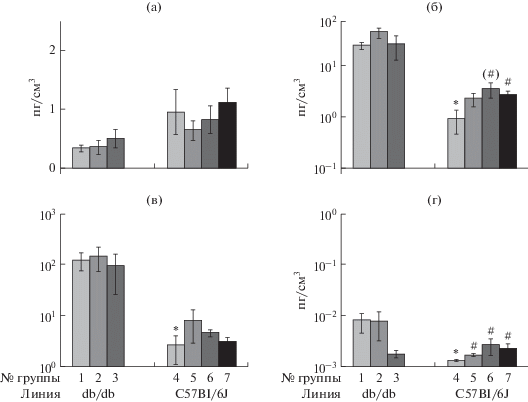
Потребление Q не оказывало влияние на уровни лептина, грелина и IL-10 у мышей db/db. У мышей C57Bl/6J потребление ВУВЖР с Q приводило к возрастанию уровня лептина и IL-10 по сравнению с таковыми у мышей контрольной группы.
В условиях потребления контрольного рациона у мышей db/db отмечались достоверно повышенные уровни глюкозы, общего холестерина, холестерина липопротеинов низкой и высокой плотности (ЛПНП и ЛПВП соответственно) и триглицеридов по сравнению с мышами C57Bl/6J (рис. 4). При этом у последних кормление ВУВЖР вызывало достоверное возрастание уровня глюкозы по сравнению с контрольной группой. У мышей db/db 1-й группы по сравнению с 4-й группой C57Bl/6J, получавшей контрольный рацион, было многократно и достоверно снижено отношение активностей аспарагиновой и аланиновой трансаминаз (АСТ/АЛТ) (коэффициент де Ритиса), рассматриваемое как индикатор интенсивности катаболизма (Рослый и др., 2002; Рослый, 2015). У мышей C57Bl/6J кормление ВУВЖР не приводило к изменению этого показателя. Под действием Q у мышей db/db достоверно снижался уровень глюкозы (η = 43%, F = 10.047, p < 0.01), возрастало содержание ЛПНП (η = 34%, F = 7.128, p < 0.02), отношение ЛПНП/ЛПВП (η= 49%, F = = 13.498, p < 0.01). Уровни ЛПВП и триглицеридов демонстрировали тенденцию к снижению (η = 20.6%, F = 3.641, p < 0.1 и η = 21.9%, F = 3.918, p < 0.1 соответственно). Потребление Q в составе ВУВЖР мышами С57Bl/6J не приводило к достоверному изменению вышеперечисленных биохимических показателей по сравнению с таковым у животных, получавших только ВУВЖР. Липолитическая активность плазмы крови достоверно снижалась под действием Q у мышей С57Bl/6, получавших ВУВЖР, тогда как аналогичное влияние Q на этот показатель у мышей db/db проявлялось только на уровне недостоверной тенденции.
Рис. 4.
Средние (M ± m) биохимические показатели плазмы крови мышей при выведении из эксперимента. а − глюкоза; б − общий холестерин; в − холестерин липопротеинов высокой плотности (ЛПВП); г − холестерин липопротеинов низкой плотности (ЛПНП) (расчет); д − ЛПНП/ЛПВП; е − триглицериды; ж − отношение активностей аспарагиновой и аланиновой трансаминаз; з − активность липазы. Различие достоверно (p < 0.05, t-тест Стьюдента и/или критерий Манна−Уитни): * − с группой 1; # − с группой 4; ** − с группой 5. Горизонтальная скобка – распределение неоднородно (ANOVA p < 0.05) для охватываемого диапазона по фактору “рацион” (R), “кверцетин” (Q).

Мышечный тонус (характеризуемый показателем удельной силы хватки передних лап животных) был достоверно снижен у мышей db/db группы 1 по сравнению с соответствующей группой 4 мышей C57Bl/6J при втором тесте (рис. 5). При этом у мышей C57Bl/6J, потреблявших ВУВЖР, сила сжатия нарастала с возрастом, что не отмечалось у мышей db/db контрольной группы. Потребление Q в обеих дозах вызывало у мышей db/db, но не у получавших ВУВЖР мышей C57Bl/6J достоверное снижение удельной силы сжатия.
Рис. 5.
Мышечный тонус (удельная сила хватки передних лап) (M ± m) мышей. а − линии db/db; б − C57Bl/6J. Различие достоверно (p < 0.05, критерий Манна−Уитни): * − с контрольной группой; ** − с мышами C57Bl/6J. 1 и 2 − первый и второй тесты соответственно.

Характеристика в тесте ПКЛ подвижности (локомоторной и поисковой активности) мышей db/db показала (рис. 6), что соответствующие индикаторы (общий путь, пройденный в лабиринте, число переходов между закрытыми (ЗР) и открытыми (ОР) рукавами) снижаются с возрастом животных. Потребление Q приводит к достоверному снижению такого ее показателя, как путь, пройденный в центральной зоне (η = 5.7%, F = 4.168, p < 0.05), и общее число переходов (η = 7.7%, F = = 5.105, p < 0.05) Для общего пути, пройденного в лабиринте, и пути, пройденного в ОР, данное изменение проявлялось только на уровне тенденции. Из числа показателей тревожности достоверные изменения были выявлены для числа выходов животных в ОР, которое достоверно снижалось как под действием Q, так и при втором тесте по сравнению с первым, что свидетельствует о возрастании тревожности животных, причем влияние со стороны потребления Q было более выраженным (η = 12%, F = 8.151, p < 0.01 по фактору Q и η = = 8.6%; F = 5.832, p < 0.05 по фактору “тест”).
Рис. 6.
Показатели (среднее, интервалы изменения) подвижности (поисковой и локомоторной активности) и тревожности в тесте ПКЛ у мышей db/db. а − путь, пройденный в центральной зоне; б − число переходов между зонами; в − полный путь, пройденный в лабиринте; г − путь, пройденный в открытых рукавах; д − число выходов в открытые рукава. * − различие с контрольной группой достоверно (p < 0.05, критерий Манна−Уитни). Горизонтальная скобка – распределение неоднородно (ANOVA, p < 0.05) для охватываемого диапазона по факторам “кверцетин” (Q), “номер теста” (Т). Численность групп 1−3: 8, 5, 4 животных при первом тесте; 8, 5, 3 животных при втором тесте соответственно.

Для мышей линии C57Bl/6J (рис. 7) было характерно в первую очередь снижение пройденного пути при втором тесте по сравнению с первым, причем на этот показатель влияло также, хотя и менее выраженно, потребление ВУВЖР (η = 5.6%, F = 35.606, p < 0.001 по фактору “тест” и η = 1.4%, F = 8.741, p < 0.05 при взаимодействии факторов “рацион” и “тест”). При втором тестировании у этих животных достоверно снижалось также общее число переходов между зонами (η = 11.3%, F = 59.221; p < 0.001 по фактору “тест”). Следовательно, мыши этой линии становятся со временем менее подвижными, причем это изменение, по-видимому, маскируется потреблением ВУВЖР. Добавка Q не влияет на рассмотренные показатели подвижности у мышей C57Bl/6J, получающих ВУВЖР. Тревожность, определяемая по показателям времени, проведенного в ЗР, и отношения времен пребывания в ЗР и ОР (ЗР/ОР), достоверно возрастает во всех группах мышей C57Bl/6J при втором тесте (η = 2.0%, F = 16.288, p < 0.001 и η = 9.7%, F = 12.529, p < 0.01 по фактору “тест” соответственно), что согласуется с данными, полученными ранее (Мжельская и др., 2018). На показатели тревожности у этих животных Q, по-видимому, также не оказывает действия.
Рис. 7.
Показатели (среднее, интервалы изменения) подвижности (поисковой и локомоторной активности) и тревожности в тесте ПКЛ у мышей C57Bl/6J. а − полный путь, пройденный в лабиринте; б − число переходов между зонами; в − время, проведенное в закрытых рукавах; г − отношение времен, проведенных в закрытых и открытых рукавах. * − различие достоверно (p < 0.05, критерий Манна−Уитни) с группой 4. # − различие между первым и вторым тестами достоверно (p < 0.05, критерий Вилкоксона для попарно-связанных значений). Горизонтальная скобка – распределение неоднородно (ANOVA, p < 0.05) для охватываемого диапазона по факторам “рацион” (R), “номер теста” (Т). Численность групп 4−7: 5, 5, 6 и 7 животных соответственно.

В тесте УРПИ (табл. 1) для мышей db/db было характерно наименьшее число заходов в темный отсек в тесте 0 (группы 1 и 3), что указывает на сниженную тревожность в этих группах. В дозе 25 мг/кг МТ Q способствовал увеличению числа заходов в темный отсек у мышей группы 2, что указывает на повышение тревожности и согласуется с данными ПКЛ для этой линии животных. При этом достоверных изменений в закреплении УРПИ в тесте 1 (характеризующем функцию кратковременной памяти) выявлено не было. У мышей C57Bl/6J, получающих ВУВЖР, Q не вызывал изменений показателей в тесте УРПИ.
Таблица 1.
Показатели теста условного рефлекса пассивного избегания у мышей опытных групп
| Группа | Линия | Рацион | L, с (M ± m)* | N, % | |
|---|---|---|---|---|---|
| первый тест** | второй тест** | ||||
| 1 | db/db | КР | 121 ± 242 | 4/8 (50)2 | 0/4 (0) |
| 2 | db/db | КР+Q25 | 180 ± 0 | 0/7 (0)1, 3 | – |
| 3 | db/db | КР+Q100 | 160 ± 2 | 4/5 (80)2 | 1/1 (100) |
| 4 | C57Bl/6 | КР | 114 ± 272 | 1/5 (20) | 2/4 (50) |
| 5 | C57Bl/6 | ВУВЖР | 99 ± 29 | 1/5 (20) | 2/4 (50) |
| 6 | C57Bl/6 | ВУВЖР+Q25 | 66 ± 22 | 0/6 (0) | 2/6 (33) |
| 7 | C57Bl/6 | ВУВЖР+Q100 | 65 ± 21 | 0/7 (0) | 5/7 (71) |
Примечание. L − латенция 1-го входа в темную камеру; с. N − число мышей, не зашедших в темную камеру; КР − контрольный (сбалансированный) рацион; ВУВЖР − высокожировой, высокоуглеводный рацион; Q − кверцетин, доза, мг/кг. Надстрочные индексы − группы¸ различия с которыми достоверны, p < 0.05. * − U-тест Манна−Уитни. ** − критерий χ2 . “−” − отсутствие данных.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
В проведенных исследованиях были получены данные о влиянии Q на показатели организма мышей на двух альтернативных моделях: у мышей db/db, потребляющих сбалансированный по энергетической ценности рацион, и у мышей C57BL/6J, потребляющих ВУВЖР. Как показали результаты определения интегральных и биохимических показателей, мыши db/db отличались от получавших контрольный рацион мышей C57BL/6J избыточной массой тела, печени и бурого жира, повышенными уровнями лептина, IL-10, соотношением лептин/грелин, гипергликемией, гипертриглицеридемией и дислипидемией, а также сниженным мышечным тонусом. Этот результат подтверждает адекватность использования мышей db/db в качестве модели генетически детерминированного ожирения. Основная причина его развития − отсутствие у мышей линии db/db нормально функционирующего рецептора лептина, вследствие чего его нейротропные и регуляторные функции не могут адекватно реализоваться (Kobayashi et al., 2000). Одновременно при этом отсутствует интернализация комплекса лептин−рецептор и резко замедляется клиренс лептина из системной циркуляции, из-за чего его уровень многократно возрастает, и для него становится характерным проявление ряда аномальных иммунотропных свойств, обусловленных частичной гомологией третичной структуры макромолекулы лептина и ряда цитокинов и хемокинов (López-Jaramillo et al., 2014; Pérez-Pérez et al., 2017). По некоторым данным механизм действия лептина у мышей db/db может заключаться в его взаимодействии с ферментами семейства сиртуинов, в частности Sirt1 (Yamamoto et al., 2007). Механизм взаимодействия белка Sirt1 и лептина до конца не расшифрован. Sirt1 вовлечен в регуляцию продолжительности жизни и снижает резистентность к лептину (Hosoi et al., 2017). Известно также, что cиртуины участвуют в НАДФ/АТФ-зависимых процессах энергетического обмена, активируют процесс глюконеогенеза и подавляют гликолиз (Rodgers et al., 2007; Horio et al., 2011). Существенно также, что сиртуины, по-видимому, одни из основных мишеней системного действия полифенолов, в том числе Q (Zhao et al., 2017).
У мышей C57Bl/6J, получавших ВУВЖР, была значительно повышена общая потребляемая энергетическая ценность рациона по сравнению с таковой у животных, находящихся на контрольном рационе. Этому соответствовали такие изменения в организме, как повышение массы белого жира, уровня гликемии, содержания лептина, IL-10 и соотношения лептин/грелин, липолитической активности. Содержание бурого жира у этих животных проявляло тенденцию к росту, что указывает на возможное увеличение пищевого термогенеза. В целом мыши C57Bl/6J, получавшие ВУВЖР, оказались сравнительно резистентными к развитию ожирения.
Воздействия Q на показатели, характеризующие развитие ожирения, существенно различались у двух использованных линий мышей. Так, если у мышей db/db Q практически не влиял на потребляемую энергетическую ценность рациона, то у C57Bl/6J, потреблявших ВУВЖР, Q в дозе 25 мг/кг МТ способствовал достоверному снижению потребляемой калорийности, что, возможно, свидетельствует о модуляции аппетита у этих животных. Уровень ЛПНП, отношение ЛПНП/ЛПВП и содержание общего холестерина повышались у мышей db/db, получавших добавку Q, тогда как у мышей C57Bl/6J, получавших ВУВЖР, подобного действия не наблюдалось. При этом следует иметь в виду, что у грызунов из-за сниженной по сравнению с приматами активности транспортера эфиров холестерина CETP наблюдается устойчивость к развитию атеросклероза даже при значительном повышении показателей ЛПНП и ЛПНП/ЛПВП (Tran et al., 2009). В этих условиях повышение уровня ЛПНП следует рассматривать как фактор, препятствующий накоплению холестерина и его эфиров в печени, аналогично тому, что наблюдалось ранее (Kobori et al., 2011). Для мышей C57Bl/6J, получавших ВУВЖР, было характерно резкое снижение липолитической активности под действием Q в наибольшей дозе; подобное изменение у db/db мышей отмечалось только на уровне тенденции.
Наконец, воздействие Q на две линии мышей различалось и по показателям мышечного тонуса и поведенческих реакций в тестах ПКЛ и УРПИ. Q достоверно снижал мышечный тонус при втором тесте, увеличивал степень тревожности и снижал подвижность только у мышей db/db, но не у C57Bl/6J, получавших ВУВЖР. Отмеченные различия могут быть связаны с зависимостью поведенческих реакций от уровня лептиновой рецепции. Согласно некоторым данным лептин в зависимости от экспрессии Ob-Rb-рецепторов в различных регионах головного мозга, включая ядра гипоталамуса, среднего мозга и ствола мозга, воздействует на мезолимбическую дофаминовую систему через активность мембранного транспортера дофамина (DAT), осуществляющего выведение дофамина из синапсов нейронов (Efimova et al., 2016; Cinque et al., 2018). Следовательно, лептин может участвовать не только в энергетическом балансе за счет регуляции орексии, но и в локомоторной активности. И наоборот, дофаминэргические механизмы за счет взаимодействия с лептиновой системой могут быть вовлечены в регуляцию аппетита (Perry et al., 2010).
В целом следует констатировать, что Q у мышей db/db оказывал неблагоприятное действие, вызывая гибель части животных и снижая уровень мышечного тонуса. Можно предположить, что у нокаутных по гену Lepr мышей db/db в состоянии избыточного накопления жировой ткани и системного воспаления, обусловленных лептиновой резистентностью, происходит активизация ферментных систем (таких, как некоторые изоформы CYP3А), способных вызывать образование аномальных токсичных метаболитов Q по аналогии с экспериментами, проведенными на крысах (Chen et al., 2003; Кравченко и др., 2012). Однако для подтверждения этой гипотезы требуются дополнительные исследования, поскольку данные о влиянии ожирения на активность ферментов системы метаболизма ксенобиотиков неоднозначны и зависят от вида, линии животных и экспериментальной модели (Tomankova et al., 2017).
Таким образом, целый ряд эффектов Q, включая его влияние на потребление пищи, содержание холестерина и его фракций плазмы крови, липолитическую активность, мышечный тонус, показатели подвижности и тревожности и активности, проявляется существенно по-разному у мышей, генетически склонных к развитию ожирения, и у нормальных животных, получающих гиперкалорийный рацион. Этот результат согласуется с известной неоднозначностью данных о клинической эффективности Q в диетотерапии ожирения и метаболического синдрома, зависящей, по-видимому, от генотипа больных (Edwards et al., 2007; Egert et al., 2010). Данное обстоятельство следует учитывать при обосновании доз и сроков применения этого БАВ в клинической практике.
Работа выполнена при финансовой поддержке Российского научного фонда (грант № 17-16-01043 “Поиск эффекторных звеньев метаболизма, регулируемых алиментарными факторами при ожирении, для разработки инновационных специализированных пищевых продуктов”).
Список литературы
Апрятин С.А., Шипелин В.А., Сидорова Ю.С., Петров Н.А., Гмошинский И.В., Никитюк Д.Б. Межвидовые различия поведенческих реакций и нейромоторики лабораторных грызунов, получающих рационы с легкоусвояемыми углеводами // Бюл. экспериментальной биологии и медицины. 2018. Т. 165. № 1. С. 9−14.
Кравченко Л.В., Аксенов И.В., Трусов Н.В., Гусева Г.В., Авреньева Л.И. Влияние количества жира в рационе на активность ферментов метаболизма ксенобиотиков и антиоксидантной защиты у крыс // Вопр. питания. 2012. Т. 81. № 1. С. 24−29.
Мжельская К.В., Шипелин В.А., Апрятин С.А., Сото С.Х., Шумакова А.А., Евстратова В.С., Кирбаева Н.В., Трусов Н.В., Гмошинский И.В. Влияние рациона с избытком жиров и углеводов на нейромоторную функцию, когнитивные, интегральные и биохимические показатели крыс и мышей различных линий // Рос. физиол. журн. им. И.М. Сеченова. 2018. Т. 104. № 4. С. 452−465.
Рослый И.М. Биохимические показатели в медицине и биологии. M.: Мед. информ. агентство, 2015. 616 с.
Рослый И.М., Абрамов С.В., Покровский В.И. Ферментемия – адаптивный механизм или маркер цитолиза? // Вестн. РАМН. 2002. Т. 8. № 1. С. 3−9.
Bojanowska E., Ciosek J. Can we selectively reduce appetite for energy-dense foods? An overview of pharmacological strategies for modification of food preference behavior // Curr. Neuropharmacol. 2016. V. 14. № 22. P. 118−142. DOI 9103147https://doi.org/10.2174/1570159X1466615110
Castrejón-Tellez V., Rodríguez-Pérez J.M., Pérez-Torres I., Pérez-Hernández N., Cruz-Lagunas A., Guarner-Lans V., Rubio-Ruiz M.E. The effect of resveratrol and quercetin treatment on PPAR mediated uncoupling protein (UCP-) 1, 2, and 3 expression in visceral white adipose tissue from metabolic syndrome rats // Int. J. Mol. Sci. 2016. V. 17. № 7. P. 1069. https://doi.org/10.3390/ijms17071069
Chen H.-W., Tsai C.-W., Yang J.-J., Liu C.-T. The combined effects of garlic oil and fish oil on the hepatic antioxidant and drug-metabolizing enzymes of rats // Br. J. Nutr. 2003. V. 89. № 2. P. 189−200. https://doi.org/10.1079/BJN2002766
Cinque S., Zoratto F., Poleggi A., Leo D., Cerniglia L., Cimino S., Tambelli R., Alleva E., Gainetdinov R.R., Laviola G., Adriani W. Behavioral phenotyping of dopamine transporter knockout rats: compulsive traits, motor stereotypies, and anhedonia // Front Psychiatry. 2018. V. 9. № 43. P. 1−13.
Deck C.A., Honeycutt J.L., Cheung E., Reynolds H.M., Borski R.J. Assessing the functional role of leptin in energy homeostasis and the stress response in vertebrates // Front. Endocrinol. (Lausanne). 2017. V. 8. P. 63. https://doi.org/10.3389/fendo.2017.00063
Edwards R.L., Lyon T., Litwin S.E., Rabovsky A., Symons J.D., Jalili T. Quercetin reduces blood pressure in hypertensive subjects // J. Nutr. 2007. V. 137. P. 2405−2411. https://doi.org/10.1093/jn/137.11.2405
Egert S., Boesch-Saadatmandi C., Wolffram S., Rimbach G., Müller M.J. Serum lipid and blood pressure responses to quercetin vary in overweight patients by apolipoprotein E genotype // J. Nutr. 2010. V. 140. P. 278−284.
Efimova E.V., Gainetdinov R.R., Budygin E.A., Sotnikova T.D. Dopamine transporter mutant animals: a translational perspective // J. Neurogenet. 2016. V. 30. № 1. P. 5–15.
Horio Y., Hayashi T., Kuno A., Kunimoto R. Cellular and molecular effects of sirtuins in health and disease // Clin. Sci. (Lond.). 2011. V. 121. № 5. P. 191−203. https://doi.org/10.1042/CS20100587
Hosoi T., Maffei M. Editorial: Leptin resistance in metabolic disorders: possible mechanisms and treatments // Front Endocrinol. (Lausanne). 2017. V. 8. P. 300. https://doi.org/10.3389/fendo.2017.00300
Hsu T.M., Hahn J.D., Konanur V.R., Noble E.E., Suarez A.N., Thai J., Nakamoto E.M., Kanoski S.E. Hippocampus ghrelin signaling mediates appetite through lateral hypothalamic orexin pathways // Elife. 2015. V. 4. P. e11190. https://doi.org/10.7554/eLife.11190
Kobayashi K., Forte T.M., Taniguchi S., Ishida B.Y., Oka K., Chan L. The db/db mouse, a model for diabetic dyslipidemia: molecular characterization and effects of Western diet feeding // Metabolism. 2000. V. 49. № 1. P. 22−31.
Kobori M., Masumoto S., Akimoto Y., Oike H. Chronic dietary intake of quercetin alleviates hepatic fat accumulation associated with consumption of a Western-style diet in C57/BL6J mice // Mol. Nutr. Food Res. 2011. V. 55. P. 530−540. https://doi.org/10.1002/mnfr.201000392
López-Jaramillo P., Gómez-Arbeláez D., López-López J., López-López C., Martínez-Ortega J., Gómez-Rodríguez A., Triana-Cubillos S. Leptin/adiponectin ratio in metabolic syndrome and diabetes // Horm. Mol. Biol. Clin. Invest. 2014. V. 18. № 1. P. 37–45. https://doi.org/10.1515/hmbci-2013-0053
Ouchi N., Parker J.L., Lugus J.J., Walsh K. Adipokines in inflammation and metabolic disease // Nat. Rev. Immunol. 2011. V. 11. P. 85–97. https://doi.org/10.1038/nri2921
Panchal S.K., Poudyal H., Brown L. Quercetin ameliorates cardiovascular, hepatic, and metabolic changes in diet-induced metabolic syndrome in rats // J. Nutr. 2012. V. 142. № 6. P. 1026−1032. https://doi.org/10.3945/jn.111.157263
Pérez-Pérez A., Vilariño-García T., Fernández-Riejos P., Martín-González J., Segura-Egea J.J., Sánchez-Margalet V. Role of leptin as a link between metabolism and the immune system // Cytokine Growth Factor Rev. 2017. V. 35. P. 71−84. DOI. 2017.03.001https://doi.org/10.1016/j.cytogfr
Perry M.L., Leinninger G.M., Chen R., Luderman K.D., Yang H., Gnegy M.E., Myers M.G., Jr., Kennedy R.T. Leptin promotes dopamine transporter and tyrosine hydroxylase activity in the nucleus accumbens of Sprague-Dawley rats // J. Neurochem. 2010. V. 114. № 3. P. 666−674. https://doi.org/10.1111/j.1471-4159.2010.06757.x
Rodgers J.T., Puigserver P. Fasting-dependent glucose and lipid metabolic response through hepatic sirtuin 1 // Proc. Natl Acad. Sci. USA. 2007. V. 104. № 31. P. 12861−12866. https://doi.org/10.1042/CS20100587
Tomankova V., Anzenbacher P., Anzenbacherova E. Effects of obesity on liver cytochromes P450 in various animal models // Biomed. Pap. Med. Fac. Univ. Palacky. Olomouc Czech. Repub. 2017. V. 161. № 2. P. 144−151. https://doi.org/10.5507/bp.2017.026
Tran L.T., Yuen V.G., McNeill J.H. The fructose-fed rat: a review on the mechanisms of fructose-induced insulin resistance and hypertension // Mol. Cell. Biochem. 2009. V. 332. P. 145–159. https://doi.org/10.1007/s11010-009-0184-4
Wong S.K., Chin K.-Y., Suhaimi F.H., Fairus A., Ima-Nirwana S. Animal models of metabolic syndrome: a review// Nutr. Metab. 2016. V. 13. P. 65.
Yamamoto H., Schoonjans K., Auwerx J. Sirtuin functions in health and disease // Mol. Endocrinol. 2007. V. 21. № 8. P. 1745–1755. https://doi.org/10.1210/me.2007-0079
Zhao Y., Chen B., Shen J., Wan L., Zhu Y., Yi T., Xiao Z. The beneficial effects of quercetin, curcumin, and resveratrol in obesity // Oxid. Med. Cell. Longev. 2017. V. 2017. P. 1459497. https://doi.org/10.1155/2017/1459497
Дополнительные материалы отсутствуют.
Инструменты
Известия РАН. Серия биологическая


