Известия РАН. Серия биологическая, 2022, № 3, стр. 289-299
Стимулирование роста молоди африканского клариевого сома (Clarias gariepinus) с помощью модификации окислительно-восстановительного потенциала воды
Д. В. Шумейко 1, С. А. Лоза 1, А. Н. Коржов 1, В. К. Ромашов 1, В. В. Малышко 2, 3, А. А. Елкина 1, 3, *, А. В. Моисеев 4
1 Кубанский государственный университет
350040 Краснодар, ул. Ставропольская, 149, Россия
2 Кубанский государственный медицинский университет Минздрава России
350063 Краснодар, ул. Седина, 4, Россия
3 ФИЦ Южный научный центр РАН
344006 Ростов-на-Дону, просп. Чехова, 41, Россия
4 Кубанский государственный аграрный университет
350004 Краснодар, ул. Калинина, 13, Россия
* E-mail: 013194@mail.ru
Поступила в редакцию 09.08.2020
После доработки 29.09.2020
Принята к публикации 29.09.2020
- EDN: QBLAXD
- DOI: 10.31857/S1026347022030167
Аннотация
Исследовано влияние воды с высоким отрицательным окислительно-восстановительным потенциалом (ОВП) на физиологические показатели молоди африканского клариевого сома (Clarias gariepinus). В результате проведенных исследований установлено, что снижение ОВП воды от +150…+250 мВ до –600…–500 мВ с помощью электромембранного генератора без изменения солевого состава при незначительном изменении pH с экспозицией 30 и 60 мин раз в сутки положительно сказывается на основных биологических показателях молоди африканского клариевого сома. Прирост биомассы в контрольной группе составил 756.6 г, а в опытной группе (30 мин обработки) – 1004.2 г. Наибольшей представительностью по массе в контрольной группе характеризовались рыбы в наименьшем размерном диапазоне: 1.0–2.9 г (38%). В опытных группах он составлял 22.6 и 18.3%, а основное количество особей находилось в диапазоне 3.0–4.9 г (38.3 и 44.1% соответственно). Установлено, что наилучшие показатели достигаются при обработке водной среды в течение 30 мин.
Широко распространенным объектом пресноводной аквакультуры является африканский клариевый сом. Биологические особенности которого обуславливают перспективность для проведения модельных исследований в установках замкнутого водоснабжения (Ковалев, 2006; Власов, Завьялов, 2014; Zaid et al., 2020). Проводятся исследования влияния различных факторов на физиологические показатели клариевого сома: биохимического профиля и экспрессии генов при повышении концентрации тяжелых металлов в среде обитания (Swaleh et al., 2020), гербицидов (Oluah et al., 2020), влияние микроэлементов (Siqwepu et al., 2020) и различных факторов загрязнения окружающей среды (Audu, Ajima, 2020). Африканский клариевый сом удобен для проведения научных исследований своей неприхотливостью в содержании, что позволяет осуществлять большие плотности посадки рыбы, отказаться от применения электроприборов, создающих постороннее влияние на объекты выращивания, и редко производить замену воды (Abd-Elkareem et al., 2020; Adeoye et al., 2020).
Разработка научных основ рациональной технологии выращивания африканского клариевого сома имеет важное хозяйственное значение. Основной средой его обитания является вода, состав и физико-химические свойства которой определяют, в том числе, и физиологические показатели рыбы (Mashaly et al., 2020). По этой причине необходимо проведение исследований эффективных способов повышения качества воды и внедрение инновационных технологий ее кондиционирования (Zhang et al., 1999; Stewart, 2009; Basov et al., 2019a, 2019b, 2019c; Volchenko et al., 2020; Dumbo et al., 2020). Особое место среди них занимает электрохимическая активация водных растворов (использование водных растворов с различными значениями ОВП), с помощью которой можно добиться улучшения физиологических показателей рыб (Bahir, 1996; Плутахин и др., 2013.). Такие водные растворы характеризуется высокой физико-химической и биологической активностью (Ichihara et al., 2015). Молекулярный водород (H2) способен достаточно легко проникать через биологические мембраны и диффундировать во внутриклеточное пространство, а также гематоэнцефалический барьер (в то время, как большинство антиоксидантных соединений не могут его преодолеть), при этом он обладает выраженными антиоксидантными свойствами. При достижении ядра и митохондрий H2 способен оказывать влияние на окислительно-восстановительные процессы в них (Ohta, 2012).
В первых работах, описывающих биологические эффекты воды с высоким отрицательным ОВП, показана возможность ее использования в качестве антиоксидантного средства (Yanagihara et al., 2005; Ohsawa et al., 2007). В дальнейшем было проведено большое количество исследований ее антиоксидантных свойств с использованием различных моделей окислительного стресса на лабораторных животных (Sun et al., 2009; Zhang et al., 2011, 2015; Ito et al., 2012; Huang et al., 2013; Shinbo et al., 2013; Hattori et al., 2015; Jing et al., 2015).
Методы получения и свойства растворов описаны в ряде научных работ (Сергунина, 1968; Петрушанко, Лобышев, 2001, 2004; Погорелов и др., 2019). Вода с измененным ОВП широко используется в пищевой промышленности, биотехнологии, кормопроизводстве, медицине и ветеринарии (Труфляк и др. 2014; Sun et al., 2015).
Цель данной работы – изучить влияние воды с высоким отрицательным ОВП на физиологические показатели молоди африканского клариевого сома.
МАТЕРИАЛЫ И МЕТОДЫ
Исследования проводили в лаборатории перспективных технологий в аквакультуре на базе бизнес-инкубатора ФГБОУ ВО “Кубанский государственный университет”.
В качестве экспериментального объекта использовали молодь африканского клариевого сома (мраморный клариевый сом или нильский клариас (Clarias gariepinus)).
Эксперимент проводили в период с 24.04.2019 г. по 24.05.2019 г. Общая продолжительность составила 30 дней.
Для содержания молоди использовали шесть пластиковых непрозрачных емкостей объемом 60 л размерами 710 × 400 × 290 мм каждая. Две емкости использовали для контрольных групп, остальные четыре – для двух опытных групп. Таким образом, все наблюдения были проведены в двукратной повторности. Каждую емкость наполняли водой в количестве 50 л. Для контрольной группы емкости наполняли отстоянной водопроводной водой (табл. 1). В эксперименте использовали аналогичную воду, которую предварительно обрабатывали путем снижения окислительно-восстановительного потенциала в опыте № 1 в течение 30 мин и в опыте № 2 в течение 60 мин.
Таблица 1.
Химический состав водопроводной воды
| pH | Жесткость, мг-экв/л | C(Ca2+), мг-экв/л | C(Mg2+), мг-экв/л | C(HCO3), ммоль/л |
C(H2CO3), ммоль/л | С(Cl–), ммоль/л | C(${\text{SO}}_{4}^{{2 - }}$), ммоль/л | С(Na+), ммоль/л | С(K+), ммоль/л |
|---|---|---|---|---|---|---|---|---|---|
| 7 | 2.9 | 2.2 | 0.7 | 4.53 | 0.21 | 0.80 | 0.42 | 5.63 | 0.71 |
Для получения воды с высоким отрицательным ОВП был собран электромембранный генератор ЭМГ-30 с экспериментальной биполярной ионообменной мембраной МБ-Э (Zabolotsky et al., 2019; Mareev et al., 2020; Melnikov et al., 2020). Принципиальная схема обработки воды представлена на рис. 1.
Рис. 1.
Принципиальная схема обработки воды: 1 – емкость с рабочим объемом 50 л с опытными объектами аквакультуры; 2 – pH метр; 3 – ОВП метр; 4 – ПК; 5 – электромембранный генератор с биполярной мембраной; 6 – источник питания; 7 – перистальтический насос.

При обработке вода из емкости с помощью перистальтического насоса производительностью 15 л/ч циркулировала через электромембранный генератор с размером электродов 1 дм2, сила тока составляла 1 А. Электроды были изготовлены из платинированного титана. Анодная и катодная камера разделены экспериментальной биполярной мембраной. В камерах генератора при протекании тока происходят следующие реакции:
(1)
${\text{катод}}\left( -- \right){\kern 1pt} :\,\,2{{{\text{H}}}_{{\text{2}}}}{\text{О}} + 2{\text{е}} \to 2{\text{O}}{{{\text{H}}}^{--}} + {{{\text{H}}}_{2}}{\kern 1pt} \uparrow ,$(2)
${\text{анод}}\left( + \right){\kern 1pt} :\,\,2{{{\text{H}}}_{{\text{2}}}}{\text{О}} - 4{\text{e}} \to 4{{{\text{H}}}^{ + }} + {{{\text{O}}}_{2}}{\kern 1pt} \uparrow .$Выделяющийся в катодной камере газообразный водород при растворении в воде смещает ее ОВП в отрицательную область. При использовании традиционных электролизеров для уменьшения ОВП воды происходит значительное смещение рН в катодной камере в щелочную область (рН > 11), что делает такую воду непригодной для жизнедеятельности объектов аквакультуры. В электромембранном генераторе происходит генерация катионов водорода на биполярной мембране, что компенсирует убыль этих ионов за счет электролиза. При обработке воды, изменяя токовые режимы и каталитическую активность мембраны, можно управлять скоростью генерации ионов водорода, чтобы поддерживать рН воды при ее обработке в заданном диапазоне. Таким образом, при обработке воды в электромембранном генераторе ее солевой состав и кислотность практически не изменяются, а ОВП от значений +150…+250 мВ снижается до –600…–500 мВ.
Обработку воды в емкостях проводили 1 раз в сутки, время работы электромембранного генератора составляло 30 мин для опытной группы 1 и 60 мин для опытной группы 2. ОВП воды в обрабатываемой емкости контролировали с помощью иономера Эксперт 001 (Россия).
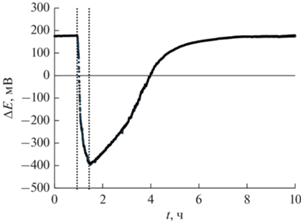
В качестве измерительного использовали точечный платиновый электрод, электродом сравнения служил хлоридсеребряный электрод, заполненный насыщенным раствором хлорида калия. Хлоридсеребряный электрод имеет потенциал +220 мВ относительно стандартного водородного электрода, поэтому для определения реального значения ОВП необходимо из измеренного значения вычесть 220 мВ. Вид зависимости ОВП от времени показан на рис. 2 (вертикальными пунктирными линиями показано время включения и выключения электромембранного генератора).
При обработке воды происходит резкое снижение ОВП во всей емкости, несмотря на то, что за 15–30 мин обработки через генератор протекает только часть воды, однако за счет высокой концентрации растворенного и газообразного водорода происходит его быстрая диффузия по всему объему обрабатываемой емкости. После окончания обработки происходит плавное повышение ОВП за счет улетучивания водорода и его расходования на реакции восстановление различных органических веществ.
В каждую емкость помещали по 130 мальков с приблизительно одинаковой средней массой тела. В итоге в эксперименте было задействовано 780 рыб. Каждые шесть дней проводили определение биомассы групп, пересчет количества и корректировку суточных норм кормления. В конце опыта производили взвешивание и измерение длины каждой особи. Взвешивание рыбы проводили с точностью до 0.01 г, кормов – до 0.1 г на электронных весах. Также каждые двое суток осуществляли полную замену воды.
Молодь кормили два раза в сутки согласно рыбоводным нормативам, рекомендациям производителя кормов, при этом суточная норма кормления в процентах от биомассы задавалась одинаково как для контроля, так и для опытных групп и составила 5% от биомассы рыб. Кормление производили осетровым кормом Сoppens vital (1.2–1.5 мм) с содержанием белка 46.0%, жира 100%, клетчатки 10%, золы 9.9% и фосфора 1.7%.
В течение эксперимента основные гидрохимические показатели (аммиак, нитриты, нитраты, pH) находились в норме. Температура воды в емкостях была в пределах 25 ± 2°С. Результаты обрабатывали с помощью стандартных статистических методов (Лакин, 1990). Статистическую достоверность отличий в группах выявляли с помощью U‑критерия Манна–Уитни и критерия Краскела–Уоллиса для непараметрических и независимых групп.
Вычисляли следующие показатели: среднее значение ($\bar {x}$), среднее квадратическое отклонение (σ), коэффициент вариации (CV), медиана, 25-й и 75-й процентиль.
Показатели роста вычисляли по следующим формулам (Щербина, Гамыгин, 2006): удельная скорость роста (Cw) – ${{C}_{w}} = \frac{{\ln {{M}_{t}} - \ln {{M}_{0}}~}}{t} \times 100~\% ;$ относительный прирост – $\Delta M = \frac{{{{M}_{t}}~--~{{M}_{0}}}}{{{{M}_{0}}}} \times 100\% ,$ где ${{M}_{0}},$ ${{M}_{t}}$ – средняя масса рыб в начале и конце периода соответственно.
Расчеты и графическое оформление полученных в работе данных, проводили с использованием программ Microsoft Excel и Statistica 12.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Температурный режим и водородный показатель в период выращивания были относительно стабильными. Температура варьировала в диапазоне от 23.5 до 25.9°С, pH от 7.3 до 8.0. При этом все изменения происходили синхронно в каждой группе. Это связано с особенностью работы электромембранного генератора, который поддерживает рН воды в заданном диапазоне аналогично контрольной группе, несмотря на снижение ОВП. Следует отметить, что при обработке опытных групп, происходило незначительное повышение температуры воды на 0.2–0.5°С, которая выравнивалась к контролю приблизительно за один час. Данное явление, как мы считаем, не могло повлиять на ход и результаты эксперимента.
В результате проведенных работ были получены основные биологические показатели молоди африканского клариевого сома (табл. 2).
Таблица 2.
Масса и длина тела африканского клариевого сома в течение эксперимента
| Сутки | Контроль | Опыт № 1 | Опыт № 2 | |||
|---|---|---|---|---|---|---|
| n, шт. | $\bar {x} \pm \sigma $, CV, % |
n, шт. | $\bar {x} \pm \sigma $, CV, % |
n, шт. | $\bar {x} \pm \sigma $, CV, % |
|
| Масса, г | ||||||
| 1 | 260 | $\frac{{0.58 \pm 0.220}}{{36}}$ | 260 | $\frac{{0.57 \pm 0.235}}{{34.8}}$ | 260 | $\frac{{0.58 \pm 0.222}}{{35.5}}$ |
| 6 | 258 | $\frac{{0.94 \pm 0.380}}{{37.4}}$ | 256 | $\frac{{1.01 \pm 0.445}}{{38.2}}$ | 254 | $\frac{{0.99 \pm 0.416}}{{37.3}}$ |
| 12 | 250 | $\frac{{1.48 \pm 0.623}}{{39.5}}$ | 246 | $\frac{{1.56 \pm 0.733}}{{41.1}}$ | 248 | $\frac{{1.56 \pm 0.661}}{{39.3}}$ |
| 18 | 249 | $\frac{{2.07 \pm 0.895}}{{41.3}}$ | 240 | $\frac{{2.35{\kern 1pt} *{\kern 1pt} * \pm \,1.15}}{{44.5}}$ | 244 | $\frac{{2.28{\kern 1pt} *{\kern 1pt} * \pm \,0.987}}{{40.8}}$ |
| 24 | 245 | $\frac{{2.81 \pm 1.239}}{{43.1}}$ | 238 | $\frac{{3.42{\kern 1pt} * \pm \,1.707}}{{47.7}}$ | 239 | $\frac{{3.29{\kern 1pt} * \pm \,1.447}}{{42.9}}$ |
| 30 | 234 | $\frac{{3.92 \pm 1.748}}{{44.6}}$ | 230 | $\frac{{5.02{\kern 1pt} * \pm \,2.561}}{{51.0}}$ | 229 | $\frac{{4.85{\kern 1pt} * \pm \,2.153}}{{44.4}}$ |
| Длина, см | ||||||
| 1 | 260 | $\frac{{4.2 \pm 0.060}}{{16.5}}$ | 260 | $\frac{{4.2 \pm 0.055}}{{15.7}}$ | 260 | $\frac{{4.2 \pm 0.057}}{{16.1}}$ |
| 30 | 234 | $\frac{{8.1 \pm 1.28}}{{15.9}}$ | 230 | $\frac{{8.5{\kern 1pt} *{\kern 1pt} * \pm \,1.38}}{{16.3}}$ | 229 | $\frac{{8.4{\kern 1pt} * \pm \,1.31}}{{15.2}}$ |
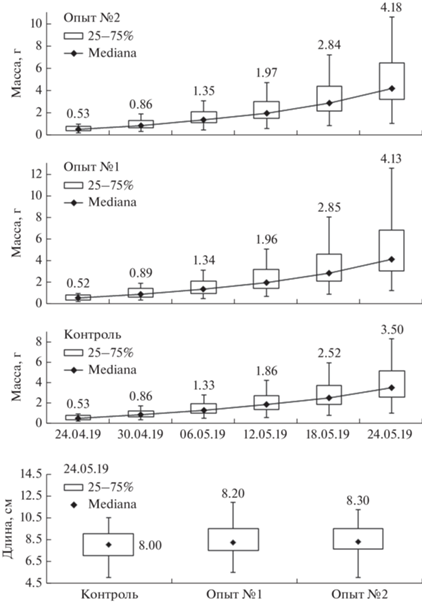
В начале опыта средняя масса молоди составляла 0.58 г, длина – 4.2 см. В течение эксперимента рост молоди изменялся в каждой группе. В конце эксперимента средняя масса составляла: в контрольной группе – 3.92 г, опытной группе № 1 – 5.02 г и опытной группе № 2 – 4.85 г. Средняя длина в конце опыта составила у контрольной группы – 8.1 см, опытной группы № 1 – 8.5 см и опытной группы № 2 – 8.4 см. При сравнении с помощью U-критерия Манна–Уитни достоверных отличий выявлено не было между опытными группами № 1 и 2.
Сравнение с помощью критерия Краскела–Уоллиса всех групп в совокупности выявило достоверные отличия между ними по средней массе на 12.05.19 при p ≤ 0.05, 18.05.19 и 24.05.19 при p ≤ 0.01, по длине в конце эксперимента 24.05.19 при p ≤ 0.01.
Коэффициент вариации массы тела в группах во времени изменялся от 34.8–36.0 до 44.4–51.0%, при этом различия по группам невелики.
В совокупности по группам по критерию Краскела–Уоллиса различия достоверны по медианам масс рыб: 18.05.19 при p ≤ 0.05 и 24.05.19 при p ≤ 0.01, по медианам длин в конце эксперимента 24.05.19 различия не выявлены (рис. 3).
Минимальная масса молоди африканского клариевого сома в конце эксперимента у всех групп была примерно одинаковой и составила 1.02–1.19 г, минимальная длина в конце также не сильно отличалась 5.0–5.5 см. В то время как максимальная масса молоди варьировала: контрольная группа – 8.2 г; опытная группа № 1 – 12.57 г; опытная группа № 2 – 10.55 г.
За время эксперимента во всех группах оценивали количество погибших рыб в вариантах (табл. 3). Изначально в опыте было задействовано по 260 экз. молоди африканского клариевого сома. Конечная выживаемость с учетом объема выборок не сильно разнилась и была следующей: контрольная группа – 234 экз. (90.0%), опытная группа № 1 – 230 экз. (88.5%), опытная группа № 2 – 229 экз. (88.1%). Такие показатели для данного вида являются нормой (Ковалев, 2006), так как они склонны к каннибализму и съедают ослабленных и мелкорослых особей. При этом данную разницу нельзя считать значительной и показательной.
Таблица 3.
Показатели выживаемости молоди африканского клариевого сома
| Сутки | Контроль | Опыт № 1 | Опыт № 2 | |
|---|---|---|---|---|
| 1 | экз. | 260 | 260 | 260 |
| % | 100.0 | 100.0 | 100.0 | |
| 6 | экз. | 258 | 256 | 254 |
| % | 99.2 | 98.5 | 97.7 | |
| 12 | экз. | 250 | 246 | 248 |
| % | 96.2 | 94.6 | 95.4 | |
| 18 | экз. | 249 | 240 | 244 |
| % | 95.8 | 92.3 | 93.8 | |
| 24 | экз. | 245 | 238 | 239 |
| % | 94.2 | 91.5 | 91.9 | |
| 30 | экз. | 234 | 230 | 229 |
| % | 90.0 | 88.5 | 88.1 | |
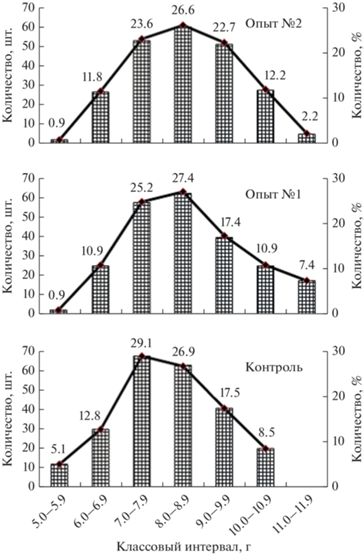
Для оценки размерной структуры, полученной в конце эксперимента молоди африканского клариевого сома, составляли вариационные ряды (рис. 4, 5). Массу оценивали по шести размерным классам с интервалом 2 г, длину по семи с интервалом 1 см.
Минимальная величина размерной группы по массе составила 1.0–2.9 г, а максимальная – 11.0–12.9 г, а по длине минимальная составила 5.0–5.9 см, максимальная – 11.0–11.9 см.
На рис. 4 видно, что в контрольной группе по сравнению с опытной группой № 1 и опытной группой № 2 отсутствуют особи в классовых интервалах 9.0–12.9 г. Наибольшей представительностью по массе в контрольной группе характеризовались рыбы в наименьшем размерном классе 1.0–2.9 г (38%). В опытной группе № 1 и 2 данный класс занимал меньшие объемы 22.6 и 18.3%, а основное количество особей находится в диапазоне 3.0–4.9 г (38.3 и 44.1% соответственно).
Необходимо отметить, что длина по сравнению с массой характеризуется меньшей изменчивостью во времени (рис. 5). В отличие от массы распределение особей по длине является нормальным, что видно из гистограмм на рис. 5. При этом в контрольной группе отсутствовали особи в классе 11.0–11.9 см, а основное количество особей во всех группах находилось в диапазоне длин от 7.0 до 9.9 см.
Показательным является изменение биомассы в течение эксперимента (табл. 4): начальная масса в каждой группе составляла 151 г. На протяжении всего эксперимента в контрольной группе наблюдали отставание в наборе биомассы. Наибольшим фактическим приростом биомассы в 1004.2 г характеризовалась опытная группа № 1, при этом, в контрольной группе – 756.6 и 958.6 г в опытной группе № 2. Ежесуточный прирост в контрольной группе составлял от 15.9 до 37.7 г/сут, опытной группе № 1 от 18.0 до 57.4 г/сут и опытной группе № 2 от 17.2 до 53.8 г/сут.
Таблица 4.
Динамика прироста и биомассы молоди клариевого сома
| Сутки | Показатель | Контроль | Опыт № 1 | Опыт № 2 |
|---|---|---|---|---|
| 6 | биомасса, г | 151 | 151 | 151 |
| прирост, г/сут. | 15.9 | 18.0 | 17.2 | |
| Cw, % | 8.1 | 9.0 | 8.7 | |
| 12 | биомасса, г | 246.2 | 258.8 | 254.4 |
| прирост, г/сут. | 20.5 | 20.9 | 22.2 | |
| Cw, % | 6.8 | 6.6 | 7.0 | |
| 18 | биомасса, г | 369.2 | 384 | 387.6 |
| прирост, г/сут. | 24.4 | 29.9 | 27.8 | |
| Cw, % | 5.6 | 6.4 | 6.0 | |
| 24 | биомасса, г | 515.4 | 563.6 | 554.6 |
| прирост, г/сут. | 29.1 | 41.2 | 38.8 | |
| Cw, % | 4.9 | 6.1 | 5.8 | |
| 30 | биомасса, г | 690.2 | 810.6 | 787.1 |
| прирост, г/сут. | 37.7 | 57.4 | 53.8 | |
| Cw, % | 4.7 | 5.9 | 5.7 | |
| Окончание опыта | биомасса, г | 91.6 | 1155.2 | 1109.6 |
Суточная норма кормления, выраженная в процентах, увеличивалась соизмеримо и закономерно растущей биомассе на каждом этапе. При этом, из-за выявленного отставания контрольной группы (с 6 сут эксперимента), основным индикатором роста являлось описание его удельной скорости, которая по мере взросления организма снижалась во всех группах: от 9.0 до 5.9% в опытной группе № 1, от 8.7 до 5.7% в опыте группе № 2 и особенно от 8.1 до 4.7% в контрольной группе. Второй индикатор – относительный прирост биомассы. На рис. 6 можно заметить снижение биомассы, при этом у контрольной группы (24.7%) практически на всем протяжении эксперимента он всегда был ниже опытных группах № 1 (29.8%) и № 2 (29.1%).
Одним из показателей эффективности выращивания и работы организма в целом является кормовой коэффициент (табл. 5). В результате за все время эксперимента больше всего корма было съедено опытной группой № 1 – 650.4 г, а опытной группой № 2 и контрольной группой 640.4 и 591.6 г, соответственно. Несмотря на то, что у опытной группы № 1 наибольший расход корма, кормовой коэффициент у него меньше, чем у других опытных групп и равен 0.65 ед., тогда как у контрольной группы – 0.77 ед., а у опытной группы № 2 – 0.67 ед.
Таблица 5.
Расход кормов в период проведения эксперимента
| Опытная группа | $\frac{{{\text{Суточная}}\,\,{\text{норма}}\,\,{\text{кормления,}}\,\,{{\text{г}} \mathord{\left/ {\vphantom {{\text{г}} {{\text{сут}}}}} \right. \kern-0em} {{\text{сут}}}}}}{{{\text{расход}}\,\,{\text{корма}}\,\,{\text{за}}\,\,{\text{период,}}\,\,{\text{г}}}}$ | Итоговый расход корма, г | ПБМ, г | КК, ед. | ||||
|---|---|---|---|---|---|---|---|---|
| Сутки | ||||||||
| 6 | 12 | 18 | 24 | 30 | ||||
| Контроль | $\frac{{7.6}}{{45.3}}$ | $\frac{{12.3}}{{73.9}}$ | $\frac{{18.5}}{{110.8}}$ | $\frac{{25.8}}{{154.6}}$ | $\frac{{34.5}}{{207.1}}$ | 591.6 | 765.6 | 0.77 |
| Опыт № 1 | $\frac{{7.6}}{{45.3}}$ | $\frac{{12.9}}{{77.6}}$ | $\frac{{19.2}}{{115.2}}$ | $\frac{{28.2}}{{169.1}}$ | $\frac{{40.5}}{{243.2}}$ | 650.4 | 1004.2 | 0.65 |
| Опыт № 2 | $\frac{{7.6}}{{45.3}}$ | $\frac{{12.7}}{{76.3}}$ | $\frac{{19.4}}{{116.3}}$ | $\frac{{27.7}}{{166.4}}$ | $\frac{{39.4}}{{236.1}}$ | 640.4 | 958.6 | 0.67 |
Таким образом, в результате проведенных работ нами установлено, что снижение ОВП от +150…+250 до –600…–500 мВ с помощью электромембранного генератора без изменения солевого состава и кислотности с экспозицией 30 и 60 мин раз в сутки положительно сказывается на основных биологических показателях молоди африканского клариевого сома. Причем наилучший показатель наблюдали в опытной группе с обработкой воды в течение 30 мин.
Эффективность выражается в статистически достоверном увеличении средних и максимальных масс молоди в опытных группах № 1 и 2, по сравнению с контрольной группой. При этом конечная выживаемость по группам с учетом объема выборок достоверно не отличалась. Наиболее представительными по массе в контрольной группе характеризовались рыбы в наименьшем размерном классе 1.0–2.9 г (38%), в свою очередь, в опытных группах № 1 и 2 основное количество особей находилось в диапазоне 3.0–4.9 г (38.3 и 44.1% соответственно). Удельная скорость роста изменялась примерно одинаково во всех группах. Относительный прирост биомассы контрольной группы практически на всем протяжении эксперимента всегда был ниже опытных групп № 1 и 2. У опытных групп № 1 и 2 был меньший по сравнению с контролем кормовой коэффициент, что говорит об эффективном усвоении корма молодью.
Таким образом, наблюдаемое увеличение продуктивности выращивания молоди африканского клариевого сома является результатом воздействия воды с высоким отрицательным ОВП на стимулирование биологических процессов в организме, однако механизм данного эффекта влияния требует более детального и тщательного изучения. Возможно, резкое изменение ОВП среды обитания клариевого сома приводит к возникновению стресса, что оказывает выраженное влияние на динамику биохимических, клеточных, тканевых и системных регуляторных процессов. Кроме того, попадание молекулярного водорода в организм приводит к изменению в экспрессии генов в системных органах, что также может отражаться на физиологических показателях молоди африканского клариевого сома.
Финансирование. Работа выполнена при финансовой поддержке Государственного задания ЮНЦ РАН (АААА-А19-119040390083-6).
Список литературы
Власов В.А., Завьялов А.П. Воспроизводство и выращивание клариевого сома (Clarias gariepinus) в установках с замкнутым водообеспечением // Зоотехника. 2014. Т. 12. С. 22–24.
Ковалев К.В. Технологические аспекты выращивания клариевого сома (Clarias gariepinus) в рыбоводной установке с замкнутым циклом водообеспечения (УЗВ): дис. канд. с.-х. наук. М.: с.-х. акад. им. К.А. Тимирязева. 2006. 132 с.
Лакин Г.Ф. Биометрия. М.: Высшая школа, 1990. 352 с.
Петрушанко И.Ю., Лобышев В.И. Неравновесные состояния электрохимически активированной воды и ее биологической активности // Биофизика. 2001. Т. 46(3). С. 389–401.
Петрушанко И.Ю., Лобышев В.И. Физико-химические свойства водных растворов, полученных в мембранном электролизере // Биофизика. 2004. Т. 49(1). С. 22–31.
Плутахин Г.А., Аидер М., Кощаев А. Г., Гнатко Е.Н. Теоретические основы электрохимической обработки водных растворов // Политематический сетевой электронный научный журн. Кубанского государственного аграрного университета (Научный журнал КубГАУ). 2013. Т. 8. P. 092.
Погорелов А.Г., Кузнецов А.Л., Панаит А.И., Погорелова М.А., Суворов О.А., Иваницкий Г.Р. Дезинтеграция бактериальной плёнки посредством электрохимически восстановленного водного раствора // Докл. академии наук. 2019. Т. 486(3). С. 395–397. https://doi.org/10.31857/S0869-56524863395-397
Сергунина Л.A. Эффективный метод электролиза для обеззараживания питьевой воде // Гигиена и санитария. 1968. Т. 33(4). С. 16–21.
Труфляк Е.В., Курченко Н.Ю., Яркин Д.С. Изучение гидропосева овощных культур с применением электроактивированной воды // Научный журнал КубГАУ. 2014. Т. 96(02). С. 1–15. http://doi.org/ej.kubagro.ru/2014/02/pdf/06.pdf
Щербина М.А., Гамыгин Е.А. Кормление рыб в пресноводной аквакультуре. М.: ВНИРО, 2006. 360 с.
Abd-Elkareem M., Abou Khalil N.S., Sayed A.E.-D.H. Cytoprotective effect of Nigella sativa seed on 4-nonylphenol-induced renal damage in the African catfish (Clarias gariepinus) // Chemosphere. 2020. V. 259. P. 127379.
Adeoye A.A., Akegbejo-Samsons Y., Fawole F.J., Davies S.J. Preliminary assessment of black soldier fly (Hermetia illucens) larval meal in the diet of African catfish (Clarias gariepinus): Impact on growth, body index, and hematological parameters // J. World Aquaculture Society. 2020. V. 51(4). P. 1024–1033.
Audu B.S., Ajima M.N.O. Metabolic enzyme profile, behavioural changes and morphophysiological parameters of African catfish Clarias gariepinus juveniles in response to burnt waste tyres // Comp. Clin. Pathology. 2020. V. 29(4). P. 787–797.
Bahir V. Electrochemical activation: A strategy for creation of environmentally benign technologies // Activated Water. 1996. V 1. P. 1–7.
Basov A., Fedulova L., Baryshev M., Dzhimak S. Deuterium-depleted water influence on the isotope 2H/1H regulation in body and individual adaptation // Nutrients. 2019a. V. 11(8). P. 1903. https://doi.org/10.3390/nu11081903
Basov A., Fedulova L., Vasilevskaya E., Dzhimak S. Possible mechanisms of biological effects observed in living systems during 2H/1H isotope fractionation and deuterium interactions with other biogenic isotopes // Molecules. 2019b. V. 24(22). P. 4101. https://doi.org/10.3390/molecules24224101
Basov A.A., Kozin S.V., Bikov I.M., Popov K.A., Moiseev A.V., Elkina A.A., Dzhimak S.S. Changes in prooxidant-antioxidant system indices in the blood and brain of rats with modelled acute hypoxia which consumed a deuterium-depleted drinking diet // Biol. Bulletin. 2019c. V. 46(6). P. 531–535. https://doi.org/10.1134/S1062359019060049
Dumbo J.C., Gilbert B.M., Avenant-Oldewage A. Oxidative stress biomarkers in the African sharptooth catfish, Clarias gariepinus, associated with infections by adult digeneans and water quality // Intern. J. Parasitology: Parasites and Wildlife. 2020. V. 12. P. 232–241.
Hattori Y., Kotani T., Tsuda H., Mano Y., Tu L., Li H., Hirako S., Ushida T., Imai K., Nakano T., Sato Y., Miki R., Sumigama S., Iwase A., Toyokuni S., Kikkawa F. Maternal molecular hydrogen treatment attenuates lipopolysaccharide-induced rat fetal lung injury // Free Radic Res. 2015. V. 49. P. 1026–1037. https://doi.org/10.3109/10715762.2015.1038257
Huang G., Zhou J., Zhan W., Xiong Y., Hu C., Li X., Li Y., Liao X. The neuroprotective effects of intraperitoneal injection of hydrogen in rabbits with cardiac arrest // Resuscitation. 2013. V. 84(5). P. 690–5. https://doi.org/10.1016/j.resuscitation.2012.10.018
Ichihara M., Sobue S., Ito M., Ito M., Hirayama M., Ohno K. Beneficial biological effects and the underlying mechanisms of molecular hydrogen – comprehensive review of 321 original articles // Med. Gas. Res. 2015. V. 5. P. 12. https://doi.org/10.1186/s13618-015-0035-1
Ito M., Hirayama M., Yamai K., Goto S., Ito M., Ichihara M., Ohno K. Drinking hydrogen water and intermittent hydrogen gas exposure, but not lactulose or continuous hydrogen gas exposure, prevent 6-hydorxydopamine-induced Parkinson’s disease in rats // Med. Gas. Res. 2012. V. 2. P. 15. https://doi.org/10.1186/2045-9912-2-15
Jing L., Wang Y., Zhao X.M., Zhao B., Han J.J., Qin S.C., Sun X.J. Cardioprotective Effect of Hydrogen-rich Saline on Isoproterenol-induced Myocardial Infarction in Rats // Heart Lung Circ. 2015. V. 24(6). P. 602–10. https://doi.org/10.1016/j.hlc.2014.11.018
Mareev S.A., Evdochenko E., Wessling M., Kozaderova O.A., Niftaliev S.I., Pismenskaya N.D., Nikonenko V.V. A comprehensive mathematical model of water splitting in bipolar membranes: Impact of the spatial distribution of fixed charges and catalyst at bipolar junction // J. Memb. Science. 2020. V. 603. P. 118010. https://doi.org/10.1016/j.memsci.2020.118010
Mashaly M.I., Allam H.E., El-Naggar M.M. Impacts of physicochemical and heavy metal parameters on infestation level of the monogeneans, Quadriacanthus spp. infesting Nile catfish, Clarias gariepinus of different water localities in Nile Delta, Egypt // J. Parasitic Diseases. 2020. V. 44(3). P. 579–589.
Melnikov S.S., Mugtamov O.A., Zabolotsky V.I. Study of electrodialysis concentration process of inorganic acids and salts for the two-stage conversion of salts into acids utilizing bipolar electrodialysis // Separ. Purif. Techn. 2020. V. 235. P. 116198. https://doi.org/10.1016/j.seppur.2019.116198
Ohsawa I., Ishikawa M., Takahashi K., Watanabe M., Nishimaki K., Yamagata K., Katsura K.-I., Katayama Y., Asoh S., Ohta S. Hydrogen acts as a therapeutic antioxidant by selectively reducing cytotoxic oxygen radicals // Nat. Med. 2007. V. 13(6). P. 688–94. https://doi.org/10.1038/nm1577
Ohta S. Molecular hydrogen is a novel antioxidant to efficiently reduce oxidative stress with potential for the improvement of mitochondrial diseases // Biochim Biophys Acta. 2012. V. 1820(5). P. 586–94. https://doi.org.https://doi.org/10.1016/j.bbagen.2011.05.006
Oluah N.S., Aguzie I.O., Ekechukwu N.E., Madu J.C., Ngene C.I., Oluah C. Hematological and immunological responses in the African catfish Clarias gairepinus exposed to sublethal concentrations of herbicide Ronstar® // Ecot. Environ. Safety. 2020. V. 201. P. 110824.
Shinbo T., Kokubo K., Sato Y., Hagiri S., Hataishi R., Hirose M., Kobayashi H. Breathing nitric oxide plus hydrogen gas reduces ischemia-reperfusion injury and nitrotyrosine production in murine heart // Am. J. Physiol. Heart Circ. Physiol. 2013. V. 305(4). P. 542–550. https://doi.org/10.1152/ajpheart.00844.2012
Siqwepu O., Salie K., Goosen N. Evaluation of potassium diformate and potassium chloride in the diet of the African catfish, Clarias gariepinus in a recirculating aquaculture system // Aquaculture. 2020. V. 526. P. 735414.
Stewart K.M. Physical Properties of Water // Encyclopedia of Inland Waters. 2009. P. 148–154.
Sun Q., Kang Z., Cai J., Liu W., Liu Y., Zhang J.H., Denoble P.J., Tao H., Sun X. Hydrogen-rich saline protects myocardium against ischemia/reperfusion injury in rats // Exp. Biol. Med. (Maywood). 2009. V. 234(10). P. 1212–1229. https://doi.org/10.3181/0812-RM-349
Sun X., Ohta S., Nakao A. Hydrogen Molecular Biology and Medicine // Springer. 2015. P. 122. https://doi/org/ https://doi.org/10.1007/978-94-017-9691-0
Swaleh S.B., Banday U.Z., Asadi M.-A., Usmani N. Biochemical profile and gene expression of Clarias gariepinus as a signature of heavy metal stress // Environ. Pollution. 2020. V. 264. P. 114693.
Volchenko N.N., Samkov A.A., Malyshko V.V., Khudokormov A.A., Moiseev A.V., Elkina A.A., Baryshev M.G., Pershin S.M. Influence of the environmental isotope composition modification on growth and metabolic activity of Rhodococcus and Saccharomyces // Biology Bulletin. 2020. V. 47(4). P. 326–330.https:// doi.org/https://doi.org/10.1134/S1062359020040135
Yanagihara T., Arai K., Miyamae K., Sato B., Shudo T., Yamada M., Aoyama M. Electrolyzed hydrogen-saturated water for drinking use elicits an antioxidative effect: a feeding test with rats // Biosci. Biotechnol. Biochem. 2005. V. 69(10). P. 1985–1987.
Zabolotsky V.I., Korzhov A.N., But A.Yu., Melnikov S.S. Reagent-free electromembrane process for decarbonization of natural water // membranes and membrane technologies. 2019. V. 1(6). P. 341–346. https://doi.org/10.1134/S2517751619060076
Zaid A., Isibor P., Aduljelili O., Akinsanya B. Effects of herbal mixture (Jedi, gbewutu and opa-eyin) on the health status of juvenile african catfish (Clarias gariepinus) // Egyptian J. Aquatic Biol. Fish. 2020. V. 24(1). P. 31–48.
Zhang J., Blaszczyk A., Grifo J., Ozil J.P., Adler A., Berkeley A. Electrical activation and in vitro development of human oocytes which failed fertilization following intracytoplasmic sperm injection // Fertility and Sterility. 1999. V. 7. P. 509–512.
Zhang G., Gao S., Li X., Zhang L., Tan H., Xu L., Chen Y., Geng Y., Lin Y., Aertker B., Sun Y. Pharmacological postconditioning with lactic acid and hydrogen rich saline alleviates myocardial reperfusion injury in rats // Sci. Rep. 2015. V. 5. P. 9858. https://doi.org/10.1038/srep09858
Zhang Y., Sun Q., He B., Xiao J., Wang Z., Sun X. Anti-inflammatory effect of hydrogen-rich saline in a rat model of regional myocardial ischemia and reperfusion // Int. J. Cardiol. 2011. V. 148(1). P. 91–95. https://doi.org/10.1016/j.ijcard.2010.08.058
Дополнительные материалы отсутствуют.
Инструменты
Известия РАН. Серия биологическая