Коллоидный журнал, 2023, T. 85, № 1, стр. 28-37
Динамические свойства смешанных пленок фуллеренола и бычьего сывороточного альбумина на водной поверхности
Н. А. Исаков 1, Б. А. Носков 1, *
1 Федеральное государственное бюджетное образовательное учреждение высшего образования
“Санкт-Петербургский государственный университет”, Институт химии
199034 Санкт-Петербург, Университетская набережная, д. 7/9, Россия
* E-mail: b.noskov@spbu.ru
Поступила в редакцию 19.10.2022
После доработки 11.11.2022
Принята к публикации 15.11.2022
- EDN: KEPZVZ
- DOI: 10.31857/S0023291222600572
Аннотация
Свойства пленки смеси фуллеренола C60(OH)20 и бычьего сывороточного альбумина на водной поверхности зависят от способа формирования этой пленки. При адсорбции компонентов из раствора смеси свойства пленки определяются в основном более поверхностно-активным белком. В то же время изотермы сжатия пленок заметно отклоняются от результатов для пленок чистого белка. При адсорбции одного из компонентов на поверхности, содержащей пленку второго компонента, иногда наблюдался синергетический эффект, когда поверхностное давление и модуль динамической поверхностной упругости заметно превышали значения для растворов индивидуальных компонентов, что вызвано сильными взаимодействиями между компонентами и образованием комплексов фуллеренола и белка в поверхностном слое.
ВВЕДЕНИЕ
Уникальные свойства фуллеренов привлекают к ним широкое внимание с момента их открытия в 1984 году. В частности, для медицины представляет интерес их способность снижать оксидативный стресс в клетках, противовирусная и антибактериальная активность, возможность использования для направленной доставки лекарств [1–3]. Однако применение фуллеренов во многом затруднено их низкой растворимостью в воде, что вызывает интерес к более гидрофильным производным фуллеренов. Среди водорастворимых производных наиболее исследованными оказываются фуллеренолы, обладающие относительно низкой токсичностью, что делает их особенно привлекательными для применения в медицинских целях [4].
Биологическая активность фуллеренолов во многом определяется их взаимодействием с биомакромолекулами, в частности, с белками. Образование короны белка вокруг агрегатов фуллеренолов в водной системе может приводить к изменению третичной структуры белка. Одно из преимуществ фуллеренола по сравнению с другими углеродными наночастицами заключается в возможности регулирования их взаимодействия с белками посредством варьирования в широких пределах числа гидроксильных групп в молекуле.
Молекула бычьего сывороточного альбумина (БСА), состоящая из трех гомологичных доменов, близка по своей структуре к молекулам человеческого сывороточного альбумина – основного белка плазмы крови. Изоэлектрическая точка БСА равна 4.9. Поэтому при нейтральном pH белок несет небольшой отрицательный заряд. Как и многие другие белки, БСА обладает заметной поверхностной активностью, образуя на водной поверхности адсорбционные слои с относительно высокой дилатационной упругостью, достигающей 80 мН/м. Отметим, что в процессе адсорбции на водной поверхности белки могут изменять свою третичную структуру [5], что, в свою очередь, может менять характер взаимодействия с наночастицами в поверхностном слое по сравнению со взаимодействиями в объеме раствора.
О взаимодействии белков с фуллеренами и их производными в объемной части водных растворов имеется значительный объем информации, полученной как c помощью физических [6–10], так и компьютерных экспериментов [6, 11–13]. Взаимодействие фуллерена с белками сильно зависит от размера агрегатов фуллерена в растворе. Наиболее эффективным оказывается связывание фуллерена с БСА при диаметре агрегатов около 100 нм [8, 9]. Основной вклад во взаимодействие белков с фуллеренами и их производными вносят силы Ван-дер-Ваальсa и водородные связи. Для производных фуллеренов, в особенности фуллеренолов, взаимодействие с белками усиливается за счет π–π-взаимодействий, оказывающиxся наиболее эффективными из-за малого размера образованных агрегатов фуллеренолов [14]. Важно отметить, что информация о взаимодействии углеродных наночастиц и белков у межфазных границ оказывается крайне ограниченной, несмотря на ее важность для объяснения взаимодействия наночастиц с белками на клеточных мембранах.
Методы дилатационной поверхностной реологии обладают высокой чувствительностью к конформации белка в поверхностном слое [5, 15–17]. В данной работе эти методы, а также эллипсометрия, атомно-силовая микроскопия, измерения изотерм сжатия используются для оценки микроскопической морфологии, взаимодействия между компонентами и свойств смешанных слоев фуллеренола C60(OH)20 и БСА на водной поверхности, полученных тремя различными способами.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Для приготовления исходных растворов фуллеренола C60(OH)20 (научно-исследовательский центр “Курчатовский Институт”, Россия) и БСА (Sigma Aldrich, Германия) использовался фосфатный буфер (pH 7.00, ионная сила I = 0.020 М). Для приготовления буферного раствора смешивались растворы NaH2PO4 (Sigma Aldrich, Германия) и Na2HPO4 (Sigma Aldrich, Германия). При этом использовалась трижды дистиллированная вода, причем вторая и третья перегонки осуществлялись на установке, полностью сделанной из стекла.
Для формирования смешанных пленок фуллерена и БСА в данной работе применяли три различных метода. Первый метод заключался в совместной адсорбции обоих компонентов из смешанных растворов. Для этого в ванны Лэнгмюра объемом 100 или 330 мл заливали смесь исходных растворов БСА и фуллеренола, а также буферного раствора до достижения заданных концентраций фуллеренола и БСА. Спустя 10 мин поверхность раствора очищалась с помощью пипетки Пастера и водоструйного насоса.
Второй способ заключался в предварительном формировании пленки фуллеренола на водной поверхности в результате адсорбции фуллеренола из концентрированного раствора в течение около 12 ч. На следующий день проводилась замена раствора фуллеренола на буферный раствор при сохранении адсорбционной пленки фуллеренола. Затем в субфазу вводился с помощью дозатора заданный объем исходного раствора БСА до достижения требуемой концентрации БСА. В ходе последующего проникновения БСА в пленку фуллеренола формировалась смешанная пленка.
Третий способ формирования смешанной пленки заключался в проникновении фуллеренола в нанесенную пленку БСА на водной поверхности. Для этого на поверхность буферного раствора в ванне Лэнгмюра с помощью стеклянной наклонной плоскости и дозатора наносился заданный объем исходного раствора БСА. Далее наклонная плоскость извлекалась из раствора, а в субфазу вводился концентрированный раствор фуллеренола. В процессе последующей адсорбции фуллеренола формировалась смешанная пленка.
Определение дилатационной поверхностной упругости проводилось на приборе ISR (KSV NIMA, Финляндия) методом осциллирующего барьера. В этом случае колебания площади поверхности раствора в ванне Лэнгмюра создавались в результате периодического движения двух фторопластовых барьеров вдоль краев ванны Лэнгмюра. Возникающие колебания поверхностного давления измерялись методом пластинки Вильгельми. Комплексная динамическая дилатационная поверхностная упругость ${\text{E}}\left( \omega \right)$ может быть определена следующим соотношением:
В данной работе амплитуда колебаний площади поверхности составляла 2%, что соответствует линейному отклику системы на колебания. Частота колебаний площади поверхности составляла 0.030 Гц, т. е. лежала в области работоспособности используемого прибора (<0.1 Гц).
Размеры агрегатов фуллеренола в водных растворах оценивались методом динамического рассеяния света (ДРС) на приборе Zetasizer ZS Nano (Malvern Instruments, Великобритания) при угле рассеяния 173°.
Эллипсометрические измерения проводились с помощью прибора Multiskop (Optrel GBR, Германия) с длиной волны лазера 632.8 нм при угле падения 49°, близком к углу Брюстера. Разность эллипсометрических углов для раствора одного поверхностно-активного вещества Δ и растворителя Δ0 пропорциональна величине адсорбции растворенного компонента [18].
Морфология слоев индивидуальных компонентов и их смесей определялась с помощью атомно-силового микроскопа (NT-MDT, Россия). Для этого пленка с водной поверхности переносилась на поверхность свежерасколотой пластинки слюды методом Лэнгмюра−Шеффера. Далее пластинки высушивались в эксикаторе при температуре 18°C в течение двух дней. Все измерения проводились в полуконтактном режиме.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Адсорбционные пленки смешанных растворов фуллеренола и БСА
Согласно данным метода ДРС в растворе образовывались агрегаты фуллеренола с диаметром в диапазоне от 4 до 12 нм, при этом средний диаметр был близок к 8 нм, что согласуется с литературными данными [19].
На кинетических зависимостях поверхностного давления (рис. 1а) и дилатационной динамической поверхностной упругости (рис. 1б) растворов смеси БСА и фуллеренола наблюдалось замедление изменения поверхностных свойств по сравнению с результатами для раствора чистого белка. Этот эффект усиливался при увеличении отношения концентрации фуллеренола к концентрации БСА. Можно предположить, что взаимодействие фуллеренола и БСА в объеме раствора приводит к формированию относительно устойчивых комплексов C60(OH)20/БСА, что понижает концентрацию свободных молекул белка и, как следствие, скорость их диффузии к поверхности, а с другой стороны скорость адсорбции агрегатов фуллеренола к поверхности также оказывается медленной из-за их относительно большого размера.
Рис. 1.
Кинетические зависимости поверхностного давления (a) и модуля дилатационной динамической поверхностной упругости (б) растворов чистого БСА (квадраты) и смешанных растворов C60(OH)20 и БСА при отношениях молярных концентраций 10 : 1 (круги), 100 : 1 (треугольники) и 500 : 1 (ромбы). Концентрация БСА в растворе составляла $8 \times {{10}^{{ - 7}}}$ М.

Для получения дополнительной информации на основе кинетических зависимостей на рис. 1 были построены зависимости модуля поверхностной упругости от поверхностного давления (рис. 2). Отклонение этих зависимостей от результатов для раствора чистого БСА не превышало примерно 10%. Это означает, что поверхностные свойства смешанных растворов определяются в основном адсорбцией белка.
Рис. 2.
Зависимости модуля дилатационной динамической поверхностной упругости от поверхностного давления растворов чистого БСА (квадраты) и смешанных растворов C60(OH)20 и БСА при отношениях молярных концентраций 10 : 1 (круги), 100 : 1 (треугольники) и 500 : 1 (ромбы). Все данные соответствуют возрасту поверхности 5 ч.

Эллипсометрические данные также согласуются с предположением о преобладании БСА в адсорбционном слое смешанного раствора C60(OH)20/БСА. Близость кинетических зависимостей Δ–Δ0 для смешанных растворов и для раствора чистого БСА (рис. 3) указывает на близкий состав адсорбционных слоев этих растворов. На начальном этапе адсорбции в течение примерно 90 мин после образования новой поверхности для смешанных растворов характерен более медленный рост угла Δ по сравнению с результатами для раствора БСА, что связано, по-видимому, с замедлением скорости диффузии к поверхности раствора. Относительно небольшие различия кинетических зависимостей для смешанных растворов и раствора БСА (рис. 3) по сравнению с соответствующими различиями на рис. 1, по-видимому, связаны с более высокой чувствительностью поверхностного давления и модуля поверхностной упругости к поверхностной концентрации при приближении к равновесию.
Рис. 3.
Кинетические зависимости Δ–Δ0 растворов чистого БСА (точки) и смешанных растворов C60(OH)20 и БСА при отношениях молярных концентраций 10 : 1 (сплошная серая линия), 500 : 1 (сплошная светло-серая линия).

Представленные выше результаты указывают только на адсорбцию БСА из смешанного раствора, но не позволяют оценить адсорбцию фуллеренола. Присутствие фуллеренола в адсорбционной пленке проявляется только при ее сжатии. Скорость сжатия составляла 7.5 см2/мин при начальной площади поверхности раствора 517.5 см2 (рис. 4). На начальном этапе сжатия поверхностное давление немного увеличивается и остается близким к поверхностному давлению слоя чистого БСА. При дальнейшем сжатии более чем на 40% отклонения от результатов для слоя БСА становятся более заметными. Быстрый рост поверхностного давления начинается для смешанных слоев раньше, чем для пленки БСА, и скорость роста увеличивается при увеличении молярного отношения C60(OH)20/БСА. Это, по-видимому, связано с усилением взаимодействия между агрегатами фуллеренола в поверхностном слое из-за повышения их локальной концентрации. Возникновение локального максимума при сильном сжатии до поверхностного давления около 50 мН/м может свидетельствовать о начале разрушения пленки (коллапс) в результате образования трехмерных агрегатов в почти двумерной поверхностной пленке. Другое возможное объяснение может состоять в резком увеличении скорости процессов механической релаксации в пленке. Однако прямые измерения скорости этого процесса после остановки сжатия пленки не подтверждают эту гипотезу. Для пленки чистого БСА, несмотря на достижение поверхностного давления 50 мН/м, экстремума поверхностного давления не наблюдается. В этом случае по мере сжатия поверхностной пленки, по-видимому, происходит непрерывный процесс перехода молекул белка из монослоя в подслой с образованием би- и трислоев. Результаты АСМ показывают, что после сжатия смешанная пленка становится более однородной, по-видимому, из-за ее уплотнения и постепенного уменьшения промежутков между агрегатами (рис. 5).
Проникновение БСА в адсорбционную пленку фуллеренола
Для получения смешанной пленки с повышенной поверхностной концентрацией фуллеренола применялся второй подход, заключающийся в адсорбции БСА из раствора с пленкой фуллеренола на его поверхности. На первой стадии происходила адсорбция фуллеренола из его раствора. Затем раствор фуллеренола в кювете заменялся на фосфатный буфер и в него впрыскивался концентрированный раствор БСА. Последующая адсорбция белка вызывала быстрый рост поверхностного давления и модуля поверхностной упругости. При приближении к равновесию эти величины заметно превышали соответствующие значения для раствора чистого БСА (рис. 6). Увеличение поверхностной упругости связано, в первую очередь, с высокой поверхностной концентрацией фуллеренола, для адсорбционных слоев которого характерны высокие значения модуля поверхностной упругости [20]. Ускорение роста поверхностного давления и увеличение этой величины на 2–4 мН/м по сравнению со значениями для раствора чистого БСА может указывать на изменения конформации молекул БСА при адсорбции. В этом случае возможно увеличение концентрации гидрофобных групп в ближней области поверхностного слоя, и, следовательно, увеличение поверхностного давления.
Рис. 6.
Кинетические зависимости поверхностного давления (а) и модуля дилатационной поверхностной упругости (б) для смешанных пленок фуллеренола и БСА, полученных в результате проникновения БСА из раствора с концентрацией 7.8 × 10–7 М в пленку фуллеренола. Пленки фуллеренола формировались в результате адсорбции из его растворов с концентрациями 3.9 × 10–3 М (сплошные круги, треугольники и ромбы) и 2.3 × 10–3 М (пустые квадраты и круги). Сплошные квадраты соответствуют адсорбции из раствора БСА без пленки фуллеренола.

Многократные измерения поверхностного натяжения и поверхностной упругости при одинаковых концентрациях БСА и фуллеренола приводят к заметным расхождениям результатов, превышающим стандартную погрешность измерения этих величин (рис. 6). Это связано с заметными и плохо воспроизводимыми изменениями морфологии адсорбционной пленки фуллеренола в процессе смены субфазы. В этом случае относительно плотная пленка, в основном состоящая из поверхностных агрегатов фуллеренола с диметром менее 50 нм, частично растворяется. Данные АСМ показывают, что на поверхности возникают более крупные “острова”, несоединенные между собой (рис. 7). При этом модуль динамической поверхностной упругости уменьшается в 4–5 раз. Свойства образующейся затем адсорбционной пленки БСА в значительной степени определяются недостаточно воспроизводимой структурой исходной пленки фуллеренола, и также оказываются плохо воспроизводимыми. На неоднородность смешанной пленки БСА/фуллеренол также указывают флуктуации динамической поверхностной упругости в процессе адсорбции белка (рис. 6).
Проникновение фуллеренола в нанесенную пленку БСА
В ходе адсорбции фуллеренола на нанесенной пленке БСА при различных поверхностных концентрациях происходит увеличение поверхностного давления от 3.5 и 8.5 до примерно 9.5 мН/м, а модуль поверхностной упругости при этом меняется от 25 и 50 мН/м до 80 мН/м, т.е. становится примерно в 1.5 раз больше значений, характерных для пленки чистого БСА (рис. 8). Увеличение поверхностного давления по сравнению со значениями для раствора фуллеренола при тех же концентрациях указывает на взаимодействие между фуллеренолом и БСА. На образование комплексов БСА/фуллеренол указывает также сильный рост динамической поверхностной упругости, по-видимому, связанный с изменением конформации БСА при взаимодействии с фуллеренолом. По-видимому, на начальном этапе адсорбция фуллеренола приводит только к уплотнению пленки БСА. При этом поверхностные свойства, по-прежнему, определяются молекулами белка, и зависимость поверхностной упругости от поверхностного давления (рис. 9) не отличается от соответствующей зависимости для раствора белка. Затем происходит резкий рост поверхностной упругости при относительно небольших изменениях поверхностного давления. Это может указывать на повышение локальной концентрации фуллеренола, прежде всего, в дальней области поверхностного слоя. В ближней области поверхностного слоя преобладают молекулы БСА, определяющие значение поверхностного натяжения.
Рис. 8.
Кинетические зависимости поверхностного давления (а) и модуля дилатационной поверхностной упругости (б) при проникновении фуллеренола из раствора с концентрацией 2.3 × 10–3 М в нанесенную пленку БСА (2.077 × 10–7 моль/м2 – пустые треугольники; 3.530 × 10–8 моль/м2 – пустые квадраты). Сплошные квадраты соответствуют адсорбционной пленке БСА (7.8 × 10–7 М) в отсутствие фуллеренола.

Рис. 9.
Зависимости модуля дилатационной поверхностной упругости от поверхностного давления для смешанных пленок фуллеренола и БСА, полученных в результате проникновения фуллеренола из раствора с концентрацией 2.3 × 10–3 М в нанесенную пленку БСА (2.077 × 10–7 моль/м2 – пустые треугольники; 3.530 × 10–8 моль/м2 – пустые квадраты). Сплошные квадраты соответствуют адсорбционной пленке БСА (7.8 × 10–7 М) в отсутствие фуллеренола.

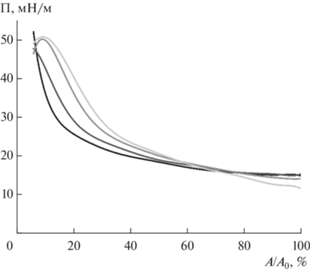
На изотермах сжатия смешанных пленок, полученных в результате проникновения фуллеренола из раствора в нанесенную пленку БСА возникает точка перегиба, соответствующая области уменьшения наклона изотермы, область “квазиплато” (рис. 10). Форма представленных кривых отличается от соответствующих результатов для поверхностных пленок, полученных в результате совместной адсорбции фуллеренола и БСА, где точка перегиба отсутствует и наблюдается локальный максимум поверхностного давления (рис. 4). Микроскопическая морфология пленок после сжатия также различна (рис. 5 и 11). На рис. 11 видны складки, соответствующие образованию многослойных структур в пленке и не видимые для пленок, полученных в результате совместной адсорбции. Эти складки образуются при относительно высокой концентрации фуллеренола в поверхностном слое. Образование складок могло быть обусловлено особенностями переноса пленки на твердую подложку. Однако, воспроизводимость основных особенностей морфологии пленки (образование складок) указывает на то, что они не связаны с влиянием процесса переноса на твердую подложку. Можно предположить, что область квазиплато на изотерме соответствует началу образования складок, т.е. формированию новой поверхностной фазы. При дальнейшем сжатии участки новой фазы начинают взаимодействовать друг с другом, приводя к увеличению наклона кривой.
Рис. 10.
Изотермы сжатия смешанных пленок фуллеренола и БСА, полученных в ходе проникновения фуллеренола из раствора с концентрацией 2.3 × 10–3 М в нанесенную пленку БСА (3.530 × 10–8 моль/м2 – черная штриховая линия; 2.077 × 10–7 моль/м2 – светло-серая штриховая линия). Черная линия соответствует сжатию адсорбционной пленки БСА (7.8 × × 10–7 М) в отсутствие фуллеренола.

ЗАКЛЮЧЕНИЕ
Свойства смешанной пленки фуллеренола и БСА на водной поверхности сильно зависят от способа ее формирования. Если смешанная пленка образуется в результате совместной адсорбции, то ее свойства определяются более поверхностно-активным белком. Фуллеренол значительно влияет только на скорость адсорбции БСА из-за уменьшения концентрации свободных молекул белка в объеме раствора в результате образования комплексов БСА/фуллеренол, характеризующихся низкой подвижностью. Присутствие фуллеренола в адсорбционной пленке проявляется также в изменении формы изотермы сжатия пленки. При высоких поверхностных давлениях (>45 мН/м) изотерма становится немонотонной, что указывает на коллапс пленки и уменьшение ее устойчивости в присутствии фуллеренола.
Образование комплексов БСА/фуллеренол в поверхностном слое происходит при проникновении фуллеренола в нанесенную пленку БСА или при проникновении БСА из раствора в пленку фуллеренола на водной поверхности. В последнем случае эта пленка формируется в результате адсорбции фуллеренола из его раствора и последующей замены этого раствора на буферный раствор. В обоих случаях, проникновение фуллеренола в пленку БСА и БСА в пленку фуллеренола, наблюдается сильный синергетический эффект: поверхностное давление и динамическая поверхностная упругость при приближении к равновесию заметно превышают исходные значения, а также значения для раствора фуллеренола в первом случае и раствора БСА во втором случае, что указывает на сильные взаимодействия между компонентами в поверхностном слое. При сжатии смешанной пленки, образованной при проникновении фуллерена в пленку белка, пленка становится сильно неоднородной в результате образования микроскопических складок, однако, изотермы сжатия остаются монотонными во всей исследованной области поверхностных давлений (8–50 мН/м).
Список литературы
Giełdoń A., Witt M. M., Gajewicz A., Puzyn T. Rapid insight into C60 influence on biological functions of proteins // Structural Chemistry. 2017. V. 28. № 6. P. 1775–1788.
Castro E., Garcia A.H., Zavala G., Echegoyen L. Fullerenes in biology and medicine // Journal of Materials Chemistry B. 2017. V. 5. № 32. P. 6523–6535.
Kazemzadeh H., Mozafari M. Fullerene-based delivery systems // Drug Discovery Today. 2019. V. 24. № 3. P. 898–905.
Semenov K.N., Charykov N.A., Postnov V.N. et al. Fullerenols: Physicochemical properties and applications // Progress in Solid State Chemistry. 2016. V. 44. № 2. P. 59–74.
Noskov B.A. Protein conformational transitions at the liquid–gas interface as studied by dilational surface rheology // Advances in Colloid and Interface Science. 2014. V. 206. P. 222–238.
Li S., Zhao X., Mo Y. et al. Human serum albumin interactions with C60 fullerene studied by spectroscopy, small-angle neutron scattering, and molecular dynamics simulations // Journal of Nanoparticle Research. 2013. V. 15. № 7. P. 1769.
Liu S., Sui Y., Guo K. et al. Spectroscopic study on the interaction of pristine C60 and serum albumins in solution // Nanoscale Research Letters. 2012. V. 7. № 1. P. 433.
Fu X., Fang Y., Zhao H., Liu S. Size-dependent binding of pristine fullerene (nC60) nanoparticles to bovine/human serum albumin // Journal of Molecular Structure. 2018. V. 1166. P. 442–447.
Liu S., Wang S., Liu Z. Investigating the size-dependent binding of pristine nC60 to bovine serum albumin by multi-spectroscopic techniques // Materials. 2021. V. 14. № 2. P. 298.
Zhang M.-F., Xu Z.-Q., Ge Y.-S. et al. Binding of fullerol to human serum albumin: spectroscopic and electrochemical approach // Journal of Photochemistry and Photobiology B: Biology. 2012. V. 108. P. 34–43.
Benyamini H., Shulman-Peleg A., Wolfson H.J. et al. Interaction of C 60 –fullerene and carboxyfullerene with proteins: docking and binding site alignment // Bioconjugate Chemistry. 2006. V. 17. № 2. P. 378–386.
Leonis G., Avramopoulos A., Papavasileiou K.D. et al. A comprehensive computational study of the interaction between human serum albumin and fullerenes // Journal of Physical Chemistry B. 2015. V. 119. № 48. P. 14971–14985.
Calvaresi M., Zerbetto F. Baiting proteins with C60 // ACS Nano. 2010. V. 4. № 4. P. 2283–2299.
Bai Y., Wu X., Ouyang P. et al. Surface modification mediates the interaction between fullerene and lysozyme: protein structure and antibacterial activity // Environmental Science: Nano. 2021. V. 8. № 1. P. 76–85.
Noskov B.A., Grigoriev D.O., Latnikova A.V. et al. Impact of globule unfolding on dilational viscoelasticity of β-lactoglobulin adsorption layers // The Journal of Physical Chemistry B. 2009. V. 113. № 40. P. 13398–13404.
Noskov B.A., Bykov A.G., Gochev G. et al. Adsorption layer formation in dispersions of protein aggregates // Advances in Colloid and Interface Science. 2020. V. 276. P. 102086.
Noskov B.A., Mikhailovskaya A.A., Lin S.-Y. et al. Bovine serum albumin unfolding at the air/water interface as studied by dilational surface rheology // Langmuir. 2010. V. 26. № 22. P. 17225–17231.
Campbell R.A., Yanez Arteta M., Angus-Smyth A. et al. Direct impact of nonequilibrium aggregates on the structure and morphology of pdadmac/SDS layers at the air/water interface // Langmuir. 2014. V. 30. № 29. P. 8664–8674.
Lebedev V.T., Kulvelis Y.V., Voronin A.S. et al. Mechanisms of supramolecular ordering of water-soluble derivatives of fullerenes in aqueous media // Fullerenes, Nanotubes and Carbon Nanostructures. 2020. V. 28. № 1. P. 30–39.
Akentiev A.V., Gorniaia S.B., Isakov N.A. et al. Surface properties of fullerenol C60(OH)20 solutions // Journal of Molecular Liquids. 2020. V. 306. P. 112904.
Дополнительные материалы отсутствуют.
Инструменты
Коллоидный журнал