Молекулярная биология, 2021, T. 55, № 2, стр. 289-304
Белок MutL из системы репарации мисматчей бактерии Neisseria gonorrhoeae: взаимодействие с ATP и ДНК
М. В. Монахова a, *, М. А. Милакина b, В. Ю. Савицкая b, Е. А. Романова a, Desirazu N. Rao c, Е. А. Кубарева a
a Научно-исследовательский институт физико-химической биологии им. А.Н. Белозерского Московского государственного университета им. М.В. Ломоносова
119991 Москва, Россия
b Химический факультет Московского государственного университета им. М.В. Ломоносова
119991 Москва, Россия
c Department of Biochemistry, Indian Institute of Science
560012 Bangalore, India
* E-mail: monakhovamv@gmail.com
Поступила в редакцию 04.08.2020
После доработки 04.08.2020
Принята к публикации 17.08.2020
Аннотация
Система репарации неканонических пар нуклеотидов, или мисматчей (MMR), обеспечивает неизменность генетической информации в процессе репликации ДНК почти во всех организмах. Репарация мисматчей инициируется после узнавания неканонической пары белком MutS и формирования комплекса MutS с белком MutL. Эукариотические и большинство бактериальных гомологов MutL могут действовать как эндонуклеазы и вносить одноцепочечный разрыв в дочернюю цепь ДНК, тем самым активируя процесс репарации. Однако многие аспекты механизма действия этого белка не изучены. Нами изучены АТРазная и ДНК-связывающая функции белка MutL из патогенной бактерии Neisseria gonorrhoeae (NgoMutL), обладающего эндонуклеазной активностью. Впервые определены кинетические параметры реакции гидролиза ATP полноразмерным белком NgoMutL. Изучено его взаимодействие с одно- и двуxцепочечными фрагментами ДНК различной длины. Показано, что NgoMutL способен эффективно образовывать комплексы с фрагментами ДНК длиной более 40 нуклеотидных звеньев. С помощью модифицированных ДНК-дуплексов, содержащих 2-пиридилдисульфидную группу на линкерах различной длины, впервые получены конъюгаты NgoMutL с ДНК. Этот результат свидетельствует о локализации остатков Cys белка дикого типа на расстоянии приблизительно 18–50 Å от дуплекса. Показано, что эффективность аффинной модификации остатков Cys NgoMutL реакционноспособными ДНК cнижается в присутствии АТР или его негидролизуемого аналога, а также ZnCl2 в реакционной смеси. Впервые высказано предположение, что консервативные остатки Cys С-концевого домена NgoMutL, отвечающие за координацию ионов металла в активном центре белка, участвуют во взаимодействии с ДНК. Полученная информация может быть полезна при реконструкции основных этапов функционирования системы MMR в прокариотах, отличных от γ-протеобактерий, и поиске новых мишеней для лекарственных препаратов против N. gonorrhoeae.
ВВЕДЕНИЕ
Двойная спираль ДНК постоянно подвергается воздействию различных мутагенных факторов, что приводит к изменению закодированной в ДНК генетической информации и нарушению нормальной жизнедеятельности организма [1]. Мутагенные факторы могут быть как экзогенными (УФ- или радиоактивное излучение), так и эндогенными (свободные радикалы, активные формы кислорода, вырабатываемые в клетках организма). Кроме того, вследствие сбоев в функционировании ДНК-полимеразы в процессе репликации ДНК возможно появление некомплементарных пар нуклеотидов, или мисматчей [2]. По существующим оценкам в случае бактериальных полимераз одна такая ошибка приходится на 0.1–10 млрд. н. Эукариотические ДНК-полимеразы не обладают 3'-5'-экзонуклеазной активностью, что обуславливает более частое возникновение мисматчей.
Для сохранения целостности и правильности генома, точной передачи генетической информации в клетках всех живых организмов существуют различные системы репарации повреждений ДНК. В случае серьезных повреждений ДНК, которые не могут быть восстановлены, инициируется запрограммированная клеточная смерть (апоптоз) [3].
За исправление повреждений ДНК, возникающих в результате ошибок ДНК-полимеразы в процессе репликации, отвечает система репарации некомплементарных пар нуклеотидов, или MMR (от англ. mismatch repair). Работа этой системы понижает вероятность возникновения мутаций в 102–103 раз [4]. Система MMR узнает не только некомплементарные пары, но также небольшие делеционные и инсерционные петли (“индели”) длиной до 4 н. [5]. Функционирование этой системы обусловлено скоординированным действием более 10 белков, в результате которого происходит удаление протяженного одноцепочечного фрагмента вновь синтезированной цепи ДНК, содержащей мисматч, с дальнейшим застраиванием образовавшейся “бреши” [6]. Ключевыми белками системы MMR являются MutS и MutL. Репарация мисматчей инициируется после узнавания неканонической пары белком MutS и формирования комплекса MutS-MutL, который предположительно направляет последовательность следующих этапов репарации. MutS – сенсорный белок, сканирующий и идентифицирующий мисматчи и повреждения в ДНК, хорошо охарактеризован [7]. Существенно меньше известно о роли MutL в процессе репарации, прежде всего из-за динамического характера структуры этого белка, принимающего множество различных конформаций, а также отсутствия у него определенного участка узнавания в ДНК [8–12].
Сигналом к репарации, при которой фрагмент цепи ДНК, содержащий мисматч, удаляется, служит гидролиз фосфодиэфирной связи в одной из цепей ДНК. В клетках γ-протеобактерий, в том числе Escherichia coli, этот разрыв вносит белок MutH, узнающий монометилированную последовательность 5'-Gm6ATC-3'/3'-CTAG^-5' (^ указывает место гидролиза). Каталитическая функция MutH стимулируется тройным комплексом, состоящим из белков MutS и MutL и ДНК с мисматчем. У эукариот и большинства бактерий метилирование не является маркером вновь синтезированной цепи. Введение разрыва в ДНК таких организмов приписывают гомологам MutL, у которых обнаружен эндонуклеазный мотив [6, 13].
Бактериальные системы репарации мисматчей, в которых белок MutL обладает эндонуклеазной функцией, изучены существенно хуже, чем системы репарации E. coli и даже человека [6]. Вместе с тем, MMR бактерий представляет значительный интерес в связи с большим функциональным и видовым разнообразием прокариот.
Neisseria gonorrhoeae – это грамотрицательный диплококк, факультативный внутриклеточный патоген человека. N. gonorrhoeae вызывает гонорею – венерическое заболевание, которое поражает в первую очередь органы репродуктивной системы человека. Чтобы адаптироваться к новой среде и избежать иммунного ответа организма-хозяина N. gonorrhoeae использует широкомасштабную вариацию фаз [14, 15]. Стандартные способы лечения гонореи быстро становятся неэффективными из-за постоянного появления новых штаммов. У N. gonorrhoeae отсутствует наиболее важная репарационная система – SOS-ответ [16]. Устойчивость N. gonorrhoeae к действию вакцин и лекарственных препаратов может быть связана не только с феноменом вариации фаз, но с эффективной работой основных систем репарации этой бактерии, в том числе системы MMR.
Функционирование системы MMR у N. gonorrhoeae и E. coli должно отличаться, поскольку у N. gonorrhoeae отсутствует никующая эндонуклеаза MutH [17]. Ранее было показано, что гомодимерный белок MutL N. gonorrhoeae (NgoMutL) обладает эндонуклеазной функцией, как и его эукариотические аналоги и белки MutL бактерий Aquifex aeolicus (AaeMutL), Bacillus subtilis (BsuMutL), Pseudomonas aeruginosa (PaeMutL), Rhodobacter sphaeroides (RspMutL), Thermus aquaticus (TaqMutL) и T. thermophilus (TthMutL) [17–22]. NgoMutL гидролизует плазмидную ДНК не только в присутствии ионов Mn2+, что характерно для белков MutLα человека и дрожжей, но также в присутствии ионов Mg2+, как PaeMutL и RspMutL, и ионов Са2+, что пока не обнаружено у MutL из других организмов [6]. В отличие от MutLα дрожжей и аналогично бактериальным белкам BsuMutL, PaeMutL, RspMutL и TthMutL ATP ингибирует гидролитическую активность NgoMutL [17–19, 21]. Таким образом, NgoMutL, по-видимому, имеет свой уникальный механизм функционирования. Недавно выявили участие этого механизма в работе системы репарации VSP (very short patch) [23].
Выделен и охарактеризован C-концевой домен NgoMutL (NgoMutL-CTD), показана его способность гидролизовать ДНК в присутствии ионов марганца [22]. Решена кристаллическая структура NgoMutL-CTD, показано, что активный центр этого фермента, ответственный за катализ гидролиза ДНК, сформирован четырьмя из шести консервативных мотивов C-концевого домена, включая центры связывания ионов двухвалентных металлов [24]. В металлсвязывающих центрах MutL содержатся остатки цистеина [25], роль которых во взаимодействии с ионами марганца и цинка пока не вполне понятна. Не выяснено, принимают ли они участие во взаимодействии с ДНК. Не удается также получить кристаллы ни полноразмерных белков MutL, ни их отдельных доменов с ДНК. Развиваемый нами метод аффинной модификации белков ДНК-дуплексами с реакционноспособными, селективными по отношению к цистеину, группировками на линкерах различной длины позволяет зондировать сближенность остатков Cys белка с ДНК в процессе их взаимодействия [26–32].
В результате проведенного исследования впервые получены кинетические параметры гидролиза ATP белком NgoMutL, установлено влияние ионов цинка на функционирование этого фермента. Кроме того, определена минимальная длина одно- и двухцепочечных фрагментов ДНК, с которыми может эффективно связываться изучаемый белок. Методом аффинной модификации с использованием дуплексов, содержащих 2-пиридилдисульфидную группу на линкерах длиной 18.6, 31.7 или 50.4 Å в пятом положении тимидина, установлено, что остатки цистеина эндонуклеазного домена NgoMutL могут взаимодействовать с ДНК. Показано, что выход ДНК-белкового конъюгата зависит от длины линкера, на котором локализована пиридилдисульфидная группа, концентрации ATP и присутствия ионов цинка в реакционной смеси.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Олигонуклеотиды, реагенты и буферные растворы. Немодифицированные и флуоресцентно меченные олигодезоксирибонуклеотиды синтезированы компанией “Евроген” (Россия). Олигодезоксирибонуклеотид с модифицированным остатком тимидина синтезирован компанией “Синтол” (Россия). Использованные в работе ДНК приведены на рис. 1.
Рис. 1.
Используемые в работе ДНК-дуплексы и олигодезоксирибонуклеотиды, содержащие флуоресцентную метку TAMRA, а также реакционноспособные дуплексы для аффинной модификации белка NgoMutL. T* – модифицированный остаток тимидина, содержащий 2-пиридилдитиогруппу на линкерах различной длины. Префикс “d” (дезокси) при обозначении олигодезоксирибонуклеотидов и ДНК-дуплексов опущен.

Использовали ATP, аденозин-5′-(γ-тио)трифосфат (ATPγS), ADP, бромид этидия фирмы “Sigma-Aldrich” (США); N,N,N',N'-тетраметилэтилендиамин (TEMED), акриламид, N,N'-метиленбисакриламид, глицерин – все “Serva” (Германия); N-2-гидроксиэтилпиперазин-N′-2-этансульфоновую кислоту (HEPES), додецилсульфат натрия (SDS), трис-(гидроксиметил)аминометан (Трис), этилендиаминтетраацетат натрия (EDTA), гидрофосфат натрия, β-меркаптоэтанол, изопропил-β-D-1-тиогалактопиранозид (IPTG), имидазол, трео-2,3-дигидрокси-1,4-димеркаптобутан (дитиотреит, DTT) – “Хеликон” (Россия); Ni-NTA (никель-нитрилотриуксусная кислота)-агарозу – “Novagen” (Германия); набор для окращивания гелей солями серебра PageSilverТМ – “Thermo Fisher Scientific” (США).
При проведении экспериментальных работ использовали следующие буферные растворы: А (10 мМ HEPES-KOH, pH 8.0, 300 мМ KCl, 1 мМ β-меркаптоэтанол, 10% (v/v) глицерина), Б (10 мМ HEPES-KOH, pH 8.0), В (10 мМ HEPES-KOH, pH 7.5, 5 мМ MgCl2), ТБЕ (89 мМ Трис, 89 мМ борная кислота, рН 8.3, 2 мМ EDTA), TГ (25 мМ Трис-HCl, 250 мМ глицин, pH 8.3, 0.1% (m/v) SDS), LAP (50 мМ Трис-HCl, pH 6.8, 2.5% (m/v) SDS, 10% (v/v) глицерина, 0.5% (v/v) β-меркаптоэтанола, 0.01% (m/v) БФС), LB (10 г/л триптон, 10 г/л NaCl, 5 г/л дрожжевой экстракт), STE (10 мМ Трис-HCl, pH 8.0, 100 мМ NaCl, 100 мкМ EDTA).
Выделение белка NgoMutL. Белок MutL синтезировали в клетках E. coli (штамм BL21(DE3)pLys). Клеточную культуру растили в 2 л среды LB, содержащей 100 мкг/мл ампициллина, и инкубировали при интенсивной аэрации и 37°C до A600 = 0.8 о.е. Затем добавляли водный раствор IPTG до концентрации 1 мМ и инкубировали клетки в течение 3 ч при 28°С. После этого отделяли клетки от среды центрифугированием в стаканах объемом 500 мл (30 мин, 4200 об./мин, 4°С), ресуспендировали клеточный осадок в 35 мл буфера STE, центрифугировали (в пробирке объемом 50 мл) в течение 15 мин при 4200 об./мин и 4°С, удаляли жидкость над осадком и замораживали биомассу при –18°С.
Белок NgoMutL выделяли методом аффинной хроматографии на носителе Ni-NTA-агароза согласно методике, описанной ранее [22]. Для дополнительной очистки от продуктов деградации использовали эксклюзионную хроматографию на колонке Enrich SEC 650 “Bio-Rad” (США). Колонку уравновешивали буфером А, который затем служил элюентом. Объем наносимого на колонку препарата – 500 мкл. Расход элюента – 1 мл/мин. За ходом разделения следили по поглощению при 280 нм. Концентрацию белка во фракциях определяли на приборе NanoDrop ND-1000 (“Thermo Fisher Scientific”). Наличие целевого белка во фракциях детектировали методом электрофореза в 8%-ном ПААГ, содержащем 0.1% SDS, как описано в [17].
Оценка АТРазной активности белка MutL. За основу были взяты методики [9, 22]. Смеси объемом 60 мкл в буфере Б, содержащие 50 нМ 76-звенного ДНК-дуплекса V (рис. 1), 5 мМ MgCl2, 50 мМ KCl, ATP в разных концентрациях (100, 150, 250, 300, 400, 500, 750, 1000 мкМ), инкубировали с белком MutL (0.7 мкМ) при 25°С в течение 150 мин. Каждые 15 мин из реакционной смеси отбирали пробы по 30 мкл и останавливали реакцию добавлением 50 мМ EDTA. Затем 20 мкл реакционной смеси добавляли к 80 мкл реагента для идентификации фосфат-иона (0.0815% малахитового зеленого, 2.32% поливинилового спирта, 5.75% молибдата аммония в 6 Н HCl в соотношении с водой 2 : 1 : 1 : 2), предварительно помещенного в ячейки 96-луночного планшета, и тщательно перемешивали. Затем добавляли 20 мкл 34%-ного раствора цитрата натрия, перемешивали до стабилизации окраски и выдерживали в течение примерно 15 мин. Поглощение полученных сине-зеленых растворов измеряли на планшетном ридере Victor X5 при длине волны 590 нм “Perkin Elmer” (США). Измеряли оптическую плотность растворов с известным количеством фосфат-иона и строили калибровочный график. С его помощью определяли количество фосфат-иона в исследуемых растворах. Кинетические параметры рассчитывали методом нелинейной регрессии с применением схемы Михаэлиса–Ментен.
Комплексообразование NgoMutL с ДНК различной длины. Для проверки ДНК-связывающей активности белка NgoMutL использовали ДНК-дуплексы I–V (рис. 1) различной длины (16, 20, 30, 41, 76 п.н.) и 16-, 20-, 30-, 41- и 76-звенные олигонуклеотиды 1–5 с флуоресцентной меткой TAMRA (5-карбокситетраметилродамином), входящие в состав ДНК-дуплексов. Связывание проводили по методике, описанной в [22]. Смеси объемом 20 мкл в буфере Б, содержащие 20 нМ ДНК-дуплекса, 1 мМ DTT, 100 мМ KCl, 0.5 мг/мл БСА, инкубировали с белками MutL различной концентрации (0.25–4 мкМ) в течение 10 мин в бане со льдом. Анализ проводили методом гель-электрофореза в 6%-ном ПААГ в ТБЕ-буфере при 4°С (метод “торможения в геле”). Фотографии гелей, полученные на приборе Typhoon FLA 9500 (“GE Healthcare”, США), обрабатывали с помощью программы TotalLab TL120 (“GE Healthcare”). Измеряли интенсивность зон, соответствующих свободной ДНК и комплексу белка MutL с ДНК. Степень комплексообразования рассчитывали как отношение интенсивности зоны, соответствующей ДНК-белковому комплексу, к суммарной интенсивности зон, умноженное на 100%. Значение кажущейся константы диссоциации ($K_{{\text{d}}}^{{{\text{app}}}}$) комплексов МutL с ДНК определяли как концентрацию белка, при которой 50% ДНК-лиганда находится в комплексе с ферментом. Расчет проводили как минимум из трех независимых экспериментов.
Аффинная модификация белка NgoMutL модифицированными ДНК. Реакцию ковалентного связывания NgoMutL с реакционноспособными ДНК проводили в соответствии с методикой, опубликованной ранее [26]. Смеси объемом 10 мкл в буфере В, содержащие 1 мкМ ДНК-дуплекса и 4 мкМ белка MutL, инкубировали в течение 15 мин в бане со льдом. Концентрация ATP, ADP, ATPγS или ZnCl2 в реакционной смеси при проведении ковалентного связывания составляла 1 мМ. Реакцию останавливали, добавляя в смесь буфер LAP без β‑меркаптоэтанола. Анализ реакционных смесей проводили в 8%-ном ПААГ, содержащем 0.1% SDS. После электрофореза гель сначала окрашивали водным раствором бромида этидия (0.5 мкг/мл) в течение 15 мин для визуализации ДНК и фотографировали в ультрафиолетовом свете. При этом наблюдалось и окрашивание зон, соответствующих белкам, что описано в [33]. Затем для визуализации белковых зон тот же гель окрашивали раствором солей серебра с помощью набора PageSilverТМ (“Thermo Fisher Scientific”) в соответствии с протоколом фирмы-производителя.
Гидролиз плазмидной ДНК белком NgoMutL. За основу взята методика [17]. Плазмиду pUC-MMR (концентрация 10 нМ) инкубировали с NgoMutL (500 нМ) в буфере Б, содержащем 100 мМ KCl, 5 мМ MgCl2 или MnCl2 (в зависимости от эксперимента), при 37°С в течение 1 ч. При проведении гидролиза в присутствии ZnCl2 его концентрация варьировали от 10 до 100 мкМ. Реакцию останавливали добавлением к инкубационной смеси 50 мМ EDTA. Для деградации белков в реакционную смесь добавляли протеиназу К (10 ед. акт.), инкубировали в течение 30 мин при 37°С. Реакционные смеси анализировали методом электрофореза в 1%-ном агарозном геле, содержащем бромид этидия.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Характеристика и выделение белка NgoMutL
Белок NgoMutL был впервые выделен и охарактеризован в 2009 г. В растворе этот белок находится в виде гомодимера [22]. Мономер NgoMutL состоит из 658 аминокислотных остатков (а.о.), имеет молекулярную массу 71.1 кДа, pI – 6.04. Конструкция на основе плазмиды pET15b, содержащая ген NgoMutL, получена с применением ПЦР с геномной ДНК штамма FA 1090 N. gonorrhoeae в качестве матрицы [22]. После секвенирования [22] в вариабельном линкерном участке обнаружены четыре делеции, что не должно сказываться на основных функциях белка. Так, удаление 40% остатков линкерного участка MutL из E. coli (EcoMutL) не повлияло существенно на свойства этого белка [34]. Ранее мы провели детальный сравнительный анализ первичных структур 1483 бактериальных белков MutL, обладающих эндонуклеазной функцией, и выявили 16 консервативных мотивов в их структуре [17, 25]. В составе NgoMutL найдено семь мотивов, ответственных за связывание и гидролиз ATP (мотивы I–III, V, VII, IX, X), а также пять мотивов (XI, XII, XIV–XVI), формирующих каталитический центр белка, обеспечивающий гидролиз ДНК (см. табл. 1 и рис. 1 в [17]). Как и все белки MutL, NgoMutL состоит из N- и C-концевых доменов и вариабельного линкера между ними. Структурные мотивы, отвечающие за связывание и гидролиз ATP, локализованы в N-концевом домене белков (NTD); мотивы, которые обеспечивают гидролиз ДНК – в C-концевом домене (CTD) [22]. Исходя из сравнения аминокислотных последовательностей гомологов MutL, взятых из базы данных UniProt, N- и С-концевые домены NgoMutL определены с точностью до 5 а.о. (1–324 и 468–658 а.о. соответственно); длина линкера – 144 а.о. Анализ шести выделенных и относительно изученных бактериальных MutL, обладающих эндонуклеазной функцией, показал, что по первичной структуре и биохимическим свойствам NgoMutL наиболее сходен с белками MutL из R. sphaeroides и P. aeruginosa [17].
Белок NgoMutL выделяли методом металл-хелатной хроматографии на сорбенте Ni-NTA-агароза за счет эффективного комплексообразования ионов Ni2+ с последовательностью из шести остатков His на N-конце белковой молекулы [22].
Дополнительную очистку NgoMutL проводили методом эксклюзионной хроматографии (см. пункт “Выделение белка NgoMutL” раздела “Экспериментальная часть”). Препарат NgoMutL получен в количестве 1 мг (концентрация 14.4 мкМ).
Анализ АТРазной активности белка NgoMutL
И бактериальные гомодимерные, и эукариотические гетеродимерные белки MutL принадлежат суперсемейству GHKL АТРаз (Gyrase, Hsp90, Histidine Kinase и MutL). Наличие в последовательности NgoMutL консервативных мотивов, ответственных за взаимодействие с ATP, позволяет также отнести его к этому семейству [25]. АТРазная активность MutL необходима для функционирования системы репарации ДНК. При взаимодействии с ATP белок MutL меняет свою конформацию и таким образом становится способным взаимодействовать с другими участниками системы репарации, что влияет на его эндонуклеазную активность [9, 10, 12, 35]. Количественно охарактеризована АТРазная активность N-концевых доменов гомологов белка MutL из четырех организмов: EcoMutL, AaeMutL, BsuMutL и PMS2 человека [6]. Данные для полноразмерного белка BsuMutL представлены только в работе [19] (табл. 1).
АТPазную активность белков удобно измерять колориметрическим методом по скорости образования фосфат-иона с использованием красителя малахитового зеленого, меняющего свой цвет при взаимодействии с фосфомолибдатным комплексом при низком значении pH [36]. Для количественной характеристики АТРазной активности NgoMutL использованы методики, предложенные ранее [9, 22]. Показано, что АТPазная активность NgoMutL увеличивается в присутствии дцДНК [22]. Исходя из этого, использованная нами реакционная смесь содержала 50 нМ 76-звенного дуплекса V (рис. 1). Количество образовавшегося фосфат-иона определяли, измеряя поглощение полученного раствора при длине волны 590 нм [37]. Зависимость начальной скорости (v0) гидролиза ATP белком NgoMutL от концентрации ATP представлена на рис. 2. Кинетические параметры реакции рассчитывали по уравнению Михаэлиса–Ментен (табл. 1).
Рис. 2.
Зависимость начальной скорости гидролиза ATP белком NgoMutL (0.7 мкМ) от концентрации субстрата. Реакцию проводили при 25°С в течение 150 мин в присутствии 50 нМ 76-звенного ДНК-дуплекса V. Представлены средние значения, вычисленные из данных трех экспериментов.

Полученные данные согласуются с данными для гомологов белка MutL из других организмов, значения KM у которых варьируют от 50 до 400 мкМ, а значения kcat – от 3 × 10–4 до 6 × 10–3 с–1. Из табл. 1 видно, что NgoMutL имеет практически такое же сродство к ATP, как и BsuMutL. У всех белков MutL, исследованных ранее, а также у NgoMutL значения kcat сравнимы. Только AaeMutL-NTD имеет константу скорости гидролиза ATP на порядок ниже. Таким образом, NgoMutL обладает относительно низкой АТРазной активностью, как и многие члены семейства GHKL, по сравнению с другими АТРазами (например, kcat ДНК-топоизомераз типа II составляет ~1 с–1 [40]).
Анализ ДНК-связывающей активности белка NgoMutL
Показано, что гомологи белка MutL способны связывать как оц-, так и дцДНК произвольной последовательности вне зависимости от присутствия мисматча [41–43]. Согласно современным представлениям ДНК-связывающий центр MutL находится в N-концевом домене белка [34]. ДНК-связывающая активность белков MutL может зависеть от множества факторов, таких как длина ДНК, наличие кофакторов (ADP, ATP, негидролизуемые аналоги ATP) и ионная сила раствора [6].
В ранних исследованиях указывалось, что EcoMutL не связывает 72-звенный ДНК-фрагмент, малоэффективно взаимодействует со 118-звенным ДНК-дуплексом и полностью связывает ДНК длиной 187 п.н. [42]. Однако затем методом измерения поляризации флуоресценции показали комплексообразование EcoMutL с 41-звенными ДНК [44]. Позднее было изучено связывание MutL из A. aeolicus, обладающего эндонуклеазной функцией, с короткими ДНК длиной от 15 до 60 п.н. [45]. Этот белок образовывал комплекс уже с 15‑звенным ДНК-дуплексом. По мере увеличения длины ДНК эффективность связывания повышалась и достигала максимального значения при длине дуплекса, равной 30 п.н. Дальнейшее увеличение длины дуплекса не влияло на связывание ДНК белком AaeMutL. Таким образом, “место посадки” белка AaeMutL на ДНК составляет около 30 п.н. [45]. Однако MutL из A. aeolicus имеет очень короткий для белков MutL линкер между N- и С-доменами (5 а.о.). MutL из T. thermophilus, длина линкера у которого составляет 29 а.о., эффективно взаимодействует с 80-звенным ДНК-дуплексом (Kd = 420 нМ) [21]. Отметим, что оба эти белка MutL относятся к подсемействам III и II соответственно. Эффективность гидролиза ими ДНК не зависит от присутствия β‑субъединицы ДНК-полимеразы III (β-зажима). Белок NgoMutL, напротив, относится к подсемейству I белков MutL, т.е. содержит характерный мотив QHLLIP, взаимодействующий с β-зажимом, и имеет достаточно длинный линкерный участок (144 а.о.) [46]. Возможно, его способность связывать короткие ДНК отличается от способности белков AaeMutL и TthMutL.
Ранее методом “торможения в геле” показали, что в присутствии 300 мМ KCl NgoMutL эффективно связывает дцДНК длиной 440 п.н. и 45-звенную оцДНК [22]. Однако известно, что уменьшение ионной силы буферного раствора повышает степень связывания белков MutL c ДНК [47]. Таким образом, для изучения методом “торможения в геле” ДНК-связывающей способности NgoMutL решено снизить концентрацию KCl в буферном растворе до 100 мМ. Эту же ионную силу раствора использовали при изучении связывания белков TthMutL и AaeMutL с ДНК [21, 45]. При выборе длины фрагментов ДНК для проведения исследования мы опирались также на данные, полученные методом поверхностного плазмонного резонанса, согласно которым NgoMutL достаточно эффективно взаимодействовал с 35-звенной оцДНК, иммобилизованной на носителе [22].
Таким образом, для проверки способности NgoMutL связывать ДНК использовали дцДНК (дуплексы I–V) длиной 16, 20, 30, 41, 76 п.н., содержащие флуоресцентную метку ТАМRA (рис. 1). В условиях комплексообразования (см. Экспериментальную часть, раздел “Комплексообразование NgoMutL с ДНК различной длины”) белок NgoMutL взаимодействует с ДНК-дуплексами длиной не менее 30 п.н. (рис. 3), т.е. в отличие от AaeMutL, дуплексы длиной 16 и 20 п.н. с NgoMutL не связываются.
Рис. 3.
Анализ комплексообразования белка NgoMutL (2 мкМ) с ДНК-дуплексами различной длины (20 нМ), содержащими флуоресцентную метку TAMRA. Комплексы формировали при 0°С в течение 10 мин. Электрофорез в 6%-ном ПААГ в буфере ТБЕ в неденатурирующих условиях.
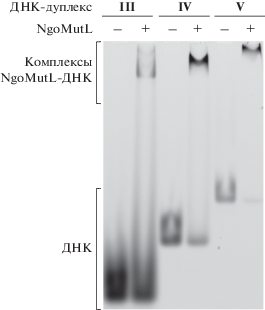
По мере увеличения длины ДНК эффективность ее связывания с NgoMutL возрастает, что согласуется с данными для АаеMutL [45]. В случае 30-звенного ДНК-дуплекса III не удалось рассчитать константу диссоциации комплекса NgoMutL–ДНК, так как в выбранных нами условиях степень связывания не достигла 50% (рис. 4). Комплексообразование NgoMutL с 41- и 76-звенными дцДНК охарактеризовано кажущимися константами диссоциации (табл. 2): при увеличении длины дуплекса от 41 до 76 п.н. величина $K_{{\text{d}}}^{{{\text{app}}}}$ уменьшилась почти вдвое. Следовательно, “место посадки” полноразмерного белка NgoMutL на ДНК превышает 41 п.н. Таким образом, это первый пример бактериального MutL с эндонуклеазной функцией из подсемейства I, который, несмотря на достаточно протяженный линкер между N- и C-доменами, способен эффективно связывать относительно короткие ДНК.
Рис. 4.
Зависимость степени комплексообразования NgoMutL с ДНК разной длины (20 нМ) от концентрации белка. Последовательности дцДНК (а) и оцДНК (б) приведены на рис. 1.

Таблица 2.
Кажущиеся константы диссоциации комплексов NgoMutL с ДНК различной длины
| Длина ДНК, п.н. | $K_{{\text{d}}}^{{{\text{app}}}},$ мкМ | |
|---|---|---|
| оцДНК | дцДНК | |
| 16 | – | – |
| 20 | – | – |
| 30 | – | + |
| 41 | 1.99 ± 0.02 | 1.39 ± 0.05 |
| 76 | 1.11 ± 0.01 | 0.86 ± 0.03 |
Кроме того, в качестве лигандов NgoMutL использовали оцДНК 1–5 такой же длины. оцДНК связываются с белком менее эффективно по сравнению с ДНК-дуплексами (табл. 2). $K_{{\text{d}}}^{{{\text{app}}}}$ их комплексов с NgoMutL примерно в 1.3–1.5 раза выше, чем $K_{{\text{d}}}^{{{\text{app}}}}$ дцДНК аналогичной длины. NgoMutL взаимодействует с оцДНК длиной более 40 нуклеотидных остатков, и чем протяженнее ДНК, тем выше эффективность связывания. Отметим, что EcoMutL, напротив, связывает оцДНК более эффективно, чем ДНК-дуплекс той же длины [10]. С другой стороны, TthMutL и эукариотический гомолог MutL – белок PMS2, эффективнее взаимодействуют с дцДНК [38].
Аффинная модификация белка NgoMutL ДНК, содержащими 2-пиридилдитиогруппу
Кристаллическая структура белка MutL в комплексе с ДНК на данный момент не определена. Невыясненным остается также вопрос о локализации ДНК в комплексе с MutL на разных стадиях процесса MMR. Удобным инструментом зондирования контактов белков с ДНК является метод ковалентного связывания этих биомолекул [48–51]. Как упоминалось, сравнение аминокислотных последовательностей белков MutL, способных гидролизовать ДНК, выявило в них пять консервативных мотивов, образующих каталитический центр [17, 25]. В состав двух из этих мотивов (XIV и XV [17, 25]) входят остатки цистеина. NgoMutL содержит остатки Cys в положениях 171, 251, 528, 604, 635. Три последних остатка Cys расположены в С-концевом домене NgoMutL и два из них (Cys604 и Cys635) входят в состав консервативных мотивов, составляющих каталитический центр белка (мотивы [A/S]CK и C[P/N]HGRP). Как показано ранее, эти остатки Cys необходимы для функционирования системы MMR. Так, замена даже одного из двух консервативных Сys на Ser или Ala в MutLα, NgoMutL-CTD или TthMutL приводит к “выключению” MMR in vivo [21, 52]. Мы поставили задачу методом ковалентного связывания определить, сближены ли остатки Cys эндонуклеазного домена белка NgoMutL c ДНК.
Для модификации белка NgoMutL с целью его ковалентного связывания с ДНК в качестве реакционноспособной группы выбрана 2-пиридилдитиогруппа, которую вводили путем ацилирования бифункциональными реагентами модифицированного олигонуклеотида, содержащего алифатическую аминогруппу в 5-м положении остатка тимидина [27]. Пиридилдитиогруппа удобна по нескольким причинам: с высокой скоростью вступает в реакцию тиолдисульфидного обмена при физиологических значениях pH; селективно модифицирует сближенные остатки Cys с высоким выходом. Аффинную модификацию остатков Cys различных ДНК-связывающих белков фрагментами ДНК, содержащими пиридилдитиогруппу, мы успешно применяли для изучения механизмов ДНК-белкового взаимодействия [26–32]. В данной работе использованы производные 59-звенного дуплекса VI: SPDP-ДНК, PEG4-SPDP-ДНК, PEG12-SPDP-ДНК (рис. 1), содержащие 2‑пиридилдитиогруппу на трех линкерах различной длины (расстояние от гетероциклического основания до атома серы, соединенного с атомом C линкера, составляет 18.6, 31.7 или 50.4 Å), что позволяет примерно оценить расстояние от Cys в белке до ДНК [26]. Ранее мы успешно использовали эти же ДНК для модификации белков MutS и МutL из системы MMR E. coli [26, 27]. Установлено, что введение в 5-е положение тимидина дуплекса VI 2-пиридилдитиогруппы на указанных на рис. 1 линкерах не влияет на комплексообразование EcoMutL с 59-звенной ДНК [26].
Ковалентное связывание NgoMutL с модифицированными ДНК, содержащими 2-пиридилдитиогруппу, проводили в буфере B, содержащем кофактор реакции гидролиза ДНК – ионы магния, в течение 15 мин при 0°С согласно методике, предложенной в работе [26]. Гидролиз 59-звенных ДНК-дуплексов в этих условиях не наблюдали (данные не приведены). Продукты реакции анализировали в 8%-ном ПААГ, содержащем SDS (рис. 5). Гели окрашивали раствором бромида этидия, а затем (для визуализации белков) раствором солей серебра. Бромид этидия интеркалирует преимущественно в ДНК, хотя в небольшой степени он связывается и с белками [33]. Для проведения реакции важно отсутствие восстановителей в инкубационной смеси: такие реагенты, как 2-меркаптоэтанол, DTT и др., разрушают связь, образующуюся между белком и ДНК, в конъюгате. Поэтому, кроме мономера NgoMutL, в геле наблюдаются также зоны, соответствующие димеру белка (рис. 5). Реакция между 2-пиридилдисульфидсодержащей ДНК и белком протекает по схеме, представленной на рис. 6. Важно отметить, что ДНК содержит только одну реакционноспособную группу в каждой молекуле, поэтому в димере NgoMutL с ДНК может реагировать только один остаток Cys.
Рис. 5.
Анализ продуктов ковалентного связывания EcoMutL(A251C) (4 мкМ) с PEG12-ДНК (1 мкМ, дорожка 3) и NgoMutL (4 мкМ) c SPDP-ДНК, PEG4-ДНК, PEG12-ДНК (1 мкМ, дорожки 5–10, дуплексы указаны под дорожками геля). Дорожки 5–7 – реакцию NgoMutL c SPDP-ДНК, PEG4-ДНК или PEG12-ДНК, соответственно, проводили в отсутствие нуклеотидных кофакторов, дорожки 8–10 – в присутствии 1 мМ АТР. Условия реакции: 15 мин, 0°C. Приведены фотографии электрофоретического разделения реакционных смесей в 8%-ном SDS-ПААГ. Один и тот же гель окрашивали бромидом этидия (панель б) и затем раствором солей серебра (панель а). Дорожки 2 и 4 – исходные белки EcoMutL(A251C) и NgoMutL соответственно. Дорожка 1 – маркер молекулярной массы белков, кДа.

Рис. 6.
Схема взаимодействия 2-пиридилдитиогруппы в ДНК с SH-группой остатка Cys гомодимера NgoMutL.

В качестве положительного контроля использовали мутантную форму белка MutL из E. coli (EcoMutL(A251C)), содержащую единственный остаток Cys вблизи предполагаемого ДНК-связывающего центра. Остаток Cys251 в EcoMutL(A251C) доступен для модификации ДНК с пиридилдитиогруппой [26]. Полученные результаты представлены на рис. 5. В случае EcoMutL(A251C) в присутствии PEG12-ДНК в геле появлялась дополнительная зона с более высокой молекулярной массой, интенсивно окрашиваемая растворами бромида этидия и солей серебра, что позволяло считать ее продуктом ковалентного связывания EcoMutL(A251C) с ДНК. Образование конъюгата EcoMutL(A251C)-ДНК свидетельствовало о реакционной способности полученных нами препаратов. Зафиксировано также появление конъюгатов белка NgoMutL с SPDP-ДНК, PEG4-SPDP-ДНК, PEG12-SPDP-ДНК с молекулярной массой около 130 кДа. Обнаружено, что выход ДНК-белкового конъюгата повышается с увеличением длины линкера между реакционной группой и ДНК. Наибольший выход продукта реакции достигнут при использовании ДНК с линкером PEG12. Таким образом, показано, что остатки Cys белка NgoMutL могут находиться на расстоянии примерно 18–50 Å от ДНК.
Влияние АТP на ковалентное связывание NgoМutL с ДНК
На следующем этапе работы оценили влияние ATP на образование конъюгатов NgoMutL-ДНК. Известно, что связывание ATP с белком MutL приводит к конформационным перестройкам белка и, соответственно, к изменениям его свойств [8, 10]. Так, присутствие ATP в реакционной смеси ингибирует эндонуклеазную активность NgoMutL [22]. В отсутствие ATP MutL находится в “открытой” конформации. В присутствии 1 мМ ATP N-концевые домены белка образуют димер. Такая конформация называется “закрытой” [10]. Мы сравнили результаты ковалентного связывания NgoMutL с 2-пиридилдисульфидсодержащими ДНК в отсутствие и в присутствии 1 мМ ATP. С этой целью белок инкубировали при 0°С с ATP или без него в течение 10 мин, а затем добавляли модифицированные ДНК: SPDP-ДНК, PEG4-SPDP-ДНК, PEG12-SPDP-ДНК. Как видно из рис. 5, ATP влияет на взаимодействие белка с ДНК: выход конъюгатов NgoMutL с PEG4-SPDP-ДНК и с PEG12-SPDP-ДНК незначительно снижается, а в случае SPDP-ДНК конъюгат не образуется. В контрольном эксперименте присутствие в реакционной смеси ADP, не вызывающего конформационных перестроек MutL [10], не влияло значимо на образование белково-нуклеинового конъюгата (рис. 7). Ранее мы показали, что эффективность ковалентного связывания остатков Cys, введенных в локализованный в N-концевом домене ДНК-связывающий центр MutL Е. coli, лишенного эндонуклеазной активности, не зависела от концентрации ATP в реакционной смеси [26]. Исходя из этого, можно предположить, что понижение выходов продуктов реакции между NgoMutL и пиридилдисульфидсодержащими ДНК в присутствии ATP связано с изменением локализации относительно ДНК остатков Cys именно эндонуклеазного домена (увеличение расстояния между ними) в процессе конформационной перестройки белка. Действительно, присутствие АТР (в отличие от АDP) в реакционной смеси снижало эффективность модификации остатков Cys C-концевого эндонуклеазного домена TthMutL гуанидингидрохлоридом. Согласно [21], это свидетельствует о существенных конформационных изменениях белка, вызванных взаимодействием с АТР. Интересно, что в присутствии негидролизуемого аналога АТР – АТPγS, образование конъюгата NgoMutL-PEG12-SPDP-ДНК не наблюдалось. Вероятно, гидролиз АТР необходим для взаимодействия остатков Cys эндонуклеазного домена с ДНК. С другой стороны, АТР и особенно его негидролизуемый аналог аденозин-5′-(β,γ-имидо)трифосфат (AMPPNP) снижают эффективность связывания TthMutL с дцДНК, что также может быть причиной уменьшения выхода ДНК-белковых конъюгатов [21].
Рис. 7.
Анализ продуктов ковалентного связывания NgoMutL (4 мкМ) c PEG12-ДНК (1 мкМ) методом электрофореза в 8%-ном SDS-ПААГ (дорожка 3). Гель окрашен солями серебра. Дорожка 1 – маркер молекулярной массы белков, кДа; дорожка 2 − исходный белок. Дорожки 4–6 соответствуют реакционным смесям, содержащим, кроме NgoMutL и PEG12-ДНК, один из нуклеотидных кофакторов (1 мМ): ADP, ATP, ATPγS соответственно. Дорожка 9 – анализ продуктов ковалентного связывания NgoMutL c PEG12-ДНК в присутствии 1 мМ ZnCl2; дорожка 7 – в присутствии 1 мМ ZnCl2 и 1 мМ ATP; дорожка 8 – в присутствии 1 мМ ZnCl2 и 1 мМ ATPγS. Условия реакции: 15 мин, 0°C.

Влияние ионов цинка на эндонуклеазную функцию NgoMutL и ковалентное связывание с ДНК
Кристаллические структуры C-концевых доменов, содержащих эндонуклеазный мотив, решены для MutL из нескольких видов бактерий: A. aeolicus (PDB-код 5B42), B. subtilis (PDB-код 3KDK), N. gonorrhoeae (PDB-код 3NCV) [19, 24, 46]. В расшифрованных структурах AaeMutL-CTD и BsuMutL-CTD обнаружены ионы цинка, которые предположительно играют важную роль в организации структуры каталитических центров этих белков [19, 46]. Показано, что BsuMutL-CTD координирует ионы Zn2+ в специальном Zn2+-связывающем участке, что приводит к сближению аминокислотных остатков мотивов XII, XIV и XV, которые формируют активный центр белка (рис. 8) [19]. Полагают, что в каталитический центр NgoMutL входят мотивы XI, XII, XIV и XV, которые катализируют гидролиз ДНК путем связывания их аминокислотных остатков с ДНК-субстратом и ионами металлов [24]. Из рис. 8 видно, что локализация ключевых аминокислотных остатков этих мотивов, в том числе Сys, в BsuMutL-CTD и NgoMutL-СTD очень похожи. Несмотря на то, что кристалл NgoMutL-СTD не содержит ионов Zn2+, можно полагать, что аминокислотные остатки NgoMutL координируют эти ионы сходным с BsuMutL образом.
Рис. 8.
Структурная организация эндонуклеазного центра белков BsuMutL-CTD (PDB-код 3KDK; панель а) и NgoMutL-CTD (PDB-код 3NCV; панель б). Приведены номера аминокислотных остатков, участвующих во взаимодействии BsuMutL-CTD (или, предположительно, NgoMutL-CTD) с ионами двухвалентных металлов. Предложено согласно [19, 24].

Сами ионы Zn2+ не обеспечивают эндонуклеазную активность NgoMutL-СTD и BsuMutL [19, 24]. Однако в случае BsuMutL присутствие обоих ионов Mn2+ и Zn2+ приводит к увеличению линейной формы плазмидной ДНК, т.е. к внесению белком двухцепочечного разрыва [19] (табл. 3). По-видимому, это обусловлено влиянием Zn2+ на структуру эндонуклеазного домена, что приводит к сближению двух каталитических центров гомодимерной молекулы белка с ДНК. С другой стороны, при добавлении Zn2+ в реакционную смесь, содержащую ионы Mn2+, наблюдалось ингибирование эндонуклеазной функции RspMutL [17]. Подобные данные получены и для MutL из P. aeruginosa [18]. Интересно, что присутствие ионов Zn2+ в реакционной смеси стимулировало эндонуклеазную активность белка MutL A. aeolicus [20] (табл. 3). Влияние ионов Zn2+ на гидролиз ДНК полноразмерным белком NgoMutL, в том числе в присутствии ионов Mn2+, ранее не изучали.
Таблица 3.
Влияние ионов Zn2+ на эндонуклеазную активность белков MutL
| Организм | Zn2+, 5 мМ | Zn2+ и Mn2+, 5 мМ | Ссылка |
|---|---|---|---|
| N. gonorrhoeae* | Гидролиз отсутствует | Ингибирование (10–100 мкМ Zn2+) | * |
| R. sphaeroides | То же | Ингибирование (10–100 мкМ Zn2+) | [17] |
| P. aeruginosa | » | Не определяли | [18] |
| B. subtilis | » | Увеличение линейного продукта гидролиза плазмиды (1 мМ Zn2+) | [19] |
| T. thermophilus | » | Не определяли | [21] |
| A. aeolicus | » | Увеличение “никованной” формы плазмиды (0.5 мМ Zn2+) | [20, 53] |
NgoMutL, как и большинство изученных ранее бактериальных белков MutL, не гидролизовал плазмиду pUC-MMR в присутствии ионов Zn2+ (5 мМ). Мы проверили влияние Zn2+ на эндонуклеазную функцию NgoMutL в присутствии 5 мМ MnCl2. С увеличением концентрации Zn2+ (10–100 мкМ) эффективность образования ДНК с разрывом только в одной из цепей белком NgoMutL значительно уменьшается (рис. 9). В присутствии 100 мкМ ZnCl2 в реакционной смеси наблюдается практически полное ингибирование эндонуклеазной активности NgoMutL. Аналогичное действие ионы Zn2+ оказывают на гидролиз белком NgoMutL двух цепей плазмиды pUC-MMR: в присутствии Mn2+ наблюдается небольшое (до 10%) увеличение линейной формы ДНК. Однако при повышении концентрации Zn2+ линейный продукт полностью исчезает (данные не приведены). Очевидно, что сродство ионов цинка к NgoMutL гораздо выше, чем ионов марганца, и ионы Zn2+ эффективно вытесняют ионы Mn2+ из металлсвязывающих участков белка.
Рис. 9.
Гидролиз плазмиды pUC-MMR (10 нМ) белком NgoMutL (500 нМ) при 37°С в течение 60 мин. а – Фотография (в инвертированном варианте) 1%-ного агарозного геля, окрашенного бромидом этидия, после электрофореза. Дорожки: 1 – маркер длины ДНК (т.п.н.); 2 – исходная плазмида pUC-MMR; 3 – pUC-MMR и NgoMutL в отсутствие ионов двухвалентных металлов; 4 – гидролиз pUC-MMR белком NgoMutL в присутствии MnCl2 (5 мМ); 5 – гидролиз pUC-MMR белком NgoMutL в присутствии MnCl2 (5 мМ) и ZnCl2 (1 мМ); 6 – гидролиз pUC-MMR эндонуклеазой рестрикции BamHI; 7 – гидролиз pUC-MMR никующей эндонуклеазой Bpu10I. Справа указаны формы кольцевой ДНК: суперскрученная (сс), с разрывом в одной цепи (оц), линейная ДНК (лин). б – Зависимость количества образующейся оц-формы при гидролизе плазмиды pUC-MMR (10 нМ) белком NgoMutL в присутствии 5 мМ MnCl2 от концентрации ZnCl2.

Полагают, что замена консервативного Cys635 из мотива XV на Ser в NgoMutL и связанная с этим инактивация системы MMR в клетках бактерии N. gonorrhoeae обусловлена потерей способности NgoMutL координировать ионы Zn2+, что подтверждается также в случае эукариотических аналогов MutL [52]. Очевидно, что если остатки Cys С-концевого домена NgoMutL взаимодействуют с ионами Zn2+, то они должны быть недоступны или менее доступны для модификации ДНК-реагентами в присутствии хлорида цинка. Поэтому интересно было провести реакцию с ДНК в присутствии 1 мМ Zn2+. Перед проведением реакции белок инкубировали с ZnCl2 (5 мин, 4°С), чтобы добиться максимального связывания ионов металла с белком. Показано, что в присутствии 1 мМ ZnCl2 конъюгат NgoMutL с PEG12-SPDP-ДНК образуется с меньшей эффективностью по сравнению с выходом продукта реакции в отсутствие ионов Zn2+. При одновременном добавлении в реакционную смесь АТР и ZnCl2 в концентрации 1 мМ ковалентное связывание между реакционноспособной ДНК и белком практически отсутствует (рис. 7). Эти результаты свидетельствуют в пользу того, что в модификации NgoMutL 2-пиридилдисульфидсодержащими ДНК участвуют остатки Cys, находящиеся в металлсвязывающих мотивах белка.
Таким образом, нами впервые получены кинетические параметры (KM,kcat) гидролиза АТP полноразмерным белком MutL N. gonorrhoeae, величина которых сопоставима со значениями, определенными в реакции гидролиза АТР белком BsuMutL. Установлено, что для эффективного связывания с NgoMutL длина как дц-, так и оцДНК должна превышать 41 нуклеотидное звено. Использование 59-звенных дуплексов с 2‑пиридилдитиогруппой позволило зафиксировать взаимодействие ДНК с остатками Cys, предположительно локализоваными в каталитическом центре белка. Ионы цинка, связываясь в этом участке белка, не только ингибируют эндонуклеазную функцию NgoMutL, но и уменьшают выход продукта реакции. Максимальный выход ДНК-белкового конъюгата получен при локализации реакционноспособной группировки на линкере длиной 50.4 Å, т.е. остатки Cys эндонуклеазного домена в составе ДНК-белкового комплекса находятся на значительном расстоянии от ДНК. В присутствии АТP и особенно его негидролизуемого аналога АТPγS эффективность ковалентного связывания NgoMutL с ДНК снижается. Для понимания механизма действия NgoMutL как компонента системы MMR необходимы дальнейшие исследования.
Авторы благодарят P. Friedhoff (Институт биохимии, университет им. Юстуса Либиха, Германия) за любезно предоставленные плазмидные конструкции с генами мутантных форм белка MutL из E. coli. D.N. Rao благодарит Научно-технический совет Департамента науки и технологии правительства Индии (грант J.C. BOSE).
Работа выполнена при финансовой поддержке совместной программы Российского фонда фундаментальных исследований и Департамента науки и технологии правительства Индии (гранты № 17-54-45126 и P-259). Белки выделяли с использованием хроматографической системы ÄKTA Purifier (Программа развития МГУ PNR 5.13).
Настоящая статья не содержит каких-либо исследований с участием людей или животных в качестве объектов исследований.
Авторы заявляют об отсутствии конфликта интересов.
Список литературы
Errol C.F., Graham C.W., Wolfram S., Richard D.W., Roger A.S., Tom E. (2006) DNA Repair and Mutagenesis. Second Ed., Washington (DC): Am. Soc. Microbiol.
Hsieh P., Yamane K. (2008) DNA mismatch repair: molecular mechanism, cancer, and ageing. Mech. Ageing Dev. 129, 391–407.
Hoeijmakers J.H.J. (2001) Genome maintenance mechanisms for preventing cancer. Nature. 411, 366–374.
Modrich P. (1991) Mechanisms and biological effects of mismatch repair. Annu. Rev. Genet. 25, 229–253.
Iyer R.R., Pluciennik A., Burdett V., Modrich P.L. (2006) DNA mismatch repair: functions and mechanisms. Chem. Rev. 106, 302–323.
Монахова М.В., Милакина М.А., Трикин Р.М., Орецкая Т.С., Кубарева Е.А. (2020) Особенности функционирования белка MutL из системы репарации “мисматчей” различных организмов. Биоорг. химия. 6, 563–579.
Hingorani M.M. (2016) Mismatch binding, ADP–ATP exchange and intramolecular signaling during mismatch repair. DNA Repair (Amst.). 38, 24–31.
Yang W. (2000) Structure and function of mismatch repair proteins. Mutat. Res. Repair. 460, 245–256.
Ban C., Yang W. (1998) Crystal structure and ATPase activity of MutL: implications for DNA repair and mutagenesis. Cell. 95, 541–552.
Ban C., Junop M., Yang W. (1999) Transformation of MutL by ATP binding and hydrolysis. Cell. 97, 85–97.
Sacho E.J., Kadyrov F.A., Modrich P., Kunkel T.A., Erie D.A. (2008) Direct visualization of asymmetric adenine nucleotide-induced conformational changes in MutLα. Mol. Cell. 29, 112–121.
Liu J., Hanne J., Britton B.M., Bennett J., Kim D., Lee J.-B., Fishel R. (2016) Cascading MutS and MutL sliding clamps control DNA diffusion to activate mismatch repair. Nature. 539, 583–587.
Nishant K.T., Plys A.J., Alani E. (2008) A mutation in the putative MLH3 endonuclease domain confers a defect in both mismatch repair and meiosis in Saccharomyces cerevisiae. Genetics. 179, 747–755.
Snyder L.A.S., Butcher S.A., Saunders N.J. (2001) Comparative whole-genome analyses reveal over 100 putative phase-variable genes in the pathogenic Neisseria spp. Microbiology. 147, 2321–2332.
Jordan P.W., Snyder L.A.S., Saunders N.J. (2005) Strain-specific differences in Neisseria gonorrhoeae associated with the phase variable gene repertoire. BMC Microbiol. 5, 21.
Black C.G., Fyfe J.A.M., Davies J.K. (1998) Absence of an SOS-like system in Neisseria gonorrhoeae. Gene. 208, 61–66.
Монахова М.В., Пенкина А.И., Павлова А.В., Лящук А.М., Кучеренко В.В., Алексеевский А.В., Лунин В.Г., Фридхофф П., Клуг Г., Орецкая Т.С., Кубарева Е.А. (2018) Характеристика эндонуклеазной функции белка MutL из системы репарации “мисматчей” Rhodobacter sphaeroides. Биохимия. 83, 281–293.
Correa E.M.E., Martina M.A., De Tullio L., Argaraña C.E., Barra J.L. (2011) Some amino acids of the Pseudomonas aeruginosa MutL D(Q/M)HA(X)2E(X)4E conserved motif are essential for the in vivo function of the protein but not for the in vitro endonuclease activity. DNA Repair (Amst.). 10, 1106–1113.
Pillon M.C., Lorenowicz J.J., Uckelmann M., Klocko A.D., Mitchell R.R., Chung Y.S., Modrich P., Walker G.C., Simmons L.A., Friedhoff P., Guarné A. (2010) Structure of the endonuclease domain of MutL: unlicensed to cut. Mol. Cell. 39, 145–151.
Iino H., Kim K., Shimada A., Masui R., Kuramitsu S., Fukui K. (2011) Characterization of C- and N-terminal domains of Aquifex aeolicus MutL endonuclease: N‑terminal domain stimulates the endonuclease activity of C-terminal domain in a zinc-dependent manner. Biosci. Rep. 31, 309–322.
Fukui K., Nishida M., Nakagawa N., Masui R., Kuramitsu S. (2008) Bound nucleotide controls the endonuclease activity of mismatch repair enzyme MutL. J. Biol. Chem. 283, 12136–12145.
Duppatla V., Bodda C., Urbanke C., Friedhoff P., Rao D.N. (2009) The C-terminal domain is sufficient for endonuclease activity of Neisseria gonorrhoeae MutL. Biochem. J. 423, 265–277.
Adamczyk-Popławska M., Bandyra K., Kwiatek A. (2018) Activity of Vsr endonucleases encoded by Neisseria gonorrhoeae FA 1090 is influenced by MutL and MutS proteins. BMC Microbiol. 18, 95.
Namadurai S., Jain D., Kulkarni D.S., Tabib C.R., Friedhoff P., Rao D.N., Nair D.T. (2010) The C-terminal domain of the MutL homolog from Neisseria gonorrhoeae forms an inverted homodimer. PLoS One. 5, e13726.
Banasik M., Sachadyn P. (2014) Conserved motifs of MutL proteins. Mutat. Res. Mol. Mech. Mutagen. 769, 69–79.
Monakhova M., Ryazanova A., Kunetsky V., Li P., Shilkin E., Kisil O., Rao D.N., Oretskaya T., Friedhoff P., Kubareva E. (2020) Probing the DNA-binding center of the MutL protein from the Escherichia coli mismatch repair system via crosslinking and Förster resonance energy transfer. Biochimie. 171–172, 43–54.
Monakhova M., Ryazanova A., Hentschel A., Viryasov M., Oretskaya T., Friedhoff P., Kubareva E. (2015) Chromatographic isolation of the functionally active MutS protein covalently linked to deoxyribonuc-leic acid. J. Chromatogr. A. 1389, 19–27.
Heinze R.J., Sekerina S., Winkler I., Biertümpfel C., Oretskaya T.S., Kubareva E., Friedhoff P. (2012) Covalently trapping MutS on DNA to study DNA mismatch recognition and signaling. Mol. Biosyst. 8, 1861.
Воробьева О.В., Романенков А.С., Метелев В.Г., Карягина А.С., Лаврова Н.В., Орецкая Т.С., Кубарева Е.А. (2003) Ковалентное связывание Cys142 метилтрансферазы SsoII с ДНК-дуплексами, содержащими фосфорилдисульфидную межнуклеотидную группу. Молекуляр. биология. 37, 906–915.
Романенков А.С., Кисиль О.В., Зацепин Т.С., Ямскова О.В., Карягина А.С., Метелев В.Г., Орецкая Т.С., Кубарева Е.А. (2006) ДНК-метилтрансфераза SsoII как бифункциональный белок: особенности взаимодействия с промоторной областью генов системы рестрикции-модификации SsoII. Биохимия. 71, 1648–1658.
Metelev V., Romanenkov A., Kubareva E., Zubin E., Polouchine N., Zatsepin T., Molochkov N., Oretskaya T. (2006) Structure-based cross-linking of NF-κB p50 homodimer and decoy bearing a novel 2′-disulfide trapping site. IUBMB Life. 58, 654–658.
Абросимова Л.А., Самсонова А.А., Перевязова Т.А., Юнусова А.К., Артюх Р.И., Романова Е.А., Железная Л.А., Орецкая Т.С., Кубарева Е.А. (2020) Роль остатков цистеина во взаимодействии никующей эндонуклеазы BspD6I с ДНК. Молекуляр. биология. 54, 667–679.
Vincent A., Scherrer K. (1979) A rapid and sensitive method for detection of proteins in polyacrylamide SDS gels: staining with ethidium bromide. Mol. Biol. Rep. 5, 209–214.
Guarné A., Ramon-Maiques S., Wolff E.M., Ghirlando R., Hu X., Miller J.H., Yang W. (2004) Structure of the MutL C-terminal domain: a model of intact MutL and its roles in mismatch repair. EMBO J. 23, 4134–4145.
Räschle M., Dufner P., Marra G., Jiricny J. (2002) Mutations within the hMLH1 and hPMS2 subunits of the human MutLα mismatch repair factor affect its ATPase activity, but not its ability to interact with hMutSα. J. Biol. Chem. 277, 21810–21820.
Cogan E.B., Birrell G.B., Griffith O.H. (1999) A robotics-based automated assay for inorganic and organic phosphates. Anal. Biochem. 271, 29–35.
Rowlands M.G., Newbatt Y.M., Prodromou C., Pearl L.H., Workman P., Aherne W. (2004) High-throughput screening assay for inhibitors of heat-shock protein 90 ATPase activity. Anal. Biochem. 327, 176–183.
Guarne A. (2001) Structure and function of the N-terminal 40 kDa fragment of human PMS2: a monomeric GHL ATPase. EMBO J. 20, 5521–5531.
Iino H., Hikima T., Nishida Y., Yamamoto M., Kuramitsu S., Fukui K. (2015) Small-angle X-ray scattering analysis reveals the ATP-bound monomeric state of the ATPase domain from the homodimeric MutL endonuclease, a GHKL phosphotransferase superfamily protein. Extremophiles. 19, 643–656.
Berger J.M., Wang J.C. (1996) Recent developments in DNA topoisomerase II structure and mechanism. Curr. Opin. Struct. Biol. 6, 84–90.
Drotschmann K., Hall M.C., Shcherbakova P. V., Wang H., Erie D.A., Brownewell F.R., Kool E.T., Kunkel T.A. (2002) DNA binding properties of the yeast Msh2-Msh6 and Mlh1-Pms1 heterodimers. Biol. Chem. 383, 969–975.
Bende S.M., Grafström R.H. (1991) The DNA binding properties of the MutL protein isolated from Escherichia coli. Nucl. Acids Res. 19, 1549–1555.
McCulloch S.D., Gu L., Li G.-M. (2003) Bi-directional processing of DNA loops by mismatch repair-dependent and -independent pathways in human cells. J. Biol. Chem. 278, 3891–3896.
Groothuizen F.S., Winkler I., Cristóvão M., Fish A., Winterwerp H.H., Reumer A., Marx A.D., Hermans N., Nicholls R.A., Murshudov G.N., Lebbink J.H., Friedhoff P., Sixma T.K. (2015) MutS/MutL crystal structure reveals that the MutS sliding clamp loads MutL onto DNA. Elife. 4, e06744.
Fukui K., Iino H., Baba S., Kumasaka T., Kuramitsu S., Yano T. (2017) Crystal structure and DNA-binding property of the ATPase domain of bacterial mismatch repair endonuclease MutL from Aquifex aeolicus. Biochim. Biophys. Acta – Proteins Proteomics. 1865, 1178–1187.
Fukui K., Baba S., Kumasaka T., Yano T. (2016) Structural features and functional dependency on β-clamp define distinct subfamilies of bacterial mismatch repair endonuclease MutL. J. Biol. Chem. 291, 16990–17000.
Niedziela-Majka A., Maluf N.K., Antony E., Loh-man T.M. (2011) Self-assembly of Escherichia coli MutL and its complexes with DNA. Biochemistry. 50, 7868–7880.
Qiu H., Wang Y. (2009) Exploring DNA-binding proteins with in vivo chemical cross-linking and mass spectrometry. J. Proteome Res. 8, 1983–1991.
Hoffman E.A., Frey B.L., Smith L.M., Auble D.T. (2015) Formaldehyde crosslinking: a tool for the study of chromatin complexes. J. Biol. Chem. 290, 26404–26411.
Verdine G.L., Norman D.P.G. (2003) Covalent trapping of protein-DNA complexes. Annu. Rev. Biochem. 72, 337–366.
Dolinnaya N., Zubin E., Kubareva E., Zatsepin T., Oretskaya T. (2009) Design and synthesis of 2-functionalised oligonucleotides. Their application for covalent trapping the protein–DNA complexes. Curr. Org. Chem. 13, 1029–1049.
Kosinski J., Plotz G., Guarné A., Bujnicki J.M., Friedhoff P. (2008) The PMS2 subunit of human MutLα contains a metal ion binding domain of the iron-dependent repressor protein family. J. Mol. Biol. 382, 610–627.
Fukui K., Baba S., Kumasaka T., Yano T. (2018) Multiple zinc ions maintain the open conformation of the catalytic site in the DNA mismatch repair endonuclease MutL from Aquifex aeolicus. FEBS Lett. 592, 1611–1619.
Дополнительные материалы отсутствуют.
Инструменты
Молекулярная биология


