Нейрохимия, 2019, T. 36, № 1, стр. 33-40
Сравнительные энзимологические характеристики холинэстераз нервной ткани и гомогената гусеницы хлопковой совки Helicoverpa armigera Hbn.
Н. Е. Басова 1, Е. В. Розенгарт 1
1 Федеральное государственное бюджетное учреждение науки Институт эволюционной физиологии и биохимии
им. И.М. Сеченова РАН
Санкт-Петербург, Россия
Поступила в редакцию 17.01.2018
После доработки 23.04.2018
Принята к публикации 13.03.2018
Аннотация
У хлопковой совки Helicoverpa (Heliothis) armigera Hbn. выявлены две холинэстеразы – ацетилхолинэстераза нервной цепочки и бутирилхолинэстераза гомогената гусеницы. Комплексное изучение субстратно-ингибиторной специфичности с использованием современных представлений о торможении высокими концентрациями субстратов, а также исследование антиферментного действия 57-ми необратимых фосфорорганических ингибиторов показали своеобразие энзимологических свойств ферментов совки по сравнению с холинэстеразами ряда членистоногих и некоторых млекопитающих.
ВВЕДЕНИЕ
Одной из ключевых проблем сравнительной нейрохимии является сопоставление каталитических характеристик ферментов нервной системы животных, стоящих на разных уровнях эволюционного развития, что хорошо иллюстрируют исследования холинэстераз (ХЭ) различного происхождения [1–3]. Сложность подобных исследований связана с необходимостью использования большого набора специфических эффекторов с логичным изменением структуры. Тогда анализ “структура–активность” дает важную информацию о строении мест сорбции эффекторов на каталитической поверхности ферментов. Для изучения субстратно-ингибиторной специфичности ХЭ повсеместно применяют различные по структуре субстраты (чаще всего холиновые эфиры карбоновых и тиокарбоновых кислот), а также обратимые ониевые и необратимые фосфорорганические ингибиторы (ФОИ) [1, 2]. Уже на заре “холинэстеразного” века было выявлено большое разнообразие свойств ХЭ не только между видами, но даже у одного животного [1–4].
В течение ряда лет проводились комплексные исследования свойств ХЭ хлопковой совки Helicoverpa (Heliothis) armigera Hbn., гусеницы которых повреждают более 120 видов культурных и дикорастущих растений (наиболее часто хлопчатник и кукурузу) [5–7]. В ткани H. armigera обнаружены две ХЭ – ацетилхолинэстераза (АХЭ) и бутирилхолинэстераза (БХЭ), существенно различающиеся по субстратной и ингибиторной специфичности, причем АХЭ находится только в ткани нервной цепочки, а БХЭ – в гемолимфе и в кишечнике [5]. Представляло интерес сопоставить данные субстратной и ингибиторной специфичности ферментов хлопковой совки с “реперными” ХЭ млекопитающих.
МЕТОДЫ ИССЛЕДОВАНИЯ
Лабораторная популяция хлопковой совки Helicoverpa (Heliothis) armigera Hbn. была выведена из гусениц, собранных на полях Ашхабадской и Чарджоуской обл. Туркмении. В дальнейшем гусениц выращивали на искусственной питательной среде по модифицированной методике Старца [8]. В опытах использовали гусениц V возраста. Для приготовления препарата АХЭ совки гусениц препарировали и извлеченные нервные цепочки замораживали в 0.05 М фосфатном буфере, pH 7.5 (15 цепочек в 1 мл). Перед опытом готовили гомогенат нервных цепочек (2 цепочки в 1 мл 0.05 М фосфатного буфера, pH 7.5) и центрифугировали 10 мин при 1000 g. Для приготовления препарата БХЭ совки готовили гомогенат из целой гусеницы (1 г в 9 мл 0.05 М фосфатного буфера, pH 7.5). После центрифугирования при 3000 g в течение 10 мин надосадочную жидкость использовали сразу или замораживали. Для ингибирования АХЭ препарат выдерживали 10 мин с 1 × 10–5 М ФОИ XII.55 [5–7]. Источниками ферментов млекопитающих служили очищенные препараты АХЭ эритроцитов человека (КФ 3.1.1.7) и БХЭ сывортки крови лошади (КФ 3.1.1.8) с удельной активностью, соответственно, 1.2 и 9.6 ед. (Пермский НИИ вакцин и сывороток).
В качестве субстратов тестированы иодиды ацетилтиохолина (АТХ), пропионилтиохолина (ПТХ) и бутирилтиохолина (БТХ) (“Merck”). Активность ХЭ определяли колориметрическим методом Эллмана [9]. Этот метод использует для определения активности ХЭ в качестве SН-хромофора (так называемого “реагента Эллмана”) 5,5'-дитиобис(2-нитробензойную кислоту). В основе метода лежит цветная реакция между продуктом холинэстеразного гидролиза субстрата тиохолином и “реагентом Эллмана”, в результате чего образуется окрашенный в желтый цвет анион 5-тио-2-нитробензойной кислоты.
Исследованные ФОИ были синтезированы в Институте биоорганической химии им. А.С. Садыкова АН Узбекистана (Ташкент) [10]:
Ряд I
 R = C2H5 (I.1); R = C3H7 (I.2); R = C4H9 (I.3); R = C5H11 (I.4); R = C6H13 (I.5); R = i-C4H9 (I.6); R = i-C5H11 (I.7).
R = C2H5 (I.1); R = C3H7 (I.2); R = C4H9 (I.3); R = C5H11 (I.4); R = C6H13 (I.5); R = i-C4H9 (I.6); R = i-C5H11 (I.7).
Ряд II
 R = C2H5 (II.8); R = C3H7 (II.9); R = C4H9 (II.10); R = C5H11 (II.11); R = C6H13 (II.12); R = i-C4H9 (II.13); R = i-C5H11 (II.14).
R = C2H5 (II.8); R = C3H7 (II.9); R = C4H9 (II.10); R = C5H11 (II.11); R = C6H13 (II.12); R = i-C4H9 (II.13); R = i-C5H11 (II.14).
Ряд III
 R = C2H5 (III.15); R = = C3H7 (III.16); R = C4H9 (III.17); R = C5H11 (III.18); R = C6H13 (III.19); R = = i-C4H9 (III.20); R = = i-C5H11 (III.21).
R = C2H5 (III.15); R = = C3H7 (III.16); R = C4H9 (III.17); R = C5H11 (III.18); R = C6H13 (III.19); R = = i-C4H9 (III.20); R = = i-C5H11 (III.21).
Ряд IV
 R = C2H5 (IV.22); R = = C3H7 (IV.23); R = C4H9 (IV.24); R = C5H11 (IV.25); R = C6H13 (IV.26); R = i-C4H9 (IV.27); R = = i-C5H11 (IV.28).
R = C2H5 (IV.22); R = = C3H7 (IV.23); R = C4H9 (IV.24); R = C5H11 (IV.25); R = C6H13 (IV.26); R = i-C4H9 (IV.27); R = = i-C5H11 (IV.28).
Ряд V
(RO)2P(O)SCH2C≡CH R = C2H5 (V.29); R = = C3H7 (V.30); R = C4H9 (V.31); R = C5H11 (V.32); R = C6H13 (V.33); R = i-C4H9 (V.34); R = i-C5H11 (V.35).
Ряд VI
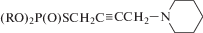 R = C2H5 (VI.36); R = C3H7 (VI.37); R = C4H9 (VI.38); R = = i-C4H9 (VI.39).
R = C2H5 (VI.36); R = C3H7 (VI.37); R = C4H9 (VI.38); R = = i-C4H9 (VI.39).
Ряд VII
C6H5(RO)P(O)SCH2C≡CH R = C5H11 (VII.40); R = C6H13 (VII.41).
Ряд VIII
C6H5(RO)P(O)SCH2CH=CH2R = C5H11 (VIII.42); R = C6H13 (VIII.43); R = i-C5H11 (VIII.44).
Ряд IX
C6H5(C5H11O)P(O)S(CH2)nCH(CH3)2n = 0 (IX.45); n = 1 (IX.46); n = 2 (IX.47).
Ряд X
C6H5(i-C5H11O)P(O)S(CH2)nCH(CH3)2n = 0 (X.48); n = 1 (X.49); n = 2 (X.50).
Ряд XI
C6H5(C6H13O)P(O)S(CH2)nCH(CH3)2n = 1 (XI.51); n = 2 (XI.52).
Группа XII: (CH3O)2P(O)OCH=CCl2 (ДДВФ, XII.53); (C2H5O)2P(O)OC6H4NO2-п (параоксон, XII.54); C2H5O(CH3)P(O)SC2H4S+(CH3)C2H5 · · ${\text{C}}{{{\text{H}}}_{{\text{3}}}}{\text{SO}}_{{\text{4}}}^{ - }$ (XII.55); эзерин (XII.56); прозерин (XII.57).
Антихолинэстеразную эффективность ингибиторов оценивали по величине бимолекулярной константы kII (субстрат – АТХ) [1, 2]. Величины kII рассчитывали по остаточной активности фермента после взаимодействия с изучаемыми ингибиторами [2] по формуле:
Для определения константы скорости kII подбирали диапазон концентраций ингибитора, в котором активность фермента угнеталась на 20–80%. В этом диапазоне для каждого ингибитора анализировали величины ингибиторных констант (средние величины из 5–6 определений). Результаты, полученные этими методами, совпали в пределах погрешности измерений. Статистическую обработку полученных данных проводили с помощью программы MS Excel.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Торможение активности ХЭ высокими концентрациями субстрата. Наличие в молекуле субстрата катионной группировки предполагает электростатическое (ион-ионное, ион-дипольное, катионное) взаимодействие с активной поверхностью ХЭ как в активном центре, так и вне его с так называемым периферическим сорбционным пунктом (ПСП) [1, 2, 11, 12]. В настоящее время именно сорбция второй молекулы субстрата с участием ПСП считается первопричиной торможения ферментативной активности ХЭ высокими концентрациями субстрата согласно схеме [2, 19 ] :
где Е и S – фермент и субстрат; ЕS' – ацилированный фермент; SE и SES' – соответственно свободный и ацилированный ферменты, ПСП которых связаны со второй молекулой субстрата; КSS – константа равновесия при связывании субстрата с ПСП, что отражает процесс торможения избытком субстрата (“субстратное ингибирование”) [2, 9]. По методу Моралева [2, 9] из линеаризованной формы уравнения МихаэлисаЭтот анализ представляет возможность сравнения таких основополагающих для познания механизма ферментативного катализа кинетических параметров, как скорость гидролиза субстрата (V), а также отражающих “сродство” субстрата по отношению к активному центру (V/КM) и к ПСП (1/КSS).
Субстратная специфичность ХЭ. В табл. 1 представлены параметры субстратной специфичности АХЭ и БХЭ хлопковой совки H. armigera и для сравнения АХЭ эритроцитов человека и БХЭ сыворотки крови лошади [2]. Как отмечалось выше, особый интерес представлял учет феномена торможения активности ХЭ высокими концентрациями субстрата, первопричиной которого является сорбция второй молекулы субстрата с участием ПСП каталитической поверхности ХЭ. Поэтому в табл. 1 приведены такой общий параметр, как скорость гидролиза субстрата (V), а также величины, отражающие “сродство” субстрата по отношению к активному центру ХЭ (V/КM) и к ПСП (1/КSS). В целом по энзимологическим характеристикам АХЭ совки и “реперная” эритроцитарная АХЭ качественно сходны: снижение скорости гидролиза и “сродства” субстрата по отношению к активному центру АХЭ (V/КM) при удлинении ацильного радикала субстрата; наличие феномена “субстратного торможения”; при переходе от АТХ к ПТХ отмечен одинаковый для обеих АХЭ рост “сродства” субстрата по отношению к ПСП (1/КSS). Такое сходство может быть продиктовано общими для этих ферментов нейрохимическими функциями, выполняемыми в организме, а именно ацетилхолиновым механизмом передачи возбуждения в нервных структурах, возникшем на самых ранних стадиях эволюции нервной системы. Однако, есть и существенные отличия: АХЭ совки с измеримой скоростью (10% от скорости гидролиза АТХ) гидролизует БТХ, в то время как “реперная” АХЭ демонстрировала полную неспособность к этой реакции; при переходе от АТХ к ПТХ степень падения “сродства” субстрата по отношению к активному центру (V/КM) была разной – в 3 раза для АХЭ совки и в 30 раз для эритроцитарной АХЭ. Эти отличия, возможно, могут быть связаны с разными вариантами аминокислотных остатков в ПСП у АХЭ совки и АХЭ эритроцитов человека. Возможно, более широкий спектр субстратов, проявляющих сродство к активному центру фермента хлопковой совки, связан с более высокими адаптогенными способностями насекомых. Из черт сходства в свойствах БХЭ совки и “реперной” сывороточной БХЭ можно отметить их способность к гидролизу всех тестированных субстратов и отсутствие феномена “субстратного торможения”. В то же время, в отличие от сывороточной БХЭ величины кинетических параметров для БХЭ совки не зависели от структуры ацильной части молекулы субстрата.
Таблица 1.
Сравнение параметров субстратной специфичности ацетил-ХЭ (АХЭ) и бутирил-ХЭ (БХЭ) гусеницы хлопковой совки Heliothis armigera, а также “реперных” ферментов – АХЭ эритроцитов человека и БХЭ сыворотки крови лошади
| Ферменты | Субстраты | Vотн, % | pKM | (V/KM)отн, % | p[S]opt | pKSS | (1/KSS)отн, % |
|
|---|---|---|---|---|---|---|---|---|
| Совка | АХЭ | АТХ | 100 | 4.89 | 100 | 3.49 | 2.20 | 100 |
| ПТХ | 65 | 4.49 | 30 | 3.49 | 2.40 | 180 | ||
| БТХ | 10 | 3.49 | 0.5 | 3.30 | 3.00 | 680 | ||
| БХЭ | АТХ | 100 | 2.10 | 100 | Отсутствует* | – | ||
| ПТХ | 100 | 4.89 | 100 | Отсутствует* | – | |||
| БТХ | 100 | 4.89 | 100 | Отсутствует** | – | |||
| АХЭ человека | АТХ | 100 | 4.40 | 100 | 3.20 | 2.00 | 100 | |
| ПТХ | 55 | 4.20 | 3 | 3.20 | 2.20 | 170 | ||
| БТХ | 0 | – | – | – | – | – | ||
| БХЭ лошади | АТХ | 100 | 3.30 | 100 | Отсутствует*** | – | ||
| ПТХ | 115 | 3.20 | 160 | Отсутствует*** | – | |||
| БТХ | 155 | 3.20 | 210 | Отсутствует*** | – | |||
Примечание: Vотн – относительная скорость гидролиза субстрата; pKM – отрицательный логарифм величины константы Михаэлиса; (V/KM)отн – относительная величина, характеризующая “сродство” субстрата активному центру фермента; p[S]opt – отрицательный логарифм величины оптимальной концентрации субстрата; pKSS – отрицательный логарифм величины константы процесса торможения избытком субстрата (“субстратного ингибирования”); (1/KSS)отн – относительная величина отношения, характеризующая “сродство” субстрата к периферическому сорбционному пункту (ПСП) фермента. “Субстратное ингибирование” не наблюдалось при: * [S] = 6.3 × 10–3 М; ** [S] = 1.0 × 10–3 М; *** [S] = 5.0 × 10–2 М.
Ингибиторная специфичность ХЭ. Первые ряды (I–IV) представленных в табл. 2 ФОИ являются производными алкалоида лупинина (ряд I), его эпимера эпилупинина (ряд II) и их иодметилатов (ряды III и IV). Тем самым они различаются как расположением относительно фосфорильной группы насыщенного азотсодержащего бицикла, так и его конфигурацией. Было показано, что иодметилат лупинина имеет цис-конфигурацию (метиламмониевая группировка занимает аксиально-экваториальное положение), а иодметилат эпилупинина – транс-конфигурацию (метиламмониевая группировка занимает аксиально-аксиальное положение) при том, что в обоих конформерах СН2ОН-группа экваториальна [13]. Можно говорить об определенном преимуществе эпилупининовой структуры для АХЭ и лупининовой – для БХЭ. Так, в случае АХЭ совки для гексильных производных эпилупинина (II.12, IV.26) это преимущество было 85–90-кратным, а в случае БХЭ совки более сильными ингибиторами оказались производные лупинина: III.15 и III.16 были в 50–60 раз эффективнее своих эпимеров (IV.22 и IV.23). Для АХЭ и БХЭ совки не наблюдалось четкой зависимости эффективности от природы алкоксигруппы ФОИ. АХЭ совки не проявила так называемого “эффекта кватернизации” [2] – повышения антихолинэстеразной активности ФОИ при переходе от азотистого основания к иодметилату (ср. ряды I и III, II и IV). В случае БХЭ можно говорить даже об обратном эффекте: третичные соединения оказывались, как правило, более активными ингибиторами, чем их метилированные аналоги. Практически все исследованные ФОИ оказались специфическими ингибиторами по отношению к БХЭ совки (особенно амильные производные II.11, III.18, IV.25). В целом, чувствительность АХЭ и БХЭ совки к исследованным ФОИ была существенно ниже, чем у ферментов млекопитающих.
Таблица 2.
Сравнительное исследование антихолинэстеразной эффективности (lg kII) ФОИ (формулы см. в тексте)
| Ингибиторы | Ферменты | |||
|---|---|---|---|---|
| ацетилхолинэстераза | бутирилхолинэстераза | |||
| хлопковой совки |
эритроцитов человека |
хлопковой совки |
сыворотки крови лошади |
|
| I.1 | 3.71 | 4.34 | 5.56 | 7.38 |
| I.2 | 3.53 | 5.18 | 5.38 | 7.48 |
| I.3 | 3.57 | 5.55 | 5.18 | 7.77 |
| I.4 | 3.18 | 5.76 | 5.26 | 8.11 |
| I.5 | 2.77 | 4.81 | 5.51 | – |
| I.6 | 3.71 | 5.20 | 5.40 | 7.08 |
| I.7 | 3.62 | 6.67 | 5.43 | 8.52 |
| II.8 | 3.65 | 4.30 | 4.45 | 6.68 |
| II.9 | 4.55 | 5.58 | 4.45 | 6.78 |
| II.10 | 3.63 | 6.28 | 4.46 | 7.78 |
| II.11 | 2.96 | 6.26 | 6.41 | 8.00 |
| II.12 | 4.68 | – | 4.72 | – |
| II.13 | 3.81 | 6.73 | 4.25 | 6.85 |
| II.14 | 4.68 | 6.85 | 4.43 | 7.67 |
| III.15 | 3.38 | 5.80 | 5.56 | 7.62 |
| III.16 | 3.05 | 5.72 | 5.76 | 7.92 |
| III.17 | 3.11 | 6.91 | 5.34 | 8.95 |
| III.18 | 2.75 | 6.15 | 6.45 | 8.69 |
| III.19 | 3.53 | 5.48 | 5.37 | – |
| III.20 | 3.13 | 5.69 | 4.51 | 7.45 |
| III.21 | 3.68 | 6.18 | 5.41 | 8.78 |
| IV.22 | 3.58 | 5.21 | 3.84 | 7.11 |
| IV.23 | 3.61 | 6.45 | 3.93 | 7.25 |
| IV.24 | 4.57 | 7.00 | 4.13 | 8.85 |
| IV.25 | 2.48 | 7.36 | 6.64 | 8.53 |
| IV.26 | 5.48 | – | 4.49 | – |
| IV.27 | 3.62 | 7.11 | 4.51 | 7.04 |
| IV.28 | 4.62 | 7.20 | 4.60 | 8.00 |
| V.29 | 2.70 | 4.32 | 4.56 | 6.57 |
| V.30 | 3.05 | 5.07 | 4.19 | 6.51 |
| V.31 | 1.49 | 5.65 | 6.93 | 6.46 |
| V.32 | 2.08 | 5.14 | 5.80 | 6.30 |
| V.33 | 1.39 | 5.58 | 5.80 | 5.07 |
| V.34 | 1.53 | 5.08 | 5.35 | 6.40 |
| V.35 | 3.23 | 5.66 | 6.24 | 6.86 |
| VI.36 | 5.72 | 5.80 | 5.35 | 6.75 |
| VI.37 | 4.74 | 6.49 | 5.35 | 7.73 |
| VI.38 | 4.94 | 6.70 | 6.22 | 7.32 |
| VI.39 | 4.52 | 6.45 | 5.41 | 6.45 |
| VII.40 | 3.60 | 4.69 | 7.14 | 4.64 |
| VII.41 | * | 3.92 | 3.29 | 4.36 |
| VIII.42 | 2.83 | 3.51 | 6.69 | 3.77 |
| VIII.43 | 2.42 | 3.25 | 6.62 | 3.82 |
| VIII.44 | 4.59 | 4.08 | 5.47 | 4.30 |
| IX.45 | * | 1.34 | 5.64 | 2.57 |
| IX.46 | * | 2.52 | 6.68 | 3.20 |
| IX.47 | * | 2.90 | 5.60 | 3.23 |
| X.48 | 2.68 | 2.45 | 5.10 | 3.23 |
| X.49 | 3.56 | 3.20 | 4.55 | 3.79 |
| X.50 | 2.38 | 3.46 | 4.60 | 3.89 |
| XI.51 | * | 2.60 | 4.49 | 3.26 |
| XI.52 | 2.14 | 2.77 | 5.12 | 3.65 |
| XII.53 | 3.89 | 4.36 | 3.68 | 5.40 |
| XII.54 | 4.63 | 5.75 | 4.00 | 6.08 |
| XII.55 | 7.18 | 7.89 | * | 5.94 |
| XII.56 | 5.76 | 5.54 | 5.53 | 5.60 |
| XII.57 | 5.04 | 4.97 | 1.08 | – |
Пропаргиловые производные (ряд V) оказались высокоспецифическими ингибиторами БХЭ совки, будучи очень слабыми ингибиторами АХЭ совки. Так, для V.31 это преимущество было 280000-кратным. Столь большое различие в тормозящем действии по отношению к ферментам одного животного является уникальным фактом [2]. Cтепень специфичности существенно отличалась в зависимости от структуры алкоксильного радикала. Следует отметить, что эти ФОИ оказались значительно менее специфическими ингибиторами сывороточной БХЭ по сравнению с эритроцитарной АХЭ. Введение в отщепляемую часть ФОИ метиленпиперидиновой группировки (ряд VI) существенно повысило эффективность по отношению к АХЭ совки и в меньшей мере – к остальным изученным ХЭ. Зависимость антиферментной активности от длины алкильной цепи алкоксильных радикалов выявила своеобразие ХЭ совки. Так, для АХЭ совки эффективность снижалась с удлинение цепи, а для БХЭ отмечался четкий максимум при R = С4Н9 (V.31, VI.38). Высокоспецифическими ингибиторами БХЭ совки оказались также ФОИ рядов VII и VIII, хотя в большинстве случаев винильные производные (ряд VIII) были более слабыми ингибиторами исследованных ХЭ, чем пропаргиловые аналоги (ряд VII).
Известно, что сопоставление эффективности ацетиленовых ФОИ с изомерными предельными соединениями позволило определять так называемый “ацетиленовый эффект” [1, 2, 14, 15]. В нашем случае в качестве предельного изомера можно с оговоркой использовать изопропильные производные (IX.46, X.49, XI.52). Только в случае АХЭ совки для VII.40 и VIII.43 (R = С5Н11) отмечен значительный эффект кратной связи, благодаря тому, что IX.46 практически не угнетал фермент. В случае других ХЭ “ацетиленовый” и “этиленовый” эффекты для этих пар соединений соответственно составляли: для БХЭ совки – 30 и 10, для БХЭ лошади – 120 и 15, для АХЭ человека – 2200 и 150. В остальных случаях, когда можно было определить эффект, его величины были ниже. Группа ФОИ производных алкоксифенилтиофосфонатов с небольшими различиями структуры тиоалкильного радикала (ряды IX–XI) оказались слабыми ингибиторами обеих АХЭ. Только в ряду X удалось выявить зависимость скорости торможения активности АХЭ совки от длины тиоалкильного радикала: максимум наблюдался для изобутильного производного (X.49). Амилокси- и изоамилоксипроизводные алкоксифенилтиофосфонатов (ряды IX и XI) были выраженными ингибиторами БХЭ: степень специфичности к БХЭ, например, для IX.47 превышала 106 раз. Однако, пожалуй, самым удивительным было то, что ФОИ этой группы оказались эффективными ингибиторами БХЭ совки даже по сравнению с ферментами млекопитающих. Так, IX.46 был в 3000 раз более эффективным ингибитором БХЭ совки, чем сывороточной БХЭ и почти в 15 000 раз, чем эритроцитарной АХЭ.
И, наконец, в группе XII представлены несколько часто используемых в холинэстеразных исследованиях ФОИ и карбаматы, высокая чувствительность к одному из которых – эзерину (XII.56) – является признаком принадлежности к семейству ХЭ [1, 2]. Сразу отметим, что эффективность эзерина по отношению к АХЭ и БХЭ совки (практически неотличимая от чувствительности “реперных” АХЭ и БХЭ) является весомым аргументом в пользу того, что ферменты совки являются ХЭ. Параоксон (XII.54) и ДДВФ (O,O-диметил-O-2,2-дихлорвинилфосфат) (XII.53) были более сильными ингибиторами “реперных” ХЭ, а сульфониевый ФОИ XII.55 тормозил активность АХЭ совки практически также эффективно, как и активность эритроцитарной АХЭ, специфическим ингибитором которой он является [1, 2]. Практически полная нечувствительность БХЭ совки только к этому ФОИ (XII.55 широко известный в холинэстеразных кругах под именем “Гд-42” [сульфометилат (2-этоксиметилфосфорилтиоэтил),этил(метил)сульфония] как чрезвычайно эффективный ингибитор по отношению к практически всем препаратам ХЭ [2, 16]) имеет среди доступной нам информации только одну аналогию со свойствами БХЭ злаковой тли S. gramina Rond. [1–4]. Этот ФОИ был использован в методике выделения БХЭ совки (см. выше).
В табл. 3 приведены ранее полученные сравнительные данные по угнетению ХЭ различных членистоногих и ряда млекопитающих под действием лупининовых (I.1, I.2, I.3, I.4) и эпилупининовых (II.8, II.9, II.10, II.11) ФОИ [2]. АХЭ совки наряду с ХЭ рисового долгоносика оказалась наименее чувствительной к действию лупининовых ФОИ. Так, I.1 тормозил АХЭ совки почти в 100 000 раз медленее, чем АХЭ комнатной мухи. В случае эпилупининовых ФОИ по отношению к АХЭ совки только пропильное производное II.9 оказалось в 10 раз сильнее лупининового аналога I.2, а эффективность остальных оставалась неизменной. ХЭ рисового долгоносика была более чувствительна к ряду II, в то время как скорость торможения ферментов остальных членистоногих, в целом, снижалась. По-видимому, гидрофобные области, сорбирующие отщепляемую часть молекулы эффектора, относительно узки у ферментов совки, вследствие чего они особо чувствительны к общей структуре ингибитора [6]. Эти данные еще раз подчеркивают выраженное своеобразие энзимологических свойств ХЭ совки.
Таблица 3.
Сравнительное исследование чувствительности к ингибирующему действию производных лупинина (ряд I) и эпилупинина (ряд II) у холинэстераз некоторых членистоногих и млекопитающих [2]
| Источник фермента |
(lg kII) | ||||||||
|---|---|---|---|---|---|---|---|---|---|
| I.1 | I.2 | I.3 | I.4 | II.8 | II.9 | II.10 | II.11 | ||
| Хлопковая совка |
АХЭ БХЭ |
3.71 5.56 |
3.53 5.38 |
3.57 5.18 |
3.18 5.26 |
3.65 4.45 |
4.55 4.45 |
3.63 4.46 |
2.96 6.41 |
| Комнатная муха Musca domestica |
8.53 | 8.08 | 7.46 | 6.36 | 7.04 | 7.28 | 6.23 | 6.66 | |
| Злаковая тля Schizaphis gramina |
5.18 | 4.64 | 4.00 | 3.98 | 3.48 | 3.52 | 3.30 | 3.42 | |
| Рисовый долгоносик Sitobion orizae |
3.15 | 3.00 | 2.95 | 2.79 | 3.58 | 3.65 | 4.00 | 4.38 | |
| Паутинный клещ Tetranychus urticae |
5.57 | 5.30 | 4.90 | 3.75 | 4.57 | 4.48 | 3.84 | 2.79 | |
| Мучнистый червец Pseudococcus maritimus |
5.91 | 5.60 | 5.00 | 4.68 | – | – | – | – | |
| АХЭ эритроцитов человека |
4.35 | 5.18 | 6.15 | 5.76 | 4.30 | 5.58 | 6.28 | 6.26 | |
| АХЭ эритроцитов кролика |
4.04 | 4.88 | 5.40 | 4.71 | 4.89 | 5.65 | 5.56 | 5.56 | |
| АХЭ мозга мыши | 4.32 | 4.21 | 5.21 | 4.08 | 4.38 | 5.15 | 5.04 | 5.04 | |
| БХЭ сыворотки крови лошади |
7.38 | 7.48 | 7.77 | 8.11 | 6.68 | 6.78 | 7.78 | 8.00 | |
ЗАКЛЮЧЕНИЕ
У хлопковой совки, как и у злаковой тли S. gramina [3, 4], выявлены две ХЭ, которые по аналогии с ферментами млекопитающих названы АХЭ и БХЭ. Изучение их субстратной специфичности обнаружило при качественном сходстве энзимологических характеристик АХЭ и БХЭ совки с “реперными” эритроцитарной АХЭ и сывороточной БХЭ выраженное своеобразие свойств этих ферментов. Так, АХЭ совки с измеримой скоростью гидролизовала БТХ, а для БХЭ совки величины кинетических параметров не зависели от структуры ацильной части молекулы субстрата. В еще большей мере своеобразие свойств этих ферментов проявилось при подробном исследовании ингибиторной специфичности. Так, АХЭ совки обладала существенно более низкой чувствительностью по отношению практически ко всем исследованным ФОИ. Иной у этого фермента оказалась также зависимость антиацетилхолинэстеразного действия от структуры ингибитора почти для всех изученных рядов ФОИ. Таким образом, отличия в ингибиторной специфичности АХЭ совки от АХЭ человека носят не только количественный, но и качественный характер. Еще большие отличия от “реперных” аналогов проявила БХЭ совки. Катионсодержащие ингибиторы либо практически не тормозили ее активности, либо оказались более слабыми эффекторами, чем их третичные аналоги (табл. 2). Однако, наибольший сюрприз преподнесли производные фенилфосфоновой кислоты (ряды VII–XI): чувствительность к этим ФОИ у БХЭ совки была высокой (величины kII достигали порядка 106–107 М–1 мин–1), что было выше, чем у ферментов млекопитающих. Столь высокая реакционная способность БХЭ является еще одним убедительным свидетельством своеобразия свойств ферментов хлопковой совки.
БЛАГОДАРНОСТИ
Работа выполнена в рамках государственного задания ФАНО России (тема № АААА-А18-118012290427-7). Спектрофотометрические исследования выполнены на базе Центра коллективного пользования научным оборудованием для физиологических, биохимических и молекулярно-биологических исследований ИЭФБ РАН.
Список литературы
Бресткин А.П., Кузнецова Л.П., Моралев С.Н., Розенгарт Е.В., Эпштейн Л.М. // Холинэстеразы наземных животных и гидробионтов. Владивосток: ТИНРО-Центр, 1997. 466 с.
Moralev S.N., Rozengart E.V. // Comparative Enzymology of Cholinesterases. La Jolla. Ca.: International University Lines, 2007. 485 p.
Розенгарт Е.В., Басова Н.Е., Сааков В.С. // Нейрохимия. 2012. Т. 29. № 1. С. 23–27.
Rozengart E.V., Basova N.E., Moralev S.N., Lushchekina S.V., Masson P., Varfolomeev S.D. // Chem. Biol. Interact. 2013. V. 203. P. 3–9.
Доренская Г.М., Чарыева О.Б., Кулиева А.М., Моралев С.Н., Розенгарт В.И. // Химия природных соед. 1994. № 1. С. 13–18.
Кулиева А.М., Моралев С.Н., Розенгарт Е.В. // Журн. эвол. биохим. и физиол. 1995. Т. 31. С. 274–280.
Gunning R.V. // J. Mol. Neuroscience. 2006. V. 30. P. 21–22.
Старц В.А., Прант Н.Я. // Новые методы в защите растений, Ч. 2. Кишинев: Штиинца, 1979. 156 с.
Ellmann G.H., Countney R.D., Anders V. Jr., Featherstone K.M. // Biochem. Pharmacol. 1961. V. 7. P. 88–95.
Абдувахабов А.А., Садыков А.А., Далимов Д.Н., Асланов Х.А. // Алкалоиды и их производные как инструмент для изучения холинергической системы. Ташкент, 1984. 288 с.
Моралев С.Н., Розенгарт Е.В. // Журн. эвол. биохим. и физиол. 1999. Т. 35. С. 3–14.
Моралев С.Н., Розенгарт Е.В. // Журн. эвол. биохим. и физиол. 2001. Т. 37. С. 358–373.
Касымов Т.К. Синтез и исследование некоторых производных лупинина // Автореф. дис. канд. наук. Ташкент, 1971.
Годовиков Н.Н., Вихрева Л.А., Бабашева К.К., Шерстобитов О.Е., Балашова Е.К., Кугешова Л.И., Розенгарт В.И., Бресткин А.П., Кабачник М.И. // Изв. АН СССР. Сер. хим. 1983. С. 1602–1605.
Бресткин А.П., Вихрева Л.А., Годовиков Н.Н., Жуковский Ю.Г., Кабачник М.И., Моралев С.Н., Розенгарт В.И. Шерстобитов О.Е. // Успехи химии. 1991. Т. 60. С. 1744–1776.
Басова Н.Е., Кормилицын Б.Н., Перченок А.Ю., Розенгарт Е.В., Сааков В.С., Суворов А.А. // Журн. эвол. биохим. и физиол. 2015. Т. 51. С. 419–426.
Дополнительные материалы отсутствуют.



