Нейрохимия, 2019, T. 36, № 4, стр. 302-307
Влияние хлорида лития на уровень мозгового нейротрофического фактора в неонатальном мозге
А. В. Баннова 1, П. Н. Меньшанов 1, 2, Н. Н. Дыгало 1, 3
1 ФИЦ Институт цитологии и генетики СО РАН
Новосибирск, Россия
2 Новосибирский государственный технический университет
Новосибирск, Россия
3 Новосибирский государственный университет
Новосибирск, Россия
Поступила в редакцию 27.11.2018
После доработки 13.03.2019
Принята к публикации 07.04.2019
Аннотация
Мозговой нейротрофический фактор BDNF, регулирующий нейрогенез и пластичность мозга, вовлечен в механизм нейропротекторного действия широко применяемого в психиатрии нормотимика – лития. Однако как влияет литий на уровень BDNF в различающихся по степени онтогенетической зрелости отделах неонатального мозга остается неясным. В работе исследовали острый эффект хлорида лития (LiCl) на уровень белка BDNF, а также на уровень белка-маркера апоптоза – активной каспазы-3 в коре и стволе мозга 3-дневных крысят. Применение LiCl приводило к увеличению уровня BDNF в стволе и коре мозга крысят через 2 ч после введения. В более зрелом отделе ЦНС – стволе, индуцированное литием увеличение уровня BDNF сопровождалось 2-кратным снижением уровня активной каспазы-3. Результаты свидетельствуют, что проявление антиапоптозного действия LiCl зависит от степени зрелости подвергшегося воздействию нормотимика отдела неонатального мозга.
ВВЕДЕНИЕ
Широко применяемый при терапии биполярных расстройств [1] нормотимик литий в последние годы активно рассматривается в качестве потенциального нейропротективного препарата при лечении острых повреждений ЦНС и хронических нейродегенеративных заболеваний [2]. Для неонатального мозга были показаны нейропротекторные эффекты солей лития на экспериментальной модели неонатальной гипоксии-ишемии [3–5] и при повреждении ЦНС токсическими агентами [6, 7]. При остром введении препарата оказывающая терапевтический эффект доза лития составляет 120–200 мг/кг [3–7]. Наблюдаемые нейропротекторные эффекты солей лития связаны с их влиянием на экспрессию антиапоптозных белков Bcl-2 семейства [8, 9] и на уровни белков семейства нейротрофинов [10–12]. Несмотря на возможность развития отдельных токсических эффектов при применении этого нормотимика [13, 14], препараты лития в силу своих нейропротективных свойств могут рассматриваться в качестве возможного способа защиты незрелого головного мозга от действия различных неблагоприятных факторов среды – глюкокортикоидов, гипоксии и анестетиков [15, 16].
Одна из потенциальных мишеней лития – мозговой нейротрофический фактор BDNF (brain derived neurotrophic factor) широко экспрессируется в незрелом мозге, в том числе – в коре и стволе [17]. В развивающемся мозге этот белок реализует свои эффекты через каспаза-3-зависимый молекулярный путь [18] и регулирует процессы нейрогенеза, влияя на пролиферацию и дифференцировку нейронов, а также способствует выживанию клеток [19]. Показано, что литий увеличивает экспрессию мозгового нейротрофического фактора BDNF в культуре кортикальных нейронов [10], ганглиозных клетках сетчатки [11], коре мозга и гиппокампе взрослых животных [8, 12]. Однако как влияют соли лития на уровень BDNF в неонатальном мозге, когда он наиболее чувствителен к действию разнообразных средовых и онтогенетических факторов [16, 20], остается неясным.
В силу асинхронности созревания различных отделов головного мозга, у крыс нейроны ствола мозга заканчивают пролиферацию и дифференцировку в эмбриогенезе, тогда как в коре мозга эти процессы продолжаются и в первые дни после рождения [21]. В результате естественные уровни BDNF в ходе перинатального развития в этих отделах головного мозга различаются [17]. В эти же сроки интенсивность активации ключевого фермента программируемой клеточной гибели – каспазы-3 в коре мозга значительно выше по сравнению со стволом мозга [17]. Асинхронное созревание мозга в онтогенезе предполагает неидентичность действия нормотимиков на уровень BDNF в разных структурах мозга в неонатальный период [22]. Целью данной работы было исследовать острый эффект нормотимика хлорида лития на уровень белка BDNF, а также на уровень маркера апоптоза – активной каспазы-3 в стволе и фронтальной коре 3-дневных крысят.
МЕТОДЫ ИССЛЕДОВАНИЯ
В эксперименте использовали крысят, рожденных и вскармливаемых собственными матерями линии Вистар. Условия содержания животных и протоколы работы с ними утверждены Комиссией по биоэтике ИЦиГ СО РАН, и соответствуют Директиве Европейского Парламента и Совета ЕС 2010/63/EU от 22.09.2010 г. День родов принимали за первый день жизни животных.
Крысятам на 3 день жизни подкожно вводили LiCl в дозе 85 мг/кг. Используемая в эксперименте доза LiCl (эквивалентна дозе 2meq) была выбрана на основе опубликованных данных [3–7]. Контрольные животные получали 0.02 мл физиологического раствора. В каждой экспериментальной группе было по 6–8 животных.
Уровни белков определяли спустя 2 ч после инъекции препаратов, поскольку ранее в эти сроки была показана возможность острой индукции экспрессии гена bdnf [23]. Ткани мозга гомогенизировали в лизирующем буфере (150 мМ NaCl, 50 мМ Трис, 1% Тритон Х-100, ингибиторы протеаз: 2 мМ PMSF и 2 мкг/мл леупептина, пепстатина и апротинина). После центрифугирования (14 000 g, 4°С, 15 мин) содержание белка в пробах определяли по методу Лоури. Супернатант, содержащий 50 мкг белка, денатурировали в буфере (50 mM трис-HCl (pH 6.8), 10% глицерина, 100 mM 2-β-меркаптоэтанола, 1% SDS, 0.002% бромфенолового синего; 5 мин при 95°С), затем разделяли методом электрофореза (система Mini-Protean 3 Dodeca Cell, Bio-Rad Laboratories, США) в 12% полиакриламидном геле (размером 84 × 80 × 1 мм) с SDS. Электрофорез проводили в электрофорезном буфере (25 мМ трис, 192 мМ глицин, 0.1% SDS, pH 8.3) при напряжении 120 V до вхождения образцов в разделяющий гель, затем – 180 V. После электрофореза белки переносили на 0.45-µм нитроцеллюлозную мембрану (Bio-Rad Laboratories, США) в буфере для переноса (47.9 мМ Трис, 38.6 мМ глицин, 20% метанол, pH 8.3) при постоянном напряжении 70 V в течение 60 мин (система Trans-Blot, Bio-Rad Laboratories, США).
Мембраны инкубировали в присутствии антител: первичных (BDNF – N-20, rabbit polyclonal, разведение 1 : 500, “Santa Cruz Biotechnology”, США; активной каспазы-3 – #9664, rabbit monoclonal, разведение 1 : 500, “Cell Signaling”, США; β-актина – sc-1616, rabbit polyclonal, разведение 1 : 20 000, “Santa Cruz Biotechnology”, США) и вторичных (goat anti-rabbit IgG antibody, разведение 1 : 1000 для BDNF и активной каспазы-3 или 1 : 10 000 для β-актина, “Bio-Rad Laboratories”, США). Затем усиливали хемилюминисцентный сигнал с помощью специального набора (SuperSignal™ West Femto Maximum Sensitivity Substrate, Lifetechnologies) в течение 1 мин. Интенсивность окрашивания полос, соответствующих анализируемым белкам, определяли путем сканирования мембран (ChemidocTM Touch Imaging System, Bio-Rad Laboratories, США) с последующей компьютерной денситометрией (программа Scion Image 4.0.3.2 Scion Corporation, США). Для детекции β-актина и целевых белков мембраны разделяли на уровне 25 кДа. Белки BDNF и активную каспазу-3 детектировали на индивидуальных мембранах. Количество белка BDNF (14 кДа) и активной каспазы-3 (17 кДа) оценивали в относительных единицах к β-актину (42 кДа) того же образца.
Помимо вышеуказанных, все используемые в работе реактивы были производства компании “Sigma-Aldrich”, США.
Статистическую обработку полученных данных проводили с использованием пакета программ STATISTICA (ver. 6.0; StatSoft, Inc., 2001). Влияние воздействий внутри одной структуры оценивали однофакторным дисперсионным анализом (ANOVA), достоверность различий между группами устанавливали согласно LSD критерию Фишера. Корреляционный анализ проводили по методу ранговой корреляции Спирмена. Результаты считали достоверными при вероятности менее 0.05.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
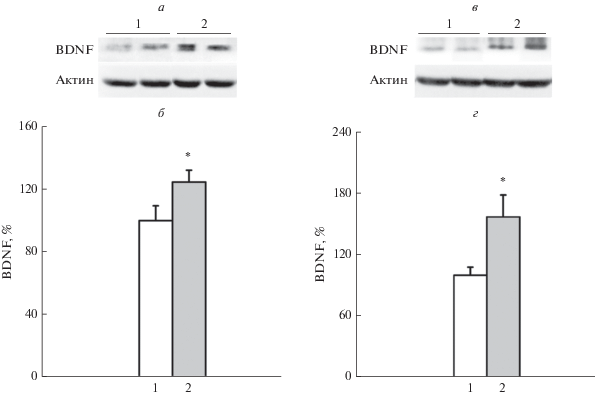
Хлорид лития увеличивал уровень мозгового нейротрофического фактора BDNF в стволе мозга 3-дневных крысят через 2 ч после введения препарата (рис. 1а, б; F(1,14) = 4.69, p < 0.048). Во фронтальной коре 3-дневных крысят было выявлено полуторакратное увеличение уровня белка BDNF через 2 часа после инъекции хлорида лития (рис. 1в, г; F(1,13) = 5.56, p < 0.035). Такое увеличение в уровне мозгового нейротрофического фактора под действием лития теоретически должно препятствовать программируемой гибели клеток в этих структурах мозга.
Рис. 1.
Уровни BDNF в стволе мозга и коре 3-дневных крысят спустя 2 ч после введения LiCl. a – Иммунодетекция BDNF (14 кДа) и актина (42 кДа) в стволе после разделения гель-электрофорезом; б – количественная оценка уровня BDNF в стволе; в – иммунодетекция BDNF и актина в коре после разделения гель-электрофорезом; г – количественная оценка уровня BDNF в коре, [M ± m, % – выраженные в процентах относительно уровня контроля, принятого за 100%]. *p < 0.05 по сравнению с введением физ. раствора. 1 – Введение физ. раствора (ствол n = 8, кора n = 7), 2 – введение LiCl (ствол n = 8, кора n = 8).
Действительно, индуцированное литием увеличение уровня белка BDNF в стволе мозга неонатальных крысят сопровождалось снижением уровня активной формы эффекторной протеазы апоптоза – каспазы-3 (рис. 2а, б; F(1,14) = 16.53, p < 0.0012). Уровни BDNF и активной каспазы-3 в стволе мозга неонатальных крысят были сопряжены между собой (R = –0.54, p < 0.0061). При этом снижение уровня активной каспазы-3 в стволе мозга после введения лития было двукратным. В отличие от ствола мозга, во фронтальной коре введение лития не вызывало изменения уровня активной формы каспазы-3 (рис. 2в, г; F(1,11) = 0.81, p > 0.387). Во фронтальной коре взаимосвязь между уровнем активной каспазы-3 и уровнем мозгового нейротрофического фактора не обнаружили (R = –0.004, p > 0.986).
Рис. 2.
Уровни активной каспазы-3 в стволе мозга и коре 3-дневных крысят спустя 2 ч после введения LiCl. a – Иммунодетекция активной каспазы-3 (17 кДа) и актина (42 кДа) в стволе после разделения гель-электрофорезом; б – количественная оценка уровня активной каспазы-3 в стволе; в – иммунодетекция активной каспазы-3 и актина в коре после разделения гель-электрофорезом; г – количественная оценка уровня активной каспазы-3 в коре, [M ± m, % – выраженные в процентах относительно уровня контроля, принятого за 100%]. *p < 0.05 по сравнению с введением физ.раствора. 1 – Введение физ.раствора (ствол n = 8, кора n = 6), 2 – введение LiCl (ствол n = 8, кора n = 7).

ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
В нашей работе выявлены быстрые эффекты острого применения нейротропного препарата – солей лития на экспрессию мозгового нейротрофического фактора BDNF в стволе и фронтальной коре мозга неонатальных крысят.
Наблюдаемое повышение уровней BDNF in vivo в исследованных отделах мозга происходило уже через два часа после применения LiCl в отсутствие воздействия повреждающих факторов. Параллельный рост уровня BDNF и в коре, и в стволе мозга наших животных сложно объяснить за счет транспортировки этого белка из других отделов мозга [23], без его синтеза de novo. Чаще всего в живых системах наиболее вероятной причиной повышения уровня того или иного белка в краткосрочной перспективе является быстрая индукция транскрипции и трансляции его гена. Ранее подобное характерное для генов раннего ответа быстрое повышение уровня BDNF наблюдали при индуцированной деполяризации нейронов коры головного мозга и гиппокампа в различных экспериментальных моделях [24–26]. При этом для гена bdnf повышение уровня мРНК, предшествующее росту уровня самого белка BDNF, наблюдали уже через 15–60 мин после экспериментальных воздействий [24, 27]. Поэтому не исключено, что после воздействия литием ген bdnf проявляет себя в неонатальном мозге как типичный ген раннего ответа.
Аналогичное выявленному в нашем эксперименте быстрое повышение уровня BDNF в ответ на применение солей лития наблюдали in vitro на клеточных культурах кортикальных нейронов и астроглии [10, 28]. Следует отметить, что хронические введение (2–4 нед.) лития также способно повышать уровень белка BDNF в коре и гиппокампе взрослых животных [8, 11, 12]. Несмотря на то, что активируемые литием молекулярные механизмы повышения уровня BDNF могут существенно отличаться при остром и хроническом введении данного нормотимика [19], результаты нашей работы свидетельствуют о способности обоих режимов применения солей лития индуцировать повышение уровня BDNF в мозге.
Увеличение литием уровня мозгового нейротрофического фактора, регулирующего выживаемость нейронов, должно препятствовать программируемой гибели клеток мозга. BDNF реализует свой антиапоптозный эффект через каспаза-3-зависимый молекулярный путь, снижая уровень активной формы ключевого фермента апоптоза в развивающемся мозге – каспазы-3 [18]. Ранее нами [29] и другими группами [30] было показано, что уровень активности данного фермента в развивающемся мозге тесно связан с интенсивностью протекания фрагментации ДНК, которая является высокоспецифичным признаком апоптоза. Известно, что изменение уровней BDNF способно влиять на убиквитин-опосредованную деградацию белков в нейронах [31]. Деградация белков в клетках млекопитающих происходит через каноническое стадийное убиквитинилирование, а время деградации любого белка определяется правилом N-концевой последовательности [32]. В соответствии с правилом N-концевой последовательности расчетное время полужизни для активной каспазы-3 составляет менее 2 ч. Поэтому не исключено, что в нашем эксперименте уровень активной формы каспазы-3 в стволе мозга снизился аналогичным образом после литий-опосредованного увеличения уровня BDNF.
Наблюдаемое нами увеличение уровня BDNF в стволе неонатальных крысят под действием лития сопровождалось снижением уровня активной каспазы-3, что свидетельствует о нейропротекторном действии лития на эту структуру в неонатальный период. Выявленный в нашей работе антиапоптозный эффект лития согласуется с литературными данными о характере действия этого нормотимика. Так литий способен предотвращать гибель аксотомированных ганглиозных клеток сетчатки [11] и оказывать общее нейропротекторное действие при гипоксически-ишемическом поражении мозга новорожденных крыс [3–5]. Кроме того, нейропротекторное действие лития показано для нейронов гиппокампа в культуре [8] и in vivo [7].
В отличие от ствола мозга, во фронтальной коре значительных изменений в уровне активной каспазы-3 при введении лития выявлено не было. Различие эффекта лития на уровень активной каспазы-3 в исследованных структурах мозга может быть обусловлено их асинхронным созреванием в онтогенезе [21], а именно, отличием в интенсивности апоптоза в этих структурах [30, 33]. В исследуемый нами период в клетках коры идет процесс интенсивной элиминации клеток, сопровождаемый высоким уровнем активной каспазы-3 [29, 30, 33, 34]. Вместе с тем, ранее нами было показано, что в коре неонатального мозга уровень BDNF значительно ниже, чем в стволе, и сопряжен с уровнем активной каспазы-3 в этих отделах [17, 34]. Разница в соотношении уровней активной каспазы-3 к BDNF в коре и стволе неонатального мозга может быть причиной различия эффекта лития на уровень активной каспазы-3 в этих структурах.
В целом установлено наличие антиапоптозных эффектов острого действия нормотимика лития на экспрессию мозгового нейротрофического фактора BDNF в стволе и фронтальной коре головного мозга неонатальных крысят даже в отсутствии воздействия повреждающих факторов. Таким образом, активируемый солями лития молекулярный механизм повышения уровня BDNF теоретически может быть использован для обеспечения экстренной нейропротекции незрелого головного мозга.
Список литературы
Dell’Osso L., Del Grande C., Gesi C., Carmassi C., Musetti L. // Neuropsychiatr. Dis. Treat. 2016. V. 12. P. 1687–1703.
Diniz B.S., Machado-Vieira R., Forlenza O.V. // Neuropsychiatr. Dis. Treat. 2013. V. 9. P. 493–500.
Li H., Li Q., Du X., Sun Y., Wang X., Kroemer G., Blomgren K., Zhu C. // J. Cereb. Blood Flow Metab. 2011. V. 31. P. 2106–2115.
Shin W.J., Gwak M., Baek C.H., Kim K.S., Park P.H. // Childs Nerv. Syst. 2012. V. 28. P. 191–198.
Xie C., Zhou K., Wang X., Blomgren K., Zhu C. // PLoS One. 2014. V. 9. e107192.
Liu J.R., Baek C., Han X.H., Shoureshi P., Soriano S.G. // Br. J. Anaesth. 2013. V. 110. P. i3–i9.
Zhou X., da Li W., Yuan B.L., Niu L.J., Yang X.Y., Zhou Z.B., Chen X.H., Feng X. // Neurochem Res. 2016. V. 41. P. 1993–2005.
Dwivedi T., Zhang H. // Front. Neurosci. 2015. V. 8. P. 457.
Dygalo N.N., Bannova A.V., Sukhareva E.V., Shishkina G.T., Ayriyants K.A., Kalinina T.S. // Biochemistry (Moscow). 2017. V. 82. P. 345–350.
Hashimoto R., Takei N., Shimazu K., Christ L., Lu B., Chuang D.M. // Neuropharmacology. 2002. V. 43. P. 1173–1179.
Wu M.M., Zhu T.T., Wang P., Kuang F., Hao D.J., You S.W., Li Y.Y. // Int. J. Mol. Sci. 2014. V. 15. P. 13550–13563.
De-Paula V.J., Gattaz W.F., Forlenza O.V. // Bipolar Disord. 2016. V. 18. P. 692–695. https://doi.org/10.1111/bdi.12449
Gong R., Wang P., Dworkin L. // Am. J. Physiol. Renal Physiol. 2016. V. 311. P. F1168–F1171.
Dineen R., Bogdanet D., Thompson D., Thompson C.J., Behan L.A., McKay A.P., Boran G., Wall C., Gibney J., O’Keane V., Sherlock M. // QJM. 2017. V. 110. P. 821–827.
Menshanov P.N., Bannova A.V., Dygalo N.N. // Behav. Brain Res. 2014. V. 271. P. 43–50.
Bannova A.V., Akulov A.E., Menshanov P.N., Dygalo N.N. // J. Pharm. Biomed. Anal. 2018. V. 150. P. 327–332.
Menshanov P.N., Lanshakov D.A., Dygalo N.N. // Physiol. Res. 2015. V. 64. P. 925–934.
Koshimizu H., Hazama S., Hara T., Ogura A., Kojima M. // Neurosci. Lett. 2010. V. 473. P. 229–232.
Guo W., Nagappan G., Lu B. // Dev. Neurobiol. 2018. V. 78. P. 647–659.
Menshanov P.N., Bannova A.V., Dygalo N.N. // Horm. Behav. 2017. V. 87. P. 122–128.
Rice D., Barone S.Jr. // Environ. Health Perspect. 2000. V. 108. P. 511–533.
Morozova A.Yu., Arutjunyan A.V., Milyutina Yu.P., Morozova P.Yu., Kozina L.S., Zhuravin I.A. // Neurochemical J. 2018. V. 12. P. 262–269.
Fawcett J.P., Bamji S.X., Causing C.G., Aloyz R., Ase A.R., Reader T.A., McLean J.H., Miller F.D. // J. Neurosci. 1998. V. 18. P. 2808–2821.
Lauterborn J.C., Rivera S., Stinis C.T., Hayes V.Y., Isackson P.J., Gall C.M. // J. Neurosci. 1996. V. 16. P. 7428–7436.
de Bartolomeis A., Buonaguro E.F., Latte G., Rossi R., Marmo F., Iasevoli F., Tomasetti C. // Front. Behav. Neurosci. 2017. V. 11. P. 240.
Fukuchi M., Sanabe T., Watanabe T., Kubota T., Tabuchi A., Tsuda M. // Biochem. Biophys. Res. Commun. 2017. V. 490. P. 682–687.
Hughes P., Beilharz E., Gluckman P., Dragunow M. // Neuroscience. 1993. V. 57. P. 319–328.
Emamghoreishi M., Keshavarz M., Nekooeian A.A. // Iran. J. Basic Med. Sci. 2015. V. 18. P. 240–246.
Menshanov P.N., Bannova A.V., Dygalo N.N. // Neurochem. Res. 2006. V. 31. P. 869–887.
de Bilbao F., Guarin E., Nef P., Vallet P., Giannakopoulos P., Dubois-Dauphin M. // J. Comp. Neurol. 1999. V. 409. P. 339–357.
Jia J.M., Chen Q., Zhou Y., Miao S., Zheng J., Zhang C., Xiong Z.Q. // J. Biol. Chem. 2008. V. 283. P. 21242–21250.
Varshavsky A. // Protein Sci. 2011. V. 20. P. 1298–1345.
Kalinina T.S., Bannova A.V., Dygalo N.N. // Bull. Exp. Biol. Med. 2001. V. 132. P. 748–750.
Muzyka V.V., Men’shanov P.N., Bannova A.V., Dygalo N.N. // Neurochemical J. 2012. V. 6. P. 260–264.
Дополнительные материалы отсутствуют.


