Нейрохимия, 2023, T. 40, № 1, стр. 3-12
Перспективы использования малых экстраклеточных везикул в качестве транспортного средства через гематоэнцефалический барьер
Л. Г. Хаспеков 1, А. А. Яковлев 2, 3
1 Научный центр неврологии Министерства науки и высшего образования РФ
Москва, Россия
2 Институт высшей нервной деятельности и нейрофизиологии РАН
Москва, Россия
3 Научно-практический психоневрологический центр им. З.П. Соловьева ДЗМ
Москва, Россия
Поступила в редакцию 23.08.2022
После доработки 17.09.2022
Принята к публикации 25.09.2022
- EDN: DUIRZW
- DOI: 10.31857/S1027813323010089
Аннотация
Одним из наиболее перспективных объектов исследования в нейробиологии в настоящее время являются малые экстраклеточные везикулы (мЭВ). К этому классу частиц относят мембранные везикулы размером до 200 нм. В состав мЭВ входят белки, липиды, нуклеиновые кислоты, низкомолекулярные метаболиты. В силу особенностей строения мЭВ не поглощаются макрофагами и могут довольно долго, по сравнению с другими наночастицами, циркулировать в крови. Принято считать, что мЭВ секретируются всеми клетками организма и осуществляют пока не выясненный во многих деталях межклеточный сигналинг. Способность этих наночастиц проникать через гематоэнцефалический барьер позволяет рассматривать их в качестве перспективных транспортных средств для переноса лекарственных препаратов в головной мозг.
Список сокращений
БА – болезнь Альцгеймера
БП – болезнь Паркинсона
ГЭБ – гематоэнцефалический барьер
РТФ – рецептор трансферрина
мЭВ – малые экстраклеточные везикулы
ЭК – эндотелиальные клетки
AMT – адсорбтивно опосредованный трансцитоз
BDNF – нейротрофический фактор мозга
BMECs – эндотелиальные клетки микрососудов головного мозга
LDL-R – рецептор липопротеинов низкой плотности
RMT – рецепторно опосредованный трансцитоз
siРНК – короткие интерферирующие РНК
Заболевания головного мозга представляют собой большую медицинскую и социальную проблему. Сложность их лечения обусловлена высокой чувствительностью мозга к повреждению и невозможностью полного восстановления нервных клеток, гибель которых начинается уже через несколько минут после кислородно-глюкозного голодания. Данные обстоятельства определяют и социальную проблему – высокую смертность и инвалидизацию как последствия повреждения головного мозга.
К настоящему времени дальше понимания лишь некоторых механизмов церебральной патологии изучение повреждений головного мозга не продвинулось. Одним из препятствий для их эффективного лечения является то, что большинство лекарств не могут преодолеть гематоэнцефалический барьер (ГЭБ), который затрудняет их эффективную доставку к клеткам головного мозга не только в условиях патологии, но и в норме.
Под термином “ГЭБ” подразумевается комплекс мелких кровеносных капилляров, плотная сеть которых осуществляет васкуляризацию мозга, при этом защищая его от повреждающих воздействий, оказываемых токсическими эндогенными и экзогенными факторами, циркулирующими в кровяном русле. На микроскопическом уровне ГЭБ состоит из однородного слоя микрососудистых эндотелиальных клеток (ЭК), соединенных между собой боковыми плотными контактами (tight junctions), которые препятствуют межклеточному переносу и/или пассивной диффузии молекул через ГЭБ, обеспечивая его высокую селективность [1]. На стороне церебральной париенхимы ЭК поддерживаются перицитами – сократительными клетками, заключенными в тонкий слой внеклеточного матрикса (базальную пластинку), и подкреплены концевыми ножками астроцитарной глии. Клетки эндотелия, перициты и астроциты в сочетании с нейронами, микроглией и олигодендроцитами образуют нейроваскулярную единицу (neurovascular unit), способствующую поддержанию гомеостаза ЦНС [1].
Таким образом, ГЭБ, вследствие специфической регуляции транспорта необходимых головному мозгу метаболитов из кровяного русла в церебральную паренхиму, выполняет функцию защиты ЦНС от разнообразных нейротоксических соединений, обеспечивая таким образом поддержание ее гомеостаза.
Однако у барьерной функции ГЭБ есть и обратная сторона, а именно, его свойства не только препятствуют проникновению в мозг вредных веществ, но и затрудняют транспорт макромолекулярных лекарственных средств, для которого часто необходимо участие специфических рецепторов и транспортных белков, локализованных непосредственно на ГЭБ. В связи со сказанным выше не будет преувеличением подчеркнуть, что в настоящее время одной из основных задач фундаментальной медицины является поиск эндогенных механизмов, способствующих целенаправленной доставке макромолекул в мозг через ГЭБ.
В последние годы появились основания считать, что одним из природных переносчиков лекарств через ГЭБ являются малые экстраклеточные везикулы (мЭВ), основными представителями которых являются экзосомы и микрочастицы. Вначале стоит отметить, что Международное общество по изучению экстраклеточных везикул рекомендует называть мЭВ любые высвобождаемые клетками мембранные структуры (экзосомы, микровезикулы, эктосомы, онкосомы, микрочастицы и т.д.) размером меньше 200 нм, если не показана их точная принадлежность к какому-то классу, например, не проведено окрашивание специфическими антителами, не проведена электронная микроскопия, преципитация за специфический антиген и т.д. [2]. Авторы рекомендаций отмечают, что точная идентификация природы экстраклеточных везикул представляет собой сложную или даже невыполнимую задачу, поэтому в настоящее время для всех невыясненных ситуаций в научной литературе рекомендуется пользоваться термином мЭВ. При этом зачастую в статьях авторы употребляют термины экзосомы и микровезикулы, не приводя доказательств происхождения этих частиц и не задумываясь о том, что неправильное употребление терминов может запутать читателя. Мы используем термин “малые экстраклеточные везикулы (мЭВ)” для обозначения частиц размером меньше 200 нм, как и рекомендовано профессиональным сообществом.
Исследования последних лет говорят, что мЭВ – действительно уникальный объект и их важность для исследования мозга сложно переоценить. Простое перечисление церебральных патологий, при которых показана диагностическая и терапевтическая значимость мЭВ, уже само по себе производит впечатление: болезнь Альцгеймера (БА) и другие формы деменции [3–7], болезнь Паркинсона (БП) [8–10], синдром Дауна [11], боковой амиотрофический склероз [12, 13], рассеянный склероз [14–16], инсульт [17–20], эпилепсия [21]. Кроме того, появляются работы о связи мЭВ со старением [22], депрессией [23–25], биполярным расстройством [26, 27], нейрогенезом [28, 29] и стрессом [30].
Такой внушительный перечень активности мЭВ определяется несколькими простыми особенностями. Во-первых, эти везикулы размером около 100 нм секретируются практически постоянно всеми клетками организма и содержат на мембране опознавательные знаки “свой/не ешь меня” для иммунной системы организма [31, 32]. Во-вторых, они способны проходить через тканевые барьеры, включая ГЭБ [33, 34]. Эти свойства позволяют мЭВ довольно долго циркулировать в крови и проникать в любые органы. Почему мЭВ содержат молекулы, характерные для физиологического состояния или патологии, остается неизвестным. Видимо, в организме существуют механизмы сигналинга с использованием мЭВ, с помощью которого клетки обмениваются информацией о возникающих патологиях [35]. Поскольку особенностью мЭВ, наиболее важной для их потенциального терапевтического применения, является способность проникать через ГЭБ, эта особенность нуждается в более подробном обсуждении.
Являясь естественным физиологическим объектом, мЭВ способны путем транс- и/или парацитоза доставлять в мозг как обычные терапевтические агенты массой порядка одного кДа, так и крупные биомакромолекулы массой сотни кДа [36–38]. Современные данные свидетельствуют о том, что мЭВ способны проходить через ГЭБ из кровяного русла как в направлении паренхимы мозга, так и обратно. Эти везикулы транспортируют и доставляют в клетки-мишени фармацевтические макромолекулы, мембранные и цитозольные белки, генетический материал (мРНК и некодирующие РНК, в том числе микроРНК), т.е. соединения, которые в свободном состоянии обычно не способны проникать через плазматическую мембрану эндотелиальных клеток (ЭК) ГЭБ [39].
Основным компонентом ГЭБ, регулирующим перенос мЭВ, являются именно ЭК. Контакт мЭВ, циркулирующих в кровяном русле, с ЭК активирует ряд механизмов, таких как фагоцитоз, эндоцитоз, микропиноцитоз, при участии которых происходит поглощение клетками мЭВ и активация их притока в ткань мозга [40]. Транспорт мЭВ через ГЭБ скорее всего является классическим примером трансцитоза. После прикрепления мЭВ к ЭК и слияния с ними содержимое мЭВ высвобождается в цитозоль ЭК, при этом взаимодействие белков мембраны мЭВ с рецепторами на поверхности ЭК приводит к формированию между мЭВ и ЭК соединений типа плотных контактов. Содержимое мЭВ, высвободившееся в ЭК, захватывается эндосомами и перемещается ими к аблюминальной поверхности ЭК [41, 42]. Концентрация мЭВ в крови является важным фактором их трансцитоза через ГЭБ, поскольку существенная доля мЭВ внутри ЭК может быть направлена на деградацию в лизосомы [43].
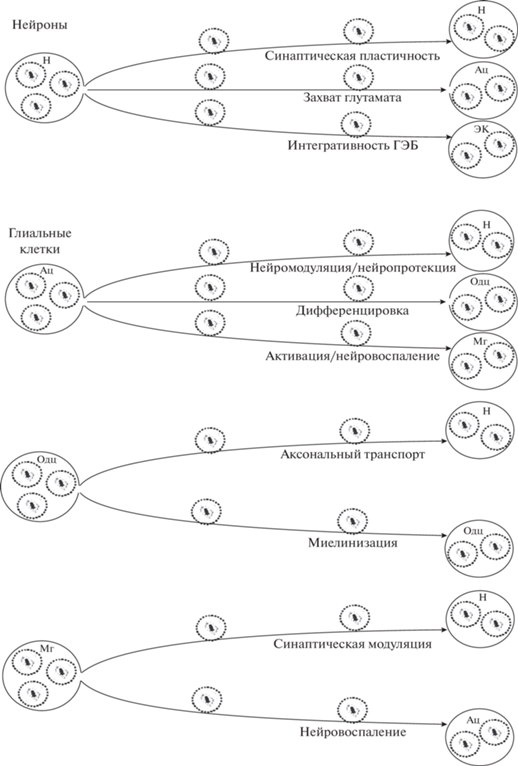
Транспорт различных соединений через ГЭБ опосредутся рядом физиологических механизмов, таких как активный эффлюкс, адсорбционно-опосредованный трансцитоз, транспорт, опосредуемый специфическими рецепторами (фолиевой кислоты, трансферрина, инсулина, глутамата, скавенджер-рецепторами и другими) [44]. Контакт с ЭК мЭВ, циркулирующих в кровяном русле, стимулирует эндоцитоз, микропиноцитоз, фагоцитоз и слияние плазматических мембран – механизмы, вовлеченные в поглощение мЭВ и ускоряющие их поступление в ткань головного мозга [40, 45, 46]. Помимо мЭВ, проникающих в мозг из крови, в самом мозге также содержатся мЭВ собственного производства [47–51], где они интенсивно секретируются различными типами глиальных клеток (астроглией, олигодендроглией, микроглией) и нейронами (рис. 1). Эти эндогенные мЭВ, захватываемые как барьерными ЭК, так и дистанционно глиальными клетками и нейронами, осуществляют организованный направленный сигналлинг между клетками мозга, поддерживая его гомеостаз [52–59].
Рис. 1.
Малые экстраклеточные везикулы нейронов и глиальных клеток доставляют через ГЭБ свою нагрузку к клеткам ЦНС, регулируя ее гомеостаз и адаптационные процессы. Н – нейроны; Ац – астроциты; Одц – олигодендроциты; Мг – микроглия; ЭК – эндотелиальные клетки.
Согласно современным представлениям, основными механизмами поступления в ткань мозга через ГЭБ экзогенных мЭВ являются трансцитоз – после тесного контакта (слияния) и интернациализации с ЭК, и, возможно, парацитоз – транспорт в ткань мозга через ГЭБ в результате проникновения мЭВ в плотные контакты между ЭК [37, 60]. После слияния и интернациализации содержимое мЭВ высвобождается в цитозоль ЭК, при этом взаимодействие белков мембраны мЭВ с рецепторами на поверхности ЭК приводит к формированию между мЭВ и ЭК соединений типа плотных контактов. Показано, что мЭВ крови, помеченые флуоресцентными красителями РНК26 и DiD (эти красители неселективно встраиваются в мембрану везикул), при инкубации с ЭК линии bEnd.3, происходящими из микрососудов мозга, проникают в эти ЭК путем трансцитоза, а затем мЭВ или высвободившееся из них содержимое захватывается эндосомами и перемещается ими к аблюминальной поверхности ЭК [41, 42, 61]. In vivo трансцитоз экзосом был показан на рыбках Danio rerio, у которых зрелый ГЭБ развивается в течение 3 дней после оплодотворения [62]. В этих экспериментах визуализация в реальном времени позволила проследить транспорт экзогенных мЭВ вплоть до их слияния с цитоплазматической мембраной ЭК.
Известны различные пути транспортировки через ГЭБ, используемые мЭВ для перемещения через барьер лекарственных препаратов, не преодолевающих его путем простой диффузии. Наиболее распространенными из них являются рецепторно-опосредованный трансцитоз (receptor-mediated transcytosis, RMT) и адсорбтивно-опосредованный трансцитоз (adsorptive-mediated transcytosis, AMT), из которых RMT позволяет наиболее эффективно транспортировать из кровяного русла через ЭК ГЭБ в ткань мозга низкомолекулярные терапевтические средства, наноразмерные частицы и т.п. в составе мЭВ. При RMT (рис. 2) участвующие в нем рецепторы активно экспрессируются на мембране ЭК микрососудов головного мозга (brain microvascular endothelial cells, BMECs), причем на наружной мембране ЭК происходит специфическое связывание транспортируемого соединения с рецептором, что инициирует эндоцитоз, с последующим переносом формирующихся эндосом, содержащих компартментализованные соединения, через ЭК в мозг [63–65]. Рецепторы, используемые мЭВ для связывания с ЭК, хорошо изучены, также давно известна способность этих рецепторов опосредовать транспорт веществ и частиц из крови в мозг через ГЭБ.
Рис. 2.
Взаимодействие малых экстраклеточных везикул, циркулирующих в кровяном русле, с рецепторами эндотелиальных клеток головного мозга при рецептор-опосредуемом трансцитозе.

Рецептор трансферрина (РТФ), гликопротеина, обеспечивающего транспорт железа в клетки головного мозга, опосредует трансцитоз в ЭК капилляров мозга мышей и человека [66, 67]. Выявлена опосредуемая РТФ доставка в мозг через ГЭБ липосом [29] и наносфер хитозана – природного полисахарида с высокой липотропной активностью [68]. Кроме того, показаны позитивные результаты направленной внутримозговой доставки конъюгированного с античеловеческим антителом к РТФ лизосомального фермента идуронат-2-сульфатазы, дефицит которого имеет место при наследственном заболевании – мукополисахаридозе II (синдроме Хантера) [69].
Рецептор липопротеинов низкой плотности (low density lipoprotein receptor, LDL-R) опосредует трансцитоз липопротеинов, обогащeнных холестерином, и представляет собой мембранный белок, специфически распознающий аполипопротеины В (APOB) и Е (APOE). Активная экспрессия LDL-R в головном мозге позволяет ему осуществлять функцию эффективного переносчика. Пептиды, полученные из АРОВ и АРОЕ, при конъюгировании с белками, например, ферментами лизосом, облегчают транспортировку белков через ГЭБ [70]. Взаимосвязь липосом и полимерсом с пептидами из АРОЕ ускоряет их опосредуемый LDL-R перенос через ГЭБ в ткань мозга путем трансцитоза в BMECs, что также характерно и для пептидов, выделенных из АРОВ [71, 72].
Рецептор инсулина и другие рецепторы. Рецептор инсулина (INS-R), опосредующий трансцитоз, экспрессируется в микрососудах головного мозга человека активнее, чем в других тканях [73]. У пациентов с мукополисахаридозом I типа показано ускорение трансцитозной доставки в мозг высокомолекулярных лекарственных средств (например, L-идуронидазы) при использовании гуманизированных антител, конъюгированных с INS-R (humanization of anti-human insulin receptor antibody, HIRMAb) [74–76], внутривенное введение которых приводило к положительным соматическим и когнитивным эффектам. Тяжелая цепь антигена поверхности клетки, обозначаемого как 4F2 (4F2 cell-surface antigen heavy chain, псевдоним – CD98hc) – гетеродимерный белок, который активно экспрессируется на мембранах BMECs человека и мыши, связывая аминокислоты и транспортируя их через ГЭБ [66, 67, 77]. Транспортер глюкозы GLUT1 – однонаправленный белковый переносчик глюкозы, кодируемый у человека геном SLC2A1 – обеспечивает облегченный транспорт глюкозы через плазматическую мембрану, в том числе, клеток BMECs, на мембране которых он активно экспрессируется, и способствует переносу в ткань мозга через ГЭБ наночастиц типа липосом и мицелл [78, 79].
В эксперименте не всегда можно обнаружить, какими рецепторами опосредуется проникновение мЭВ через ГЭБ. Тем не менее, оно происходит, скорее всего, путем трансцитоза, что было показано неоднократно. В модели ишемического инсульта у мышей экстраклеточные везикулы, в том числе мЭВ, из нейрональных стволовых клеток по сравнению с везикулами из мезенхимальных стволовых клеток, более эффективно достигали паренхимы мозга через ГЭБ [80]. У рыбок Danio rerio нагруженные цитостатическим антибиотиком доксорубицином мЭВ из ВMЕСs или клеток опухоли мозга доставляли содержимое к клеткам опухоли [81]. В этой работе в эмбрионы рыбки через кардинальную вену вводили мЭВ, нагруженные флуоресцентным красителем родамином-123, а затем его флуоресценцию регистрировали в кровяном русле. Одновременно было показано, что родамин-123 сам по себе, вне мЭВ, в паренхиму мозга не проникал. С другой стороны, меченые родамином-123 мЭВ из ЭК линии bEND.3 активно проникали в структуры мозга, подтверждая способность этих носителей доставлять лекарственные средства в терапевтических целях через ГЭБ.
Из внеклеточного пространства мЭВ интернационализируются клетками-реципиентами путем различных механизмов: эндоцитоза, микропитоза, фагоцитоза, захвата плазматической мембраной. Результаты ряда работ допускают, что основным механизмом транспорта мЭВ внутрь ЭК может быть эндоцитоз [82]. Следует отметить, что эндоцитоз облегчается патологическими состояниями, что было показано в отношении мЭВ из макрофагов на моделях in vivo и in vitro. В модели ишемического инсульта in vitro мЭВ, нагруженные люциферазой, значительно интенсивнее, чем в норме, пересекали монослой BMECs [83]. Проникновение мЭВ в клетки происходило путем эндоцитоза, хотя сравнительно небольшое количество везикул все же преодолевало монослой BMECs параклеточным путем, в результате пассивной диффузии через межклеточные контакты между этими клетками. В модели воспаления у мышей внутривенно введенные мЭВ из наивных макрофагов (naive macrophage) преодолевали ГЭБ путем трансцитоза, и в условиях воспаления делали это более эффективно, чем в норме, доставляя в мозг BDNF [84]. Таким образом, макрофагальные мЭВ являются возможными перспективными переносчиками через ГЭБ в мозг лекарственных соединений в условиях церебральной патологии. При этом процесс эндоцитозной интернализации мЭВ в ЭК зависит от типа клеток, которые секретировали мЭВ. Как считается, мЭВ, будучи секретированы различными клетками, несут различную нагрузку, в том числе белки и липиды. Кроме того, мЭВ из разных клеток используют разные способы проникновения через ГЭБ, а эффективность этого проникновения, в свою очередь, может зависеть от характера патологического состояния мозга [85].
Помимо эндоцитоза, проницаемость ГЭБ для мЭВ опосредуется, как полагают, еще одним механизмом. Так, показано, что мЭВ из клеток рака молочной железы содержат микроРНК miR-105, снижающую целостность ГЭБ за счет непосредственного воздействия на белок ZO-1, основной молекулярный компонент плотных контактов между BMECs [86]. Похожий эффект оказывали мЭВ из нормальных стволовых клеток пульпы зуба, повышая проницаемость микрокапилляров на начальной стадии острого воспаления [87]. Кроме того, проницаемость ГЭБ значительно возрастает при цереброваскулярных заболеваниях, что позволяет проходить через него макромолекулярным соединениям белковой природы [88]. В культуре клеток головного мозга грызунов и на интактных зародышах рыбки Danio rerio показана возможность поддержания целостности ГЭБ нейрональными мЭВ, содержащими микроРНК miR-132, путем интернализиция этих мЭВ в BMECs и переноса таким образом miR-132 в BMECs [89]. После этого miR-132 воздействует непосредственно на кальций/кальмодулин-зависимую киназу эукариотического фактора элонгации 2 (eukaryotic elongation factor 2 kinase, eef2k), регулируя экспрессию васкулярного эндотелиального кадгерина, важного фактора, укрепляющего плотные контакты. Таким образом, мЭВ, несущие miR-132, могут поддерживать целостность церебральных сосудов, в отдельных случаях способствуя терапии неврологических заболеваний.
В терапии БП использовали мЭВ, нагруженные антиоксидантным белком каталазой и проходившие через ГЭБ после интраназального введения [90]. Чтобы преодолеть ГЭБ, мЭВ модифицировали с использованием мозгонаводящихся пептидов (brain homing peptides), направленных на связывание с эндотелием ГЭБ. Кроме того, полученные из наивных макрофагов мЭВ содержат поверхностные белки (антиген 1, ассоциированный с функцией лимфоцитарного интегрина (LFA-1), внутриклеточные молекулы адгезии (ICAM 1), углевод-связывающие рецепторы лецитина С-типа), которые также связываются с BMECs [84]. ЭК капилляров мозга эспрессируют на своей поверхности рецепторы трансферрина (РТФ), поэтому декорирование мЭВ трансферрином в качестве лиганда этих рецепторов облегчало транспорт таких мЭВ через ГЭБ путем трансцитоза [91]. Усиление экспрессии РТФ на BMECs при инсульте стимулировало перенос энкефалина в мозг с помощью мЭВ, проникающих через ГЭБ [92]. Декорированные фолатом мЭВ также направляются в паренхиму мозга через ГЭБ при участии эндоцитоза, связываясь с экспрессируемыми на BMECs ГЭБ рецепторами фолиевой кислоты [60]. Нацеливания лекарственных средств на ЭК ГЭБ можно добиться с помощью полученных из мезенхимальных стволовых клеток мЭВ, модифицированных гликопротеином вируса бешенства (RVG). Такие мЭВ взаимодействуют с рецепторами ацетилхолина, присутствующими на поверхности ЭК ГЭБ [93].
Все вышесказанное указывает на то, что мЭВ представляют собой эффективные переносчики нейротропных фармацевтических соединений благодаря способности проникать через биологические барьеры (в том числе ГЭБ). Однако оптимизация процесса поступления мЭВ в паренхиму мозга через ГЭБ является непростой задачей. Чтобы способствовать более эффективной доставке мЭВ в мозг с использованием трансцитоза, мЭВ приходится подвергать дополнительным усовершенствованиям, используя методы прямой биохимической или физической модификации мембранных поверхностей, а также модификации с помощью генной инженерии клеток, продуцирующих мЭВ [94–96].
С помощью методов генной инженерии можно создать в клетках фабрики по производству мЭВ заранее спроектированной конструкции, да еще к тому же нагруженных определенными белками. Например, показана возможность доставлять короткую интерферирующую РНК (short interfering РНК, siРНК) в мозг мыши с помощью мЭВ [97]. Для снижения иммуногенности мЭВ авторы получали их из дендритных клеток тех же животных. Путем генетического инжиниринга достигалась совместная экспрессия мембранного белка экзосом Lamp2b и пептида нейрон-специфического гликопротеина вируса бешенства (Rabies Virus Glycoprotein (RVG)-peptide) в дендритных клетках. Затем очищенные мЭВ нагружали siРНК к специфичной для клеток головного мозга изоформе GAPDH (глицеральдегид-3 фосфат дегидрогеназе) и вводили внутривенно, что приводило к нокдауну специфического гена этого белка. В результате достигалось значительное снижение экспрессии бета секретазы BACE1 – терапевтической мишени при моделировании БА у мышей.
Биохимический инжиниринг мЭВ, по сравнению с генетическим, проще, оперативнее и не требует долговременных модификаций клеток-продуцентов [89]. Активный RMT в мозг инициировали, модифицируя поверхность ЭкС несколькими биохимическими способами [98]. Для этой цели использовали, в частности, пептид Т7, способный взаимодействовать с РТФ, не нарушая его связи с трансферрином [91]. После конъюгирования пептида Т7 с Lamp2b (белком экзосомной мембраны) модифицированные таким образом мЭВ после внутривенного введения гораздо активнее, чем немодифицированные, достигали клеток внутричерепной глиобластомы у крыс. Для другого вида RMT, с участием LDL-R, использовали мЭВ, меченые АРОВ путем его конъюгирования с тетраспанином CD9, трансмембранным белком, экспрессируемым на мембране мЭВ [95]. Для идентификации мЭВ, как связанных, так и не связанных с АРОВ (CD9 и CD9-APOB), использовали, соответственно, флуоресцентные зонды с зеленой (DiD) и голубой (DiO) флуоресценцией. Оказалось, что после внутривенного введения в коре головного мозга мышей интенсивно накапливаются и длительно удерживаются мЭВ CD9-APOB, тогда как мЭВ CD9 не обнаруживаются.
Физический инжиниринг сохраняет химическую стабильность поверхности модифицируемых мЭВ, используя ультразвук и электропорацию, которые стимулируют нагрузку этих наночастиц терапевтическим материалом и не изменяют их биологических свойств [99, 100]. В одной из работ с целью оптимизации целенаправленной доставки в мозг наночастицы золота (AuNPs) комбинировали с нейрон-ориентироваными мЭВ, полученными из подвергнутых генетической инженерии клеток линии НЕК293Т. Такие модифицированные комплексы успешно связывались с клетками мозга in vitro и активно проникали через ГЭБ, накапливаясь в мозге мыши после внутривенного введения [101].
Следует отметить, что мЭВ из мезенхимальных стволовых и иммунных клеток могут проходить сквозь ГЭБ и без модификации их поверхности. Так, мЭВ из гипоксической клеточной линии глиобластомы U87 способствуют пролиферации BMECs и вызывают повышение проницаемости ГЭБ, опосредуемое сосудистым эндотелиальным ростовым фактором-А (VEGF-A) вследствие уменьшения экспрессии белков плотных межклеточных контактов клаудина-5 и окклюдина [102]. Полагают, что мЭВ, несущие только определенный поверхностный белок интегрин, проникают через ГЭБ и эффективно воздействуют на ткани опухоли. Показано пересечение ГЭБ мЭВ, модифицированными целевым пептидом нейропилин-1-аргинин-глицин-глутаминовой кислотой (RGE) [103]. То же показано относительно нагруженных куркумином мЭВ, конъюгированных с аргинил-глицил-аспарагиновой кислотой (RGD), при лечении ишемии головного мозга [104]. Обнаружено, что тетраспанин CD9 на поверхности мЭВ взаимодействует с поверхностным гликопротеином на клетках-мишенях и способствует слиянию мЭВ с клеточной мембраной, ускоряя прямую цитозольную доставку гена [105]. Кроме того, предполагают, что мЭВ, компартментализуясь в мультивезикулярные тельца и перемещаясь в них от одной клетки к другой, могут проходить через несколько уровней ГЭБ [82, 106].
Все сказанное выше подтверждает обоснованность попыток использования мЭВ в качестве транспортного средства нового поколения. Все исследованные на настоящий момент наноразмерные частицы (липосомы, наномицеллы, наночастицы металлов и т.д.) были каждая в свое время отличными кандидатами на роль переносчиков лекарственных препаратов через ГЭБ. Однако по разным причинам разработка этих нанокандидатов к полномасштабному прорыву в этой области не привела. Попытки найти новые необычные средства доставки лекарств в мозг еще продолжаются, но, кажется, мЭВ способны полностью удовлетворить все потребности в транспортных средствах типа кровь–мозг. Отличительные качества мЭВ хорошо известны. Эти частицы имеют биологическое происхождение и не вызывают ответа макрофагов в организме. Они содержат на мембране лиганды, позволяющие связываться с ЭК ГЭБ. Уникальные свойства мЭВ, окончательно еще не выясненные, позволяют им проходить сквозь слой ЭК. Так что не стоит удивляться, если в самое ближайшее время появятся лекарственные препараты на основе или с использованием мЭВ в качестве транспортеров в мозг. А самые мотивированные оптимисты могут надеяться, что такие препараты откроют новую эру в лечении заболеваний головного мозга.
Список литературы
Busatto S., Morad G., Guo P., Moses M.A. // FASEB Bioadv. 2021. V. 3. P. 665–675.
Théry C., Witwer K.W., Aikawa E., Alcaraz M.J., Anderson J.D., Andriantsitohaina R., Antoniou A., Arab T., Archer F., Atkin-Smith G.K. et al. // J. Extracell. Ves. 2018. V. 7. № 1. 1535750
Kapogiannis D., Mustapic M., Shardell M.D., Berkowitz S.T., Diehl T.C., Spangler R.D., Tran J., Lazaropoulos M.P., Chawla S., Gulyani S. // JAMA Neurology. 2019. V. 76. № 11. P. 1340–1351.
Mustapic M., Eitan E., Werner J.K., Berkowitz S.T., Lazaropoulos M.P., Tran J., Goetzl E.J., Kapogiannis D. // Front. Neurosci. 2017. V. 11. 278.
Winston C.N., Goetzl E.J., Akers J.C., Carter B.S., Rockenstein E.M., Galasko D., Masliah E., Rissman R.A. // Alzheimer’s and Dementia: Diagnosis, Assessment and Disease Monitoring. 2016. V. 3. P. 63–72.
Goetzl E.J., Kapogiannis D., Schwartz J.B., Lobach I.V., Goetzl L., Abner E.L., Jicha G.A., Karydas A.M., Boxer A., Miller B.L. // FASEB J. 2016. V. 30. № 12. P. 4141–4148.
Fiandaca M.S., Kapogiannis D., Mapstone M., Boxer A., Eitan E., Schwartz J.B., Abner E.L., Petersen R.C., Federoff H.J., Miller B.L. // Alzheimer’s Dem. 2015. V. 11. № 6. P. 600–607.
Ardashirova N.S., Fedotova E.Yu., Illarioshkin S.N. // Neurochem. J. 2020. V. 14. № 2. P. 127-132.
Shi M., Liu C., Cook T.J., Bullock K.M., Zhao Y., Ginghina C., Li Y., Aro P., Dator R., He C. // Acta Neuropath. 2014. V. 128. № 5. P. 639–650.
Shi M., Kovac A., Korff A., Cook T.J., Ginghina C., Bullock K.M., Yang L., Stewart T., Zheng D., Aro P. // Alzheimer’s & Dementia. 2016. V. 12. № 11. P. 1125–1131.
Hamlett E.D., Goetzl E.J., Ledreux A., Vasilevko V., Boger H.A., LaRosa A., Clark D., Carroll S.L., Carmona-Iragui M., Fortea J. // Alzheimer’s & Dementia. 2017. V. 13. № 5. P. 541–549.
Sproviero D., la Salvia S., Giannini M., Crippa V., Gagliardi S., Bernuzzi S., Diamanti L., Ceroni M., Pansarasa O., Poletti A. // Front. Neurosci. 2018. V. 12. 487.
Ivanova M.V., Chekanova E.O., Belugin B.V., Dolzhikova I.V, Tutykhina I.L., Zakharova M.N. // Neurochem. J. 2020. V. 14. № 3. P. 321–327.
Martinez B., Peplow P.V. // Neural Regeneration Res. 2020. V. 15. № 4. P. 606–619.
Mycko M.P., Baranzini S.E. // Mult. Sclerosis J. 2020. V. 26. № 5. P. 599–604.
Ebrahimkhani S., Beadnall H.N., Wang C., Suter C.M., Barnett M.H., Buckland M.E., Vafaee F. // Mol. Neurobiol. 2020. V. 57. № 2. P. 1245–1258.
Xin H., Wang F., Li Y., Lu Q.-E., Cheung W.L., Zhang Y., Zhang Z.G., Chopp M. // Cell Transpl. 2017. V. 26. № 2. P. 243–257.
Chen Y., Song Y., Huang J., Qu M., Zhang Y., Geng J., Zhang Z., Liu J., Yang G.-Y. // Front. Neurol. 2017. V. 8. 57.
Song Y., Li Z., He T., Qu M., Jiang L., Li W., Shi X., Pan J., Zhang L., Wang Y. // Theranostics. 2019. V. 9. № 10. P. 2910–2923.
Yakovlev A.A. // Neurochem. J. 2022. V. 16. № 2. P. 121–129.
Choi J., Kim S.Y., Kim H., Lim B.C., Hwang H., Chae J.H., Kim K.J., Oh S., Kim E.Y., Shin J.-S. // BMC Neurol. 2020. V. 20. № 1. P. 85.
Kumar S., Vijayan M., Bhatti J.S., Reddy P.H. // Prog. Mol. Biol. Transl. Sci. 2017. 146:47-94.
Nasca C., Dobbin J., Bigio B., Watson K., de Angelis P., Kautz M., Cochran A., Mathé A.A., Kocsis J.H., Lee F.S. // Mol. Psychiatry. 2021. V. 26. № 9. P. 5140–5149.
Gruzdev S.K., Yakovlev A.A., Druzhkova T.A., Guekht A.B., Gulyaeva N.V. // Cell. Mol. Neurobiol. 2019. V. 39. № 6. P. 729–750
Yakovlev A.A., Druzhkova T.A., Nikolaev R.V., Kuznetsova V.E., Gruzdev S.K., Guekht A.B., Gulyaeva N.V. // Neurochem. J. 2019. V. 13. № 4. P. 385–390.
Ceylan D., Tufekci K.U., Keskinoglu P., Genc S., Ozerdem A. // J. Affect. Dis. 2020. V. 262. P. 99–107.
Amoah S.K., Rodriguez B.A., Logothetis C.N., Chander P., Sellgren C.M., Weick J.P., Sheridan S.D., Jantzie L.L., Webster M.J., Mellios N. // Neuropsychopharmacology. 2020. V. 45. № 4. P. 656–665.
Ma Y., Li C., Huang Y., Wang Y., Xia X., Zheng J.C. // Cell Comm. Signal. 2019. V. 17. № 1. 96.
Sharma G., Modgil A., Layek B., Arora K., Sun C., Law B., Singh J. // J. Control. Release. 2013. V. 167. № 1. P. 1–10.
Gómez-Molina C., Sandoval M., Henzi R., Ramírez J.P., Varas-Godoy M., Luarte A., Lafourcade C.A., Lopez-Verrilli A., Smalla K.H., Kaehne T. // Int. J. Neuropsychopharmacol. 2019. V. 22. № 3. P. 232–246
Belhadj Z., He B., Deng H., Song S., Zhang H., Wang X., Dai W., Zhang Q. // J. Extracell. Ves. 2020. V. 9. № 1. 1806444.
Kamerkar S., Lebleu V.S., Sugimoto H., Yang S., Ruivo C.F., Melo S.A., Lee J.J., Kalluri R. // Nature. 2017. V. 546. № 7659. P. 498–503
Shi M., Sheng L., Stewart T., Zabetian C.P., Zhang J. // Prog. Neurobiol. 2019. V. 175. P. 96–106.
Banks W.A., Sharma P., Bullock K.M., Hansen K.M., Ludwig N., Whiteside T.L. // Int. J. Mol. Sci. 2020. V. 21. № 12. P. 1–21.
Tkach M., Théry C. // Cell. 2016. V. 164. № 6. P. 1226–1232.
Patil S.M., Sawant S.S., Kunda N.K. // Eur. J. Pharm. Biopharm. 2020. V. 154. P. 259–269.
Heidarzadeh M., Gürsoy-Özdemir Y., Kaya M., Eslami Abriz A., Zarebkohan A., Rahbarghazi R., Sokullu E. // Cell Biosci. 2021. V. 11. № 1. 142.
Dardet J.P., Serrano N., András I.E., Toborek M. // Front. Drug Deliv. 2022. V. 2.
Kalluri R., LeBleu V.S. // Science. 2020. V. 367. № 6478. eaau6977.
Matsumoto J., Stewart T., Banks W.A., Zhang J. // Curr. Pharm. Des. 2017. V. 23. № 40. P. 6206–6214.
Tian T., Zhu Y.-L., Hu F.-H., Wang Y.-Y., Huang N.-P., Xiao Z.-D. // J. Cell. Physiol. 2013. V. 228. № 7. P. 1487–1495.
Toth A.E., Holst M.R., Nielsen M.S. // Curr. Pharm. Des. 2020. V. 26. № 13. P. 1405–1416.
Haqqani A.S., Thom G., Burrell M., Delaney C.E., Brunette E., Baumann E., Sodja C., Jezierski A., Webster C., Stanimirovic D.B. // J. Neurochem. 2018. V. 146. № 6. P. 735–752.
Patel M.M., Patel B.M. // CNS Drugs. 2017. V. 31. № 2. P. 109–133.
Banks W.A., Sharma P., Bullock K.M., Hansen K.M., Ludwig N., Whiteside T.L. // Int. J. Mol. Sci. 2020. V. 21. № 12. P. 1–21.
Saint-Pol J., Gosselet F., Duban-Deweer S., Pottiez G., Karamanos Y. // Cells. 2020. V. 9. № 4. 851.
Krämer-Albers E.-M., Bretz N., Tenzer S., Winterstein C., Möbius W., Berger H., Nave K.-A., Schild H., Trotter J. // Proteomics Clin. Appl. 2007. V. 1. № 11. P. 1446–1461.
Wang G., Dinkins M., He Q., Zhu G., Poirier C., Campbell A., Mayer-Proschel M., Bieberich E. // J. Biol. Chem. 2012. V. 287. № 25. P. 21384–21395.
Xin H., Li Y., Buller B., Katakowski M., Zhang Y., Wang X., Shang X., Zhang Z.G., Chopp M. // Stem Cells. 2012. V. 30. № 7. P. 1556–1564.
Zhang Y., Kim M.S., Jia B., Yan J., Zuniga-Hertz J.P., Han C., Cai D. // Nature. 2017. V. 548. № 7665. P. 52–57.
Fitzner D., Schnaars M., van Rossum D., Krishnamoorthy G., Dibaj P., Bakhti M., Regen T., Hanisch U.-K., Simons M. // J. Cell Sci. 2011. V. 124. № 3. P. 447–458.
Frühbeis C., Fröhlich D., Kuo W.P., Amphornrat J., Thilemann S., Saab A.S., Kirchhoff F., Möbius W., Goebbels S., Nave K.-A. // PLoS Biol. 2013. V. 11. № 7. e1001604.
Morel L., Regan M., Higashimori H., Ng S.K., Esau C., Vidensky S., Rothstein J., Yang Y. // J. Biol. Chemistry. 2013. V. 288. № 10. P. 7105–7116.
Frühbeis C., Fröhlich D., Kuo W.P., Krämer-Albers E.-M. // Front. Cell. Neurosci. 2013. V. 7. 182.
Budnik V., Ruiz-Cañada C., Wendler F. // Nat. Rev. Neurosci. 2016. V. 17. № 3. P. 160–172.
Fitzner D., Schnaars M., van Rossum D., Krishnamoorthy G., Dibaj P., Bakhti M., Regen T., Hanisch U.-K., Simons M. // J. Cell Sci. 2011. V. 124. № 3. P. 447–458.
Budnik V., Ruiz-Cañada C., Wendler F. // Nat. Rev. Neurosci. 2016. V. 17. № 3. P. 160–172.
Fauré J., Lachenal G., Court M., Hirrlinger J., Chatellard-Causse C., Blot B., Grange J., Schoehn G., Goldberg Y., Boyer V. // Mol. Cell. Neurosci. 2006. V. 31. № 4. P. 642–648.
Zhang J., Li S., Li L., Li M., Guo C., Yao J., Mi S. // Genom. Proteom. Bioinform. 2015. V. 13. № 1. P. 17–24.
Shetgaonkar G.G., Marques S.M., DCruz C.E.M., Vibhavari R.J.A., Kumar L., Shirodkar R.K. // Drug Deliv. Transl. Res. 2022. V. 12. № 5. P. 1047–1079.
Qu M., Lin Q., Huang L., Fu Y., Wang L., He S., Fu Y., Yang S., Zhang Z., Zhang L. // J. Control. Release. 2018. V. 287. P. 156–166.
Morad G., Carman C.V., Hagedorn E.J., Perlin J.R., Zon L.I., Mustafaoglu N., Park T.-E., Ingber D.E., Daisy C.C., Moses M.A. // ACS Nano. 2019. V. 13. № 12. P. 13853–13865.
Pulgar V.M. // Front. Neurosci. 2019. V. 12. 1019
Terstappen G.C., Meyer A.H., Bell R.D., Zhang W. // Nat. Rev. Drug Discov. 2021. V. 20. № 5. P. 362–383.
Azarmi M., Maleki H., Nikkam N., Malekinejad H. // Int. J. Pharm. 2020. V. 586. 119582.
Uchida Y., Ohtsuki S., Katsukura Y., Ikeda C., Suzuki T., Kamiie J., Terasaki T. // J. Neurochem. 2011. V. 117. № 2. P. 333–345.
Zuchero Y.J.Y., Chen X., Bien-Ly N., Bumbaca D., Tong R.K., Gao X., Zhang S., Hoyte K., Luk W., Huntley M.A. // Neuron. 2016. V. 89. № 1. P. 70–82.
Karatas H., Aktas Y., Gursoy-Ozdemir Y., Bodur E., Yemisci M., Caban S., Vural A., Pinarbasli O., Capan Y., Fernandez-Megia E. // J. Neurosci. 2009. V. 29. № 44. P. 13761–13769.
Sonoda H., Morimoto H., Yoden E., Koshimura Y., Kinoshita M., Golovina G., Takagi H., Yamamoto R., Minami K., Mizoguchi A. // Mol. Ther. 2018. V. 26. № 5. P. 1366–1374.
Spencer B.J., Verma I.M. // Proc Natl Acad Sci U S A. 2007. V. 104. № 18. P. 7594–7599.
Wagner S., Zensi A., Wien S.L., Tschickardt S.E., Maier W., Vogel T., Worek F., Pietrzik C.U., Kreuter J., von Briesen H. // PLoS One. 2012. V. 7. № 3. e32568.
Spencer B., Trinh I., Rockenstein E., Mante M., Florio J., Adame A., El-Agnaf O.M.A., Kim C., Masliah E., Rissman R.A. // Neurobiol. Dis. 2019. V. 127. P. 163–177.
Zhang W., Liu Q.Y., Haqqani A.S., Leclerc S., Liu Z., Fauteux F., Baumann E., Delaney C.E., Ly D., Star A.T. // Fluids Barriers CNS. 2020. V. 17. № 1. 47.
Pardridge W.M., Kang Y.-S., Buciak J.L., Yang J. // Pharm. Res. 1995. V. 12. № 6. P. 807–816.
Boado R.J., Pardridge W.M. // Mol. Pharmaceutics. 2017. V. 14. № 4. P. 1271–1277.
Pardridge W.M., Boado R.J., Giugliani R., Schmidt M. // BioDrugs. 2018. V. 32. № 2. P. 169–176.
Feral C.C., Nishiya N., Fenczik C.A., Stuhlmann H., Slepak M., Ginsberg M.H. // Proc Natl Acad Sci U S A. 2005. V. 102. № 2. P. 355–360.
Xie F., Xie F., Qin, Yuan, Tang, Zhang, Fan, Chen, Hai, Yao, et al. // Int. J. Nanomedicine. 2012. V. 7. P. 163–175.
Guo Y., Zhang Y., Li J., Zheng Y., Lu Y., Jiang X., He X., Ma H., An S., Jiang C. // ACS Appl. Mater. Interfaces. 2015. V. 7. № 9. P. 5444–5453.
Webb R.L., Kaiser E.E., Scoville S.L., Thompson T.A., Fatima S., Pandya C., Sriram K., Swetenburg R.L., Vaibhav K., Arbab A.S. // Transl. Stroke Res. 2018. V. 9. № 5. P. 530–539.
Yang T., Martin P., Fogarty B., Brown A., Schurman K., Phipps R., Yin V.P., Lockman P., Bai S. // Pharm. Res. 2015. V. 32. № 6. P. 2003–2014.
Record M., Subra C., Silvente-Poirot S., Poirot M. // Biochem. Pharmacol. 2011. V. 81. № 10. P. 1171–1182.
Chen C.C., Liu L., Ma F., Wong C.W., Guo X.E., Chacko J.V., Farhoodi H.P., Zhang S.X., Zimak J., Ségaliny A. // Cell. Mol. Bioengineering. 2016. V. 9. № 4. P. 509–529.
Yuan D., Zhao Y., Banks W.A., Bullock K.M., Haney M., Batrakova E., Kabanov A.V. // Biomaterials. 2017. V. 142. P. 1–12.
Hu G.W., Li Q., Niu X., Hu B., Liu J., Zhou S.M., Guo S.C., Lang H.L., Zhang C.Q., Wang Y. // Stem Cell Res. Ther. 2015. V. 6. № 1. 10.
Zhou W., Fong M.Y., Min Y., Somlo G., Liu L., Palomares M.R., Yu Y., Chow A., O’Connor S., Chin A.R. // Cancer Cell. 2014. V. 25. № 4. P. 501-515.
Pivoraitė U., Jarmalavičiūtė A., Tunaitis V., Ramanauskaitė G., Vaitkuvienė A., Kašėta V., Biziulevičienė G., Venalis A., Pivoriūnas A. // Inflammation. 2015. V. 38. № 5. P. 1933–1941.
Wardlaw J.M., Doubal F.N., Valdes-Hernandez M., Wang X., Chappell F.M., Shuler K., Armitage P.A., Carpenter T.C., Dennis M.S. // Stroke. 2013. V. 44. № 2. P. 525–527.
Xu B., Zhang Y., Du X.-F., Li J., Zi H.-X., Bu J.-W., Yan Y., Han H., Du J.-L. // Cell Res. 2017. V. 27. № 7. P. 882–897.
Haney M.J., Klyachko N.L., Zhao Y., Gupta R., Plotnikova E.G., He Z., Patel T., Piroyan A., Sokolsky M., Kabanov A.V. // J. Control. Release. 2015. V. 207. P. 18–30.
Kim G., Kim M., Lee Y., Byun J.W., Hwang D.W., Lee M. // J. Control. Release. 2020. V. 317. P. 273–281.
Liu Y., Fu N., Su J., Wang X., Li X. // BioMed Res. Int. 2019. V. 2019. 4273290.
Cui G.-H., Wu J., Mou F.-F., Xie W.-H., Wang F.-B., Wang Q.-L., Fang J., Xu Y.-W., Dong Y.-R., Liu J.-R. // FASEB J. 2018. V. 32. № 2. P. 654–668.
Xu M., Feng T., Liu B., Qiu F., Xu Y., Zhao Y., Zheng Y. // Theranostics. 2021. V. 11. № 18. P. 8926–8944.
Choi H., Choi K., Kim D.-H., Oh B.-K., Yim H., Jo S., Choi C. // Pharmaceutics. 2022. V. 14. № 3. 672.
Malekian F., Shamsian A., Kodam S.P., Ullah M. // J. Physiol. 2022. May 16. https://doi.org/10.1113/JP282799
Alvarez-Erviti L., Seow Y., Yin H., Betts C., Lakhal S., Wood M.J.A. // Nat. Biotechnol. 2011. V. 29. № 4. P. 341–345.
Salunkhe S., Dheeraj, Basak M., Chitkara D., Mittal A. // J. Control. Release. 2020. V. 326. P. 599–614.
Gopalan D., Pandey A., Udupa N., Mutalik S. // J. Control. Release. 2020. V. 319. P. 183–200.
Xu R., Greening D.W., Chen M., Rai A., Ji H., Takahashi N., Simpson R.J. // Proteomics. 2019. V. 19. № 8. e1900121.
Khongkow M., Yata T., Boonrungsiman S., Ruktanonchai U.R., Graham D., Namdee K. // Sci. Rep. 2019. V. 9. № 1. 8278.
Zhao C., Wang H., Xiong C., Liu Y. // Biochem. Biophys. Res. Commun. 2018. V. 502. № 3. P. 324–331.
Jia G., Han Y., An Y., Ding Y., He C., Wang X., Tang Q. // Biomaterials. 2018. V. 178. P. 302–316.
Tian T., Zhang H.X., He C.P., Fan S., Zhu Y.L., Qi C., Huang N.P., Xiao Z.D., Lu Z.H., Tannous B.A. // Biomaterials. 2018. V. 150. P. 137–149.
Alyautdin R., Khalin I., Nafeeza M.I., Haron M.H., Kuznetsov D. // Int. J. Nanomedicine. 2014. V. 9. № 1. P. 795–811.
El-Andaloussi S., Lee Y., Lakhal-Littleton S., Li J., Seow Y., Gardiner C., Alvarez-Erviti L., Sargent I.L., Wood M.J.A. // Nat. Prot. 2012. V. 7. № 12. P. 2112–2126.
Дополнительные материалы отсутствуют.
Инструменты
Нейрохимия


