Неорганические материалы, 2021, T. 57, № 9, стр. 962-967
Активность гидроксильных групп на поверхности твердых оксидов в процессах атомно-слоевого осаждения
Ю. К. Ежовский *
Санкт-Петербургский государственный технологический институт (технический университет)
190013 Санкт-Петербург, Московский пр., 26, Россия
* E-mail: ezhovski1@mail.ru
Поступила в редакцию 25.03.2020
После доработки 08.04.2021
Принята к публикации 29.04.2021
Аннотация
Показана возможность использования значений индуктивных постоянных для количественной оценки реакционной способности гидроксильных групп на поверхности некоторых твердых оксидов при синтезе наноструктур методом молекулярного наслаивания (атомно-слоевого осаждения). Показано, что полное протекание реакции на поверхности возможно, если гидроксильные группы имеют бóльшую индуктивную постоянную, чем активная группа реагента. Приводятся обоснование выбранного подхода и экспериментальные результаты для твердых оксидов кремния, алюминия, магния, титана и бериллия.
ВВЕДЕНИЕ
Развитие атомно-слоевого осаждения (молекулярного наслаивания) как одного из методов нанотехнологии [1, 2], а также прогнозирование условий синтеза поверхностных наноструктур, используемых для модифицирования таких предкерамических матриц, как оксиды кремния, алюминия, магния, титана и бериллия, предусматривают количественную оценку реакционной способности поверхностных гидроксильных групп. Одним из таких подходов является система корреляционного анализа, базирующаяся на принципе линейности свободных энергий (ЛСЭ) и успешно используемая в химии высокомолекулярных соединений [3]. В соответствии с этим принципом, реакционную способность можно прогнозировать в пределах серии изоструктурных соединений с использованием эмпирических или экспериментально определяемых констант.
Согласно остовной модели строения твердых веществ и развитой на ее основе химии надмолекулярных соединений [4, 5], любые химические превращения на их поверхности могут рассматриваться как полимераналогичные. В этом случае подход, основанный на применении принципа ЛСЭ и системы корреляционного анализа в химии твердых тел, может стать базисом для создания количественной теории поверхностных реакций. Перспективность такого подхода для количественной оценки реакционной способности гидроксильных групп на поверхности монокристаллического кремния в процессах молекулярного наслаивания была показана ранее [6].
Цель данной работы – изучение возможности использования такого подхода для количественной оценки реакционной способности гидроксильных групп на поверхности дисперсных матриц на примере ряда твердых оксидов. В работе использовались выпускаемые промышленностью диоксид кремния (А-175), оксид алюминия (γ-Al2O3), диоксид титана (анатаз), оксид цинка, оксид бериллия и оксид магния (все квалификации “ч. д. а.”).
ТЕОРЕТИЧЕСКИЙ АНАЛИЗ
В соответствии с остовной концепцией строения твердых тел [4], любое твердое вещество представляется как совокупность химически инертного остова (X) и реакционно-способных функциональных групп поверхности (Y) (например, –ОН). Способность остова как заместителя к тому или иному типу взаимодействия количественно характеризуется соответствующей константой, численное значение которой носит относительный характер, т.е. позволяет оценить воздействие данного заместителя относительно эталонного. Это позволяет в рамках формального подхода применять принцип ЛСЭ для различных твердых веществ, имеющих однотипные функциональные группы, и использовать линейные соотношения типа
где А – любая коррелируемая величина (например, константа скорости K или lgK); α – коэффициент пропорциональности, отражающий чувствительность реакционного центра к воздействию заместителя в данной реакции. Индексы Y и X относятся соответственно к реакционному центру (функциональной группе) Y и твердому остову Х.Качественная интерпретация реакционной способности соединения Xi–Y заключается в выявлении механизма воздействия остова Xi на реакционный центр (функциональную группу) Y. Установлено [3], что основной вклад вносят индуктивный, стерический, резонансный и другие эффекты. Так, эффективную электроотрицательность Xi обычно характеризуют индуктивной константой (σi), которая отражает суммарный индуктивный эффект и полярный резонанс этого заместителя. Наиболее распространенная концепция индуктивного эффекта – внутримолекулярная поляризация, вызванная заряженной или электроотрицательной группой и передаваемая по цепочке связей.
Влияние остова твердого тела, а точнее поверхностной группировки его атомов, можно охарактеризовать значением индуктивной константы остова (σS), которую можно определить, например, по сдвигам частот валентных колебаний элемент-гидридной связи, в частности, связи Si–H в функциональной группе поверхностного соединения. Эта связь очень чувствительна к эффектам заместителей, и сдвиг ее частот практически исключает влияние стерических факторов. В этом случае уравнение (1) примет вид
где νi, ν0– частоты валентных колебаний в данном соединении и в эталонном, например метилзамещенном силане или силоксане.Если в качестве индуктивных констант σi, характеризующих влияние других заместителей (Ri) в поверхностном соединении использовать константы Тафта $\left( {\sigma _{i}^{*}} \right),$ то и σS также будет определяться по шкале индуктивных констант Тафта. Наличие данных по константам Тафта для большого числа низкомолекулярных заместителей [7] значительно упрощает расчетную часть методики и делает предлагаемый подход в достаточной степени универсальным.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Коэффициенты уравнения (2) для реакционного ряда твердых оксидов определяли на образцах диоксида кремния (аэросил А-175), предварительно термообработанного в вакууме при 673 К. Характеристические частоты валентных колебаний связи Si–H хемосорбированных силанов находили по ИК-спектрам, регистрируемым на спектрометрах, снабженных Фурье-анализатором. Спектры снимали непосредственно в кювете-реакторе как в режиме накопления, так и многократно с разверткой при различных скоростях сканирования и масштабах регистрации частот с последующим усреднением значений в результате их статистической обработки. Отклонения отдельных измерений от среднестатистических значений в области частот 2100–3800 см–1 не превышали 2 см–1. Значения максимумов частот валентных колебаний связи Si–H в различных функциональных группах, синтезированных на поверхности аэросила, приведены в табл. 1.
Таблица 1.
Влияние природы заместителя на частоту валентных колебаний кремнийгидридной связи и индуктивный эффект заместителей
| № | Хемосорбируемый хлорсилан | Поверхностное соединение | νi (Si–H), см–1 | Σσ* [4] | Σσi + $\sigma _{S}^{*}$ |
|---|---|---|---|---|---|
| 1 | Cl(CH3)2SiH | ≡Si–O–Si(CH3)2H | 2161 | 0 | 5.05 |
| 2 | ClPh2SiH | ≡Si–O–Si(Ph)2H | 2182 | 1.104 | 6.14 |
| 3 | Cl2(CH3)SiH | ≡Si–O–Si(CH3)ClH | 2215 | 2.880 | 7.91 |
| 4 | » | ≡Si–O–Si(CH3)H | 2260 | 0 | 10.15 |
| 5 | –//– + Н2О | ≡Si–O–Si(CH3) (OH)H | 2190 | 1.550 | 6.61 |
| 6 | –//– + СН3ОН | ≡Si–O–Si(CH3)(OCH3)H | 2189 | 1.450 | 6.50 |
| 7 | –//– + C2H5OH | ≡Si–O–Si(CH3) (OEt)H | 2187 | 1.366 | 6.40 |
| 8 | Cl2PhSiH | ≡Si–O–SiPhClH | 2225 | 3.480 | 8.49 |
| 9 | » | ≡Si–O–SiPhH | 2270 | 0.552 | 10.67 |
| 10 | –//– + Н2О | ≡Si–O–SiPh(OH)H | 2203 | 2.147 | 7.23 |
| 11 | –//– + СН3ОН | ≡Si–O–SiPh(OCH3)H | 2200 | 2.050 | 7.07 |
| 12 | –//– + C2H5OH | ≡Si–O–SiPh(OEt)H | 2199 | 1.966 | 7.03 |
| 13 | Cl3SiH | ≡Si–O–SiCl2H | 2272 | 5.760 | 10.77 |
При хемосорбции метилдихлорсилана и фенилдихлорсилана можно было синтезировать различные по составу поверхностные соединения. Указанные силаны реагировали с поверхностью аэросила в основном монофункционально (соединения 3, 8 из табл. 1), и при последующей обработке таких образцов парами воды или спирта не вступившие в реакцию группы Si–Cl гидролизовались или алкоксилировались. Это сопровождалось соответствующими изменениями в ИК-спектрах (рис. 1, кривые 1', 2 '), а именно: частичным восстановлением полосы поглощения Si–OH-групп (ν = 3750 см–1; рис. 1, кривая 1') при гидролизе или изменением формы и интенсивности спектральных полос С–Н-связей (рис. 1, кривая 2 ') при алкоксилировании. В обоих случаях введение в окружение кремнийгидридной связи нового заместителя (–ОН-, –OCH3- или ‒OC2H5-групп) сопровождалось относительным смещением полосы поглощения связи Si–H (табл. 1, соединения 3, 5, 6, 7 и 8, 10, 11, 12; рис. 1). Последующее термостатирование таких образцов в течение 1 ч (Т = 623 К) приводило к некоторому снижению интенсивности полос поглощения группировок 3 и 8 (табл. 1) и появлению новых с νi(Si–H) = 2260 и 2270 см–1. Это сопровождалось исчезновением полосы поглощения ОН-групп (ν = 3750 см–1) и полос поглощения С–Н-связей алкоксигрупп (ν = 2850, 3070 см–1; рис. 1, кривые 1", 2").
Рис. 1.
ИК-спектры аэросила: обработанного парами фенилдихлорсилана при 473 К (1) с последующей регидратацией (1') и после термостатирования при 673 К в течение 60 мин (1"); обработанного парами метилдихлорсилана при 473 К (2) с последующей обработкой парами этилового спирта (2') и после термостатирования при 673 К в течение 60 мин (2").

Используя значения констант Тафта $\left( {\Sigma \sigma _{i}^{*}} \right)$ для таких заместителей, как Cl2MeSiH ($\Sigma \sigma _{i}^{*}$ = 2.88), Cl3SiH ($\Sigma \sigma _{i}^{*}$ = 5.76), Cl2PhSiH ($\Sigma \sigma _{i}^{*}$ = 3.48) и ClPh2SiH ($\Sigma \sigma _{i}^{*}$ = 1.10) [7], были определены коэффициенты соотношения (2) и получено выражение
Очевидно, что реакционная способность гидроксильных групп поверхности кремнезема зависит от температуры, т.е. от их концентрации. Это вызвано увеличением электроотрицательности поверхностных атомов кремния, обусловленным удалением из их координационной сферы гидроксилов и (или) молекул воды [8] и перераспределением электронной плотности в Si–O-связях поверхности. Следовательно, для образцов, находящихся в различной степени гидратации, численные значения $\sigma _{S}^{*}$ должны отличаться, количественно отражая это явление. Результаты эксперимента подтвердили это. Для серии образцов аэросила А-175, прошедших предварительную термообработку в вакууме в интервале температур 473–1073 К и обладающих различной концентрацией гидроксильных групп, по экспериментальным данным νi (SiH) (см. табл. 2) были рассчитаны значения $\sigma _{S}^{*}$ с использованием уравнения (3). Они могут служить количественной мерой влияния кремний-кислородной группировки поверхности (или даже всей поверхности) на гидроксильную группу и характеризовать ее активность в зависимости от температуры. С повышением температуры значения $\sigma _{S}^{*}$ возрастали, что указывало на повышение реакционной способности гидроксильных групп (табл. 2).
Таблица 2.
Влияние термообработки на концентрацию гидроксильных групп и индуктивную константу для SiO2, рассчитанную по данным νi(SiH) для хемосорбированного диметилхлорсилана
| Температура обработки Т, К | 473 | 573 | 673 | 773 | 873 | 973 | 1073 |
| Концентрация гидроксильных групп СОН, мкмоль/м2 | 7.8 | 5.6 | 3.4 | 3.0 | 2.6 | 2.3 | 1.5 |
| Полоса поглощения νi(SiH), см-1 | 2152 | 2155 | 2161 | 2163 | 2165 | 2168 | 2170 |
| Индуктивная постоянная $\sigma _{S}^{*}$ | 4.57 | 4.73 | 5.05 | 5.15 | 5.25 | 5.41 | 5.52 |
Использование корреляционного анализа для установления общей закономерности влияния остова твердой матрицы на активность функциональных групп поверхности было продемонстрировано на ряде дисперсных оксидов: цинка, магния, бериллия, титана и алюминия, константы кислотности которых изменяются в достаточно широком диапазоне. Таблетированные образцы этих оксидов гидроксилировались парами воды и обрабатывались парами диметилхлорсилана (ДМХС) при температурах, рекомендованных для каждого оксида [9, 10].
Исследование гидроксильного покрова как кремнеземов, так и других оксидов (Al2O3, xAl2O3⋅ySiO2, TiO2, ZnO и др.) [10], обладающих ценными каталитическими свойствами, показало, что по числу координационных связей кислорода различают три типа ОН-групп: связанных с металлом оксидного остова одной (I), двумя (II) и тремя (III) связями. При этом подразумевается, что все связи М–О равноценны.
При обработке указанных оксидов парами ДМХС в их спектрах наблюдался ряд особенностей. На рис. 2 представлены ИК-спектры исходных и обработанных образцов оксидов бериллия, титана и алюминия. В результате хемосорбции ДМХС образовывались термически устойчивые соединения М–О–Si(CH3)2H (М – оксидообразующий металл). Обработка оксида бериллия парами ДМХС при малых давлениях (~1 Па) показала, что в спектрах образцов снижается интенсивность полосы поглощения ОН-групп типа I с ν(OH) = 3720 см–1 и появляется полоса поглощения связи Si–H с ν(Si–H) = 2135 см–1 (рис. 2, кривые 1, 1'). При увеличении давления паров ДМХС до 50 Па в реакцию вступали ОН-группы типа II с ν(OH) = 3630 см–1. При этом формировались новые кремний-гидридные группировки с ν(Si–H) = = 2240 см–1 (рис. 2, кривая 1 "). Аналогичные изменения наблюдались на образцах диоксида титана (анатаз) и γ-Al2O3 (рис. 2, кривые 2, 2 ', 2 ", 2 '", 3, 3 ', 3", 3'").
Рис. 2.
ИК-спектры оксидов бериллия (1), титана (2) и алюминия (3): исходных (1–3), обработанных ДМХС при 473 К (р ≈ 1 Па, τ = 30 мин) (1'–3'), обработанных в тех же условиях при р ≈ 50 Па (1"–3"), термостатированных в вакууме при Т = 523 К, τ = 60 мин (1"'–3"').
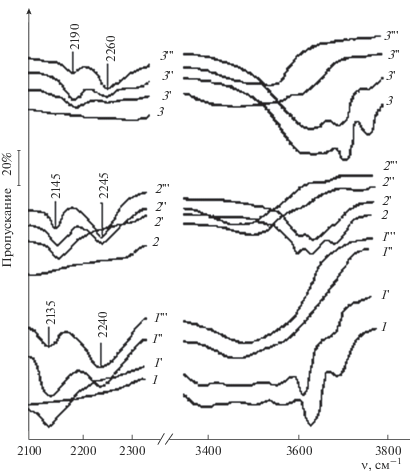
Полученные данные свидетельствуют о том, что на поверхности всех исследованных оксидов первыми вступали в реакцию гидроксильные группы типа I. Однако группы этого типа должны быть наименее активны в реакциях электрофильного замещения. Наблюдаемое противоречие можно объяснить влиянием стерических факторов в гетерогенных химических процессах. Малая концентрация и пространственное расположение “утопленных” ОН-групп типа II или III неблагоприятны для поверхностных реакций.
При обработке парами ДМХС поверхности оксидов цинка и магния синтезировать термически устойчивые поверхностные соединения типа М–О–Si–R2H не удалось. Для ОН-групп типов I и II наблюдалось только смещение полосы поглощения ν(OH), вызванное присутствием на поверхности силана, который является сравнительно сильным основанием. Последующая термообработка приводила к его полной десорбции, что указывало на отсутствие химических связей. Одна из возможных причин – низкая электрофильность ДМХС в реакциях с относительно малоактивными гидроксильными группами на поверхности этих матриц.
Гидроксильные группы III для всех указанных оксидов выявить не удалось, по-видимому, из-за их отсутствия или чрезвычайно малой концентрации.
Сопоставив значения $\sigma _{S}^{*},$ рассчитанные по экспериментальным частотам ν(SiH) для групп, синтезированных на однотипных реакционных центрах (например, ОН-группах типа I) (табл. 3), все исследованные оксиды можно расположить по возрастанию эффективной электроотрицательности остова в следующий ряд:
Таблица 3.
ИК-характеристики группировок М–ОН, Si–H и индуктивный эффект остова некоторых оксидов $\sigma _{S}^{*}$ (Т = 473 К)
| Оксид | Тип ОН-групп |
ν (OH), см–1 | ν (SiH), см–1 | $\sigma _{S}^{*}$ |
|---|---|---|---|---|
| BeO | I | 3720 | 2135 | 3.70 |
| BeO | II | 3630 | 2240 | 8.93 |
| TiO2 (анатаз) | I | 3700 | 2145 | 4.21 |
| TiO2 (анатаз) | II | 3640 | 2245 | 9.42 |
| γ-Al2O3 | I | 3780 | 2190 | 6.55 |
| γ-Al2O3 | II | 3720 | 2260 | 10.20 |
| SiO2 (аэросил) | I | 3750 | 2152 | 4.57 |
Полученный ряд количественно характеризует реакционную способность гидроксильных групп на поверхности этих оксидов.
Анализируя полученные данные, можно попытаться установить некую общую взаимосвязь между индуктивными постоянными и энергетическими характеристиками этих матриц. Поскольку в основе самого понятия индуктивных постоянных лежат представления о зависимости свободной энергии молекул от некоторого взаимодействия вдоль σ-связей, обусловленного эффективными электроотрицательностями атомов или более сложных структурных единиц, то с этой точки зрения энергии связей должны были бы представлять наиболее идеальный экспериментальный материал для оценки индуктивных постоянных. Несмотря на прямую корреляцию индуктивного эффекта с электроотрицательностью элемента, такая зависимость не отражала бы воздействия других атомов ближайшего окружения функциональной группы. Как показал анализ полученных результатов, более полную картину взаимодействия в системе остов–функциональная группа отражает энергия образования твердого оксида. На рис. 3 показана эта взаимосвязь, которая практически линейна для ряда исследованных оксидов. Следует отметить, что отличия в энергиях кристаллического остова для различных модификаций исследованных оксидов не превышали 50 кДж/моль (на рис. 3 показаны горизонтальным отрезком), поэтому заметного отклонения от общей линейной зависимости не наблюдается.
Рис. 3.
Связь индуктивной постоянной оксидного остова с его энергией образования: светлые кружки – предполагаемые значения $\sigma _{S}^{*}$ для Та2О5, MgO и ZnO.

Установленная зависимость $\sigma _{S}^{*}$ = f(E) (рис. 3) может быть использована для прогнозирования значений $\sigma _{S}^{*},$ а следовательно, и реакционной способности гидроксильных групп на поверхности либо других оксидных матриц, либо слоя оксида. На рис. 3 показаны предполагаемые значения $\sigma _{S}^{*}$ для оксидов магния и цинка. Их экспериментально определить не удалось, вероятнее всего, из-за слабой электрофильности используемого реагента – ДМХС.
ЗАКЛЮЧЕНИЕ
Полученные значения индуктивных констант как для оксидов, так и для монокристаллического кремния [6] позволяют не только количественно оценить влияние остова на активность поверхностных ОН-групп при термообработке, но и прогнозировать возможность и направление реакций с различными реагентами. Для этого необходимо провести сравнение значений $\sigma _{S}^{*}$ для различных заместителей с выбором направления обмена группы на более электроотрицательную, т.е. с большей индуктивной константой. Это означает, что для полного протекания реакций на поверхности следует выбрать реагент с $\sigma _{i}^{*}$ < $\sigma _{S}^{*}$ либо находить условия дополнительной активации гидроксилов, которая может осуществляться как повышением температуры, так и использованием химических реагентов, например протонакцепторов, повышающих протонизацию гидроксилов. Так, использование триэтиламина как катализатора обмена позволило ликвидировать латентный период в формировании слоев оксида кремния на поверхности свежепротравленного кремния ($\sigma _{{{\text{Si}}}}^{*}$ = 2.9) [6] при ее попеременной обработке парами SiCl4 и Н2О, а также успешно осуществить синтез диэлектрических нанослоев оксидов тантала и алюминия и их многослойных композиций [11].
Список литературы
Malygin A.A., Smirnov V.M. Early Work on Atomic Layer Deposition Cited // Solid State Technol. 2002. March. P. 14–17.
Puurunen R. Surface Chemistry of Atomic Layer Deposition: a Case Study for the Trimethylaluminum/Water Process // J. Appl. Phys. 2005. V. 97. P. 121301-1–121301-52.
Пальм В.А. Основы количественной теории органических реакций. Л.: Химия, 1977. 359 с.
Алесковский В.Б. О природе твердых химических соединений // Журн. прикл. химии. 1982. Т. 55. С. 725–730.
Алесковский В.Б. Химия надмолекулярных соединений. СПб.: Изд. СПбГУ, 1996. 256 с.
Ежовский Ю.К. Активность поверхности монокристаллического кремния в процессах молекулярного наслаивания // Неорган. материалы. 2019. Т. 55. № 2. С. 117–122.
Справочник химика. М.-Л.: Химия, 1971. Т. 3. 1005 с.
Ежовский Ю.К., Осипов А.В. Термодинамическая модель формирования поверхностных функциональных групп // Поверхность. Рентгеновские, синхротронные и нейтронные исследования. 1999. № 3. С. 39–43.
Цыганенко А.А., Филимонов В.Н. ИК-спектры гидроксильного покрова окислов со структурой вюрцита // Докл. АН СССР. 1972. Т. 203. С. 636–639.
Цыганенко А.А., Хоменя А.В., Филимонов В.Н. Исследование протонодонорной способности ОН-групп поверхности окислов методом ИК-спектроскопии // Адсорбция и адсорбенты. 1976. Т. 4. С. 86–90.
Ежовский Ю.К. Нанослои оксидов тантала и алюминия и диэлектрические композиции на их основе // Поверхность. Рентгеновские, синхротронные и нейтронные исследования. 2021. № 2. С. 267–272.
Дополнительные материалы отсутствуют.
Инструменты
Неорганические материалы


