Неорганические материалы, 2023, T. 59, № 1, стр. 61-70
Фазообразование в системе V2O5–AlN
В. А. Ларионов 1, *, Р. И. Гуляева 1, Е. А. Нифонтова 1
1 Институт металлургии УрО Российской академии наук
620016 Екатеринбург, ул. Амундсена, 101, Россия
* E-mail: larionov.imet@ya.ru
Поступила в редакцию 23.06.2022
После доработки 18.11.2022
Принята к публикации 21.11.2022
- EDN: OTLEGU
- DOI: 10.31857/S0002337X23010141
Аннотация
Методами химического, рентгенофазового анализов, а также совмещенного термического и масс-спектрометрического анализов изучены взаимодействия в системе V2O5–AlN. Установлено, что нагрев смесей с молярным отношением AlN : V2O5 ≥ 2.33 выше 1100°С приводит к образованию в конденсированных продуктах нитридов ванадия: V2N, VN0.81 и VN. Образования твердых растворов алюминия в ванадии либо алюминидов ванадия при нагревании смесей во всем исследуемом интервале температур не выявлено. При химическом взаимодействии V2O5 с AlN соблюдается принцип последовательности превращений А.А. Байкова: V2O5 → VO2 → V4O7 → V3O5 → V2O3 → VO → V.
ВВЕДЕНИЕ
Нитрид алюминия обладает рядом интересных физических свойств. Высокое электросопротивление, коррозионная стойкость к воздействиям воздуха и расплавов металлов при повышенных температурах, стойкость к термоудару делают AlN незаменимым при изготовлении тиглей для разливки некоторых металлов, при изготовлении алюминиевых электролизеров и других видов продукции [1, 2]. Благодаря высокой теплопроводности, высокому объемному сопротивлению и умеренным диэлектрическим свойствам нитрид алюминия находит широкое применение в области электроники (например, для изготовления керамических алюмонитридных диэлектрических теплоотводящих подложек и коммутационных плат для ракетно-космической техники) и в строительной сфере [3–5]. Тем не менее, для изделий из AlN характерны те же проблемы, что и для всех материалов с ковалентным типом связи (твердость, хрупкость, дефектность структуры). Их решают путем добавки небольших количеств оксидов редких, редкоземельных и/или щелочноземельных металлов, способствующих лучшему спеканию, повышению плотности, теплопроводности, устранению грубых структурных дефектов в изделиях [6–10].
В качестве реагента-носителя азота нитрид алюминия используют при выплавке азотсодержащих ванадий-алюминиевых лигатур, предназначенных для легирования титана. AlN в шихту плавки вводят либо в виде самостоятельного реагента [11], либо в составе прекурсора, получаемого азотированием порошков промышленных сплавов V(85–45)–Al методом самораспространяющегося высокотемпературного синтеза (СВС) [12, 13]. Известно [11, 14, 15], что лигатуры V–Al–N–(C) получают внепечным алюминотермическим способом. Реакции восстановления ванадия из его оксидов алюминием являются экзотермическими с выделением количества тепла, достаточного для самопроизвольного протекания процессов восстановления [16]. В работе [17] установлено, что независимо от того, в каком виде азот вводится в шихту для выплавки вышеупомянутых лигатур – NaNO3, VN, V2N, AlN либо в виде смесей нитридов алюминия и ванадия – непосредственно в самих лигатурах азот всегда присутствует только в виде AlN.
Цель данной работы – изучение фазообразований, происходящих при взаимодействии V2O5 с AlN, для совершенствования технологий производства азотированных ванадий-алюминиевых лигатур и для разработки составов и способов получения оксидно-нитридной керамики.
Ранее [18] методами термодинамического моделирования, а также химического и рентгенофазового анализов были изучены взаимодействия, происходящие при нагревании брикетированных смесей V2O5 с AlN. Однако полученные в работе [18] данные потребовали уточнения и экспериментального дополнения.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Для экспериментального изучения взаимодействия в системе V2O5–AlN были приготовлены брикетированные смеси по обычной керамической технологии. Давление прессования – 10 МПа. В качестве исходных компонентов использовали пентаоксид ванадия квалификации “ч.д.а.” производства фирмы Glencore Operations SA PTY Ltd (Южная Африка) и порошок нитрида алюминия марки СВС ТЧ-1 производства ИСМАН РАН (Россия, г. Черноголовка) по ТУ 88-1-200-92 крупностью минус 0.045 мкм с удельной поверхностью 0.5 м2/г. Согласно ТУ, в нитриде алюминия содержалось (мас. %): 32.5 N, 0.5 O, 0.11 Fe, 0.02 С, остальное Al.
Процессы, происходящие при взаимодействии V2O5 с AlN, изучали двумя методами.
1. Химическим и рентгенофазовым анализами (РФА) продуктов нагревания брикетированных смесей V2O5 + AlN. Отношение AlN/V2O5 = 0.67–9.0 (моли). Смеси исходных компонентов готовили по обычной керамической технологии. Давление прессования 10.0 МПа. Нагрев брикетов вели в токе гелия в печи СШВЛ-0.62/16-И2 с вольфрамовым нагревателем до температур ≤1600°C с последующей изотермической выдержкой при заданной температуре 0.5–1.0 ч. Скорость нагрева – 7.0–10.0°С/мин.
2. Дифференциальной сканирующей калориметрией (ДСК), термогравиметрическим и масс-спектрометрическим анализами смеси V2O5 + AlN на приборе синхронного термического анализа Netzsch STA 449 C Jupiter. Относительная погрешность определения температуры составила ±3°С, а энтальпии – ±10%. Определение состава газов, выделяющихся при нагреве смеси, выполнено на сопряженном с термоанализатором квадрупольном масс-спектрометре QMS 403 C Aёolos в режиме заданных массовых чисел. Нагрев образцов до 1300°С и охлаждение до 500°С осуществлено с постоянной скоростью (20°С/мин) в токе аргона (30 мл/мин) в тиглях для ДСК из Al2O3 с крышечками, имеющими отверстия. Масса измельченных и спрессованных материалов составляла ≈30.0 мг. Отношение AlN/V2O5 задавали равным 1.67 (моли).
О характере фазообразования судили по результатам РФА продуктов взаимодействия, выполненного на автоматизированном дифрактометре ДРОН-2.0 (излучение CuKα отфильтрованное, монохроматизированное), оборудованном высокотемпературной приставкой УВД-2000. Высокотемпературную съемку порошкообразного образца с мольным отношением AlN/V2O5 = 7.44 вели в токе гелия при нагреве от комнатной температуры до 1230°С и последующем охлаждении. При расшифровке дифрактограмм пользовались базой данных ICDD PDF2.
Содержание элементов в исходных образцах и конечных продуктах определено методами атомно-абсорбционной (спектрометр SOLAAR M6) и оптической эмиссионной (спектрометр SpectroFlame Modula S) спектроскопии.
Расчет энергий Гиббса химических реакций выполнен с использованием программного комплекса НSC Chemistry 6.12 [19]. Отсутствующие в базе данных программы значения термохимических характеристик (энтальпию образования $\Delta H_{f}^{0}$, энтропию ΔS и коэффициенты А, В и С эмпирического уравнения теплоемкости ср) алюминидов ванадия (V5Al8, VAl3, V3Al2) заимствованы из работы [20].
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Изучение взаимодействия V2O5 и AlN методом спекания брикетированных смесей. Результаты экспериментального изучения фазообразования при нагреве брикетированных смесей xV2О5 + yAlN представлены в табл. 1 и на рис. 1–3. Согласно данным табл. 1, в области температур 1200–1600°С взаимодействие между V2O5 и AlN приводит к образованию нитридов ванадия V2N, VN0.81 и VN. Конденсированная фаза также представлена оксидами ванадия и алюминия.
Таблица 1.
Фазовый состав продуктов взаимодействия V2O5 с AlN
| Мольное отношение AlN/V2O5 в шихте | Фазовый состав после нагрева и изотермической выдержки при | |||
|---|---|---|---|---|
| 1000°С | 1100°С | 1200°С | 1600°С | |
| 9.00 | AlN, V2O3, Al2O3 (мало) | AlN, AlV2O4, Al2O3, V2O3 (мало) | AlN, VN, Al2O3 | AlN, VN0.81, V2N, Al2O3 |
| 7.44 | AlN, V2O3, Al2O3 (мало) | AlN, AlV2O4, V2O3, Al2O3 | AlN, VN0.81, Al2O3 | AlN, Al2O3, VN* |
| 5.66 | AlN, V2O3, Al2O3 (мало) | AlN, AlV2O4, V2O3, Al2O3 | VN, AlN, Al2O3, V2N (мало) | VN0.81, V2N, Al2O3, AlN |
| 4.00 | AlN, V2O3, Al2O3 (мало) | AlN, V2O3, AlV2O4, Al2O3 | VN, Al2O3, AlN, V2N, AlV2O4 (мало), V2O3 (мало) | V2N, VN0.81, Al2O3, AlN |
| 3.33 | AlN, V2O3, Al2O3 (мало) | AlN, V2O3, AlV2O4, Al2O3 | VN0.81, Al2O3, V2N (мало), AlV2O4 (мало) | VN, Al2O3* |
| 2.33 | V2O3, AlN, Al2O3, VO2 (мало) | V2O3, AlN, AlV2O4, Al2O3 | AlV2O4, Al2O3, V2N, V2O3 | AlV2O4, V2N, Al2O3, VN0.81 |
| 1.22 | Al2O3, V4O7, V3O5, VO2, AlN | V3O5, Al2O3, VO2, AlN | V2O3, V3O5, Al2O3, VO2, AlN | V2O3, Al2O3, AlN |
| 0.67 | VO2, Al2O3, AlN (мало) | VO2, Al2O3, AlN (мало) | VO2, Al2O3, AlN (мало) | V2O3, Al2O3, AlN (мало) |
Рис. 1.
Дифрактограммы продуктов взаимодействия V2O5 с AlN после нагрева и изотермической выдержки образцов с соотношением AlN/V2O5 = 4.00 при 1000 (1), 1100 (2), 1200 (3), 1600°С (4).

Рис. 2.
Дифрактограммы продуктов взаимодействия V2O5 с AlN после нагрева и изотермической выдержки при t = = 1600°С образцов с соотношением AlN/V2O5, равным 9.00 (1), 5.66 (2), 2.33 (3), 0.67 (4).

Рис. 3.
Изменение интенсивности рефлексов фаз, формирующихся в результате взаимодействия V2O5 и AlN при нагреве в гелии в высокотемпературной рентгеновской приставке (AlN/V2O5 = 7.44).

Соотношение реагентов в смеси и температура экспериментов закономерно отражаются на фазовом составе продуктов взаимодействия V2O5 и нитрида алюминия. Из табл. 1 и рис. 1–3 видно, что при увеличении AlN/V2O5 от 0.67 до 9.0 (моли) степень окисления ванадия изменяется от VO2 до V2O3.
В продуктах взаимодействия смесей с AlN/V2O5 ≥ ≥ 2.33 после нагрева до температур выше 1100°С обнаружена фаза ванадата алюминия AlV2O4 [21], причем ее количество прямо пропорционально количеству AlN в исходных смесях. Образование шпинели такого состава подтверждается в работах [22, 23], в которых ее специально синтезировали путем спекания смесей V2O3 + V2O5 + Al в кварцевых ампулах в вакууме при t = 1100°С. Ванадат алюминия можно представить в виде смеси Al2O3 + V2O3 + 2VO. Следовательно, в согласии с данными [24] соблюдается принцип последовательности превращений А.А. Байкова: V2O5 → VO2 → V4O7 → V3O5 → V2O3 → VO. Дальнейшее увеличение температуры выше 1100°С, согласно результатам РФА, приводит к восстановлению ванадия из ванадата алюминия и образованию нитридов ванадия.
Результаты химического анализа на содержание азота в конденсированных продуктах взаимодействия V2O5 с AlN и контроля убыли массы смесей при нагревании (табл. 2) показывают, что наряду с реакциями
(1)
$3{{{\text{V}}}_{{\text{2}}}}{{{\text{O}}}_{{\text{5}}}} + {\text{2AlN}} = 6{\text{V}}{{{\text{O}}}_{2}} + {\text{A}}{{{\text{l}}}_{{\text{2}}}}{{{\text{O}}}_{3}} + {{{\text{N}}}_{2}},$(2)
$4{\text{V}}{{{\text{O}}}_{{\text{2}}}} + 2{\text{AlN}} = {{{\text{V}}}_{{\text{2}}}}{{{\text{O}}}_{{\text{3}}}} + {\text{A}}{{{\text{l}}}_{{\text{2}}}}{{{\text{O}}}_{3}} + {{{\text{N}}}_{2}},$(3)
$3{\text{Al}}{{{\text{V}}}_{{\text{2}}}}{{{\text{O}}}_{{\text{4}}}} + {\text{8AlN}} = 6{\text{VN}} + 4{\text{A}}{{{\text{l}}}_{{\text{2}}}}{{{\text{O}}}_{3}} + {{{\text{N}}}_{2}},$(4)
$4{{{\text{V}}}_{{\text{4}}}}{{{\text{O}}}_{7}} + {\text{2AlN}} = 8{{{\text{V}}}_{{\text{2}}}}{{{\text{O}}}_{3}} + {\text{A}}{{{\text{l}}}_{{\text{2}}}}{{{\text{O}}}_{3}} + {{{\text{N}}}_{{\text{2}}}}{\text{O}},$(5)
$15{\text{V}}{{{\text{O}}}_{2}} + 2{\text{AlN}} = 5{{{\text{V}}}_{{\text{3}}}}{{{\text{O}}}_{5}} + {\text{A}}{{{\text{l}}}_{{\text{2}}}}{{{\text{O}}}_{{\text{3}}}} + 2{\text{NO}},$Таблица 2.
Изменение содержания азота в продуктах взаимодействия V2O5 с AlN
| Мольное отношение AlN/V2O5 | Убыль массы Δm (%) и содержание азота СN (мас. %) после выдержки при | |||||
|---|---|---|---|---|---|---|
| 1000°С | 1200°С | 1500°С | ||||
| ∆m | СN | ∆m | СN | ∆m | СN | |
| 7.44 | 3.4 | 14.2 | 5.4 | 12.6 | 6.0 | 9.5 |
| 3.33 | 4.4 | 7.8 | 9.5 | 7.4 | 9.7 | 5.3 |
Следовательно, шпинель AlV2O4 может образовываться в результате протекания реакций с участием NO и N2O, например:
(6)
${{{\text{V}}}_{{\text{2}}}}{{{\text{O}}}_{3}} + {\text{AlN}} + {\text{NO}} = {\text{Al}}{{{\text{V}}}_{{\text{2}}}}{{{\text{O}}}_{4}} + {{{\text{N}}}_{2}},$(7)
${{{\text{V}}}_{{\text{2}}}}{{{\text{O}}}_{{\text{3}}}} + {\text{AlN}} + {{{\text{N}}}_{{\text{2}}}}{\text{O}} = {\text{Al}}{{{\text{V}}}_{{\text{2}}}}{{{\text{O}}}_{4}} + 1.5{{{\text{N}}}_{2}}.$Следует отметить, что ранее [18] фаза с дифракционными максимумами d/n, равными (Å): 2.031–2.049, 2.345–2.366, 1.436–1.449, 1.225–1.235, определялась нами как оксид ванадия VO [25]. Исследуя в дальнейшем фазообразование в тройной системе V2O5–Al–AlN, мы пришли к выводу, что в данном случае фазами с такими линиями являются VN0.81 (d/n = 2.029, 2.342, 1.434, 1.223, Å) [26] или VN (d/n = 2.045, 2.361, 1.446, 1.233, Å) [27]. Возможность их образования согласуется с диаграммой состояния V–N [28].
Таким образом, методом РФА установлено, что взаимодействие пентаоксида ванадия с нитридом алюминия при t > 1100°С приводит к образованию в продуктах взаимодействия нитридов V2N, VN0.81 и VN. Формирования твердых растворов алюминия в ванадии либо алюминидов ванадия не происходит.
Изучение взаимодействия V2O5 и AlN методами термического и масс-спектрометрического анализов. Термический анализ исходных компонентов показал, что AlN при нагреве со скоростью 20.0°С/мин до 1300°С в потоке аргона практически не претерпевает превращений (рис. 4). Незначительное повышение массы с 900°С, достигающее 1.28% (от исходной массы), обусловлено, вероятно, окислением примесей (Al, Fe и пр.) следовыми содержаниями кислорода в аргоне. На ДСК-кривой пентаоксида ванадия выявлен эндотермический эффект с началом и максимумом при 664 и 675°С, вызванный его плавлением (рис. 5). Оценка теплоты плавления V2O5 (65.19 кДж/моль, что близко табличным значениям [29]) подтвердила хорошее качество используемого реактива. Убыль массы образца V2O5 при нагреве до температуры 1200°С составила 2.34%.
Результат определения термических эффектов и изменения массы образца при взаимодействии пентаоксида ванадия с нитридом алюминия представлен на рис. 6, а дифрактограмма продуктов взаимодействия смеси после нагрева – на рис. 7. Судя по рис. 6, взаимодействие V2O5 с нитридом алюминия начинается при температуре, близкой к температуре плавления V2O5, и сопровождается ступенчатой убылью массы, достигающей 4.92% при 1300°С. На кривой ДСК при этом выявлены экзотермические эффекты: первый, совмещенный, с началом при 655°С и двумя максимумами при 657 и 713°С, второй – с началом при 857°С и максимумом при 998°С. Дальнейший нагрев сопровождается появлением слабого растянутого экзотермического эффекта, указывающего на незавершенность процесса взаимодействия. Масс-спектрометрический анализ образующихся газов выявил (рис. 6) периодическое, синхронное по температуре с максимумами на линии ДСК выделение азота (максимумы при 656, 710, 998 и 1250°С), а также выделение N2O – активное в интервале 500–700°С и постоянное при дальнейшем нагреве до 1300°С. Значительное количество ионов с массовым числом 30 а.е.м., характерным для масс-спектров оксидов азота (N2O, NO2, NO и др.), наблюдается при нагреве смеси V2O5 и AlN в области температур 250–850°С.
Рис. 6.
Результаты термического анализа (а) смеси V2O5 + AlN с молярным отношением AlN/V2O5 = 1.67 и масс-спектрометрические данные отходящих газов (б–г).
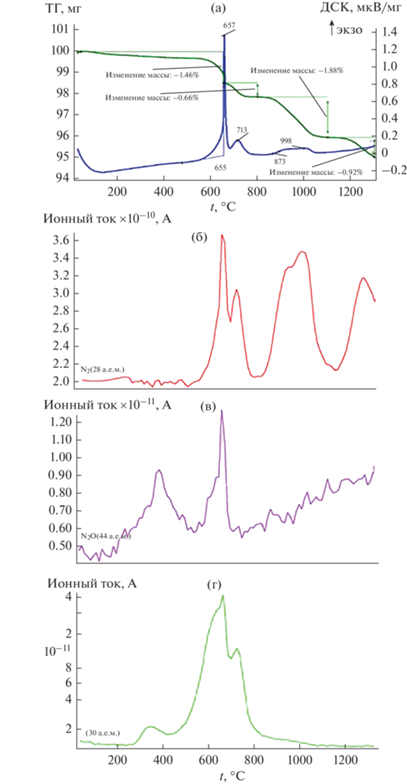
Рис. 7.
Дифрактограмма продуктов взаимодействия V2O5 с AlN после термического анализа (AlN/V2O5 = 1.67).

Согласно результатам РФА, основными продуктами взаимодействия смеси с отношением исходных компонентов AlN/V2O5 = 1.67 (моли) после непрерывного нагрева до 1300°С являются V2O3, AlV2O4, Al2O3 и непрореагировавший AlN (рис. 7). Эти результаты хорошо согласуются с результатами РФА, полученными при изучении фазообразования между V2O5 и AlN методом спекания брикетированных смесей в вакуумной печи (табл. 1).
Таким образом, можно сделать вывод, что термоэффекты при 713 и 998°С на кривой ДСК (рис. 6) соответствуют образованию низших оксидов ванадия, а слабый растянутый экзотермический эффект при t > 1040°С – образованию шпинели AlV2O4. Масс-спектрометрический анализ отходящих газов подтверждает сделанное ранее предположение о том, что ванадат алюминия AlV2O4 может образовываться в результате протекания реакций с участием NO и N2O.
Тестирование нитрида алюминия показало, что при его нагревании также происходит выделение NO (рис. 4). Однако температура начала выделения NO несколько ниже, чем термического эффекта, зафиксированного при нагревании смеси V2O5 + AlN. Это обстоятельство может указывать на то, что вначале идет разрушение оксонитрида AlxNyOz, присутствующего, вероятно, в нитриде, и лишь затем получают развитие реакции, протекающие с образованием N2, N2O, NO.
Таким образом, результаты термического и масс-спектрометрического изучения взаимодействия V2O5 с AlN при нагреве до температуры 1300°С указывают на частичное образование и выделение в газовую фазу азота и его оксидов, что подтверждает данные, полученные ранее при изучении взаимодействия V2O5 с AlN методом спекания.
ЗАКЛЮЧЕНИЕ
Методами РФА, химического анализа, а также совмещенного термического и масс-спектрометрического анализов изучено взаимодействие в системе V2O5–AlN при молярных отношениях AlN/V2O5 = 0.67–9.00. Установлено, что нагрев смеси V2O5 + AlN с молярным отношением AlN/V2O5 ≥ ≥ 2.33 выше 1100°С приводит к образованию в конденсированных продуктах взаимодействия нитридов ванадия: V2N, VN0.81 и VN. При нагревании смесей соблюдается принцип последовательности превращений А.А. Байкова: V2O5 → VO2 → V4O7 → → V3O5 → V2O3 → VO → V.
При взаимодействии V2O5 с AlN на начальной стадии протекает восстановление ванадия из V2O5 до V2O3 с выделением в газовую фазу азота, N2O и NO. Последующее взаимодействие V2O3 с оксидами азота приводит к образованию шпинели AlV2O4. Дальнейшая реакция ванадата алюминия с AlN приводит к образованию нитридов ванадия.
Образование твердых растворов алюминия в ванадии или алюминидов ванадия в конденсированных продуктах взаимодействия V2O5 с AlN при различном соотношении исходных компонентов во всем исследованном интервале температур не установлено.
Список литературы
Косолапова Т.Я. Тугоплавкие нитриды. Киев: Наук. думка, 1983. 174 с.
Самсонов Г.В. Неметаллические нитриды. М.: Металлургия, 1969. 264 с.
Virkar A.V., Jackson T.B., Cutler R.A. Thermodynamic and Kinetic Effects of Oxygen Removal on the Thermal Conductivity of Aluminum Nitride // J. Am. Ceram. Soc. 1989. V. 72. № 11. P. 2031–2042. https://doi.org/10.1111/j.1151-2916.1989.tb06027.x
Никитушкин И.В., Сивков А.А., Иватушенко А.С. Плазмодинамический синтез ультрадисперсного нитрида алюминия и получение AlN-керамики методом искрового плазменного спекания // Решетневские чтения. 2017. № 21-1. С. 156–157.
Савченко Е.М., Чупрунов А.Г., Сидоров В.А., Биларус И.А. Алюмонитридная керамика в коммутационных платах силовой электроники // Электрон. техника. Сер. 2: Полупроводниковые приборы. 2019. №. 4 (255). С. 43. https://doi.org/10.36845/2073-8250-2019-255-4-43-54
Cannard P., Ekström T., Tilley R.J.D. The Reaction of AlN with Some Metal Oxides at High Temperatures // J. Eur. Ceram. Soc. 1992. V. 9. № 1. P. 53–60. https://doi.org/10.1016/0955-2219(92)90077-Q
Toy C., Savrun E. Novel Composites in the Aluminum Nitride-Zirconia and—Hafnia Systems // J. Eur. Ceram. Soc. 1998. V. 18. № 1. P. 23–29. https://doi.org/10.1016/S0955-2219(97)00104-0
Qiao L., Zhou H., Xue H., Wang S. Effect of Y2O3 on Low Temperature Sintering and Thermal Conductivity of AlN Ceramics // J. Eur. Ceram. Soc. 2003. V. 23. № 1. P. 61–67. https://doi.org/10.1016/S0955-2219(02)00079-1
Fabrichnaya O., Pavlyuchkov D., Neher R., Herrmann M., Seifert H.J. Liquid Phase Formation in the System Al2O3–Y2O3–AlN: Part II. Thermodynamic Assessment // J. Eur. Ceram. Soc. 2013. T. 33. № 13–14. P. 2457–2463. https://doi.org/10.1016/j.jeurceramsoc.2013.05.004
González J.C., Rodríguez M.Á., Figueroa I.A., Villafuerte-Castrejón M.-E., Díaz G.C. Development of AlN and TiB2 Composites with Nb2O5, Y2O3 and ZrO2 as Sintering Aids // Materials. 2017. V. 10. № 3. P. 324. https://doi.org/10.3390/ma10030324
Рылов А.Н., Райков А.Ю., Мартынов А.В., Чумарев В.М., Ларионов А.В., Сельменских Н.И. Использование нитрида алюминия при выплавке лигатуры V–Al–N // Металлы. 2013. № 4. С. 3–7.
Закоржевский В.В., Боровинская И.П., Дубровский А.Я., Зелянский А.В., Паздников И.П., Чумарев В.М. Способ получения азотсодержащего материала на основе нитридов металлов для лигатур титановых сплавов и азотсодержащий материал для лигатур титановых сплавов: Пат. 2422246. РФ БИ № 18.
Закоржевский В.В., Ковалев И.Д., Дубровский А.Я. Самораспространяющийся высокотемпературный синтез азотсодержащего материала на основе нитридов алюминия и ванадия для получения лигатур титановых сплавов // Новые огнеупоры. 2018. № 8. С. 49–52. https://doi.org/10.17073/1683-4518-2018-8-49-52
Чумарев В.М., Ларионов А.В., Cельменских Н.И., Панкратов А.А., Дубровский А.Я., Pылов А.Н., Райков А.Ю. Cтруктура и фазовый состав лигатуры V–Al–N // Металлы. 2012. № 6. С. 9–15.
Taranov D.V., Larionov A.V., Chumarev V.M., Smirnov L.A., Trubachev M.V., Vohmentsev S.A. Structure and Phase Composition of V–Al–N–C Master Alloy // Theoretical and Practical Conference with International Participation and School for Young Scientists “FERROALLOYS: Development Prospects of Metallurgy and Machine Building Based on Completed Research and Development” (NIOKR-2018). Yekaterinburg, 2018 // KnE Materials Science. 2019. P. 118–125. https://doi.org/10.18502/kms.v5i1.3958
Лякишев Н.П., Плинер Ю.Л., Игнатенко Г.Ф., Лаппо С.И. Алюминотермия. М.: Металлургия, 1978. 424 с.
Ларионов А.В. Физико-химическое обоснование применения нитрида алюминия при выплавке ванадийсодержащих азотированных лигатур для титановых сплавов: дис. … канд. техн. наук. Екатеринбург: ИМЕТ УрО РАН, 2016. 121 с.
Чумарев В.М., Марьевич В.П., Ларионов А.В., Дубровский А.Я. Взаимодействие V2O5, Nb2O5 и Ta2O5 с AlN // Неорган. материалы. 2011. Т. 47. № 3. С. 317–322.
Roine A. Outokumpu HSC Chemistry for Windows. Chemical Reactions and Equilibrium Software with Extensive Thermochemical Database. Pori: Outokumpu Research OY, 2002.
Удоева Л.Ю., Чумарев В.М., Ларионов А.В., Рылов А.М., Трубачев М.В. Моделирование алюминотермической выплавки сплавов Mo–Ti–Al и Mo–Ti–V–Cr–Al // Металлы. 2013. № 2. С. 12–19.
База данных ICDD PDF2 № 01-077-2131.
Prytz O., Flage-Larsen E., Gu L. Charge-Ordered Spinel AlV2O4: High-Energy-Resolution EELS and Computational Studies // Phys. Rev. B: Condens. Matter. 2012. V. 85. № 19. https://doi.org/10.1103/PhysRevB.85.195112
Kalavathi S., Amirthapandian S., Chandra S. et al. Valence State, Hybridization and Electronic Band Structure in the Charge Ordered // J. Phys.: Condens. Matter. 2014. V. 26. № 1. https://doi.org/10.1088/0953-8984/26/1/015601
Елютин В.П., Павлов Ю.А. Высокотемпературные материалы М.: Металлургия, 1972. 264 с.
База данных ICDD PDF2 № 01-071-6420; № 01-077-2173; № 03-065-2896; № 03-065-4054; № 03-065-9475.
База данных ICDD PDF2 № 01-071-1139.
База данных ICDD PDF2 № 00-025-1252.
Carlson O.N., Smith J.F., Nafziger R.H. The Vanadium-Nitrogen System: a Review // Metall. Mater. Trans. A. 1986. V. 17. № 10. P. 1647–1656. https://doi.org/10.1007/BF02817263
Ефимов А.И., Белорукова Л.П., Василькова И.В., Чечев В.П. Свойства неорганических соединений. Л.: Химия, 1983. 392 с.
Дополнительные материалы отсутствуют.
Инструменты
Неорганические материалы




