Расплавы, 2022, № 6, стр. 576-588
Термодинамика взаимодействия хлорида кадмия с расплавом LiCl–KCl методом ЭДС
В. Г. Колясников a, А. М. Потапов a, *, В. Ю. Шишкин a, А. Е. Дедюхин a, Ю. П. Зайков a
a Институт высокотемпературной электрохимии УрО РАН
Екатеринбург, Россия
* E-mail: a.potapov_50@mail.ru
Поступила в редакцию 22.06.2022
После доработки 14.07.2022
Принята к публикации 21.07.2022
- EDN: HXVQLE
- DOI: 10.31857/S023501062206007X
Аннотация
Расплавленная эвтектическая смесь LiСl–KCl является перспективной средой для проведения многих высокотемпературных электрохимических процессов рафинирования, разделения, электрокристаллизации и др. Она обладает низкой температурой плавления, невысокой коррозионной активностью и достаточно широким электрохимическим окном. Последовательность растворения и выделения металлов в электролитах определяется их электрохимическими потенциалами. Объектом исследования являются растворы CdCl2 в расплавленной эвтектике LiCl–KCl. Хлорид кадмия рассматривается как перспективный агент для хлорирования в расплаве. Цель работы – оценить термодинамические параметры взаимодействия хлорида кадмия с расплавом LiCl–KCl: экспериментально измерить равновесные электродные потенциалы кадмия в расплавленной эвтектике LiCl–KCl при содержании хлорида кадмия от 0.25 до 20 мол. % в температурном интервале от 450 до 550°C, используя метод э. д. с., рассчитать значения условных стандартных электродных потенциалов кадмия в вышеупомянутой среде и определить температурную зависимость изобарно-изотермического потенциала. Показано, что с увеличением концентрации CdCl2 и повышением температуры равновесные потенциалы кадмия в расплавленной эвтектике LiCl–KCl сдвигаются в более положительную область. Получены эмпирические уравнения изотрем электродных потенциалов. По наклону изотерм установлено, что валентность катионов кадмия в расплавленной эвтектике LiCl–KCl равна двум. Результаты расчета показали, что в интервале температур 450–550°С значения энтальпии и энтропии реакции образования хлорида кадмия в расплаве LiCl–KCl равны: $\Delta H = - 382.63$ кДж/моль; $\Delta S = - 119.66$ Дж/моль · К. Энергия Гиббса реакции образования хлорида кадмия в расплаве LiCl–KCl возрастает с ростом температуры.
ВВЕДЕНИЕ
Равновесные потенциалы металлов являются важной характеристикой электрохимической системы. Во многих случаях электродные реакции протекают при потенциалах близких к равновесным. В таком случае величины равновесных потенциалов позволяют установить последовательность электроосаждения металлов в катодных процессах, характеристики сплавообразования, в целом контролировать и управлять электрохимическими процессами в высокотемпературных технологиях. Кроме того, возможно оценить валентное состояние ионов и термодинамические характеристики хлоридов металлов в исследуемой солевой системе.
В настоящее время расплав (LiCl–KCl)эвт + CdCl2 может рассматриваться как среда пирохимического или пироэлектрохимического способа переработки нитридного отработавшего ядерного топлива (ОЯТ). Нитридное ОЯТ можно растворить в расплавленной эвтектике LiCl–KCl, например, анодным растворением [1–3]. В качестве катода предполагается использовать жидкий кадмий. В этом случае для начала катодного процесса в расплав необходимо добавить хлорид какого-либо достаточно электроположительного металла. Хлорид кадмия идеально подходит для этой технологической операции, так как выделившийся кадмий присоединится к катодному металлу, и в расплав, таким образом, не вносятся дополнительные ионы.
Другой способ растворения нитридного ОЯТ называют “мягким” хлорированием (т.е. без использования газообразного Cl2), он не связан с применением электричества [4–10]. В расплаве LiCl–KCl компоненты нитридного ОЯТ непосредственно взаимодействуют с растворенным CdCl2.
В обоих случаях для моделирования процессов для разработки технологий необходимо знать равновесный потенциал кадмия в расплаве LiCl–KCl. Имеющиеся литературные данные ограничены одной работой 1959-го года [11], в которой потенциал измерен при температурах 500–550°С и при концентрациях CdCl2 от 0.67 до 13.53 мол. %.
Кроме того, в 2012 г. Волкович [12] опубликовал результаты измерений электродных потенциалов Cd2+/Cd в LiCl, RbCl и CsCl в диапазоне температур от 680 до 760°С.
Экстраполируя эти данные на расплав LiCl–KCl и на температуру 500°C, можно получить оценки искомых потенциалов. Они отличаются от данных работы [11] на 46–52 мB.
Имеющиеся в литературных источниках значения электродных потенциалов кадмия в расплавленной эвтектике LiCl–KCl лежат в достаточно узких интервалах температур и концентраций.
Целью работы является оценить термодинамические параметры взаимодействия хлорида кадмия с расплавом LiCl–KCl: экспериментально измерить равновесные электродные потенциалы кадмия в расплавленной эвтектике LiCl–KCl при содержании хлорида кадмия от 0.25 до 20 мол. % в температурном интервале от 450 до 550°C, используя метод э. д. с., рассчитать значения условных стандартных электродных потенциалов кадмия в вышеупомянутой среде и определить температурную зависимость изобарно-изотермического потенциала.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Реактивы
Для проведения экспериментов использовали эвтектическую смесь 58.8LiCl–41.2KCl (мол. %), приготовленную из порошков хлоридов лития и калия марки “ч. д. а.” в необходимом соотношении. Взвешивание проводили на весах фирмы “СартоГосм” модель – МВ210-А. Исходные соли очищали методом зонной плавки [13–15], после чего готовили навеску солей массой 40 г и помещали ее в стеглоуглеродный тигель.
Тигель опускали в реактор, представляющий из себя герметичную колбу из кварцевого стекла. Далее проводили вакуумирование внутреннего пространства реактора до остаточного давления 3 · 10–2 мм рт. ст., постепенно увеличивали температуру до 300°С, контролируя давление в реакторе; объем заполняли очищенным аргоном до атмосферного давления, плавно увеличивая температуру до 700°С (3 ч); для гомогенизации расплав выдерживали при этой температуре около 1 ч. Управление печью выполнялось с помощью терморегулятора “ОВЕН”.
Металлический кадмий очищали методом дистилляции. Ячейка для дистилляции выполнялась из кварцевого стекла и имела патрубок для создания вакуума. Одна часть ячейки, в которой испарялся и возгонялся металлический кадмий, помещалась в горизонтальную печь, а другая часть, в которой кадмий конденсируется, охлаждалась вентилятором. Горячая и холодная зоны ячейки были разделены перегородкой, чтобы избежать перетекания чистого расплавленного кадмия обратно к неочищенному. Кадмий погружался в ячейку, после чего под вакуумом прогревался при температуре 200°С, при этом удалялась лишняя влага и оксиды с поверхности кадмия, металл приобретал желтый оттенок. Далее при постепенном повышении температуры до 700°С металл начинал испаряться, а возгоны кадмия конденсировались на стенках ячейки. Извлечение очищенного слитка металлического кадмия осуществляли посредством разрушения ячейки после охлаждения.
Измерение
Условные стандартные электродные потенциалы для небольших концентраций ионов металлов в расплавах хлоридов щелочных и щелочноземельных металлов могут быть определены на основе прямых измерений. С этой целью нужно при заданной температуре измерить равновесные потенциалы исследуемого электрода по отношению к хлорному электроду сравнения для нескольких концентраций его ионов в электролите. Принимая концентрацию ионов в расплаве равной аналитически определяемой, величина условного стандартного потенциала вычисляется из равенств:
(1)
$E_{{{{{\text{M}}{{{\text{e}}}^{{n + }}}} \mathord{\left/ {\vphantom {{{\text{M}}{{{\text{e}}}^{{n + }}}} {{\text{Me}}}}} \right. \kern-0em} {{\text{Me}}}}}}^{*} = {{E}_{1}} - \frac{{RT}}{{nF}}{\text{ln[M}}{{{\text{e}}}^{{n + }}}{{{\text{]}}}_{{{\kern 1pt} 1}}} = {{E}_{2}} - \frac{{RT}}{{nF}}{\text{ln[M}}{{{\text{e}}}^{{n + }}}{{{\text{]}}}_{2}} = \ldots ,$В нашем случае измерение равновесных потенциалов кадмия сводилось к определению э. д. с. гальванического элемента: Mo|Cd(ж)|LiCl–KCl–CdCl2||LiCl–KCl|Cl2,С.
Хлорный электрод сравнения использовали в экспериментах, как наиболее точный и термодинамически обоснованный при работе с хлоридами [19]. Эксперимент проводили в кварцевой ячейке (рис. 1), в которую устанавливали основной стеклоуглеродный тигель объемом 100 мл, с находящейся в нем эвтектикой LiCl–KCl. В тигель после плавления соли погружали алундовый тигель меньшего диаметра, содержащий либо эвтектику LiCl–KCl, либо смесь (LiCl–KCl)эвт + CdCl2 известного состава и металлический кадмий. Ячейку герметично закрывали крышкой, вакуумировали, а затем заполняли аргоном. Аргон очищали пропусканием через разогретую до 700°C циркониевую стружку. Хлорид кадмия вводили в расплав двумя способами: для малых концентраций – анодным растворением металла при силе тока I = 10–12 мА, катодом при этом служил хлорный электрод сравнения, находящийся за диафрагмой; для получения расплавов, содержащих 1 мол. % CdCl2 и более, в расплав сразу добавляли навеску CdCl2 [17, 18].
Рис. 1.
Ячейка для измерения равновесных потенциалов. 1 – Кварцевая ячейка; 2 – асбестовая диафрагма; 3 – кварцевый чехол для электрода сравнения; 4 – хлорный электрод сравнения; 5 – кварцевый чехол термопары; 6 – крышка ячейки; 7 – никелевый теплозащитный экран; 8 – молибденовый токоподвод; 9 – стеклоуглеродный тигель; 10 – расплавленная эвтектика LiCl–KCl; 11 – расплав LiCl–KCl + CdCl2; 12 – алундовый тигель; 13 – расплавленный металлический кадмий.

Эксперименты выполняли при помощи потенциостата BioLogic (Франция). За установившиеся принимали значения, которые в течении часа изменялись не более чем на ±1 мВ. При вводе в расплав ионов Cd2+ анодным растворением, равновесие наступало спустя 1–1.5 ч после снятия токовой нагрузки. При задании концентрации хлорида кадмия в расплаве весовым методом, равновесие устанавливалось в течение 4–5 ч. Для стабилизации температуры ячейку с расплавом помещали в массивный металлический блок, который нагревали печью сопротивления. Температуру расплава контролировали хромель-алюмелевой термопарой, соединенной с высокоомным вольтметром. В измеренные значения равновесных потенциалов вносили поправку на величину возникающей термо-эдс между токоподводом из молибдена и металлическим электродом, и спектрально чистым углеродом и хлорным электродом. Согласно данным Смирнова [16] при температуре 500°С термо-эдс составляет –6 мВ.
РЕЗУЛЬТАТЫ
Измерения равновесных электродных потенциалов металлического кадмия $(E_{{{{{\text{C}}{{{\text{d}}}^{{2 + }}}} \mathord{\left/ {\vphantom {{{\text{C}}{{{\text{d}}}^{{2 + }}}} {{\text{Cd}}}}} \right. \kern-0em} {{\text{Cd}}}}}}^{p})$ проводили при температурах 450, 500 и 550°С в расплавленной эвтектике LiCl–KCl, содержащей от 0.25 до 3.5 мол. % CdCl2. Результаты представлены на рис. 2.
Рис. 2.
Зависимость равновесных электродных потенциалов кадмия от концентрации хлорида кадмия в расплаве.

Были получены температурные зависимости потенциалов кадмия при большем содержании хлорида кадмия в расплавленной эвтектике LiCl–KCl, а именно 10–20 мол. %. Результаты представлены на рис. 3.
Рис. 3.
Зависимость равновесных электродных потенциалов кадмия от температуры при разном содержании хлорида кадмия в расплаве.

Из зависимостей, изображенных на рис. 2 и 3 можно заключить, что с увеличением концентрации CdCl2 и повышением температуры потенциалы сдвигаются в более положительную область.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
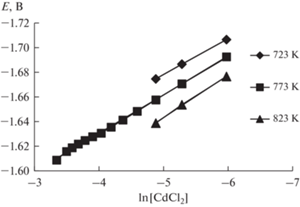
Экспериментальные зависимости измеренных равновесных электродных потенциалов от натурального логарифма концентрации хлорида кадмия (рис. 4) в расплаве описываются ур. (2):
(2)
$E_{{{{{\text{C}}{{{\text{d}}}^{{{\text{2 + }}}}}} \mathord{\left/ {\vphantom {{{\text{C}}{{{\text{d}}}^{{{\text{2 + }}}}}} {{\text{Cd}}}}} \right. \kern-0em} {{\text{Cd}}}}}}^{p} = a + b \cdot {\text{ln}}\left[ {{\text{CdC}}{{{\text{l}}}_{{\text{2}}}}} \right].$Откуда n рассчитывается как:
где $n$ – количество электронов, участвующих в реакции; $R$ – газовая постоянная, 8.31 Дж/моль · К; $T$ – температура, К; $F$ – постоянная Фарадея, 96 496 Кл/моль.Полученные значения коэффициентов уравнения представлены в табл. 1.
Таблица 1.
Эмпирические коэффициенты
| T, K | $E_{{{{{\text{C}}{{{\text{d}}}^{{2 + }}}} \mathord{\left/ {\vphantom {{{\text{C}}{{{\text{d}}}^{{2 + }}}} {{\text{Cd}}}}} \right. \kern-0em} {{\text{Cd}}}}}}^{*}$ | $b$ | n |
|---|---|---|---|
| 723 | –1.533 | 0.0291 | 2.14 |
| 773 | –1.502 | 0.0310 | 2.15 |
| 823 | –1.471 | 0.0344 | 2.06 |
Рассчитанные значения n приблизительно равны двум. Это является экспериментальным доказательством того, что при равновесии с металлом в хлоридном расплаве подавляющая часть кадмия находится в двухвалентном состоянии.
Для сравнения мы оценили условные стандартные потенциалы кадмия в расплавленной эвтектике LiCl–KCl по данным работы [12]. В ней измерены равновесные потенциалы кадмия в расплавленных LiCl, RbCl и CsCl. Температурный диапазон в работе [12] не совпадает с нашим. Была выполнена экстраполяция на температуры 450, 500 и 550°С. Установлено [16], что наблюдается линейное изменение величин $E_{{{{{\text{M}}{{{\text{e}}}^{{2 + }}}} \mathord{\left/ {\vphantom {{{\text{M}}{{{\text{e}}}^{{2 + }}}} {{\text{Me}}}}} \right. \kern-0em} {{\text{Me}}}}}}^{*}$ от обратного эффективного радиуса катиона соли-растворителя $(r_{{{\text{эф}}}}^{{ - 1}}).$ На основе данных работы [12], мы получили оценку условных стандартных потенциалов кадмия в расплаве LiCl–KCl в необходимом температурном интервале.
На рис. 5 показаны условные стандартные потенциалы кадмия при разных температурах в расплавленных LiCl, RbCl, CsCl по данным работы [12].
Рис. 5.
Зависимости условных стандартных потенциалов кадмия в разных солях-растворителях от температуры по данным работы [12].

Данные работы [12] были также аппроксимированы уравнением (4). Коэффициенты этого уравнения представлены в табл. 2.
(4)
$E_{{{{{\text{C}}{{{\text{d}}}^{{{\text{2 + }}}}}} \mathord{\left/ {\vphantom {{{\text{C}}{{{\text{d}}}^{{{\text{2 + }}}}}} {{\text{Cd}}}}} \right. \kern-0em} {{\text{Cd}}}}}}^{*} = d + c \cdot T.$Таблица 2.
Коэффициенты в уравнении (4) для условных стандартных потенциалов кадмия, полученных в работе [12]
| Соль-растворитель | $c \cdot {{10}^{4}}$ | $d$ |
|---|---|---|
| LiCl | 6.527 | –2.013 |
| RbCl | 7.285 | –2.194 |
| CsCl | 7.229 | –2.198 |
Таблица 3.
Значения условного стандартного потенциала кадмия $E_{{{{{\text{C}}{{{\text{d}}}^{{{\text{2 + }}}}}} \mathord{\left/ {\vphantom {{{\text{C}}{{{\text{d}}}^{{{\text{2 + }}}}}} {{\text{Cd}}}}} \right. \kern-0em} {{\text{Cd}}}}}}^{*}$ в зависимости от температуры [12]
| Т, К | $E_{{{{{\text{C}}{{{\text{d}}}^{{2 + }}}} \mathord{\left/ {\vphantom {{{\text{C}}{{{\text{d}}}^{{2 + }}}} {{\text{Cd}}}}} \right. \kern-0em} {{\text{Cd}}}}}}^{*}$ | ||
|---|---|---|---|
| LiCl | RbCl | CsCl | |
| 723 | –1.541 | –1.667 | –1.675 |
| 773 | –1.508 | –1.631 | –1.639 |
| 823 | –1.476 | –1.594 | –1.603 |
Кристаллографические радиусы катионов взяты по Shannon [20]. Используя линейную зависимость условных стандартных потенциалов кадмия от обратного радиуса катиона соли-растворителя, мы рассчитали $E_{{{{{\text{C}}{{{\text{d}}}^{{{\text{2 + }}}}}} \mathord{\left/ {\vphantom {{{\text{C}}{{{\text{d}}}^{{{\text{2 + }}}}}} {{\text{Cd}}}}} \right. \kern-0em} {{\text{Cd}}}}}}^{*}$ в расплавленной эвтектике LiCl–KCl. Результаты представлены на рис. 6.
Рис. 6.
Зависимости условного стандартного потенциала кадмия $E_{{{{{\text{C}}{{{\text{d}}}^{{{\text{2 + }}}}}} \mathord{\left/ {\vphantom {{{\text{C}}{{{\text{d}}}^{{{\text{2 + }}}}}} {{\text{Cd}}}}} \right. \kern-0em} {{\text{Cd}}}}}}^{*}$ от обратного радиуса катиона соли-растворителя $r_{{{\text{эф}}}}^{{ - 1}}$ на основании расчетов по данным работы [12].

Обратный эффективный радиус катиона эвтектики LiCl–KCl рассчитывался по формуле (5):
(5)
$r_{{{\text{эф}}}}^{{ - 1}}\left( {{\text{L}}{{{\text{i}}}^{ + }} - {{{\text{K}}}^{ + }}} \right) = 0.588 \cdot {{r}^{{ - 1}}}({\text{L}}{{{\text{i}}}^{ + }}) + 0.412{{r}^{{ - 1}}}({{{\text{K}}}^{ + }}).$Таблица 4.
Условные стандартные потенциалы $E_{{{{{\text{C}}{{{\text{d}}}^{{{\text{2 + }}}}}} \mathord{\left/ {\vphantom {{{\text{C}}{{{\text{d}}}^{{{\text{2 + }}}}}} {{\text{Cd}}}}} \right. \kern-0em} {{\text{Cd}}}}}}^{*}.$ Экспериментальные данные и оцененные по данным работы [12]
| Т, К | $E_{{{{{\text{C}}{{{\text{d}}}^{{2 + }}}} \mathord{\left/ {\vphantom {{{\text{C}}{{{\text{d}}}^{{2 + }}}} {{\text{Cd}}}}} \right. \kern-0em} {{\text{Cd}}}}}}^{*}$, B | Разница, B | |
|---|---|---|---|
| рассчитанные по данным [10] | наши данные | ||
| 723 | –1.587 | –1.533 | 0.054 |
| 773 | –1.553 | –1.506 | 0.047 |
| 823 | –1.519 | –1.471 | 0.048 |
Условные потенциалы, рассчитанные по данным работы [12], отличаются от наших на 47–54 мВ. Это может быть связанно с тем, что наши измерения и измерения в работе [12] проводились при значительно отличающихся температурах (различие в 200°С).
В работе [11] условные стандартные потенциалы кадмия измерены в расплавленной эвтектике LiCl–KCl и при температурах близких к температурам наших экспериментов.
На рис. 7 полученные нами данные по условным стандартным потенциалам кадмия сопоставлены с данными работ [11] и [12].
Рис. 7.
График зависимости условного стандартного электродного потенциал кадмия в расплавленной эвтектике LiCl–KCl от температуры.

Полученные нами условные стандартные потенциалы кадмия практически совпадают с потенциалами, полученными в работе [11].
Зная условные стандартные электродные потенциалы $E_{{{{{\text{C}}{{{\text{d}}}^{{{\text{2 + }}}}}} \mathord{\left/ {\vphantom {{{\text{C}}{{{\text{d}}}^{{{\text{2 + }}}}}} {{\text{Cd}}}}} \right. \kern-0em} {{\text{Cd}}}}}}^{*},$ измеренные по отношению к хлорному электроду сравнения, можно рассчитать условные стандартные величины изменения энергии Гиббса $\Delta G_{{{\text{CdC}}{{{\text{l}}}_{{2\left( {{\text{распл}}} \right)}}}}}^{*}$ при реакции:
(6)
${\text{C}}{{{\text{d}}}_{{({\text{ж}})}}} + {\text{C}}{{{\text{l}}}_{{2({\text{г}})}}} = {\text{CdC}}{{{\text{l}}}_{{2({\text{распл}})}}},$(7)
$\Delta G_{{{\text{CdC}}{{{\text{l}}}_{{{\text{2}}\left( {{\text{распл}}} \right)}}}}}^{*} = - ~n \cdot F \cdot E_{{{{{\text{C}}{{{\text{d}}}^{{{\text{2 + }}}}}} \mathord{\left/ {\vphantom {{{\text{C}}{{{\text{d}}}^{{{\text{2 + }}}}}} {{\text{Cd}}}}} \right. \kern-0em} {{\text{Cd}}}}}}^{*},$(8)
$\Delta G_{{{\text{смеш}}}}^{*} = \Delta G_{{{\text{CdC}}{{{\text{l}}}_{{{\text{2}}\left( {{\text{распл}}} \right)}}}}}^{*} - \Delta G_{{{\text{CdC}}{{{\text{l}}}_{{{\text{2}}\left( {\text{ж}} \right)}}}}}^{0}.$Таблица 5.
Рассчитанные по нашим результатам значения изменения энергии Гиббса при растворении CdCl2 в эвтектике LiCl–KCl
| T, К | $E_{{{{{\text{C}}{{{\text{d}}}^{{2 + }}}} \mathord{\left/ {\vphantom {{{\text{C}}{{{\text{d}}}^{{2 + }}}} {{\text{Cd}}}}} \right. \kern-0em} {{\text{Cd}}}}}}^{*}$, В | $\Delta G_{{{\text{CdC}}{{{\text{l}}}_{{2\left( {{\text{распл}}} \right)}}}}}^{*}$, кДж/моль | $\Delta G_{{{\text{CdC}}{{{\text{l}}}_{{2\left( {\text{ж}} \right)}}}}}^{0}$, кДж/моль | $\Delta G_{{{\text{смеш}}}}^{*}$, кДж/моль |
|---|---|---|---|---|
| 723 | –1.533 | –295.86 | –272.20 | –23.66 |
| 773 | –1.502 | –289.87 | –267.00 | –22.87 |
| 823 | –1.471 | –283.89 | –261.80 | –22.09 |
Рис. 8.
Зависимость условного стандартного электродного потенциала $E_{{{{{\text{C}}{{{\text{d}}}^{{{\text{2 + }}}}}} \mathord{\left/ {\vphantom {{{\text{C}}{{{\text{d}}}^{{{\text{2 + }}}}}} {{\text{Cd}}}}} \right. \kern-0em} {{\text{Cd}}}}}}^{*}$ в расплавленной эвтектике LiCl–KCl от температуры, полученная экспериментально.

С ростом температуры значение $E_{{{{{\text{C}}{{{\text{d}}}^{{{\text{2 + }}}}}} \mathord{\left/ {\vphantom {{{\text{C}}{{{\text{d}}}^{{{\text{2 + }}}}}} {{\text{Cd}}}}} \right. \kern-0em} {{\text{Cd}}}}}}^{*}$ сдвигается в положительную область.
Наблюдается линейная зависимость (10):
(9)
$E_{{{{{\text{C}}{{{\text{d}}}^{{{\text{2 + }}}}}} \mathord{\left/ {\vphantom {{{\text{C}}{{{\text{d}}}^{{{\text{2 + }}}}}} {{\text{Cd}}}}} \right. \kern-0em} {{\text{Cd}}}}}}^{*} = a - b \cdot T.$Следовательно:
ВЫВОДЫ
Измерены равновесные потенциалы в расплавах на основе эвтектической системы 0.588LiCl–0.412KCl, содержащей дихлорид кадмия. Измерения выполнены в диапазоне температур 450–550°С и в интервале концентраций 0.25–20 мол. % CdCl2. С увеличением концентрации CdCl2 и повышением температуры потенциалы сдвигаются в более положительную область.
Получены на основании экспериментальных данных эмпирические уравнения изотерм электродных потенциалов. По наклону изотерм установлено, что валентность катионов кадмия в расплавленной эвтектике LiCl–KCl равна двум.
Рассчитаны методом эдс условные стандартные электродные потенциалы $E_{{{{{\text{C}}{{{\text{d}}}^{{{\text{2 + }}}}}} \mathord{\left/ {\vphantom {{{\text{C}}{{{\text{d}}}^{{{\text{2 + }}}}}} {{\text{Cd}}}}} \right. \kern-0em} {{\text{Cd}}}}}}^{*},$ определена их температурная зависимость:
(12)
$E_{{{{{\text{C}}{{{\text{d}}}^{{{\text{2 + }}}}}} \mathord{\left/ {\vphantom {{{\text{C}}{{{\text{d}}}^{{{\text{2 + }}}}}} {{\text{Cd}}}}} \right. \kern-0em} {{\text{Cd}}}}}}^{*} = - 1.981 + 6.2 \cdot {{10}^{{ - 4}}} \cdot T.$Энергия Гиббса реакции образования хлорида кадмия в расплаве LiCl–KCl уменьшается по модулю с ростом температуры.
Список литературы
Hayashi H., Sato T., Shibata H. Pyrochemical treatment of spent nitride fuels for MA transmutation // Sci. China Chem. 2014. 11. P. 1427–1431.
Hayashi H., Shibata H., Akabori M. [and other]. Electrolysis of AmN in LiCl–KCl eutectic melts and renitridation of Am recovered in liquid Cd cathode // Denki Kagaku Oyobi Kogyo Butsuri Kagaku. 2009. 8. P. 673–676.
Shirai O., Kato T., Iwai T. [and other]. Electrochemical behaviors of PuN and (U, Pu)N in LiCl–KCl eutectic melts // J. Phys. Chem. Solids. 2005. 2–4. P. 456–460.
Zaykov Yu.P., Mochalov Yu.S., Khokhlov V.A. [and other]. Pyrochemical recycling of the nitride SNF of fast neutron reactors in molten salts as a part of the short-circuited nuclear fuel cycle // Int. Conf. on Fast Reactors and Related Fuel Cycles: Next Generation Nuclear Systems for Sustainable Development. Yekaterinburg, RF Book of Abstracts (CD) IAEA-CN245. Rep. 259.
Shishkin V.Yu., Potapov A.M., Kovrov V. [and other] The peculiarities of pyrochemical reprocessing of spent nuclear fuel // Int. nuclear fuel cycle conf. Nuclear energy innovation to the carbon-free world. 2017, Seoul (Korea). Proceedings. Paper EA-104-PD3.
Zhitkov A., Potapov A., Karimov K., Shishkin V., Dedyukhin A., Zaykov Y. Interaction between UN and CdCl2 in molten LiCl–KCl eutectic. I. Experiment at 773 K // Nucl. Eng. Techn. 2020. 52. P. 123–134.
Zhitkov A., Potapov A., Karimov K., Kholkina A., Shishkin V., Dedyukhin A., Zaykov Y. Interaction between UN and CdCl2 in molten LiCl–KCl eutectic. II. Experiment at 1023 K // Nucl. Eng. Techn. 2022. 54. P. 653–660.
Hayashi H., Kobayashi F., Ogawa T., Minato K.J. Dissolution of uranium nitrides in LiCl–KCl eutectic melt // Nucl. Scienceand Technology. 2002. № 3. P. 624–627.
Song K.-C., Lee H., Hur J.-M. [and other] Status of pyroprocessing technology development in Korea // Nucl. Eng. Techn. 2010. 2. P. 131–144.
Nakazono Y., Iwai T, Arai Y. Pyroprocessing of nitride fuel // Proc. Symp. on Nitride Fuel Cycle Technology. 2004. JAERI, Tokai, Japan. JAERI-Conf 2004-015. P. 91–96.
Yang L., Hudson R. G. Equilibrium electrode potentials of some metal-chlorine galvanic cells and activities of some metal chlorides in LiCl–KCl eutectic melt // Transactions of the metallurgical society of aime. 1959. P. 589–601.
Волкович А. В. Равновесные потенциалы кадмия в хлоридных расплавах лития, рубидия и цезия // Расплавы. 2012. № 1. С. 20–28.
Бочегов В.И., Сигайлов М.В., Солодкова М.В. Аналитический и численный расчет очистки простых кристаллических веществ методом зонной плавки с конечным размером слитка // Расплавы. 2014. № 4. С. 87–96.
Пфанн В. Зонная плавка. М.: Мир, 1970.
Шишкин В.Ю., Митяев В.С. Очистка галогенидов щелочных металлов методом зонной плавки // Известия АН СССР. Неорганические материалы. 1982. № 11. С. 1917–1918.
Смирнов М.В. Электродные потенциалы в расплавленных хлоридах. М.: Наука, 1973.
Поддымов B.П., Машовец B.П. О природе растворов кадмия в расплавах его галогенидов. Физическая химия расплавленных солей // Тр. 2-го Всес. совещ. по физ. химии расплавленных солей. 1965. С. 236–243.
Волкович A.B., Потапенко O.Г., Новиков E.A., Ничков И.Ф., Лязгин Б.И. Равновесие между кадмием и кадмийсодержащими хлоридными и хлоридно-фторидными расплавами калия и натрия. Физическая химия и электрохимия расплавленных и твердых электролитов // Тезисы докладов V Всес. совещ. по физической химии и электрохимии расплавленных солей, оксидных расплавов и твердых электролитов. Том I. Структура и свойства электролитов. 1973. С. 79–81.
Алабышев А.Ф., Лантратов М., Морачевский А. Электроды сравнения для расплавленных солей. M.: Металлургия, 1965.
Shannon R.D. Revised effective ionic radii and systematic studies of interatomic distances in halides and chalcogenides // Acta Crystallogr. 1976. A32. P. 751–767.
Компьютерная программа HSC Chemistry. Версия 7.1. Лицензия N 71 175 от 25 февраля 2014 г.
Дополнительные материалы отсутствуют.