Теоретические основы химической технологии, 2021, T. 55, № 4, стр. 480-488
Растворение оксидов металлов в глубоком эвтектическом растворителе хлорид холина–сульфосалициловая кислота
И. В. Зиновьева a, А. Я. Федоров a, Н. А. Милевский a, Ю. А. Заходяева a, *, А. А. Вошкин a
a Институт общей и неорганической химии им. Н.С. Курнакова РАН
Москва, Россия
* E-mail: yz@igic.ras.ru
Поступила в редакцию 23.03.2021
После доработки 24.03.2021
Принята к публикации 25.03.2021
Аннотация
Предложен глубокий эвтектический растворитель (DES) хлорид холина–сульфосалициловая кислота для растворения оксидов Co(II), Cu(II), Zn(II), Fe(III), Ni(III) и Mn(III). Проведено экспериментальное исследование влияния времени растворения, массового соотношения твердое : жидкость, температуры и мольного соотношения хлорида холина и сульфосалициловой кислоты на растворение оксидов металлов в предложенном DES. Установлен механизм растворения исследуемых оксидов металлов. Показано, что DES хлорид холина–сульфосалициловая кислота может быть потенциально использован для эффективного выщелачивания металлов из компонентов отработанных химических источников тока.
ВВЕДЕНИЕ
Возрастающее количество металлсодержащих отходов, являющихся источником широкого круга стратегически важных и ценных элементов, побуждает научное сообщество уделять все больше внимания разработке экономически выгодных и ресурсосберегающих технологий. Экстракция является хорошо известным эффективным методом извлечения, разделения и очистки металлов [1–6]. Традиционно в гидрометаллургическом методе для извлечения металлов из твердого в качестве выщелачивающих агентов применяют водные растворы неорганических (соляная, серная, азотная и др.), органических (лимонная, янтарная, винная, молочная, яблочная, аскорбиновая) кислот, щелочей (например, гидроксид натрия) и солей (например, оксалаты, тартраты и др.). В настоящее время уделяют большое внимание применению в качестве выщелачивающих агентов неводных растворителей, таких как молекулярные органические растворители, ионные жидкости и глубокие эвтектические растворители. Предварительные исследования показали, что глубокие эвтектические растворители позволяют эффективно извлекать металлы из природных руд (например, гетит), отработанных аккумуляторов (Li-ion, Ni-MH и др.), магнитов (NdFeB, SmCo), флуоресцентных ламп и других металлсодержащих отходов [7–11]. Поскольку металлы в твердых компонентах вышеперечисленных источников содержатся чаще всего в форме оксидов, в работах [12–16] проведено исследование растворения различных оксидов металлов с использованием DES. Более высокой растворяющей способностью обладают DES, где одним из компонентов является карбоновая кислота, поскольку повышенная кислотность среды способствует разрыву связи Me–O. Ранее было показано, что DES хлорид холина–этиленгликоль проявляет слабые растворяющие свойства по отношению к оксидам кобальта, марганца, никеля, железа и др. Однако введение в DES хлорид холина–этиленгликоль 0.1 М раствора трифторметансульфокислоты увеличивает эффективность растворения ряда оксидов металлов более чем в 10 раз [12]. При этом растворимость оксидов металлов в DES зависит от значения энергии кристаллической решетки и чем она выше, тем меньше растворимость оксида металла. Также было установлено, что замещение гидроксильных групп на тиольные в структуре донора водородной связи приводит к улучшению физических свойств DES и увеличению их растворяющей способности. DES хлорид холина–п-толуолсульфоновая кислота показал себя эффективным растворителем для оксидов металлов по сравнению с DES на основе мочевины, малоновой кислоты и в ряде случаев с соляной кислотой. В работе [17] показано, что DES на основе п-толуолсульфоновой кислоты способен количественно извлекать литий и кобальт из катода Li-ion батарейки при температуре 90°С за 15 мин. Однако стоит отметить, что количество работ по изучению выщелачивания оксидов металлов с использованием DES на основе органических кислот невелико.
Ранее нами был изучен DES хлорид холина–сульфосалициловая кислота и опробован для извлечения металлов из их оксидов [18]. Настоящая работа является продолжением исследования растворения оксидов металлов с использованием предложенного DES. В качестве модельных объектов были выбраны оксиды Co(II), Zn(II), Cu(II), Fe(III), Ni(III), Mn(III), которые имеют наибольшее экономическое значение и широко используются в компонентах химических источников тока.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Хлорид холина (Acros Organics, чистота 99%) и сульфосалициловая кислота квалификации “х. ч.” были использованы без дополнительной очистки. Оксиды кобальта (II), меди (II), цинка(II), железа(III), никеля(III) и марганца(III) использовали со степенью чистоты >99%.
В качестве растворителя был использован DES на основе хлорида холина и сульфосалициловой кислоты эвтектического состава в мольном соотношении 7 : 3. Взвешенные на аналитических весах AND HR-100AZ (Япония) реагенты помещали в стеклянные виалы объемом 10 мл. Для образования глубокого эвтектического растворителя виалы помещали в термостатированную глицериновую баню при температуре 90°С и перемешивали при 1250 об./мин в течение 120 мин на магнитной мешалке IKA C-MAG HS 4 (Германия).
Исследование растворения оксидов Cu(II), Co(II), Zn(II), Fe(III), Ni(III) и Mn(III) в DES проводили в стеклянных виалах при массовом соотношении твердой и жидкой фазы 1 : 25. Эксперименты проводили в термостатированных условиях при температуре 80°С и постоянном перемешивании 1250 об./мин. Время, при котором достигается максимальная растворимость оксидов металлов в DES, было определено и в большинстве экспериментов составляло 120 мин.
Концентрацию ионов металлов в DES после растворения оксидов определяли спектрофотометрическим методом с использованием 4-(2-пиридилазо)резорцина, образующего комплексы с металлами, которые поглощают в видимой области спектра на следующих длинах волн, нм: Zn (492), Ni (495), Cu (496), Mn (499), Co (510). Содержание Fe(III) в жидкой фазе после экстракции определяли методом спектрофотометрии в видимой области (λ = 420 нм) с использованием в качестве индикатора сульфосалициловой кислоты относительно холостых растворов. Измерение оптической плотности проводили на приборе Экросхим ПЭ-5400УФ (Россия).
Для установления состава комплексов металлов после растворения были записаны спектры поглощения в области длин волн от 190 до 1000 нм на приборе Cary-60 Agilent Tech. (США) в кварцевых кюветах толщиной 1 мм.
Спектры ядерного магнитного резонанса для чистого и содержащих металлы DES были записаны в дейтерированном растворителе (D3С)2SO) на спектрометре Bruker Fourier 300 HD (Швейцария) с рабочей частотой 300 МГц при температуре 25°С.
Представленные экспериментальные данные являются результатом серии экспериментов и обработаны методами математической статистики.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Впервые проведено исследование растворения ряда оксидов металлов с использованием DES на основе хлорида холина и сульфосалициловой кислоты.
На рис. 1 представлены результаты растворения оксидов металлов во времени в диапазоне от 5 до 300 мин. Постоянное значение содержания металлов в растворе устанавливается после 120 мин растворения для всех исследуемых оксидов. Из полученных результатов видно, что максимальная растворимость оксидов металлов в предложенном DES достигается достаточно быстро по сравнению с ранее изученными DES на основе левулиновой и щавелевой кислот, где время, за которое растворимость оксидов металлов достигает максимального значения, составляет более 10 ч [15].
Рис. 1.
Зависимость содержания металлов в DES хлорид холина–сульфосалициловая кислота (7 : 3) от времени проведения процесса: T = 80°C; соотношение твердое : жидкость = 1 : 25.

Для установления состава извлеченных соединений металлов были получены электронные спектры поглощения глубокого эвтектического растворителя после растворения оксидов кобальта(II) и меди(II) в видимой области спектра (рис. 2). Видно, что в DES металлы существуют в виде тетрахлоридных комплексов. На основе полученных результатов процесс растворения, протекающий с участием DES хлорид холина–сульфосалициловая кислота можно описать следующим уравнением:
Рис. 2.
Электронные спектры поглощения DES хлорид холина–сульфосалициловая кислота после растворения: (а) – CuO, (б) – CoO.

Растворение оксидов железа(III) и цинка(II) протекает по схожему механизму ввиду возможного образования устойчивых анионных хлорокомплексов [FeCl4]– и [ZnCl4]2–. Кроме того, электронные спектры поглощения в видимой области спектра подтверждают отсутствие сульфосалицилатных комплексов для железа(III), существующие при 540 нм. Тем не менее косвенным подтверждением соответствия механизма растворения вышеприведенному уравнению является спектр электронного поглощения, полученный для раствора железа(III), разбавленного этиловым спиртом и снятый относительно чистого DES с соответствующей концентрацией также в этиловом спирте. На рис. 3 помимо максимума поглощения на длине волны 306 нм, относящейся к сульфосалициловой кислоте, виден характерный максимум поглощения на длине волны 365 нм, который соответствует иону [FeCl4]–.
Особый интерес представляет изучение механизма растворения Ni2O3 и Mn2O3. На рис. 4 представлен электронный спектр поглощения DES после растворения оксида никеля(III) с максимумами поглощения на 657 и 708 нм, подтверждающий образованием анионного хлорокомплекса Ni(II). Таким образом, процесс растворения оксидов никеля и марганца сопровождается окислительно-восстановительной реакцией и его можно представить следующим уравнением:
Рис. 4.
Электронный спектр поглощения DES хлорид холина–сульфосалициловая кислота после растворения Ni2O3.

На примере растворения оксида кобальта(II) показано, что введение дополнительного количества воды в DES до 40% не влияет на механизм растворения, что подтверждается электронными спектрами DES, записанными после растворения (рис. 5).
Рис. 5.
Электронные спектры DES хлорид холина–сульфосалициловая кислота после растворения CoO при различном содержании воды.

Для подтверждения существования в комплексе катиона холина была снята серия 1H ЯМР-спектров для растворов кобальта(II), меди(II) и цинка(II). На рис. 6 видно, что сигнал метильных групп, связанных с атомом азота в ионе холина, на спектрах растворов металлов в DES имеет сдвиг, отличный от соответствующего на спектре чистого DES. Данный факт говорит о встраивании в координационную сферу холина хлорных анионных комплексов металлов.
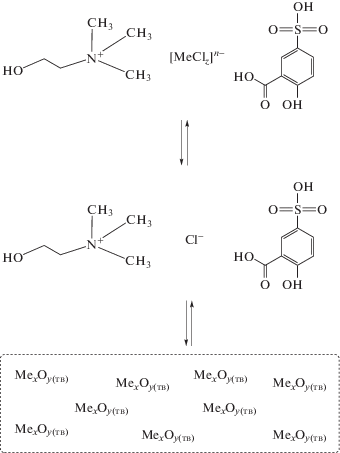
На рис. 7 схематично представлен механизм растворения исследуемых оксидов металлов в предложенном DES.
Рис. 7.
Схематичное представление растворения оксида металла в системе с DES хлорид холина–сульфосалициловая кислота.
Проведено исследование зависимости растворения оксидов металлов от температуры в диапазоне от 60 до 100°С. Результаты, представленные на рис. 8, показывают, что содержание металлов в системе с DES возрастает с увеличением температуры практически линейно. Максимальные значения для всех исследуемых металлов достигаются при 100°С. Таким образом, DES хлорид холина–сульфосалициловая кислота может быть использован для комплексного извлечения металлов из их оксидов.
Рис. 8.
Влияние температуры на растворение оксидов металлов в DES хлорид холина–сульфосалициловая кислота (7 : 3).

Были проведены исследования влияния массового соотношения твердой и жидкой фазы на растворение оксидов металлов в DES. Исследуемые соотношения составляли 1 : 15, 1 : 25, 1 : 50, 1 : 100 и 1 : 150. Результаты исследования зависимости содержания металлов в DES представлены на рис. 9.
Рис. 9.
Влияние соотношения твердое : жидкость на растворение оксидов металлов в DES хлорид холина–сульфосалициловая кислота (7 : 3): Т = 80°С.

Варьирование массового соотношения оксида металла к DES позволило выявить наиболее оптимальные условия проведения процесса их растворения. Анализ полученных зависимостей показал, что рост содержания Co(II), Cu(II), Zn(II) и Fe(III) наблюдается во всем исследуемом диапазоне соотношений твердое : жидкость, достигая максимального значения при 1 : 200. Однако скорость роста концентрации с изменением соотношения твердое : жидкость минимальна в диапазоне 1 : 50–1 : 200. Таким образом, соотношение 1 : 50 является оптимальным с точки зрения эффективности и экономичности. Растворимость оксида марганца(III) и никеля(III) при разных соотношениях твердое : жидкость изменяется незначительно.
Известно, что концентрация ионов Cl– является определяющим фактором в образовании преобладающих форм хлорокомплексов металлов в растворе. Нами было изучено влияние соотношения хлорида холина и сульфосалициловой кислоты на содержание металлов в системе с предложенным DES (рис. 10). Как и предполагалось, с возрастанием содержания хлорида холина в DES растворимость оксидов металлов увеличивается ввиду повышения количества ионов Сl–, благоприятствуя образованию хлоридных комплексов. Для всех исследуемых оксидов металлов растворяющая способность DES увеличивается в следующем ряду соотношений HBA : HBD: (3 : 7) < < (1 : 1) < (7 : 3) < (4 : 1). В случае с оксидами железа(III), кобальта (II) и цинка (II) при использовании DES хлорид холина–сульфосалициловая кислота при мольном соотношении HBA : HBD, равном 4 : 1, наблюдается количественное растворение.
ЗАКЛЮЧЕНИЕ
В настоящей работе для растворения оксидов металлов был предложен DES хлорид холина–сульфосалициловая кислота. Установлен механизм растворения оксидов металлов в DES. Металлы переходят в раствор в виде анионных комплексов ${\text{MeCl}}_{4}^{{n - }}.$ Изучено влияние температуры, соотношения твердое : жидкость, времени проведения процесса и соотношения HBA : HBD на растворение оксидов металлов. Исходя из полученных результатов, можно сделать вывод, что предложенный DES позволяет эффективно растворять оксиды металлов.
Исследование выполнено за счет гранта Российского научного фонда (проект № 20-13-00387).
Список литературы
Meng F., Liu Q., Kim R., Wang J., Liu G., Ghahreman A. Selective recovery of valuable metals from industrial waste lithium-ion batteries using citric acid under reductive conditions: Leaching optimization and kinetic analysis // Hydrometallurgy. 2020. V. 191. P. 105160.
Федорова М.И., Левина А.В., Заходяева Ю.А., Вошкин А.А. Межфазное распределение V(IV) в системе полиэтиленгликоль 1500–нитрат натрия–вода // Теор. осн. хим. технол. 2020. Т. 54. № 4. С. 475. [Fedorova M.I., Levina A.V., Zakhodyaeva Y.A., Voshkin A.A. Interphase Distribution of V(IV) in the Polyethylene Glycol 1500–Sodium Nitrate–Water System // Theor. Found. Chem. Eng. 2020. V. 54. № 4. P. 604.]
Zakhodyaeva Y.A., Zinov’eva I.V., Tokar E.S., Voshkin A.A. Complex extraction of metals in an aqueous two-phase system based on poly(ethylene oxide) 1500 and sodium nitrate // Molecules. 2019. V. 24. № 22. P. 4078.
Федорова М.И., Заходяева Ю.А., Зиновьева И.В., Вошкин А.А. Извлечение легких редкоземельных элементов из нитратных растворов с использованием полиэтиленгликоля-1500 // Изв. Акад. наук. Сер. хим. 2020. Т. 7. С. 1344. [Fedorova M.I., Zakhodyaeva Y.A., Zinov’eva I.V., Voshkin A.A. Recovery of rare-earth elements from nitrate solutions using polyethylene glycol 1500 // Russ. Chem. Bull. 2020. V. 69. № 7. P. 1344.]
Федорова М.И., Заходяева Ю.А., Баранчиков А.Е., Кренев В.А., Вошкин А.А. Экстракционная переработка Fe,Ni-содержащих элементов Ni-МH аккумуляторов // Журн. неорг. хим. 2021. Т. 66. № 2. С. 274. [Fedorova M.I., Zakhodyaeva Y.A., Baranchikov A.E., Krenev V.A., Voshkin A.A. Extraction Reprocessing of Fe,Ni-Containing Parts of Ni–MH Batteries // Russ. J. Inorg. Chem. 2021. V. 66. № 2. P. 266.]
Федорова М.И., Зиновьева И.В., Заходяева Ю.А., Вошкин А.А. Экстракция Fe(III), Zn(II) и Mn(II) в системе с “зеленым” растворителем для тиоцианата триоктилметиламмония // Теор. осн. хим. технол. 2020. Т. 54. № 2. С. 202. [Fedorova M.I., Zinov’eva I.V., Zakhodyaeva Y.A., Voshkin A.A. Extraction of Fe(III), Zn(II), and Mn(II) using a system with a green solvent for trioctylmethylammonium thiocyanate // Theor. Found. Chem. Eng. 2020. V. 54. № 2. P. 313.]
Riaño S., Petranikova M., Onghena B., Vander Hoogerstraete T., Banerjee D., Foreman M.R.StJ., Ekberg C., Binnemans K. Separation of rare earths and other valuable metals from deep-eutectic solvents: A new alternative for the recycling of used NdFeB magnets // RSC Adv. 2017. V. 7. P 32100.
Ni S., Su J., Zhang H., Zeng Z., Zhi H., Sun X. A cleaner strategy for comprehensive recovery of waste SmCo magnets based on deep eutectic solvents // Chem. Eng. J. 2021. V. 412. Article number 128602.
Pateli I.M., Abbott A.P., Binnemans K., Rodriguez N. Recovery of yttrium and europium from spent fluorescent lamps using pure levulinic acid and the deep eutectic solvent levulinic acid–choline chloride // RSC Adv. 2020. V. 10. № 48. P. 28879.
Tran M.K., Rodrigues M.T.F., Kato K., Babu G., Aja-yan P.M. Deep eutectic solvents for cathode recycling of Li-ion batteries // Nat. Energy. 2019. V. 4. P. 339.
Zürner P., Frisch G. Leaching and selective extraction of indium and tin from zinc flue dust using an oxalic acid based deep eutectic solvent // ACS Sustainable Chem. Eng. 2019. V. 7. № 5. P. 5300.
Pateli I.M., Thompson D., Alabdullah S., Abbott A.P., Jenkin G., Hartley J. The effect of pH and hydrogen bond donor on the dissolution of metal oxides in deep eutectic solvents // Green Chem. 2019. V. 22. P. 5476.
Damilano G., Laitinen A., Willberg-Keyriläinen P., Lavonen T., Häkkinen R., Dehaen, W., Binnemans K., Kuutti, L. Effects of thiol substitution in deep-eutectic solvents (DESs) as solvents for metal oxides // RSC Adv. 2020. V. 10. № 39. P. 23484.
Abbott A.P., Capper G., Davies D.L., McKenzie K.J., Obi S.U. Solubility of Metal Oxides in Deep Eutectic Solvents Based on Choline Chloride // J. Chem. Eng. Data. 2006. V. 51. № 4. P. 1280.
Richter J., Ruck M. Synthesis and Dissolution of Metal Oxides in Ionic liquids and Deep Eutectic Solvents // Molecules. 2019. V. 25. № 1. P. 78.
Rodriguez N., Machiels L., Binnemans K. p-Toluenesulfonic Acid-based Deep-Eutectic Solvents for Solubilizing Metal Oxides // ACS Sustainable Chem. Eng. 2019. V. 7. № 4. P. 3940.
Roldan-Ruiz M.J., Ferrer M.L., Gutierrez M.C., del Monte F. Highly efficient p-toluenesulfonic acid-based deep-eutectic solvent for cathode recycling of Li-ion battery // ACS Sustainable Chem. Eng. 2020. V. 8. P. 5437.
Зиновьева И.В., Федоров А.Я., Милевский Н.А., Заходяева Ю.А., Вошкин А.А. Глубокий эвтектический растворитель на основе хлорида холина и сульфосалициловой кислоты: свойства и применение // Теор. осн. хим. технол. 2021. Т. 55. № 3. С. 299.
Дополнительные материалы отсутствуют.
Инструменты
Теоретические основы химической технологии





