Успехи современной биологии, 2022, T. 142, № 4, стр. 349-364
Роль водорода и метана микробиома человека и животных в обеспечении антиоксидантной защиты организма
1 Факультет фундаментальной медицины МГУ им. М.В. Ломоносова
Москва, Россия
2 Институт экспериментальной кардиологии Национального медицинского
исследовательского центра кардиологии МЗ РФ
Москва, Россия
* E-mail: oleg.omedvedev@gmail.com
Поступила в редакцию 15.05.2022
После доработки 15.05.2022
Принята к публикации 16.05.2022
- EDN: JHCMCB
- DOI: 10.31857/S004213242204007X
Аннотация
Описаны современные представления о микробиоме желудочно-кишечного тракта и особенностях его ферментативной активности. Дана информация о типах металл-протеиновых гидрогеназ, необходимых как для продукции, так и для утилизации молекулярного водорода. Гидрогеназы метаногенных архей участвуют только в утилизации свободного водорода. Рассмотрены особенности строения архей и их принципиальные отличия от бактерий микробиоты. В настоящее время доказательства антиоксидантной активности молекулярного водорода провоцируют повышенный интерес к исследованиям и механизмов его действия, и его эффективности при многих патологических состояниях, в патогенезе которых участвует оксидативный стресс. Приведены данные о кинетике образования и утилизации водорода и метана, описаны неинвазивные способы их изучения в эксперименте и клинике. Указывается на перспективность ингибирования метаногенных архей с целью уменьшения отрицательного влияния промышленного животноводства на процессы глобального потепления. Предлагаются подходы для оптимального сочетания экзогенного и эндогенного (из микробиоты) водорода для персонифицированной профилактики неинфекционных болезней путем повышения уровня водорода в крови с целью усиления антиоксидантной защиты организма человека.
ВВЕДЕНИЕ
В последние годы резко повысился интерес к изучению роли совокупности микроорганизмов толстого кишечника (микробиоты) у животных и человека и их способности к генерации ряда метаболитов, которые способны осуществлять как протективное, так и провоцирующее воздействие при развитии метаболических, сердечно-сосудистых и других неинфекционных заболеваний. Во многом это связано с тем, что, начиная с 2000-х гг., стали широко внедряться метагеномные методы 16S rRNA в фундаментальных и клинических исследованиях. Подтверждением этому является резкое увеличение числа публикаций по результатам изучения микробиома кишечника. Так, поиск публикаций по ключевым словам “gut microbiome” в базе данных PubMed (20.02.2022) обнаруживает менее 90 опубликованных статей в год в период до 2010 г. и более 9 тыс. – в 2020–2021 гг.
Кишечная микрофлора – важный фактор в процессах получения, накопления и траты энергии, извлекаемой из пищи. Ранее было показано, что всасывание жиров, простых углеводов и белков начинается в двенадцатиперстной кишке и в основном заканчивается в подвздошной (DiBaise et al., 2008). Дистальная часть тонкой кишки вовлечена во всасывании желчных кислот и витамина В12, тогда как в толстой кишке происходит всасывание воды, электролитов и короткоцепочечных жирных кислот, образующихся за счет микробной ферментации (Krajmalnik-Brown et al., 2012). Суммарно толстая кишка получает только около 15% от всех карбогидратов пищи и 5–33% белков (Sender et al., 2016).
У новорожденных кишечный тракт содержит мало микроорганизмов, однако он быстро заселяется триллионами (1013–1014) непатогенных микроорганизмов, обычно это факультативные анаэробы, потом облигатные анаэробы, включающие Bifidobacterium, Bacteroides и Clostridium (Robertson et al., 2019; Kalantar-Zadeh et al., 2019).
Общее количество микроорганизмов в организме человека превышает общее количество соматических клеток в 1.3–2.3 раза, в зависимости от возраста и состояния организма (Robertson et al., 2019).
Плотность микробных клеток по ходу желудочно-кишечного тракта (ЖКТ) неоднородна. В желудке она наименьшая и составляет 102–103 бактерий/мл, что, видимо, связано с высокой кислотностью содержимого; в двенадцатиперстной кишке и верхних отделах тонкой кишки эта величина достигает 103–106/мл, что связывают с относительно высокой скоростью прохождения содержимого; в нижних отделах тонкого кишечника – 107–109/мл; максимальная концентрация определяется в толстой кишке – 1010–1012 микробных клеток/мл (Staley, Konopka, 1985; Mailhe et al., 2018; Robertson et al., 2019).
Микроскопические и культуральные исследования содержимого толстой кишки и фекальных масс, выполненные в 1960–1970-х гг., показали, что большинство обнаруживаемых микроорганизмов относятся к грамположительным – рода Bifidobacterium, Eubacterium, Peptostreptococcus, Ruminococcus, Lactobacillus, Clostridium. Значительно меньше грамотрицательных бактерий – рода Bacteroides, Fusobacteria. Тогда же исследователи обратили внимание на то, что количество микроорганизмов, выявляемых микроскопически, было значительно больше, чем при культивировании in vitro. Этому факту дали название: великая аномалия подсчетов в чашке (great plate count anomaly) (Vartoukian et al., 2010). Это объясняется тем, что только 1% всех микроорганизмов достаточно легко культивируются in vitro (Bilen et al., 2018), и тем, что подавляющее большинство микроорганизмов толстой кишки являются анаэробами.
Традиционно в составе микробиоты кишечника выделяют до 1000 различных микроорганизмов, относящихся к прокариотам. Уже в 2018 г. сообщалось (Bilen et al., 2018) о 2776 видах микроорганизмов у человека. Они входят в состав 11 основных филотипов, главным образом в Firmicutes, Proteobacteria, Bacteroidetes, Actinobacteria.
Метагеномные исследования последних лет содержат огромный массив информации, однако ее недостаточно для понимания функциональных, метаболических возможностей отдельных видов микроорганизмов микробиоты. В ряде работ культурально выделены микроорганизмы, которые не были обнаружены методами высокоскоростного секвенирования. Делается заключение, что культуральные методы и секвенирование не являются антагонистическими, а должны сочетаться и дополнять друг друга при характеристике микробиоты человека (Staley, Konopka, 1985; Lagier et al., 2012).
Состав микробиоты зависит от многих факторов: географии проживания, структуры и привычек питания, количества пре- и пробиотиков в диете, частоты и вида использования антибиотиков, возраста (Каштанова и др., 2015; Nishijima et al., 2016; Takakura et al., 2020).
В настоящее время очевидно, что метаболические возможности микробиоты трудно переоценить. Это заключение базируется на том, что каталог генов микробиоты превышает 10 млн генов, тогда как у человека всего около 30 тыс. генов. Это было выяснено при анализе более 1200 образцов микробиоты из фекальных масс жителей Европы, США и Китая (Li et al., 2014). Несмотря на то, что биологическая функция большинства генов микроорганизмов микробиоты остается малоизученной, хорошо известно, что кишечная микробиота оказывает влияние на организм хозяина разными путями: модулирует иммунную защиту (Chung et al., 2012), обеспечивает защиту от ряда патогенов (Pickard et al., 2017), метаболизирует желчные кислоты и ксенобиотики (Spanogiannopoulos et al., 2016; Wahlström et al., 2016), регулирует не только гомеостаз самого кишечника (Reinhardt et al., 2012), но и влияет на функции мозга (Parker et al., 2020; Danilenko et al., 2021).
В литературе последних лет широко обсуждается возможность участия микробиоты кишечника не только в патогенезе заболеваний самого кишечника: болезни Крона, синдрома раздраженного кишечника, диареи и др., но также и в развитии ожирения (Krajmalnik-Brown et al., 2012; Gupta et al., 2020), атеросклероза (Komaroff, 2018), сахарного диабета 2-го типа (Zhao et al., 2018), сердечной недостаточности (Branchereau et al., 2019), артериальной гипертензии (Драпкина, Широбоких, 2018; Adnan et al., 2017; Wilck et al., 2017).
Многие вопросы в изучении микробиоты остаются пока без ответа, что связано с ее сложным составом, функции отдельных компонентов продолжают быть неизвестными. В состав микробиома кишечника входит более 2000 видов бактерий и архей, грибы, вирусы и простейшие. В недавно опубликованной работе (Camarillo-Guerrero et al., 2021) авторы сообщают, что в базу данных по бактериофагам кишечника внесено уже более 140 тыс. индивидуальных вирусов, причем наибольшее разнообразие фагов выявлено в бактериях филотипа Firmicutes.
Метагеномные исследования позволяют обнаружить наличие значительного количества микроорганизмов в составе кишечного микробиома, однако они не позволяют определить функцию, метаболические особенности каждого из обнаруженных микроорганизмов или их групп и сообществ. В связи с этим существенное развитие получили метаболомные исследования – изучение низкомолекулярных метаболитов, продуцируемых микробиотой. К таким метаболитам относятся как газы – водород Н2, метан СН4, сероводород H2S, аммиак NH3, оксид азота NO, так и низкомолекулярные легколетучие вещества. В последнем обзоре 2021 г. авторы (Drabińska et al., 2021) приводят данные об обнаружении более 2700 подобных веществ в разных биологических средах организма, из которых 1488 могут быть определены в выдыхаемом воздухе.
ВОДОРОД-ПРОДУЦИРУЮЩИЕ БАКТЕРИИ И ГЕНЫ ГИДРОГЕНАЗ
Способность микроорганизмов микробиоты продуцировать или утилизировать молекулярный водород Н2 зависит от наличия у них гидрогеназ – металлсодержащих ферментов, катализирующих простую реакцию взаимного перехода от протонов и электронов в дигидроген – молекулярный водород Н2. Окисление Н2 и обратная реакция – восстановления протонов – имеют большое значение для микроорганизмов, позволяя им модулировать вход/выход энергии, регулировать окислительно-восстановительный потенциал и передавать химические сигналы (Lubitz et al., 2014). Катализируемая гидрогеназами реакция иллюстрируется формулой:
Гидрогеназы представлены большой группой металлопротеинов, которые классифицируются по иону(ам) металла(ов), входящего(их) в их активный центр. К основным группам гидрогеназ относятся содержащие в своем активном центре или никель–железо [NiFe], или диион железа [FeFe], или моноион железа [Fe]. Детальная информация о типах и видах гидрогеназ представлена в базе данных HydDB (Søndergaard et al., 2016).
Гидрогеназы [NiFe] – наиболее хорошо изученный класс ферментов, которые в большинстве случаев характеризуются связыванием и окислением Н2. На основании филогенетического анализа совокупность этих гидрогеназ подразделяют на 4 группы, различающиеся по своей локализации в микроорганизмах – от мембраносвязанных форм до растворимых, по степени своей каталитической активности, по устойчивости или высокой чувствительности к действию кислорода (Vignais, Billoud, 2007).
В зависимости от основной функции выделяют (Greening et al., 2016): 4 группы и 22 подгруппы [NiFe]-гидрогеназ, 3 группы и 6 подгрупп [FeFe], тогда как [Fe]-гидрогеназы представляют собой небольшую гомогенную группу. Это позволило объединить ферменты в несколько классов: ответственных за гидрогенотрофное дыхание – [NiFe]-группы 1a, 1b, 1c; за гидрогенное ферментирование – [FeFe]-группы A1, B, [NiFe]-группа 4a; за бифуркацию электронов – [FeFe]-группы А2, A3, A4, [NiFe]-группа 3c; за чувствительность в анаэробных условиях – [FeFe]-группа С.
Гидрогеназы [FeFe] обнаружены у анаэробных прокариот и низших эукариот и участвуют в генерации больших количеств Н2. В этих организмах фермент обнаружен в хлоропластах и гидрогеносомах. Наибольшее количество вариантов гидрогеназ [FeFe] выделено из сульфатредуцирующих Clostridia (Lubitz et al., 2014). Гидрогеназы [Fe] обнаружены только у метаногенных архей (Sickerman, Hu, 2019).
При анализе 343 видов микроорганизмов, входящих в геномную базу данных “Проект микробиома человека. Раздел: Желудочно-кишечный тракт” (Human Microbiome Project. Gastrointestinal tract), было установлено, что 71% из них имеют гены, кодирующие синтез гидрогеназ. Из этих микроорганизмов 60% имели гены, кодирующие [FeFe]-гидрогеназы, и лишь 21% – гены, кодирующие [NiFe]-гидрогеназы. Был обнаружен только один штамм (метаноген Methanobrevibacter smithii), кодирующий [Fe]-тип гидрогеназы (Wolf et al., 2016). С учетом данных о наличии генов (рис. 1), кодирующих гидрогеназы, предполагается, что в кишечнике водород преимущественно образуется бактериями микробиоты: Ruminococcus spp., Roseburia spp., Clostridium spp., Bacteroides spp. (Carbonero et al., 2012; Wolf et al., 2016). Следует подчеркнуть, что широко известные бактерии, положительно влияющие на многие процессы хозяина – Bacilli и Bifidobacteria – не обладают генами для синтеза гидрогеназ (Wolf et al., 2016).
Рис. 1.
Выявляемость генов, кодирующих синтез различных гидрогеназ у микроорганизмов микробиоты кишечника (по: Wolf et al., 2016, адаптировано). (а) – представительство различных гидрогеназ в микроорганизмах (бактериях и археях) микробиоты кишечника; (б) – количество участков ДНК, кодирующих разные группы и подгруппы гидрогеназ.

Участие основных типов гидрогеназ в процессах ферментативной продукции водорода и его утилизации представлено на рис. 2.
Рис. 2.
Суммарная схема метаболизма водорода H2 микробиотой кишечника на основании результатов метагеномных исследований (по: Wolf et al., 2016, адаптировано). Показаны типы микроорганизмов и группы гидрогеназ, участвующих как в генерации, так и в утилизации водорода. Функциональное значение отдельных групп гидрогеназ отражено площадью кругов, соответствующей каждой группе, и основано на результатах 20 метагеномных исследований по представительству соответствующих генов гидрогеназ. Верхняя часть рисунка: показана роль различных гидрогеназ в генерации водорода микробиотой. Нижняя часть рисунка: показана роль различных гидрогеназ в утилизации водорода микробиотой. Fdrd – ферредоксин восстановленный, Fdox – ферредоксин окисленный, NAD(P)H – никотинамид-адениндинуклеотид, восстановленная форма, NAD(P)+ – никотинамидадениндинуклеотид, окисленная форма.

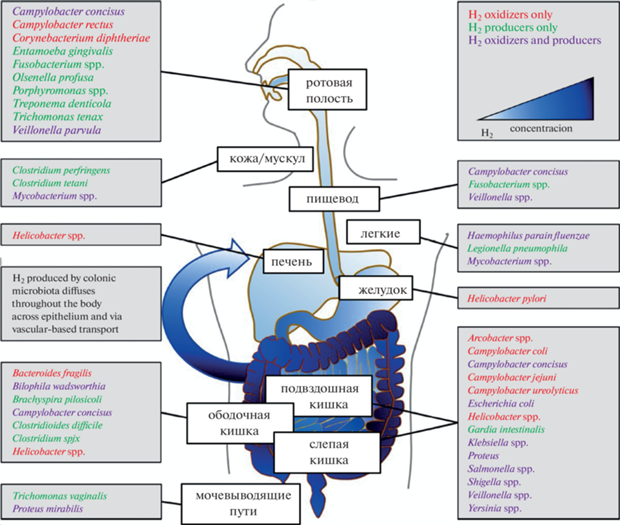
Генами для синтеза гидрогеназ обладают не только микроорганизмы-комменсанты микробиоты, но и целый ряд патогенов. Более 200 патогенов (рис. 3), зарегистрированных в базе данных Микробиомного проекта человека, также обладают способностью к генерации или потреблению водорода (Benoit et al., 2020).
Рис. 3.
Патогенные бактерии, обладающие гидрогеназами как для генерации, так и для утилизации водорода (по: Benoit et al., 2020, адаптировано). Интенсивностью синего цвета отражена относительная концентрация водорода в различных отделах ЖКТ человека. В правом верхнем углу цветом дается маркировка бактерий с преимущественной способностью: красным – потребляющие, окисляющие водород, зеленым – генерирующие водород, фиолетовым – способные как генерировать, так и потреблять водород.
Многие важные аспекты, однако, остаются малоизученными. Один из них (Abou Hamdan et al., 2012; Sickerman, Hu, 2019): что определяет сдвиг в каталитической активности гидрогеназ от продукции к утилизации Н2? Модуляция подобного фактора могла бы служить способом усиливать продукцию Н2 микробиотой кишечника и после его частичного всасывания в кровь оказывать системный антиоксидантный эффект.
Один из основных способов повышения уровня эндогенного водорода в крови – подавление активности гидрогенотрофных микроорганизмов микробиоты ЖКТ: метаногенных архей (эксклюзивных производителей метана) и сульфатредуцирующих бактерий (производителей сероводорода).
МЕТАНОГЕННЫЕ АРХЕИ И ИХ ГЕНЫ ГИДРОГЕНАЗ
Археи представляют собой большую группу микроорганизмов, первоначально обнаруженных в экстремальных условиях обитания, а позднее – и в микробиоте кишечника человека. Около 40 лет тому назад из кала человека был изолирован первый представитель архей – Methanobrevibacter smithii (Miller et al., 1982). В последующем было показано, что они представлены в составе микробиомов большинства эукариотических организмов (рис. 4)
Рис. 4.
Филогенетическое древо царства архей (по: Borrel et al., 2020, адаптировано). Эвриархеоты (Euryarchaeota) – тип архей. TACK – группа архей, название представляет собой аббревиатуру, образованную из первых четырех обнаруженных: Thaumarchaeota, Aigarchaeota, Crenarchaeota и Korarchaeota. Asgard – предполагаемый суперфил, состоящий из группы архей. DPANN – супергруппа архей, название представляет собой аббревиатуру, образованную из первых пяти обнаруженных: Diapherotrites, Parvarchaeales, Aenigmarchaeota, Nanoarchaeota и Nanohaloarchaeota. Цветом выделены археи, ассоциированные с биологическими организмами – растениями и животными, включая человека.

Археи отличаются от бактерий (табл. 1) не только генетически, но также структурой и композицией мембран, поверхностным слоем белков и гетерополисахаридов, уникальных липидов, а некоторые метан-генерирующие археи – наличием псевдомуреина (Koga, Morii, 2005; Bang, Schmitz, 2018).
Таблица 1.
Сравнение бактерий и архей по ряду структурных и функциональных характеристик (по: Borrel et al., 2020)
| Характеристика | Бактерии | Археи |
|---|---|---|
| Ядро | Нет | Нет |
| Органеллы | Нет | Нет |
| Сплайсосомные интроны | Нет | Нет |
| Форма хромосом | Круглая и линейная | Круглая |
| Опероны | Да | Да |
| РНК-полимераза | Бактериоподобная | Эукариотоподобная |
| ДНК-полимераза | Бактериоподобная | Эукариотоподобная |
| Тип рибосом | 70S | 70S |
| Начало трансляции (аминокислота) | Формилметионин | Метионин |
| Гистоны | Нет | Да |
| Пептидогликан | Да | Нет; псевдопептидогликан |
| Подвижность | Жгутик бактериального типа | Жгутик архейного типа |
| Липополисахарид | Да | Нет |
| Мембранные липиды | Эфирные звенья (глицерин-1-фосфатный остов) |
Эфирные звенья (глицерин-3-фосфатный остов) |
| Метаногенез | Нет | Да |
| Кислородный фотосинтез | Да | Нет |
| Споры | Да | Нет |
| Патогенность для человека | Да | Нет |
Совокупность разнообразных видов архей определяется термином “археом”. Относительно меньшая изученность архей микробиома человека, по сравнению с бактериями, связана с тем, что среди них пока не выявлены патогенные формы, кроме того, существуют методические сложности их идентификации. При изучении археома обычно используют методы культивации или методологию qPCR. Использование метода 16S rRNA часто ориентировано на изучение бактерий и пары универсальных праймеров для покрытия широкого спектра прокариотического разнообразия. Низкое представительство ДНК архей в человеческих образцах; недостаточный лизис мембран и экстракции ДНК; проблемы универсальных праймеров в полном обнаружении сигнатур архей; неполная база 16S rRNA генов – все это лежит в основе методологических сложностей анализа микробиомных архей (Borrel et al., 2020).
Недавно опубликован каталог 1167 геномов из кишечного археома человека, 85% которых принадлежат археям из рода Methanobrevibacter. Подавляющее большинство архей ЖКТ человека – метаногены. Все изученные виды Methanobrevibacter spp. из кишечника человека обладают генетическим потенциалом для утилизации формиат-аниона муравьиной кислоты (HCOO−), водорода Н2 и углекислого газа СО2 для синтеза метана (Chibani et al., 2022). Для утилизации Н2 археями необходимы [NiFe]-гидрогеназы типа 3а, 3с, 4h, 4i, а также [Fe]-гидрогеназа, обнаруженная только в археях (Sickerman, Hu, 2019; Benoit et al., 2020). Метаногенные археи – это основные гидрогенотрофы – потребители Н2, продуцируемого микробиотой при ферментации сложных углеводов. Упрощенная схема потребления водорода гидрогенотрофными микроорганизмами микро-биоты обычно иллюстрируется формулой:
В ранее выполненных исследованиях отмечалось, что археи составляют от 0.1 до 21.3% от всех микроорганизмов, заселяющих ЖКТ (Kim et al., 2020). Разработка в последнее время методов, не зависимых от культуральных (например, секвенирование следующего поколения Next Generation Sequencing), создала новые возможности для изучения состава микробиоты кишечника. В результате получены данные о значительно большем представительстве архей, которые в кале человека могут составлять от 25 до 95% (Hoffmann et al., 2013; Matijašić et al., 2020). Метаногенные археи синтезируют метан, потребляя Н2 и СО2, тем самым понижая давление газа в просвете кишки (Gaci et al., 2014).
Конкурентами метаногенных архей за использование Н2 могут быть сульфатредуцирующие бактерии (Conway de Macario, Macario, 2009; Houshyar et al., 2021) (рис. 2). Синтез конечного продукта – сероводорода H2S отражается формулой (Smith et al., 2019):
Ферментирование неперевариваемых углеводов (пищевых волокон) микробиотой – один из основных диетических факторов, приводящих к повышенной генерации водорода в толстой кишке (Levitt, 1969; Levitt, Bond, 1970; Carbonero et al., 2012; Wolf et al., 2016). Процесс ферментации неусваиваемых человеком углеводов микробиотой кишечника крайне сложен и включает экспрессию от 94 (тип Actinobacteria) до 175 (тип Firmicutes) и даже до 386 (тип Bacteroidetes) карбогидратактивных ферментов, представленных гликозид гидролазами, гликозид трансферазами, полисахарид лиазами, карбогидрат эстеразами и модулями связывания карбогидратов (Flint et al., 2012). Исследования на крысах, получавших с кормом дополнительное количество неперевариваемых углеводов, показали, что повышенная генерация водорода не всегда сопровождается увеличением доли микроорганизмов, обладающих гидрогеназой и генерирующих водород, тогда как была обнаружена высокая степень положительной корреляции с количеством Bifidobacteriales, не имеющих гена, кодирующего гидрогеназу (Nishimura et al., 2018). Также среди крыс от разных производителей обнаружена большая разница в количестве производимого микробиотой водорода при потреблении одинакового количества пищевых волокон. В группе малопроизводящих Н2 концентрация водорода в крови печеночной вены составляла 1.54 мкмоль/л, тогда как в группе многопроизводящих – 17.4 мкмоль/л. Пероральная трансплантация микробиоты от крыс, многопроизводящих водород, малопроизводящим крысам сопровождалась у последних повышением уровня водорода в крови печеночной вены с 3.07 до 9.95 мкмоль/л, что положительно коррелировало с уровнем родов Bifidobacterium, Allobaculum, Parabacteroides и отрицательно – c уровнем родов Bacteroides, Ruminococcus, Escherichia (Nishimura et al., 2018). Близкие результаты получены японскими исследователями у людей, получавших молоко с добавлением пищевых волокон (Kawashima et al., 2019). Механизм и причинно-следственные связи между повышением продукции водорода под влиянием пищевых волокон и ростом количества бактерий из порядка Bifidobacteriales остаются пока неясными.
Работы конца прошлого столетия заложили основу наших знаний об основных параметрах генерации водорода микробиотой толстого кишечника, и возможности оценки этого процесса по динамике содержания его в выдыхаемом воздухе. Исследование здоровых добровольцев показало, что в газах толстой кишки 19–20% составляет водород, 9–14% – СО2, 7–9% – метан и лишь 0.0003% – сероводород (Levitt, 1971; Sahakian et al., 2010). С учетом более низкой концентрации сероводорода в просвете толстой кишки и в выдыхаемом воздухе, по сравнению с метаном, он не может существенно влиять на баланс и доступность Н2 (Sahakian et al., 2010).
Недавно австралийские ученые с помощью проглатываемой капсулы, определяющей концентрацию кислорода, водорода и углекислого газа на всем протяжении ЖКТ, подтвердили результаты предыдущих исследований, базирующихся в основном на непрямых измерениях (Kalantar-Zadeh et al., 2018, 2019).
С использованием технологии перфузии разных отделов кишечника инертным газом у 14 участников эксперимента показано, что скорость образования водорода в толстой кишке в 100 раз выше, чем в тонкой (Levitt, 1969). Абсолютная скорость образования водорода зависела от времени воздержания от приема пищи. Так, при голодании 24 ч скорость образования водорода была 0.047 мл/мин, при голодании 12 ч – 0.32 мл/мин и после введения 2 г лактозы прямо в толстую кишку – в среднем 1.6 мл/мин. Параллельная регистрация содержания водорода в выдыхаемом воздухе показала, что существует тесная линейная зависимость между скоростью образования водорода в кишке и его уровнем в выдыхаемом воздухе, что является основанием для использования водородного дыхательного теста для неинвазивной оценки газообразующей функции микробиоты толстой кишки. Эти исследования показали, что около 21% образованного в кишке водорода всасывается в кровь и выделяется через легкие (Levitt, 1969; Levitt, Bond, 1970). В последующих исследованиях основные результаты ранее выполненных работ подтверждены и уточнены (Levitt, 1971; Flourié et al., 1990; Strocchi, Levitt, 1992). Более точные данные получены в Кембридже (UK) на 10 участниках эксперимента с использованием калориметрии/плетизмографии всего тела, когда была возможность определять объемы газов, выделяемых как через анус, так и с дыханием. Установлено, что через легкие выделяется в среднем 58% всего произведенного микробиотой водорода, а при малых скоростях образования в кишке (до 200 мл/сут) эта величина достигает 65%. На фоне диеты без крахмала и пищевых волокон образовывалось 35 мл Н2/сут, после приема 7.5, 15 или 22.5 г лактулозы образовывалось 90, 230 и 320 мл Н2/сут соответственно (Christl et al., 1992).
В течение нескольких десятилетий гастроэнтерологи использовали измерения водорода в выдыхаемом воздухе (водородный дыхательный тест) для определения скорости прохождения пищевой массы по ЖКТ, для диагностики синдрома избыточного бактериального роста в тонкой кишке, лактазной недостаточности и непереносимости углеводов (фруктозы, галактозы, лактозы, сорбитола) (Корниенко и др., 2013; Ивашкин и др., 2019; Simrén, Stotzer, 2006; Shin, 2014).
В большинстве работ отмечается большой разброс получаемых данных, что не позволяет говорить о клинической норме уровня водорода в выдыхаемом воздухе у здорового человека (Di Stefano et al., 2013).
С целью большей стандартизации, унификации методов проведения водородного дыхательного теста в клинике, а также интерпретации полученных результатов опубликовано несколько клинических рекомендаций: Итальянская (Gasbarrini et al., 2009), Северо-Американская (Rezaie et al., 2017), Американской гастроэнтерологической ассоциации (Pimentel et al., 2020), Европейская (Hammer et al., 2022).
МОЛЕКУЛЯРНЫЙ ВОДОРОД КАК АНТИОКСИДАНТ
Водород при этом до недавнего времени расценивался как биомаркер событий в микробиоте кишечника, который не оказывает самостоятельного эффекта на организм хозяина. Отношение к водороду в корне изменилось в 2007 г., когда в престижном журнале “Nature Medicine” группа японских авторов опубликовала статью, доказывающую антиоксидантную активность водорода на биологических моделях (Ohsawa et al., 2007). Авторы и последующие исследования показали, что водород защищает мозг в условиях ишемии/реперфузии и инсульта, нейтрализуя активные формы кислорода – гидроксильный радикал ОН– и пероксинитрит ONOO–, но не взаимодействуя с более слабыми окислителями: супероксид-анион радикалом О2–, перекисью водорода Н2О2 или оксидом азота NO (Liu et al., 2011). После этого резко возрос интерес к изучению биологических эффектов водорода у животных и человека, который вводился извне или в виде насыщенной водородом воды, таблеток, содержащих металлический магний, или ингаляционно в концентрации до 4%, чтобы предупредить взрывоопасность вдыхаемого газа (Kurokawa et al., 2015). За период с 2007 г. по настоящее время уже опубликовано более 2000 статей по изучению биологических и медицинских эффектов молекулярного водорода.
Фундаментальные исследования показали защитное действие экзогенного водорода в модельных опытах на животных, клеточных культурах в условиях оксидативного стресса. Показано антиатеросклеротическое действие молекулярного водорода в опытах на мышах (Ohsawa et al., 2008; Iketani et al., 2018), замедление развития хронической сердечной недостаточности у крыс (Chi et al., 2018). Отмечены кардиопротективное действие на модели ишемии/реперфузии миокарда у крыс (Li L. et al., 2019; Li X. et al., 2019) и антистрессорный эффект высоких концентраций водорода в опытах на мышах (Gao et al., 2017). В нескольких лабораториях подтвердили защитное действие водорода на моделях легочной гипертензии (Wang et al., 2011; He et al., 2013; Kishimoto et al., 2015).
Изучение механизмов действия водорода в условиях оксидативного стресса привело большинство авторов к заключению, что в дополнение к прямой нейтрализации гидроксильного радикала ОН– и пероксинитрита ONOO– его антиоксидантное действие проявляется за счет усиленной экспрессии эндогенных белков: супероксиддисмутазы, каталазы, глутатионпероксидазы, следствием чего является снижение маркеров окислительного стресса: малонового диальдегида, производных тиобарбитуровой кислоты и 8-гидрокси-деокси-гуаназина. Имеются доказательства (Ichihara et al., 2015; Barancik et al., 2020; Wang et al., 2020; Slezak et al., 2021) влияния водорода на сигнальные пути передачи информации внутрь клетки, а также цитопротекции и противовоспалительного действия за счет снижения синтеза провоспалительных цитокинов, антиапоптотического действия (рис. 5).
Рис. 5.
Суммарная иллюстрация механизмов положительного влияния молекулярного водорода в условиях оксидативного стресса. Приведены известные механизмы на основании повышения (стрелки вверх) или понижения (стрелки вниз) основных биомаркеров оксидативного стресса. Nrf2 – nuclear factor-erythroid-2-related factor 2; ARE – antioxidant response elements; PI3K/Akt – phosphatidylinositol-3-kinase/protein kinase B; JAK2/STAT3 – activated Janus kinase 2/signal transducers and transcription 3; ASK1 – apoptotic signal-regulated kinase 1; P38 – путь сигнальной трансдукции; MAPK – mitogen-activated protein kinase; JNK – c-Jun N-terminal kinase; GSK3β – glycogen synthase kinase 3 beta; CD36 – cyclin-dependent kinase 36; SOD – superoxide dismutase; CAT – catalase; GPx – glutathione peroxidase; HO-1 – heme oxygenase 1; MPO – myeloperoxidase; GSS – glutathione synthetase; •OH – гидроксильный радикал; ONOO– – пероксинитрит; MDA – malondialdehyde; TBARS – thiobarbituric acid reactive substances; 8-OHdG – 8-hydroxy-desoxyguanosine; NADPH oxidase – никотинамидадениндинуклеотидфосфат-оксидаза; Bcl-2 – регулятор апоптоза; Bcl-xL – ингибитор апоптоза; LC3-II – microtubule-associated protein 1A/1B-light chain 3; Beclin-1 – регулятор апоптоза; Atg7 – autophagy related 7; ERK – extracellular signal-regulated kinase; Каспазы 3, 8, 12 – индукторы апоптоза; mTOR/STAT3 – mammalian target of rapamycin/signal transducers and transcription 3; NF-κB – nuclear factor kappa B; TNF-α – tumor necrosis factor alpha; ICAM-1 – intercellular cell adhesion molecule-1; IFN-γ – интерферон гамма; IL-10 – интерлейкин 10; HMGB-1 – high-mobility group box protein 1 (по: Barancik et al., 2020, адаптировано).

Последующие клинические испытания антиоксидантных свойств молекулярного водорода в основном подтвердили результаты ранее выполненных фундаментальных исследований на животных. Во-первых, подтверждена безопасность ингаляционного использования водорода в концентрации 2–4% (Javorac et al., 2019), а также и более высоких концентраций, в частности у больных с инфекцией COVID-19 – при ингаляции смеси, содержащей 66% водорода и 33% кислорода (Guan et al., 2020a,b; Lin et al., 2020). Во-вторых, подтверждены кардиопротективные и нейропротективные эффекты молекулярного водорода у пациентов, что было связано с его антиоксидантными свойствами (Ono et al., 2012; Tamura et al., 2016, 2017, 2020; Alshami et al., 2020). Предлагается использовать водород при лечении заболеваний, связанных с хроническим воспалением (Hirano et al., 2021). В литературе есть сообщения о положительном влиянии водорода на эндотелиальную дисфункцию (Sakai et al., 2014), в том числе и при проведении рандомизированных контролируемых исследований (Ishibashi et al., 2020). Насыщение водородом диализной жидкости улучшает прогноз у пациентов как при гемодиализе, так и при перитонеальном диализе, уменьшая развитие фиброза (Nakayama et al., 2018a,b; Lu et al., 2020).
Выявление антиоксидантных свойств молекулярного водорода, с одной стороны, привело к выполнению большого количества исследований, в которых изучали эффекты экзогенного водорода, вводимого в организм в виде насыщенной водородом воды или ингаляций, с другой стороны, появилось второе дыхание в работах по анализу эффектов эндогенного водорода, продуцируемого микробиотой кишечника преимущественно при ферментации пищевых волокон. Компании Азиатских стран, прежде всего Японии, Южной Кореи и Китая, стали лидерами по выпуску различных генераторов водорода для медицинского применения.
Поскольку молекулярный водород является доказанным антиоксидантом и генерируется микробиотой человека и многих животных, особенно жвачных, представляется перспективным его увеличение в крови путем подавления его потребителей в просвете кишечника, прежде всего метаногенных архей.
Проблема подавления метаногенов уже более 50 лет разрабатывается в сельском хозяйстве, в частности для увеличения эффективности использования кормов (Nkrumah et al., 2006), а также для уменьшения негативного влияния на экологию, так как метан, вырабатываемый жвачными животными, составляет около 12–14% от всех антропогенных воздействий, приводящих к глобальному потеплению. По способности вызывать потепление атмосферы метан в 28 раз сильнее СО2 (Reisinger et al., 2021).
Стратегия подавления метаногенеза включает прямые воздействия на метаногенные археи в виде добавок в корм Asparagopsis taxiformis или 3-NOP (3‑nitrooxypropanol). Asparagopsis taxiformis – красная морская водоросль, в состав которой входят различные галогенсодержащие метаны, включая бромоформ, дибромохлорметан, бромохлоруксусную кислоту, дихлоруксусную кислоту и др. Было показано подавление энзиматической активности бромоформом за счет связывания витамина В12, который по химическому строению близок коэнзиму F430 – кофактору, необходимому для метаногенеза. На модели микробиоты желудка жвачных животных in vitro показано, что при внесении в субстрат 5%-ной добавки Asparagopsis taxiformis продукция метана угнетается на 95–99% (Roque et al., 2019; Vijn et al., 2020), не изменяя продукцию таких полезных метаболитов ферментации, как короткоцепочечные жирные кислоты (Machado et al., 2014; Mizrahi et al., 2021). Кормление овец с добавкой этой водоросли понижало продукцию метана на 80%, не вызывая отрицательного влияния на вес животных в течение 72 дней (Li et al., 2016).
3-NOP синтезирован для ингибирования комплекса MCR (methyl-coenzyme M reductase), необходимого на последней стадии синтеза метана у всех метаногенов. В большинстве исследований 3-NOP угнетал метаногенез in vivo до 60%, не влияя при этом на здоровье и поведение животных.
К непрямым воздействиям относится добавление в корм нитратов и сульфатов (представляют потенциальный риск для здоровья животных), антимикробных препаратов (например, ионофорный антибиотик monensin). Использование таких антибиотиков для подавления синтеза метана вызывает большую критику и запрещено в ряде стран Евросоюза (Mizrahi et al., 2021).
В экспериментах на крысах и в исследованиях в клинике на человеке была показана способность статинов подавлять продукцию метана метаногенными археями, так как ингибирование ими HMGCR (3-hydroxy-3-methyl-glutaryl-coenzyme A reductase) способно не только подавлять синтез холестерина, но и нарушать синтез мембран архей (Gottlieb et al., 2016; Nkamga et al., 2017). Мембраны всех архей содержат значительные количества изопреноидных спиртов, которые характерны только для них. Эти спирты синтезируются из мевалоната, поэтому статины ингибируют синтез таких спиртов. Кроме того известно, что один из статинов – ловастатин – в дозе 150 мг/л угнетает продукцию метана на 42%, не изменяя при этом содержания бактерий или процессов ферментации углеводов (Soliva et al., 2011). В литературе также есть указания на способность продуктов растительного происхождения – таннинов и сапонинов, ненасыщенных жирных кислот и ряда бактериоцинов – подавлять образование метана (Patra et al., 2017; Mizrahi et al., 2021). Одним из новых направлений создания лекарственных препаратов, способных избирательно подавлять активность архей, может быть синтез ингибиторов гидрогеназ, специфичных для метаногенных архей.
ЗАКЛЮЧЕНИЕ
Метаанализ опубликованных данных позволил установить, что микробиота 59.8% всех участников эксперимента способна продуцировать как водород, так и метан. Между объемами выделенных газов наблюдались реципрокные отношения, то есть при высоком содержании одного газа другой обнаруживался в меньшем количестве. Потребление водорода при синтезе метана позволяет объяснить этот феномен. Оставшиеся 40.2% участников эксперимента синтезировали только водород (Modesto et al., 2021). Выделение групп людей с низким уровнем продукции водорода позволяет персонифицировано рекомендовать им подавлять функцию метаногенных архей и/или использовать источники экзогенного водорода в виде либо насыщенной водородом воды, либо ингаляций с водородом. Можно предположить, что антиоксидантный и другие эффекты экзогенного водорода будут более выражены у людей с низким уровнем собственного производства водорода микробиотой кишечника. В связи с этим более широкое использование водородного и метанового дыхательных тестов может иметь значение для персонифицированных рекомендаций по здоровому питанию и более эффективному использованию протективных, антиоксидантных свойств молекулярного водорода. Появление на рынке первого портативного устройства для определения уровня водорода и метана в выдыхаемом воздухе у человека (https://foodmarble.com/#how-it-works-cta) позволяет амбулаторно определить, к какой группе относится человек, с целью разработки персонифицированных рекомендаций по повышению его антиоксидантной защиты.
К сожалению, пока мало изученным остается вопрос о возможности использования диетических и фармацевтических факторов для повышения продукции молекулярного водорода микробиотой кишечника с целью усиления антиоксидантной защиты организма.
Список литературы
Драпкина О.М., Широбоких О.Е. Роль кишечной микробиоты в патогенезе сердечно-сосудистых заболеваний и метаболического синдрома // Рац. фармакотер. кардиол. 2018. Т. 14. № 4. С. 567–574. https://doi.org/10.20996/1819-6446-2018-14- 4-567-574
Ивашкин К.В., Широкова Е.Н., Ивашкин В.Т. и др. Сократительная функция миокарда у пациентов с циррозом печени и синдромом избыточного бактериального роста // Кардиология. 2019. Т. 59. № 4. С. 67–73.
Каштанова Д.А., Ткачева О.Н., Бойцов С.А. Микробиота кишечника и факторы кардиоваскулярного риска. Часть 1. Микробиота кишечника, возраст и пол // Кардиоваск. тер. профилак. 2015. Т. 14. № 4. С. 92–95. https://doi.org/10.15829/1728-8800-2015-4-92-95
Корниенко Е.А., Кубалова С.С., Дмитриенко М.А., Джагацпанян И.Э. Клиническое применение водородного дыхательного теста в диагностике лактазной недостаточности и синдрома избыточного бактериального роста у детей раннего возраста // Практика педиатра. 2013. № 2. С. 36–43.
Abou Hamdan A., Dementin S., Liebgott P.P. et al. Understanding and tuning the catalytic bias of hydrogenase // J. Am. Chem. Soc. 2012. V. 134. № 20. P. 8368–8371. https://doi.org/10.1021/ja301802r
Adnan S., Nelson J.W., Ajami N.J. et al. Alterations in the gut microbiota can elicit hypertension in rats // Physiol. Genomics. 2017. V. 49. № 2. P. 96–104. https://doi.org/10.1152/physiolgenomics.00081.2016
Alshami A., Einav S., Skrifvars M.B., Varon J. Administration of inhaled noble and other gases after cardiopulmonary resuscitation: a systematic review // Am. J. Emerg. Med. 2020. V. 38. № 10. P. 2179–2184. https://doi.org/10.1016/j.ajem.2020.06.066
Bang C., Schmitz R.A. Archaea: forgotten players in the microbiome // Emerg. Top. Life Sci. 2018. V. 2. № 4. P. 459–468. https://doi.org/10.1042/ETLS20180035
Barancik M., Kura B., LeBaron T.W. et al. Molecular and cellular mechanisms associated with effects of molecular hydrogen in cardiovascular and central nervous systems // Antioxidants (Basel). 2020. V. 9. № 12. P. 1281. https://doi.org/10.3390/antiox9121281
Benoit S.L., Maier R.J., Sawers R.G., Greening C. Molecular hydrogen metabolism: a widespread trait of pathogenic bacteria and protists // Microbiol. Mol. Biol. Rev. 2020. V. 84. № 1. P. e00092-19. https://doi.org/10.1128/MMBR.00092-19
Bilen M., Dufour J.C., Lagier J.C. et al. The contribution of culturomics to the repertoire of isolated human bacterial and archaeal species // Microbiome. 2018. V. 6. № 1. P. 94. https://doi.org/10.1186/s40168-018-0485-5
Borrel G., Brugère J.F., Gribaldo S. et al. The host-associated archaeome // Nat. Rev. Microbiol. 2020. V. 18. № 11. P. 622–636. https://doi.org/10.1038/s41579-020-0407-y
Branchereau M., Burcelin R., Heymes C. The gut microbiome and heart failure: a better gut for a better heart // Rev. Endocr. Metab. Disord. 2019. V. 20. № 4. P. 407–414. https://doi.org/10.1007/s11154-019-09519-7
Camarillo-Guerrero L.F., Almeida A., Rangel-Pineros G. et al. Massive expansion of human gut bacteriophage diversity // Cell. 2021. V. 184. № 4. P. 1098–1109.e9. https://doi.org/10.1016/j.cell.2021.01.029
Carbonero F., Benefiel A.C., Gaskins H.R. Contributions of the microbial hydrogen economy to colonic homeostasis // Nat. Rev. Gastroenterol. Hepatol. 2012. V. 9. № 9. P. 504–518. https://doi.org/10.1038/nrgastro.2012.85
Chi J., Li Z., Hong X. et al. Inhalation of hydrogen attenuates progression of chronic heart failure via suppression of oxidative stress and P53 related to apoptosis pathway in rats // Front. Physiol. 2018. V. 9. P. 1026. https://doi.org/10.3389/fphys.2018.01026
Chibani C.M., Mahnert A., Borrel G. et al. A catalogue of 1167 genomes from the human gut archaeome // Nat. Microbiol. 2022. V. 7. № 1. P. 48–61. https://doi.org/10.1038/s41564-021-01020-9
Christl S.U., Murgatroyd P.R., Gibson G.R., Cummings J.H. Production, metabolism, and excretion of hydrogen in the large intestine // Gastroenterology. 1992. V. 102. № 4. Pt 1. P. 1269–1277.
Chung H., Pamp S.J., Hill J.A. et al. Gut immune maturation depends on colonization with a host-specific microbiota // Cell. 2012. V. 149. № 7. P. 1578–1593. https://doi.org/10.1016/j.cell.2012.04.037
Conway de Macario E., Macario A.J.L. Methanogenic archaea in health and disease: a novel paradigm of microbial pathogenesis // Int. J. Med. Microbiol. 2009. V. 299. № 2. P. 99–108. https://doi.org/10.1016/j.ijmm.2008.06.011
Danilenko V.N., Devyatkin A.V., Marsova M.V. et al. Common inflammatory mechanisms in COVID-19 and Parkinson’s diseases: the role of microbiome and probiotics in their prevention // J. Inflamm. Res. 2021. V. 14. P. 6349–6381. https://doi.org/10.2147/JIR.S333887
Di Stefano M., Mengoli C., Bergonzi M. et al. Hydrogen breath test and intestinal gas production // Eur. Rev. Med. Pharmacol. Sci. 2013. V. 17. Suppl 2. P. 36–38.
DiBaise J.K., Zhang H., Crowell M.D. et al. Gut microbiota and its possible relationship with obesity // Mayo Clin. Proc. 2008. V. 83. № 4. P. 460–469. https://doi.org/10.4065/83.4.460
Drabińska N., Flynn C., Ratcliffe N. et al. A literature survey of all volatiles from healthy human breath and bodily fluids: the human volatilome // J. Breath. Res. 2021. V. 15. № 3. https://doi.org/10.1088/1752-7163/abf1d0
Flint H.J., Scott K.P., Duncan S.H. et al. Microbial degradation of complex carbohydrates in the gut // Gut Microbes. 2012. V. 3. № 4. P. 289–306. https://doi.org/10.4161/gmic.19897
Flourié B., Etanchaud F., Florent C. et al. Comparative study of hydrogen and methane production in the human colon using caecal and faecal homogenates // Gut. 1990. V. 31. № 6. P. 684–685. https://doi.org/10.1136/gut.31.6.684
Gaci N., Borrel G., Tottey W. et al. Archaea and the human gut: new beginning of an old story // World J. Gastroenterol. 2014. V. 20. № 43. P. 16062–16078. https://doi.org/10.3748/wjg.v20.i43.16062
Gao Q., Song H., Wang X.T. et al. Molecular hydrogen increases resilience to stress in mice // Sci. Rep. 2017. V. 7. № 1. P. 9625. https://doi.org/10.1038/s41598-017-10362-6
Gasbarrini A., Corazza G.R., Gasbarrini G. et al. Methodology and indications of H2-breath testing in gastrointestinal diseases: the Rome Consensus Conference // Aliment. Pharmacol. Ther. 2009. V. 29. Suppl 1. P. 1–49.
https://doi.org/10.1111/j.1365-2036.2009.03951.x
Gottlieb K., Wacher V., Sliman J., Pimentel M. Review article: inhibition of methanogenic archaea by statins as a targeted management strategy for constipation and related disorders // Aliment. Pharmacol. Ther. 2016. V. 43. № 2. P. 197–212. https://doi.org/10.1111/apt.13469
Greening C., Biswas A., Carere C.R. et al. Genomic and metagenomic surveys of hydrogenase distribution indicate H2 is a widely utilised energy source for microbial growth and survival // ISME J. 2016. V. 10. № 3. P. 761–777. https://doi.org/10.1038/ismej.2015.153
Guan W.J., Wei C.H., Chen A.L. et al. Hydrogen/oxygen mixed gas inhalation improves disease severity and dyspnea in patients with Coronavirus disease 2019 in a recent multicenter, open-label clinical trial // J. Thorac. Dis. 2020a. V. 12. № 6. P. 3448–3452. https://doi.org/10.21037/jtd-2020-057
Guan W.J., Wei C.H., Chen A.L. et al. Erratum to hydrogen/oxygen mixed gas inhalation improves disease severity and dyspnea in patients with Coronavirus disease 2019 in a recent multicenter, open-label clinical trial // J. Thorac. Dis. 2020b. V. 12. № 8. P. 4591–4592. https://doi.org/10.21037/jtd-2020-062
Gupta A., Osadchiy V., Mayer E.A. Brain-gut-microbiome interactions in obesity and food addiction // Nat. Rev. Gastroenterol. Hepatol. 2020. V. 17. № 11. P. 655–672. https://doi.org/10.1038/s41575-020-0341-5
Hammer H.F., Fox M.R., Keller J. et al. European guideline on indications, performance, and clinical impact of hydrogen and methane breath tests in adult and pediatric patients: European Association for Gastroenterology, Endoscopy and Nutrition, European Society of Neurogastroenterology and Motility, and European Society for Paediatric Gastroenterology Hepatology and Nutrition consensus // United European Gastroenterol. J. 2022. V. 10. № 1. P. 15–40. https://doi.org/10.1002/ueg2.12133
He B., Zhang Y., Kang B. et al. Protection of oral hydrogen water as an antioxidant on pulmonary hypertension // Mol. Biol. Rep. 2013. V. 40. № 9. P. 5513–5521. https://doi.org/10.1007/s11033-013-2653-9
Hirano S.I., Ichikawa Y., Sato B. et al. Potential therapeutic applications of hydrogen in chronic inflammatory diseases: possible inhibiting role on mitochondrial stress // Int. J. Mol. Sci. 2021. V. 22. P. 2549. https://doi.org/10.3390/ijms22052549
Hoffmann C., Dollive S., Grunberg S. et al. Archaea and fungi of the human gut microbiome: correlations with diet and bacterial residents // PLoS One. 2013. V. 8. № 6. P. e66019. https://doi.org/10.1371/journal.pone.0066019
Houshyar Y., Massimino L., Lamparelli L.A. et al. Going beyond bacteria: uncovering the role of archaeome and mycobiome in inflammatory bowel disease // Front. Physiol. 2021. V. 12. P. 783295. https://doi.org/10.3389/fphys.2021.783295 https://foodmarble.com/#how-it-works-cta (ссылка подтверждена 15.05.2022)
Ichihara M., Sobue S., Ito M. et al. Beneficial biological effects and the underlying mechanisms of molecular hydrogen - comprehensive review of 321 original articles // Med. Gas. Res. 2015. V. 5. P. 12. https://doi.org/10.1186/s13618-015-0035-1
Iketani M., Sekimoto K., Igarashi T. et al. Administration of hydrogen-rich water prevents vascular aging of the aorta in LDL receptor-deficient mice // Sci. Rep. 2018. V. 8. № 1. P. 16822. https://doi.org/10.1038/s41598-018-35239-0
Ishibashi T., Kawamoto K., Matsuno K. et al. Peripheral endothelial function can be improved by daily consumption of water containing over 7 ppm of dissolved hydrogen: a randomized controlled trial // PLoS One. 2020. V. 15. № 5. P. 0233484. https://doi.org/10.1371/journal.pone.0233484
Nkrumah J.D., Okine E.K., Mathison G.W. et al. Relationships of feedlot feed efficiency, performance, and feeding behavior with metabolic rate, methane production, and energy partitioning in beef cattle // J. Anim. Sci. 2006. V. 84. № 1. P. 145–153. https://doi.org/10.2527/2006.841145x
Javorac D., Stajer V., Ratgeber L. et al. Short-term H2 inhalation improves running performance and torso strength in healthy adults // Biol. Sport. 2019. V. 36. № 4. P. 333–339. https://doi.org/10.5114/biolsport.2019.88756
Kalantar-Zadeh K., Berean K.J., Ha N. et al. A human pilot trial of ingestible electronic capsules capable of sensing different gases in the gut // Nat. Electron. 2018. V. 1. P. 79–87. https://doi.org/10.1038/s41928-017-0004-x
Kalantar-Zadeh K., Berean K.J., Burgell R.E. et al. Intestinal gases: influence on gut disorders and the role of dietary manipulations // Nat. Rev. Gastroenterol. Hepatol. 2019. V. 16. № 12. P. 733–747. https://doi.org/10.1038/s41575-019-0193-z
Kawashima M., Tsuno S., Matsumoto M., Tsubota K. Hydrogen-producing milk to prevent reduction in tear stability in persons using visual display terminals // Ocul. Surf. 2019. V. 17. № 4. P. 714–721. https://doi.org/10.1016/j.jtos.2019.07.008
Kim J.Y., Whon T.W., Lim M.Y. et al. The human gut archaeome: identification of diverse haloarchaea in Korean subjects // Microbiome. 2020. V. 8. № 1. P. 114. https://doi.org/10.1186/s40168-020-00894-x
Kishimoto Y., Kato T., Ito M. et al. Hydrogen ameliorates pulmonary hypertension in rats by anti-inflammatory and antioxidant effects // J. Thorac. Cardiovasc. Surg. 2015. V. 150. № 3. P. 645–654.e3. https://doi.org/10.1016/j.jtcvs.2015.05.052
Koga Y., Morii H. Recent advances in structural research on ether lipids from archaea including comparative and physiological aspects // Biosci. Biotechnol. Biochem. 2005. V. 69. № 11. P. 2019–2034. https://doi.org/10.1271/bbb.69.2019
Komaroff A.L. The microbiome and risk for atherosclerosis // JAMA. 2018. V. 319. № 23. P. 2381–2382. https://doi.org/10.1001/jama.2018.5240
Krajmalnik-Brown R., Ilhan Z.E., Kang D.W., DiBaise J.K. Effects of gut microbes on nutrient absorption and energy regulation // Nutr. Clin. Pract. 2012. V. 27. № 2. P. 201–214. https://doi.org/10.1177/0884533611436116
Kurokawa R., Seo T., Sato B. et al. Convenient methods for ingestion of molecular hydrogen: drinking, injection, and inhalation // Med. Gas Res. 2015. V. 5. P. 13. https://doi.org/10.1186/s13618-015-0034-2
Lagier J.C., Million M., Hugon P. et al. Human gut microbiota: repertoire and variations // Front. Cell. Infect. Microbiol. 2012. V. 2. P. 136. https://doi.org/10.3389/fcimb.2012.00136
Levitt M.D. Production and excretion of hydrogen gas in man // N. Engl. J. Med. 1969. V. 281. № 3. P. 122–127. https://doi.org/10.1056/NEJM196907172810303
Levitt M.D. Volume and composition of human intestinal gas determined by means of an intestinal washout technic // N. Engl. J. Med. 1971. V. 284. № 25. P. 1394–1398. https://doi.org/10.1056/NEJM197106242842502
Levitt M.D., Bond J.H. Volume, composition, and source of intestinal gas // Gastroenterology. 1970. V. 59. № 6. P. 921–929.
Li J., Jia H., Cai X. et al. An integrated catalog of reference genes in the human gut microbiome // Nat. Biotechnol. 2014. V. 32. № 8. P. 834–841. https://doi.org/10.1038/nbt.2942
Li L., Liu T., Liu L. et al. Effect of hydrogen-rich water on the Nrf2/ARE signaling pathway in rats with myocardial ischemia-reperfusion injury // J. Bioenerg. Biomembr. 2019. V. 51. № 6. P. 393–402. https://doi.org/10.1007/s10863-019-09814-7
Li X., Norman H.C., Kinley R.D. et al. Asparagopsis taxiformis decreases enteric methane production from sheep // Anim. Prod. Sci. 2016. V. 58. № 4. https://doi.org/10.1071/AN15883
Li X., Li L., Liu X. et al. Attenuation of cardiac ischaemia – reperfusion injury by treatment with hydrogen-rich water // Curr. Mol. Med. 2019. V. 19. № 4. P. 294–302. https://doi.org/10.2174/1566524019666190321113544
Lin H.Y., Lai P.C., Chen W.L. A narrative review of hydrogen-oxygen mixture for medical purpose and the inhaler thereof // Med. Gas Res. 2020. V. 10. № 4. P.193–200. https://doi.org/10.4103/2045-9912.295226
Liu S., Liu K., Sun Q. et al. Consumption of hydrogen water reduces paraquat-induced acute lung injury in rats // J. Biomed. Biotechnol. 2011. V. 2011. P. 305086. https://doi.org/10.1155/2011/305086
Lu H., Chen W., Liu W. et al. Molecular hydrogen regulates PTEN-AKT-mTOR signaling via ROS to alleviate peritoneal dialysis-related peritoneal fibrosis // FASEB J. 2020. V. 34. № 3. P. 4134–4146. https://doi.org/10.1096/fj.201901981R
Lubitz W., Ogata H., Rüdiger O., Reijerse E. Hydrogenases // Chem. Rev. 2014. V. 114. № 8. P. 4081–4148. https://doi.org/10.1021/cr4005814
Machado L., Magnusson M., Paul N.A. et al. Effects of marine and freshwater macroalgae on in vitro total gas and methane production // PLoS One. 2014. V. 9. № 1. P. e85289. https://doi.org/10.1371/journal.pone.0085289
Mailhe M., Ricaboni D., Vitton V. et al. Repertoire of the gut microbiota from stomach to colon using culturomics and next-generation sequencing // BMC Microbiol. 2018. V. 18. № 1. P. 157. https://doi.org/10.1186/s12866-018-1304-7
Matijašić M., Meštrović T., Paljetak H.Ć. et al. Gut microbiota beyond bacteria – mycobiome, virome, archaeome, and eukaryotic parasites in IBD // Int. J. Mol. Sci. 2020. V. 21. № 8. P. 2668. https://doi.org/10.3390/ijms21082668
Miller T.L., Wolin M.J., Conway de Macario E., Macario A.J. Isolation of Methanobrevibacter smithii from human feces // Appl. Environ. Microbiol. 1982. V. 43. № 1. P. 227–232. https://doi.org/10.1128/aem.43.1.227-232.1982
Mizrahi I., Wallace R.J., Moraïs S. The rumen microbiome: balancing food security and environmental impacts // Nat. Rev. Microbiol. 2021. V. 19. № 9. P. 553–566. https://doi.org/10.1038/s41579-021-00543-6
Modesto A., Cameron N.R., Varghese C. et al. Meta-analysis of the composition of human intestinal gases // Dig. Dis. Sci. 2021. https://doi.org/10.1007/s10620-021-07254-1
Nakayama M., Itami N., Suzuki H. Novel haemodialysis (HD) treatment employing molecular hydrogen (H2)-enriched dialysis solution improves prognosis of chronic dialysis patients: a prospective observational study // Sci. Rep. 2018a. V. 8. № 1. P. 254. https://doi.org/10.1038/s41598-017-18537-x
Nakayama M., Watanabe K., Hayashi Y. et al. Translational research of peritoneal dialysis solution with dissolved molecular hydrogen // Contrib. Nephrol. 2018b. V. 196. P. 162–170. https://doi.org/10.1159/000485717
Nishijima S., Suda W., Oshima K. et al. The gut microbiome of healthy Japanese and its microbial and functional uniqueness // DNA Res. 2016. V. 23. № 2. P. 125–133. https://doi.org/10.1093/dnares/dsw002
Nishimura N., Tanabe H., Komori E. et al. Transplantation of high hydrogen-producing microbiota leads to generation of large amounts of colonic hydrogen in recipient rats fed high amylose maize starch // Nutrients. 2018. V. 10. № 2. P. 144. https://doi.org/10.3390/nu10020144
Nkamga V., Armstrong N., Drancourt M. In vitro susceptibility of cultured human methanogens to lovastatin // Int. J. Antimicrob. Agents. 2017. V. 49. № 2. P. 176–182. https://doi.org/10.1016/j.ijantimicag.2016.09.026
Ohsawa I., Ishikawa M., Takahashi K. et al. Hydrogen acts as a therapeutic antioxidant by selectively reducing cytotoxic oxygen radicals // Nat. Med. 2007. V. 13. № 6. P. 688–694. https://doi.org/10.1038/nm1577
Ohsawa I., Nishimaki K., Yamagata K. et al. Consumption of hydrogen water prevents atherosclerosis in apolipoprotein E knockout mice // Biochem. Biophys. Res. Commun. 2008. V. 377. № 4. P. 1195–1198. https://doi.org/10.1016/j.bbrc.2008.10.156
Ono H., Nishijima Y., Adachi N. et al. A basic study on molecular hydrogen (H2) inhalation in acute cerebral ischemia patients for safety check with physiological parameters and measurement of blood H2 level // Med. Gas Res. 2012. V. 2. № 1. P. 21. https://doi.org/10.1186/2045-9912-2-21
Parker A., Fonseca S., Carding S.R. Gut microbes and metabolites as modulators of blood-brain barrier integrity and brain health // Gut Microbes. 2020. V. 11. № 2. P. 135–157. https://doi.org/10.1080/19490976.2019.1638722
Patra A., Park T., Kim M., Yu Z. Rumen methanogens and mitigation of methane emission by anti-methanogenic compounds and substances // J. Anim. Sci. Biotechnol. 2017. V. 8. P. 13. https://doi.org/10.1186/s40104-017-0145-9
Pickard J.M., Zeng M.Y., Caruso R., Núñez G. Gut microbiota: role in pathogen colonization, immune responses, and inflammatory disease // Immunol. Rev. 2017. V. 279. № 1. P. 70–89. https://doi.org/10.1111/imr.12567
Pimentel M., Saad R.J., Long M.D., Rao S.S.C. ACG clinical guideline: small intestinal bacterial overgrowth // Am. J. Gastroenterol. 2020. V. 115. № 2. P. 165–178. https://doi.org/10.14309/ajg.0000000000000501
Reinhardt C., Bergentall M., Greiner T.U. et al. Tissue factor and PAR1 promote microbiota-induced intestinal vascular remodeling // Nature. 2012. V. 483. № 7391. P. 627–631. https://doi.org/10.1038/nature10893
Reisinger A., Clark H., Cowie A.L. et al. How necessary and feasible are reductions of methane emissions from livestock to support stringent temperature goals? // Philos. Trans. A Math. Phys. Eng. Sci. 2021. V. 379. № 2210. P. 20200452. https://doi.org/10.1098/rsta.2020.0452
Rezaie A., Buresi M., Lembo A. et al. Hydrogen and methane-based breath testing in gastrointestinal disorders: The North American Consensus // Am. J. Gastroenterol. 2017. V. 112. № 5. P. 775–784. https://doi.org/10.1038/ajg.2017.46
Robertson R.C., Manges A.R., Finlay B.B., Prendergast A.J. The human microbiome and child growth - first 1000 days and beyond // Trends Microbiol. 2019. V. 27. № 2. P. 131–147. https://doi.org/10.1016/j.tim.2018.09.008
Roque B.M., Brooke C.G., Ladau J. et al. Effect of the macroalgae Asparagopsis taxiformis on methane production and rumen microbiome assemblage // Anim. Microbiome. 2019. V. 1. № 1. P. 3. https://doi.org/10.1186/s42523-019-0004-4
Sahakian A.B., Jee S.R., Pimentel M. Methane and the gastrointestinal tract // Dig. Dis. Sci. 2010. V. 55. № 8. P. 2135–2143. https://doi.org/10.1007/s10620-009-1012-0
Sakai T., Sato B., Hara K. et al. Consumption of water containing over 3.5 mg of dissolved hydrogen could improve vascular endothelial function // Vasc. Health Risk Manag. 2014. V. 10. P. 591–597. https://doi.org/10.2147/VHRM.S68844
Sender R., Fuchs S., Milo R. Revised estimates for the number of human and bacteria cells in the body // PLoS Biol. 2016. V. 14. № 8. P. e1002533. https://doi.org/10.1371/journal.pbio.1002533
Shin W. Medical applications of breath hydrogen measurements // Anal. Bioanal. Chem. 2014. V. 406. № 16. P. 3931–3939. https://doi.org/10.1007/s00216-013-7606-6
Sickerman N.S., Hu Y. Hydrogenases // Methods Mol. Biol. 2019. V. 1876. P. 65–88. https://doi.org/10.1007/978-1-4939-8864-8_5
Simrén M., Stotzer P.O. Use and abuse of hydrogen breath tests // Gut. 2006. V. 55. № 3. P. 297–303. https://doi.org/10.1136/gut.2005.075127
Slezak J., Kura B., LeBaron T.W. et al. Oxidative stress and pathways of molecular hydrogen effects in medicine // Curr. Pharm. Des. 2021. V. 27. № 5. P. 610–625. https://doi.org/10.2174/1381612826666200821114016
Smith N.W., Shorten P.R., Altermann E.H. et al. Hydrogen cross-feeders of the human gastrointestinal tract // Gut Microbes. 2019. V. 10. № 3. P. 270–288. https://doi.org/10.1080/19490976.2018.1546522
Søndergaard D., Pedersen C.N.S., Greening C. HydDB: a web tool for hydrogenase classification and analysis // Sci. Rep. 2016. V. 6. № 1. P. 34212. https://doi.org/10.1038/srep34212
Soliva C.R., Amelchanka S.L., Duval S.M., Kreuzer M. Ruminal methane inhibition potential of various pure compounds in comparison with garlic oil as determined with a rumen simulation technique (Rusitec) // Br. J. Nutr. 2011. V. 106. № 1. P. 114–122. https://doi.org/10.1017/S0007114510005684
Spanogiannopoulos P., Bess E.N., Carmody R.N., Turnbaugh P.J. The microbial pharmacists within us: a metagenomic view of xenobiotic metabolism // Nat. Rev. Microbiol. 2016. V. 14. № 5. P. 273–287. https://doi.org/10.1038/nrmicro.2016.17
Staley J.T., Konopka A. Measurement of in situ activities of nonphotosynthetic microorganisms in aquatic and terrestrial habitats // Annu. Rev. Microbiol. 1985. V. 39. P. 321–346. https://doi.org/10.1146/annurev.mi.39.100185.001541
Strocchi A., Levitt M.D. Factors affecting hydrogen production and consumption by human fecal flora. The critical roles of hydrogen tension and methanogenesis // J. Clin. Invest. 1992. V. 89. № 4. P. 1304–1311. https://doi.org/10.1172/JCI115716
Takakura W., Oh S.J., Singer-Englar T. et al. Comparing the rates of methane production in patients with and without appendectomy: results from a large-scale cohort // Sci. Rep. 2020. V. 10. Art. 867.
Tamura T., Hayashida K., Sano M. et al. Feasibility and safety of hydrogen gas inhalation for post-cardiac arrest syndrome – first-in-human pilot study // Circ. J. 2016. V. 80. № 8. P. 1870–1873. https://doi.org/10.1253/circj.CJ-16-0127
Tamura T., Hayashida K., Sano M. et al. Efficacy of inhaled HYdrogen on neurological outcome following BRain Ischemia During post-cardiac arrest care (HYBRID II trial): study protocol for a randomized controlled trial // Trials. 2017. V. 18. № 1. P. 488. https://doi.org/10.1186/s13063-017-2246-3
Tamura T., Suzuki M., Hayashida K. et al. Hydrogen gas inhalation alleviates oxidative stress in patients with post-cardiac arrest syndrome // J. Clin. Biochem. Nutr. 2020. V. 67. № 2. P. 214–221. https://doi.org/10.3164/jcbn.19-101
Vartoukian S.R., Palmer R.M., Wade W.G. Strategies for culture of “unculturable” bacteria // FEMS Microbiol. Lett. 2010. V. 309. № 1. P. 1–7. https://doi.org/10.1111/j.1574-6968.2010.02000.x
Vignais P.M., Billoud B. Occurrence, classification, and biological function of hydrogenases: an overview // Chem. Rev. 2007. V. 107. № 10. P. 4206–4272. https://doi.org/10.1021/cr050196r
Vijn S., Compart D.P., Dutta N. et al. Key considerations for the use of seaweed to reduce enteric methane emissions from cattle // Front. Vet. Sci. 2020. V. 7. P. 597430. https://doi.org/10.3389/fvets.2020.597430
Wahlström A., Sayin S.I., Marschall H.-U., Bäckhed F. Intestinal crosstalk between bile acids and microbiota and its impact on host metabolism // Cell Metab. 2016. V. 24. № 1. P. 41–50. https://doi.org/10.1016/j.cmet.2016.05.005
Wang Y., Jing L., Zhao X.M. et al. Protective effects of hydrogen-rich saline on monocrotaline-induced pulmonary hypertension in a rat model // Respir. Res. 2011. V. 12. № 1. P. 26. https://doi.org/10.1186/1465-9921-12-26
Wang W.L., Ge T.Y., Chen X. et al. Advances in the protective mechanism of NO, H2S, and H2 in myocardial ischemic injury // Front. Cardiovasc. Med. 2020. V. 7. P. 588206. https://doi.org/10.3389/fcvm.2020.588206
Wilck N., Matus M.G., Kearney S.M. et al. Salt-responsive gut commensal modulates TH17 axis and disease // Nature. 2017. V. 551. № 7682. P. 585–589. https://doi.org/10.1038/nature24628
Wolf P.G., Biswas A., Morales S.E. et al. H2 metabolism is widespread and diverse among human colonic microbes // Gut Microbes. 2016. V. 7. № 3. P. 235–245. https://doi.org/10.1080/19490976.2016.1182288
Zhao L., Zhang F., Ding X. et al. Gut bacteria selectively promoted by dietary fibers alleviate type 2 diabetes // Science. 2018. V. 359. № 6380. P. 1151–1156. https://doi.org/10.1126/science.aao5774
Дополнительные материалы отсутствуют.
Инструменты
Успехи современной биологии


