Успехи современной биологии, 2022, T. 142, № 4, стр. 390-403
Неспецифические мишени коррекции воспаления легких, вызванного аэрозолями повреждающих факторов различной природы
О. А. Яковлев 1, *, М. А. Юдин 1, 2, С. В. Чепур 1, Н. Г. Венгерович 1, 3, А. В. Степанов 1, А. А. Бабкин 1
1 Государственный научно-исследовательский испытательный
институт военной медицины
Санкт-Петербург, Россия
2 Северо-Западный государственный медицинский университет
им. И.И. Мечникова
Санкт-Петербург, Россия
3 Санкт-Петербургский государственный химико-фармацевтический
университет
Санкт-Петербург, Россия
* E-mail: gniiivm_15@mil.ru
Поступила в редакцию 15.03.2022
После доработки 22.03.2022
Принята к публикации 25.03.2022
- EDN: QCMSDR
- DOI: 10.31857/S004213242204010X
Аннотация
Приведены данные о современном состоянии особенностей патогенеза формирования воспаления в организме, в частности в легких, при воздействии повреждающих факторов различной природы: возбудителей инфекций, химических токсикантов, а также инкорпорированных радионуклидов и др. Рассмотрены особенности самого воспаления, как типового патологического процесса, приведены сведения о медиаторах, индуцирующих так называемую проразрешающую фазу проявлений воспаления, обоснованы подходы к нейроиммунной коррекции неспецифического воспаления. Обобщены данные об альтернативных подходах к коррекции неспецифического воспаления: факторы свертывающей системы, модуляторы интегрированного стрессового ответа, модуляторы сигма-1-рецепторов. На основании представленных данных сформулированы общие направления терапии неспецифического воспаления легких, включающие рефлексогенную и противовоспалительную терапию в комбинации с препаратами мультимодального действия, а также проразрешающую терапию в комбинации с препаратами, препятствующими фиброзированию.
ВВЕДЕНИЕ
Возбудители инфекций, химические токсиканты, а также инкорпорированные радионуклиды (далее повреждающие факторы) опосредуют специфические и неспецифические респираторные нарушения в результате аэрогенного воздействия. При этом формирование воспалительной реакции выступает в качестве ключевого триггера, опосредующего их повреждающее действие. Выраженность и интенсивность этого процесса зависит от характеристик биодоступности повреждающих факторов и от размера ингалированных частиц аэрозоля: чем крупнее частицы вдыхаемого аэрозоля, тем менее вероятно их осаждение в нижних отделах дыхательного тракта (Cargnello Roux, 2011). В профиле осаждения аэрозоля важную роль играет геометрия различных областей трахеобронхиального древа. Диаметр определяет необходимое смещение частицы до ее контакта с эпителиальной выстилкой, поперечное сечение обусловливает скорость движения воздуха (Башарин и др., 2022), а характер ветвлений бронхов влияет на смешивание между вдыхаемым и резервным воздухом (Чепур и др., 2019; Codagnone et al., 2018).
При аэрозольном поступлении основой последующих взаимодействий повреждающего фактора с организмом служит уровень нейроиммуноэндокринной реакции, определяющей интенсивность неспецифических воспалительных процессов, нередко заканчивающихся летальным исходом или выраженными морфофункциональными изменениями легочной ткани, существенно снижающими качество жизни: хронической обструктивной болезнью легких, диффузным фиброзом легких, дыхательной недостаточностью и т.п. Поэтому тактика профилактики и лечения пострадавших с подобной патологией должна предусматривать экстренное, по возможности, ингаляционное введение лекарственных средств, препятствующих индукции триггерных механизмов воспалительной реакции, нивелирующих начальную фазу воспаления и ускоряющих формирование адаптивного комплекса структурно-функциональных перестроек.
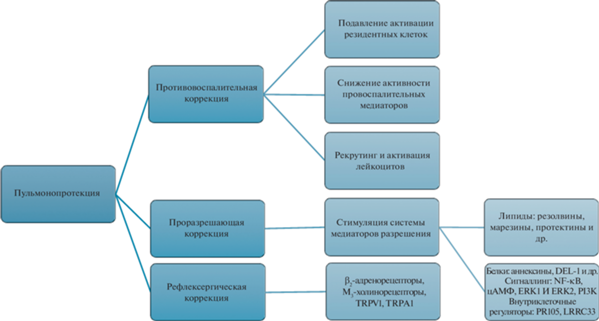
Для определения возможных направлений терапии ингаляционных поражений легких следует учитывать молекулярно-клеточные механизмы индукции, поддержания и разрешения воспаления, присущие действию широкого спектра повреждающих факторов. На настоящий момент схема коррекции неспецифического воспаления легких (пульмонопротекция) основана на применении средств противовоспалительной и проразрешающей терапии, а также на блокировании патологических рефлекторных реакций (рис. 1).
КОРРЕКЦИЯ СОБСТВЕННО ВОСПАЛИТЕЛЬНОЙ РЕАКЦИИ
Известно, что взаимодействие организма с повреждающим фактором инициирует высвобождение провоспалительных медиаторов. Так, прямое повреждение клеток химическими токсикантами приводит к высвобождению молекулярных фрагментов, ассоциированных с повреждением DAMPs (damage-associated molecular patterns), тогда как повреждение, вызванное биопатогеном, – молекулярных фрагментов, ассоциированных с патогеном PAMPs (pathogen-associated molecular patterns). Выделяют также универсальную систему молекулярных сигналов, ассоциированную с нарушением клеточного гомеостаза, экспрессией генов, воспалением, аллергией и репарацией тканей. Вышеперечисленные сигнальные молекулы представлены: белками; РНК; ДНК; липополисахаридами (ЛПС); экзо- и эндотоксинами; различными гликанами, которые активируют рецепторы распознавания паттернов – toll-подобные рецепторы TLR1–11, NOD-подобные рецепторы NBS-LRR (nucleotide-binding site leucine-rich repeat), RIG-I-подобные рецепторы (RLR); мембранными 2'–5'-олигоаденилатсинтазами и протеинкиназами, активируемыми двухспиральной РНК и др. (Чепур и др., 2019; Di Salvo et al., 2021). Сочетанное или изолированное воздействие этих молекулярных образов определяет индукцию воспаления. Некоторые ксенобиотики (флогогены) могут предопределять их активацию без прямого повреждения тканей, предположительно посредством стрессорных молекул MICA, MICB, RAE-1, ULBP1, ULBP2, ULBP3 с высоким аффинитетом к киллер-ингибирующим рецепторам NK-клеток (Zingoni et al., 2018). Считается, что ткане- и стрессор-специфическое представительство, концентрация и длительность действия данных сигналов программируют воспалительную реакцию и определяют ее специфичность. Отмеченные обстоятельства диктуют необходимость выявления наиболее значимых предикторов неспецифического воспаления.
Вне зависимости от природы повреждающего фактора нарушение целостности клеток ведет к высвобождению во внеклеточную среду значительного объема цитозольного и внутриядерного содержимого, включающего консервативные гидрофобные домены – алармины. Алармины представлены дефензинами, кателицидинами, нейротоксином эозинофилов, ядерным негистоновым белком B1 – HMGB1, белками теплового шока HSP, нуклеиновыми кислотами, гистонами, нуклеосомами. Выступая в роли лигандов специфических рецепторов: TLRs, гликан-связывающего рецептора RAGE (receptor for advanced glycation endproducts), рецепторов фагоцитоза, включая MerTK и MFG-E8, рецептора лектина С-типа – CLR, рецептора-мусорщика SR (scavenger receptor) и др., алармины индуцируют воспалительную реакцию (Anfinogenova et al., 2020). Так, массивный некроз тканей при хирургических операциях приводит к системной воспалительной реакции, которая в 4–7% случаев заканчивается летальным исходом (Бакулина и др., 2017). Рецепторы аларминов выступают ассоциирующим звеном в ответ на повреждающие стимулы, а воздействие на них оправдано с точки зрения универсальности коррекции неспецифического воспаления.
Влияние DAMPs опосредовано значительным представительством рецепторов, среди которых существенная роль принадлежит TLR4. Проявляя способность к рецепции огромного числа DAMPs, включая бактериальные ЛПС, TLR4 служат универсальным триггером развития неспецифического воспаления, подкрепление которого обусловлено клетками иммунной системы человека. Существуя в виде гомо- и гетеродимерных комплексов с рецепторами других подтипов, которые находятся как на цитолемме, так и внутриклеточно в цитоплазме, TLR4 запускают механизмы врожденного иммунитета. Способность связываться со всеми адаптерными белками обусловливает основную роль TLR4 в формировании неспецифического воспаления, включая цитокиновую секрецию, выработку провоспалительных ИЛ-13 и ИЛ-18, а также процессов аутофагии и апоптоза (Бакулина и др., 2017).
TLR4 участвуют в патогенезе хронических воспалительных заболеваний, острого сепсиса, а также жизнеугрожающих осложнений опасных инфекций (Perrin-Cocon et al., 2017). Так, нокаут генов по TLR4 защищает грызунов от гибели в результате нарушения сократимости миокарда, вызванного токсином Bacillus anthracis (Kandadi et al., 2012). На настоящий момент доказано (Imai et al., 2008), что тяжесть острого повреждения легких при воздействии повреждающих факторов зависит от степени активации сигнального пути врожденного иммунитета TLR4–TRIF–TRAF6, где TLR4 (toll-like receptor 4) – толл-подобный рецептор 4, TRIF (TIR-domain-containing adapter-inducing interferon-β) – TIR-домен-содержащий адаптер, индуцирующий интерферон-β, TRAF6 (TNF receptor- associated factor 6) – фактор 6, ассоциированный с рецептором TNF. В свою очередь, использование антагонистов TLR4 предотвращает секрецию провоспалительных цитокинов, миграцию дендритных клеток, индуцированную ЛПС, а также снижает острое повреждение легких и летальность, ассоциированные с вирусной инфекцией.
В качестве блокаторов TLR4 можно использовать антагонисты μ‑опиоидных рецепторов (налоксон и налтрексон). Их эффективность в отношении TLR4-зависимой патологии – нейропатической боли или аддикции – продемонстрирована в ряде работ (Watkins et al., 2014; Wang et al., 2016). Наиболее перспективным средством коррекции гипериммунного ответа на данный момент считается правовращающий изомер налтрексона (Selfridge et al., 2015). Именно с ним связывают способность таргетно блокировать каскад PAMPs-ассоциированных ЛПС-зависимых стимулов в отношении TLR4.
Выброс медиаторов в кровеносное русло способствует рекрутингу нейтрофилов и моноцитов костномозгового происхождения, которые мигрируют в очаг воспаления, где подвергаются дифференцировке. В очаге воспаления эпителиальные и иммунокомпетентные клетки начинают продуцировать цитокины и хемокины: MCP-1 (monocyte chemoattractant protein 1), CCR2 (C-C motif chemokine receptor type 2), CXCL-1 (C-X-C motif chemo-kine ligand 1), среди которых приоритетная роль в развитии и прогрессировании воспалительного процесса принадлежит ФНО-α и ИЛ-1β. В результате воздействия протеолитических ферментов ФНО-α высвобождается от связи с цитолеммой и взаимодействует с одноименным рецептором на поверхности макрофагов, дендритных клеток, Т-лимфоцитов и активирует домен апоптоза через митоген-активированную протеинкиназу p38-MAPK и NF-κB. MAPK активирует факторы транскрипции Ets и, как следствие, экспрессию генов fas, в результате чего увеличивается продукция провоспалительных протеинов II класса (DP, DQ, DR), антигенов HLA Т‑клеточного рецептора, АР-1, регулирующего транскрипцию циклина 1D, и провоспалительных ростовых факторов NGF, EGF, PDGF и др. (Cargnello, Roux, 2011). Результат активации нейтрофилов и моноцитов – накопление активных форм кислорода и азота.
В плане скрининга эффективных пульмонопротекторов возможно использовать модель повреждения легких сигаретным дымом, основываясь на общих патогенетических механизмах поражения легких, присущих многим повреждающим факторам (рис. 2).
Среди молекулярных мишеней, воздействие на которые может способствовать профилактике и лечению неспецифического воспаления легких, целесообразно выделить (Yao et al., 2008):
1. Ингибиторы клеточного сигналинга: ингибиторы фосфодиэстеразы B-типа (PDE4B) и 4-го типа (рофлумиласт, циломиласт, GRC3886 и GSK842470); ингибиторы p38-MAPK (SB 203580, SB 239063 и RWJ 67657, SD282, GSK-681323, GSK-85633); ингибиторы IKK-2 (находятся в стадии разработки); ингибиторы фосфоинозитид-3-киназы PI3K δ- и γ-типов (LY294002).
2. Ингибиторы цитокинов и хемокинов: антагонисты CCL2 (MCP-1) и CCR2 (CCX915, INCB3284, антитела ABN912, INCB8696, JNJ-27553292, SKL-2841 и INCB3344); антагонисты CXCL1, CXCL8 (SB-265610, SCH 527123); ингибиторы ФНО-α (инфиксимаб, этанерцепт, адалумимаб).
3. Модификаторы гистондеацетилаз HDAC (вориностат и ромидепсин).
4. Антипротеиназы: ингибиторы эластаз нейтрофилов (ZD0892, AZD3342, α-1-антитрипсин); ингибиторы MMP-1, -2, -9, -12 (макрофагальных) типов (маримастат, BMS-561392 и GW3333).
СРЕДСТВА, ИНДУЦИРУЮЩИЕ ПРОРАЗРЕШАЮЩУЮ ФАЗУ ВОСПАЛИТЕЛЬНОЙ РЕАКЦИИ
Несмотря на то, что разрешение – это исход воспаления любой этиологии, этот период характеризуется активным процессом, регулируемым специальными проразрешающими липидными медиаторами (ПЛМ). Их синтез начинается в момент активации нейтрофилов (минуты, часы) и продолжается до функционально-структурного восстановления ткани легкого (сутки, недели). ПЛМ снижают выраженность воспалительной реакции без депрессии иммунной системы, защищают ткани от повреждения, ускоряют удаление этиологических факторов воспаления и апоптотических лейкоцитов, способствуя восстановлению гомеостаза (Krishnamoorthy et al., 2018). ПЛМ образуются в результате ферментирования жирных кислот: липоксины – из арахидоновй кислоты, Е-серия резолвинов – из эйкозапентаеновой кислоты, D-серия резолвинов, протектинов и марезинов – из докозагексаеновой кислоты. При определенных условиях могут образовываться высокоактивные конъюгаты, например ПЛМ-сульфид- или ПЛМ-ацетил-производные (Chiang, Serhan, 2020).
Большое количество публикаций, посвященных резолвинам, в последнее время связано, в том числе, с перспективами их использования при лечении COVID-19, поскольку гипервоспалительная реакция, вплоть до цитокинового шторма, представляет одну из основных причин высокой летальности при коронавирусной инфекции (Panigrahy et al., 2020). Основой этому послужили результаты применения средств проразрешающей терапии на моделях патологии легочной ткани, при этом наибольшую перспективность представляет использование резолвина D1. Так, показано (Xia et al., 2019), что резолвин D1 при внутрибрюшинном введении уменьшал вентиляционно-ассоциированное повреждение легких мышей, выраженность эмфиземы и хронического воспаления на модели хронического (Hsiao et al., 2015) и острого (Hsiao et al., 2013) воздействия сигаретного дыма. Резолвин D1 способствовал разрешению воспаления легких на модели инфекции, вызванной синегнойной палочкой Pseudomonas aeruginosa (Codagnone et al., 2018) или на модели ЛПС-индуцированного повреждения легких (Wang et al., 2014). Резолвин D1 ограничивал септическое повреждение легких мышей, вызванное (Zhuo et al., 2018) перевязкой и пункцией слепой кишки.
Важнейшая особенность биохимических превращений резолвинов связана с их чувствительностью к ацетилирующему действию аспирина. Так, на модели паракват-индуцированного повреждения легких мышей аспирин-индуцированный резолвин D1 оказывал защитное действие, снижая окcидативный стресс, воспалительную реакцию и отек легких (Hu et al., 2019), а на модели пневмонии смешанной этиологии уменьшал воспаление и инфицирование легких (Wang et al., 2017).
В разрешении воспаления, помимо резолвинов, участвуют липоксины, марезины, а также различные протеины – аннексин А1, TIM-4 (T-cell immunoglobulin and mucin domain 4), действие которых реализуется благодаря модификации сигнального пути (PI3K, связанной с АТФ) и работы внутриклеточных регуляторов воспалительных реакций (семейство протеинкиназ В (РКВ) и серин-треониновой специфичности). Показано, что, связываясь со специфическим N-формильным пептидным рецептором 2-го типа (FPR2) мембран лейкоцитов, аннексин A1 уменьшает вызванную N‑формилметионин-содержащими олигопептидами (включая продукты арахидоновой кислоты) эпителиальную адгезию, процессы миграции лейкоцитов, хемотаксис и фагоцитоз (Schloer et al., 2019).
Вышеприведенные данные свидетельствуют о перспективности применения резолвинов, в частности резолвина D1, в качестве средств, индуцирующих проразрешающую фазу неспецифического воспаления.
НЕЙРОИММУННУАЯ КОРРЕКЦИЯ НЕСПЕЦИФИЧЕСКОГО ВОСПАЛЕНИЯ ЛЕГКИХ
Острое воздействие повреждающих факторов и в первую очередь токсических веществ на легкие обусловлено не только нарушением целостности тканей вследствие прямого цитолитического действия, но и гиперактивацией защитных функций организма, таких как выделение слизи, кашель, бронхоспазм, отек, а также нейрогенное воспаление. Уменьшить интенсивность рефлекторных реакций можно, разомкнув рефлекторную дугу, представленную афферентной, центральной и эфферентной фазами. Этот подход успешно реализуется применением β2-адреномиметиков и М3‑холиноблокаторов в качестве средств ургентной терапии поражений пульмонотоксикантами (De Virgiliis, Di Giovanni, 2020).
Дыхательный эпителий содержит легочные нейроэндокринные клетки, часть из которых ассоциирована с отростками нервных клеток и называется НЭТ (нейроэпителиальные тельца), которые способны к высвобождению иммуннотропных аминов и пептидов. Доказаны роль НЭТ в развитии легких, в течении воспалительных заболеваний, а также способность НЭТ выступать в качестве стволовых клеток (Yeger et al., 2019).
Показано, что иннервация НЭТ, по аналогии с эндотелием сосудов, осуществляется чувствительными волокнами узловатого и яремного ганглиев n. vagus, которые экспрессируют мембранные рецепторы к нейротропным факторам и пуринам соответственно. Активация волокон эндогенными и экзогенными медиаторами вызывает деполяризацию нейронов с последующим выбросом нейропептидов как в легких, так и вблизи вторичных нейронов ядра одиночного пути, запуская при этом рефлекторный кашель. В развитии кашля также участвуют медленнопроводящие (~1 м/с) немиелинизированные волокна C-типа, которые экспрессируют TRPV1-рецепторы (Nassenstein et al., 2018).
Парасимпатическая эфферентная регуляция нейроиммунных процессов в легких анатомо-гистологически обеспечивается преганглионарными нейронами дорзального моторного ядра n. vagus, достигающего интрамуральных ганглиев трахеи, содержащих ацетилхолин-продуцирующие нейроны и нехолинергические нейроны нервного сплетения Ауэрбаха вблизи наружного продольного мышечного слоя пищевода. Последние в качестве нейромедиаторов высвобождают интестициальный вазоактивный пептид VIP (vasoactive intestinal peptide) и NO (Yildiz-Pekoz, Ozsoy, 2017).
В отличие от нейронального ацетилхолина, высвобождение его ненейрональной доли происходит неквантово. Так, на экспериментальной модели бронхиальной астмы на животных применение антихолинергических препаратов обеспечивало бронхолитический эффект, уменьшение слизи и воспаления и ремоделирование через процесс блокирования M3R. Провоспалительный эффект ацетилхолина, включающий повышение хемотаксиса нейтрофилов и стимуляцию продукции активных форм кислорода, вероятно, также опосредован активацией M3R, что подтверждается применением фармакологических зондов (Shen et al., 2020).
VIP-ергические парасимпатические нервные волокна широко колокализованы с пептидом, активирующим аденилатциклазу гипофиза. Оба медиатора усиливают вазодилатацию и бронходилатацию. В дополнение тучные клетки и Th2-лимфоциты синтезируют VIP, который оказывает противовоспалительный эффект, что подтверждено на различных моделях воспаления легких. Так, профилактическое введение интратрахеально аналога VIP снижало рекрутинг воспалительных клеток на 70% в бронхоальвеолярной лаважной жидкости (Prescott et al., 2020). Позднее взаимодействие между сенсорными нейронами и эозинофилами, а также антиген-презентирующими клетками подтверждено гистологически. Эозинофилы влияют на ветвление сенсорных нейронов, предположительно за счет избыточной секреции фактора роста нервов. В свою очередь доказано, что нервные волокна стимулируют миграцию эозинофилов за счет секреции эотаксина-1. Существенная роль в организации нейроиммунных взаимодействий принадлежит тучным клеткам, которые способны активировать TRPV1-рецептор через H1-рецептор нейронов.
Клиническая значимость нейроиммунного взаимодействия в обеспечении воспалительных процессов подтверждается клиническим успехом рефрактерной терапии бронхиальной астмы путем вагальной термопластики и стимуляции блуждающего нерва (Caravaca et al., 2019). Нейроиммунные взаимодействия на анатомическом уровне, выступающие в качестве мишеней фармакологической коррекции воспаления, схематично отображены на рис. 3.
Рис. 3.
Схематичное отображение нейроиммунных взаимодействий, выступающих в качестве мишеней фармакологической коррекции воспаления. P2XR – семейство АТФ-открываемых P2X-пуринергических рецепторов; P2YR – семейство АТФ-открываемых P2Y-пуринергических рецепторов; AR – адренорецепторы; M2R – мускариновый ацетилхолиновый рецептор 2-го типа; M3R – мускариновый ацетилхолиновый рецептор 3-го типа; CGRP – кальцитонин ген-связанный пептид; β2AR – β2-адренорецеторы; VIP – вазоинтестицинальный пептид; NO – оксид азота; TRPV1R – рецептор транзиторного потенциала по ванилоиду, член 1-го подсемейства; TRPA1R – рецептор транзиторного потенциала по анкирину, член 1-го подсемейства; TRPM8R – рецептор транзиторного потенциала по меластатину, член 8-го подсемейства; NKA – нейрокинин А; SP – субстанция P; 5-HT – серотонин.

Стимуляция парасимпатических волокон индуцирует бронхоспазм, гиперсекрецию слизи и вазодилатацию легочных сосудов через активацию мускариновых холинорецепторов 3-го типа М3-ХР. Мускариновые холинорецепторы 2-го типа представлены на пресинаптических терминалях, а их активация ослабляет высвобождение ацетилхолина и препятствует бронхоспазму. Многие факторы биологической природы, например вирусы парагриппа, нарушают функцию М2-ХР, что приводит к усилению выброса ацетилхолина и повышению тонуса гладкой мускулатуры. Учитывая способность легочных макрофагов экспрессировать М2-ХР, М3-ХР, можно сделать вывод о корреляции между активностью ацетилхолиновой системы и выраженностью воспаления (Koarai et al., 2012). Обратная положительная связь подтверждается способностью ИФНγ, ФНО-α и ИЛ-1β повышать экспрессию М2-ХР, что, в частности, показано на моделях вирусных инфекций, в том числе SARS-CoV-2 (Rynko et al., 2014). Активация C‑волокон, содержащих кальцитонин, ген-связанный пептид CGRP, тахикинины (субстанция P и нейрокинин А), вызывает спазм гладкой мускулатуры дыхательных путей, вазодилатацию, избыточное образование слизи, что в совокупности формирует клинические проявления синдрома неспецифического воспаления. Показано, что P2RY1+-нейроны блуждающего нерва обеспечивают запуск каскада реакции воспаления в ответ на ингаляционное поступление различных ирритантов, при этом рецепторы растяжения дыхательных путей Piezo2 интегрируют и координируют защитные рефлексы, в частности ларингоспазм (Nonomura et al., 2017). В реализации неспецифического воспаления при воздействии повреждающих факторов участвуют сенсорные клетки, богатые НЭТ с биоактивными медиаторами: бомбезином, серотонином, CGRP (Noguchi et al., 2020).
Перспективными мишенями фармакологической коррекции рефлекс-зависимого воспаления могут являться катионные каналы, действующие через транзиторный рецепторный потенциал (TRP-канал): ванилоидные (TRPV1), анкириновые (TRPA1) и меластатиновые (TRPM8), а также рецепторы медиаторов эфферентных волокон легочной ткани (субстанция P и CGRP). Локализуясь на ноцицептивных периферических нейронах TRPA1, TRPV1 и TRPM8, они ответственны за восприятие острой и хронической боли, инициирование рефлекторного кашля, развитие приступов астмы, повреждение легких и асептическое воспаление (Grace et al., 2013). Их особенность – возможность активации воспалительных процессов вне связи с конкретным пульмонотоксикантом, а только посредством попадания частиц с диаметром менее 2.5 мм, так называемых тонкодисперсных частиц (ТЧ2.5). Экспериментально показано, что профилактическое лечение антагонистами TRPV1- и TRPA1-рецепторов эффективно предотвращает воспаление легких и гиперчувствительность бронхов, вызванные интраназальной инстилляцией ТЧ2.5 мышам в дозе 7.8 мг/кг (Xu et al., 2019).
Другой представитель семейства рецепторов TRP – TRPC6 – экспрессируется на эозинофилах, нейтрофилах, тучных клетках и CD4+-лимфоцитах, и его активация вовлечена в патогенез астмы и аллергического воспаления. В свою очередь активация TRPV1 на C-волокнах сенсорных нейронов приводит к высвобождению тахикининов и усилению рекрутинга иммунных клеток (Jia, Lee, 2007).
TRPA1-рецепторы активируются лакриматорами (CS, CN, CR), лекарственными средствами (парацетамол, дифенгидрамин), продуктами горения, химиотерапевтическими агентами, сигаретным дымом, а также другими поллютантами (Belvisi, Birrell, 2017). В настоящее время в качестве наиболее вероятных кандидатов, способных блокировать TRP-каналы, рассматривают: AG489, выделенный из яда паука Agelenopsis aperta, HCRG21, выделенный из актинии Heteractis crispa, JYL-1421 и AMG8562 (Кветкина и др., 2019).
АЛЬТЕРНАТИВНЫЕ ПОДХОДЫ К КОРРЕКЦИИ НЕСПЕЦИФИЧЕСКОГО ВОСПАЛЕНИЯ
Факторы свертывающей системы крови
Факторы свертывающей системы крови относят к провоспалительным факторам, тогда как вещества, оказывающие противоположное действие, обладают противовоспалительным эффектом, что показано на различных моделях повреждения легких (Choi et al., 2008). Так, на модели ЛПС-индуцированного повреждения легких крыс введение гепарина с помощью небулайзера в дозе 1000 UI/кг обеспечивало снижение экспрессии гена плазминогена, а также эффекторов TGFβ – Smad 2, Smad 3 – и NF-κB – P-selectin, CCL2. Превентивная ингаляция гепарина обладала выраженным защитным действием (Chimenti et al., 2017). Помимо этого, гепарин обладал противоастматическим действием на моделях аллерген-, аденозин-индуцированной астмы и астмы физического усилия за счет предупреждения дегрануляции тучных клеток (Mousavi et al., 2015). Ингаляционное введение гепарина при состояниях, сопровождающихся воспалением легочной ткани и системной гиперкоагуляцией, становится обязательным показанием для пациентов с тяжелыми формами COVID-19 (van Haren et al., 2020). В настоящий момент доказано, что ингаляции нефракционированного гепарина обеспечивают противовоспалительное действие за счет:
– блокады гепарансульфат-содержащих рецепторов цитолеммы, рассматриваемых в качестве транслокационного кофактора шиповидного белка пепломера (spike) к рецептор‑связывающему домену рецептора ангиотензин-превращающего фермента 2 (ACE2) (Clausen et al., 2020);
– снижения экспрессии провоспалительных медиаторов и ингибирования системы комплемента, за счет взаимодействия с С1-компонентом (Shi et al., 2021);
– дезагрегации ДНК и актина с последующей активацией эндогенной ДНКазы и снижением электростатических взаимодействий между молекулами муцина (Broughton-Head et al., 2007);
– инактивации тромбина, фактора Ха, калликреина, сериновых протеаз и уменьшения избыточного отложения фибрина (Camprubí-Rimblas et al., 2018).
Помимо гепарина, практический интерес представляет антитромбин, который, обладая схожей с гепарином противовоспалительной активностью, лишен побочных эффектов последнего (остеопороз и тромбоцитопения). На модели пневмонии у крыс, вызванной Streptococcus pneumoniae, внутривенное введение антитромбина приводило к снижению количества нейтрофилов в бронхоальвеолярном лаваже, а спустя 48 ч – к существенному падению уровней ФНО-α, ИЛ-6 и цитокин-индуцированного нейрофильного хемоаттрактанта 3 CINC-3 (cytokine-induced neutrophil hemoattractant), также на модели острого повреждения легких эндотоксином – к снижению экспрессии ERK1/2 и p38-MAPK (Sun et al., 2009).
Модуляторы интегрированного стрессового ответа
Каждая эукариотическая клетка при воздействии на нее повреждающих факторов интегрировано реагирует на это снижением синтеза белка с двумя целями: и предотвращения накопления его дефектных форм, и препятствия репликации биоагента, а также повышением экспрессии генов, позволяющих специфично адаптироваться либо к повреждающим факторам, либо к факторам, запускающим апоптоз (Emanuelli et al., 2020). Для различных стрессовых факторов существуют внутриклеточные сенсоры-киназы, запускающие интегрированный стресс-ответ ISR (integrated stress response). При наличии в цитозоле двухцепочечных ДНК (дсДНК) цитозольная протеинкиназа R (PКR) и PКR-подобная киназа эндоплазматического ретикулума активируют киназы эукариотического фактора инициации 2α (eIF2α), при оксидативном стрессе и дефиците Fe2+ активируется гем-регулирующий ингибитор HRI (heme-regulated inhibitor), при дефиците аминокислот активируется киназа, контролирующая общую неподавляемость GCN2 (general control non-derepressible). После фосфорилирования α-субъединицы фактора инициации трансляции 2 (eIF2) последний взаимодействует с метионин-переносящей РНК (тРНК) на рибосоме и запускает трансляцию.
В норме eIF2α гидролизует связанный ГТФ, который восполняется фактором обмена гуаниновых нуклеотидов eIF2β. Однако при воздействии повреждающих факторов eIF2α в основном представлен фосфорилированной формой, которая легко связывается с eIF2β и ингибирует дальнейший обмен ГТФ.
По этой причине синтез белка может существенно замедляться, что способствует активации факторов транскрипции ATF4 и CHOP и повышению экспрессии геном GADD34 белка, индуцированного повреждением DIP (damage-induced protein). DIP формирует комплекс с протеинфосфатазой PP1 и G-актином, обеспечивая функционирование eIF2α-специфических фосфатаз и сохранение трансляции. Указанный механизм позволяет временно активировать ISR, тогда как при отсутствии такого взаимодействия можно наблюдать клеточную гибель (Pakos-Zebrucka et al., 2016).
Функция ISR рассматривается с противоположных позиций относительно вирусной инвазии. Это связано, как правило, с самой природой патогена. Активация PKR вирусной ДНК считается частью противовирусного иммунитета, однако многие вирусы совершенствуют системы противодействия данному механизму. Для вирусов семейств Togaviridae, Reoviridae и вируса гепатита С фосфорилирование eIF2α может способствовать трансляции их мРНК (Fusade-Boyer et al., 2019). Для других быстро реплицирующихся вирусов, напротив, реализация такого механизма существенно замедляет внутриклеточную сборку белкового капсида вирусных частиц.
ISR представляет собой универсальный неспецифический защитный механизм в ответ на действие повреждающих факторов различной природы. Однако избыточный ISR может оказаться неблагоприятным для клетки и не являться адаптивным. В связи с этим разрабатываются фармакологические инструменты для снижения интенсивности ISR в виде так называемых ингибиторов интегрированного стресс-ответа – ISRIB. Механизм их действия заключается в связывании по аллостерическому сайту с eIF2β – основной мишенью фосфорилированного eIF2α – и в усилении рекрутинга гуанидиновых остатков при наличии фосфорилированного eIF2α (Zyryanova et al., 2021). Следовательно, ISRIB переводит неактивный комплекс, участвующий в синтезе белка, в активный, восстанавливая потенциал клетки к синтезу защитных белков. Дисфункция ISR может лежать в основе состояний, сопряженных с недостаточной функцией системы эндогенной защиты от поражающих факторов различной природы, что требует проработки вопроса о целенаправленной фармакологической коррекции дисфункциональной ISR. На данный момент синтезировано несколько модулирующих ISR соединений, структурно схожих с ISRIB.
Несмотря на то, что ISR представляет собой новую мишень в противопневмонийной защите (van 't Wout et al., 2014), уже есть доказательства эффективности модуляторов ISR при различных патологиях дыхательной системы. Так, ISRIB в дозе 2.5 мг/кг при внутрибрюшинном введении снижал выраженность блеомецин- и асбестоз-индуцированного легочного фиброза, в том числе по причине снижения избытка образования коллагена. Помимо этого, ISRIB способствует облегчению трансформации альвеолярных макрофагов 2-го типа в альвеолярные макрофаги 1-го типа, что необходимо для поддержания газообмена в легких (Watanabe et al., 2021). ISRIB, как салубринал и Sal003, ингибирует фосфатазу eIF2α. Sephin1 (производное гуанабеза) селективно блокирует GADD34-фосфатазу и стресс-индуцированную протеинфосфатазу 1 (PPP1R15A), в результате чего освободившаяся серин/треониновая фосфатаза PP1 дефосфорилирует eIF2α. По всей видимости, за счет дополнительного действия на протеинфосфатазу у последнего при курсовом введении в течение 11 сут в дозе 5 мг/кг прослеживали противовирусную активность на модели заражения кроликов вирусом миксомы. Таким образом, применение модуляторов ISR с целью предотвращения фиброзирующих процессов в легких после ингаляционного воздействия патологических факторов может оказаться перспективным. Противовоспалительный потенциал данного класса соединений хорошо реализуется, особенно при заболеваниях, связанных с неправильной сборкой белков (с фолдингом), при так называемых болезнях накопления, однако относительно бактериальных и вирусных поражений до настоящего времени нет однозначного мнения (Pierre, 2019).
Мультимодальные агенты
Поскольку воспалительный процесс характеризуется вовлечением огромного числа эффекторных клеток и их сигнальных путей, в плане его нивелирования может оказаться оправданным использование противовоспалительных средств мультимодального типа действия, например веществ растительного происхождения, относящихся к флаваноидам – кверцетина и его аналога дигидрокверцетина (Adhikari et al., 2021).
На модели ЛПС-индуцированного повреждения клеточной линии TC-1 показано, что таксифолин снижает цитотоксическое действие и уровень летальности посредством модуляции NF-κB-сигналинга (Liu et al., 2020). С помощью компьютерного моделирования доказана потенциальная возможность таксифолина и раментина выступать в качестве ингибиторов главной протеазы (Mpro) SARS-CoV-2 при удовлетворительных характеристиках переносимости (Fischer et al., 2020). Таксифолин показал способность подавлять оксидативный стресс и воспаление легких, вызванное бензо[а]пиреном (125 мг/кг) при курсовом введении мышам в дозе 20–40 мг/кг на протяжении 14 сут. Корригирующее действие было обусловлено высоким уровнем экспрессии NF-E2-связанного фактора 2 (Nrf2), NAD(P)H-хинон дегидрогеназы-1 (NQO1), гена гемоксигеназы 1 (HO-1), супероксиддисмутазы (SOD), где Nrf2 отводится ведущая роль в подавлении воспаления через ингибирование NF-κB-сигнального пути (Islam et al., 2021).
Кверцетин проявляет противовоспалительные, антиоксидантные свойства, а также блокирует перекисное окисление липидов, агрегацию тромбоцитов и сосудистую проницаемость. Его эффективность продемонстрирована на моделях ЛПС-индуцированной продукции ФНО-α в макрофагах, ЛПС-индуцированной продукции ИЛ-9 в легочных клетках линии А54, ЛПС-индуцированного повышения мРНК и ФНО-α в глиальных клетках, FcεRI-опосредованного высвобождения провоспалительных цитокинов, триптаз и гистамина из культуры тучных клеток (Jafarinia et al., 2020). Кверцетин обладает бронходилатирующим действием, предположительно за счет усиления нисходящих сигналов β-адренорецепторов гладкой мускулатуры бронхов и за счет ингибирования ФДЭ4. Воздействие увеличивалось при его ингаляционном введении в растворе ФБР-буфера с помощью небулайзера и предупреждало метахолин-индуцированное повышение резистентности дыхательных путей. Отмеченная способность вещества повышать изопреналин-индуцированную релаксацию бронхов может быть востребована при развитии тахифилаксии к агонистам β-адренорецепторов, которая осложняет терапию не только приступа бронхиальной астмы, но и поражения аэрополлютантами.
Антидепрессанты – модуляторы сигма-1-рецептора
Флувоксамин – селективный ингибитор обратного захвата серотонина (СИОЗС) – обладает высоким сродством к сигма-1-рецепторам в терапевтически релевантных дозах. Механизмы его противовоспалительного и иммуномодулирующего действия до конца не изучены, однако способность блокировать перенос SARS-CoV-2 через эндолизосомы и гиперкоагуляцию при COVID-19 указывает на потенциальную возможность влияния на мембранообразование лизосом (Marčec, Likić, 2021). Так в двойном слепом рандомизированном исследовании взрослых пациентов с COVID-19 лица, получавшие флувоксамин, имели более низкую вероятность клинического ухудшения в течение 15 дней. Позднее было высказано предположение, что положительный терапевтический эффект может быть также связан с ингибированием кислой сфингомиелазы и со способностью влиять на протонирование мембран и тем самым содействовать удержанию вирусной частицы в лизосоме (Sukhatme et al., 2021). Известно, что СИОЗС влияют на агрегацию тромбоцитов путем снижения в них содержания серотонина. Спустя 12 нед. терапии флувоксамином в дозе 100–150 мг/сут концентрация серотонина в тромбоцитах снижается на 86%, а в плазме крови – на 60% (Celada et al., 1992). Снижая концентрацию серотонина в тромбоцитах, СИОЗС способны ослаблять их потенциал к агрегации и предотвращать состояние гиперкоагуляции на фоне воспаления, вызванного повреждающими факторами. Дополнительное противовоспалительное действие флуоксамина сопряжено со способностью ингибировать распад мелатонина в печени, что ведет к повышению его концентрации в плазме крови. Блокируя дегрануляцию тучных клеток, он снижает опосредованные гистамином отек тканей и гиперкоагуляцию. С другой стороны, флувоксамин уменьшает проявления гиперцитокинемии на модели ЛПС-индуцированного сепсиса. Данный эффект может быть опосредован влиянием флувоксамина на резидентный белок эндоплазматического ретикулума – сигма-1-рецептор, который считается естественным фактором ингибирования продукции цитокинов (Rosen et al., 2019). Способность флувоксамина понижать уровни провоспалительных цитокинов объясняет сокращение избытка IL-6 у пациентов, перенесших COVID-19.
Таким образом, порядок применения терапевтических средств, направленных на снижение активности провоспалительных цитокинов, целесообразно корректировать, исходя из конкретных периодов потенциального роста их уровня после воздействия повреждающих факторов.
ЗАКЛЮЧЕНИЕ
Острое и хроническое воздействие повреждающих факторов химического и биологического происхождения на дыхательную систему и организм в целом встречается повсеместно и представляет значительную долю в структуре общей заболеваемости и смертности (рис. 4). Применение стандартизованных схем терапии не всегда приводит к полному выздоровлению пораженных лиц. Так, например, при COVID-19 у выздоровевших могут отмечаться отдаленные последствия, снижающие качество их жизни. В этой связи актуализируется необходимость изучения и разработки универсальных (неспецифических) средств терапии воспаления легких, предусматривающих блокаду патогенетических каскадов, и направленного лечебно-профилактического воздействия на ключевые этапы воспаления с целью ускорения разрешения воспаления и прерывания дезадаптивных рефлекторных реакций.
Рис. 4.
Хронология молекулярно-клеточных изменений при воспалении легких и своевременные терапевтические подходы. АГБ – аэрогематический барьер; повреждающие факторы сверху вниз: бактерии, сигаретный дым, промышленные аэрополлютанты, пульмонотоксиканты по типу параквата, вирусы.

Общие направления терапии неспецифического воспаления должны включать: непосредственно после воздействия поражающих факторов – рефлексогенную терапию, затем – противовоспалительную терапию в комбинации с препаратами мультимодального действия, затем – проразрешающую терапию в комбинации с препаратами, препятствующими фиброзированию.
Список литературы
Бакулина Л.С., Литвиненко И.В., Накатис Я.А. и др. Сепсис: пожар и бунт на тонущем в шторм корабле. Часть 1. Триггеры воспаления. Рецепция триггеров воспаления и сигнальная трансдукция. СПб.: СЗГМУ им. И.И. Мечникова, 2017. 272 с.
Башарин В.А., Чепур С.В., Толкач П.Г. и др. Токсикология продуктов горения полимерных материалов. СПб.: Левша. Санкт-Петербург, 2022. 104 с.
Кветкина А., Калужский Л., Лейченко Е. и др. Новые мишени пептида Кунитц-типа актинии Heteractis magnifica // ДАН. 2019. Т. 487. № 2. С. 221–224.
Чепур С.В., Плужников Н.Н. Сайганов С.А. и др. Гипотеза матричного синтеза апериодических полисахаридов // Успехи соврем. биол. 2019. Т. 139. № 6. С. 583–593.
Adhikari B., Marasini B. P., Rayamajhee B. et al. Potential roles of medicinal plants for the treatment of viral diseases focusing on COVID-19: a review // Phytother. Res. 2021. V. 35. № 3. P. 1298–1312.
Anfinogenova N.D., Quinn M.T., Schepetkin I.A., Atochin D.N. Alarmins and c-Jun N-terminal kinase (JNK) signaling in neuroinflammation // Cells. 2020. V. 9. № 11. P. 2350.
Belvisi M.G., Birrell M.A. The emerging role of transient receptor potential channels in chronic lung disease // Eur. Respir. J. 2017. V. 50. № 2. P. 1601357.
Broughton-Head V.J., Shur J., Carroll M.P. et al. Unfractionated heparin reduces the elasticity of sputum from patients with cystic fibrosis // Am. J. Physiol. Lung Cell. Mol. Physiol. 2007. V. 293. № 5. P. L1240–L1249.
Camprubí-Rimblas M., Tantinyà N., Bringué J. et al. Anticoagulant therapy in acute respiratory distress syndrome // Ann. Transl. Med. 2018. V. 6. № 2. P. 36.
Caravaca A.S., Gallina A.L., Tarnawski L. et al. An effective method for acute vagus nerve stimulation in experimental inflammation // Front. Neurosci. 2019. V. 13. P. 877.
Cargnello M., Roux P.P. Activation and function of the MAPKs and their substrates, the MAPK-activated protein kinases // Microbiol. Mol. Biol. Rev. 2011. V. 75. № 1. P. 50–83.
Celada P., Dolera M., Alvarez E., Artigas F. Effects of acute and chronic treatment with fluvoxamine on extracellular and platelet serotonin in the blood of major depressive patients. Relationship to clinical improvement // J. Affect. Disord. 1992. V. 25. № 4. P. 243–249.
Chiang N., Serhan C.N. Specialized pro-resolving mediator network: an update on production and actions // Essays Biochem. 2020. V. 64. № 3. P. 443–462.
Chimenti L., Camprubí-Rimblas M., Guillamat-Prats R. et al. Nebulized heparin attenuates pulmonary coagulopathy and inflammation through alveolar macrophages in a rat model of acute lung injury // Thromb. Haemost. 2017. V. 117. № 11. P. 2125–2134.
Choi G., Hofstra J.J., Roelofs J.J. et al. Antithrombin inhibits bronchoalveolar activation of coagulation and limits lung injury during Streptococcus pneumoniae pneumonia in rats // Crit. Care Med. 2008. V. 36. № 1. P. 204–210.
Clausen T.M., Sandoval D.R., Spliid C.B. et al. SARS-CoV-2 infection depends on cellular heparan sulfate and ACE2 // Cell. 2020. V. 183. № 4. P. 1043–1057.
Codagnone M., Cianci E., Lamolinara A. et al. Resolvin D1 enhances the resolution of lung inflammation caused by long-term Pseudomonas aeruginosa infection // Muc. Immunol. 2018. V. 11. № 1. P. 35–49.
De Virgiliis F., Di Giovanni S. Lung innervation in the eye of a cytokine storm: neuroimmune interactions and COVID-19 // Nat. Rev. Neurol. 2020. V. 16. № 11. P. 645–652.
Di Salvo E., Di Gioacchino M., Tonacci A. et al. Alarmins, COVID-19 and comorbidities // Ann. Med. 2021. V. 53. № 1. P. 777–785.
Emanuelli G., Nassehzadeh-Tabriz N., Morrell N.W., Marciniak S.J. The integrated stress response in pulmonary disease // Eur. Respir. Rev. 2020. V. 29. № 157. P. 200184.
Fischer A., Sellner M., Neranjan S. et al. Potential inhibitors for novel coronavirus protease identified by virtual screening of 606 million compounds // Int. J. Mol. Sci. 2020. V. 21. № 10. P. 3626.
Fusade-Boyer M., Dupré G., Bessière P. et al. Evaluation of the antiviral activity of Sephin1 treatment and its consequences on eIF2α phosphorylation in response to viral infections // Front. Immunol. 2019. V. 10. P. 134.
Grace M.S., Dubuis E., Birrell M.A., Belvisi M.G. Pre-clinical studies in cough research: role of transient receptor potential (TRP) channels // Pulm. Pharmacol. Ther. 2013. V. 26. № 5. P. 498–507.
Hsiao H.M., Sapinoro R.E., Thatcher T.H. et al. A novel anti-inflammatory and pro-resolving role for resolvin D1 in acute cigarette smoke-induced lung inflammation // PLoS One. 2013. V. 8. № 3. P. e58258.
Hsiao H.M., Thatcher T.H., Colas R.A. et al. Resolvin D1 reduces emphysema and chronic inflammation // Am. J. Pathol. 2015. V. 185. № 12. P. 3189–3201.
Hu X., Shen H., Wang Y. et al. Aspirin-triggered resolvin D1 alleviates paraquat-induced acute lung injury in mice // Life Sci. 2019. V. 218. P. 38–46.
Imai Y., Kuba K., Neely G.G. et al. Identification of oxidative stress and Toll-like receptor 4 signaling as a key pathway of acute lung injury // Cell. 2008. V. 133. № 2. P. 235–249.
Islam J., Shree A., Vafa A. et al. Taxifolin ameliorates benzo[a]pyrene-induced lung injury possibly via stimulating the Nrf2 signalling pathway // Int. Immunopharmacol. 2021. V. 96. P. 107566.
Jafarinia M., Hosseini M.S., Kasiri N. et al. Quercetin with the potential effect on allergic diseases // Allerg. Asthma Clin. Immunol. 2020. V. 16. P. 36.
Jia Y., Lee L.-Y. Role of TRPV receptors in respiratory diseases // Biochim. Biophys. Acta Mol. Bas. Dis. 2007. V. 1772. № 8. P. 915–927.
Kandadi M.R., Frankel A.E., Ren J. Toll-like receptor 4 knockout protects against anthrax lethal toxin-induced cardiac contractile dysfunction: role of autophagy // Br. J. Pharmacol. 2012. V. 167. № 3. P. 612–626.
Koarai A., Traves S.L., Fenwick P.S. et al. Expression of muscarinic receptors by human macrophages // Eur. Respir. J. 2012. V. 39. № 3. P. 698–704.
Krishnamoorthy N., Abdulnour R.E., Walker K.H. et al. Specialized proresolving mediators in innate and adaptive immune responses in airway diseases // Physiol. Rev. 2018. V. 98. № 3. P. 1335–1370.
Liu J.H., Cao L., Zhang C.H. et al. Dihydroquercetin attenuates lipopolysaccharide-induced acute lung injury through modulating FOXO3-mediated NF-κB signaling via miR-132-3p // Pulm. Pharmacol. Ther. 2020. V. 64. P. 101934.
Marčec R., Likić R. Could fluvoxamine keep COVID-19 patients out of hospitals and intensive care units? // Croat. Med. J. 2021. V. 62. № 1. P. 95–100.
Mousavi S., Moradi M., Khorshidahmad T., Motamedi M. Anti-inflammatory effects of heparin and its derivatives: a systematic review // Adv. Pharmacol. Sci. 2015. V. 2015. Art. 507151.
Nassenstein C., Krasteva-Christ G., Renz H. New aspects of neuroinflammation and neuroimmune crosstalk in the airways // J. Allerg. Clin. Immunol. 2018. V. 142. № 5. P. 1415–1422.
Noguchi M., Furukawa K.T., Morimoto M. Pulmonary neuroendocrine cells: physiology, tissue homeostasis and disease // Dis. Model. Mech. 2020. V. 13. № 12. P. dmm046920.
Nonomura K., Woo S.H., Chang R.B. et al. Piezo2 senses airway stretch and mediates lung inflation-induced apnoea // Nature. 2017. V. 541. № 7636. P. 176–181.
Pakos-Zebrucka K., Koryga I., Mnich K. et al. The integrated stress response // EMBO Rep. 2016. V. 17. № 10. P. 1374–1395.
Panigrahy D., Gilligan M.M., Huang S. et al. Inflammation resolution: a dual-pronged approach to averting cytokine storms in COVID-19? // Cancer Met. Rev. 2020. V. 39. № 2. P. 337–340.
Perrin-Cocon L., Aublin-Gex A., Sestito S.E. et al. TLR4 antagonist FP7 inhibits LPS-induced cytokine production and glycolytic reprogramming in dendritic cells, and protects mice from lethal influenza infection // Sci. Rep. 2017. V. 7. P. 40791.
Pierre P. Integrating stress responses and immunity // Science. 2019. V. 365. № 6448. P. 28–29.
Prescott S.L., Umans B.D., Williams E.K. et al. An airway protection program revealed by sweeping genetic control of vagal afferents // Cell. 2020. V. 181. № 3. P. 574–589.
Rosen D.A., Seki S.M., Fernández-Castañeda A. et al. Modulation of the sigma-1 receptor-IRE1 pathway is beneficial in preclinical models of inflammation and sepsis // Sci. Transl. Med. 2019. V. 11. № 478. P. eaau5266.
Rynko A.E., Fryer A.D., Jacoby D.B. Interleukin-1β mediates virus-induced M2 muscarinic receptor dysfunction and airway hyperreactivity // Am. J. Respir. Cell Mol. Biol. 2014. V. 51. № 4. P. 494–501.
Schloer S., Hübel N., Masemann D. et al. The annexin A1/FPR2 signaling axis expands alveolar macrophages, limits viral replication, and attenuates pathogenesis in the murine influenza A virus infection model // FASEB J. 2019. V. 33. № 11. P. 12188–12199.
Selfridge B.R., Wang X., Zhang Y. et al. Structure-activity relationships of (+)-naltrexone-inspired Toll-like receptor 4 (TLR4) antagonists // J. Med. Chem. 2015. V. 58. № 12. P. 5038–5052.
Shen X., Wang Q., Lin Y. et al. Voltage-dependent modulation of TRPA1 currents by diphenhydramine // Cell Calcium. 2020. V. 90. P. 102245.
Shi C., Tingting W., Li J.P. et al. Comprehensive landscape of heparin therapy for COVID-19 // Carbohydr. Polym. 2021. V. 254. P. 117232.
Sukhatme V.P., Reiersen A.M., Vayttaden S.J., Sukhatme V.V. Fluvoxamine: a review of its mechanism of action and its role in COVID-19 // Front. Pharmacol. 2021. V. 12. P. 652688.
Sun H.M., Hong L.Z., Shen X.K. et al. Antithrombin-III without concomitant heparin improves endotoxin-induced acute lung injury rats by inhibiting the activation of mitogen-activated protein kinase // Chin. Med. J. (Engl.). 2009. V. 122. № 20. P. 2466–2471.
van Haren F.M.P., Page C., Laffey J.G. et al. Nebulised heparin as a treatment for COVID-19: scientific rationale and a call for randomized evidence // Crit. Care. 2020. V. 24. № 1. P. 454.
van 't Wout E.F., Hiemstra P.S., Marciniak S.J. The integrated stress response in lung disease // Am. J. Respir. Cell Mol. Biol. 2014. V. 50. № 6. P. 1005–1009.
Wang L., Yuan R., Yao C. et al. Effects of resolvin D1 on inflammatory responses and oxidative stress of lipopolysaccharide-induced acute lung injury in mice // Chin. Med. J. (Engl.). 2014. V. 127. № 5. P. 803–809.
Wang X., Zhang Y., Peng Y. et al. Pharmacological characterization of the opioid inactive isomers (+)-naltrexone and (+)-naloxone as antagonists of toll-like receptor 4 // Br. J. Pharmacol. 2016. V. 173. № 5. P. 856–869.
Wang H., Anthony D., Yatmaz S. et al. Aspirin-triggered resolvin D1 reduces pneumococcal lung infection and inflammation in a viral and bacterial coinfection pneumonia model // Clin. Sci. (Lond.). 2017. V. 131. № 18. P. 2347–2362.
Watanabe S., Markov N.S., Lu Z. et al. Resetting proteostasis with ISRIB promotes epithelial differentiation to attenuate pulmonary fibrosis // PNAS USA. 2021. V. 118. № 20. P. e2101100118.
Watkins L.R., Wang X., Mustafa S., Hutchinson M.R. In vivo veritas: (+)-naltrexone’s actions define translational importance: a letter in response to Skolnick et al. “Translational potential of naloxone and naltrexone as TLR4 antagonists” // Trends Pharmacol. Sci. 2014. V. 35. № 9. P. 432–433.
Xia H., Wang J., Sun S. et al. Resolvin D1 alleviates ventilator-induced lung injury in mice by activating PPARγ/NF-κB signaling pathway // Biomed. Res. Int. 2019. V. 2019. P. 6254587.
Xu M., Zhang Y., Wang M. et al. TRPV1 and TRPA1 in lung inflammation and airway hyperresponsiveness induced by fine particulate matter (PM2.5) // Oxid. Med. Cell. Longev. 2019. V. 2019. Art. 7450151.
Yao H., De Boer W. I., Rahman I. Targeting lung inflammation: novel therapies for the treatment of COPD // Curr. Respir. Med. Rev. 2008. V. 4. № 1. P. 57–68.
Yeger H., Pan J., Cutz E. Precursors and stem cells of the pulmonary neuroendocrine cell system in the developing mammalian lung // Airway chemoreceptors in the vertebrates. Structure, evolution and function / Eds G. Zaccone, E. Cutz, D. Adriaensen, C.A. Nurse, A. Mauceri. Boca Raton: CRC Press, 2019. P. 291–310.
Yildiz-Pekoz A., Ozsoy Y. Inhaled heparin: therapeutic efficacy and recent formulations // J. Aerosol. Med. Pulm. Drug Deliv. 2017. V. 30. № 3. P. 143–156.
Zhuo Y., Zhang S., Li C. et al. Resolvin D1 promotes SIRT1 expression to counteract the activation of STAT3 and NF-κB in mice with septic-associated lung injury // Inflammation. 2018. V. 41. № 5. P. 1762–1771.
Zingoni A., Molfetta R., Fionda C. et al. NKG2D and its ligands: “One for all, all for one” // Front. Immunol. 2018. V. 9. P. 476.
Zyryanova A.F., Kashiwagi K., Rato C. et al. ISRIB blunts the integrated stress response by allosterically antagonising the inhibitory effect of phosphorylated eIF2 on eIF2B // Mol. Cell. 2021. V. 81. № 1. P. 88–103.
Дополнительные материалы отсутствуют.
Инструменты
Успехи современной биологии