Успехи современной биологии, 2022, T. 142, № 5, стр. 463-476
Внутрипородная дифференциация аборигенной Костромской породы крупного рогатого скота на основе SNP-маркеров мясной продуктивности
И. В. Лазебная 1, *, А. В. Перчун 2, О. Е. Лазебный 3
1 Институт общей генетики им. Н.И. Вавилова Российской академии наук
Москва, Россия
2 Федеральный центр охраны здоровья животных
Владимир, Россия
3 Институт биологии развития им. Н.К. Кольцова Российской академии наук
Москва, Россия
* E-mail: Lazebnaya@mail.ru
Поступила в редакцию 13.07.2022
После доработки 23.07.2022
Принята к публикации 24.07.2022
- EDN: HHGUHV
- DOI: 10.31857/S0042132422050088
Аннотация
Впервые проведено исследование внутрипородной изменчивости четырех однонуклеотидных полиморфизмов генов RORC, GHR, Lep и LepR, ассоциированных с мясной продуктивностью, в пяти выборках костромской породы молочно-мясного направления селекции, а также проведено сравнение с известными данными для двух родственных друг другу мясных пород, абердин-ангусской и русской комолой. Одни и те же аллели локусов исследованных генов являлись превалирующими по частоте, как во всех выборках костромской породы, так и у привлеченных для совместного анализа двух дополнительных пород. Распределение частот генотипов во всех выборках костромской породы не отклонялось от распределения по Харди–Вайнбергу. По комплексу изученных маркеров выявлена дифференциация выборок костромской породы друг от друга и от абердин-ангусской и русской комолой пород методом многомерного шкалирования на основе попарных значений FST и с помощью G-теста. Анализ выборок костромской породы с двумя другими породами методом байесовской кластеризации выявил четыре латентные генетические структуры. У костромской породы встречались все типы кластеров, у абердин-ангусской и русской комолой – лишь некоторые. Установлен различный вклад исследованных локусов во внутри- и межпородную дифференциацию. Так, на внутрипородном уровне проявили себя гены Lep и LepR, на межпородном – дополнительно ген RORC. При этом наибольшей изменчивостью характеризовался локус гена GHR. В целом, по локусам исследованных генов внутрипородная изменчивость костромской породы являлась сопоставимой с межпородной. Полученные результаты обсуждаются в связи с вовлеченностью данных локусов в популяционные процессы у исследованных пород крупного рогатого скота и являются обоснованием необходимости более детального исследования внутрипородной изменчивости по SNP-маркерам, ассоциированным с селекционно-ценными признаками у всего спектра пород, независимо от их продуктивной направленности.
ВВЕДЕНИЕ
Костромская порода крупного рогатого скота (КРС) является одной из лучших российских пород молочно-мясного направления селекции. Созданная на основе местного скота Костромской обл. мисковской и бабаевской групп с последующим прилитием крови швицкой и альгаузской пород, была зарегистрирована в качестве породы в 1944 г. (Дунин, Матрос, 2014). Костромскую породу разводят в Костромской, Владимирской, Ивановской областях и в Республике Марий-Эл. Порода характеризуется высокими показателями молочной и мясной продуктивности. Ее молоко сбалансировано по содержанию жира и белка, на 100 г жира приходится около 85–90 г белка. Кроме того, молоко пригодно для изготовления качественных сыров, на что указывают и данные по преобладанию B-аллеля (62%) гена каппа-казеина (Перчун и др., 2012), ассоциированного с более высоким содержанием белка в молоке и выходом сыра, а также с высокой скоростью формирования белковой мицеллы и ее качеством, лучшей температурной устойчивостью (Калашникова, Труфанов, 2006; Сибагатуллин и др., 2010; Сулимова и др., 2014; Bonfatti et al., 2011).
Стоит отметить и продуктивное долголетие коров этой породы. Известны случаи хозяйственного использования их до 20-летнего возраста. Порода отличается значительной резистентностью к ряду инфекционных заболеваний: бруцеллезу, туберкулезу и лейкозу и характеризуется быстрым ростом: среднесуточные приросты на откорме составляют до 1.5 кг при конечном убойном выходе – 55–65% (Дунин, Матрос, 2014). Как показало исследование аллелей гена главного комплекса гистосовместимости BOLA-DRB3, выявлена высокая суммарная частота аллелей устойчивости при низкой частоте аллелей восприимчивости к вирусу лейкоза КРС, 23.2 и 8.4% соответственно (Lazebnaya et al., 2020). У костромской породы установлено распределение частот аллелей генов GH и PRL (Лазебная и др., 2011), которые у отдельных пород ассоциированы с признаками молочной продуктивности (Лазебная и др., 2012). К концу прошлого столетия наметилась тенденция снижения породного разнообразия КРС (Алтухов и др., 2004) и численности сохранившегося аборигенного скота. В частности, поголовье костромской породы в 1974 г. составляло 865.6 тыс. коров (Сидоренко, Баранова, 2004), а к 2018 г. насчитывало только 9317 животных (Баранов и др., 2019). В то же время на фоне значительного сокращения поголовья костромской породы, с учетом ее уникальности особое значение приобрели исследования по анализу внутрипородной генетической изменчивости локусов генов, ассоциированных с молочной продуктивностью и иммунитетом (Лазебная и др., 2011; Перчун и др., 2012; Сулимова и др., 2014; Lazebnaya et al., 2020). Однако маркеры мясной продуктивности, такие как локусы генов орфанного рецептора С, связанного с рецептором ретиноевой кислоты (RORC, хромосома 3) и рецептора гормона роста (GHR, хромосома 20), а также локусы генов лептина (Lep, хромосома 4) и его рецептора (LepR, хромосома 3) до последнего времени практически не исследовали.
Ген орфанного рецептора С, связанного с рецептором ретиноевой кислоты (RORC), принадлежит к суперсемейству генов рецепторов стероидных и тиреоидных гормонов. Продукт гена RORC – белок RORγ является ДНК-связывающим транс-крипционным фактором, локализованным в ядерной мембране (Hirose et al., 1994). Рецептор RORγ является ключевым регулятором дифференцировки клеток иммунной системы, циркадного ритма, обмена липидов и стероидов (Jetten, 2009). Известно о повышенной экспрессии гена RORC в скелетных мышцах человека (Hirose et al., 1994). Информация об эндогенных лигандах этого рецептора до сих пор противоречива (Zhang et al., 2015). Известно, что однонуклеотидный полиморфизм RORC:g.3984A>G (экзон 8) связан с мраморностью мяса и отложением жира у пород ангус и шотгорн (Barendse et al., 2007). Установлена частота генотипов по данной однонуклеотидной замене у такой породы, как казахская белоголовая казахстанской и российской селекции, а также у пород скота калмыцкая и монгольская хогорого (Gorlov et al., 2014).
Ген рецептора гормона роста GHR кодирует трансмембранный белок, являющийся членом семейства цитокиновых рецепторов первого типа, который совместно с гормоном роста участвует в регуляции постнатального роста организма (Dehkhoda et al., 2018). Известно о повышенной экспрессии гена GHR в жировых тканях (Glad et al., 2019). Исследована изменчивость данного гена, ассоциированного с признаками роста и репродукции у абердин-ангусской породы КРС (Bos taurus L., 1758) по нуклеотидной замене g.257A>G (S555G) в экзоне 10 (Fedota et al., 2017). Показана положительная корреляция мутантного G-аллеля с ростом мышечной массы (Fedota et al., 2017).
Гены гормона лептина (Lep) и рецептора лептина (LepR) регулируют энергетический обмен (Cirillo et al., 2008). Ген Lep кодирует синтезирующийся преимущественно в жировой ткани соответствующий гормон, который влияет на поддержание энергетического равновесия посредством контроля потребления пищи и расхода энергии. Кроме того, лептин регулирует иммунный ответ и репродуктивную функцию (Zhang, et al., 1994; Houseknecht et al., 1998). Установлены ассоциации полиморфизма локуса g.1127A>T (rs29004487, Y7F) гена Lep с весом разделанной туши у японской черной породы КРС (Kawaguchi et al., 2016), а также локуса g.115C>T (T945M) гена LepR с увеличением веса у быков зебувидной породы нелоре (da Silva et al., 2012).
Учитывая установленную ранее высокую изменчивость костромской породы по локусам генов BOLA-DRB3, PRL, GH и CSN3, в то же время продолжающееся падение численности животных данной породы, исследование ее внутрипородных характеристик по генам мясной продуктивности представляется важным для планирования селекционных программ одной из лучших комбинированных российских пород с сохранением ее генетического разнообразия (Сулимова и др., 2011; Лазебная и др., 2011; Lazebnaya et al., 2020).
Целью нашей работы являлось исследование SNP-маркеров генов RORC, GHR, Lep и LepR в пяти выборках костромской породы из разных стад и анализ изменчивости в сравнении с известными данными по этим маркерам у родственных друг другу мясных пород абердин-ангусской и русской комолой.
МАТЕРИАЛЫ И МЕТОДЫ
Образцы крови
Исследовали образцы крови коров костромской породы из племенных стад: СПК “Гридино” (N = 100) и СПК “Колхоз “Родина” (N = 48) Красносельского р-на Костромской обл., племенного репродуктора ООО “Агрофирма “Планета” (N = 48) Буйского р-на Костромской обл., ОАО “Племзавода “Караваево” (N = 125) Костромского р-на Костромской обл., а также образцы спермы быков-производителей из ОАО “Костромское” (N = = 85) по племенной работе. Далее в качестве названий выборок используем: “Гридино”, “Родина”, “Планета”, “Караваево”, “Костромское”.
Анализ полиморфизма
Определяли полиморфизм генов: рецептора ретиноевой кислоты RORC (DQ667048.1: хромосома 3, экзон 8, g.3984A>G), рецептора гормона роста GHR (AC_000177.1: хромосома 20, экзон 10, rs109300983, g.257A>G, S555G), лептина Lep (U50365.1: хромосома 4, экзон 2, rs29004487, g.252A>T, Y7F) и его рецептора LepR (AJ580801.1: хромосома 3, экзон 20, g.115C>T, T945M) с помощью полимеразной цепной реакции с последующим рестрикционным анализом по ранее описанным методикам (Gorlov et al., 2017).
Статистический анализ
Анализ данных проводили в два этапа, сначала исследовали внутрипородную изменчивость в пяти выборках костромской породы, затем изучали межпородную изменчивость с проведением совместного анализа этих выборок с двумя породами – абердин-ангусской и русской комолой. Данные о частотах генотипов, аллелей перечисленных выше локусов, а также значения статистики хи-квадрат (χ2), и их вероятности (P) для выборок костромской породы рассчитывали в настоящей работе, а для абердин-ангусской и русской комолой пород получены из работы Горлова с соавт. (Gorlov et al., 2017). Эти две дополнительные породы использовались нами в качестве аутгруппы как породы мясного направления селекции в отличие от комбинированной костромской породы. Отметим, что абердин-ангусская порода является одной из лучших мясных пород, а недавно созданная порода русская комолая – ее гибрид с калмыцкой породой (Gorlov et al., 2017).
Рассчитывали следующие популяционно-генетические параметры: значения наблюдаемой (Ho) и ожидаемой (He) гетерозиготности по уточненной формуле (uHe); попарные внутри- и межпородные значения G-теста и индекса подразделенности Райта (FST), соответствующие им значения вероятности (P), а также проводили анализ молекулярной изменчивости (AMOVA), как отдельно по каждому маркеру, так и с учетом четырех маркеров в программе GenAlEx v.6.503. (Peakall et al., 2006, 2012). Для оценки значимости P использовали поправку на множественные сравнения Бенджамини–Хохберга (Benjamini, Hochberg, 1995).
Выявление латентных популяционно-генетических структур проводили с помощью кластерного анализа с применением алгоритма Монте-Карло по схеме марковских цепей для байесовской статистики STRUCTURE 2.3.4 (Pritchard et al., 2000) сначала у костромской породы, затем в группе с абердин-ангусской и русской комолой породами. Анализ проводили с использованием модели генетического смешения (admixture) и скоррелированности частот аллелей в разных популяциях, с учетом локализации образцов. Предварительный выбор стартовой точки марковской цепи (burn-in) проводили в течение 500 000 итераций, с последующим построением марковской цепи в течение 1 000 000 итераций для предполагаемого числа групп в выборке K, равного от 1 до 10 в десяти повторностях для каждой величины K. Для определения истинного количества кластеров использовали метод, предложенный Эванно в 2005 г. (Evanno et al., 2005).
РЕЗУЛЬТАТЫ
Распределение частот аллелей и генотипов исследованных генов
В табл. 1 представлена частота аллелей и генотипов по каждому из четырех локусов генов RORC, GHR, Lep и LepR в пяти выборках костромской породы, а также у абердин-ангусской и русской комолой пород, ожидаемая гетерозиготность He, значение хи-квадрат и соответствующая ему вероятность отклонения от распределения частот генотипов по Харди–Вайнбергу.
Таблица 1.
Частоты аллелей и генотипов SNP-локусов генов RORC, GHR, Lep и LepR, результаты теста Харди–Вайнберга в исследованных выборках и породах
| Выборки костромской породы | Порода | ||||||||
|---|---|---|---|---|---|---|---|---|---|
| Гридино | Планета | Родина | Караваево | Костромское | Костромская порода | Абердин-ангусская* | Русская комолая* | ||
| Локус гена RORC | |||||||||
| Аллель | A | 0.870 | 0.833 | 0.885 | 0.866 | 0.865 | 0.865 | 0.703 | 0.775 |
| G | 0.130 | 0.167 | 0.115 | 0.134 | 0.135 | 0.135 | 0.297 | 0.225 | |
| Генотип | AA | 0.750 | 0.688 | 0.771 | 0.740 | 0.729 | 0.738 | 0.475 | 0.616 |
| AG | 0.240 | 0.292 | 0.229 | 0.252 | 0.271 | 0.255 | 0.458 | 0.317 | |
| GG | 0.010 | 0.021 | 0.000 | 0.008 | 0.000 | 0.007 | 0.068 | 0.067 | |
| χ2 | 0.372 | 0.120 | 0.804 | 0.887 | 2.081 | 3.442 | 0.552 | 0.508 | |
| P | 0.542 | 0.729 | 0.370 | 0.346 | 0.149 | 0.064 | 0.457 | 0.476 | |
| He | 0.227 | 0.281 | 0.205 | 0.233 | 0.235 | 0.234 | 0.421 | 0.352 | |
| Локус гена GHR | |||||||||
| Аллель | A | 0.710 | 0.729 | 0.844 | 0.728 | 0.747 | 0.741 | 0.763 | 0.750 |
| G | 0.290 | 0.271 | 0.156 | 0.272 | 0.253 | 0.259 | 0.237 | 0.250 | |
| Генотип | AA | 0.510 | 0.542 | 0.688 | 0.552 | 0.554 | 0.557 | 0.610 | 0.566 |
| AG | 0.400 | 0.375 | 0.313 | 0.352 | 0.386 | 0.369 | 0.305 | 0.367 | |
| GG | 0.090 | 0.083 | 0.000 | 0.096 | 0.060 | 0.074 | 0.085 | 0.067 | |
| χ2 | 0.082 | 0.123 | 1.646 | 1.545 | 0.033 | 0.594 | 1.457 | 0.030 | |
| P | 0.774 | 0.726 | 0.199 | 0.214 | 0.856 | 0.441 | 0.227 | 0.863 | |
| He | 0.414 | 0.399 | 0.266 | 0.398 | 0.380 | 0.384 | 0.365 | 0.378 | |
| Локус гена Lep | |||||||||
| Аллель | A | 0.960 | 0.969 | 0.938 | 0.968 | 0.925 | 0.954 | 0.890 | 0.933 |
| T | 0.040 | 0.031 | 0.063 | 0.032 | 0.075 | 0.046 | 0.110 | 0.067 | |
| Генотип | AA | 0.920 | 0.938 | 0.875 | 0.936 | 0.863 | 0.910 | 0.797 | 0.867 |
| AT | 0.080 | 0.063 | 0.125 | 0.064 | 0.125 | 0.087 | 0.186 | 0.133 | |
| TT | 0.000 | 0.000 | 0.000 | 0.000 | 0.013 | 0.002 | 0.017 | 0.000 | |
| χ2 | 0.174 | 0.050 | 0.213 | 0.137 | 0.786 | 0.028 | 0.142 | 0.306 | |
| P | 0.677 | 0.823 | 0.644 | 0.712 | 0.375 | 0.868 | 0.706 | 0.580 | |
| He | 0.077 | 0.061 | 0.118 | 0.062 | 0.140 | 0.088 | 0.198 | 0.125 | |
| Локус гена LepR | |||||||||
| Аллель | C | 0.785 | 0.781 | 0.885 | 0.740 | 0.889 | 0.803 | 0.992 | 0.875 |
| T | 0.215 | 0.219 | 0.115 | 0.260 | 0.111 | 0.197 | 0.008 | 0.125 | |
| Генотип | CC | 0.610 | 0.667 | 0.771 | 0.528 | 0.802 | 0.649 | 0.983 | 0.750 |
| CT | 0.350 | 0.229 | 0.229 | 0.424 | 0.173 | 0.308 | 0.017 | 0.250 | |
| TT | 0.040 | 0.104 | 0.000 | 0.048 | 0.025 | 0.042 | 0.000 | 0.000 | |
| χ2 | 0.136 | 5.212 | 0.804 | 1.297 | 1.266 | 0.217 | 0.004 | 1.224 | |
| P | 0.712 | 0.022 | 0.370 | 0.255 | 0.261 | 0.641 | 0.948 | 0.268 | |
| He | 0.339 | 0.345 | 0.205 | 0.386 | 0.199 | 0.316 | 0.017 | 0.221 | |
У всех исследованных выборок костромской породы преобладающими по частоте являлись A-аллели локусов RORC, GHR и Lep и C-аллель локуса LepR. Различались использованные локусы по уровню и диапазону частот превалирующего аллеля. Так, наименьший диапазон частоты наиболее представленного аллеля наблюдался по локусу гена Lep – 0.044 (от 0.925 в выборке “Костромское” – до 0.969 в выборке “Планета”). Близкий по величине диапазон выявлен и по гену RORC – 0.052 (от 0.833 в выборке “Планета” до 0.885 в выборке “Родина”). По использованным маркерам генов LepR и GHR установлено наибольшее варьирование частот преобладающих аллелей, с величиной диапазона 0.149 (от 0.740 в выборке “Караваево” до 0.889 в выборке “Костромское”) и 0.134 (от 0.710 в выборке “Гридино” до 0.844 в выборке “Родина”) соответственно. Приведенные в табл. 1 значения хи-квадрат и соответствующие им значения вероятности соответствия распределения частот генотипов равновесному по Харди–Вайнбергу свидетельствуют о том, что во всех выборках по всем SNP-маркерам значимых отклонений не обнаружено, в том числе и для выборки “Планета” по гену LepR после введения поправки на множественные сравнения Бенджамини–Хохберга (Benjamini, Hochberg, 1995).
У абердин-ангусской и русской комолой пород преобладали частоты тех же аллелей, что и в выборках костромской породы (табл. 1). При этом по гену GHR частота превалирующего A-аллеля практически одинакова во всех исследованных выборках и породах, тогда как по генам RORC и Lep частота преобладающего A-аллеля в обоих случаях несколько ниже у мясных пород, особенно у абердин-ангусской. По гену LepR наблюдалась обратная картина: у мясных пород, особенно у абердин-ангусской, частота превалирующего C-аллеля выше, чем в выборках костромской породы. Более точное сравнение распределений частот аллелей с помощью G-теста представлено ниже.
Сравнение выборок и пород по распределению частот аллелей с помощью G-теста
Проведенный анализ на достоверность различий по распределению частот аллелей (табл. 2) между выборками костромской породы отдельно по каждому локусу с использованием G-теста, показал достоверные различия только по гену LepR между выборкой “Костромское” и выборками “Гридино” (P = 0.008) и “Караваево” (P = 0.0001), а также между “Караваево” и “Родина” (P = 0.002), с учетом поправки (q = 0.015) на множественные сравнения Бенджамини–Хохберга (Benjamini, Hochberg, 1995).
Таблица 2.
Попарные значения G-теста и их вероятность у исследованных выборок костромской породы, абердин-ангусской и русской комолой пород
| Локус гена RORC | ||||||||
| выборки костромской породы | порода | |||||||
| Гридино | Планета | Родина | Караваево | Костромское | Абердин-ангусская | Русская комолая | ||
| Выборки костромской породы | Гридино | 0 | 0.403 | 0.706 | 1.000 | 1.000 | 0.000 | 0.029 |
| Планета | 0.700 | 0 | 0.298 | 0.446 | 0.490 | 0.025 | 0.283 | |
| Родина | 0.143 | 1.083 | 0 | 0.624 | 0.625 | 0.001 | 0.031 | |
| Караваево | 0.000 | 0.580 | 0.241 | 0 | 1.000 | 0.000 | 0.031 | |
| Костромское | 0.000 | 0.476 | 0.239 | 0.000 | 0 | 0.001 | 0.048 | |
| Порода | Абердин-ангусская | 12.879 | 5.042 | 10.921 | 13.159 | 11.1061 | 0 | 0.208 |
| Русская комолая | 4.770 | 1.151 | 4.639 | 4.670 | 3.91108 | 1.587 | 0 | |
| Локус гена GHR | ||||||||
| выборки костромской породы | порода | |||||||
| Гридино | Планета | Родина | Караваево | Костромское | Абердин-ангусская | Русская комолая | ||
| Выборки костромской породы | Гридино | 0 | 0.731 | 0.010 | 0.673 | 0.428 | 0.304 | 0.436 |
| Планета | 0.118 | 0 | 0.052 | 1.000 | 0.752 | 0.575 | 0.729 | |
| Родина | 6.614 | 3.790 | 0 | 0.020 | 0.062 | 0.138 | 0.089 | |
| Караваево | 0.178 | 0.000 | 5.424 | 0 | 0.667 | 0.477 | 0.652 | |
| Костромское | 0.627 | 0.100 | 3.472 | 0.186 | 0 | 0.762 | 1.000 | |
| Порода | Абердин-ангусская | 1.058 | 0.315 | 2.201 | 0.507 | 0.092 | 0 | 0.819 |
| Русская комолая | 0.607 | 0.120 | 2.899 | 0.203 | 0.000 | 0.052 | 0 | |
| Локус гена Lep | ||||||||
| выборки костромской породы | порода | |||||||
| Гридино | Планета | Родина | Караваево | Костромское | Абердин-ангусская | Русская комолая | ||
| Выборки костромской породы | Гридино | 0 | 0.705 | 0.403 | 0.650 | 0.151 | 0.017 | 0.297 |
| Планета | 0.143 | 0 | 0.301 | 1.000 | 0.132 | 0.023 | 0.229 | |
| Родина | 0.698 | 1.069 | 0 | 0.216 | 0.703 | 0.216 | 1.000 | |
| Караваево | 0.206 | 0.000 | 1.531 | 0 | 0.052 | 0.004 | 0.137 | |
| Костромское | 2.062 | 2.275 | 0.146 | 3.769 | 0 | 0.314 | 0.788 | |
| Порода | Абердин-ангусская | 5.679 | 5.200 | 1.530 | 8.373 | 1.014 | 0 | 0.235 |
| Русская комолая | 1.089 | 1.450 | 0.000 | 2.210 | 0.072 | 1.411 | 0 | |
| Локус гена LepR | ||||||||
| выборки костромской породы | порода | |||||||
| Гридино | Планета | Родина | Караваево | Костромское | Абердин-ангусская | Русская комолая | ||
| Выборки костромской породы | Гридино | 0 | 1.000 | 0.030 | 0.265 | 0.008 | 0.000 | 0.039 |
| Планета | 0.000 | 0 | 0.051 | 0.423 | 0.022 | 0.000 | 0.067 | |
| Родина | 4.684 | 3.803 | 0 | 0.002 | 1.000 | 0.000 | 0.815 | |
| Караваево | 1.241 | 0.643 | 9.437 | 0 | 0.000 | 0.000 | 0.002 | |
| Костромское | 7.119 | 5.273 | 0.000 | 14.440 | 0 | 0.000 | 0.720 | |
| Порода | Абердин-ангусская | 35.926 | 29.359 | 12.577 | 48.155 | 14.359 | 0 | 0.000 |
| Русская комолая | 4.274 | 3.356 | 0.055 | 9.384 | 0.128 | 15.332 | 0 | |
По распределениям частот аллелей гена GHR абердин-ангусская и русская комолая породы не отличались от выборок костромской породы. По гену RORC абердин-ангусская порода дифференцировалась от всех выборок костромской породы, тогда как русская комолая порода – нет, так же, как и по гену Lep. По этому гену абердин-ангусская порода отличалась от выборок костромской породы “Гридино”, “Планета” и “Караваево”, в то время как от выборок “Родина” и “Костромское” – нет. По гену LepR абердин-ангусская порода дифференцировалась от всех выборок костромской породы, тогда как русская комолая порода – только от выборки “Караваево”. Необходимо отметить, что G-тест показал значимую дифференциацию абердин-ангусской породы от русской комолой только по гену LepR. Таким образом, если по гену GHR не обнаружено никаких отличий между исследованными выборками и породами, то по гену RORC наблюдалась дифференциация выборок костромской породы от абердин-ангусской, но не от русской комолой породы. Отсутствовало различие между костромской и русской комолой породами и по гену Lep, тогда как абердин-ангусская порода дифференцировалась от отдельных выборок костромской породы. По гену LepR русская комолая порода отличалась только от выборки “Караваево”, в то время как абердин-ангусская порода дифференцировалась от всех выборок костромской породы по этому локусу. Полученные результаты свидетельствуют о значительном различии выборок костромской породы по двум исследованным маркерам генов Lep и LepR. Необходимо отметить, что наибольшей изменчивостью у костромской породы характеризовался ген GHR, но именно по этому гену между исследованными выборками и породами отсутствовали какие-либо отличия, так же, как и между породами, при сравнении их друг с другом после формирования объединенной выборки костромской породы. Исследованная порода без деления ее на выборки отличалась от обеих мясных пород более высокой частотой превалирующего аллеля гена RORC и дифференцировалась от абердин-ангусской породы, характеризуясь более высокой частотой A‑аллеля гена Lep и более низкой частотой C-аллеля гена LepR, но отличий между костромской и русской комолой породами не обнаружено.
Ожидаемая гетерозиготность в выборках и породах
В целом исследованные выборки костромской породы характеризовались невысоким уровнем гетерозиготности (He) всех использованных локусов (табл. 1). Выявлены две группы по ширине диапазона варьирования значений He с узким и широким интервалами. К первой группе относились локусы генов Lep и RORC, интервал значений He для которых составляет соответственно 0.079 (от 0.061 в выборке “Планета” до 0.140 в “Костромское”) и 0.076 (от 0.205 в выборке “Родина” до 0.281 в выборке “Планета”). Вторую группу сформировали гены GHR и LepR, диапазоны варьирования значений He для которых составили соответственно 0.148 (от 0.266 в выборке “Родина” до 0.414 в “Гридино”) и 0.187 (от 0.199 в выборке “Костромское” до 0.386 в “Караваево”). Как видно, у второй группы маркеров не только интервал шире, но и выше уровень изменчивости, выраженный через ожидаемую гетерозиготность. Отметим, что у русской комолой породы значения He по большинству маркеров находились в указанных для костромской породы интервалах, кроме гена RORC, у которого значение He выше и составило 0.352. У абердин-ангусской породы только по гену GHR значение He не вышло за пределы выявленного у костромской породы диапазона значений данного параметра. В то время как по генам RORC и Lep значения He у абердин-ангусской породы выше, а по гену LepR – значительно ниже указанных диапазонов для этих генов у костромской породы, соответственно, 0.421, 0.198 и 0.017.
Дифференциация выборок и пород на основе значений FST по всем исследованным локусам
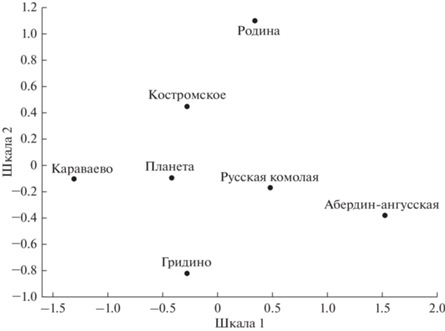
Дифференциация выборок костромской породы была оценена по комплексу исследованных локусов с использованием коэффициента подразделенности Райта (FST), значения которого приведены в табл. 3, а ординация выборок в пространстве двух первых шкал, выполненная на основе этих данных после коррекции значений P с учетом поправки на множественные сравнения Бенджамини–Хохберга (q = 0.021) (Benjamini, Hochberg, 1995), на рис. 1.
Таблица 3.
Попарные значения FST и их вероятность у абердин-ангусской, русской комолой пород и исследованных выборок костромской породы
| Выборки костромской породы | Порода | |||||||
|---|---|---|---|---|---|---|---|---|
| Гридино | Планета | Родина | Караваево | Костромское | Абердин-ангусская | Русская комолая | ||
| Выборки костромской породы | Гридино | 0 | 0.915 | 0.002 | 0.704 | 0.057 | 0.001 | 0.039 |
| Планета | 0.001 | 0 | 0.043 | 0.821 | 0.17 | 0.001 | 0.272 | |
| Родина | 0.015 | 0.015 | 0 | 0.001 | 0.206 | 0.001 | 0.051 | |
| Караваево | 0.001 | 0.001 | 0.019 | 0 | 0.004 | 0.001 | 0.005 | |
| Костромское | 0.007 | 0.007 | 0.006 | 0.012 | 0 | 0.001 | 0.345 | |
| Порода | Абердин-ангусская | 0.037 | 0.032 | 0.029 | 0.045 | 0.019 | 0 | 0.065 |
| Русская комолая | 0.009 | 0.006 | 0.011 | 0.013 | 0.004 | 0.010 | 0 | |
Рис. 1.
Ординация выборок костромской породы в проекции двух первых шкал, выполненная методом многомерного шкалирования на основе достоверных попарных значений FST, рассчитанных по четырем маркерам.

Все выборки костромской породы дифференцированы друг от друга (рис. 1). Крайнее положение по первой шкале занимают выборки “Родина” и “Караваево”. Наиболее близко к последней расположена выборка “Гридино”. Далее следуют выборки “Костромское” и “Планета”, последняя находится примерно на одинаковом расстоянии от наиболее дистанцированных друг от друга выборок “Родина” и “Караваево”. По второй шкале крайнее положение занимают выборки из “Караваево” и “Костромское”, между которыми расположены “Планета” и “Гридино” несколько смещенные от центра в направлении выборок из “Караваево” и “Костромское” соответственно. К выборке “Планета” вплотную примыкает выборка “Родина” со стороны “Караваево”. Кроме того, был выполнен совместный анализ выборок костромской породы с абердин-ангусской и русской комолой породами. Его результаты в виде ординации выборок представлены на рис. 2. Некоторые межвыборочные расстояния по первой шкале у костромской породы сопоставимы с расстоянием между абердин-ангусской и русской комолой породами, или даже больше, как, например, между такими выборками костромской породы, как “Караваево” и “Родина”. Абердин-ангусская порода являлась наиболее удаленной от выборок костромской породы, в то время как русская комолая порода тяготеет на рисунке к выборкам костромской породы, особенно к выборке “Родина”. Вторая шкала дифференцирует, главным образом, выборки костромской породы.
Результаты анализа молекулярной изменчивости
Анализ молекулярной изменчивости (AMOVA), проведенный с учетом всех маркеров, выявил уровень внутрипородной дифференциации (FST) у костромской породы, равный 0.7% (d.f. = 4, P = = 0.003), вклад в которую вносят маркеры генов Lep и LepR, FST для которых равен по 1.5% для каждого из генов (d.f. = 4, P = 0.006 и d.f. = 4, P = = 0.003 соответственно). В то время, как в межпородную дифференциацию с учетом внутрипородного деления костромской породы на выборки и включения в анализ дополнительно абердин-ангусской и комолой пород, при сохранении эффекта локуса гена Lep (FST = 0.012, d.f. = 6, P = = 0.001), установлен более весомый вклад гена LepR, уровень дифференциации по которому увеличился до 3.4% (d.f. = 6, P = 0.001). Кроме того, обнаружен и вклад гена RORC, 2% (d.f. = 6, P = = 0.001). При этом уровень межпородной дифференциации по всем использованным маркерам составил 1.5% (d.f. = 6, P = 0.001).
Байесовский кластерный анализ
Поиск латентных генетических структур (кластеров) у костромской породы был выполнен с применением байесовского анализа с учетом всех маркеров в программе STRUCTURE с использованием модели генетического смешения (admixture) и скоррелированности частот аллелей в разных популяциях. Он выявил только одну структуру (результат не приводится). Несмотря на то, что дифференциация выборок костромской породы по методу многомерного шкалирования на основе попарных значений FST и результатам AMOVA была обнаружена, байесовский анализ ее не выявил.
Совместный анализ изменчивости выборок костромской породы с абердин-ангусской и русской комолой породами по тому же спектру маркеров и с использованием названной выше модели кластерного анализа позволил выявить несколько латентных структур у костромской породы. Результат отражает диаграмма на рис. 3. Методом Эванно (Evanno et al., 2005) установлено наиболее вероятное число кластеров, равное четырем, которые неравномерно распределены в исследованных выборках и породах. В выборках “Гридино” и “Костромское” доминирует кластер, обозначенный на рис. 3 желтым цветом 78 и 65% соответственно, в выборках “Планета” и “Родина” он составляет по 44%. Чуть меньше, 34%, – в выборке “Караваево”. В этой же выборке доминирует кластер синего цвета, 60%. В значительно меньшей пропорции он представлен в выборках “Планета” (15%) и “Родина” (28%). Кластер зеленого цвета четко выражен только в выборке “Планета” (26%), что отличает ее от остальных выборок. Примерно с такой же частотой выявлен кластер, обозначенный красным цветом в выборках “Родина” (28%) и “Костромское” (27%), в выборках “Гридино” и “Планета” его частота ниже (19% и 15% соответственно).
Рис. 3.
Результаты байесовского кластерного анализа исследованных пород по четырем маркерам при K = 4. Обозначения: цифрами на оси абсцисс обозначены следующие породы и выборки: 1 – абердин-ангусская порода, 2 – русская комолая порода; выборки костромской породы: 3 – “Гридино”, 4 – “Планета”, 5 – “Родина”, 6 – “Караваево”, 7 – “Костромское”.

Таким образом, среди выборок костромской породы по соотношению выявленных байесовским анализом кластеров наиболее сходны выборки “Гридино” и “Костромское”. Этот результат подтвержден топологией данных выборок в проекции двух первых шкал на рис. 1 по первой шкале. Все остальные выборки костромской породы отличаются как от двух названных, так и друг от друга, по соотношению кластеров разного типа.
Что касается привлеченных для совместного анализа с костромской породой двух мясных пород, высоким сходством с костромской породой обладает русская комолая. Их объединяет степень выраженности наиболее представленных кластеров, обозначенных желтым и красным цветом, доля которых только у русской комолой породы совпадает (по 43%), в противоположность абердин-ангусской породе, которая отличается значительным доминированием кластера, обозначенного красным цветом (94%). Эта порода наиболее однородна среди представленных пород, как по высокой выраженности главным образом только одного кластера, так и его равной доли у большинства исследованных животных. Высокой консолидацией особей характеризуется и выборка костромского скота из племзавода “Караваево”, однако в отличие от абердин-ангусской породы, в этой выборке костромского скота представлены преимущественно два кластера, обозначенные желтым и синим цветом.
Дерево генетических расстояний между выявленными кластерами, представленное на рис. 4, отражает характер взаимоотношений между ними. Очевидно, что первый кластер красного цвета наиболее удален от совокупности других кластеров, то есть он наиболее отличен от них, и величина его доли в той или иной выборке или породе вносит основной вклад в дифференциацию этих выборок и пород. Данный кластер максимально представлен у абердин-ангусской породы, генетически удаленной от русской комолой и еще в большей степени от выборок костромского скота. Из остальных кластеров наиболее близки кластеры синего и желтого цветов, менее сходен с ними кластер зеленого цвета. Последний в значительной доле представлен только в выборке костромского скота “Планета”. Кластер желтого цвета выявлен во всех выборках костромской породы и у русской комолой, синего цвета – в выборках “Караваево”, “Родина” и “Планета”.
Рис. 4.
Дерево кластеров, выявленных в результате байесовского кластерного анализа абердин-ангусской, русской комолой пород и выборок костромской породы, исследованных по четырем маркерам. Обозначения: цифрам соответствуют кластеры, имеющие следующие цветовые обозначение на рис. 3: 1 – кластер красного цвета, 2 – кластер зеленого цвета, 3 – кластер синего цвета, 4 – кластер желтого цвета.
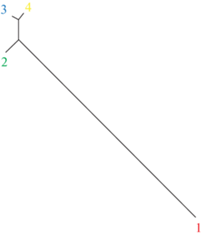
Соотнесение результатов, полученных разными методами (метод многомерного шкалирования на основе попарных значений FST и кластерный анализ на основе апостериорной вероятности Байеса) с использованием всего массива данных, свидетельствует о сходном характере дифференциации исследованных пород и выборок. Оба метода показали наибольшую дифференциацию абердин-ангусской породы и выборки “Караваево” костромской породы. Они характеризуются диаметрально противоположным содержанием наиболее обособленного кластера красного цвета, как свидетельствует рис. 4. Именно доля этого кластера в наибольшей степени соответствует уровню дифференциации исследованных выборок и пород по первой шкале (рис. 2). В соответствии с увеличением доли данного кластера (рис. 3) на ординации следом за выборкой “Караваево” костромской породы располагаются выборки “Планета”, “Гридино”, “Костромское”, “Родина”, русская комолая и абердин-ангусская породы (рис. 2). Наименьший вклад в дифференциацию, вероятно, вносят наиболее сходные кластеры 3 и 4 (рис. 4), синего и желтого цвета соответственно.
ОБСУЖДЕНИЕ
Исследование внутрипородной изменчивости у костромской породы с использованием локусов генов RORC, GHR, Lep, LepR показало наличие сходных распределений частот аллелей, а именно преобладание с той или иной степенью выраженности одних и тех же аллелей: A-аллелей генов RORC, GHR, Lep и C-аллеля гена LepR. Вместе с тем, два вида проведенного анализа, молекулярной изменчивости и многомерного шкалирования, дифференцировали выборки данной породы. AMOVA только для выборок костромской породы, проведенный с учетом всех маркеров, установил уровень внутрипородной дифференциации у этой породы равный 0.7%, при этом выявлен вклад только маркеров генов Lep и LepR (по 1.5%). Совместный анализ выборок костромской породы с мясными абердин-ангусской и русской комолой породами выявил дифференцирующий эффект наряду с генами Lep и LepR, также вклад гена RORC, 2%. При этом дифференцирующий уровень LepR вырос до 3.4%, а общий эффект всех исследованных локусов составил 1.5%.
Дифференцировать выборки костромской породы методом байесовского кластерного анализа удалось только в результате совместного исследования их с абердин-ангусской и русской комолой породами. При выявленном наиболее вероятном числе кластеров, равном четырем, наибольшей изменчивостью обладает костромская порода, в разных выборках которой наблюдается от двух до четырех основных кластеров, в то время как у одной из лучших мясных пород абердин-ангусской, представлен практически только один кластер (94%), а у русской комолой породы – два.
Таким образом, у костромской породы выявлен уровень внутрипородной изменчивости сопоставимый с межпородным, что характерно далеко не для всех пород. Так, исследованные ранее две выборки ярославской породы крупного рогатого скота не отличались друг от друга даже по столь полиморфному гену главного комплекса гистосовместимости, как ген BOLA-DRB3 (Lazebnaya et al., 2020).
Стоит отметить, что локус GHR, характеризующийся максимальной изменчивостью не обладал дифференцирующим эффектом для выборок костромской породы даже при включении в совместный анализ двух дополнительных пород, поскольку популяционная структура изменчивости этого маркера практически одинакова во всех исследованных нами выборках и породах. Это может объясняться несколькими причинами: либо эффектом основателя, так как при создании породы использовали определенное число быков-основателей и коров со специфическим соотношением частоты аллелей исследованного локуса, который они и передали по наследству, либо эффектом отбора, который мог быть, как искусственным, в случае ассоциации полиморфизма этого локуса с признаками мясной или молочной продуктивности, так и естественным, направленным против генотипов с пониженной приспособленностью, либо сочетанием этих типов отбора. Известно, что исследованная нами замена аденинового остатка на гуаниновый в положении 257 (rs109300983) в десятом экзоне гена GHR приводит к замене аминокислоты серин (AGC) на аминокислоту глицин (GGC) в цитоплазматическом домене рецептора гормона роста (Chakraborty et al., 2016). Несмотря на то, что обе аминокислоты являются нейтральными, но молекула глицина более компактна, поэтому, нельзя исключить влияние данной замены на конформацию рецептора. Наблюдаемое у двух мясных пород такое же соотношение частот аллелей исследованного локуса, как и в выборках костромской породы, вероятно, исключает эффект основателя, так как у этих пород не могли быть одни и те же основатели. Дополнительно к этому отличить эффект основателя от эффекта отбора можно было бы генотипированием всех используемых быков-производителей и исследованием всех рожденных животных, а не только соответствующих породным требованиям, то есть прошедших бонитировку. С другой стороны, межпородные исследования КРС демонстрируют и другие соотношения частот аллелей по данному локусу. Так, у мясных пород шароле и лимузин (Trakovicka et al., 2015) частота A-аллеля составляла 54 и 56% соответственно, в противоположность исследованной нами костромской породе, а также породам, данные о которых представлены другими авторами, абердин-ангусской, русской комолой (Gorlov et al., 2017) и симментальской (Ardicli et al., 2017), у которых частота этого аллеля составляла 74, 76, 75 и 72% соответственно. В то же время, в двух стадах голштино-фризской породы польской селекции (Olenski et al., 2010), у айрширской породы финской селекции (Viitala et al., 2006), у абердин-ангуcской породы, исследованной Федота с соавт. (Fedota et al., 2017), частота данного аллеля выше по сравнению с породами, рассматриваемыми в настоящем исследовании, и равна соответственно 83, 89, 87, 86%. Это свидетельствует о широте диапазона внутривидового разнообразия по данному локусу. Является ли установленное нами отсутствие различий частот A-аллеля гена GHR между выборками костромской породы случайным, позволил бы выяснить мониторинг внутрипородной изменчивости этого локуса у данной породы.
Высокий уровень внутрипородной дифференциации у костромской породы по локусам генов Lep и LepR можно было бы объяснить комбинированным использованием данной породы, ее селекцией по двум направлениям, молочному и мясному. Вероятно, сказывается и использование быков-производителей разной линейной принадлежности, и специфика работы с породой в племенных заводах, непосредственно осуществляющих селекционную работу, и в племрепродукторах, в которые животные поступают из разных племенных заводов. Так, наибольшая консолидация животных в выборке “Караваево” костромской породы, возможно, отражает результат длительной селекции на высокие показатели молочной продуктивности (удои, высокое содержание молочного жира и белка, пригодность молока к сыроварению), которые, как отмечает ряд авторов, у некоторых пород также ассоциированы с исследованными нами маркерами (Banos et al., 2008; Trakovická et al., 2013; Hill et al., 2016). Именно данный племзавод является историческим центром создания породы, ее совершенствования и поддержания. В репродуктор “Планета” поступали животные не только из исследованных нами племенных заводов, что, возможно, отражено в наличии у этой выборки высокой доли кластера зеленого цвета (0.256), практически отсутствующего в других выборках.
ЗАКЛЮЧЕНИЕ
Таким образом, исследование генетической структуры пяти выборок молочно-мясной костромской породы крупного рогатого скота и двух пород мясного направления селекции по четырем локусам генов, ассоциированным с мясной продуктивностью, наглядно продемонстрировало сопоставимость уровней внутри- и межпородной изменчивости, что подтверждает представление об аборигенных породах как о породах, отличающихся большей генетической изменчивостью по сравнению с глобально распространенными унифицированными породами КРС. Соответственно, сохранение отечественных пород важно для поддержания внутривидового разнообразия, особенно в непредсказуемо меняющихся климатических условиях, способствующих изменению эпидемиологической ситуации.
При этом различные гены вносят не одинаковый вклад во внутри- и межпородную дифференциацию. Так, впервые проведенное нами исследование внутрипородной изменчивости костромского скота по отдельным и совместно использованным локусам генов RORC, GHR, Lep, LepR, ассоциированным с продуктивными признаками, показало на данном генетическом материале дифференцирующую способность локусов Lep, LepR, а также локуса гена RORC при анализе с группой сравнения. Полученные результаты убедительно доказывают необходимость продолжения комплексных исследований в этом направлении, что особенно важно для аборигенных пород, о генетическом разнообразии которых информации недостаточно. Дальнейший мониторинг изменчивости по маркерам селекционно-ценных признаков может стать основой для проведения исследований данных локусов с целью поиска ассоциаций с продуктивными признаками у костромской породы.
Список литературы
Алтухов Ю.П., Салменкова Е.А., Курбатова О.Л. и др. Динамика популяционных генофондов при антропогенных воздействиях. М.: Наука, 2004, 620 с.
Баранов А.В., Парамонова Н.Ю., Баранова Н.С. и др. Костромская порода крупного рогатого скота в новом столетии: состояние и перспективы // Аграр. наука Евро-Северо-Востока. 2019. Т. 20. № 6. С. 533–547.
Дунин И.М., Матрос В.П. Разведение костромской породы крупного рогатого скота в Российской Федерации / Ред. Н.С. Баранов, Н.Ю. Парамонов, Т.В. Репин. 70 лет костромской породе скота: сборник статей. Караваево: Костромская ГСХА, 2014. С. 21–24.
Калашникова Л.А., Труфанов В.Г. Влияние генотипа каппа-казеина на молочную продуктивность и технологические свойства молока коров холмогорской породы // Докл. РАСХН. 2006. № 4. С. 43–44.
Лазебная И.В., Лазебный О.Е., Рузина М.Н. и др. Полиморфизм генов гормона роста bGH и пролактина bPRL и изучение его связи с процентным содержанием жира в молоке у коров костромской породы // Сельскохоз. биол. 2011. Т. 46. № 4. С. 46–51.
Лазебная И.В., Лазебный О.Е., Максименко В.Ф., Сулимова Г.Е. Полиморфизм генов гормона роста и пролактина в связи с признаками качества молока у крупного рогатого скота ярославской породы // Сельскохоз. биол. 2012. Т. 47. № 2. С. 39–44.
Перчун А.В., Лазебная И.В., Белокуров С.Г. и др. Полиморфизм генов CSN3, BPRL и BGH у коров костромской породы в связи с показателями молочной продуктивности // Фундам. исслед. 2012. № 11–2. С. 304–308.
Сибагатуллин Ф.С., Фаизов Т.Х., Шарафутдинов Г.С. и др. Использование ДНК технологий в животноводстве // Вестн. Казанского ГАУ. 2010. Т. 15. № 1. С. 130–132.
Сидоренко В.А., Баранова Н.С. Костромичи и “Костромичка”: к 60-летию создания костромской породы крупного рогатого скота (1944–2004). Кострома: Костромаиздат, 2004. 160 с.
Сулимова Г.Е., Лазебная И.В., Перчун А.В. и др. Уникальность костромской породы крупного рогатого скота с позиции молекулярной генетики // Достижения АПК. 2011. № 9. С. 52–54.
Сулимова Г.Е., Перчун А.В., Рузина М.Н., Лазебная И.В. Перспективы использования костромского скота в молочном и мясном животноводстве / Ред. Н.С. Баранов, Н.Ю. Парамонов, Т.В. Репин. 70 лет костромской породе скота: сборник статей. Караваево: Костромская ГСХА, 2014. С. 62–71.
Ardicli S., Dincel D., Samli H., Balci F. Effects of polymorphisms at LEP, CAST, CAPN1, GHR, FABP4 and DGAT1 genes on fattening performance and carcass traits in Simmental bulls // Arch. Anim. Breed. 2017. V. 60. P. 61–70.
Banos G., Woolliams J.A., Woodward B.W. et al. Impact of single nucleotide polymorphisms in leptin, leptin receptor, growth hormone receptor, and diacylglycerol acyltransferase (DGAT1) gene loci on milk production, feed, and body energy traits of UK dairy cows // J. Dairy Sci. 2008. V. 91. P. 3190–3200.https://doi.org/10.3168/jds.2007-0930
Barendse W., Bunch R.J., Kijas J.W., Thomas M.B. The effect of genetic variation of the retinoic acid receptor-related orphan receptor C gene on fatness in cattle // Genetics. 2007. V. 175. P. 843–853. https://doi.org/10.1534/genetics.106.064535
Benjamini Y., Hochberg Y. Controlling the false discovery rate: a practical and powerful approach to multiple testing // J. R. Stat. Soc. Ser. B Stat. Methodol. 1990. V. 557. P. 289–300. https://doi.org/10.1111/j.2517-6161.1995.tb02031.x
Bonfatti V., Cecchinato A., Di Martino G. et al. Effect of κ-casein B relative content in bulk milk κ-casein on Montasio, Asiago, and Caciotta cheese yield using milk of similar protein composition // J. Dairy Sci. 2011. V. 94. № 2. P. 602–613.
Chakraborty A.D., Kumar D., Singh S.G., Sudan A. Growth hormone receptor (GHR) gene and its applications in livestock: a review // Agric. Rev. 2016. V. 37 (3). P. 250–254.https://doi.org/10.18805/ag.v37i3.3541
Cirillo D., Rachiglio A.M., la Montagna R. et al. Leptin signaling in breast cancer: an overview // J. Cell. Biochem. 2008. V. 105. P. 956–964.https://doi.org/10.1002/jcb.21911
Dehkhoda F., Lee C.M.M., Medina J., Brooks A.J. The growth hormone receptor: mechanism of receptor activation, cell signaling, and physiological aspects // Front. Endocrinol. (Lausanne). 2018. V. 9. Art. 35. 23 p.https://doi.org/10.3389/fendo.2018.00035
Evanno G., Regnaut S., Goudet J. Detecting the number of clusters of individuals using the software STRUCTURE: a simulation study // Mol. Ecol. 2005. V. 14. P. 2611–2620. https://doi.org/10.1111/j.1365-294X.2005.02553.x
Fedota O.M., Lysenko N.G., Ruban S.Y. et al. The effects of polymorphisms in growth hormone and growth hormone receptor genes on production and reproduction traits in Aberdeen-Angus cattle (Bos taurus L., 1758) // Cytol. Genet. 2017. V. 51. P. 352–360. https://doi.org/10.3103/S0095452717050024
Glad CA.M., Svensson P.-A., Nystrom F.H. et al. Expression of GHR and downstream signaling genes in human adipose tissue — relation to obesity and weight change // J. Clin. Endocrinol. Metab. 2019. V. 104. P. 1459–1470. https://doi.org/10.1210/jc.2018-01036
Gorlov I.F., Fedunin A.A., Randelin D.A., Sulimova G.E. Polymorphisms of bGH, RORC, and DGAT1 genes in Russian beef cattle breeds // Russ. J. Genet. 2014. V. 50. P. 1302–1307. https://doi.org/10.1134/S1022795414120035
Gorlov I., Sulimova G., Perchun A. et al. Genetic polymorphism of the RORC, bGH, bGHR, LEP, LEPR genes in Russian hornless cattle breed // 16th Internat. Sci. Conf. Engineering for Rural Development. 2017. V. 16. P. 201–206.
Hill R., Canal A., Bondioli K. et al. Molecular markers located on the DGAT1, CAST, and LEPR genes and their associations with milk production and fertility traits in Holstein cattle // Genet. Mol. Res. 2016. V. 31. 15 (1).https://doi.org/10.4238/gmr.15017794
Hirose T., Smith R.J., Jetten A.M. ROR gamma: the third member of ROR/RZR orphan receptor subfamily that is highly expressed in skeletal muscle // Biochem. Biophys. Res. Commun. 1994. V. 205. № 3. P. 1976–1983.https://doi.org/10.1006/bbrc.1994.2902
Houseknecht K.L., Baile C.A., Matteri R.L., Spurlock M.E. The biology of leptin: a review // J. Anim. Sci. 1998. V. 76. P. 1405–1420.
Jetten A.M. Retinoid-related orphan receptors (RORs): critical roles in development, immunity, circadian rhythm, and cellular metabolism // Nucl. Recept. Signal. 2009. V. 7. P. e003. https://doi.org/10.1621/nrs.07003
Kawaguchi F., Okura K., Oyama K. Identification of leptin gene polymorphisms associated with carcass traits and fatty acid composition in Japanese Black cattle // Anim. Sci. J. 2017. V. 88. P. 433–438. https://doi.org/10.1111/asj.12672
Lazebnaya I.V., Perchun A.V., Lazebny O.E. Intrabreed and interbreed variation of the BOLA-DRB3.2 gene in the Kostroma and Yaroslavl indigenous Russian cattle breeds // Immunogenetics. 2020. V. 72. P. 355–366. https://doi.org/10.1007/s00251-020-01173-7
Olenski K., Suchocki T., Kaminski S. Inconsistency of associations between growth hormone receptor gene polymorphism and milk performance traits in Polish Holstein-Friesian cows and bulls // Anim. Sci. Pap. Rep. 2010. V. 28. P. 3.
Peakall R., Smouse P.E. GenAlEx 6: genetic analysis in Excel. Population genetic software for teaching and research // Mol. Ecol. Notes. 2006. V. 6. P. 288–295.
Peakall R., Smouse P.E. GenAlEx 6.5: genetic analysis in Excel. Population genetic software for teaching and research – an update // Bioinformatics. 2012. V. 28. P 2537–2539. https://doi.org/10.1093/bioinformatics/bts460
Pritchard J.K., Stephens M., Donnelly P. Inference of population structure using multilocus genotype data // Genetics. 2000. V. 155. P. 945–959.https://doi.org/10.1093/genetics/155.2.945
da Silva R.C., Ferraz J.B., Meirelles F.V. et al. Association of single nucleotide polymorphisms in the bovine leptin and leptin receptor genes with growth and ultrasound carcass traits in Nellore cattle // Genet. Mol. Res. 2012. V. 11. P 3721–3728. https://doi.org/10.4238/2012.August.17.10
Trakovická A., Moravčíková N., Kasarda R. Genetic polymorphisms of leptin and leptin receptor genes in relation with production and reproduction traits in cattle // Acta Biochim. Pol. 2013. V. 60. P. 783–787.
Trakovicka A., Moravčikova N., Nadasky R. Analysis of genetic structure within beef cattle breeds using SNPs in four candidate genes / Book of abstracts of the 66th Ann. Meeting of the Eur. Association for Anim. Production Warsaw, Poland, 31 August–4 September 2015. EAAP Book of Abstracts, V. 21. P. 237.
Viitala S., Szyda J., Blott S. et al. The role of the bovine growth hormone receptor and prolactin receptor genes in milk, fat and protein production in Finnish ayrshire // Dairy Cattle Genet. 2006. V. 173. P. 2151–2164.
Zhang Y., Proenca R., Maffei M. et al. Positional cloning of the mouse obese gene and its human homo-logue // Nature. 1994. V. 372. P. 425–432.
Zhang Y., Luo Xy., Wu Dh. Xu Y. ROR nuclear receptors: structures, related diseases, and drug discovery // Acta Pharmacol. Sin. 2015. V. 36. P. 71–87. https://doi.org/10.1038/aps.2014.120
Дополнительные материалы отсутствуют.
Инструменты
Успехи современной биологии