Успехи современной биологии, 2023, T. 143, № 1, стр. 3-15
Метаболизм триптофана: новый взгляд на роль триптофановых производных в организме человека
О. П. Шатова 1, *, А. В. Шестопалов 1, 2
1 Российский национальный исследовательский медицинский
университет им. Н.И. Пирогова
Москва, Россия
2 НМИЦ Детской гематологии, онкологии и иммунологии
им. Дмитрия Рогачева Минздрава России
Москва, Россия
* E-mail: shatova.op@gmail.com
Поступила в редакцию 04.07.2022
После доработки 21.07.2022
Принята к публикации 25.07.2022
- EDN: HLAMIY
- DOI: 10.31857/S0042132423010076
Аннотация
В современной научной литературе пристальное внимание уделяется биологической роли катаболитов триптофана как в норме, так и при различных патологиях. Все больше появляется сообщений, что катаболиты триптофанового обмена играют сигнальную роль в организме человека и в микробном сообществе кишечника. Активно изучаются рецепторы и сигнальные пути в организме человека так называемых триптофановых сигнальных молекул (ТриСМ), их клеточные мишени, физиологические и метаболические эффекты. В настоящее время установлено, что практически все катаболиты триптофанового обмена являются сигнальными молекулами. Многие из них реализуют свою сигнальную роль через арил-углеводородные рецепторы (АhR). Доминантный путь обмена триптофана для организма человека – это кинурениновый путь, который является источником универсальных сигнальных молекул – кинуренина, хинолиновой и кинуреновой кислот. Индольный путь катаболизма триптофана, главный для микробиоты, за исключением реакций образования индолов в иммунокомпетентных клетках, является источником межцарственных и межвидовых сигнальных молекул – индола и его производных: индол-3-пирувата, индол-3-лактата, индол-3-ацетата, индол-3-пропионата, индол-3-акрилата, индол-3-бутирата и индол-3-ацетальдегида. Серотонин и мелатонин являются также универсальными сигнальными молекулами и широко изучены при различных заболеваниях нервной системы.
ВВЕДЕНИЕ
Источником L-триптофана (Три) в организме человека могут быть пища, микробиотический синтез и реутилизация собственных аминокислот в результате распада белков и пептидов. Однако, общепринято считать, что основное количество Три поступает в организм человека именно с пищевыми нутриентами (Gao et al., 2020). Синтез Три в организме человека не происходит, и данная аминокислота является для Homo sapiens незаменимой – эссенциальной (Badawy, 2019). Три является единственной аминокислотой, которая связывается с альбумином в плазме, при этом примерно 10–15% общего количества Три плазмы находится в свободной форме и 85–90% транспортируется в связанном с альбуминами состоянии, причем эти два состояния существуют в равновесии (Gao et al., 2020). Это может быть связано с тем, что Три метаболизируется организмом человека до большого количества различных сигнальных молекул (Kumar et al., 2021). Видимо с этим связана способность Три транспортироваться через гематоэнцефалический барьер (ГЭБ) только в свободной форме с помощью конкурентного и неспецифического переносчика аминокислот L-типа. Попадая в центральную нервную систему (ЦНС), Три действует как предшественник нескольких метаболических путей, включая общий синтез белка, синтез серотонина/мелатонина и выработку кинуренина (Jones et al., 2013).
Общеизвестно, что кишечный микробиом и диета значимо влияют на метаболизм хозяина, и многие метаболические и физиологические процессы в значительной степени модулируются низкомолекулярными метаболитами (Cénit et al., 2014). Метаболизм Три через кинурениновый путь (КП) участвует в регуляции иммунитета, функции нейронов и в гомеостазе кишечника (Platten et al., 2019). Продукция серотонина (5-гидрокситриптофана – 5-ГТ) нейронами ЦНС регулирует сон, настроение и аппетит, тогда как образование серотонина в кишечном тракте энтерохромаффинными клетками регулирует перистальтику кишечника и его проницаемость, а также иммунитет и воспалительную реакцию (Grifka-Walk et al., 2021). В кишечнике образуется множество различных микробных индольных катаболитов Три (МИКТ), которые являются лигандами арилгидрокарбоновых рецепторов (АhR) (Gutiérrez-Vázquez, Quintana, 2018; Vyhlídalová et al., 2020; Kumar et al., 2021) или прегнан Х-рецепторов (PXR) (Venkatesh et al., 2014). К МИКТ относится индол и различные индольные производные, например: индол-3-пируват, индол-3-ацетат, индол-3-лактат, индол-3-пропионат, индол-3-карбоксальдегид, индол-3-ацетальдегид и др. (Vyhlídalová et al., 2020).
КИНУРЕНИНОВЫЙ ПУТЬ – ДОМИНАНТНЫЙ ПУТЬ ОБМЕНА ДЛЯ Homo sapiens И ИСТОЧНИК УНИВЕРСАЛЬНЫХ ТРИПТОФАНОВЫХ СИГНАЛЬНЫХ МОЛЕКУЛ (ТриСМ)
Более 90% всего Три окисляется в печени через КП (Cervenka et al., 2017). Некоторыми авторами высказывается мнение, что до 95% поступившего в организм Три превращается в кинуренин клетками организма хозяина и только 1–2% Три утилизируется через серотониновый путь обмена (Hendrikx, Schnabl, 2019).
КП катаболизма Три (рис. 1) начинается с превращения Три в N-формил-кинуренин индоламин-2,3-диоксигеназой (IDO, ЕС: 1.13.13.52) и в тот же метаболит триптофан-2,3-диоксигеназой (TDO, ЕС: 1.13.13.11); далее N-формил-кинуренин превращается в L-кинуренин арилформамидазой (ЕС: 3.5.1.9).
Далее L-кинуренин превращается кинуренин-3-монооксигеназой (ЕС: 1.14.13.9) в 3-гидрокси-L-кинуренин, а затем кинурениназой (ЕС: 3.7.1.3) 3-гидрокси-L-кинуренин и L-кинуренин превращаются в антранилат и 3-гидроксиантранилат. В свою очередь антранилат превращается в 3-гидроксиантранилат благодаря антранилат-3-монооксигеназе (ЕС: 1.14.14.8). 3-Гидроксиантранилат превращается в циннабариновую кислоту каталазой (ЕС: 1.11.1.6) или каталазой-пероксидазой (ЕС: 1.11.1.21). Далее кольцо 3-гидроксиантранилата раскрывается до 2-амино-3-карбоксимуконат полуальдегида 3-гидроксиантранилат-3,4-диоксигеназой (ЕС: 1.13.11.6), а затем спонтанно превращается в хинолиновую кислоту, которая далее с помощью фосфорибозилпирофосфата (ФРПФ) и хинолинат фосфорибозилтрансферазы (ЕС: 2.4.2.19) превращается в мононуклеотид никотиновой кислоты. Кроме того, L-кинуренин кинуренин-аминотрансферазой (КАТ, ЕС: 2.6.1.7) превращается в кинуреновую кислоту и этим же ферментом 3-гидрокси-L-кинуренин превращается в ксантуреновую кислоту. Далее хинолиновая кислота превращается в рибонуклеотид хинолиновой кислоты и уже затем в никотинамидадениндинуклеотид (НАД+) (Marszalek-Grabska et al., 2021). Среди метаболитов кинуренинового пути хинолиновая кислота, по-видимому, является одним из наиболее важных с точки зрения биологической активности (Jones et al., 2013).
КП играет основную роль во влиянии на доступность Три за счет клиренса избытка Три. Катаболизм Три по кинурениновому пути инициируется индукцией скорость-лимитирующих ферментов: IDO или TDO. Так IDO гиперэкспрессируется в различных органах и тканях: головном мозге, желудочно-кишечном тракте и печени, тогда как TDO экспрессируется только в печени (O’Mahony et al., 2015). Однако существуют работы, которые демонстрируют повсеместную экспрессию IDO и экспрессию TDO, кроме печени, еще в плаценте, гонадах и головном мозге (Cecchi et al., 2021).
Экспрессия IDO повсеместна (Cecchi et al., 2021) и зависит от уровня провоспалительных цитокинов в организме. Так, одним из самых мощных индукторов экспрессии IDO является интерферон γ (INFγ) (Wolf et al., 2004). Активность TDO регулируется доступностью триптофана, и при этом промотор данного регуляторного фермента содержит глюкокортикоид-чувствительный элемент в ДНК (GRE, glucocorticoid response element), соответственно экспрессия TDO зависит от уровня кортизола и его сигнального пути. Так, известно, что при стрессе происходит индукция экспрессии TDO (Cecchi et al., 2021).
Кинуренин является сигнальной молекулой, действуя через AhR, и имеет плейотропные эффекты в зависимости от типа клеток, на которые оказывает свое действие (Cervenka et al., 2017). Кроме того, кинуренин может быть далее метаболизирован в биоактивные молекулы, которые также выполняют сигнальную функцию (Marszalek-Grabska et al., 2021). Существует значительное количество взаимодействий с микробиомом в отношении метаболитов Три. Микробиом кишечника может регулировать выработку метаболитов Три хозяина и может использовать как пищевой, так и синтезированный микроорганизмами Три для создания биогенных метаболитов. Производные Tри, такие как индол, способны передавать сигналы ксенобиотическим рецепторам, включая AhR, вызывая толерогенные эффекты (Grifka-Walk et al., 2021).
Так, КП имеет два основных направления превращения. В физиологических условиях кинуренин преимущественно превращается в 3-гидроксикинуренин, а затем в 3-гидроксиантраниловую кислоту, хинолиновую кислоту и, наконец, в НАД+ (Cervenka et al., 2017). Остальной кинуренин в результате KAT-реакции превращается в кинуреновую кислоту. Биологическая роль главных ТриСМ кинуренинового пути суммирована в табл. 1.
Таблица 1.
Функции ключевых ТриСМ кинуренинового пути
| Название ТриСМ | Рецептор ТриСМ | Эффект сигналинга | Источник |
|---|---|---|---|
| L-кинуренин | Является агонистом AhR | Связывается с AhR во многих иммунных клетках и подавляет иммунитет (иммунодепрессивное действие). Стимулирует апоптоз Т-клеток и индуцирует регуляторные Т-клетки (Treg). Является предшественником нейротоксических метаболитов (антраниловой и хинолиновой кислот). Также кинуренин обладает вазоактивными свойствами | Zádori et al., 2012; Marszalek-Grabska et al., 2021 |
| 3-гидрокси-L-кинуренин | АФК выполняют сигнальную роль в регуляции основных функций клетки | Генерирует свободные радикалы и оказывает токсическое действие на нервную ткань | Chen, Guillemin, 2009; Zádori et al., 2012 |
| Кинуреновая кислота | Конкурентно ингибирует (антагонист) рецепторы глутамата (ионотропный рецептор глутамата, селективно связывающий N-метил-D-аспартат – NMDA) | Снижает активность в сайте коагониста глицина рецептора NMDA 5. Введение даже низких концентраций (наномолярный диапазон) кинуреновой кислоты в мозг снижает уровень глутамата на 30–40%. Имеет нейропротекторную и антиоксидантную функции. Также оказывает выраженное противосудорожное и седативное действие | Carpenedo et al., 2001; Chen Guillemin, 2009; Savitz, 2020 |
| Является негативным аллостерическим модулятором α7-никотиновых рецепторов 7 | Оказывает вазоактивное действие | ||
| Агонист рецептора, связанного с орфанным G-белком (GPR35) | Модулирует выработку цАМФ и ингибирует каналы Ca2+ N-типа симпатических нейронов и астроцитов | Guo et al., 2008 | |
| Является агонистом AhR | Регулирует иммунный ответ за счет своего действия на терминацию высвобождения цитокинов в некоторых типах клеток, включая макрофаги | Opitz et al., 2011 | |
| Агонист рецептора гидроксикарбоновой кислоты 3 (HCA3) | Данный рецептор является мембранным и ассоциирован с G-протеином | Tunaru et al., 2003 | |
| Агонист мускариновых K+-каналов | Замедление частоты сердечных сокращений | Chen, Guillemin, 2009 | |
| Скавенджер реактивных форм кислорода (РФК) | Снижение окислительного стресса | Chen, Guillemin, 2009 | |
| Антраниловая кислота | Агонист фарнезоидных X-рецепторов (FXR) | Регулирует обмен глюкозы, желчных кислот и триглицеридов. Подавляет рост и размножение патогенов, в том числе имеет противовирусное действие | Silva et al., 2019 |
| 3-гидроксиантраниловая кислота | Генерирует свободные радикалы | Внутримозговое введение 3-гидроксиантраниловой кислоты приводит к снижению активности холинацетилтрансферазы, выполняет как прооксидантную, так и антиоксидантную функции, имеет противовоспалительное действие | Chen, Guillemin, 2009; Castro-Portuguez, Sutphin, 2020 |
| Хинолиновая кислота | Является агонистом рецептора NMDA | Оказывает ингибирующее действие на обратный захват глутамата астроцитами, что приводит к эксайтотоксичности и вызывает гибель нейронов. Таким образом, оказывает нейротоксическое действие | Stone, Perkins, 1981 |
| Является агонистом AhR | Приводит к ингибированию активации инфламмасомы NLRP3 (Nod-подобного рецептора) и снижению воспаления в коже при псориазе | Marszalek-Grabska et al., 2021; Qiao et al., 2022 | |
| Ксантуреновая кислота | Ингибирует передачу сигналов инсулина/инсулиноподобного фактора роста 1 (ИФР-1) в островках поджелудочной железы | Castro-Portuguez, Sutphin, 2020 | |
| НАД+ | Является агонистом AhR | Участвует в воспалительной реакции | Marszalek-Grabska et al., 2021 |
При воспалении провоспалительные цитокины шунтируют метаболизм Tри в сторону образования кинуренина (Savitz, 2020). IDO активируется главным образом через IFNγ-зависимый путь. Однако существуют и IFNγ-независимые пути, например, через активацию TLR-4 (толл-подобного рецептора 4-го типа) (Connor et al., 2008) или через активацию IL-1R (рецептора интерлейкина 1 бета) (Zunszain et al., 2012). Важно отметить, что лептин также принимает участие в активации IDO. Таким образом, лептин повышает превращение Три в кинуренин и его производные (Mangge et al., 2014). Это может означать, что лептин также активирует нижестоящий метаболизм кинуренина. Однако это не всегда так. Например, повышающая регуляция IDO, вызванная острым воспалением, увеличивает уровни кинуренина и кинуреновой кислоты, но не влияет на уровень антраниловой кислоты в плазме крови у больных с пневмонией (Thomas et al., 2020). То есть не всегда понятна степень повышения различных катаболитов нисходящего пути катаболизма Три, а их вклад в регуляцию метаболизма может быть разнонаправленным, как например для хинолиновой и кинуреновой кислот (Agus et al., 2018). Следует отметить амбивалентную роль хинолиновой и кинуреновой кислот для нервной ткани, если кинуреновая кислота оказывает нейропротекторное действие, то хинолиновая кислота обладает нейротоксичностью и от соотношения этих метаболитов кинуренинового пути зависит развитие нейродегенеративных заболеваний (Vamos et al., 2009).
Известно, что Три и кинуренин могут проникать через ГЭБ. Так, около 60–80% кинуренина в головном мозге в физиологических условиях имеет внемозговое происхождение (Kita et al., 2002). Важно отметить, что КП играет решающую роль в энергетическом обмене клеток, так как необходим для образования НАД+. Поскольку во время иммунного ответа потребность в энергии существенно возрастает, КП является ключевым регулятором иммунной системы (Savitz, 2020). Существует так называемый кинурениновый переключатель, который означает, что в физиологическом состоянии весь Три, который не пошел на синтез белка в печени, метаболизируется до НАД+ или подвергается катаболизму до воды и углекислого газа. Тогда как при иммунной̆ стимуляции в ткани легких происходит активация IDO, что способствует срабатыванию “кинуренинового переключателя”, и системный̆ кинуренин начинают активно поглощать иммунокомпетентные клетки с целью гиперпродукции в них НАД+ и интенсификации энергетического обмена (Shestopalov et al., 2021).
За пределами иммунной системы экспрессия генов КП наиболее высока в печени, почках и поджелудочной железе. Утилизация Три в этих органах контролируется экспрессией TDO (Labadie et al., 2019). Однако именно печень является основным местом синтеза НАД+de novo из Три (Castro-Portuguez, Sutphin, 2020).
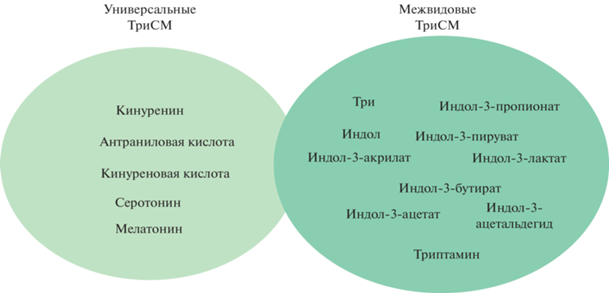
Интересным является тот факт, что любой метаболит, образованный из Три, да и сам Три, являются сигнальными молекулами. Кинуренин является универсальной сигнальной молекулой, так как образуется и в организме хозяина (Homo sapiens), и в микроорганизмах кишечника/других локализаций организма. Кроме того, к универсальным сигнальным молекулам относятся антраниловая и хинолиновая кислоты, а также метаболит серотонинового пути катаболизма Три – серотонин (Agus et al., 2018).
Так, некоторые ТриСМ формируют узлы связи сигнальной трансдукции между различными царствами живых организмов. В организме человека кинуренин оказывает свое действие через AhR (Szelest et al., 2021). Сигнальный путь AhR играет важную роль в регуляции иммунных реакций, ксенопротекции (Bock, 2017), регенерации, росте и дифференцировке клеток, развитии органов, патогенезе метаболических заболеваний, а также канцерогенезе (Vyhlídalová et al., 2020). AhR связывает различные лиганды – это не только индолы. К ним можно отнести: флавоноиды, полифенолы, а также синтетические полициклические ароматические углеводороды и диоксиноподобные соединения. AhR представляет собой цитозольный фактор транскрипции, связанный с несколькими ко-шаперонами, который обычно неактивен. После связывания лиганда с химическими веществами, такими как 2,3,7,8-тетрахлордибензо-п-диоксин (TCDD), шапероны диссоциируют, в результате чего AhR перемещается в ядро и димеризуется с ядерным транслокатором AhR (ARNT, aryl hydrocarbon receptor nuclear translocator), что приводит к изменениям в транскрипции соответствующих генов (Sun et al., 2020).
Установлено, что производные антраниловой кислоты (антранилата) являются сильными агонистами фарнезоидных X-рецепторов (FXR). При этом известно, что FXR представляет собой ядерный рецептор, гиперэкспрессируемый в печени, желчном пузыре, кишечнике, почках и надпочечниках. Он регулирует важную физиологическую роль в различных метаболических путях, участвующих в гомеостазе желчных кислот, триглицеридов и глюкозы (Chen et al., 2016).
Микробиота организма человека участвует в преобразовании антранилата в хинолиновые регуляторы quorum sensing (QS) (Sas et al., 2018). Количественный анализ полимеразной цепной реакции в реальном времени (qRT-PCR) показал, что добавление экзогенной антраниловой кислоты ингибирует уровни экспрессии компонентов пути – цАМФ-протеинкиназы А у микроорганизмов. При этом антраниловая кислота ингибирует половое спаривание S. scitamineum и морфологический переход посредством интерференции между царствами. В своем исследовании авторы демонстрируют, что именно антраниловая кислота, а не ее метаболиты оказывают такой ингибиторный эффект. Антраниловая кислота способствует патогенности R. solanacearum и контролирует уровни экспрессии широкого спектра различных генов. Дифференциально экспрессируемые антранилатом гены были связаны с рядом биологических функций, включая подвижность и прикрепление клеток, устойчивость к стрессу, вирулентность, регуляцию транскрипции, синтез мембранных компонентов, мембранный транспорт, множественную лекарственную устойчивость, детоксикацию и передачу сигнала (Song et al., 2020). Установлено, что помимо диффузионных сигнальных факторов (DSF), антраниловая кислота также играет ключевое значение во внутривидовой передаче сигналов, выполняет важную функцию в межвидовой и межцарственной коммуникациях (Deng et al., 2014).
Хинолиновая кислота является важным агонистом рецепторов NMDA (N-метил-D-аспартата), характеризуя эксайтотоксический механизм при секреции в высоких концентрациях и обладая нейротоксическим действием (Behl et al., 2021). Результаты показали, что хинолиновая кислота вызывает изменения в продукции РФК, уровнях нитритов, активности антиоксидантных ферментов, содержании глутатиона и повреждении белков и липидов (Ferreira et al., 2022).
Очень важным вопросом является проницаемость ГЭБ для ТриСМ. Так установлено, что через ГЭБ проходят Три, кинуренин, 3-гидроксикинуренин и циннабариновая кислота. Предшественником последней является 3-гидроксиантранилат, и данная кислота также является ТриСМ, а ее рецептором является AhR (Marszalek-Grabska et al., 2021). Можно со всей определенностью говорить, что именно проницаемость ГЭБ для различных ТриСМ определяет их регуляторные эффекты в нервной ткани.
Так, содержание в головном мозге кинуренина напрямую зависит от его содержания в сыворотке крови. При этом сывороточный кинуренин имеет как экзогенное, так и эндогенное происхождение. Экзогенный кинуренин поступает в организм человека с некоторыми пищевыми продуктами (мед, молоко, грибы, тыква, кунжут и ферментированная пища, например кефир, йогурт, пиво, квас, вино), а также синтезируется микроорганизмами кишечника. Эндогенный кинуренин образуется преимущественно печенью и иммунными клетками (Marszalek-Grabska et al., 2021). Недавняя работа освещает высокое содержание кинуренина в грудном молоке, и авторы приходят к мысли, что кинуренин и его метаболиты отвечают как за развитие моторных двигательных навыков, так и оказывают заметное воздействие на психоэмоциональную сферу потомства (Marszalek-Grabska et al., 2022).
ИНДОЛЬНЫЙ ПУТЬ: МЕХАНИЗМ КОЭВОЛЮЦИИ ОРГАНИЗМА ХОЗЯИНА И МИКРОБИОТЫ, ОБЕСПЕЧЕННЫЙ ПРОДУКЦИЕЙ МЕЖЦАРСТВЕННЫХ/МЕЖВИДОВЫХ ТриСМ
В настоящее время вполне очевидно, что присутствие микроорганизмов в организме хозяина влияет на эволюцию животных и спецификацию клеточных судеб, включая и клетки нервной системы (Wei et al., 2021). Большая часть Три, образующегося в результате переваривания белков, всасывается в тонкой кишке и транспортируется в различные органы для преобразования в эндогенные лиганды AhR, такие как ксантуреновая кислота, кинуренин и кинуреновая кислота (Roager, Licht, 2018). Однако значительная часть Три достигает толстой кишки, где под влиянием микробиотических ферментов Три метаболизируется микроорганизмами с образованием индола и его производных (Roager, Licht, 2018).
Так, многие бактерии производят небольшие молекулы для мониторинга плотности популяции и таким образом регулируют свое коллективное поведение, этот процесс называется ощущением кворума – QS. При этом существует способность организма хозяина “прослушивать” бактериальную сигнализацию, что дает возможность тонко настраивать физиологически дорогостоящие иммунные реакции. В системном QS и межцарственном взаимодействии места в первом ряду отводятся для индольных сигнальных молекул – индолу и его производным: индол-3-пирувату, индол-3-лактату, индол-3-ацетату, индол-3-пропионату, индол-3-акрилату, индол-3-бутирату и индол-3-ацетальдегиду.
Интересно, что индол-3-пируват может образоваться в оксидазной реакции (ЕС: 1.4.3.2) в дендритных клетках и макрофагах человека при лейкемии (Carbonnelle-Puscian et al., 2009). То есть индольный путь возможен не только в кишечнике благодаря микробиотическим реакциям.
Было показано, что индол-3-лактат является ингибитором КАТ I в нервной ткани человека, то есть бактериальный индол-3-лактат регулирует КП превращения Три в клетках организма хозяина. Примечательно, что у новорожденных детей Bifidobacterium в кишечнике образуют огромное количество индол-3-лактата, который, попадая в макроорганизм, отвечает за дифференцировку нервной ткани (Shestopalov et al., 2020a, 2020b). Кроме того, индол-3-лактат, индол-3-ацетат и индол-3-пропионат оказывают липотропное действие и препятствуют жировой инфильтрации печени (Venkatesh et al., 2014). Индол-3-пропионат является очень важной ТриСМ, которая определяет проницаемость кишечника (Konopelski, Mogilnicka, 2022).
Индол оказывает сигнальное действие на L-клетки кишечника хозяина и регулирует секрецию глюкагоноподобного пептида 1-го типа (GLP-1) в них. Свои сигнальные эффекты на организм хозяина индол оказывает через механизм ингибирования потенциал-зависимых К+-каналов, что приводит к увеличению ширины потенциалов действия, запускаемых L-клетками и к усилению входа Ca2+, тем самым резко стимулируя секрецию GLP-1. С другой стороны, индол замедляет продукцию АТФ, блокируя НАДН-дегидрогеназу, что приводит к длительному снижению секреции GLP-1 (Chimerel et al., 2014). Индол, как и многие производные индола, является агонистом AhR и таким образом регулирует экспрессию цитохромов и ксенопротекцию. Консервативные лиганды AhR, такие как индол, по-видимому, играют решающую роль не только в обнаружении ксенобиотических соединений, но также в идентификации и передаче сигналов, которые индуцируют гены, ответственные за оогенез, тем самым увеличивая плодовитость (Kumar et al., 2021). Интересно, что индол усиливает образование внешних мембранных микробиотических везикул (Díez-Sainz et al., 2021) и соответственно может позитивно влиять на транслокацию бактериальных ДНК в кровь.
Следует указать, что индол является наиболее распространенным МИКТ и образуется широким спектром бактерий, в том числе принадлежащих к родам Escherichia, Bacteroides и Clostridium. Эти бактерии используют триптофаназу (ЕС: 4.1.99.1) для расщепления триптофана на индол, пируват и аммиак, что приводит к средней концентрации индола в фекалиях человека от 0.25 до 1.2 мМ (Chimerel et al., 2014). Далее индол превращается монооксигеназой (ЕС: 1.1.14.16) в индоксил, в свою очередь индоксил превращается в ацетил-индоксил, а ацетил-индоксил ацетил-индоксил-оксидоредуктазой (ЕС:1.7.3.2) метаболизируется до ацетил-исатина. Другой вариант индольного превращения для Три начинается с триптофанаминотранферазной реакции (ЕС: 2.6.1.27), в результате которой образуется индол-3-пируват, далее индол-3-пируватредуктаза (ЕС: 1.1.1.110) превращает индол-3-пируват в индол-3-лактат, а затем индол-3-лактат превращается в индол-3-акрилат ферментом цинномоил-КоА:фенил-лактат-КоА-трансферазой (ЕС: 2.8.3.17), который затем превращается в индол-3-пропионат короткоцепочечной ацил-КоА дегидрогеназой (ЕС: 1.3.8.15). Следует отметить, что индол-3-пируват может превратиться в индол-3-ацетат – индол-3-пируват монооксигеназой (ЕС: 1.14.13.168) или индол-3-ацетальдегид индол-3-пируват декарбоксилазой (ЕС: 4.1.1.74). Также Три под воздействием триптофан-2-монооксигеназы (ЕС: 1.13.12.3) превращается в индол-3-ацетамид, а затем индол-3-ацетамид превращается амидазой (ЕС: 3.5.1.4) в индол-3-ацетат, а затем ацетальдегиддегидрогеназой (ЕС: 1.2.1.5) в индол-3-ацетальдегид, который далее превращается в индол-3-этанол индол-3-ацетальдегидредуктазой (ЕС: 1.1.1.190). При действии триптофандекарбоксилазы (ЕС: 4.1.1.28) Три превращается в триптамин (https://www.genome.jp/kegg/pathway/map/ map00380.html) (рис. 2).
Именно индол, индол-3-ацетат и индол-3-лактат являются доминантными МИКТ в кишечнике человека (Shestopalov et al., 2021). Индол-3-ацетат значительно ослабляет продукцию медиаторов воспаления в макрофагах (Krishnan et al., 2019), имеет липостатический и гипохолестеринемический эффекты, которые реализует через AhR в организме хозяина. Через AhR действует и индолальдегид, который также является метаболитом обмена Три микробиотического происхождения. Индолальдегид повышает продукцию интерлейкина-22 (IL-22) иммунными клетками (Roager, Licht, 2018). IL-22 стимулирует продукцию антимикробных белков дефензинов-2 и -3, в связи с чем данный цитокин вызывает значительный интерес в противовоспалительной и противоинфекционной иммунотерапии (Barthelemy et al., 2018).
Кроме того, установлено, что индол-3-пропионат и индол-3-ацетат обладают антиоксидантными свойствами. Также показано, что индол-3-пропионат уменьшает инсулинорезистентность и отрицательно коррелирует с развитием сахарного диабета 2-го типа. Это связано и с влиянием индол-3-пропионата на секрецию инсулина, и с влиянием индол-3-пропионата на инсулиносенситивность тканей (de Mello et al., 2017).
Очень важное значение для организма человека имеет индол-3-лактат. Данный метаболит Три также имеет микробное происхождение и принимает участие в нейритогенезе (Shestopalov et al., 2021). Было показано, что индол-3-лактат снижает воспаление в слизистой оболочке кишечника. Гиперпродукция данного метаболита преимущественно обеспечивается Bifidobacterium. Кроме того, индол-3-лактат индуцирует экспрессию ферментов антиоксидантной системы: супероксиддисмутазы и глутатионредуктазы (Ehrlich et al., 2020).
Установлено, что МИКТ регулируют активацию микроглии, а также продукцию трансформирующего фактора роста альфа (TGFα) и фактора роста эндотелия сосудов (VEGF-B), и это может модулировать программу транскрипции астроцитов и ограничивать воспаление в ЦНС (Sittipo et al., 2021).
Таким образом индол является основным метаболитом, продуцируемым микробиотой кишечника из Три. Показано, что именно индол влияет на нейрогенез и функцию мозга. Кроме того, производные индола, такие как триптамин, индол-3-ацетат и индол-3-пропионат могут пересекать ГЭБ и регулировать пролиферацию, дифференцировку и выживание нейронов посредством передачи сигналов AhR. Более того, анализ in silico показал, что различные метаболиты Три опосредуют ось микробиота–кишечник–мозг. Эти исследования демонстрируют, что метаболиты Три играют важную роль в ЦНС (Sittipo et al., 2021).
СЕРОТОНИНОВЫЙ ПУТЬ ОБМЕНА Три: 90% СЫВОРОТОЧНОГО СЕРОТОНИНА ЭНТЕРОЦИТАРНОГО ПРОИСХОЖДЕНИЯ
В результате декарбоксилирования Три бактериальной триптофандекарбоксилазой (ЕC: 4.1.1.28) образуется специфичная для микроорганизмов ТриСМ – триптамин. В то же время декарбоксилирование 5-гидрокситриптофана происходит в клетках человека и при этом образуется сигнальная молекула – серотонин (Agus et al., 2018). Триптамин при этом регулирует высвобождение серотонина энтерохромаффинными клетками кишечника, который в свою очередь стимулирует моторику желудочно-кишечного тракта, воздействуя на нейроны энтеральной нервной системы (Roager, Licht, 2018).
Серотонин является одним из главных метаболитов Три и регулирует очень многие физиологические функции, например, принимает участие в регуляции аппетита, секреции инсулина, гемостазе и поддержании тонуса сосудов (van Galen et al., 2018). Следует отметить, что образование более чем 90% серотонина в организме человека происходит именно в кишечнике в энтерохромаффинных клетках (Wang et al., 2020). Однако существует мнение, что ГЭБ непроницаем для данного медиатора, и его основная функция локализована в желудочно-кишечном тракте. Однако сообщалось, что серотонин увеличивает проницаемость ГЭБ, что косвенно влияет на функцию мозга (Abbott, 2000). Микробиота кишечника контролирует серотониновый путь метаболизма Три, благодаря образованию дезоксихолевой кислоты, которая обладает активирующем действием на синтез серотонина (триптофангидроксилаза-1, ЕС: 1.14.16.4) (Agus et al., 2018). Установлено, что у гнотобиотических мышей (безмикробных) было показано снижение серотонина как в толстой кишке, так и в сыворотке крови. Истощенные уровни серотонина представлялось возможным восстановить путем реколонизации несколькими штаммами бактерий, такими как консорциум спорообразующих видов. Кроме того, некоторые роды бактерий, такие как Candida, Streptococcus, Escherichia, Enterococcus и Pseudomonas могут продуцировать серотонин (Evrensel, Ceylan, 2015).
Серотонин модулирует несколько функций иммунных клеток и является известным мощным модулятором иммунных клеток при аутоиммунных заболеваниях посредством нескольких механизмов. Например, было показано, что серотонин подавляет экспрессию MHC класса II и антигенпрезентирующую способность макрофагов. Серотонин также может снижать выработку провоспалительных цитокинов, таких как IL-6 и фактор некроза опухоли α (TNF-α), макрофагами и лимфоцитами (Sittipo et al., 2021).
Серотонин имеет очень важное значение в регуляции перистальтики кишечника и всасывании питательных веществ. Моносахариды пищи стимулируют синтез серотонина энтерохромафинными клетками кишечника. Кроме того, микробиота кишечника продуцирует короткоцепочечные жирные кислоты, например бутират и ацетат, которые, помимо прочего, выполняют сигнальную функцию, индуцируя экспрессию триптофангидроксилазы-1 и продукцию серотонина в клетках кишечника (Maffei, 2021).
Дефицит периферического (кишечного) серотонина и нарушение серотонинергической сигнализации связан с ожирением (van Galen et al., 2021), компульсивным перееданием и развитием депрессии (McCuen-Wurst et al., 2018). Интересно, что синдром дефицита вознаграждения, который связан с дефицитом серотонина имеет патогенетическое значение в развитии саркопении и саркопенического ожирения. При этом именно саркопеническое ожирение является метаболически нездоровой формой ожирения и приводит к стимуляции неопластического роста (Blum et al., 2021).
ЗАКЛЮЧЕНИЕ
Следует отметить, что метаболизм кинуренинов является высококонсервативным во всех эукариотических клетках – от дрожжей до человека (Castro-Portuguez, Sutphin, 2020). Кинурениновый путь имеет две основные ветви, заканчивающиеся продукцией нейроактивного метаболита кинуреновой кислоты или ключевой молекулы всего живого – НАД+. Очевидно, что каждая из ветвей более активна в разных тканях и типах клеток, а при иммунной стимуляции срабатывает так называемый кинурениновый переключатель, который перенаправляет весь системный кинуренин на продукцию НАД+ в иммунных клетках. Важно отметить, что многие метаболиты кинуренинового пути обмена Три являются универсальными сигнальными молекулами (рис. 3).
Они регулируют многие клеточные функции и имеют разнообразный рецепторный аппарат для реализации своих эффектов как в организме человека, так и в симбиотических микроорганизмах. Регуляторная роль ТриСМ кинуренинового пути обмена сделала данный путь одной из основных потенциальных мишеней в изучении патогенеза нейродегенеративных заболеваний, опухолевого роста, развития метаболического синдрома, ожирения, сахарного диабета и старения.
В настоящее время до конца остается не известно, являются ли индольные производные Три исключительно метаболитами микробиотического происхождения. Так, из проанализированных нами литературных источников найдено, что индол-3-пропионат образуется в иммунных клетках (Shestopalov et al., 2021). Однако это происходит при лейкимии, и многие авторы склонны думать, что индольные метаболиты имеют исключительно микробиотическое происхождение (Wei et al., 2021) Кишечные микроорганизмы секретируют множество метаболитов, которые являются сигнальными молекулами, некоторые из них регулируют функцию клеток и проницаемость барьеров, включая ГЭБ. Важно отметить, что продукция микробиотических метаболитов очень динамична и высокоадаптивна к изменяющимся условиям и диетическим предпочтениям (Lee et al., 2015). Существует мнение, что индолы – это метаболиты микроорганизмов, которые они образуют из пищевого Три и с их помощью подавляют микробную репликацию (Lee et al., 2015). Остается не до конца понятно, метаболизируется ли по индольному пути тот Три, который могут продуцировать микроорганизмы кишечника и какой процент микробиотического Три может быть использован для продукции индольных метаболитов.
Серотонин вне сомнения продуцируется как организмом человека, так и микроорганизмами кишечника. Высокие концентрации серотонина продуцируют Escherichia, Enterococcus и Pseudomonas (Sittipo et al., 2021). Кишечный серотонин выполняет местную регуляторную функцию наравне с влиянием на системный сигнальный фон. Серотонин определяет проницаемость ГЭБ (Abbott, 2000) для сигнальных молекул кинуренинового и индольного путей обмена Три.
Следует резюмировать, что многие из метаболитов обмена Три являются сигнальными молекулами. Некоторые из них универсальны для многих живых организмов, часть из них являются межвидовыми или межцарственными сигнальными молекулами. Бóльшая часть ТриСМ оказывает свое регуляторное действие через AhR, но имеются и другие разнообразные варианты сигнальной трансдукции. Роль большинства из ТриСМ еще предстоит изучить. Более 100 лет прошло с момента открытия индола, но мы можем только частично оценить биологическую роль данного вещества. Очень многое требует дополнительного исследования. Однако с уверенностью можно утверждать, что современное понимание роли метаболитов Три очень сильно отличается от того, что мы представляли еще 10–15 лет тому назад.
Список литературы
Abbott N.J. Inflammatory mediators and modulation of blood-brain barrier permeability, cellular and molecular neurobiology // Cell Mol. Neirobiol. 2000. V. 20. P. 131–147. https://doi.org/10.1023/a:1007074420772
Agus A., Planchais J., Sokol H. Gut microbiota regulation of tryptophan metabolism in health and disease // Cell Host Microbe. 2018. V. 23. P. 716–724. https://doi.org/10.1016/j.chom.2018.05.003
Badawy A.A. Tryptophan metabolism: a versatile area providing multiple targets for pharmacological intervention // Egypt. J. Basic Clin. Pharmacol. 2019. V. 9. Art. 101415. https://doi.org/10.32527/2019/101415
Barthelemy A., Sencio V., Soulard D. et al. Interleukin-22 immunotherapy during severe influenza enhances lung tissue integrity and reduces secondary bacterial systemic invasion // Infect. Immun. 2018. V. 86. P. e00706-17. https://doi.org/10.1128/IAI.00706-17
Behl T., Kaur I., Sehgal A. et al. The footprint of kynurenine pathway in neurodegeneration: janus-faced role in Parkinson’s disorder and therapeutic implications // Int. J. Mol. Sci. 2021. V. 22. P. 6737. https://doi.org/10.3390/ijms22136737
Blum K., Gold M., Lianos-Gomez L. et al. Hypothesizing nutrigenomic-based precision anti-obesity treatment and prophylaxis: should we be targeting sarcopenia induced brain dysfunction? // Int. J. Environ. Res. Publ. Health. 2021. V. 18. P. 9774. https://doi.org/10.3390/ijerph18189774
Bock K.W. Human and rodent aryl hydrocarbon receptor (AHR): from mediator of dioxin toxicity to physiologic AhR functions and therapeutic options // Biol. Chem. 2017. V. 398. P. 455–464. https://doi.org/10.1515/hsz-2016-0303
Carbonnelle-Puscian A., Copie-Bergman C., Baia M. et al. The novel immunosuppressive enzyme IL4I1 is expressed by neoplastic cells of several B-cell lymphomas and by tumor-associated macrophages // Leukemia. 2009. V. 23. P. 952–960. https://doi.org/10.1038/leu.2008.380
Carpenedo R., Pittaluga A., Cozzi A. et al. Presynaptic kynurenate-sensitive receptors inhibit glutamate release // Eur. J. Neurosci. 2001. V. 13. P. 2141–2147. https://doi.org/10.1046/j.0953-816X.2001.01592.x
Castro-Portuguez R., Sutphin G.L. Kynurenine pathway, NAD+ synthesis, and mitochondrial function: targeting tryptophan metabolism to promote longevity and healthspan // Experim. Gerontol. 2020. V. 132. P. 110841. https://doi.org/10.1016/j.exger.2020.110841
Cecchi M., Paccosi S., Silvano A. et al. Dexamethasone induces the expression and function of tryptophan-2-3-dioxygenase in SK-Mel-28 melanoma cells // Pharmaceuticals (Basel). 2021. V. 14 (3). P. 211. https://doi.org/10.3390/ph14030211
Cénit M.C., Matzaraki V., Tigchelaar E. et al. Rapidly expanding knowledge on the role of the gut microbiome in health and disease // Biochim. Biophys. Acta – Mol. Basis Dis. 2014. V. 1842. P. 1981–1992. https://doi.org/10.1016/j.bbadis.2014.05.023
Cervenka I., Agudelo L.Z., Ruas J.L. Kynurenines: tryptophan’s metabolites in exercise, inflammation, and mental health // Science. 2017. V. 357. P. eaaf9794. https://doi.org/10.1126/science.aaf9794
Chen M., Yang X., Lai X. et al. Structural investigation for optimization of anthranilic acid derivatives as partial FXR agonists by in silico approaches // Int. J. Mol. Sci. 2016. V. 17. P. 536. https://doi.org/10.3390/ijms17040536
Chen Y., Guillemin G.J. Kynurenine pathway metabolites in humans: disease and healthy states // Int. J. Tryptophan Res. 2009. V. 2. P. 1–19. https://doi.org/10.4137/ijtr.s2097
Chimerel C., Emery E., Summers D. et al. Bacterial metabolite indole modulates incretin secretion from intestinal enteroendocrine L cells // Cell Rep. 2014. V. 9. P. 1202–1208. https://doi.org/10.1016/j.celrep.2014.10.032
Connor T.J., Neasa S., Sullivan J. et al. Induction of indolamine 2,3-dioxygenase and kynurenine 3-monooxygenase in rat brain following a systemic inflammatory challenge: a role for IFN-gamma? // Neurosci. Lett. 2008. V. 441 (1). P. 29–34. https://doi.org/10.1016/j.neulet.2008.06.007
Deng Y., Lim A., Lee J. et al. Diffusible signal factor (DSF) quorum sensing signal and structurally related molecules enhance the antimicrobial efficacy of antibiotics against some bacterial pathogens // BMC Microbiol. 2014. V. 14. P. 51. https://doi.org/10.1186/1471-2180-14-51
Díez-Sainz E., Lorente-Cebrian S., Aranaz P. et al. Potential mechanisms linking food-derived microRNAs, gut microbiota and intestinal barrier functions in the context of nutrition and human health // Front. Nutr. 2021. V. 8. P. 586564. https://doi.org/10.3389/fnut.2021.586564
Ehrlich A.M., Pacheco A., Henrick B. et al. Indole-3-lactic acid associated with Bifidobacterium-dominated microbiota significantly decreases inflammation in intestinal epithelial cells // BMC Microbiol. 2020. V. 20. P. 356. https://doi.org/10.1186/s12866-020-02023-y
Evrensel A., Ceylan M.E. The gut-brain axis: the missing link in depression // Clin. Psychopharmacol. Neurosci. 2015. V. 13. P. 239–244. https://doi.org/10.9758/cpn.2015.13.3.239
Ferreira F.S., Santos T., Junior O. et al. Quinolinic acid impairs redox homeostasis, bioenergetic, and cell signaling in rat striatum slices: prevention by coenzyme Q10 // Neurotox. Res. 2022. V. 40. P. 473–484. https://doi.org/10.1007/s12640-022-00484-9
van Galen K.A., Horst K., Booij J. et al. The role of central dopamine and serotonin in human obesity: lessons learned from molecular neuroimaging studies // Metabolism: Clin. Experim. 2018. V. 85. P. 325–339. https://doi.org/10.1016/j.metabol.2017.09.007
van Galen K.A., Horst K.W., Serlie M.J. Serotonin, food intake, and obesity // Obesity Rev. 2021. V. 22. P. e13210. https://doi.org/10.1111/obr.13210
Gao K., Mu C., Farzi A. et al. Tryptophan metabolism: a link between the gut microbiota and brain // Adv. Nutr. 2020. V. 11. P. 709–723. https://doi.org/10.1093/advances/nmz127
Grifka-Walk H.M., Jenkins B.R., Kominsky D.J. Amino acid Trp: the far out impacts of host and commensal tryptophan metabolism // Front. Immunol. 2021. V. 12. P. 653208. https://doi.org/10.3389/fimmu.2021.653208
Guo J., Williams D., Puhl H. et al. Inhibition of N-type calcium channels by activation of GPR35, an orphan receptor, heterologously expressed in rat sympathetic neurons // J. Pharmacol. Experim. Therap. 2008. V. 324. P. 342–351. https://doi.org/10.1124/jpet.107.127266
Gutiérrez-Vázquez C., Quintana F.J. Regulation of the immune response by the aryl hydrocarbon receptor // Immunity. 2018. V. 48 (1). P. 19–33. https://doi.org/10.1016/j.immuni.2017.12.012
Hendrikx T., Schnabl B. Indoles: metabolites produced by intestinal bacteria capable of controlling liver disease manifestation // J. Int. Med. 2019. V. 286. P. 32–40. https://doi.org/10.1111/joim.12892
Jones S.P., Guillemin G.J., Brew B.J. The kynurenine pathway in stem cell biology // Int. J. Tryptophan Res. 2019. V. 6. P. 57–66. https://doi.org/10.4137/IJTR.S12626
Kita T., Morrison P., Heyes M. et al. Effects of systemic and central nervous system localized inflammation on the contributions of metabolic precursors to the L-kynurenine and quinolinic acid pools in brain // J. Neurochem. 2002. V. 82. P. 258–268. https://doi.org/10.1046/j.1471-4159.2002.00955.x
Konopelski P., Mogilnicka I. Biological effects of indole-3-propionic acid, a gut microbiota-derived metabolite, and its precursor tryptophan in mammals’ health and disease // Int. J. Mol. Sci. 2022. V. 23. P. 1222. https://doi.org/10.3390/ijms23031222
Krishnan S., Ding Y., Saedi N. et al. Erratum: gut microbiota-derived tryptophan metabolites modulate inflammatory response in hepatocytes and macrophages // Cell Rep. 2018. V. 23. P. 1099–1111. https://doi.org/10.1016/j.celrep.2019.08.080
Kumar P., Lee J.H., Lee J. Diverse roles of microbial indole compounds in eukaryotic systems // Biol. Rev. 2021. V. 96. P. 2522–2545. https://doi.org/10.1111/brv.12765
Labadie B.W., Bao R., Luke J.J. Reimagining IDO pathway ion axis // Clin. Cancer Res. 2019. V. 25. P. 1462–1471. https://doi.org/10.1158/1078-0432.CCR-18-2882
Lee J.H., Wood T.K., Lee J. Roles of indole as an interspecies and interkingdom signaling molecule // Trends Microbiol. 2015. V. 23. P. 707–718. https://doi.org/10.1016/j.tim.2015.08.001
Maffei M.E. 5-hydroxytryptophan (5-htp): Natural occurrence, analysis, biosynthesis, biotechnology, physiology and toxicology // Int. J. Mol. Sci. 2021. V. 22. P. 181. https://doi.org/10.3390/ijms22010181
Mangge H., Summers K., Mrinitzer A. et al. Obesity-related dysregulation of the tryptophan-kynurenine metabolism: role of age and parameters of the metabolic syndrome // Obesity. 2014. V. 22. P. 195–201. https://doi.org/10.1002/oby.20491
Marszalek-Grabska M. et al. Kynurenine emerges from the shadows – current knowledge on its fate and function // Pharmacol. Therap. 2021. V. 225. P. 107845. https://doi.org/10.1016/j.pharmthera.2021.107845
Marszalek-Grabska M., Stachniuk A., Iwaniak P. et al. Unexpected content of kynurenine in mother’s milk and infant formulas // Sci. Rep. 2022. V. 12. P. 6464. https://doi.org/10.1038/S41598-022-10075-5
McCuen-Wurst C., Ruggieri M., Allison K.C. Disordered eating and obesity: associations between binge-eating disorder, night-eating syndrome, and weight-related comorbidities // Ann. N.Y. Acad. Sci. 2018. V. 1411. P. 96–105. https://doi.org/10.1111/nyas.13467
de Mello V.D., Paananen J., Lindstrom J. et al. Indolepropionic acid and novel lipid metabolites are associated with a lower risk of type 2 diabetes in the Finnish diabetes prevention study // Sci. Rep. 2017. V. 7. P. 46337. https://doi.org/10.1038/srep46337
O’Mahony S.M., Clarke G., Borre Y.E. et al. Serotonin, tryptophan metabolism and the brain–gut–microbiome axis // Behav. Brain Res. 2015. V. 277. P. 32–48. https://doi.org/10.1016/j.bbr.2014.07.027
Opitz C.A., Litzenburger U., Sahm F. et al. An endogenous tumour-promoting ligand of the human aryl hydrocarbon receptor // Nature. 2011. V. 478. P. 197–203. https://doi.org/10.1038/nature10491
Platten M., Nollen E., Rohrig U. et al. Tryptophan metabolism as a common therapeutic target in cancer, neurodegeneration and beyond // Nat. Rev. Drug Dis. 2019. V. 18. P. 379–401. https://doi.org/10.1038/s41573-019-0016-5
Qiao P., Zhang C., Yu J. et al. Quinolinic acid, a tryptophan metabolite of the skin microbiota, negatively regulates NLRP3 inflammasome through AhR in psoriasis // J. Invest. Dermatol. 2022. V. 142. P. 2184–2193. https://doi.org/10.1016/j.jid.2022.01.010
Roager H.M., Licht T.R. Microbial tryptophan catabolites in health and disease // Nat. Commun. 2018. V. 9. P. 3294. https://doi.org/10.1038/s41467-018-05470-4
Sas K., Szabó E., Vécsei L. Mitochondria, oxidative stress and the kynurenine system, with a focus on ageing and neuroprotection // Molecules. 2018. V. 23. P. 191. https://doi.org/10.3390/molecules23010191
Savitz J. The kynurenine pathway: a finger in every pie // Mol. Psych. 2020. V. 25. P. 131–147. https://doi.org/10.1038/s41380-019-0414-4
Shestopalov A.V., Shatova O.P., Komarova E.F. et al. Features of metabolic coupling in the “superorganism” system (host–microbiota) // Crim. J. Experim. Clin. Med. 2020a. V. 10. P. 95–103. https://doi.org/10.37279/2224-6444-2020-10-2-95-103
Shestopalov A.V., Shatova O.P., Karbyshev M.S. et al. “Kynurenine switch” and obesity // Bull. Siberian Med. 2020b. V. 4. P. 103–111. https://doi.org/10.20538/1682-0363-2021-4-103-111
Shestopalov A.V. et al. Coupling features of intestinal and serum indole pools in obesity // Prob. Biol. Med. Pharm. Chem. 2021. V. 24. P. 3–12. https://doi.org/10.29296/25877313-2021-10-01
Silva S., Shimizu J., Oliveira D. et al. A diarylamine derived from anthranilic acid inhibits ZIKV replication // Sci. Rep. 2019. V. 9. P. 17703. https://doi.org/10.1038/s41598-019-54169-z
Sittipo P. Brain profiling in murine colitis and human epilepsy reveals neutrophils and TNFα as mediators of neuronal hyperexcitability // J. Neuroinflamm. 2021. V. 19. P. 154. https://doi.org/10.1186/s12974-022-02510-1
Song S., Yin W., Sun X. et al. Anthranilic acid from Ralstonia solanacearum plays dual roles in intraspecies signaling and inter-kingdom communication // ISME J. 2020. V. 14. P. 2248–2260. https://doi.org/10.1038/s41396-020-0682-7
Stone T.W., Perkins M.N. Quinolinic acid: a potent endogenous excitant at amino acid receptors in CNS // Eur. J. Pharmacol. 1981. V. 72. P. 411–412. https://doi.org/10.1016/0014-2999(81)90587-2
Sun M., Ma N., He T. et al. Tryptophan (Trp) modulates gut homeostasis via aryl hydrocarbon receptor (AhR) // Crit. Rev. Food Sci. Nutr. 2020. V. 60. P. 1760–1768. https://doi.org/10.1080/10408398.2019.1598334
Szelest M., Walczak K., Plech T. A new insight into the potential role of tryptophan-derived AhR ligands in skin physiological and pathological processes // Int. J. Mol. Sci. 2021. V. 22. P. 1104. https://doi.org/10.3390/ijms22031104
Thomas T., Stefanoni D., Reisz J. et al. COVID-19 infection alters kynurenine and fatty acid metabolism, correlating with IL-6 levels and renal status // JCI Insight. 2019. V. 5. P. e140327. https://doi.org/10.1172/JCI.INSIGHT.140327
Tunaru S., Kero J., Schaub A. et al. PUMA-G and HM74 are receptors for nicotinic acid and mediate its anti-lipolytic effect // Nat. Med. 2003. V. 9. P. 352–355. https://doi.org/10.1038/nm824
Vamos E., Pardutz A., Klivenyi P. et al. The role of kynurenines in disorders of the central nervous system: possibilities for neuroprotection // J. Neurol. Sci. 2009. V. 283. P. 21–27. https://doi.org/10.1016/j.jns.2009.02.326
Venkatesh M., Mukherjee S., Wang H. et al. Symbiotic bacterial metabolites regulate gastrointestinal barrier function via the xenobiotic sensor PXR and toll-like receptor 4 // Immunity. 2014. V. 41. P. 296–310. https://doi.org/10.1016/j.immuni.2014.06.014
Vyhlídalová B., Krrasulova K., Pecinkova P. et al. Gut microbial catabolites of tryptophan are ligands and agonists of the aryl hydrocarbon receptor: a detailed characterization // Int. J. Mol. Sci. 2020. V. 21. P. 2614. https://doi.org/10.3390/ijms21072614
Wang S.Z., Yu Y.J., Adeli K. Role of gut microbiota in neuroendocrine regulation of carbohydrate and lipid metabolism via the microbiota–gut–brain–liver axis // Microorganisms. 2020. V. 8. P. 527. https://doi.org/10.3390/microorganisms8040527
Wei G.Z., Martin K.A., Xing P.Y. et al. Tryptophan-metabolizing gut microbes regulate adult neurogenesis via the aryl hydrocarbon receptor // PNAS USA. 2021. V. 118 (27). P. e2021091118. https://doi.org/10.1073/pnas.2021091118
Wolf A.M., Wolf D., Rumpold H. et al. Overexpression of indoleamine 2,3-dioxygenase in human inflammatory bowel disease // Clin. Immunol. 2004. V. 113. P. 47–55. https://doi.org/10.1016/j.clim.2004.05.004
Zádori D., Klivenyi P., Szalardy L. et al. Mitochondrial disturbances, excitotoxicity, neuroinflammation and kynurenines: novel therapeutic strategies for neurodegenerative disorders // J. Neurol. Sci. 2012. V. 322. P. 187–191. https://doi.org/10.1016/j.jns.2012.06.004
Zunszain P.A., Anacker C., Cattaneo A. et al. Interleukin-1β: a new regulator of the kynurenine pathway affecting human hippocampal neurogenesis // Neuropsychopharmacology. 2012. V. 37. P. 939–949. https://doi.org/10.1038/npp.2011.277
Дополнительные материалы отсутствуют.
Инструменты
Успехи современной биологии