Как правило, инструментальный химический анализ проб сложного состава включает процедуры разделения и концентрирования с целью устранения мешающего влияния матричных компонентов проб и снижения пределов обнаружения целевых аналитов. Однако такая пробоподготовка остается наиболее длительной и трудоемкой в общей схеме химического анализа и предполагает большой расход реагентов и проб на ее выполнение.
Новые возможности для инструментального химического анализа открыли методы жидкостной микроэкстракции, обеспечивающие возможность эффективного предконцентрирования целевых аналитов, миниатюризацию и экологическую безопасность пробоподготовки [1–3]. Миниатюризация состоит в уменьшении масштабов процедур на всех стадиях выполнения анализа с целью снижения расходов проб, реагентов и образующихся отходов и, как следствие, повышения его экологической безопасности. Повысить экспрессность жидкостной микроэкстракции возможно путем ее автоматизации на принципах проточных методов, в которых основной акцент сделан на замену ручных рутинных процедур, составляющих основу стадии пробоподготовки, простыми легко автоматизируемыми операциями объединения и смешения потоков пробы, растворов реагентов и экстрагентов [4–6].
В последнее время особое внимание уделяют поиску и разработке новых эффективных экстракционных систем для выделения различных классов аналитов, в том числе в условиях проточного анализа [7]. К “зеленым” экстрагентам последнего поколения относят глубокие эвтектические растворители (ГЭР) [8, 9]. Такие экстрагенты состоят из двух или более прекурсоров, которые способны образовывать между собой водородные связи, что приводит к существенному снижению температуры плавления ГЭР по сравнению с температурами плавления исходных компонентов. Как правило, ГЭР находятся в жидком состоянии при нормальных условиях. Комбинируя прекурсоры ГЭР можно получать “дизайнерские” гидрофобные [10] и гидрофильные [11] растворители с требуемыми экстракционными свойствами.
Фторхинолоны находят обширное применение при фармакотерапии широкого круга заболеваний человека и животных. Выведение фторхинолонов и их метаболитов из организма осуществляется почками, главным образом в неизменном виде [12], поэтому фторхинолоны попадают в сточные воды и загрязняют объекты окружающей среды. Важной задачей является разработка экспрессных и чувствительных способов определения антибиотиков в сточных водах.
Цель данной работы − разработка автоматизированного способа дисперсионной жидкостной микроэкстракции в ГЭР, реализуемого на принципах циклического инжекционного анализа (ЦИА). Способ предполагает диспергирование экстрагента газовой фазой (углекислым газом), которая образуется in situ в экстракционной камере проточного анализатора. С целью подтверждения эффективности предложенного способа дисперсионной жидкостной микроэкстракции изучали возможность выделения антибиотиков фторхинолонового ряда (офлоксацина, флероксацина и норфлоксацина) из проб сточных вод для последующего их определения методом высокоэффективной жидкостной хроматографии с флуориметрическим детектированием (ВЭЖХ-ФД).
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Рабочие растворы фторхинолонов (офлоксацина, флероксацина и норфлоксацина) готовили непосредственно перед работой последовательным разбавлением деионизованной водой стандартного раствора (1.0 мг/л), полученного растворением соответствующих навесок аналитов в 0.01 М растворе NaOH. Стандартный раствор фторхинолонов устойчив при хранении в закрытом сосуде в холодильнике при 5°C в течение одного месяца.
Глубокие эвтектические растворители готовили в стеклянном стакане путем смешивания 1 мл гептановой кислоты, 22.4 г расплавленного ментола и 13 мл муравьиной кислоты. Смесь хранили в закрытом сосуде в холодильнике при 5°C.
Фосфатный буферный раствор (pH 6.4) готовили перед анализом путем смешивания 0.05 М раствора Na2HPO4 и 0.05 М раствора NaH2PO4 в соотношении 1 : 3.
Все реактивы имели квалификацию не ниже ч. д. а.
Пробы сточных вод получали из ГУП “Водоканал Санкт-Петербурга”. Перед анализом все пробы предварительно фильтровали через фильтр “синяя лента”.
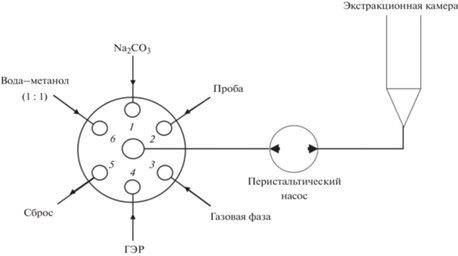
Гидравлическая схема ЦИА (рис. 1) включала: соленоидный кран-переключатель (Cole-Parmer, США); перистальтический насос (MasterFlex L/S, Cole-Parmer, США), обеспечивающий реверс направления потока (скорость потока – от 0.5 до 6.0 мл/мин); экстракционную камеру – полипропиленовую трубку конусообразной формы объемом 5 мл; трубки для коммуникаций из политетрафторэтилена (внутренний диаметр 0.5 мм). Система управлялась с помощью компьютера.
Хроматографический анализ выполняли с помощью жидкостного хроматографа с флуориметрическим детектором LC-20 (Shimadzu, Япония). Для определения фторхинолонов устанавливали длины волн возбуждения и флуоресценции 278 и 466 нм соответственно. Хроматографическое разделение осуществляли на колонке Luna C18 (250 × 4.6 мм, размер частиц 5 мкм, Phenomenex, США) в изократическом режиме при 40°C. Подвижная фаза представляла собой смесь метанола и фосфатного буферного раствора (рН 6.4) в соотношении 45 : 55. Скорость потока подвижной фазы составляла 0.7 мл/мин. Времена удерживания норфлоксацина, флероксацина и офлоксацина составляли 6.3, 9.7 и 11.3 мин соответственно.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
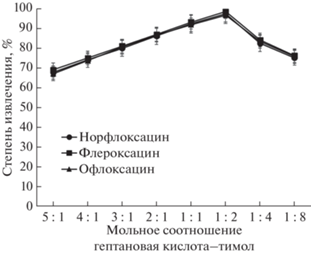
На предварительном этапе для микроэкстракционного выделения фторхинолонов в статических условиях изучали возможность применения гидрофобных ГЭР на основе тимола и гептановой кислоты с различным соотношением прекурсоров. Тимол широко применяется в качестве акцептора водородной связи для приготовления устойчивых в водной фазе ГЭР [13]. Гептановую кислоту выбрали в качестве донора водородной связи, поскольку она обеспечивает возможность получения менее вязких ГЭР по сравнению с более длинноцепочечными карбоновыми кислотами. Высокая вязкость растворителей ограничивает их применение в проточном анализе. ГЭР и водный раствор аналитов (200 мкг/л) встряхивали при соотношении фаз 1 : 30 в течение 5 мин, после чего выполняли хроматографический анализ полученных фаз. Установили, что максимальные степени извлечения наблюдаются при мольном соотношении гептановой кислоты и тимола 1 : 2 соответственно (рис. 2).
Рис. 2.
Влияние состава глубокого эвтектического растворителя на эффективность экстракции фторхинолонов (концентрация аналитов 200 мкг/л).
Для автоматизации дисперсионной жидкостной микроэкстракции фторхинолонов в ГЭР разработали гидравлическую схему (рис. 1), которая предполагает коммутацию крана-переключателя, перистальтического насоса и сообщающейся с атмосферой экстракционной камеры. Схема обеспечивает возможность диспергирования фазы ГЭР потоком углекислого газа, который образуется в результате химической реакции гидрокарбонат-ионов с прекурсором ГЭР непосредственно в экстракционной камере.
Учитывая необходимость в доноре протонов для реакции образования углекислого газа в присутствии гидрокарбонат-ионов, в состав ГЭР на основе гептановой кислоты и тимола (1 : 2) вводили муравьиную/уксусную кислоту, которая растворяется и в водной фазе, и в фазе ГЭР. Муравьиную/уксусную кислоту вводили в ГЭР в количествах, необходимых для полной нейтрализации водной фазы, чтобы обеспечить условия для извлечения молекулярных форм аналитов. Установили, что в присутствии муравьиной кислоты наблюдается более интенсивное выделение углекислого газа и перемешивание фаз (диспергирование) в экстракционной камере, так как этот прекурсор ГЭР является более сильной кислотой, чем уксусная (pKa 3.75 и 4.76 соответственно).
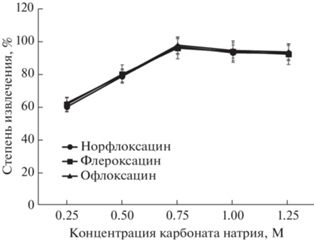
Карбонат натрия использовали как источник гидрокарбонат-ионов в растворе пробы. Для оптимизации концентрации карбоната натрия в водной фазе проводили серию экспериментов в условиях ЦИА. В экстракционной камере последовательно смешивали 2 М раствор Na2CO3 (0.6, 1.3, 1.9, 2.5, 3.1 мл) с водным раствором антибиотиков (4.4, 3.7, 3.1, 2.5, 1.9 мл). Далее в экстракционную камеру подавали ГЭР на основе тимола и гептановой кислоты (100 мкл; мольное соотношение 1 : 2) и муравьиной кислоты (от 100 до 490 мкл). Результаты, представленные на рис. 3, показывают, что оптимальная концентрация Na2CO3 составляет 0.75 М, так как, начиная с этой концентрации, степени извлечения аналитов достигают максимального значения, и дальнейшее увеличение концентрации реагента не влияет на эффективность массопереноса.
Рис. 3.
Влияние концентрации карбоната натрия на эффективность экстракции фторхинолонов (концентрация аналитов 200 мкг/л).
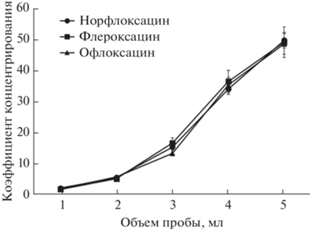
Объем пробы влияет на соотношение фаз и достигаемые коэффициенты концентрирования. С целью снижения пределов обнаружения изучили возможность увеличения соотношения объемов фаз. Для этого в экстракционную камеру последовательно подавали порции 2 М раствора Na2-CO3 и водного раствора аналитов в различных соотношениях, получая в результате от 1 до 5 мл водной фазы с постоянными концентрациями Na2CO3 (0.75 М) и аналитов (200 мкг/л). Далее к полученному раствору добавляли трехкомпонентный ГЭР, состоящий из тимола и гептановой кислоты (мольное соотношение 1 : 2) и муравьиной кислоты (от 60 до 295 мкл). Как видно из рис. 4, объем водной фазы 5 мл обеспечивает максимальные коэффициенты концентрирования. Дальнейшее увеличение объема пробы невозможно, так как при этом происходит частичное растворение фазы экстрагента в пробе, что затрудняет отбор органической фазы и приводит к невоспроизводимым результатам.
Рис. 4.
Влияние объема пробы на эффективность экстракции фторхинолонов (концентрация аналитов 200 мкг/л).
Изучали влияние времени разделения фаз в экстракционной камере на прецизионность в интервале от 30 с до 10 мин. При этом дополнительно в экстракционную камеру подавали поток атмосферного воздуха (скорость потока 3.0 мл/мин), который инициировал разрушение эмульсии. При перемешивании фаз в течение менее 5 мин значения sr составляли от 20 до 45%. Для воспроизводимого разделения фаз требовался барботаж в течение 5 мин, при этом sr ≤ 10%.
На основании полученных результатов разработали способ определения фторхинолонов в водных средах. На первом этапе с помощью перистальтического насоса через кран-переключатель в экстракционную камеру подавали 1.9 мл 2 М раствора Na2CO3 (канал 1) и 3.1 мл пробы (канал 2). Для перемешивания двух растворов в камеру в течение 20 с подавали атмосферный воздух (канал 3). Далее вводили 390 мкл ГЭР (гептановая кислота, ментол и муравьиная кислота, 1 : 2 : 48) (канал 4), после чего подавали атмосферный воздух в течение 5 мин. Скорость потоков составляла 3.0 мл/мин. На втором этапе (после разделения фаз) с помощью перистальтического насоса выполняли слив нижней (водной) фазы из камеры, а фазу экстракта перекачивали в виалу для последующего ВЭЖХ-ФД-анализа. На заключительном этапе проводили промывку всех коммуникаций системы смесью метанола и дистиллированной воды (1 : 1) (канал 6).
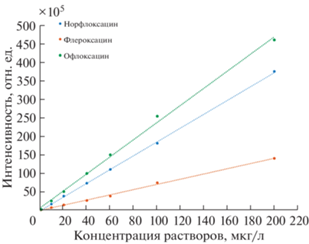
Для построения градуировочных зависимостей (рис. 5) использовали стандартные растворы аналитов, которые проводили через все стадии микроэкстракции. Способ обеспечил диапазоны определяемых концентраций офлоксацина, флероксацина и норфлоксацина от 1 до 200 мкг/л при объеме пробы 5 мл. Пределы обнаружения (3σ) для всех аналитов составили 0.3 мкг/л, пределы определения (10σ) для всех аналитов – 1 мкг/л. Для этого уровня концентраций соотношение сигнал/шум составило 8, 11 и 16 для норфлоксацина, флероксацина и офлоксацина соответственно. Относительная неисключенная систематическая погрешность для уровня концентраций аналитов 1 мкг/л не превышала ±20% (P = = 0.95). При этом значения sr внутрилабораторной прецизионности не превышали 9% (n = 6). Производительность пробоподготовки – 10 проб в час. Время хроматографического анализа – 20 мин. Способ позволил исключить ручные манипуляции и стадию центрифугирования.
Аналитические возможности способа подтверждены при анализе сточных вод. В пробах антибиотики не были обнаружены (табл. 1). Правильность полученных результатов проверяли методом введено−найдено. Хроматограммы, полученные при анализе сточной воды с различными добавками офлоксацина, флероксацина и норфлоксацина, представлены на рис. 6. Относительную степень извлечения фторхинолонов рассчитывали по формуле:
Таблица 1.
Результаты анализа сточных вод (n = 3, P = 0.95)
| Образец сточной воды | Аналит | Введено, мкг/л |
Найдено, мкг/л |
Относительная степень извлечения, % |
|---|---|---|---|---|
| № 1 | Норфлоксацин | 0 | <ПО* | |
| 15 | 12.1 ± 1.2 | 81 | ||
| 30 | 25.0 ± 1.5 | 83 | ||
| 45 | 38.6 ± 1.9 | 86 | ||
| Флероксацин | 0 | <ПО | ||
| 15 | 13.5 ± 1.4 | 90 | ||
| 30 | 24.4 ± 0.8 | 81 | ||
| 45 | 38.7 ± 2.1 | 86 | ||
| Офлоксацин | 0 | <ПО | ||
| 15 | 13.2 ± 0.9 | 88 | ||
| 30 | 25.6 ± 1.2 | 85 | ||
| 45 | 37.4 ± 0.9 | 83 | ||
| № 2 | Норфлоксацин | 0 | <ПО | |
| 15 | 14.7 ± 0.8 | 98 | ||
| 30 | 27.1 ± 1.0 | 90 | ||
| 45 | 41.7 ± 1.5 | 93 | ||
| Флероксацин | 0 | <ПО | ||
| 15 | 13.7 ± 0.7 | 91 | ||
| 30 | 28.6 ± 1.3 | 95 | ||
| 45 | 40.5 ± 1.0 | 90 | ||
| Офлоксацин | 0 | <ПО | ||
| 15 | 14.8 ± 0.9 | 99 | ||
| 30 | 27.7 ± 0.6 | 92 | ||
| 45 | 41.2 ± 1.4 | 92 | ||
| № 3 | Норфлоксацин | 0 | <ПО | |
| 15 | 12.6 ± 0.7 | 84 | ||
| 30 | 24.7 ± 1.2 | 82 | ||
| 45 | 40.0 ± 1.4 | 89 | ||
| Флероксацин | 0 | <ПО | ||
| 15 | 13.4 ± 1.1 | 89 | ||
| 30 | 26.0 ± 0.9 | 87 | ||
| 45 | 39.7 ± 1.3 | 88 | ||
| Офлоксацин | 0 | <ПО | ||
| 15 | 13.9 ± 0.6 | 93 | ||
| 30 | 26.7 ± 1.0 | 89 | ||
| 45 | 37.3 ± 0.6 | 83 |
Рис. 6.
Хроматограммы, полученные при анализе сточной воды с добавками фторхинолонов (времена удерживания норфлоксацина, флероксацина и офлоксацина: 6.3, 9.7 и 11.3 мин соответственно).
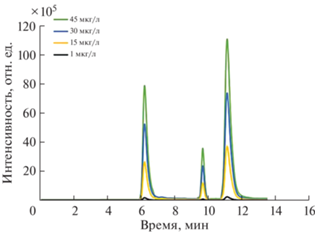
Относительная степень извлечения превышала 81%, что подтверждает отсутствие существенного мешающего влияния компонентов матрицы на извлечение и определение аналитов. В соответствии с данными [14] для уровня концентраций аналита 10 мкг/л значение относительной степени извлечения в диапазоне от 60 до 115% является допустимым.
* * *
Разработан автоматизированный способ дисперсионной жидкостной микроэкстракции, основанный на диспергировании глубокого эвтектического растворителя потоком углекислого газа, который образуется в результате химической реакции. Представлена гидравлическая схема для реализации дисперсионной жидкостной микроэкстракции на принципах циклического инжекционного анализа. Для микроэкстракционного выделения офлоксацина, флероксацина и норфлоксацина изучена возможность применения глубокого эвтектического растворителя на основе ментола, гептановой и муравьиная кислот. Предложенный способ определения фторхинолонов в сточных водах обеспечивает пределы обнаружения (0.3 мкг/л), сопоставимые с приведенными в работах [15–17]. В отличие от описанных ранее способов дисперсионной микроэкстракции, разработанный способ исключает необходимость применения токсичных экстрагентов, полярных растворителей для диспергирования экстрагентов и центрифугирования для разделения фаз.
Авторы выражают благодарность РНФ (№ 21-13-00020, https://rscf.ru/project/21-13-00020/) за финансовую поддержку в проводимых исследованиях, а также ГУП “Водоканал Санкт-Петербурга” за предоставленные пробы.