Автоматика и телемеханика, № 1, 2021
© 2021 г. А.В. МАТВЕЕВ, канд. физ.-мат. наук (matav@mail.ru)
(Омский государственный университет им. Ф.М. Достоевского)
МАТЕМАТИЧЕСКОЕ МОДЕЛИРОВАНИЕ КИНЕТИКИ
ЙОДСОДЕРЖАЩИХ РАДИОФАРМПРЕПАРАТОВ
В ЗАДАЧАХ ЯДЕРНОЙ МЕДИЦИНЫ
Рассмотрены методы моделирования и разработан единый подход к
построению математических моделей кинетики радиофармпрепаратов с
изотопами йода в организме человека при диагностических и терапевти-
ческих процедурах ядерной медицины. Предложены различные способы
идентификации модельных параметров на основе количественных дан-
ных радионуклидных исследований функционального состояния органов.
Приведены и проанализированы результаты фармакокинетического мо-
делирования при радионуклидной диагностике печени, почек и щитовид-
ной железы с помощью йодсодержащих радиофармпрепаратов. Также об-
суждаются особенности и результаты моделирования и дозиметрического
планирования радиойодтерапии щитовидной железы.
Ключевые слова: математическое моделирование, ядерная медицина, ки-
нетика, радиофармпрепарат, камерная модель.
DOI: 10.31857/S0005231021010086
1. Введение
В настоящее время в ядерной медицине насчитывается более сотни ра-
дионуклидных фармацевтических препаратов (РФП), которые применяются
для диагностики (радионуклидная диагностика) и терапии (радионуклидная
терапия) целого ряда неонкологических и онкологических заболеваний [1-6].
Самым распространенным радионуклидом здесь является технеций (99mTc).
Однако РФП, меченные им, находят применение только для целей диагно-
стики. Второе место занимают препараты, меченные радиоактивными изото-
пами йода (123I,125I,131I). Причем эти РФП применяются и в диагностике,
и в терапии. Например, изотоп131I, впервые внедренный в 1946 г. для ле-
чения рака щитовидной железы, остается самым эффективным методом для
лечения тиреотоксикоза и злокачественной опухоли щитовидной железы [7].
Для целей радионуклидной диагностики РФП с изотопами йода широ-
ко применяются как в невизуализирующих, так и в визуализирующих мето-
дах [8]. В настоящее время актуальными с практической точки зрения по-
прежнему остаются следующие невизуализирующие методы диагностики с
применением изотопов125I и131I: радиоиммунный анализ, иммунорадиомет-
рический анализ, измерение йодпоглотительной функции щитовидной желе-
зы (радиойодзахват, радиойодметрия), определение объема циркулирующей
147
крови, определение скорости клубочковой фильтрации и эффективного по-
чечного плазматока. В визуализирующих методах используются изотопы123I
и131I в составе разнообразных РФП: для выявления и оценки ЗНО в онколо-
гии (йодорганические РФП, меченые моноклональные антитела), при оценке
метаболизма миокарда (меченые жирные кислоты), при диагностике почек и
мочевыделительной системы (гиппуран), при оценке функциональности пе-
чени и гепатобилиарной системы (бенгалроз), для визуализиции желез в эн-
докринологии (йодорганические РФП, йодид натрия), для сцинтиграфии го-
ловного мозга и оценки мозгового кровообращения (сывороточный альбумин,
йодорганические РФП), для исследования нейротрансмиссии в нейрологии
(меченые радиолиганды, йодорганические РФП).
Радиоизотоп131I уже более 60 лет успешно используется для терапии
(в связи с наличием β-излучения) и диагностики (γ-излучение) заболеваний
щитовидной железы, в том числе дифференцированного рака щитовидной
железы и его метастазов. В последнее десятилетие в нашей стране при про-
ведении радионуклидной диагностики вместо131I начали применять радио-
изотоп123I. Данный изотоп обладает следующими преимуществами по срав-
нению c131I: 1) оптимальный для регистрации спектр энергии γ-излучения -
159 кэВ, 2) отсутствие β-излучения и 3) относительно короткий период полу-
распада, что способствует уменьшению лучевой нагрузки на пациента. Одна-
ко из-за сложностей его производства в непосредственной близости от места
применения (высокая стоимость циклотронного получения) и сильно ограни-
ченного времени его транспортировки в отдаленные от производителя кли-
ники в отечественной медицине до сих пор в диагностике нередко использу-
ется131I.
Одним из основных методов при оценке результатов радионуклидных
исследований, использующих γ-излучение радиоизотопов с энергиями от
нескольких десятков до нескольких сотен кэВ и играющих важную роль в
диагностике структурно-функционального состояния жизненно важных ор-
ганов организма человека, является фармакокинетическое моделирование [9].
Количественные данные о кинетике РФП в организме представляются в
виде фармакокинетических кривых “Активность-время”, которые отражают
пространственно-временные процессы изменения концентрации радиоинди-
катора в зонах интереса и характеризуют скорость процессов “накопления-
выведения” в исследуемом органе или ткани. Это дает возможность про-
следить изменения сцинтиграфических изображений во времени для оценки
функций биосистемы, а также рассчитать соответствующие количественные
показатели, характеризующие различные функции исследуемых органов и
тканей. Сложность же такого моделирования заключается в двух аспектах.
С одной стороны, в чрезмерном упрощении анатомо-физиологических осо-
бенностей организма при разбиении его на кинетические камеры, что может
приводить к потере или искажению значимой для диагностики информации,
с другой - в излишнем учете всех возможных взаимосвязей функциониро-
вания органов и систем, что, наоборот, приведет к появлению избыточного
количества абсолютно бесполезных для клинической интерпретации матема-
тических данных либо модель становится вообще неразрешимой.
148
В настоящей статье вырабатывается единый подход к построению камер-
ных моделей кинетики различных РФП с изотопами йода как при диагно-
стике функционального состояния органов и систем организма с помощью
невизуализирующих и визуализирующих радионуклидных методов, так и при
терапии заболеваний щитовидной железы с помощью радиойода. На основе
данного подхода разработаны фармакокинетические модели и созданы со-
ответствующие им расчетные программы на языке программирования C++
для обработки и оценки результатов радионуклидной диагностики и тера-
пии. В качестве клинических данных, необходимых для идентификации па-
раметров моделирования (транспортных констант), были использованы ре-
зультаты диагностических обследований пациентов радиологического отде-
ления БУЗОО “Областная клиническая больница”. Работа основана на прин-
ципах и методах фармакокинетики (камерное моделирование) [10, 11]. Для
численного решения систем дифференциальных уравнений некоторых моде-
лей автор использовал методы Рунге-Кутты и метод Розенброка [12, 13], а
для нахождения минимума функции нескольких переменных при идентифи-
кации параметров моделирования - метод Хука-Дживса [14, 15].
2. Модель кинетики при исследовании щитовидной железы
и радиойодтерапии
Исследование функционального состояния щитовидной железы по погло-
щению радиоактивных изотопов йода (используется131I или123I) позволяет
оценить внутритиреоидный этап обмена йода в организме, выявить наруше-
ние неорганической и органической фаз его обмена в ткани железы [8]. Суть
метода (радиойодзахват, радиойодметрия) состоит в оценке скорости накоп-
ления радиоизотопа в тиреоидной ткани после перорального приема водного
раствора неорганического РФП “Натрия йодид” (вводимая в организм ди-
агностическая активность A0 может изменяться от 600 кБк до 11 МБк в
зависимости от используемого радиоизотопа и целей исследования). Гамма-
излучение радиойода, захваченного щитовидной железой, регистрируют с по-
мощью тиреорадиометра через 2, 4 и 24 ч после приема РФП. Показатели нор-
мального поглощения РФП щитовидной железой зависят от географических
особенностей местности, поэтому в лабораториях должны быть определены
свои нормативные стандарты [7, 8].
Радиойодметрия широко используется не только как самостоятельный ме-
тод при оценке функциональной активности щитовидной железы, но так-
же при индивидуальном дозиметрическом планировании радиойодтерапии
ее неонкологических и онкологических заболеваний [16, 17]. Успешность про-
ведения радиойодтерапии зависит от того, удалось ли реализовать лечебную
поглощенную дозу в щитовидной железе, которая в свою очередь зависит от
того, насколько точно определена кинетика накопления РФП в ней. Огромное
значение здесь приобретает фармакокинетическое моделирование транспорта
радиойода в организме. Предварительно измеренная на этапе радиойодмет-
рии накопленная активность радиойода в щитовидной железе используется
для идентификации параметров фармакокинетической модели, с помощью
которой удается рассчитать вводимую в организм активность РФП для до-
149
стижения запланированной врачом лечебной поглощенной дозы в щитовид-
ной железе на этапе радиойодтерапии. Особенностям моделирования и дози-
метрического планирования радиойодтерапии посвящены публикации автора
[18, 19].
Для описания фармакокинетики РФП с учетом его перорального по-
ступления в организм автором предложена четырехкамерная модель (из
четырех компартментов), геометрическая схема которой представлена на
рис. 1. Данная модель включает в себя камеру желудочно-кишечного тракта
(Gastro), камеру кровеносной системы (Haema), камеру щитовидной железы
(Thyreoidea) и камеру мочевыделительной системы (Urina). Функции удер-
жания активности РФП в четырех камерах обозначены нами как FG, FH , FT
и FU соответственно.
В публикациях также встречаются и другие модели для описания кинети-
ки РФП при диагностике и терапии щитовидной железы. Например, в [20-23]
рассматриваются модели без камеры желудочно-кишечного тракта, предпо-
лагая мгновенное всасывание РФП в кровь при его пероральном приеме или
внутривенное введение РФП. Отсутствие данной камеры позволяет ввести
разделение камеры щитовидной железы на две камеры по отношению к хи-
мической форме радиойода - неорганическая форма и органическая форма,
что является правильным с точки зрения фармакокинетики. Однако в рам-
ках таких моделей невозможно рассчитать поглощенную радиационную дозу
на желудочно-кишечный тракт, что имеет существенное значение при инди-
видуальном дозиметрическом планировании радиойодтерапии. В публикации
автора [24] дан обзор и проведено сравнение разных камерных моделей при
радионуклидной диагностике и терапии щитовидной железы. Используемая в
данной статье четырехкамерная модель (см. рис. 1) является, с точки зрения
автора, наиболее простой в математическом плане и в тоже время позво-
ляет описать кинетику РФП и осуществить дозиметрическое планирование
радиойодтерапии не хуже других аналогичных моделей.
Математическая интерпретация данной четырехкамерной модели сводит-
ся к следующей системе линейных дифференциальных уравнений первого
порядка:
dFG(t)
= -(KGH + λ)FG(t),
dt
dFH (t)
= KGHFG(t) + KTHFT(t) - (KHT + KHU + λ)FH(t),
dt
(1)
dFT (t)
= KHTFH(t) - (KTH + λ)FT(t),
dt
d
FU (t)
= KHUFH(t) - λFU(t),
dt
где λ - постоянная распада радиойода (0,0036 ч-1 - для131I и 0,0522 ч-1 -
для123I), а KGH , KHT , KTH и KHU - параметры межкамерных коммуни-
каций (см. рис. 1). С фармакокинетической точки зрения, параметры KGH ,
KHT , KTH и KHU задают удельные скорости обмена РФП между соседними
150
KHT
Gastro
KGH
Haema
Thyreoidea
FG
FH
FT
KTH
KHU
A0
Urina
FU
Рис. 1. Геометрическая иллюстрация модели при радиойодметрии и радиой-
одтерапии.
камерами и носят название транспортных констант [10, 11]. В дальнейшем эти
модельные параметры подлежат идентификации на основе индивидуальных
количественных данных радиойодметрии для каждого пациента. Функции
удержания активности в камерах удобно выражать в относительных едини-
цах, принимая введенную активность РФП A0 за условную единицу. Таким
образом, эти функции задают относительную активность РФП в камерах и
могут принимать значения от 0 до 1. С учетом перорального введения РФП
в организм начальные условия для системы уравнений (1) запишутся как
(2)
FG (0) = 1, FH (0) = 0, FT (0) = 0, FU
(0) = 0.
Решение системы уравнений (1) с начальными условиями (2) может быть
найдено аналитически или численно, например с помощью методов Рунге-
Кутты или Розенброка. Аналитическое решение данной системы приведе-
но в [18]. Особенности численного решения с помощью метода Розенбро-
ка рассмотрены в [19]. Автор настоящей статьи разработал программный
комплекс численного решения системы дифференциальных уравнений (1)
в среде Borland C++. Идентификация транспортных констант модели ре-
ализована в программе с помощью функционала невязки, который задает
меру отклонения расчетной (теоретической, модельной) характеристики от
ее клинических значений в заданные моменты времени ti. Для радиойодмет-
рии - это измеренные клиническим тиреорадиометром значения накопленной
активности FT в щитовидной железе через 2, 4 и 24 ч от момента введе-
ния РФП в организм. Функционал невязки в данном случае записывается
в виде:
(
)
∑{
}2
(3)
F
K= KGH,KHT ,KTH,KHU
=
FрасчT(ti) - FклинT(ti)
i=1
при N = 3 (t1 = 2, t2 = 4, t3 = 24 ч). Далее решалась вариационная задача по
нахождению его минимума методом Хука-Дживса:
(4)
δF(K)
F >0
KGH>0,KHT >0,=0,δ2
KTH>0,KHU>0
151
Таблица 1. Рассчитанные индивидуальные фармакокинетические характеристики
Номер
Транспортные константы, ч-1
TH, ч TT , ч tmax, ч Amax/A0
пациента
KGH KHT KTH KHU
1
5,029
0,117
0,018
0,022
5,12
208,66
23,43
0,648
2
3,876
0,084
0,044
0,048
7,00
64,17
15,69
0,392
3
23,430
0,347
0,001
0,042
2,01
201,72
12,06
0,847
4
24,310
0,425
0,001
0,113
1,50
193,33
9,32
0,760
5
5,890
0,064
0,001
0,027
8,21
220,54
34,83
0,578
6
4,590
0,300
0,086
0,232
2,26
26,07
4,39
0,411
7
5,009
0,688
0,020
0,181
1,46
96,71
5,62
0,742
8
5,580
0,092
0,034
0,038
4,41
194,39
20,24
0,449
9
12,980
0,410
0,001
0,315
1,44
180,54
7,21
0,550
10
5,003
0,111
0,001
0,145
3,65
186,71
16,27
0,404
11
9,380
0,323
0,001
0,103
2,08
194,28
11,27
0,723
12
5,670
0,226
0,001
0,155
2,52
188,10
12,29
0,562
13
5,149
0,571
0,001
0,206
1,38
188,26
7,31
0,715
14
6,840
0,122
0,001
0,226
2,56
178,68
12,76
0,327
15
12,870
0,167
0,001
0,117
2,79
191,42
15,10
0,546
16
16,430
0,300
0,001
0,064
2,11
198,97
12,59
0,779
17
5,123
0,312
0,001
0,007
3,00
208,50
14,00
0,917
18
4,577
0,171
0,008
0,091
6,65
129,3
14,50
0,577
19
15,192
0,232
0,038
0,078
2,65
69,10
10,00
0,598
20
11,163
0,263
0,051
0,090
2,75
65,50
9,00
0,581
Среднее
9,405
0,266
0,016
0,115
3,28
159,25
13,39
0,61
значение
при условии положительных значений всех транспортных констант, которые
в данном случае приобретают смысл вариационных параметров. Идентифи-
цированные таким образом значения транспортных констант использовались
для построения кривых “Активность-время” и расчета индивидуальных фар-
макокинетических и дозиметрических характеристик.
В табл. 1 приведены полученные автором значения параметров фармако-
кинетической модели - индивидуальные транспортные константы для 20 па-
циентов, рассчитанные на их основе значения максимальной относительной
активности радиойода в щитовидной железе (Amax/A0) и соответствующие
им промежутки времени от начала исследования (tmax), а также эффектив-
ные периоды полувыведения РФП из плазмы крови (TH ) и щитовидной желе-
зы (TT ). Из данной таблицы видно, что для почти всех рассмотренных нами
пациентов значения их индивидуальных транспортных констант удовлетво-
ряют неравенствам:
KGH > KHT > KHU > KTH.
Эти неравенства находят вполне оправданное фармакокинетическое объяс-
нение о всасывании, распределении, биотрансформации и экскреции фарм-
препарата с учетом его тропности к щитовидной железе. Фармакокинетика
РФП во всех камерах подробно описана в [18].
152
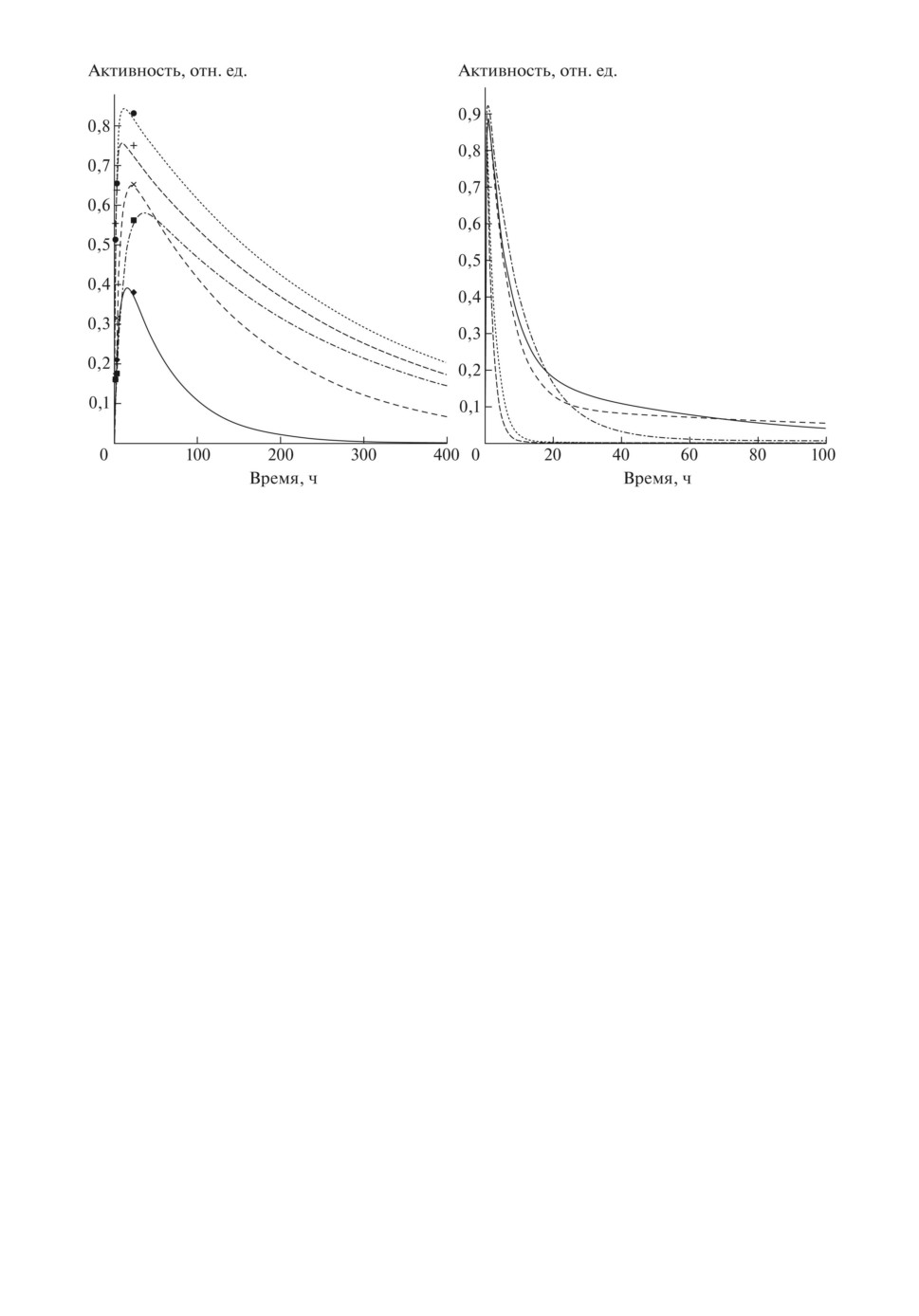
Рис. 2. Кривые “Активность-время” для щитовидной железы и клинические
значения относительной активности радиойода в ней (слева) и кривые кли-
ренса крови (справа). Пояснения даны в тексте.
В качестве примера на рис. 2 приведены рассчитанные кривые “Актив-
ность-время” для щитовидной железы и плазмы крови (клиренс), а также
результаты клинических радиометрических измерений в моменты времени 2,
4 и 24 ч от начала исследования. Для удобства представления результатов
приводим данные только для первых пяти пациентов (табл. 1): пациент № 1 -
разреженная штриховая линия и наклонные крестики, пациент № 2 - сплош-
ная линия и ромбы, пациент № 3 - пунктирная линия и кружки, пациент № 4 -
штриховая линия и крестики, пациент № 5 - штрихпунктирная линия и квад-
ратики.
Как видно из рис. 2 (слева), в модели достигнуто хорошее согласие рас-
четных значений кинетики радиойода в щитовидной железе с клинически-
ми значениями с учетом их погрешности (до 20 %). Сложность в идентифи-
кации транспортных констант и расчете кинетических кривых заключается
в малом количестве клинических радиометрических значений для каждого
пациента (всего три точки). Однако получение большего количества радио-
метрических значений приводит к существенной нагрузке на медицинский
персонал, а также к излишним проблемам для самого пациента (непрерыв-
ное пребывание в стационаре во время исследования, значительные мате-
риальные затраты на обследование и т.д.). Кроме того, для определения
функции радиойодзахвата (гипо-, гипер- или эутиреоз, блокада щитовид-
ной железы и т.п.) в большинстве случаев достаточно трех клинических
радиометрических значений, снятых в строго фиксированные промежутки
времени от начала введения РФП в организм. Для нормальной функции
щитовидной железы относительная активность радиойода в ней составля-
ет: 5-10 %
через 2 ч, 10-19 %
через 4 ч, 10-30 % через 24 ч [7, 8].
153
Уровни поглощения 10-13 % и 27-30 % через 24 ч рассматривают как соот-
ветственно низшая и высшая границы нормы. При диффузно-токсическом
зобе (ДТЗ) или раке максимальное поглощение радиойода в щитовидной же-
лезе в среднем увеличивается до 55-82 %, хотя в некоторых случаях оно
может быть в пределах нормы [7]. Как видно из рис. 2 (слева) и табл. 1
(Amax/A0), для всех пациентов рассчитанные кривые “Активность-время” и
кинетические данные соответствуют гипертиреозу, что характерно для ди-
агноза ДТЗ. При этом времена максимального накопления активности ра-
диойода в щитовидной железе (tmax) и эффективные периоды его полувыве-
дения из нее (TT ), рассчитанные автором, лежат в пределах 4-35 ч и 26-221 ч
соответственно и согласуются с реально наблюдаемыми значениями на
практике [7, 17].
Фармакокинетическая модель позволяет определить кинетику РФП в
органах и тканях, в которых его активность невозможно или затрудни-
тельно измерить клиническими методами. На рис. 2 приведены рассчитан-
ные кривые клиренса крови от РФП, восстановленные по радиометриче-
ским данными поглощенной активности радиойода в щитовидной железе
согласно соотношениям (1)-(4). Камера крови является центральной каме-
рой в фармакокинетической модели и взаимодействует со всеми другими
компартментами. Поэтому кинетика РФП в плазме крови особо чувстви-
тельна к значениям всех четырех транспортных констант, приведенных в
табл. 1. В клинической функциональной диагностике клиренс крови и па-
раметры, его характеризующие, имеют существенное значение при поста-
новке диагноза. Как видно из рис. 2 (справа), на кривых клиренса отчет-
ливо выделяются два участка - быстрый спад активности в плазме кро-
ви (α-фаза) и последующие (после 10-20 ч) медленно убывающие ее зна-
чения (β-фаза) [18]. При этом рассчитанные автором эффективные пери-
оды полувыведения РФП из плазмы крови лежат в пределах от 1 до 9 ч
(см. табл. 1).
Рассчитанные индивидуальные фармакокинетические параметры транс-
порта РФП в организме (табл. 1) и кривые “Активность-время” (рис. 2) в
дальнейшем могут быть использованы для целей дозиметрического планиро-
вания радиойодтерапии неонкологических и онкологических заболеваний щи-
товидной железы у пациентов, в ней нуждающихся (в рассмотренном случае -
это все пациенты с ДТЗ, перечисленные в табл. 1). При этом предполагается,
что кинетика радиойода в организме пациента при введении ему диагности-
ческой и терапевтической активностей РФП одинакова на протяжении всех
проводимых исследований. Как показали ранее авторы публикаций [7, 20, 21]
на основе статистического анализа, выдвинутая гипотеза вполне оправдана.
Методика индивидуального дозиметрического планирования и подходы к на-
значению активности РФП при радиойодтерапии рассмотрены в публикациях
автора [19, 25].
Поглощенные радиационные дозы D в камерах модели (см. рис. 1), соот-
ветствующих органам и тканям (щитовидная железа, желудок, кровь, моче-
вой пузырь), рассчитывались с помощью разработанного автором программ-
ного комплекса на основе индивидуальных фармакокинетических парамет-
154
Таблица 2. Рассчитанные индивидуальные дозиметрические характеристики
Номер Запланированная Индивидуальная
DG, Гр DH, Гр DU , Гр
пациента
доза DT , Гр
активность A0, МБк
1
100
144
0,01
0,02
0,13
2
60
141
0,02
0,04
0,27
3
100
104
0,01
0,01
0,01
4
100
115
0,01
0,01
0,10
5
80
67
0,01
0,02
0,06
6
60
559
0,20
0,02
1,79
7
80
592
0,06
0,03
0,87
8
80
78
0,01
0,01
0,13
9
100
152
0,01
0,01
0,32
10
60
85
0,01
0,01
0,18
11
120
703
0,04
0,04
0,70
12
100
133
0,01
0,01
0,22
13
100
85
0,01
0,01
0,11
14
80
300
0,02
0,02
0,79
15
80
63
0,01
0,01
0,10
16
100
81
0,01
0,01
0,06
17
60
122
0,01
0,01
0,01
18
60
333
0,03
0,02
0,45
19
50
500
0,02
0,05
0,87
20
50
503
0,02
0,05
0,98
Среднее
81
242
0,03
0,02
0,41
значение
ров по интегральным формулам вида [19]
∞
∫
A0 < Eβ >
(5)
D=k
F (t)dt,
m
0
где
< Eβ > - средняя энергия β-частиц распада изотопа
131I, равная
0,19 МэВ/распад, A0 - вводимая терапевтическая активность РФП, m - мас-
са органа или ткани, k - размерный коэффициент. Расчет поглощенной дозы
на мочевой пузырь проводился с учетом его периодического опорожнения в
процессе радиойодтерапии. Формула (5) также использовалась для расчета
индивидуальной вводимой терапевтической активности РФП A0 по заплани-
рованной врачом поглощенной дозе в щитовидной железе DT согласно мето-
дике индивидуального дозиметрического планирования радиойодтерапии.
В табл. 2 приведены основные результаты индивидуального дозиметриче-
ского планирования - индивидуальная вводимая активность РФП, вычислен-
ная по запланированной врачом лечебной поглощенной дозе в щитовидной
железе DT , а также дозовые нагрузки на желудок DG, кровеносную систе-
му DH и мочевой пузырь DU , соответствующие вводимой активности A0.
Запланированная поглощенная доза лежит в пределах 50-120 Гр для всех па-
циентов и коррелирует с предварительными клинико-диагностическими дан-
ными, прежде всего, с объемом щитовидной железы и ее функцией радио-
155
йодзахвата. Как видно из табл. 2, рассчитанная индивидуальная вводимая
активность РФП, необходимая для достижения соответствующих запланиро-
ванных поглощенных доз в щитовидной железе, варьирует от 63 до 703 МБк.
Среднее же ее значение составляет 242 МБк и примерно соответствует стан-
дартной активности РФП, которая вводится в организм всех пациентов, ко-
гда индивидуальное дозиметрическое планирование не проводится (см. [19]).
Как показывают результаты моделирования, при индивидуальном дозимет-
рическом планировании практически отсутствуют случаи недо- или переоб-
лучения ткани щитовидной железы, а дозовые нагрузки на другие органы и
ткани остаются в пределах нормы. Однако, как видно из табл. 2, для па-
циента № 6 получены слишком высокие расчетные значения поглощенной
дозы в желудке (0,20 Гр) и в мочевом пузыре (1,79 Гр), что, несомненно,
связано с его индивидуальными фармакокинетическими характеристиками
и, прежде всего, с быстрым выведением радиойода из щитовидной железы
(у него самая большая константа KTH по сравнению с другими пациентами,
см. табл. 1). При подготовке данного пациента к процедуре радиойодтера-
пии ему необходимо дополнительное диагностическое обследование и более
точное определение функции радиойодзахвата при радиометрии щитовидной
железы.
Следует также отметить, что при терапии рака щитовидной железы вво-
димая в организм активность РФП лежит в пределах от 2000 до 7000 МБк
(значительно выше, чем при ДТЗ). Такие активности приводят к эффектам
абляции ткани щитовидной железы [26]. Рассмотренная выше камерная мо-
дель также может быть использована при радиойодтерапии рака щитовидной
железы. В этом случае необходимо изменить математическую интерпрета-
цию модели, которая будет учитывать эффекты абляции ткани щитовидной
железы и уменьшение ее массы в процессе радиойодтерапии. Особенности
фармакокинетического моделирования и индивидуального дозиметрическо-
го планирования радиойодтерапии дифференцированного рака щитовидной
железы рассматриваются в публикации автора [27].
Таким образом, на основе камерного моделирования показано, что фар-
макокинетические характеристики вводимого в организм РФП для каждого
пациента являются сугубо индивидуальными и не могут быть описаны усред-
ненными кинетическими параметрами. При этом значения поглощенных ра-
диационных доз при радиойодтерапии очень чувствительны к кинетическим
параметрам камерной модели (транспортным константам). Поэтому при ин-
дивидуальном дозиметрическом планировании следует уделять особое вни-
мание получению точных количественных данных ультразвукового исследо-
вания (объем щитовидной железы) и радиойодметрии (значения накопленной
активности в щитовидной железе) и на их основе идентификации параметров
моделирования.
3. Модель кинетики при исследовании печени
Гепатография применяется для изучения поглотительной и выделитель-
ной функции печени с помощью РФП, вводимого в вену [28]. В основе метода
лежит регистрация кинетики двух гепатотропных красок: бенгальского ро-
156
A0
Haema
KHJ
Jecur
KJI
Intestinum
FH
FJ
FI
Рис. 3. Геометрическая иллюстрация модели при гепатографии.
зового (бенгалроз, или калийная соль тетрайодхлорфлюоресцеина) и бром-
сульфалеина, меченных радиоизотопами131I или123I.
С помощью радиометрического прибора (клинический радиограф, радио-
метр) регистрируют три кинетические кривые: клиренс крови (с помощью
датчика, расположенного над областью сердца или у ушной раковины), ге-
патограмму (датчик над правой долей печени) и энтерограмму (в левой по-
ловине эпигастральной области или центральной части живота). Измерение
радиоактивности регистрируют в течение 90 мин, а при серьезных заболе-
ваниях оно может быть продлено до 24 ч. По кривым определяют количе-
ственные параметры, важные для диагностики, такие как время достижения
максимума активности в печени tmax, время продолжительности плато tplat,
время поступления индикатора в кишечник (≥ 20 %) tint, эффективный пе-
риод полуочищения крови от РФП TH и др. [8]. Огромное значение в оценке
этих параметров имеет параллельное кинетическое моделирование транспор-
та РФП в организме.
Для описания кинетики РФП с учетом особенностей регистрации радиоак-
тивности при проведении гепатографии автором предложена трехкамерная
модель (из трех компартментов), геометрическая схема которой представле-
на на рис. 3. Данная математическая модель включает в себя камеру плазмы
крови (Haema), камеру печени с желчными протоками и пузырем (Jecur),
камеру кишечника (Intestinum). Функции удержания активности РФП в ка-
мерах обозначены как FH , FJ и FI соответственно.
Система дифференциальных уравнений в рамках данной модели прини-
мает вид:
dFH (t)
= -(KHJ + λ)FH(t),
dt
dFJ (t)
(6)
= KHJFH(t) - (KJI + λ)FJ(t),
dt
dFI (t)
= KJIFJ(t) - λFI(t).
dt
С клинико-диагностической точки зрения, транспортная константа KHJ
здесь отражает поглотительную функцию печени и задает скорость очищения
крови от РФП, а KJI - выделительную функцию печени и скорость поступ-
ления РФП в двенадцатиперстную кишку. Функции удержания активности
также выражаются в относительных единицах (вводимая в организм актив-
ность A0 составляет 5-15 кБк/кг). С учетом внутривенного введения РФП
начальные условия для системы уравнений (6) запишутся как
(7)
FH (0) = 1, FJ (0) = 0, FI
(0) = 0.
157
Решение системы уравнений (6) с начальными условиями (7) легко нахо-
дится аналитически:
FH = exp(-KHJ t) · exp(-λt),
KHJ exp(-λt)
(8)
FJ =
{exp(-KJI t) - exp(-KHJ
t)} ,
KHJ - KJI
KHJ exp(-λt)
KJI exp(-λt)
FI =
{1 - exp(-KJI t)} -
{1 - exp(-KHJ t)} .
KHJ - KJI
KHJ - KJI
С целью построения кривых “Активность-время” в соответствии с найден-
ными выражениями для относительных активностей (8) необходимо иденти-
фицировать кинетические параметры - транспортные константы KHJ и KJI .
Значения транспортных констант для каждого пациента являются индивиду-
альными и зависят от целого ряда их анатомо-физиологических и биохимиче-
ских характеристик, наличия заболеваний гепатобилиарной системы и дру-
гих патологий. Как правило, для этого используются количественные клини-
ческие данные, полученные в процессе радиографии (графики клиренса кро-
ви и гепатограмма) или радиометрии (набор точек регистрации активности в
разные моменты времени с области печени). Также могут быть использованы
эмпирические формулы и закономерности. В настоящей статье транспортные
константы определялись несколькими способами, рассмотрим их.
Константа KHJ может быть определена по клиническому графику кли-
ренса крови. Прологарифмировав первое выражение в (8), получим:
ln(FH ) = - (KHJ + λ) t.
В полулогарифмической шкале координат график этой зависимости - пря-
мая, и константа KHJ определяется как
KHJ = - tg α - λ,
т.е. тангенс угла наклона этой прямой к оси времени, взятый с противопо-
ложным знаком. Однако если клинический график построить в виде экспо-
ненциальной зависимости, то α - это аналогичный угол наклона касательной,
проведенной к графику клиренса крови на начальном участке согласно
∕
dFH
dt (t = 0) = - (KHJ + λ) = tg α.
Аналогично производная по времени от второго выражения в (8)
∕
dFJ
dt (t = 0) = KHJ = tg α,
что позволяет определить данную константу также по тангенсу угла наклона
касательной на начальном участке к клиническому графику гепатограммы.
Еще один способ определения константы клиренса крови возможен через эф-
фективный период полувыведения РФП из крови TH , который может быть
определен по графику клиренса крови или по эмпирической формуле [28]:
∕
(
∕
)
3
TH ≈ lg
A5
A15
,
158
Таблица 3. Основные показатели исследования печени и численные результаты
моделирования
Контрольная
Хронический
Цирроз
Алкогольная
Показатели
группа
гепатит
печени
гепатопатия
tmax, мин
22-27
31,4-37,0
35-60
17,3-22,1
tplat, мин
23,2-27,8
33,0-41,6
40
9,4-21,0
tint, мин
23,6-32,9
48,4-58,6
46,7-60,0
13,2-23,4
TH, мин
8,6-10,5
10,1-14,3
12,9-17,0
6,9-8,7
KHJ, мин-1
0,07-0,08
0,05-0,07
0,04-0,05
0,08-0,10
KJI, мин-1
0,01-0,03
0,01-0,02
0,00-0,02
0,02-0,04
Amax/A0
0,55-0,70
0,55-0,75
0,50-0,80
0,50-0,75
где A5 и A15 - это активности выведения РФП на 5 и 15 мин соответственно.
С учетом первого выражения из (8) нетрудно получить, что
∕
KHJ = ln 2
TH - λ.
Константа KJI также может быть идентифицирована несколькими спо-
собами. С учетом того, что KJI ≪ KHJ , согласно выражению (8) для FJ
оценить значение KJI можно, аппроксимируя экспонентой нисходящий уча-
сток клинического графика гепатограммы, поскольку на этом участке зави-
симость близка к exp (-KJI t). Также эта константа может быть рассчитана
через время tmax достижения максимального значения FmaxJ, которое легко
∕
определить по графику. Решив простое уравнение dFJ
dt (t = tmax) = 0, по-
лучим
)∕
(KHJ +λ
(9)
tmax = ln
(KHJ - KJI
).
KJI + λ
При известных значениях KHJ , λ и tmax из уравнения (9) может быть найдено
значение константы KJI . Еще один способ вычисления константы KJI возмо-
жен через эффективный период полувыведения РФП из печени TJ , который
может быть определен по клиническому графику гепатограммы. В этом слу-
чае используется приближенная формула:
∕
TJ ≈ tmax + ln 2
(KJI + λ).
В случае если имеется набор точек регистрации активности с области пе-
чени в разные моменты времени ti, то задача идентификации транспорт-
ных констант KHJ и KJI может быть решена с использованием функ-
ционала невязки аналогично формулам (3),-(4) с использованием функции
FJ (KHJ , KJI , t) из (8). Для реализации задачи идентификации транспортных
констант модели автор написал программу на языке программирования C++.
С помощью данной программы также осуществлялись расчеты фармакоки-
нетических параметров и построения кривых “Активность-время”.
В табл. 3 приведены основные показатели радионуклидного исследования
печени с применением РФП “Бенгалроз-I-131” (по В.К. Поленко и др.), взя-
тые из [28], и рассчитанные автором транспортные константы в норме (кон-
трольная группа) и при различных заболеваниях. Обозначения всех вели-
чин приведены в тексте выше. Также в табл. 3 приведен еще один значимый
159
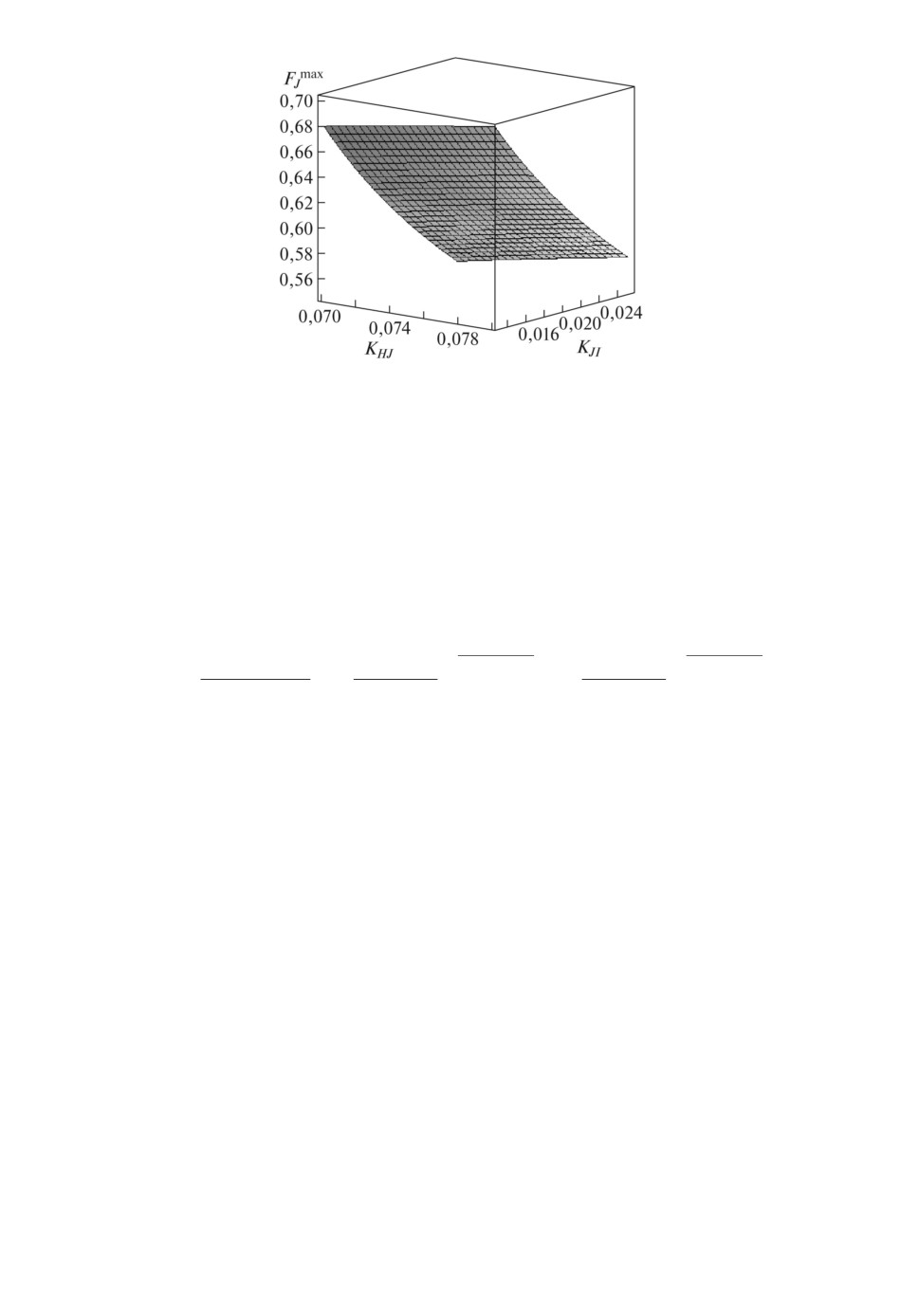
Рис. 4. Графическая зависимость относительной максимальной активности
РФП в печени при гепатографии для контрольной группы обследуемых па-
циентов.
для диа∕ностики параметр-максимальное значение активности РФП в пече-
ни Amax
A0 (или FmaxJ), достигаемое при t = tmax. Подставляя выражение (9)
в (8) для FJ , получаем следующее выражение для максимума относительной
активности в печени
FmaxJ (KHJ,KJI) =
) KJI +λ
(10)
KHJ
(KJI +λ
KHJ-KJI
(KJI +λ)KHJ-KJ
I
=
-
KHJ - KJI KHJ + λ
KHJ
+λ
Как видно из (10), FmaxJ является функцией двух аргументов KHJ и KJI ,
в трехмерном пространстве - это поверхность. Подставляя из табл. 3 крайние
границы значений кинетических констант в (10), можно рассчитать диапа-
зон возможных значений максимума активности в печени для разных групп
обследуемых пациентов. Минимальная граница диапазона возможных значе-
ний FmaxJ достигается при минимальном значении KHJ и максимальном KJI ,
а максимальная граница - при максимальном KHJ и минимальном KJI во
всех группах, приведенных в табл. 3. В качестве примера на рис. 4 приведена
графическая зависимость FmaxJ (KHJ , KJI ) для контрольной группы.
Рассчитанные и приведенные в табл. 3 границы возможных значений
транспортных констант KHJ и KJI для каждой из групп обследуемых па-
циентов далее использовались для построения кривых “Активность-время” в
зонах интереса (плазма крови, печень, кишечник) согласно выражениям (8).
Данные зависимости отражают фармакокинетику РФП в организме, а по-
тому несут значимую клинико-диагностическую информацию. В идеале они
должны совпадать с клиническими графиками с учетом всех погрешностей и
артефактов. Для удобства при построении фармакокинетических зависимо-
стей были объединены две группы сходных с диагностической точки зрения
заболеваний - хронический гепатит и цирроз печени, для которых строили
один общий график во всех зонах интереса. Данные зависимости для трех
160
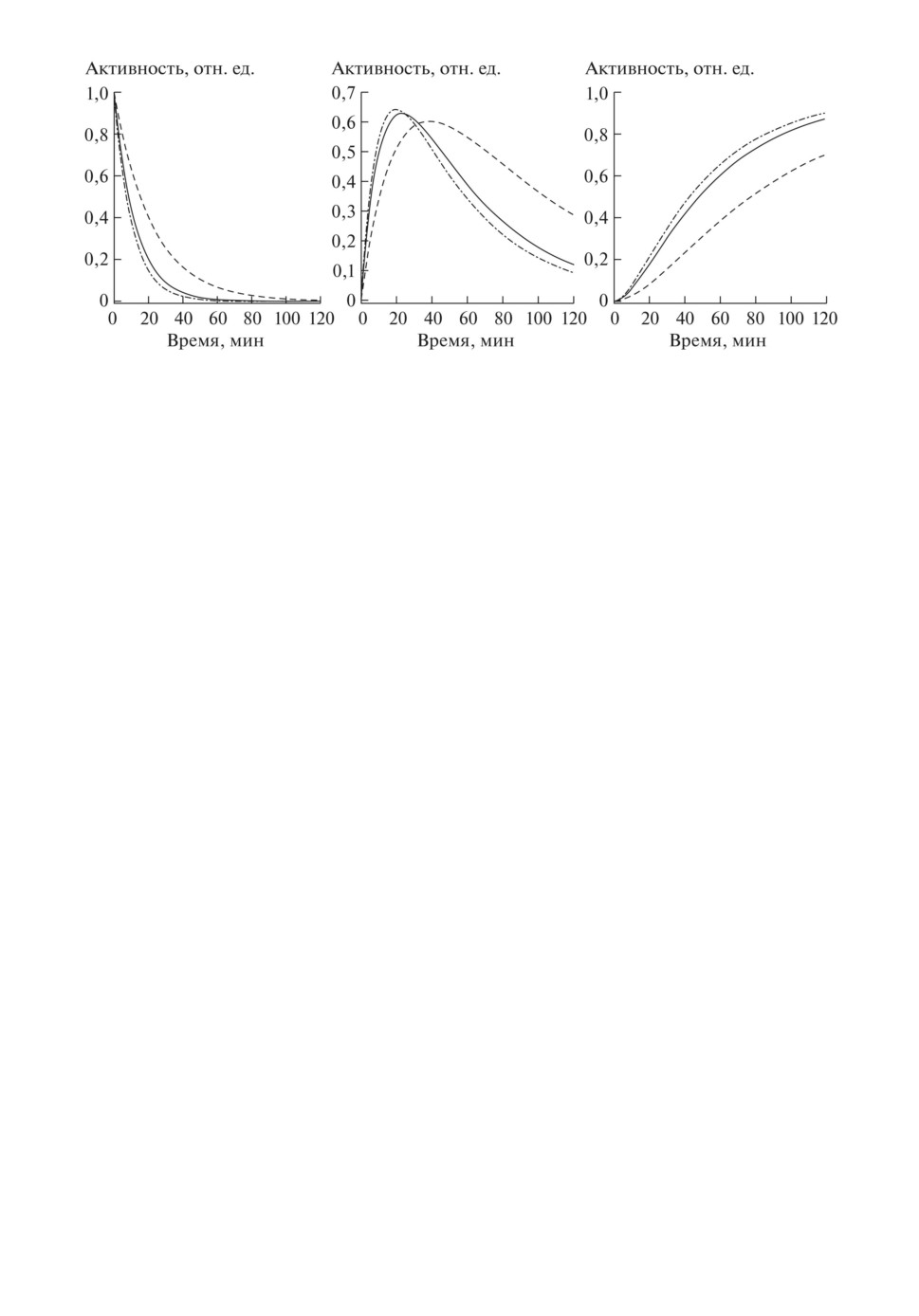
Рис. 5. Рассчитанные кривые “Активность-время” при гепатографии с РФП
“Бенгалроз-I-131” для плазмы крови (слева), печени (посередине), кишечника
(справа). Пояснения даны в тексте.
групп при значениях транспортных констант из указанных в табл. 3 диапа-
зонов приведены на рис. 5. Сплошные кривые соответствуют контрольной
группе (KHJ = 0,08, KJI = 0,02 мин-1), штриховые - группе с гепатитом и
циррозом (KHJ = 0,045, KJI = 0,013 мин-1), штрихпунктирные - группе с
алкогольной гепатопатией (KHJ = 0,095, KJI = 0,022 мин-1).
Анализируя результаты кинетического моделирования при радиоизотоп-
ной гепатографии, можно отметить следующее. У больных хроническим ге-
патитом и особенно циррозом наблюдается снижение поглотительной функ-
ции печени относительно контрольной группы - уменьшается высота подъе-
ма гепатограммы, удлиняется плато, замедляется очищение крови от РФП
(рис. 5), что численно отражается на увеличении значения периода TH и
уменьшении значения константы KHJ примерно в два раза. Также увели-
чивается время поступления РФП в кишечник (рис. 5). При алкогольном
гепатозе наблюдаются обратные закономерности - высота подъема гепато-
граммы увеличивается, плато укорачивается, ускоряется очищение крови от
РФП (рис. 5), что численно отражается на небольшом уменьшении значения
периода TH и увеличении значения константы KHJ по сравнению с контроль-
ной группой. Также немного уменьшается время поступления РФП в кишеч-
ник (рис. 5). Такие изменения гепатограммы наблюдаются при нетяжелых
алкогольных гепатопатиях [29].
4. Модель кинетики при исследовании почек
Ренография применяется для изучения фильтрационной и эвакуаторной
функции почек с помощью РФП, в качестве которого в данном методе ис-
пользуется гиппуран, меченный радиоизотопами131I или123I (натриевая
соль ортойодгиппуровой кислоты) [30]. РФП вводят внутривенно из расчета
0,01-0,02 МБк/кг и осуществляют запись регистрации активности в течение
20 мин. Исследование можно выполнять, используя положение пациента сидя
161
или лежа. В связи с этим количественные параметры нормы, в зависимости
от положения обследуемого, могут значительно отличаться [8].
С помощью радиометрического прибора регистрируют три (иногда две)
кинетические кривые “Активность-время”: две ренограммы (с помощью дат-
чиков, расположенных по центру проекции каждой почки) и клиренс крови
(с помощью датчика, расположенного над областью сердца, если он имеет-
ся). По кривым “Активность-время” определяют количественные параметры,
важные для функциональной диагностики, такие как клиренс крови или эф-
фективный период полуочищения крови от РФП TH (отражает суммарную
фильтрационную функцию почек, в норме не превышает 14 мин), эффектив-
ный период полувыведения РФП почкой T1/2 (отражает эвакуаторную функ-
цию каждой почки, в норме примерно 5-9 мин), время достижения макси-
мума активности в почке tmax (отражает фильтрационную или секреторную
способность почки, в норме 2-5 мин) и др. [8].
Для описания кинетики РФП с учетом вышеописанных особенностей реги-
страции радиоактивности при проведении радионуклидной диагностики по-
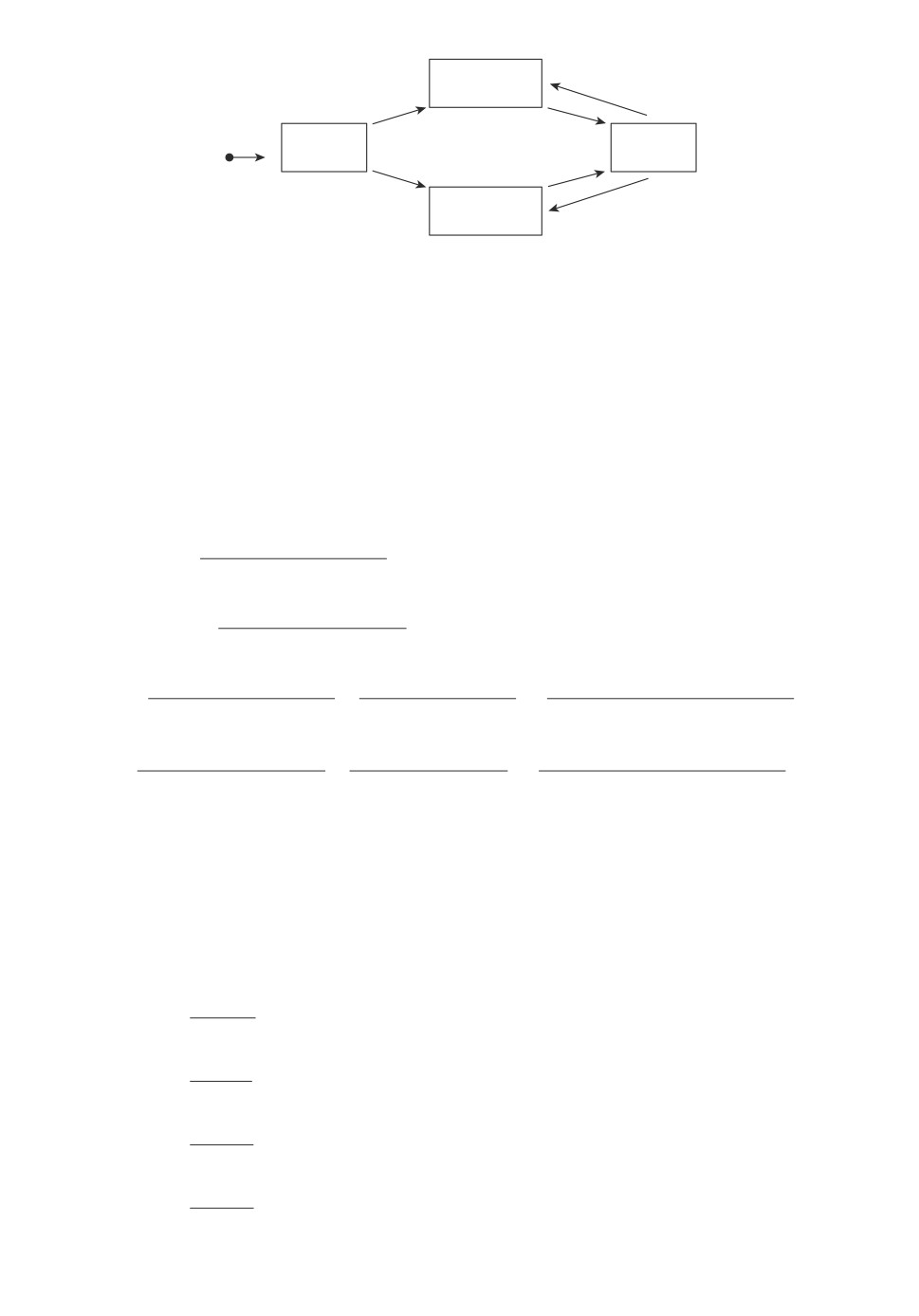
чек автором предложена четырехкамерная модель, геометрическая схема ко-
торой представлена на рис. 6. Данная математическая модель включает в
себя камеры: плазмы крови (H), левой (LR) и правой (RR) почек и каме-
ру мочевого пузыря (U). Функции удержания активности РФП в камерах
обозначены как FH , FL, FR и FU соответственно. Транспортные константы
KHL и KHR отражают фильтрационную функцию каждой почки, а их сумма
KH = KHL + KHR определяет скорость очищения крови от РФП (клиренс
крови), константы KLU и KRU отражают эвакуаторную функцию левой и
правой почки. Транспортные константы KUL и KUR (для левой и правой
почки соответственно) учитывают ретроградный ток (заброс) мочи из моче-
вого пузыря в мочеточник по направлению к почке при описании кинетики
РФП в организме пациентов с пузырно-мочеточниковым рефлюксом (ПМР),
если он имеется.
С учетом особенностей проявления ПМР [31] моделирование кинетики
РФП в организме осуществлялось в три этапа. Первый этап заключается во
внутривенном введении РФП, фильтрации его почками и последующей эва-
куации с мочой в камеру мочевого пузыря до момента проявления ПМР, т.е.
при 0 ≤ t ≤ t1, где t1 - время начала ПМР (появления обратного тока мочи).
На данном этапе KUL = 0 и KUR = 0 (см. рис. 6) и кинетика РФП полностью
описывается системой дифференциальных уравнений без учета ПМР:
dFH (t)
= -(KHL + KHR + λ)FH(t),
dt
dFL(t)
= KHLFH(t) - (KLU + λ)FL(t),
dt
(11)
dFR(t)
= KHRFH(t) - (KRU + λ)FR(t),
dt
FU (t)
d
= KLUFL(t) + KRUFR(t) - λFU(t)
dt
162
FL
Ren S.
KUL
Left
KHL
KLU
FH
FU
0
A
Haema
Urina
KHR
KRU
FR
Ren D.
KUR
Right
Рис. 6. Геометрическая иллюстрация модели при ренографии.
с начальными условиями для функций относительной активности:
(12)
FH (0) = 1, FL (0) = 0, FR (0) = 0, FU
(0) = 0.
Решение системы уравнений (11) с начальными условиями (12) находится
аналитически:
FH = exp (-(KHL + KHR)t) · exp(-λt),
KHL exp(-λt)
FL =
{exp(-KLU t) - exp (-(KHL + KHR)t)} ,
KHL + KHR - KLU
KHR exp(-λt)
(13)
FR =
{exp(-KRU t) - exp (-(KHL + KHR
)t)} ,
KHL + KHR - KRU
}
KHLKLU exp(-λt)
{1 - exp(-KLUt)
1 - exp(-(KHL + KHR)t)
FU =
-
+
KHL + KHR - KLU
KLU
KHL + KHR
}
KHRKRU exp(-λt)
{1 - exp(-KRUt)
1 - exp(-(KHL + KHR)t)
+
-
KHL + KHR - KRU
KRU
KHL + KHR
Отметим, что этот этап полностью описывает кинетику РФП в организме
пациентов без ПМР (в этом случае параметр t1 → ∞).
Второй этап заключается в появлении обратного тока мочи с РФП в мо-
четочнике (при t ≥ t1). В этом случае KUL = 0 и KUR = 0. Система диффе-
ренциальных уравнений с учетом ПМР в рамках второго этапа принимает
вид:
dFH (t)
= -(KHL + KHR + λ)FH(t),
dt
dFL(t)
= KHLFH(t) + KULFU(t) - (KLU + λ)FL(t),
dt
(14)
dFR(t)
= KHRFH(t) + KURFU(t) - (KRU + λ)FR(t),
dt
FU (t)
d
= KLUFL(t) + KRUFR(t) - (KUL + KUR + λ)FU(t)
dt
163
Активность, отн. ед.
0,6
Сounts
4,7k
0,5
4,2k
3,7k
0,4
3,3k
Right Kidney Bkgd. Corrected
2,8k
0,3
2,3k
1,9k
0,2
1,4k
Left Kidney Bkgd. Corrected
0,9k
0,1
0,5k
0k
0
3
5
7
9
11
13
15
17
19
21
0
3
6
9
12
15
18
21
Time
Время, мин
Рис. 7. Кривые “Активность-время” для пациента с ПМР правого мочеточ-
ника при ренографии с РФП “Гиппуран-I-131” (слева приведены клинические
результаты, справа - результаты моделирования). Пояснения даны в тексте.
с начальными условиями:
FH (t1) = FH1, FL (t1) = FL1, FR (t1) = FR1, FU (t1) = FU1,
(15)
где FH1, FL1, FR1, FU1 - значения функций относительной активности на
первом этапе моделирования при t = t1. Решение системы уравнений (14) с
начальными условиями (15) может быть найдено аналитически или числен-
но, например с помощью методов Рунге-Кутты или Розенброка [12, 13]. При
аналитическом решении получаются очень громоздкие математические вы-
ражения, которые здесь не приводим.
Третий этап связан с отсутствием обратного тока мочи в мочеточнике при
t ≥ t2 (t2 > t1), где k2 - время окончания заброса мочи из мочевого пузыря в
мочеточник. На этом этапе KUL = 0, KUR = 0 и кинетика РФП вновь описы-
вается системой дифференциальных уравнений (11) с начальными условия-
ми:
FH (t2) = FH2, FL (t2) = FL2, FR (t2) = FR2, FU (t2) = FU2,
(16)
где FH2, FL2, FR2, FU2 - значения функций относительной активности на
втором этапе моделирования при t = t2. Если наличие обратного тока мочи
присутствует до конца исследования, то третий этап отсутствует.
Совместные решения систем уравнений (11) и (14) с начальными условия-
ми (12), (15), (16) и с идентифицированными на основе клинических данных
транспортными константами KHL, KHR, KLU , KRU , KUL и KUR использова-
лись автором для построения кривых “Активность-время”. Идентификация
транспортных констант осуществлялась по аналогии с описанными выше спо-
собами (в предыдущих разделах статьи). Расчеты фармакокинетических па-
раметров и построения кривых “Активность-время” были выполнены в раз-
работанном программном комплексе в среде Borland C++.
В качестве примера на рис. 7 приведены клинические и рассчитанные
в рамках четырехкамерной модели кривые “Активность-время” для па-
164
циента с ПМР правого мочеточника. Ренограммы для левой почки изоб-
ражены сплошными линиями, для правой - штриховыми. Штрихпунк-
тирной и штрихдипунктирной линиями показаны рассчитанные кривые
для камер крови и мочевого пузыря соответственно. Получены следую-
щие значения индивидуальных транспортных констант: KHL = 0,39 мин-1,
KHR = 0,80 мин-1, KLU = 0,10 мин-1, KRU = 0,14 мин-1, KUL = 0 (отсут-
ствие ПМР) и KUR = 0,10 мин-1 (ПМР при t1 = 8 мин и t2 = 12 мин). Пунк-
тирной линией показано продолжение ренограммы для правой почки при
t > t1, если бы ПМР не было (при KUR = 0). Ренограмма для левой поч-
ки имеет нормальный тип. Рассчитанные с использованием выражений (13)
значения tmax и T1/2 для левой почки равны 2,27 и 9,20 мин соответственно.
Для правой почки - tmax = 2,04 мин и с учетом ПМР T1/2 ≈ 7,9 мин. Следу-
ет отметить, что при отсутствии ПМР для правой ренограммы (пунктирная
линия) получается более низкое значение T1/2 = 7,00 мин.
Также автором был осуществлен расчет фармакокинетических парамет-
ров и выполнено построение кривых “Активность-время” на основе клиниче-
ских данных радионуклидной диагностики пациентов без ПМР, но с различ-
ными типами ренограмм: нормальный, афункциональный и обструктивный
тип [32]. При анализе идентифицированных транспортных констант моде-
ли установлено, что ренограммы афункционального типа характеризуются
более низкими значениями констант фильтрации и более высокими значе-
ниями констант эвакуации по сравнению с ренограммами нормального типа.
Особенностью ренограмм обструктивного типа является равенство констан-
ты эвакуации нулю. Также восстановлены и проанализированы модельные
кривые клиренса крови и накопления РФП в моче (при их отсутствии в кли-
нических данных диагностики).
5. Заключение
В данной статье разработан единый подход к построению камерных мо-
делей кинетики различных радиофармацевтических препаратов с изотопами
йода как при диагностике функционального состояния органов, тканей и си-
стем организма с помощью невузуализирующих и визуализирующих радио-
нуклидных методов, так и при терапии заболеваний щитовидной железы с
помощью радиойода. Представлены три математические модели транспорта
радиофармпрепаратов в организме человека и реализованные на их осно-
ве алгоритмы обработки количественных данных радионуклидной диагно-
стики печени и желчевыделительной системы, почек и мочевыделительной
системы, а также функциональной диагностики и радионуклидной терапии
щитовидной железы. Предложены различные способы идентификации мо-
дельных параметров межкамерных коммуникаций - транспортных констант.
Рассмотрены подходы к индивидуальному дозиметрическому планированию
радиойодтерапии заболеваний щитовидной железы на основе камерного мо-
делирования.
Применение фармакокинетического моделирования при функциональном
и морфофункциональном исследовании органов, тканей и систем организма
позволяет научно обосновать полученные в процессе радионуклидной диагно-
165
стики и/или терапии количественные результаты и сцинтиграммы, связать
их с определенными морфофункциональными характеристиками биосисте-
мы, показателями гемодинамики и дать, таким образом, их более объектив-
ную интерпретацию.
СПИСОК ЛИТЕРАТУРЫ
1.
Kar N.R. Production and Applications of Radiopharmaceuticals: A Re-
view
// Int. J. Pharm. Investigation.
2019. V.
9. No.
2. P.
36-42.
2.
Payolla F.B., Massabni A.C., Orvig C. Radiopharmaceuticals for Diagnosis in Nu-
clear Medicine: A Short Review // Eclética Qu´im. J. 2019. V. 44. No. 3. P. 11-19.
3.
Debnath S., Babu M.N., Kumar G.V. Radiopharmaceuticals and their Therapeutic
Applications in Health Care System // Pharma Times. 2016. V. 48. No. 3. P. 15-18.
4.
Зырянов С.К., Затолочина К.Э. Перспективы применения радионуклидных
лекарственных препаратов при лечении злокачественных новообразований в
РФ // Качественная клиническая практика. 2018. № 2. С. 51-57.
5.
Чернов В.И., Медведева А.А., Синилкин И.Г., Çельчан Р.В., Брагина О.Д.,
Чойнзонов Е.Л. Ядерная медицина в диагностике и адресной терапии злока-
чественных новообразований // Бюллетень сибирской медицины. 2018. Т. 17.
6.
Матвеев А.В. Ядерная медицина: радиоизотопы и фармпрепараты. Омск:
Изд-во ОмГУ, 2016.
7.
Цыб А.Ф., Древаль А.В., Гарбузов П.И. и др. Радиойодтерапия тиреотоксикоза:
руководство. М.: ГЭОТАР-Медиа, 2009.
8.
Радионуклидная диагностика для практических врачей / Под ред. Лишмано-
ва Ю.Б., Чернова В.И. Томск: STT, 2004.
9.
Синякова О.Г. Методы математического моделирования в задачах оценки со-
стояния организма (радионуклидная диагностика) // АиТ. 2005. № 1. С. 142-153.
Sinyakova O.G. Methods of Mathematical Modeling for Estimation of the Organism
Condition (Radionuclide Diagnostics) // Autom. Remote Control. 2005. V. 66. No. 1.
10.
Сергиенко В.И., Джеллифф Р., Бондарева И.Б. Прикладная фармакокинетика:
основные положения и клиническое применение. М.: Изд-во РАМН, 2003.
11.
Бондарева И.Б. Математическое моделирование в фармакокинетике и фарма-
кодинамике. Дисс
д.б.н. Москва, 2001.
12.
Галанин М.П., Ходжаева С.Р. Разработка и тестирование методов решения
жестких обыкновенных дифференциальных уравнений // Математическое мо-
делирование и численные методы. 2014. № 4. С. 95-119.
13.
Калиткин Н.Н., Корякин П.В. Численные методы: в 2 кн. Кн. 2. Методы мате-
матической физики: учебник для студентов вузов. М.: Изд. центр “Академия”,
2013.
14.
Сулимов В.Д., Шкапов П.М., Носачев С.К. Локальный поиск методом Хука-
Дживса в гибридном алгоритме глобальной оптимизации // Наука и обра-
зование: научное издание МГТУ им. Н.Э. Баумана. 2014. № 6. С. 107-123.
166
15.
Хук Р., Дживс Т.А. Прямой поиск решения для числовых и статистических
проблем. М.: Мир, 1961.
16.
Al-jubeh W., Shaheen A., Zalloum O. Radioiodine I-131 for Diagnosing and Treat-
ment of Thyroid Diseases // Conf. Paper. 2012. No. 6.
17.
Tang J., Kong D., Cui Q., Wang K., Zhang D., Liao X., Gong Y., Wu G. The Role
of Radioactive Iodine Therapy in Papillary Thyroid Cancer: an Observational Study
Based on SEER // OncoTargets and Therapy. 2018. V. 11. P. 3551-3560.
18.
Матвеев А.В., Носковец Д.Ю. Фармакокинетическое моделирование и дозимет-
рическое планирование радиойодтерапии тиреотоксикоза // Вестн. Ом. ун-та.
2014. № 4. С. 57-64.
19.
Матвеев А.В., Носковец Д.Ю. Особенности дозиметрического планирования ра-
диойодтерапии на основе фармакокинетического моделирования // Вестн. Ом.
ун-та. 2016. № 3. C. 74-83.
20.
Власова О.П., Клепов А.Н., Матусевич Е.С., Поцулко Е.П. Математическое мо-
делирование для дозиметрического планирования радиойодтерапии пациентов
с заболеваниями щитовидной железы // ВНМТ. 2008. T. 15. № 1. C. 17-19.
21.
Липанова Н.Н., Клепов А.Н., Наркевич Б.Я. Дозиметрическое планирование и
дозовый контроль в радиойодотерапии рака щитовидной железы // Медицин-
ская радиология и радиационная безопасность. 2012. Т. 57. № 3. С. 53-65.
22.
Липанова Н.Н. Радиобиологическое и дозиметрическое обоснование радионук-
лидной терапии заболеваний щитовидной железы. Дисс
канд. физ.-мат. наук.
Москва, 2012.
23.
Власова О.П. Метод идентификации параметров метаболизма радиойода и рас-
чет поглощенных доз при радионуклидной терапии щитовидной железы. Дисс.
... канд. биол. наук. Москва, 2010.
24.
Лизогуб Д.С., Матвеев А.В. Радиоизотопные методы исследования в диагно-
стике заболеваний щитовидной железы // Молодёжь третьего тысячелетия
[Электронный ресурс]: сб. науч. статей / [отв. ред. С.В. Белим]. Омск: Изд-во
Ом. гос. ун-та, 2017. - 1 электрон. опт. диск (CD-ROM); 12 см.
25.
Лизогуб Д.С., Матвеев А.В. Индивидуальное дозиметрическое планирование
радиойодтерапии на основе камерного моделирования // Проблемы научной
мысли. 2019. Т. 7. № 3. С. 15-17.
26.
Silberstein E.B. Comparison of Outcomes After123I Versus131I Preablation Imaging
Before Radioiodine Ablation in Differentiated Thyroid Carcinoma // J. Nucl. Med.
27.
Матвеев А.В. Фармакокинетическая модель и расчет поглощенных доз при ра-
дионуклидной терапии рака щитовидной железы // Лучевая диагностика и те-
28.
Поленко В.К., Пономарев П.С., Чибисов В.А. и др. Радиоизотопная диагности-
ка. Метод. пос. М.: Воениздат, 1984.
29.
Матвеев А.В., Корнеева М.Ю. Особенности моделирования кинетики радио-
фармпрепаратов при функциональном исследовании гепатобилиарной систе-
мы // Вестн. Ом. ун-та. 2015. № 3. C. 42-51.
30.
Кундин В.Ю. Поспелов С.В. Радиофармацевтические препараты для визуализа-
ции и оценки функционального состояния мочевыделительной системы // Уро-
логiя. Украiнський науково-практичний журнал урологiв, андрологiв та нефро-
логiв. 2012. Т. 16. № 2(61). С. 58-64.
167
31. Лопаткин Н.А., Пугачев А.Г. Пузырно-мочеточниковый рефлюкс. М.: Медици-
на, 1990.
32. Матвеев А.В. Особенности моделирования кинетики радиофармпрепаратов при
функциональном исследовании мочевыделительной системы // Вестн. Ом. ун-
Статья представлена к публикации членом редколлегии А.И. Михальским.
Поступила в редакцию 29.02.2020
После доработки 15.04.2020
Принята к публикации 09.07.2020
168