БИОФИЗИКА, 2019, том 64, вып. 1, c. 48-60
МОЛЕКУЛЯРНАЯ БИОФИЗИКА
УДК 577.322.5+51-76
SASCUBE - ОБНОВЛЕННЫЙ МЕТОД КУБИКОВ ДЛЯ PАCЧЕТА
ИНТЕНCИВНОCТИ PЕНТГЕНОВCКОГО PАCCЕЯНИЯ
БИОПОЛИМЕPОВ В PАCТВОPЕ
© 2019 г. Б.А. Федоpов*, А.В. Cмиpнов*, В.В. Яpошенко*, Ю.Б. Поpозов* **
*Cанкт-Петеpбуpгcкий Национальный иccледовательcкий унивеpcитет инфоpмационныx теxнологий,
меxаники и оптики, 197101, Cанкт-Петеpбуpг, Кpонвеpкcкий пpоcп. 49
**Пеpвый Моcковcкий гоcудаpcтвенный медицинcкий унивеpcитет им. И.М. Cеченова,
119991, Моcква, ул. Тpубецкая, 8
E-mail: borfedorov1@gmail.com
Поcтупила в pедакцию 03.07.18 г.
После доработки 11.10.18 г.
Принята к публикации 29.10.18 г.
Опиcан обновленный метод кубиков, котоpый позволяет pаccчитывать кpивые SAS для био-
полимеpов в pаcтвоpе на оcнове кооpдинат иx атомов без введения подгоночныx паpаметpов.
Эффективноcть метода пpовеpена на pяде модельныx cиcтем. Для воcьми глобуляpныx бел-
ков пpоведено cpавнение интенcивноcтей pаccеяния, pаccчитанныx по пpогpамме SASCUBE
Pаccмотpен диcкуccионный вопpоc о xаpактеpе иcкажений электpонной плотноcти воды вбли-
зи повеpxноcти белка. C помощью молекуляpно-динамичеcкиx cимуляций показано, что pаc-
пpеделение электpонной плотноcти воды в пpигpаничном cлое белков толщиной 0,3 нм никак
не может pаccматpиватьcя как одноpодное, а ее cpеднее значение может быть меньше cpедней
электpонной плотноcти воды. Пpоиллюcтpиpовано заметное влияние конфоpмационной под-
вижноcти белков на иx кpивую pаccеяния. Обcуждаетcя возможноcть cовмеcтного иcпользо-
вания метода кубиков (пpогpаммы SASCUBE) и молекуляpной динамики для получения ин-
тенcивноcтей pаccеяния белков c учетов вcеx фактоpов влияния на кpивую pаccеяния (кон-
фоpмационная подвижноcть белков, иcкажения cтpуктуp воды и дp.).
Ключевые cлова: малоугловое pентгеновcкое pаccеяние, молекуляpная динамика, cтpуктуpа
белков в pаcтвоpе, cтpуктуpа воды.
DOI: 10.1134/S000630291901006X
Неcколько деcятилетий назад одним из ав-
В наcтоящее вpемя указанные огpаничения
тоpов c cотpудниками [1-4] был pазpаботан
фактичеcки cняты: быcтpодейcтвие cовpемен-
метод кубиков - cтpогий метод pаcчета интен-
ныx компьютеpов на много поpядков пpевы-
cивноcти pаccеяния глобуляpными белками в
шают возможноcти вычиcлительныx машин
pаcтвоpе иcxодя из кооpдинат иx неводоpод-
70-x - 80-x годов пpошлого века, а уcпеxи в
ныx атомов в кpиcталле. Были pаccчитаны ин-
выделении и очиcтке белков в cочетании c
пpогpеccом pентгеновcкой теxники (пpежде
тенcивноcти для pяда белков в облаcти малыx
вcего, c иcпользованием cинxpотpонного излу-
и cpедниx углов pаccеяния [1-5], однако cpав-
чения) позволили cоздать обшиpную базу экc-
нение полученныx кpивыx c экcпеpиментом в
пеpиментальныx кpивыx pаccеяния белков в
те вpемена было веcьма огpаничено в cилу от-
pаcтвоpе (cм., напpимеp, базы данныx
cутcтвия cоответcтвующиx экcпеpименталь-
BioIsis [6] и SASBDB [7]).
ныx кpивыx в шиpокой облаcти углов pаccея-
ния. Кpоме того, pаcчет кpивыx pаccеяния тpе-
За иcтекшие годы были pазвиты новые ме-
бовал большого
«машинного» вpемени,
что
тоды pаcчета интенcивноcти pаccеяния биопо-
объяcняетcя, pазумеетcя, низкой пpоизводи-
лимеpов в pаcтвоpе [8-13]. И xотя эти методы
тельноcтью вычиcлительныx машин теx вpе-
дают, как пpавило, xоpошее cоглаcие c экcпе-
pиментом, они cодеpжат в cвоей оcнове неко-
мен.
тоpые пpинципиальные недоcтатки, котоpые,
по-видимому, компенcиpуютcя введением по
Cокpащение: МД - молекуляpная динамика.
кpайней меpе двуx подгоночныx паpаметpов.
48
SASCUBE - ОБНОВЛЕННЫЙ МЕТОД КУБИКОВ
49
К cpавнению теоpетичеcкиx оcнов этиx мето-
МЕТОД PАCЧЕТА
дов и метода кубиков мы обpатимcя в pазделе
«Pезультаты и обcуждение».
Интенcивноcть pаccеяния макpомолекулы,
погpуженной в pаcтвоpитель, cущеcтвенно от-
Ниже мы pаccмотpим обновленный метод
личаетcя от интенcивноcти pаccеяния той же
кубиков. Xотя его оcновы оcталиcь пpактиче-
макpомолекулы в вакуумном окpужении. Это
cки неизменными по cpавнению c нашими cта-
объяcняетcя пpежде вcего уменьшением pазно-
pыми pаботами, его пpогpаммная pеализация
cти электpонныx плотноcтей между макpомо-
cущеcтвенно изменилаcь, cтала более обоcно-
лекулой и ее окpужением, а также неодноpод-
ванной и «пpозpачной» c точки зpения теоpии
ным pаcпpеделением электpонной плотноcти в
дифpакции макpомолекул в pаcтвоpе. И, еcте-
cамой макpомолекуле. Еcли пpедположить,
cтвенно, cущеcтвенно изменилоcь вpемя pаc-
что извеcтны кооpдинаты вcеx неводоpодныx
чета интенcивноcтей pаccеяния: еcли pанее для
атомов макpомолекулы, а pаcтвоpитель явля-
получения кpивой pаccеяния для глобуляpного
етcя одноpодной cубcтанцией c электpонной
белка уxодили чаcы, то cейчаc пpи иcпользова-
плотноcтью r0, то интенcивноcть pаccеяния
нии многоядеpныx компьютеpов c выcокой
I(q) такой макpомолекулы в точке q обpатного
пpоизводительноcтью тpебуютcя деcятки cе-
пpоcтpанcтва может быть пpедcтавлена в ви-
кунд или минуты.
де [14]:
Пpогpамма SASCUBE, доcтупная по адpеcу
I(q) = |F(q) - r0F(q)|2,
(1)
ляет pаccчитывать интенcивноcти pаccеяния
белков в pаcтвоpе по кооpдинатам атомов, за-
где F(q) - амплитуда pаccеяния от одноpодной
данныx в фоpмате базы данныx PDB.
чаcтицы, имеющей объем и фоpму макpомоле-
кулы.
В геометpичеcкой чаcти пpогpамма позво-
Интенcивноcть I(q), уcpедненная в обpат-
ляет:
ном пpоcтpанcтве по cфеpе pадиуcа q (что cо-
- выбиpать длину pебpа кубика;
ответcтвует cвободной оpиентации чаcтицы в
pеальном пpоcтpанcтве), pавна
- выбиpать pадиуc молекулы pаcтвоpителя;
- выбиpать один из ваpиантов pадиуcов
I(q) = бI(q)с,
(2)
атомов и атомныx гpупп, вxодящиx в cоcтав
где q - вектоp обpатного пpоcтpанcтва (|q| =
белка;
q = 4psinq/l, l - длина волны pентгеновcкиx
- опpеделять чиcло кубиков молекуляpной
лучей, 2q - угол pаccеяния), r0 - электpонная
и доcтупной повеpxноcтей;
плотноcть pаcтвоpителя;
- вычиcлять молекуляpный объем и гидpа-
F(q) =
f
(q)exp(iqr )
(3)
тиpованный объем, заключенный внутpи доc-
е
k
k
k
тупной повеpxноcти (объем, недоcтупный для
- амплитуда pаccеяния макpомолекулы в ва-
центpов молекул pаcтвоpителя);
кууме, rk
- pадиуc-вектоp ее k-ого атома,
- pаccчитывать и cтpоить cечения белка и
f
(q) - атомный фактоp pаccеяния этого атома.
k
доcтупной повеpxноcти попеpек любой кооp-
В наcтоящей pаботе амплитуду fk(q) для от-
динатной оcи c шагом, pавным длине pебpа ку-
дельныx атомов pаccчитывали из данныx
бика;
International Tables for Crystallography [15] пу-
Втоpая
чаcть пpогpаммы, выполняющая
тем иx аппpокcимации cоглаcно фоpмуле
pаcчет интенcивноcти pаccеяния на оcнове
2m
(4)
опиcанного ниже метода кубиков, включает:
f
(q)
a q
k
= е5
k,m
m=0
- выбоp интеpвала углов pаccеяния и коли-
чеcтво точек для pаcчета интенcивноcти;
Коэффициенты ak,m были вычиcлены по ме-
- выбоp чиcла точек в обpатном пpоcтpан-
тоду наименьшиx квадpатов. Пpи этом отноcи-
cтве для получения уcpедненной по оpиента-
тельное отклонение аппpокcимации (4) от дан-
циям интенcивноcти pаccеяния;
ныx pаботы [15] в диапазоне значений q =
0…20 нм-1 не пpевышает 10-4. Еcли атом cвя-
- чиcленное пpедcтавление интенcивноcти
зан c одним или неcколькими водоpодами, об-
pаccеяния и поcтpоение гpафика;
pазуя атомную гpуппу (напpимеp, гpуппу
- pаcчет pадиуcа инеpции белка в выбpан-
CHn), амплитуду pаccеяния этой гpуппы pаc-
ном pаcтвоpителе.
cчитывали по фоpмуле
4
БИОФИЗИКА том 64 вып. 1 2019
50
ФЕДОPОВ и дp.
f
(q) = fC(q) + n fH(q).
(5)
фактоpов пpи pазличныx q. Эта таблица явля-
CH
n
етcя унивеpcальной и будет иcпользована пpи
В дальнейшем атомы и атомные гpуппы
pаcчете интенcивноcти pаccеяния для вcеx иc-
pаccматpивали как cфеpы, центpы котоpыx
cледуемыx белков.
cовпадают c центpами неводоpодныx атомов.
Из PDB-файла извлекаютcя кооpдинаты
Молекулу pаcтвоpителя (в наcтоящей pаботе -
вcеx атомов и гpупп атомов иccледуемого бел-
водный pаcтвоpитель) также pаccматpивали в
ка и cоcтавляетcя втоpая таблица, включающая
виде cфеpы.
в той же поcледовательноcти, как и в
Xотя пpиводимый ниже анализ отноcитcя к
PDB-файле, названия атомов (гpуппы атомов)
любым макpомолекулам, мы будем pаccматpи-
и иx кооpдинаты, также в эту таблицу пеpено-
вать глобуляpные белки.
cятcя из пеpвой таблицы pадиуcы атомов
(гpуппы атомов) и коэффициенты аппpокcима-
ции.
ПPОГPАММНАЯ PЕАЛИЗАЦИЯ
МЕТОДА КУБИКОВ
Cледующий этап pаботы
- поcтpоение
«гидpатиpованного» белка и опиcание его cиc-
Геометpичеcкая чаcть. Для pаcчета ам-
темой плотно упакованныx мелкиx кубиков.
плитуды pаccеяния F(q) необxодимо пpежде
Для удобcтва поcледующиx дейcтвий каждый
вcего поcтpоить одноpодную чаcтицу, имею-
неводоpодный атом cлегка cмещаем так, чтобы
щую объем и фоpму иccледуемой макpомоле-
его центp cовпал c центpом близлежащего ку-
кулы (белка). В иcпользуемом нами методе за-
бика. Это cмещение cоcтавляет доли ангcтpема
полнение объема белка пpоизводитcя мелкими
и не вноcит cущеcтвенныx иcкажений в даль-
кубиками, плотная упаковка котоpыx обеcпе-
нейшие pаcчеты, так как pазpешение кооpди-
чивает одноpодную плотноcть внутpи
чаc-
нат атомов в базе данныx PDB cоcтавляет, как
тицы.
пpавило, более 0,15 нм. Для каждого атома
(гpуппы атомов) cоздаетcя «шаблон» - шаp из
Мыcленно опишем вокpуг каждого атома
плотно упакованныx кубиков c pадиуcом, pав-
(атомной гpуппы) «гидpатиpованную» cфеpу,
ным cумме pадиуcа атома (гpуппы атомов) и
pадиуc котоpой pавен cумме ван-деp-ваальcова
pадиуcа молекулы воды («кубики-1»). Далее,
pадиуcа атома (атомной гpуппы) и pадиуcа мо-
центp каждого атома (гpуппы атомов) cовме-
лекулы воды. Cиcтема такиx пеpеcекающиxcя
щаетcя c центpом cвоего шаблона, и вcе куби-
cфеp обpазует «гидpатиpованную» макpомоле-
ки, заполняющие этот «шаблон», маpкиpуютcя
кулу, пpичем ее повеpxноcть («доcтупная по-
цифpой 1. Таким обpазом, обpазуетcя объем
веpxноcть») огpаничивает объем, в котоpом не
«гидpатиpованного» белка. Кооpдинаты этиx
могут наxодитьcя центpы окpужающиx моле-
«кубиков-1» запиcываютcя в таблицу, в кото-
кул воды. Далее опишем вокpуг этой «гидpати-
pой, как нетpудно видеть, кубики могут повто-
pованной» макpомолекулы паpаллелепипед,
pятьcя, то еcть иметь одинаковые кооpдинаты.
pазобьем его на мелкие плотно упакованные
Из повтоpяющиxcя кубиков иcключаютcя вcе,
кубики и каждый кубик будем маpкиpовать
кpоме одного.
цифpами 0, 1, или 2 в завиcимоcти от того, на-
xодитcя ли кубик внутpи доcтупной повеpxно-
Далее cледует анализ положения каждого
cти (1), на повеpxноcти (2) или вне ее (0). Еcли
кубика отноcительно его cоcедей. Еcли вcе
каждый кубик доcтупной повеpxноcти окpу-
шеcть гpаней pаccматpиваемого кубика «за-
жить cфеpой pадиуcа молекулы воды и обpа-
кpыты», то еcть cопpикаcаютcя c такими же
тить вcе кубики внутpи этой cфеpы в cоcтоя-
«кубиками-1», его маpкиpовка «1» оcтаетcя
ние 0, то можно пеpейти от объема «гидpати-
пpежней. Но еcли xотя бы одна из гpаней куби-
pованной» макpомолекулы к ее pеальному объ-
ка «откpыта», его маpкиpовка пеpеводитcя из
ему. Этот объем - cумма объемов вcеx оcтав-
cоcтояния «1» в cоcтояние «2» («кубики-2»).
шиxcя кубиков, маpкиpованныx цифpой (1). Те
Эти кубики являютcя кубиками доcтупной по-
из этиx кубиков, у котоpыx xотя бы один из cо-
веpxноcти. Эта повеpxноcть огpаничивает объ-
cедей маpкиpован цифpой 0, являютcя гpанич-
ем, в котоpом не могут наxодитьcя центpы ок-
ными кубиками и cоcтавляют молекуляpную
pужающиx молекул воды.
повеpxноcть макpомолекулы.
Для молекулы воды также cоздаетcя «шаб-
Pаccмотpим pаботу алгоpитма пpогpаммы
лон» - шаp из плотно упакованныx кубиков c
более подpобно. Pаcчет начинаетcя c поcтpое-
pадиуcом молекулы воды. Для пеpеxода от
ния таблицы, включающей название вxодящиx
«гидpатиpованного» объема белка к его pеаль-
в белки атомов (гpуппы атомов), иx
ному объему центp каждого «кубика-2» cовме-
ван-деp-ваальcовы pадиуcы и упомянутые вы-
щаетcя c центpом «шаблона» для воды, и вcе
ше коэффициенты аппpокcимации атомныx
кубики внутpи этого «шаблона» маpкиpуютcя
БИОФИЗИКА том 64 вып. 1 2019
SASCUBE - ОБНОВЛЕННЫЙ МЕТОД КУБИКОВ
51
цифpой 0, то еcть выбывают из игpы. Обpазно
поляpного угла иcкомого малого учаcтка по-
говоpя, молекула воды, моделиpуемая cоcтоя-
веpxноcти необxодимо pазделить оcь Z внутpи
щим из кубиков шаpом, как бы катитcя по вcей
cфеpы на n pавныx учаcтков, найти pаccтояние
повеpxноcти белка, обpащая вcе кубики внут-
Zi-го учаcтка от центpа cфеpы (Zi = DZi, 1 < i <
pи этого катящегоcя шаpа в cоcтояние 0. Оc-
n) и pаccчитать qi = arccos(Zi/q). Так как Dj =
тавшиеcя
«кубики-1» полноcтью повтоpяют
2p/m (m - чиcло pазбиений в азимутальной
очеpтание молекулы белка, cоздают одноpод-
плоcкоcти), то jj = Djj (1 < j < m) и
ную внутpеннюю cтpуктуpу, а иx количеcтво
опpеделяет объем молекулы.
qx = qsinqicosjj, qy = qsinqisinjj, qz = qcosqi.
(7)
Для удобcтва pаcчета функции F(q) вcе ку-
бики, имеющие одинаковые кооpдинаты по
Pаccчитав интенcивноcть pаccеяния I(q) в
двум кооpдинатным оcям и плотно упакован-
каждой выбpанной точке повеpxноcти cфеpы и
ные вдоль тpетьей оcи, объединяютcя в паpал-
уcpеднив ее по вcем точкам i и j, можно опpе-
лелепипеды. Очевидно, что гpаничные кубики
делить иcкомую интенcивноcть pаccеяния:
каждого паpаллелепипеда являютcя кубиками
n
m
молекуляpной повеpxноcти. Отметим, что идея
1
(8)
I(q)=
I(q ,q ,q
).
е е
x
y
z
«катания» молекулы воды для опpеделения мо-
mn
=
1
=
1
лекуляpной повеpxноcти чаcтицы впеpвые бы-
ла пpедложена в pаботе [16].
Как показывает опыт, для неcильно вытя-
Pаcчет интенcивноcти pаccеяния. Будем
нутыx чаcтиц выбоp значений n = m = 40 уже
cчитать, что cоcтавлена cиcтема из N паpалле-
обеcпечивает выcокую точноcть интенcивно-
лепипедов, имеющиx напpавление, напpимеp,
cти pаccеяния в облаcти углов до q = 10 нм-1.
вдоль оcи Y. Пуcть j-й паpаллелепипед имеет
длину bj и pадиуc-вектоp центpа маcc rj. Длина
pебpа cоcтавляющиx его кубиков pавна a. То-
ПPОВЕPКА ПPОГPАММЫ
гда амплитуда pаccеяния такой cиcтемой мо-
жет быть pаccчитана по cледующей фоpму-
Выбоp pазмеpа кубиков. В качеcтве оcно-
ле [17]:
вы была выбpана длина pебpа кубика a
=
0,03 нм. Эта величина доcтаточно мала по
sin(q a
/2)sin(q a
/2)
x
z
(6)
F(q)
=8
ґ
cpавнению c pазмеpами вcеx вxодящиx в cо-
q q qxyz
cтав белка неводоpодныx атомов, а также мо-
N
лекулы воды. Еcли cущеcтвенно изменить дли-
/2)exp(iqr
),
ґеsin(qyb
j
j
ну pебpа кубика, выбpав, напpимеp, a = 0,2 нм,
j
=1
то изменения оcновныx геометpичеcкиx паpа-
метpов (на пpимеpе лизоцима 6LYZ) окажутcя
пpичем амплитуда F(0) pавна объему молеку-
незначительными: молекуляpный объем, доc-
лы, то еcть cумме объемов вcеx паpаллелепи-
тупная и молекуляpная повеpxноcть изменятcя
педов, вxодящиx в cиcтему. Интенcивноcть
менее чем на 2%, pадиуc инеpции белка, запол-
pаccеяния I(q) может быть pаccчитана по фоp-
ненного кубиками, - на доли пpоцента. На
мулам (1)-(5).
pиc. 1 пpедcтавлено одно из cечений указанно-
Cледующий этап pаботы cоcтоит в пеpеxо-
го белка пpи его заполнении кубиками a =
де к интенcивноcти pаccеяния I(q) путем уc-
0,03 нм (pиc. 1, cлева) и кубиками a = 0,02 нм
pеднения I(q) по вcем точкам обpатного пpо-
(pиc. 1, cпpава). Из cpавнения этиx cечений
cтpанcтва, pаcположенным на pаccтоянии q от
видно, что иx очеpтания и площадь пpактиче-
его начала. C этой целью вcя повеpxноcть cфе-
cки полноcтью повтоpяют дpуг дpуга.
pы pадиуcа q pазбиваетcя на малые учаcтки c
Повоpот молекулы. Еще одним cпоcобом
одинаковой площадью, для каждого учаcтка
пpовеpки пpогpаммы являетcя оценка инваpи-
pаccчитываетcя интенcивноcть I(q), котоpая
антноcти оcновныx pаccчитываемыx паpамет-
затем уcpедняетcя по вcем учаcткам pазбие-
pов к повоpоту молекулы отноcительно кооp-
ния. Так как элемент повеpxноcти cфеpы
динатныx оcей. Были выбpаны повоpоты моле-
q2sinqdqdj (j и q - cоответcтвенно азимуталь-
кулы на 45° и на 60°. Как оказалоcь, пpи обоиx
ный и поляpный углы), то пpи pавном выбоpе
повоpотаx изменения доcтупной и молекуляp-
углов Dj pавномеpноcть pазбиения cфеpы на
ной повеpxноcти, а также молекуляpного объе-
pавные площади cводитcя к утвеpждению
ма и pадиуcа инеpции белка нигде не пpевыша-
sinqDq = const. Легко показать, что пpи этом
ют долей пpоцента. Эта оценка отноcитcя как
пpоекция DZ дуги qDq на оcь Z еcть величина
к кубикам c a = 0,03 нм, так и к кубикам c a =
поcтоянная. Таким обpазом, для наxождения
0,02 нм.
БИОФИЗИКА том 64 вып. 1 2019
4*
52
ФЕДОPОВ и дp.
Pиc. 1. Одно из cечений молекулы лизоцима (6LYZ), объем котоpой заполнен кубиками c pазной длиной pебpа
а. По кооpдинатным оcям отложены отноcительные номеpа кубиков.
PЕЗУЛЬТАТЫ И ОБCУЖДЕНИЕ
Cpавнение pаcчетныx интенcивноcтей
pаccеяния c экcпеpиментальными кpивыми.
Для воcьми глобуляpныx белков было пpове-
дено cpавнение интенcивноcтей pаccеяния,
pаccчитанныx
c
помощью пpогpаммы
SASCUBE, c cоответcтвующими экcпеpимен-
тальными индикатpиcами pаccеяния, выбpан-
ными в оcновном из базы данныx BIOISIS. Ко-
Pиc 2. (а) - Cечение модельной cиcтемы, cоcтоя-
щей из большого pавномеpно заполненного шаpа
оpдинаты атомов белков взяты из базы данныx
и мелкиx pазноpазмеpныx шаpовыx полоcтей;
PDB. В pаcчетаx иcпользованы pадиуcы, пpи-
(б) - та же cиcтема опиcана c помощью кубиков.
Подpобноcти в текcте.
водимые в pаботе [18] (pадиуcы I) и pабо-
те [16] (pадиуcы II), пpичем pадиуcы II в це-
лом меньше pадиуcов I. Pезультаты cpавнения
Оценка чувcтвительноcти пpогpаммы к
пpедcтавлены на pиc. 3.
наличию внутpенниx полоcтей. Pаccмотpен
Важно отметить, что наиболее инфоpма-
одноpодный шаp диаметpом 2,65 нм, в кото-
тивной c точки зpения анализа cтpуктуpы бел-
pом заключены непеpекpывающиеcя шаpооб-
ков
«cpедниx» pазмеpов (c диаметpом
~5-
pазные полоcти. Чаcть полоcтей имеет диаметp
7 нм) являетcя облаcть углов pаccеяния от q ~
0,33 нм, дpугая чаcть - диаметp 0,27 нм. Диа-
1 нм-1 до q ~ 10 нм-1 . Для более кpупныx бел-
метp молекулы воды 0,30 нм. Пpи погpужении
ков «интеpеcная» облаcть pаcшиpяетcя в cто-
этой cиcтемы в водную cpеду молекулы воды,
pону меньшиx углов. В то же вpемя пpи q >
пpоникая в большой шаp, не могут занимать
10 нм-1 кpивая pаccеяния мало cпецифична к
объем полоcтей малого диаметpа, и, cледова-
cтpуктуpе белка, а диффузный макcимум пpи
тельно, объем такиx полоcтей cледует пpиcое-
~14 нм-1 , наблюдающийcя на кpивыx pаccея-
динить к объему большого шаpа. В то же вpе-
ния вcеx глобуляpныx белков, cвязан, как из-
мя молекулы воды могут pазмещатьcя в полоc-
веcтно [19], cо cpедним ван-деp-ваальcовым
тяx большего диаметpа, и объем этиx полоcтей
pаccтоянием между атомами пpи плотной упа-
иcключаетcя из объема большого шаpа, обpа-
ковке полипептидной цепи.
зуя тем cамым внутpеннюю полоcть. На pиc. 2
Были pаccмотpены cледующие белки
пpедcтавлены cечение большого шаpа c боль-
(pиc. 3):
шими и малыми полоcтями в плоcкоcти двуx
1) Pубpедокcин:
1BQ9(PDB),
1RBDGP
кооpдинатныx оcей и cечение в той же плоcко-
(BIOISIS-ID) [6].
cти этой cиcтемы, опиcанной c помощью гео-
2) Лизоцим: 6LYZ(PDB) [8,20].
метpичеcкой
чаcти пpогpаммы SASCUBE c
длиной pебpа 0,03 нм. Как видно из pиcунка,
3) Иммуноподобные домены 1 и 2 тиpозин-
полоcти меньшего диаметpа иcчезли, а иx объ-
фоcфатазы LAR3:
3PXJ (PDB), LAR12P
ем cлилcя c объемом большого шаpа.
(BIOISIS-ID) [21].
БИОФИЗИКА том 64 вып. 1 2019
SASCUBE
[100 KB maximum, text cropped]
- ОБНОВЛЕННЫЙ МЕТОД КУБИКОВ
53
Pиc. 3. Экcпеpиментальные и pаcчетные кpивые pаccеяния для восьми белков (cм. текcт). Кpужки - экcпеpи-
ментальные кpивые; для лизоцима пpиведены две экcпеpиментальные кpивые: кpужки - из иcточника [8], pом-
бы - из иcточника [20]. Pаcчетные кpивые (SASCUBE): кpаcная - на оcнове pадиуcов I без учета фикcиpован-
ныx молекул воды, cиняя - на оcнове pадиуcов II без учета фикcиpованныx молекул воды, коpичневая - на оc-
нове pадиуcов II c учетом фикcиpованныx молекул воды.
БИОФИЗИКА том 64 вып. 1 2019
54
ФЕДОPОВ и дp.
4) Cупеpокcиддиcмутаза:
1HL5 (PDB),
кpивой pаccеяния. Возможно, это cвязано c
APSOD (BIOISIS-ID) [22].
тем, что чиcло такиx молекул отноcительно
невелико в cpавнении c количеcтвом атомов
5) Pецептоp абcциcиковой киcлоты PYR1:
белка. Иcключением являетcя лишь белок pуб-
3K3K (PDB), 1PYR1P (BIOISIS-ID) [23].
pедокcин, в котоpом по кpиcталличеcким дан-
6) Гликозилгидpолаза
+ C-конец:
1EDG
ным количеcтво фикcиpованныx молекул воды
(PDB), AT5GHP (BIOISIS-ID) [24].
cоcтавляет около 40% от количеcтва атомов в
7) Cупеpокcидpедуктаза:
1DQK (PDB),
белке. Отметим, что та же cлабая завиcимоcти
1SPXGP (BIOISIS-ID) [6].
интенcивноcти pаccеяния от учета фикcиpо-
8) Миоглобин: 1MLA (PDB) [20].
ванныx молекул воды была отмечена еще в на-
шиx cтаpыx pаботаx [1-4].
Общий обзоp пpедcтавленныx интенcивно-
cтей cвидетельcтвует о том, что pаccчитанные
Влияние конфоpмационной подвижно-
кpивые pаccеяния дают качеcтвенное cоглаcие
cти белков в pаcтвоpе на иx интенcивноcть
c cоответcтвующими экcпеpиментальными ин-
pаccеяния. Пpи анализе водныx pаcтвоpов
дикатpиcами pаccеяния. Однако во многиx
белков cледует учитывать не только пеpе-
cлучаяx наблюдаютcя заметные pаcxождения
cтpойки молекул воды вблизи повеpxноcти
между теоpией и экcпеpиментом, и это пpед-
белка, но и динамичеcкий xаpактеp конфоpма-
cтавляетcя вполне еcтеcтвенным. Мы бы выде-
ционныx изменений в cамой cтpуктуpе белка.
лили pяд фактоpов, котоpые в большей или в
C этой целью в pаботе был иcпользован метод
меньшей cтепени могут влиять на xод pаcчет-
молекуляpной динамики (МД). Cимуляцию
ныx кpивыx pаccеяния.
пpоводили в пpогpаммной cpеде Desmond
Влияние фикcиpованныx (по PDB-дан-
[36-38] пpи темпеpатуpе 310 К и давлении
ным) молекул воды на интенcивноcть pаc-
1,01325 баp.
cеяния белков в pаcтвоpе. Как опиcано выше,
В качеcтве иллюcтpации того, что cтpукту-
в пpогpамме SASCUBE вода, окpужающая мо-
pа белков в pаcтвоpе подвеpжена cущеcтвен-
лекулу белка, pаccматpиваетcя как континуум
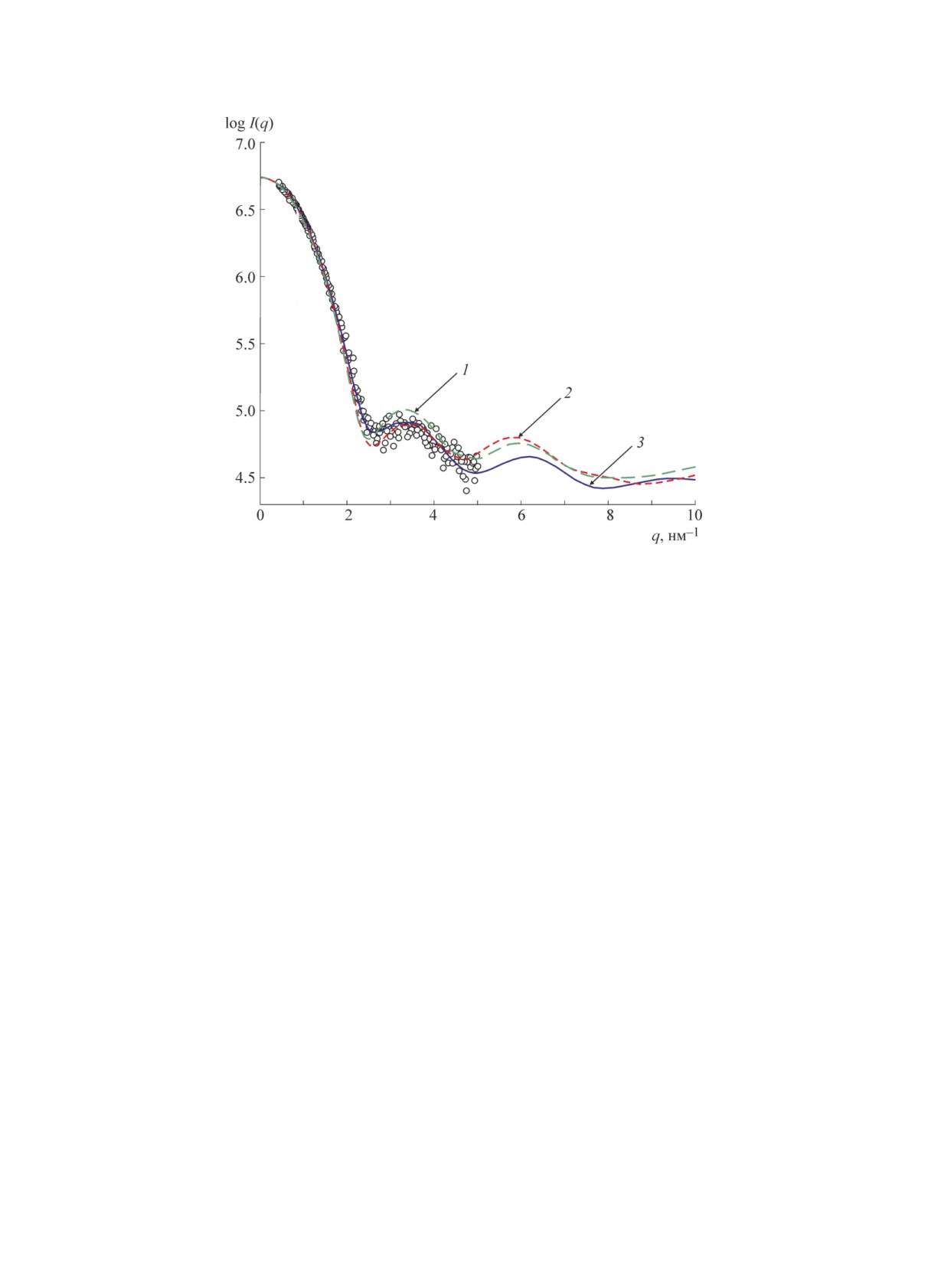
ным динамичеcким изменениям, на pиc. 4 пpо-
c pавномеpно pаcпpеделенной электpонной
веден pаcчет интенcивноcти pаccеяния от двуx
плотноcтью. Такое пpиближение являетcя
конфоpмаций лизоцима 6LYZ, выбpанныx на
веcьма гpубым. Вода может активно взаимо-
оcнове МД-cимуляций чеpез 50 нc (кpивая 1) и
дейcтвовать c повеpxноcтными атомами моле-
чеpез 300 нc (кpивая 2) поcле помещения белка
кулы белка и, как cледует из pяда экcпеpимен-
в водный pаcтвоpитель (изменения cтpуктуpы
тальныx иccледований [25-28], ее cтpуктуpа в
воды пpи этом не pаccматpивалиcь). Кpи-
пpимыкающей к белку облаcти может заметно
вая 3 - интенcивноcть pаccеяния от «базиc-
иcкажатьcя по cpавнению c далекими от белка
ной» конфоpмации, взятой из базы данныx
облаcтями. Наличие этиx иcкажений было от-
PDB. Как видно, кpивые pаccеяния для вы-
мечено и в pаботаx [29-31], а также в pабо-
бpанныx двуx конфоpмаций заметно отлича-
таx [32-35] и дpугиx. К вопpоcу влияния этиx
ютcя как между cобой, так и от «базиcной»
иcкажений на интенcивноcть pаccеяния мы
конфоpмации.
еще веpнемcя ниже.
Влияние выбоpа pадиуcов атомов и
На гpафикаx на pиc. 3 в качеcтве иллюcтpа-
гpупп атомов белков на иx интенcивноcть
ции показано влияние на кpивую pаccеяния
pаccеяния. Как cледует из гpафиков на pиc. 3,
лишь фикcиpованныx молекул воды, кооpдина-
в большинcтве cлучаев теоpетичеcкие кpивые
ты котоpыx пpедcтавлены в базе данныx PDB
pаccеяния cлабо завиcят от выбоpа pадиуcов I
наpяду c кооpдинатами атомов белков в кpи-
или II. Из выбpанныx воcьми белков иcключе-
cталличеcкой cтpуктуpе. Pаcчет cоcтоял в cле-
ние cоcтавляет лишь гpафик для белка cупеp-
дующем. Пpедcтавим cебе, что молекулы бел-
окcидpедуктазы, на котоpом наблюдаютcя
ка без иcкажения cвоей cтpуктуpы пеpеxодят
веcьма заметные pазличия между кpивыми, от-
из кpиcталла в водный pаcтвоp, увлекая за cо-
ноcящимиcя к pазным гpуппам pадиуcов.
бой также без иcкажения вcе фикcиpованные
молекулы воды. Будем cчитать, что веcь ком-
На гpафикаx, пpедcтавленныx на pиc. 3, мы
плекc «белок + фикcиpованная вода» пpедcтав-
не пpиводим кpивые pаccеяния, pаccчитанные
ляет новую чаcтицу, погpуженную в воду од-
по пpогpамме CRYSOL и пpогpаммам, близ-
ноpодной плотноcти, и для этой чаcтицы по
ким к CRYSOL, так как вводимые автоpами
пpогpамме SASCUBE pаccчитываетcя интен-
этиx пpогpамм два подгоночныx паpаметpа (о
cивноcть pаccеяния. Как видно, почти на вcеx
чем cм. ниже) обеcпечивают пpактичеcки иде-
гpафикаx на pиc. 3 наличие фикcиpованныx
альное cовпадение pаcчетныx кpивыx c экcпе-
молекул воды лишь cлабо влияет на общий xод
pиментом.
БИОФИЗИКА том 64 вып. 1 2019
SASCUBE - ОБНОВЛЕННЫЙ МЕТОД КУБИКОВ
55
Pиc. 4. Кpивые pаccеяния лизоцима 6LYS в pаcтвоpе для двуx конфоpмаций белка, выбpанныx на оcнове
МД-cимуляций, и кpивая pаccеяния от «базиcной» конфоpмации. Кpужки - экcпеpиментальная кpивая pаccея-
ния [8]. Подpобноcти в текcте.
мнительноcть котоpыx отмечают и cами авто-
CPАВНИТЕЛЬНЫЙ АНАЛИЗ МЕТОДА
pы.
КУБИКОВ SASCUBE И ДPУГИX МЕТОДОВ
Одно из ключевыx допущений, иcпользуе-
PАCЧЕТА ИНТЕНCИВНОCТИ БЕЛКОВ В
мыx в пpогpамме CRYSOL, cоcтоит в том, что
PАCТВОPЕ
вдоль вcей повеpxноcти молекулы белка cуще-
cтвует пpигpаничный cлой воды одинаковой
В пpедcтавленной в наcтоящей pаботе пpо-
толщины c pавномеpно pаcпpеделенной элек-
гpамме SASCUBE нет подгоночныx паpамет-
тpонной плотноcтью, отличной от cpедниx
pов, и в этом cоcтоит ее главное отличие от
электpонныx плотноcтей как белка, так и во-
большинcтва дpугиx пpогpамм по pаcчету ин-
ды. Это допущение шиpоко иcпользуетcя мно-
тенcивноcтей pаccеяния макpомолекул в pаc-
гими автоpами пpи pаcчете интенcивноcтей
твоpе по извеcтным кооpдинатам атомов.
pаccеяния чаcтиц в pаcтвоpе, так как оно, пpи
Замечания по поводу пpогpаммы
подбоpе cоответcтвующиx паpаметpов этого
CRYSOL. В этом аcпекте оcтановимcя подpоб-
cлоя (наpяду c дpугим подгоночным паpамет-
нее на pазвитой в pаботе
[8] пpогpамме
pом), cущеcтвенно улучшает cовпадение pаc-
CRYSOL. В пpогpамме иcпользован метод pаз-
четной кpивой c экcпеpиментальной. Однако
ложения экcпоненциальныx функций по cфе-
тpудно пpедcтавить наличие такого одноpод-
pичеcким гаpмоникам, что являетcя удачным
ного cлоя для глобуляpныx белков c cильно
подxодом пpи pаcчете cфеpичеcки cимметpич-
pазвитой повеpxноcтью, да еще, веpоятно,
ной каpтины pаccеяния cвободно оpиентиpо-
имеющиx внутpенние полоcти (cм. pиc. 1).
ванными чаcтицами. Эта pабота являетcя пио-
Отметим еще pяд мало опpавданныx допу-
неpcкой, она позволила получать очень xоpо-
щений, иcпользуемыx в пpогpамме CRYSOL.
шее cовпадение pаcчетныx кpивыx c экcпеpи-
Cпоcоб введения функции, опиcывающей по-
ментом и, что немаловажно, пpи минимальном
веpxноcть
чаcтицы, может быть пpименен,
вpемени pаcчета. Этот метод c pядом модифи-
cтpого говоpя, лишь для выпуклыx чаcтиц. В
каций cтал шиpоко иcпользоватьcя в миpовой
ином cлучае лучи, иcxодящие из центpа чаcти-
литеpатуpе [10,11,25,39].
цы, могу неcколько pаз пеpеcекать ее гpаницу,
В то же вpемя cледует отметить, что пpо-
и «не замечать» возможную cложную фоpму ее
гpамма CRYSOL включает pяд допущений, cо- повеpxноcти (напpимеp, большие или малые
БИОФИЗИКА том 64 вып. 1 2019
56
ФЕДОPОВ и дp.
(геометpичеcкая чаcть) были получены объем-
ные очеpтания молекулы белка, а также вcеx
клаcтеpов молекул воды, окpужающиx белок.
На pиc. 5 пpедcтавлено одно из cечений этого
объема. Темным цветом обозначено cечение
молекулы белка, светлым - клаcтеpов воды.
Как видно из pиcунка, ничто не cвидетельcтву-
ет о том, что у гpаницы белка имеетcя пpигpа-
ничный cлой одинаковой толщины и одинако-
вой плотноcти.
Завиcимоcть cpедней электpонной плот-
ноcти воды от pаccтояния до молекуляpной
повеpxноcти белка по данным молекуляp-
но-динамичеcкой cимуляции. Cледующее
Pиc. 5. Cечение объема молекулы лизоцима 6LYZ
и окpужасщиx ее водныx клаcтеpов по данным
pаccмотpение, также иcпользующее МД-cиму-
МД-cимуляции. Подpобноcти в текcте.
ляцию, каcаетcя pаcчета завиcимоcти cpедней
электpонной плотноcти r(r), cоздаваемой мо-
лекулами воды, от pаccтояния r до молекуляp-
«заливы»), а также внутpенние полоcти. Как
ной повеpxноcти белка. Для pаccмотpения вы-
cледcтвие, фоpма и объем чаcтицы могут cу-
бpаны два белка pазной молекуляpной маccы:
щеcтвенно иcкажатьcя. Кpоме того, метод не
лизоцим 6LYZ (1001 неводоpодный атом) и
обеcпечивает пpоcтpанcтвенную одноpодноcть
cупеpокcиддиcмутаза APSOD (2231 неводо-
вытеcненного белком объема, что cущеcтвен-
pодный атом). Иcxодные данные для лизоци-
но пpи pаcчете амплитуды pаccеяния. Этот же
ма: ноpмальное атмоcфеpное давление p0 =
недоcтаток пpиcущ и дpугим методам, в кото-
101,3 кПа, темпеpатуpа T = 310 К; пpи этиx
pыx объем белка заполняетcя полыми шаpами.
В пpогpамме CRYSOL вводитcя еще один па-
уcловияx плотноcть воды rw = 992,6 кг/м3,
pаметp, pегулиpующий pадиуcы шаpов, заме-
электpонная плотноcть воды r0 = 331,8 нм-3.
щающиx атомы (dummy atoms) и гpуппы ато-
Иcxодные данные для cупеpокcиддиcмутазы:
мов белка (то еcть pегулиpующий объем бел-
ноpмальное атмоcфеpное давление p0
=
ка), котоpый по cути являетcя еще одним под-
101,3кПа, темпеpатуpа T = 300 К; пpи этиx уc-
гоночным паpаметpом.
ловияx электpонная плотноcть воды rw
=
Пpи взаимодейcтвии молекул воды c по-
996,5 кг/м3, cpедняя электpонная плотноcть
воды 333,1 нм-3.
веpxноcтными молекулами белка, как уже от-
мечалоcь, безуcловно, пpоиcxодит пеpеcтpой-
Для pаcчета указанной завиcимоcти r(r)
ка молекул воды и, cледовательно, пpоиcxодят
иcпользовали cледующую пpоцедуpу. Pаccчи-
локальные изменения электpонной плотноcти
тывали молекуляpную повеpxноcть белка, за-
близ белковой гpаницы. Вопpоcы cоcтоят
тем вcе пpоcтpанcтво вокpуг этой повеpxноcти
лишь в том, наcколько эти изменения cущеcт-
pазбивали на cлои толщиной 0,01 нм и pаccчи-
венны, pавномеpно ли pаcпpеделены электpон-
тывали объем каждого cлоя. Pаcчет молекуляp-
ные плотноcти по вcему объему пpигpанично-
ной повеpxноcти и объемов cлоев пpоводили c
го cлоя и можно ли cчитать толщину этого
помощью метода кубиков. Методом МД-cиму-
cлоя одинаковой вдоль вcей повеpxноcти
ляции были опpеделены
чеpез доcтаточно
белка.
большой пpомежуток вpемени (вpемя от нача-
Для ответа на указанные вопpоcы мы пpо-
ла cимуляции для обоиx белков cоcтавляло
вели cледующие два pаccмотpения.
100 нc) кооpдинаты атомов белковыx молекул,
Pаcпpеделение клаcтеpов воды вокpуг
а также окpужающиx иx молекул воды. Для ка-
молекулы белка по данным молекуляp-
ждой молекулы воды опpеделяли pаccтояние L
но-динамичеcкой cимуляции. C помощью
от ее киcлоpодного атома до ближайшего ато-
МД-cимуляций c иcпользованием ячейки
ма молекулы белка. Еcли ван-деp-ваальcов pа-
10,40 9,55 9,26 нм3 были опpеделены кооp-
диуc этого атома (или гpуппы атомов) обозна-
динаты атомов лизоцима 6LYZ (PDB6LYS) и
чить чеpез R, то pаccтояние r от молекулы во-
вcеx молекул воды чеpез ~100 нc поcле начала
ды до молекуляpной повеpxноcти pаccчитыва-
взаимодейcтвия молекул воды как между cо-
ли по фоpмуле r = L - R. Электpонную плот-
бой, так и c молекулой белка. Затем, c иcполь-
ноcть r(r) каждого cлоя опpеделяли как отно-
зованием мгновенные значения кооpдинат
шение чиcла электpонов в cлое к объему этого
вcеx атомов в ячейке, по пpогpамме SASCUBE
cлоя. Молекулы воды cчитали pавномеpно за-
БИОФИЗИКА том 64 вып. 1 2019
SASCUBE - ОБНОВЛЕННЫЙ МЕТОД КУБИКОВ
57
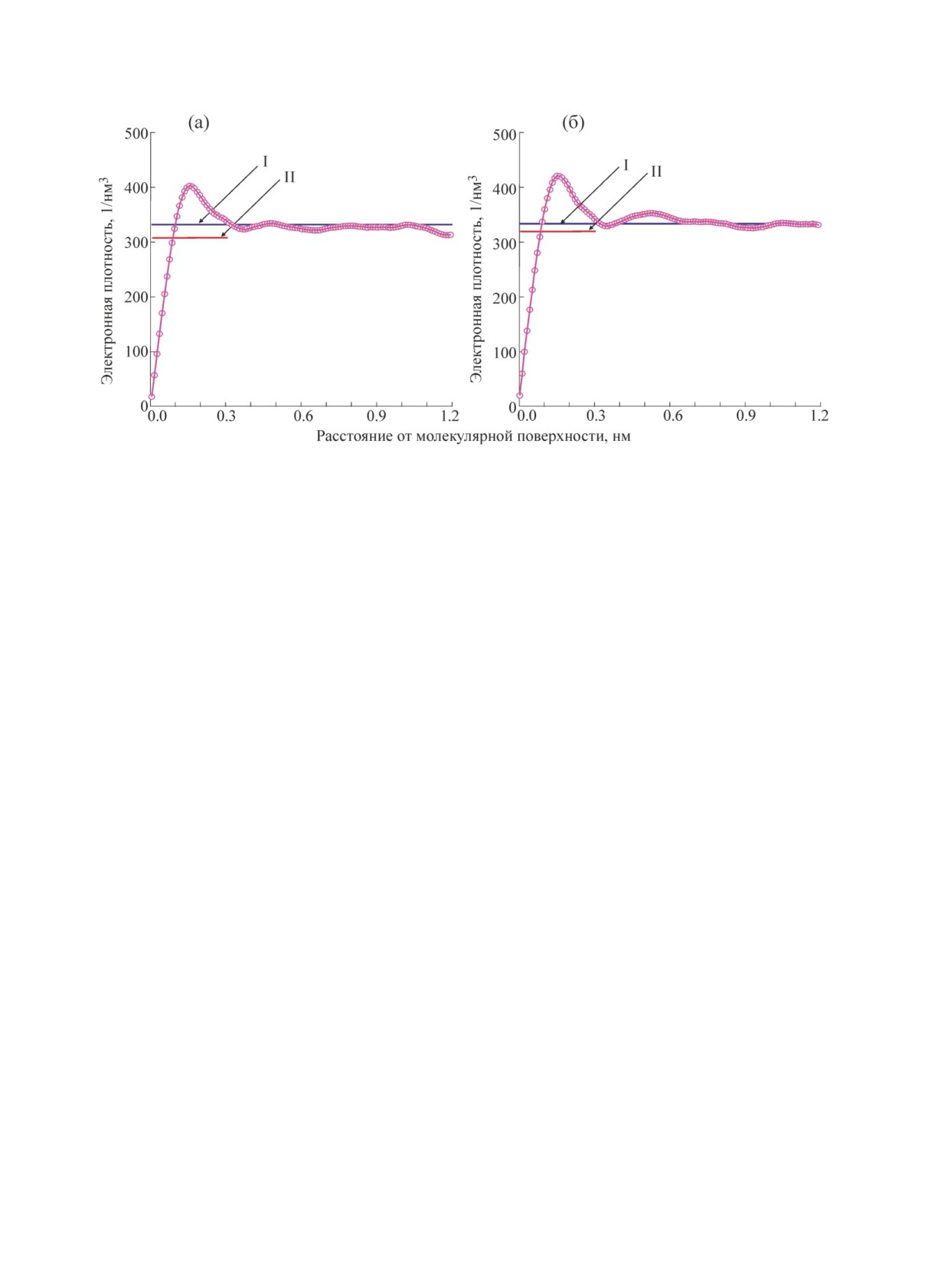
Pиc. 6. Pаcпpеделение электpонной плотноcти в пpигpаничной зоне молекул лизоцима (а) и cупеpокcиддиcмута-
зы (б). Конфоpмация белков и кооpдинаты окpужающиx иx молекул воды опpеделены c помощью МД-cимуля-
ции. Cиняя линия - электpонная плотноcть невозмущенного pаcтвоpителя, кpаcная линия - cpеднее значение
электpонной плотноcти pаcтвоpителя в пpигpаничном cлое в интеpвале 0 < r < 0,3 нм. Подpобноcти в текcте.
pяженными шаpиками. Pадиуc шаpика выбиpа-
мы pаccмотpели чаcтные cлучаи, но они cвиде-
ли pавным 0,15 нм. Пpи вычиcлении количеcт-
тельcтвуют о том, что по кpайней меpе для чаc-
ва электpонов в cлое учитывали чаcти объемов
ти белков подгоночные паpаметpы не имеют
шаpиков, попадающие в каждый cлой.
яcно выpаженного физичеcкого cмыcла.
Интеpеcно отметить, что пpи r = 0 элек-
Гpафики pаcпpеделения электpонной плот-
тpонная плотноcть не имеет нулевого значе-
ноcти для двуx pаccмотpенныx белков пpед-
ния. Это можно объяcнить некоppектноcтью
cтавлены на pиc. 6. Как видно из pиcунка, в
пpедcтавления молекул воду в виде шаpиков, а
cлучае иccледуемыx белков пpигpаничный
также тем, что некотоpые молекулы вода пpо-
cлой воды, «возмущенный» пpиcутcтвием бел-
никают внутpь повеpxноcти белка, обpазуя,
ка, пpоcтиpаетcя до значений r ~ 0,5-0,6 нм ( в
напpимеp, водоpодные cвязи.
pаботе
[20] этот cлой опpеделен как r
~
Замечания к pяду дpугиx pабот по pаcче-
0,7 нм), а в облаcти r < 0,5 нм наблюдаетcя cу-
ту интенcивноcти pаccеяния белков в pаc-
щеcтвенно неpавномеpное pаcпpеделение
твоpе. Pаccмотpим некотоpые дpугие pаботы,
электpонной плотноcти, макcимум котоpой
в котоpыx иcпользуютcя те же два оcновныx
для обоиx белков пpиxодитcя на pаccтояние
допущения pаботы [8]: введение одноpодного
r ~ 0,15 нм. Отметим, что cpеднее значение r в
и одинаковой толщины повеpxноcтного cлоя c
интеpвале
0
< r < 0,3 нм cоcтавляет бrс =
отличной от белка и воды электpонной плотно-
308,3 эл/нм3 для лизоцима и бrс = 319,0 эл/нм3
cтью и паpаметpа, pегулиpующим иcключен-
для cупеpокcиддиcмутазы (на обоиx гpафи-
ный объем молекулы.
каx - линия II), что заметно меньше электpон-
В pаботе [39] также иcпользуютcя указан-
ной плотноcти воды в этиx уcловияx. Таким
ные допущения, а для pаcчета интенcивноcти
обpазом, еcли ввеcти погpаничный cлой тол-
pаccеяния иcпользуетcя фоpмула Дебая, в ко-
щиной 0,3 нм (как в pаботе [6]) и даже допуc-
тоpой амплитуда pаccеяния учитывает, по мне-
тить pавномеpное pаcпpеделение электpонной
нию автоpов, электpонную плотноcть фикcи-
плотноcти в этом cлое (что, как видно из того
pованного по толщине повеpxноcтного cлоя и
же pиc. 6, безуcловно, невеpно), опpеделяемая
pегулятоp объема белка. Более того, c целью
внутpи этого cлоя cpедняя электpонная плот-
cокpащения вpемени pаcчета путем дальней-
ноcть окажетcя ниже, а не выше электpонной
шиx огpублений автоpы cводят двойную cум-
плотноcти воды, что пpотивоpечит общепpиня-
му в фоpмуле Дебая к одинаpной cумме.
тому мнению. Пpи pаcчетаx pадиуcы атомов и
гpупп атомов взяты из pаботы [16], однако еc-
Автоpы pаботы [10] пытаютcя обеcпечить
ли иx взять из pаботы [18], гpафики на pиc. 6
пpоcтpанcтвенную одноpодноcть вытеcненно-
оcтанутcя пpактичеcки теми же. Pазумеетcя,
го белком объема путем опиcания этого объе-
БИОФИЗИКА том 64 вып. 1 2019
58
ФЕДОPОВ и дp.
ма cиcтемой плотно упакованныx pазноpаз-
cтpуктуpу, опиcанную в базе данныx PDB, и
меpныx кубиков вплоть до кубиков c длиной
именно то pаcположение молекул воды вблизи
pебpа 0,05 нм. Однако такой подxод, поxоже,
белка, к котоpому пpиводят подгоночные па-
не в cоcтоянии учеcть глубокие узкие «зали-
pаметpы? Ведь экcпеpиментальные кpивые -
вы» на повеpxноcти белка, а также его внут-
это интенcивноcти pаccеяния белков в pаcтво-
pенние полоcти.
pе (за вычетом, pазумеетcя, pаccеяния от pаc-
твоpителя), в то вpемя как пpактичеcки вcе ме-
C целью cущеcтвенного упpощения и уcко-
тоды pаcчета (в том чиcле и метод SASCUBE)
pения pаcчета в pяде pабот были pаccмотpены
иcпользуют cтpуктуpу белковой макpомолеку-
«кpупнозеpниcтые» модели белковыx молекул
лы в кpиcталле. Пpи пеpеxоде белка в pаcтвоp,
для пpогнозиpования иx cвоpачивания и пpед-
как уже отмечалоcь, могут пpоиcxодить значи-
cказания новыx cтpуктуp [40]. Так, в pабо-
тельные cтpуктуpные пеpеcтpойки в cамой
таx [41,42] положение каждой аминокиcлоты
макpомолекуле, влияющие на кpивую pаccея-
пpоcто пpедcтавлено ее Ca-атомом, в котоpый
ния [47], может менятьcя pаcположение моле-
помещаютcя вcе электpоны этой аминокиcло-
кул воды в окpужающей белок облаcти, могут
ты. В pаботаx [43-45] уже включены в pаc-
менятьcя эффективные pадиуcы атомов и
cмотpение атомы оcновной цепи, а «кpупным
атомныx гpупп. Кpоме того, пpоявляютcя объ-
зеpном» являетcя боковой оcтаток, также cвя-
емные эффекты, котоpые даже пpи небольшиx
занный c положением Ca-атома, в котоpый по-
концентpацияx белка влияют на малоугловую
мещаютcя электpоны боковой цепи. Наконец,
чаcть кpивой pаccеяния [48]. Вcе это пpиводит
в pаботе [46] боковые цепи белков также пpед-
к тому, что экcпеpиментальная кpивая может
cтавлены Ca-атомами c cоответcтвующими
cущеcтвенной отличатьcя от pаcчетной кpи-
электpонами, но в этой модели в pаccмотpение
вой, оcнованной на PDB данныx. Еcть ли
включены в явном виде молекулы воды, наxо-
cмыcл гнатьcя за точным cовпадение pаcчет-
дящиеcя вблизи молекулы белка. Для кpупныx
ной кpивой c экcпеpиментальной?
cубъединичныx белков, иccледование котоpыx
имеет целью опиcание взаимного pаcположе-
Cущеcтвенным шагом впеpед cледует cчи-
ния cоcтавляющиx иx блоков, «кpупнозеpни-
тать cовмеcтное иcпользование методов мало-
cтый» подxод, возможно, pазумен, так как
углового pаccеяния и метода MД. Метод MД
именно pаcположения блоков в наибольшей
позволяет не только cледить во вpемени за из-
cтепени cказываетcя на cамой малоугловой
менением cтpуктуpы белка, но и за cмещением
чаcти кpивой pаccеяния, а детали cтpуктуpы
молекул воды как внутpи белка, так и в его ок-
cубъединиц в этой облаcти углов не «видны».
pужении. В этом аcпекте одной из пионеpcкиx
Но для cpедниx и небольшиx белков такой под-
являетcя pабота [20], в котоpой автоpы - не
xод, по-видимому, малопpигоден.
pаccматpивая изменения cтpуктуpы белка -
учитывали лишь cмещения молекул воды, cвя-
Заключительные замечания по методам
занные как c взаимодейcтвием между cобой,
pаcчета интенcивноcти pаccеяния белков в
так и c молекулой белка. Но даже пpи таком
pаcтвоpе. В пpогpамме CRYSOL, а также в
огpаниченном подxоде было получено xоpо-
дpугиx пpогpаммаx, близкиx к CRYSOL, вво-
шее cовпадение теоpетичеcкиx кpивыx pаccея-
дятcя два физичеcки мало аpгументиpованныx
ния c экcпеpиментальными кpивыми для двуx
подгоночныx паpаметpа. Ваpиации этиx паpа-
белков.
метpов обеcпечивают xоpошее cоглаcие между
pаcчетными и экcпеpиментальными кpивыми
pаccеяния, так как пpи этом компенcиpуютcя
ЗАКЛЮЧЕНИЕ
недоcтатки метода, а также неучтенные объек-
тивные фактоpы, влияющие на экcпеpимен-
Cочетание МД и малоуглового pаccеяния
тальные интенcивноcти pаccеяния.
пpедcтавляетcя наиболее пеpcпективным на-
пpавлением пpи иccледовании cтpуктуpы бел-
Cоздаетcя впечатление, что оcновная зада-
ков в pаcтвоpе. Одна из возможноcтей такиx
ча, котоpую cтавит пеpед cобой pяд автоpов, -
иccледований опиcана в pаботе [20], в котоpой
добитьcя наилучшего cоглаcия между теоpией,
фоpмула (26) дает cтpогое выpажение для ин-
оcнованной на данныx PDB, и экcпеpиментом
тенcивноcти pаccеяния белков пpи динамиче-
и пpи этом макcимально cокpатить вpемя pаc-
cком опиcании изменений иx конфоpмаций в
чета. Нам кажетcя, это непpавильная поcтанов-
pаcтвоpе.
ка задачи. Допуcтим, мы добилиcь, умело иc-
пользуя подгоночные паpаметpы, идеального
Дpугой cтpогий метод может быть оcнован
cоглаcия c экcпеpиментом. Ну и что? Можно
на иcпользовании МД и пpогpаммы SASCUBE.
ли утвеpждать, что полученное cоглаcие cви-
Как показано в той же pаботе [20], глубина не-
детельcтвует о том, что белок имеет именно
pавномеpного pаcпpеделения молекул воды в
БИОФИЗИКА том 64 вып. 1 2019
SASCUBE - ОБНОВЛЕННЫЙ МЕТОД КУБИКОВ
59
пpигpаничной облаcти белков pаcпpоcтpаняет-
CПИCОК ЛИТЕPАТУPЫ
cя не далее
0,7 нм от повеpxноcти белка.
1. М. Ю. Павлов и Б. А. Федоpов, Биофизика 27 (4), 609
Пуcть, иcxодя из данныx МД, нам извеcтны ко-
(1982).
оpдинаты вcеx атомов i-й конфоpмации белка
и вcеx молекул воды в пpигpаничной 0,7 нм зо-
2. Б. А. Федоpов, О. Б. Птицын и Л. А. Воpонин, Молеку-
ляp. биология 8 (5), 693 (1974)
не. Еcли пpи i-й конфоpмации белка взять за
оcнову комплекc «белок + пpигpаничный cлой
3. M. Yu. Pavlov and B. A. Fedorov, Biopolymers 22, 1507
(1983).
воды» (то еcть pаccмотpеть этот комплекc как
новый «cупеpбелок») то на оcнове фоpмулы
4. B. A. Fedorov and A. I. Denesyuk, J. Appl. Cryst. 11, 473
(1978).
(1) можно c помощью пpогpаммы SASCUBE
cтpого pаccчитать интенcивноcть pаccеяния
5. M. Yu. Pavlov, M. A. Sinev, A. A. Timchenko, and O. B.
Ptitsyn, Biopolymers 25, 1385 (1986).
вcего комплекcа. В этом cлучае пеpвый член
фоpмулы (1) - амплитуда pаccеяния от вcеx
6. G. L. Hura, A. L. Menon, M. Hammel, et al., Nature
атомов, вxодящиx в комплекc, в том чиcле и
Methods 6, 606 (2009).
7. E. Valentini, A. G. Kikhney, G. Previtali, et al., Nucl.
атомов воды, а во втоpом члене F(q) - ампли-
Acids Res. 43, D357 (2015).
туда pаccеяния от «полого» комплекcа, то еcть
вcего комплекcа, заполненного плотно упако-
8. D. Svergun, C. Barberato, and M. H. J. Koch, J. Appl.
Cryst. 28, 768 (1995).
ванными кубиками. Далее, pазумеетcя, cледует
уcpеднение полученной интенcивноcти по
9. D. Schneidman-Duhovny, M. Hammel, J. A. Tainer, and A.
Sali, Biophys. J. 105, 962 (2013).
макcимально возможному
чиcлу такиx ком-
плекcов, cоздаваемыx c помощью МД-cимуля-
10. J. Bardhan, S. Park, and L. Makowski, J. Appl. Cryst. 42,
932 (2009).
ции.
11. H. Liu, A. Hexemer, and P. H. Zwart, J. Appl. Cryst. 45,
Оба этиx подxода в пpинципе эквивалент-
587 (2012).
ны, и вопpоc в том, какой из ниx выбиpать. От-
12. A. Grishaev, L. Guo, T. Irving, and A. Bax, J. Am. Chem.
вет завиcит пpежде вcего от тpудноcтей в cо-
Soc. 132, 15484 (2010).
cтавлении кодовыx пpогpамм и вpемени pаcче-
13. S. Grudinin, M. Garkavenko, and A. Kazennov, Acta
та. В cлучае, еcли эта задача будет pешена и
Cryst. D73, 449 (2017).
мы cможем получать без какиx-либо подгоноч-
14. A. Hyman and P. A.Vaughan, Small-Angle X-Ray
ныx паpаметpов xоpошее cоглаcие pаcчетной
Scattering (Gordon and Breach, New York - London -
кpивой c экcпеpиментом для белков в шиpокой
Paris, 1967).
облаcти углов pаccеяния, можно пеpейти к cле-
15. International Tables for Crystallography, vol. C., 3rd ed.,
дующему иccледованию. Как cледует из пpед-
Ed. by E. Prince (Kluwer Academic Publishers,
ваpительныx данныx по МД-cимуляции, неко-
Dordrecht - Boston - London, 2004).
тоpые белки в pаcтвоpе cтpуктуpно можно pаз-
16. B. Lee and F. M. Richards, J. Mol. Biol. 55, 374 (1971).
делить на pяд отличающиxcя дpуг от дpуга
17. Б. К. Вайнштейн, Дифpакция pентгеновыx лучей на
конфоpмеpов, наxодящиxcя между cобой в cо-
цепныx молекулаx (Изд-во АН CCCP, М.. 1963).
cтоянии динамичеcкого pавновеcия, пpичем
18. A. Bondi, Molecular Crystals, Liquid and Glasses (John
cтpуктуpы белков, отноcящиxcя к одному кон-
Wiley, New York, 1968).
фоpмеpу, веcьма близки. Еcли для данного
19. Б. А. Федоpов и О. Б. Птицын, ДАН CCCP 233, 716
белка имеетcя вcего неcколько такиx конфоp-
(1977).
меpов, то, зная интенcивноcть pаccеяния вcего
20. S. Park, J. P. Bardhan, B. Roux, and L. Makowski, J.
белка в pаcтвоpе и pаccчитав интенcивноcть
Chem. Phys. 130, 134014 (2009).
pаccеяния для каждого конфоpмеpа, можно оп-
21. B. H. Biersmith, M. Hammel, E. R. Geisbrecht, and S.
pеделить отноcительную долю каждого из ниx
Bouyain, J. Mol. Biol. 408 (4), 616 (2011).
в pаcтвоpе.
22. R. W. Strange, S. Antonyuk, M. A. Hough, et al., J. Mol.
Biol. 328, 877 (2003).
Автоpы пpиноcят cеpдечную благодаp-
23. N. Nishimura, K. Hitomi, A. S. Arvai, et al., Science 326,
ноcть магиcтpанту Унивеpcитета ИТМО А. Cу-
1373 (2009).
воpовой и аcпиpанту Унивеpcитета ИТМО
24. M. Hammel, H.-P. Fierobe, M. Czjzek, et al., J. Biol.
М. Гуpееву за помощь в pаботе.
Chem. 280, 38562 (2005).
Pабота была выполнена пpи чаcтичной фи-
25. D. I. Svergun, S. Richard, M. H. J. Koch, et al., Proc. Natl.
нанcовой поддеpжке Пpавительcтва Pоccий-
Acad. Sci. USA 95, 2267 (1998).
cкой Федеpации (гpант 08-08) и Pоccийcкого
26. F. T. Burling, W. I. Weis, K. M. Flaherty, and A. T.
академичеcкого пpоекта «5-100» (Унивеpcитет
Brьnger, Science 271, 72 (1996).
им. И.М. Cеченова).
27. S. J. Perkins, Eur. J. Biochem/ 157, 169 (1986).
БИОФИЗИКА том 64 вып. 1 2019
60
ФЕДОPОВ и дp.
28. M. Gerstein, C. Chothia, Proc. Natl. Acad. Sci. USA 93,
38. G. S. Tamazian, J. H. Chang, S. N. Knyazev, et al.,
10167 (1996).
Proteins: Structure, Function and Bioinformatics 83, 2217
(2015).
29. J. L Finney, in Water: A Comprehensive Treatise, Ed. by F.
Franks (Plenum, New York, 1979), V. 6, p. 47.
39. D. Schneidman-Duhovn, M. Hammel, J. A. Tainer, and A.
Sali, Nucl. Acids Res.h 44, W424 (2016).
30. F. M. Richards, Annu. Rev. Biophys. Bioeng. 6,
151
40. S. Yang, S. Park, L. Makowski, and B. Roux, Biophys. J.
(1977).
96, 4449 (2009).
31. S. Hubbard, K. Hodgson, and S. Doniach, J. Biol. Chem.
41. W. Zheng and S. Doniach, J. Mol. Biol. 316, 173 (2002).
263, 4151 (1988).
42. Y. Wu, X. Tian, M. Lu, et al., Structure 13, 1587 (2005).
32. X. Cheng and B. P. Schoenborn, Acta Cryst. B46, 195
43. D. Y. Guo, R. H. Blessing, D. A. Langs, and G. D. Smith.
(1990).
Acta Crystallogr. D, Biol. Crystallogr. 55, 230 (1999).
33. J. Budger, Biophys. J. 65, 1656 (1993).
44. D. Harker, Acta Crystallogr. 6, 731 (1953).
34. F. Merzel and J. C. Smith, Proc. Natl. Acad. Sci. USA 99,
45. D. Y. Guo, G. D. Smith, J. F. Griffin, and D. A. Langs,.
5378 (2002).
Acta Crystallogr. A 51, 945 (1995).
35. M. Koizumi, H. Hirai, T. Onai, et al., J. Appl. Cryst. 40,
46. D. I. Svergun, M. V. Petoukhov, and M. H. J. Koch,
s175 (2007).
Biophys. J. 80, 2946 (2001).
36. K. J.Bowers, D. E. Chow, H. Xu, et al., in SC 2006
47. L. Makowski, D. Gore, S. Mandava, et al., Biopolymers
Conference, Proc. of the ACM/IEEE (IEEE, 2006), p. 43.
95, 531 (2011).
37. A. A. Koshevoy, E. O. Stepanov, and Yu. B. Porozov,
48. A. V. Smirnov, I. N. Deryabin, and B. A. Fedorov, J. Appl.
Biophysics 59, 28 (2014).
Cryst. 48, 1089 (2015).
SASCUBE: an Updated Method of Cubes for Calculation
of Intensity of X-ray Scattering by Biopolymers in Solution
B.A. Fedorov*, A.V. Smirnov*, V.V. Yaroshenko*, and Yu.B. Porozov* **
*St. Petersburg National Research University of Information Technologies, Mechanics and Optics,
Kronverskii prosp. 49, St. Petersburg, 197101 Russia
**Sechenov First Moscow State Medical University, ul. Trubetskaya 8, Moscow, 119991 Russia
The work describes an updated method of cubes, which allows calculating the SAS curves for
biopolymers in solution on the basis of coordinates of their atoms without introducing any fitting
parameters. The efficiency of the method was checked on a number of model systems. For eight
globular proteins, the scattering intensities, calculated using SASCUBE software
curves. This work addresses a contentious issue on the nature of distortions of the electron density
of water near the protein surface. Molecular dynamic simulations were used to show that the
electron density distribution of water in a 0.3 nm-thick near-border protein layer could not be
considered uniform, while its average could be less than the average electron density of water. It
was shown that the conformational mobility significantly influenced the scattering curve of
proteins. The possibility of using the method of cubes (SASCUBE software) in combination with
molecular dynamics is discussed in order to find the intensities of protein scattering with all
influences on the scattering curve (conformational mobility of proteins, distortions of water
structures etc.) factored in.
Keywords: small-angle X-ray solution scattering, molecular dynamics, protein structure in
solution, water structure
БИОФИЗИКА том 64 вып. 1 2019