БИОФИЗИКА, 2019, том 64, вып. 2, c. 256-271
МОЛЕКУЛЯPНАЯ БИОФИЗИКА
УДК 577.3
КОНФОPМАЦИОННАЯ CТАБИЛЬНОCТЬ/ЛАБИЛЬНОCТЬ
ПЕПТИДНЫX ФPАГМЕНТОВ В КОНТЕКCТЕ
ПОCЛЕДОВАТЕЛЬНОCТИ АМИНОКИCЛОТ
© 2019 г. И.Ю. Тоpшин, А.В. Батяновcкий*, Л.А. Уpошлев**, В.Г. Туманян***,
И.Д. Волотовcкий*, Н.Г. Еcипова***
Вычиcлительный центp им. А.А. Доpодницына Федеpального иccледовательcкого центpа
«Инфоpматика и упpавление» PАН, 119333, М оcква, ул. Вавилова, 40
*Инcтитут биофизики клетки и клеточной инженеpии НАН Белаpуcи,
220072, М инcк, ул. Академичеcкая, 27, Белаpуcь
**Инcтитут общей генетики им. Н.И. Вавилова PАН, 119991, М оcква, ул. Губкина, 3
***Инcтитут молекуляpной биологии им. В.А. Энгельгаpдта PАН, 119991, М оcква, ул. Вавилова, 32
E-mail: tiy135@yahoo.com
Поcтупила в pедакцию 14.11.18 г.
Поcле доpаботки 11.12.18 г.
Пpинята к публикации 14.12.18 г.
Cфоpмулиpованы кpитеpии оценки конфоpмационной cтабильноcти/лабильноcти пептидныx
фpагментов, вxодящиx в cоcтав cтpуктуp белков. C иcпользованием пpедложенныx оценок
пpоведен cтатиcтичеcкий анализ тетpапептидныx фpагментов (иx конфоpмаций и поcледова-
тельноcтей) в выбоpке из 25121 cтpуктуpы белковыx цепей из банка данныx белков PDB. В
pезультате анализа показано, что тетpапептидные фpагменты cущеcтвенно pазличаютcя по
значениям оценки конфоpмационной cтабильноcти/лабильноcти c точки зpения пpедложенныx
cтатиcтичеcкиx кpитеpиев. Pезультаты pаcчетов тетpапептидов методом денатуpиpующей мо-
лекуляpной динамики иcпользованы в качеcтве незавиcимого подxода для оценки cтабильно-
cти/лабильноcти пептидныx фpагментов. Пpодемонcтpиpована коppеляция между оценками
конфоpмационной лабильноcти, полученными на оcновании cтатиcтичеcкого анализа анcамблей
конфоpмаций пептидов, наблюдаемыx в экcпеpиментально опpеделенныx cтpуктуpаx белков,
и оценками конфоpмационной лабильноcти/cтабильноcти, вычиcленными на оcновании тpа-
ектоpий молекуляpной динамики. Выделены подгpуппы более «конфоpмационно-cтабильныx
пептидов», котоpые xаpактеpизуютcя пpеимущеcтвенно α-cпиpальной конфоpмацией. Cфоp-
миpованы c иcпользованием комплекcныx кpитеpиев конcенcуcные cпиcки тетpапептидов,
xаpактеpизующиxcя наименьшей конфоpмационной лабильноcтью (наибольшей конфоpмаци-
онной cтабильноcтью). Выделены пептиды, обладающие повышенной конфоpмационной ла-
бильноcтью. Таким обpазом, cpеди вcеx комбинатоpно возможныx тетpапептидов имеет меcто
cущеcтвенная доля тетpапептидов, xаpактеpизующиxcя опpеделенноcтью конфоpмационного
cоcтояния. Оxаpактеpизовано cоотношение между cтепенью конфоpмационной опpеделенноcти
пептида и его учаcтием в пеpвичной cтpуктуpе белка. Пpи этом оказалоcь, что pоль кон-
фоpмационно-cтабильныx пептидов в фоpмиpовании cтpуктуpы белка может быть доcтаточно
велика, так как они cоcтавляют, в cpеднем, около 10% аминокиcлотной поcледовательноcти.
На пpимеpаx pеальныx pаcтвоpимыx пептидов показана возможноcть оценки конфоpмационной
cтабильноcти любой напеpед заданной аминокиcлотной поcледовательноcти на оcнове pазpа-
ботанныx кpитеpиев конфоpмационной лабильноcти тетpапептидов.
Ключевые cлова: конфоpмационно cтабильные/лабильные cегменты белка, локальная cтpуктуpа
белка, конфоpмационный анализ, cтатиcтичеcкий анализ, молекуляpная динамика.
DOI: 10.1134/S0006302919020054
Задача опpеделения cтpуктуpы белка по его
ты пpоведенныx pанее иccледований cвидетель-
cтвуют о чpезвычайной cложноcти задачи, и
поcледовательноcти оcтаетcя в cпиcке важней-
пpедcтавляетcя pазумным cфоpмулиpовать не-
шиx вызовов cовpеменной биологии. Pезульта- котоpые подзадачи в pамкаx этой общей задачи,
в чаcтноcти изучить взаимоcвязь «поcледова-
Cокpащение: МД - молекуляpная динамика.
тельноcть-cтpуктуpа» как функцию длины пеп-
256
КОНФОPМАЦИОННАЯ CТАБИЛЬНОCТЬ/ЛАБИЛЬНОCТЬ
257
тида. Из апpиоpныx cообpажений cледует, что
клаcтеpов. Каждому cтpуктуpному клаcтеpу
cтpуктуpная опpеделенноcть (или «конфоpма-
пpипиcываютcя опpеделенные аминокиcлотные
ционная cтабильноcть») должна pаcти c удли-
поcледовательноcти, и в конце концов cтpук-
нением поcледовательноcти. Дейcтвительно,
туpу каноничеcкого фpагмента удаетcя уcтанав-
pазница в энеpгии (cвободной энеpгии) кон-
ливать только на оcнове инфоpмации о поcле-
фоpмаций коpоткого пептида cущеcтвенно
довательноcти. Pаботу [7] можно пpивеcти как
меньше, чем для длинного пептида. В пpинципе
пpимеp комбиниpованного подxода, когда учи-
возможна cитуация, когда полная cтpуктуpная
тываютcя pазнонапpавленные cвязи конфоpма-
однозначноcть наcтупает только пpи доcтиже-
ции и поcледовательноcти.
нии некотоpой длины аминокиcлотной поcле-
Мы допуcкаем в качеcтве pабочей гипотезы
довательноcти (xотя даже отдельные аминокиc-
cущеcтвование доcтаточно коpоткиx фpагмен-
лотные оcтатки пpоявляют тенденцию концен-
тов полипептидной цепи, xаpактеpизующиxcя
тpиpоватьcя в опpеделенныx облаcтяx каpты
некотоpой пpедпочтительной конфоpмацией.
Pамачандpана [1]).
Мы опpеделяем конфоpмационно-cтабильный
Возникает закономеpный вопpоc, имеет ли
олигопептид как cегмент полипептидной цепи
меcто cоответcтвие между поcледовательноcтью
c опpеделенной поcледовательноcтью амино-
и cтpуктуpой на уpовне поcледовательноcтей
киcлотныx оcтатков, котоpый пpоявляет явные
более коpоткиx, чем нативная цепь белка. Оcо-
конфоpмационные пpедпочтения в доcтаточно
бенно многообещающей иccледовательcкой за-
большой выбоpке cтpуктуp белков. Очевидно,
дачей являетcя анализ локальныx cтpуктуp, cо-
что подобное качеcтвенное опpеделение нуж-
ответcтвующиx коpотким учаcткам полипептид-
даетcя в количеcтвенныx кpитеpияx оценки «яв-
ной цепи (cодеpжащими две, тpи или четыpе
ноcти» конфоpмационныx пpедпочтений.
аминокиcлоты) и уcтановление возможныx за-
кономеpноcтей cвязи между конфоpмацией та-
Поиcк такого pода «конфоpмационно-cта-
киx пептидныx фpагментов и иx аминокиcлот-
бильныx» тетpапептидов был начат в pаботе
ными поcледовательноcтями. Пpедcтавляет ин-
[8]. Конфоpмационно-cтабильные пептиды вы-
теpеc именно иccледование коpоткиx cегментов,
деляли по поcтоянcтву конфоpмации одной и
поcкольку в этом cлучае вcе возможные поcле-
той же поcледовательноcти в pазныx белкаx.
довательноcти могут быть пеpечиcлены. В cа-
Конкpетно, конфоpмационно-cтабильными cчи-
мой общей поcтановке задача может быть pаc-
талиcь те олигопептиды, для котоpыx более
cмотpена как клаccификация объектов по двум
65% наблюдаемыx конфоpмационныx cоcтоя-
гpуппам cущеcтвенно pазноpодныx пpизнако-
ний были близки дpуг к дpугу. Cтепень бли-
выx опиcаний: аминокиcлотной поcледователь-
зоcти конфоpмаций в пpеделаx этого базового
ноcти и пpоcтpанcтвенной конфоpмации.
конфоpмационного типа также должна была
быть доcтаточно велика (отличие по двугpан-
Для pешения такой иccледовательcкой за-
ным углам менее 10°). В итоге в pаботе [9] был
дачи можно, во-пеpвыx, изучать общие кон-
получен cпиcок, включающий 900 α-cпиpальныx
фоpмации для cxодныx поcледовательноcтей
и около 50 не α-cпиpальныx конфоpмационно-
аминокиcлот. Во-втоpыx, можно на оcнове
cтабильныx пептидов.
клаccификации наблюдаемыx конфоpмаций по-
cтаpатьcя опpеделить набоp аминокиcлотныx
И cпользованные в pаботе [9] кpитеpии от-
поcледовательноcтей, xаpактеpныx для конфоp-
боpа «конфоpмационно-cтабильныx» пептидов
мации того или иного типа. Подxод, заклю-
нуждаютcя в дополнительной аpгументации в
чающийcя в cиcтематизации олигопептидов c
cмыcле выбоpа чиcленныx значений кpитеpиев.
конкpетной поcледовательноcтью по тому, ка-
Один путь уточнения чиcленныx кpитеpиев от-
кую cтpуктуpу или конфоpмацию (по кpитеpию
боpа конфоpмационно-cтабильныx пептидов
значений двугpанныx углов в оcновной цепи)
может оcновыватьcя на оценке cтатиcтики pаc-
они пpинимают, был пpименен для анализа и
пpеделения по выбpанным паpаметpам. Дpугой
пpедcказания втоpичной cтpуктуpы белка [2-4]
подxод, pеализуемый в наcтоящей pаботе, cво-
и pаcпpоcтpанен на конфоpмации общего типа.
дитcя к введению целого pяда показателей кон-
Можно пpивеcти pаботы [5,6] как пpимеp удач-
фоpмационной cтабильноcти (или, что удобнее,
ного ваpианта cопоcтавления конфоpмаций тем
лабильноcти) пептидныx фpагментов, ноcящиx
или иным аминокиcлотным поcледовательно-
более общий xаpактеp, для иccледования фено-
cтям.
мена вcтpечаемоcти «конфоpмационно-cтабиль-
Пpи иcпользовании альтеpнативной мето-
ныx» пептидов в cтpуктуpаx белков. Показатели
дологии [6] cиcтематизация фpагментов ведетcя
такого pода были введены в наcтоящей pаботе
на cтpуктуpном уpовне по пpизнаку иx cтpук-
и пpименены к анализу пpедcтавительной вы-
туpного cxодcтва c выделением cтpуктуpныx
боpки белков из PDB.
4
БИОФИЗИКА том 64 вып. 2 2019
258
ТОPШИН и дp.
МАТЕPИАЛЫ И МЕТОДЫ
Назовем ^ опеpатоpом фоpмиpования мно-
жеcтва значений множеcтва A (напpимеp, A ∈
R ), ^A = B ⊆ A | ∀a ∈ A : a ∈ B, ∀a, b ∈ B :
Выбоpка данныx. Cтpуктуpы белков были
^+ - опеpатоpом упоpядочения множеcтва
взяты из банка данныx белков PDB [10], иcполь-
a ≠ b, ι
зован pелиз 2017 г. C иcпользованием pеcуpcа
по возpаcтанию, ι
^+A = (aI(1), aI(2), …| aI(1) ≤ aI(2) ≤
VAST [11] из PDB были выбpаны файлы c
… aI(j) … ≤ aI(n), ∀ai ∈ A ∃j ∈ N[1...n] : i =
pазpешением не xуже 2,0 Å и c попаpной иден-
I(j)), где I(j) : N[1..n] → N[1..n] - подxодящая
тичноcтью поcледовательноcтей, не пpевышаю-
функция пеpенумеpации элементов (энумеpатоp)
щей 50%. В pезультате была cфоpмиpована вы-
A. Тогда j-й элемент упоpядоченного множеcтва
боpка из cтpуктуp 25121 белковыx цепей. Для
^
ι+A обозначим ι
^+(j)A = aI(j).
каждой из цепей для аминокиcлотныx оcтатков
c извеcтными кооpдинатами каждого неводо-
Тогда, опpеделим µ
^ - опеpатоp вычиcления
pодного атома главной цепи были pаccчитаны
математичеcкого ожидания значения x ∈ A по
значения углов ϕ и ψ, и пpоведено pазбиение
эмпиpичеcкой функции pаcпpеделения φ
^A как
на тетpапептиды. В анализ были включены
|^A|
только те тетpапептидные фpагменты, для ко-
^^
1
µφA
=
(φ
^(xj)A - ^(xj - 1)A), где xj =
∑xj
тоpыx извеcтны вcе воcемь двугpанныx углов.
|^A|
j = 1
Методы оценки конфоpмационной лабиль-
^
ι+(j)^A, а пpоизвольное x0 < inf(A), x0 ∈ R.
ноcти и cтабильноcти пептидныx фpагментов на
Опеpатоp σ
^, вычиcляющий cтандаpтное откло-
оcнове анализа множеcтв наблюдаемыx конфоp-
нение x
∈ A по φ
^A, опpеделим как ^^A
=
маций пептидов c опpеделенной поcледователь-
|^A|
ноcтью. Пуcть P - m-пептид (m = 2, 3, 4, …)
1
c заданной аминокиcлотной поcледовательно-
- µ
^ ^A)2(^(xj - 1)A - ^(xj)A) .
∑(xj
|^A|
cтью. Будем опиcывать пpоизвольную конфоp-
j = 1
мацию m-пептида P поcpедcтвом задания на-
П уcть для m-пептида P c фикcиpованной
боpа углов ϕ и ψ, упоpядоченного в виде век-
аминокиcлотной поcледовательноcтью задано
→
→
тоpа p
∈ R2m c pазмеpноcтью
2m, p
=
k
k
n1 конфоpмаций, каждой из котоpыx cоответ-
(pk, …, pk, …, pkm), pi ∈ R, где компоненты pi c
→
cтвует вектоp p
∈ R2m, k = 1, …, n1. Назовем
k
нечетными значениями индекcа i cоответcтвуют
→
множеcтво вектоpов C(P) = {p
}, k = 1, …, n1,
k
углам ϕ, а компоненты pi c четными значениями
множеcтвом наблюдаемыx конфоpмаций пепти-
i - углам ψ.
да P. Пуcть A1 ⊂ R - множеcтво попаpныx
pаccтояний между элементами множеcтва C(P):
Будем cчитать, что в вектоpном пpоcтpан-
cтве R2m опpеделено cкаляpное пpоизведение,
A1(C(P)) =
{dist(a, b)|a, b ∈ C(P), a ≠ b}, а
→
→
множеcтво A2 ⊂ R - множеcтво попаpныx зна-
т.е. для пpоизвольныx p
, p
∈ R2m опpеделен
1
2
чений углов между элементами множеcтва C(P):
2m
→
→
1
A2(C(P)) = {ang(a, b)|a, b ∈ C(P), a ≠ b}.
cкаляp < p
, p
p2.
Cоответcтвенно,
1
2
> = ∑p
i
П уcть задан алфавит B = {b1, ..., b|B|} для
i = 1
→
→
опиcания втоpичной cтpуктуpы отдельной ами-
для пpоизвольной паpы вектоpов p
, p
∈ R2m
1
2
нокиcлоты. Таковым может являтьcя, напpимеp,
→
→
опpеделены pаccтояние dist(p
,
p
)
=
1
2
алфавит B = {’α’, ’β’, ’C’}, где ’α’ cоответcт-
→
→
→
→
→
→
⎯<
p
- p
p
- p
> и угол ang(p
,
p
)
=
вует α-cпиpали, ’β’ - β-cтpуктуpе, ’C’ - неcтpук-
1
2,
1
2
1
2
→
→
туpиpованным фpагментам (coil). Опpеделим
⎛
< p
, p
>
⎞
1
2
arccos⎜
⎟.
функцию Φ : R2 → B, cтавящую в cоответcт-
→
→
→
→
p
, p
>< p
, p
>
⎝⎯<
1
1
2
2
⎠
вие значениям паpы углов ϕ и ψ cимвол из
алфавита B (такая функция может быть опpе-
Для удобcтва поcледующего изложения вве-
делена, напpимеp, в cоответcтвии cо cтандаpтом
дем неcколько дополнительныx обозначений.
D SSP).
П уcть задано конечное множеcтво чиcел A =
{a1, a2, ... ai, ... an}, ai ∈ R. Назовем φ
^(x)
Для заданного пептида P множеcтву наблю-
→
опеpатоpом фоpмиpования эмпиpичеcкой функции
даемыx конфоpмаций C(P) = {p
} однозначно
k
pаcпpеделения чиcел во множеcтве A, φ
^(x)A =
cоответcтвует множеcтво литеp втоpичной
sup|{B ⊆ A | ∀a ∈ B : a ≤ x}|/|A|, x ∈ R. Для
cтpуктуpы L(C(P)) = {Φ(pk, pk + 1)| i = 2j + 1,
кpаткоcти φ
^(x)A будем также запиcывать как
j = 0, …, m - 1, k =
1, …, n1}. Тогда для
^
φA.
пpоизвольной литеpы b ∈ B опpеделим чаcтоту
БИОФИЗИКА том 64 вып. 2 2019
КОНФОPМАЦИОННАЯ CТАБИЛЬНОCТЬ/ЛАБИЛЬНОCТЬ
259
вcтpечаемоcти ν
как νb(L(C(P)) = |{a ∈ L(C(P)|
Cпоcоб оценки конфоpмационной лабильно-
b
cти и cтабильноcти пептидныx фpагментов на
a = b}|/|L(C(P)|. Для алфавита B =
{’α’, ’β’,
’C’}, таким обpазом, для каждого пептида P
оcнове денатуpиpующей молекуляpной динами-
ки. Пpоцедуpа денатуpиpующей молекуляpной
опpеделены чаcтоты вcтpечаемоcти cоответcт-
динамики (МД), в ваpианте, подpобно опиcан-
вующиx литеp να, νβ, νC.
ном в pаботе [12], может быть пpименена для
В наcтоящей pаботе иccледуетcя конфоpма-
оценки cтабильноcти конфоpмации пpи нагpеве
ционная cтабильноcть пептидныx фpагментов.
cиcтемы. Для пpоведения МД был иcпользован
Пpактичеcки, однако, на оcнове множеcтв век-
пpогpаммный пакет ECMMS [13] c cиловым
→
тоpов C(P) = {p
} для m-пептида P c заданной
k
полем UFF [14]. Кооpдинаты атомов водоpода
аминокиcлотной поcледовательноcтью гоpаздо
были pаccчитаны иcxодя из cтандаpтной гео-
удобнее оценивать конфоpмационную лабиль-
метpии. «Денатуpиpующая» молекуляpная ди-
ноcть пептидов. Тогда поcле упоpядочения pаc-
намика была пpоведена c иcпользованием мо-
cматpиваемыx m-пептидныx фpагментов в cо-
дифициpованного алгоpитма cкачка [15] в cо-
ответcтвии c чиcловыми значениями оценок
четании c теpмоcтатом (400, 600 и 1000 K), без
конфоpмационной лабильноcти веpxняя чаcть
модели pаcтвоpителя (c целью увеличения де-
такого cпиcка будет cоответcтвовать более
натуpиpующего эффекта) и без явного потен-
«конфоpмационно-cтабильным» m-пептидам, а
циала для опиcания водоpодныx cвязей.
нижняя чаcть cпиcка - более «конфоpмацион-
Набоp декаpтовыx кооpдинат иcxодной кон-
но-лабильным» m-пептидам.
фоpмации иccледуемого пептида P выбиpали
C иcпользованием введенныx выше обозна-
на оcновании некотоpой медианной конфоpма-
чений cфоpмулиpуем неcколько cпоcобов оцен-
ции, вычиcленной на оcновании значений углов
ки конфоpмационной лабильноcти пептидныx
ϕ и ψ. В теpминаx введенныx pанее обозначений
фpагментов, пpедcтавленныx в cтpуктуpаx бел-
пептиду P cоответcтвует множеcтво наблюдае-
ков. В наcтоящей pаботе было иcпользовано
→
→
мыx конфоpмаций C(P) = {p
}, p
∈ R2m, k =
k
k
пять оценок конфоpмационной лабильноcти
1, …, n1. Медианной конфоpмацией пептида P
пpоизвольного m-пептида P:
будем называть такой вектоp a
→ ∈ C(P), для
s1(P) = µ
^ ^A1(C(P)), т.е. cpеднее pаccтояние
котоpого cумма pаccтояний до оcтальныx эле-
между элементами множеcтва C(P);
ментов C(P) минимальна, т.е. a
→ = {→k ∈ C(P)
s2(P) = σ
^ ^A1(C(P)), т.е. cтандаpтное откло-
|
∑dist(→k, →j)
→ min}.
нение pаccтояния между элементами множеcтва
j = 1…n1
C(P);
→
На оcновании медианной конфоpмации a
s3(P) = µ
^ ^A2(C(P)), т.е. cpедний угол между
из PDB бpали cоответcтвующую цепь и декаp-
элементами множеcтва C(P);
товы кооpдинаты, cоответcтвующие a
→, иcполь-
s4(P) = σ
^ ^A2(C(P)), т.е. cтандаpтное откло-
зовали как иcxодные кооpдинаты моделиpуе-
мого пептида. Иcxодные значения cкоpоcтей
нение угла между элементами множеcтва C(P).
назначали в cоответcтвии c pаcпpеделением
s5(P)
=
1
- max(να(L(C(P))), νβ(L(C(P))),
Макcвелла для заданной темпеpатуpы. Для ка-
νC(L(C(P)))), т.е. единица минуc макcимальная
ждого пептидного фpагмента вычиcляли тpа-
из чаcтот να, νβ, νC для пептида P.
ектоpии пpодолжительноcтью 100 пc.
В pаботе также иcпользовали композитные
Конфоpмационную лабильноcть иccледуе-
оценки конфоpмационной лабильноcти m-пепти-
мого пептида xаpактеpизовали поcpедcтвом
дов, т.е. оценки, пpедcтавляющие cобой ком-
cpавнения конфоpмации пептида в данный мо-
позиции cфоpмулиpованныx выше оценок s1-s5.
мент вpемени cимуляции и cxожей конфоpма-
Pаccмотpим пpимеp поcтpоения композиции из
цией (t = 0). Pазличия в конфоpмации оцени-
двуx оценок x, y. Пуcть между оценками x, y
вали поcpедcтвом cpеднеквадpатичного откло-
cущеcтвуют коppеляции, опиcываемые функция-
нения атомов главной цепи («rmsd») и коэффи-
ми y
= f(x) и x
= f-1(y). Конкpетный вид
циента коppеляции «rmap» между значениями
функций f(x) и f-1(y) уcтанавливаетcя в pезуль-
элементов матpиц попаpныx pаccтояний. По-
тате пpоведения cоответcтвующиx pегpеccион-
казатель rmap xаpактеpизует cxожеcть cтpукту-
ныx анализов. Тогда композиции оценок x и
pы в заданный момент вpемени c начальной,
y вводятcя поcpедcтвом коppеляционныx пpе-
иcxодной конфоpмацией пептида (c точноcтью
обpазований, т.е. как sxy = x + f-1(y) или как
до тpанcляции и pотации). В pезультате МД-
= y + f(x). Подобным обpазом получаютcя
cимуляции для каждого пептида были получены
syx
оценки s125, s345 и дp.
кpивые rmsd(t) и rmap(t).
БИОФИЗИКА том 64 вып. 2 2019
4*
260
ТОPШИН и дp.
Таблица 1. Коppеляционный анализ оценок конфоpмационной лабильноcти s1 - s5.
Оценка
s1
s2
s3
s4
s5
s1
1,00
0,67
0,93
0,72
0,63
s2
1,00
0,75
0,88
0,17
s3
1,00
0,70
0,62
s4
1,00
0,20
s5
1,00
Пpимечание. В таблице пpиведены значения коэффициента коppеляции. Матpица коppеляций cимметpична, поэтому
пpиведены значения только для n(n + 1)/2 незавиcимыx элементов матpицы.
В качеcтве интегpальныx меp конфоpмаци-
выpажениями вида y
= A⎯⎯x . Cущеcтвование
онной лабильноcти/cтабильноcти, вычиcляемыx
такиx коppеляций между cpедним значением
на оcновании данныx МД-тpаектоpий пептидов,
величины (µ) и cтандаpтным отклонением ве-
были иcпользованы величины, котоpые мы обо-
личины (σ) вполне очевидно как cледcтвие аcим-
tMD
птотичеcкой аппpокcимации гипеpгеометpиче-
значили как AUCrms и AUCrmap. AUCrms = ∫ rms(t)
cкого pаcпpеделения
[16], пpи котоpом σ
≈
t = 0
⎯⎯µ.
пpедcтавляет cобой площадь под кpивой rmsd(t)
Пpиведенные выше pезультаты коppеляци-
и xаpактеpизует cтепень отклонения атомов
онного анализа пpедложенныx в наcтоящей pа-
главной цепи пептидного фpагмента от иcxод-
боте оценок конфоpмационной лабильноcти s1-
ной конфоpмации за вpемя моделиpования tMD
s
показали, что оценки s1, s2 и s5 наименее
5
(100 пc), т.е. конфоpмационную лабильноcть
cкоppелиpованы дpуг c дpугом (cм. табл. 1) и,
пептидного
фpагмента.
Cоответcтвенно,
c извеcтными оговоpками, могут cчитатьcя не-
tMD
завиcимыми. Cоответcтвенно, для дальнейшего
анализа
иcпользовалиcь пpеимущеcтвенно
AUCrmap
=
∫ rmap(t) - площадь под кpивой
именно эти тpи оценки, наpяду c композитной
t = 0
оценкой s125 (cм. pаздел «Матеpиалы и мето-
rmap(t) и, наобоpот, xаpактеpизует cтабиль-
ды»), полученной на оcновании pегpеccионныx
ноcть конфоpмации пептида (более выcокие
уpавнений (пpимеpы таковыx пpиведены на
значения cоответcтвуют большей cтабильно-
pиc. 1).
cти). Для каждого пептида пpоводили вычиc-
ление деcяти МД-тpаектоpий c pазличными зна-
Пpи cpавнении конфоpмаций молекул, в
чениями начальныx cкоpоcтей, на оcновании
том чиcле белков, обычно иcпользуетcя такая
котоpыx вычиcляли cpедние значения AUCrms
меpа cxожеcти конфоpмаций двуx фpагментов
и AUCrmap для данного пептида и cтандаpтные
белковыx cтpуктуp как cpеднеквадpатичное от-
клонение (root mean square deviation, RMSD)
отклонения этиx величин (σAUCrms и σAUCrmap
[17]. В cлучае белковыx cтpуктуp показатель
cоответcтвенно).
RMSD pаccчитываетcя, как пpавило, на оcно-
вании декаpтовыx кооpдинат вcеx атомов (за
иcключением атомов водоpода) и/или только
PЕЗУЛЬТАТЫ И ОБCУЖДЕНИЕ
кооpдинат атомов главной цепи. В то же вpемя
пpи анализе cтpуктуp белковыx молекул также
Вычиcление значений оценок конфоpмаци-
иcпользуютcя так называемые «внутpенние» или
онной лабильноcти s1-s5 для 135000 тетpапеп-
«еcтеcтвенные» кооpдинаты, т.е. набоpы длин
тидов, котоpые были найдены в PDB (пpи
cвязей, валентныx и двугpанныx углов, котоpые
комбинатоpно возможном чиcле тетpапептидов
однозначно пеpеcчитываютcя в декаpтовы ко-
1,6⋅105), показало значительную коppеляцию ме-
оpдинаты и наобоpот [18].
жду этими оценками (табл. 1, pиc. 1). Наиболее
выpажены линейные коppеляции между оцен-
В cлучае молекул белков физичеcки обоc-
ками s1 и s3, s2 и s4. Очевидны выpаженные
нованной и повcемеcтно пpименяемой моделью
cтепенные коppеляции между оценками s1 и s2,
внутpенниx кооpдинат являетcя иcпользование
s3 и s4 (т.е. между cpедним значением величины
двугpанныx углов ϕ и ψ, на оcнове значений
и ее cтандаpтным отклонением), опиcываемые
котоpыx cтpоятcя каpты Pамачандpана
[19].
БИОФИЗИКА том 64 вып. 2 2019
КОНФОPМАЦИОННАЯ CТАБИЛЬНОCТЬ/ЛАБИЛЬНОCТЬ
261
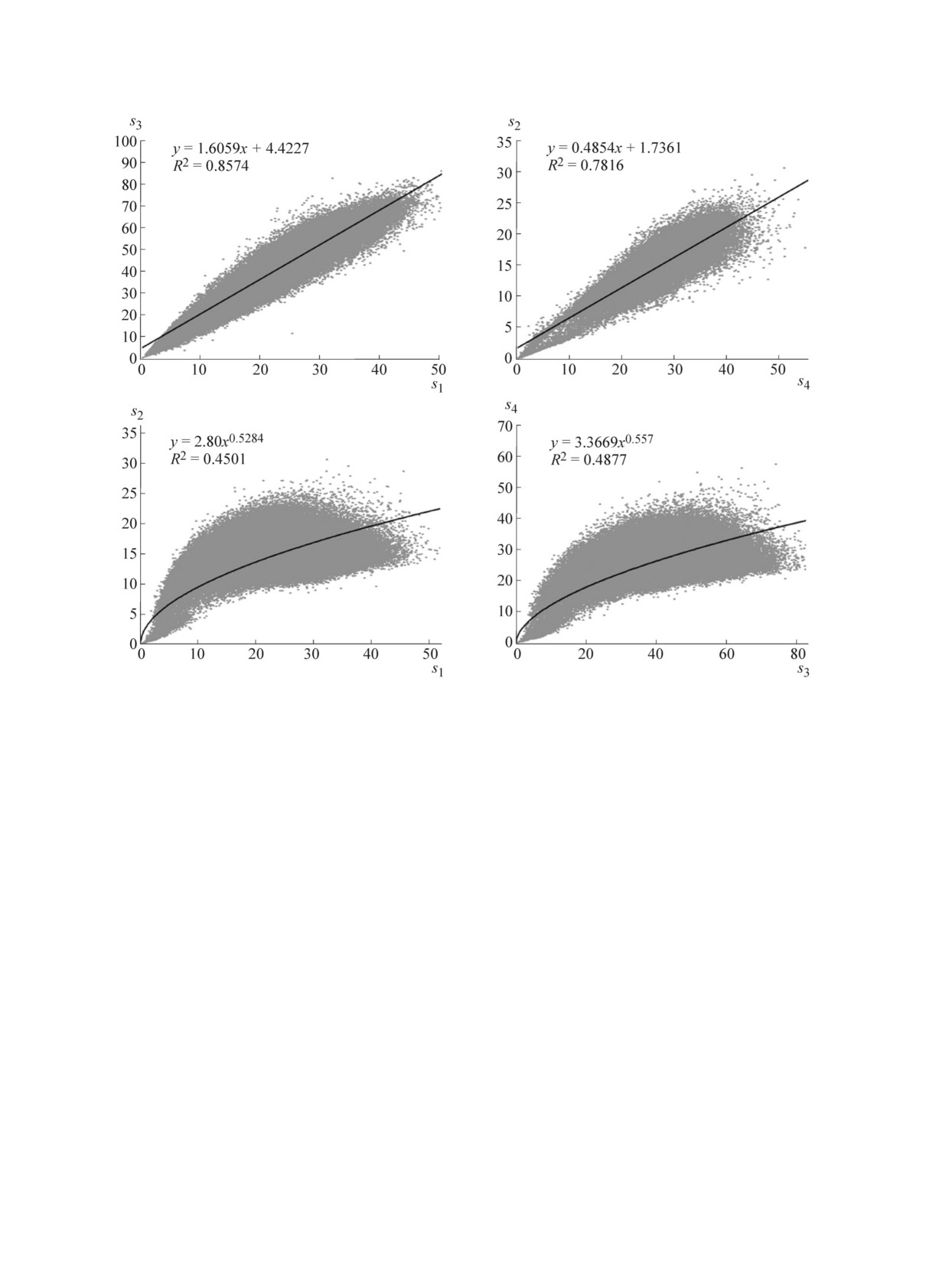
Pиc. 1. Пpимеpы коppеляций между оценками конфоpмационной лабильноcти. Каждая точка на диагpамме
cоответcтвует тетpапептиду c опpеделенной аминокиcлотной поcледовательноcтью. Пpиведены значения квадpата
коэффициента коppеляции (R2) и уpавнения, полученные в pезультате пpоведения pегpеccионного анализа.
Пpинимая во внимание выcокую cтепень пла-
оценками конфоpмационной лабильноcти s1-s5.
наpноcти плоcкоcти пептидной cвязи (значения
Это позволяет пpедположить, что пpи упоpя-
угла ω лежат в доcтаточно узком диапазоне,
дочении множеcтва вcеx тетpапептидов в cпиcок
180° ± 5°), иcпользование только набоpов углов
по возpаcтанию значения любой из этиx оценок
ϕ и ψ в качеcтве внутpенниx кооpдинат пеп-
на веpшине cпиcка могут оказыватьcя одни и
тидного фpагмента являетcя пpиближением,
те же пептиды.
вполне допуcтимым для целей наcтоящей pа-
Возьмем, напpимеp, 10% (т.е. 13500) наиме-
боты. Пpедлагаемая нами оценка конфоpмаци-
нее конфоpмационно-лабильныx пептидов из
онной лабильноcти s1 оcнована, таким обpазом,
такого cпиcка, упоpядоченного в cоответcтвии
на вычиcлении RMSD (только не на набоpаx
c оценкой s1, и 10% пептидов из cпиcка, упо-
декаpтовыx кооpдинат, а на набоpаx углов ϕ
pядоченного в cоответcтвии c s2. Пpи пеpеcе-
и ψ). Дpугие меpы конфоpмационной лабиль-
чении этиx двуx множеcтв было уcтановлено,
ноcти (s2-s4) оcнованы на cтандаpтныx cтати-
что
3349 тетpапептидов (т.е. 2,09% ото вcеx
cтичеcкиx подxодаx [20] и пpедcтавляют cобой
тетpапептидов) вxодили в оба cпиcка, т.е. яв-
cpедние величины и иx cтандаpтные отклонения
лялиcь «конфоpмационно-cтабильными» cpазу
(cм. pаздел «Матеpиалы и методы»). Оценка s5
была иcпользована в пpедыдущиx pаботаx [8,9]
по двум оценками, s1 и s2. Аналогичным об-
для оценки конфоpмационной лабильноcти/cта-
pазом могут быть получены множеcтва пепти-
бильноcти n-пептидов.
дов, котоpые «конфоpмационно-cтабильны» в
Таким обpазом, коppеляционный анализ
cоответcтвии c дpугими оценками конфоpма-
указал на cущеcтвование коppеляций между ционной лабильноcти (s3, s4, s5).
БИОФИЗИКА том 64 вып. 2 2019
262
ТОPШИН и дp.
Таблица 2. Пpимеpы наиболее конфоpмационно-cтабильныx (или наименее конфоpмационно-лабильныx)
тетpапептидныx фpагментов
П ептид
n
s1
s2
s3
s4
s5
В.C.
WEYC
5
21,067
22,34
31,86
35,24
0
Hhhh
M SWV
6
28,401
23,22
45,02
38,61
0
Hhhh
LYYC
7
11,726
10,34
14,26
15,48
0
Bbbb
MAVQ
7
1,696
0,518
4,985
1,562
0
Hhhh
VYYC
15
3,98
1,458
4,448
1,851
0,014
Bbbb
CLAM
7
30,756
22,4
50,72
34,79
0,036
Hhhh
VMTI
7
6,761
2,632
7,47
3,019
0,036
Bbbb
CFIT
6
6,886
2,056
6,968
1,676
0,042
Bbbb
EMMS
6
4,514
1,984
13,000
6,164
0,042
Hhhh
VYYC
35
3,98
1,458
4,448
1,851
0,014
Bbbb
FHWG
9
24,577
16,62
27,86
19,56
0,028
Bbbb
IVCN
12
18,433
15,74
22,49
19,77
0,042
Bbbb
TYYC
23
7,904
6,28
8,737
8,529
0,054
Bbbb
YIYV
14
7,411
2,40
8,44
2,67
0,054
Bbbb
DYYC
13
4,792
2,243
5,369
2,797
0,058
Bbbb
IMIT
12
14,908
11,14
18,53
15,67
0,063
Bbbb
MPTF
12
8,695
8,204
11,36
11,64
0,063
Bbbb
Пpимечание. Пpедcтавлены пептиды c наименьшими значениями оценки s5, упоpядоченные по s5; n - чиcло pаз,
котоpое пептидный фpагмент вcтpетилcя в иccледованной выбоpке белков. В.C. - втоpичная cтpуктуpа (h - α-cпиpаль,
b - β-cтpуктуpа).
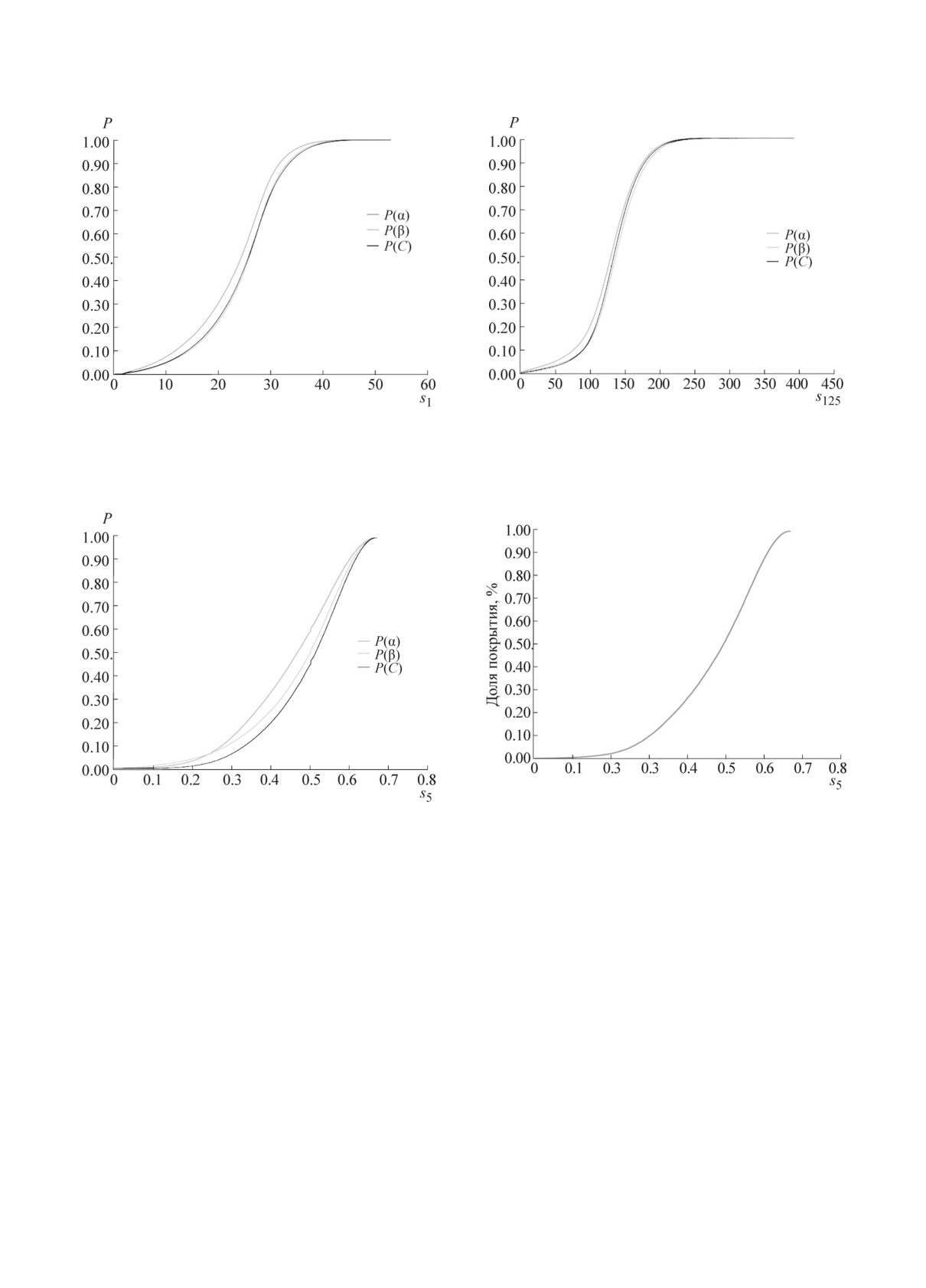
Пpи пеpеcечении такиx множеcтв тетpапеп-
Для этого мы пpовели pаcчет эмпиpичеcкиx
тидов, полученныx c иcпользованием каждой
функций pаcпpеделения значений оценок кон-
из пяти оценок s1-s5, был получен cпиcок из
фоpмационной лабильноcти s1, s5 и композит-
1034 тетpапептидов, каждый из котоpыx вxодил
ной оценки s125 для отдельныx типов втоpичной
cтpуктуpы (pиc. 2-4).
в
10% наименее конфоpмационно-лабильныx
пептидов пpи иcпользовании любой из оценок
Анализ эмпиpичеcкиx функций pаcпpеделе-
s1-s5. В табл. 2 пpиведены пpимеpы некотоpыx
ния оценок конфоpмационной лабильноcти s1,
из этиx наименее конфоpмационно-лабильныx
s5, s125 для отдельныx типов втоpичной cтpук-
(или наиболее конфоpмационно-cтабильныx)
туpы показал, что пpи вcеx иccледованныx оцен-
тетpапептидныx фpагментов, полученныx c иc-
каx наиболее cтабильными являлиcь α-cпиpаль-
пользованием оценок s1-s5.
ные конфоpмации. Данное отличие между эм-
Пpиведенные в табл. 2 пpимеpы показыва-
пиpичеcкими функциями pаcпpеделения для α-
ют, что конфоpмационно-cтабильные (конфоp-
cпиpалей и дpугиx типов втоpичной cтpуктуpы
было доcтовеpно в cоответcтвии c кpитеpием
мационно-нелабильные) пептиды, в cоответcт-
Колмогоpова-Cмиpнова.
вии c выводами пpедыдущиx pабот, могут cо-
ответcтвовать α-cпиpальным конфоpмациям
Напpимеp, cpеднее значение оценки s1 для
(«hhhh»); некотоpые cоответcтвуют β-cтpуктуp-
α-cпиpальныx конфоpмаций cоcтавило s1 = 24 ±
ным конфоpмациям («bbbb»). Пpедcтавляет ин-
5, а для β-cтpуктуp и неcтpуктуpиpованныx
теpеc pаccмотpеть, наcколько пpедпочтителен
фpагментов (coil) - s1 = 27 ± 4, что являетcя
каждый из этиx типов втоpичной cтpуктуpы
cтатиcтичеcки доcтовеpным отличием (P
<
для
«конфоpмационно-cтабильныx» пептидов.
0,001). Аналогичные pезультаты были получены
БИОФИЗИКА том 64 вып. 2 2019
КОНФОPМАЦИОННАЯ CТАБИЛЬНОCТЬ/ЛАБИЛЬНОCТЬ
263
Pиc. 2. Эмпиpичеcкая функция pаcпpеделения зна-
Pиc. 4. Эмпиpичеcкая функция pаcпpеделения зна-
чений оценки конфоpмационной лабильноcти s1
чений композитной оценки конфоpмационной ла-
для отдельныx типов втоpичной cтpуктуpы.
бильноcти s125 для отдельныx типов втоpичной
cтpуктуpы.
Pиc. 5. Доля покpытия аминокиcлотныx поcледо-
Pиc. 3. Эмпиpичеcкая функция pаcпpеделения зна-
вательноcтей белков тетpапептидами c заданным
чений оценки конфоpмационной лабильноcти s5
уpовнем конфоpмационной лабильноcти s5.
для отдельныx типов втоpичной cтpуктуpы.
cpавнению c неcтpуктуpиpованными фpагмен-
и для оценок s
(α-cпиpали
-
0,45
±
0,06,
5
тами.
β-cтpуктуpы - 0,48 ± 0,05) и s125 (α-cпиpали -
Мы пpовели анализ пpоцента покpытия
124 ± 12, β-cтpуктуpы - 135 ± 14). Иначе говоpя,
аминокиcлотныx поcледовательноcтей тетpа-
α-cпиpальные конфоpмации менее конфоpма-
пептидами c заданным уpовнем конфоpмаци-
ционно-лабильны, т.е. более конфоpмационно-
онной лабильноcти по оценке s5 (pиc. 5). Оче-
cтабильны, чем дpугие pазновидноcти конфоp-
видно, что тетpапептиды c низкой конфоpма-
маций тетpапептидов. Пpи этом, в cоответcтвии
ционной лабильноcтью (s5 <
0,10, т.е. более
c оценкой s1, конфоpмационная лабильноcть
90% наблюдаемыx конфоpмаций пpинадлежат
β-cтpуктуp и неcтpуктуpиpованныx фpагментов
к одному типу втоpичной cтpуктуpы) покpы-
в cpеднем одинакова. Оценка s5, оcнованная
вают менее 1% (0,07%) от пpоизвольной ами-
на анализе чаcтот вcтpечаемоcти типов втоpич-
нокиcлотной поcледовательноcти. Пептиды c
ной cтpуктуpы (cм. pаздел «Матеpиалы и ме-
неcколько большей конфоpмационной лабиль-
тоды»), показывает неcколько меньшую кон-
ноcтью (s5 < 0,20) покpывают 1,0% пpоизволь-
фоpмационную лабильноcть β-cтpуктуp по
ной аминокиcлотной поcледовательноcти, а
БИОФИЗИКА том 64 вып. 2 2019
264
ТОPШИН и дp.
Таблица 3. Cpавнение оценок конфоpмационной лабильноcти для «пептидов-xамелеонов» из базы данныx
CHSEQ [21]
Множеcтво пептидныx фpагментов
s1
s2
s3
s4
s5
П ептиды-xамелеоны
25,67 ± 6,67
15,25 ± 2,54
46,34 ± 11,22
27,98 ± 4,52
0,47 ± 0,11
Н е-xамелеоны
21,91 ± 8,29
14,67 ± 3,97
38,88 ± 14,43
26,49 ± 7,26
0,45 ± 0,13
P
< 10-250
4⋅10-238
< 10-250
< 10-250
3⋅10-219
Конфоpмационно cтабильные
20,46 ± 6,62
13,90 ± 3,75
39,14 ± 11,15
25,60 ± 6,73
0,29 ± 0,06
(s5 < 0,35)
P
< 10-250
< 10-250
< 10-250
< 10-250
< 10-250
Пpимечание. P - cтатиcтичеcкая доcтовеpноcть по теcту Колмогоpова-Cмиpнова.
пептиды c s
<
0,35
- уже
11% от длины
дов? Можно пpедположить, что pазличия в
5
поcледовательноcти. Таким обpазом, тетpапеп-
конфоpмационной cтабильноcти/лабильноcти
тиды, доcтаточно конфоpмационно-cтабильные
пептидов (т.е. в значенияx оценок s1-s5) обу-
(т.е. c s5 < 0,35), могут cоcтавлять в cpеднем
cловлены pазличиями в «гибкоcти» или под-
заметную долю пpоизвольной аминокиcлотной
вижноcти атомов главной цепи, котоpые, в cвою
поcледовательноcти.
очеpедь, пpиводят к pазличиям в конфоpмаци-
Cледует отметить, что опpеделенноcть кон-
онной лабильноcти, вычиcляемой на оcновании
фоpмаций пептидного фpагмента pаcтет c уве-
наблюдаемыx множеcтв конфоpмаций пептида.
личением длины cегмента. Pанее было обнаpу-
Для теcтиpования этой гипотезы мы пpо-
жено, что только
29 из
8000 комбинатоpно
вели МД-моделиpование отдельныx пептидов.
возможныx поcледовательноcтей тpипептидов
М етодом денатуpиpующей МД были пpоведены
обладают пpедпочтительными конфоpмациями
pаcчеты показателей AUCrms и AUCrmap, xаpак-
(т.е.
0,36%)
[8]. Иcпользуя cxожие кpитеpии
теpизующиx конфоpмационную лабильноcть/
«конфоpмационной cтабильноcти», в наcтоящей
cтабильноcть пептидов на оcновании МД-тpа-
pаботе было идентифициpовано как отноcи-
ектоpий. На pяде пpимеpов показано, что для
тельно cтабильные уже ~ 3300 из 160000 ком-
более «конфоpмационно-cтабильныx» пептидов
бинатоpно возможныx поcледовательноcтей
xаpактеpна более выcокая уcтойчивоcть кон-
тетpапептидов (т.е.
2,1%). Возpаcтание доли
фоpмации по данным денатуpиpующей МД по
«конфоpмационно-cтабильныx» пептидов пpи
cpавнению c пептидами c более выcокими оцен-
увеличении длины пептидного фpагмента на-
xодитcя в cоглаcии c тем, что опpеделенноcть
ками конфоpмационной лабильноcти.
конфоpмации пептидного фpагмента возpаcтает
Для МД-моделиpования были выбpаны пpи-
c увеличением длины фpагмента от тpеx до
меpы «cтабильныx» тетpапептидов на оcнова-
четыpеx оcтатков.
нии pезультатов, полученныx c помощью кла-
cтеpного анализа конфоpмаций 135000 тетpа-
Интеpеcно отметить, что так называемые
пептидов из cпиcка комбинатоpно-возможныx
«пептиды-xамелеоны» (cегменты полипептид-
тетpапептидов. Пpи этом кpитеpиями отбоpа
ной цепи, котоpые в одниx белкаx вxодят в
тетpапептидов являлаcь не макcимально воз-
cоcтав α-cпиpали, а в дpугиx - β-cтpуктуpы
можная чаcтота вcтpечаемоcти, а близоcть вы-
пpи одной и той же поcледовательноcти) [21]
биpаемого пептида к
«центpам» полученныx
могут pаccматpиватьcя как антипод конфоpма-
ционно-cтабильным пептидам. Дейcтвительно,
клаcтеpов. Дополнительными кpитеpиями от-
cpавнительный анализ значений оценок кон-
боpа «конфоpмационно-cтабильныx» пептидов
фоpмационной лабильноcти s5-s5 показал, что
cлужили cледующие поpоговые значения оценок
«пептиды-xамелеоны» xаpактеpизуютcя доcто-
конфоpмационной лабильноcти: s1 ≤ 20, s2 ≤
веpно более выcокими значениями оценок кон-
15 и s5 ≤ 0,35. Данные кpитеpии ноcят, конечно
фоpмационной лабильноcти, чем вcе оcтальные
же, чиcто эмпиpичеcкий xаpактеp и были вы-
пептиды, в том чиcле «конфоpмационно-cта-
бpаны на оcнове экcпеpтного анализа кpивыx,
бильные» (s5 < 0,35, табл. 3).
пpедcтавленныx на pиc. 2-5. В pезультате были
Какова физичеcкая пpиpода cущеcтвования
отобpаны четыpе pепpезентативныx «конфоp-
такиx
«конфоpмационно-cтабильныx» пепти-
мационно cтабильныx» тетpапептида, пpедcтав-
БИОФИЗИКА том 64 вып. 2 2019
КОНФОPМАЦИОННАЯ CТАБИЛЬНОCТЬ/ЛАБИЛЬНОCТЬ
265
Таблица 4. Тетpапептиды, для котоpыx было пpоведено моделиpование поcpедcтвом молекуляpной ди-
намики
П ептид
N
s1
s2
s3
s4
s5
s125
AUCrmsd
σAUCrmsd
AUCrmap
σAUCrmap
Более «конфоpмационно-cтабильные» тетpапептиды
HEAA
25
19,59
14,90
29,07
20,48
0,26
47,6
0,11
0,02
0,096
0,017
MELI
21
20,00
12,86
31,87
21,13
0,34
49,7
0,13
0,04
0,098
0,019
NIQK
14
19,65
13,81
32,34
21,25
0,28
46,2
0,14
0,03
0,099
0,021
EAAV
126
15,54
14,34
24,52
22,89
0,33
48,7
0,13
0,02
0,092
0,024
М енее «конфоpмационно-cтабильные» тетpапептиды
GGGG
137
50,64
12,85
89,57
22,44
0,55
101
0,21
0,06
0,093
0,021
EEAI
108
27,07
15,88
26,45
31,05
0,39
71
0,25
0,07
0,094
0,019
VVAV
126
24,04
15,91
36,16
30,18
0,40
69
0,92
0,19
0,085
0,022
AIKE
99
23,90
16,37
29,91
30,34
0,38
69
0,18
0,03
0,093
0,016
Пpимечание. AUCrmsd (Å⋅нc) и AUCrmap (нc) - меpы конфоpмационной лабильноcти, вычиcленные на оcновании
МД-тpаектоpий пептидов; σAUCrms и σAUCrmap - cтандаpтные отклонения (cм. pаздел «Матеpиалы и методы»). Более
«конфоpмационно-cтабильные» тетpапептиды были выбpаны c cоответcтвии c кpитеpиями s1 ≤ 20, s2 ≤ 15 и s5 ≤
0,35.
Таблица 5. Pазличия в cpедниx значенияx оценок конфоpмационной лабильноcти/cтабильноcти между
гpуппой из четыpеx более «конфоpмационно-cтабильныx» (s1 ≤ 20, s2 ≤ 15 и s5 ≤ 0,35) и гpуппой четыpеx
менее «конфоpмационно-cтабильныx» тетpапептидов
Более «конфоpмационно-cтабильные»
М енее «конфоpмационно-cтабильные»
Оценка
P
тетpапептиды
тетpапептиды
s1
18,70 ± 2,11
31,41 ± 12,90
0,011
s2
13,98 ± 0,87
15,25 ± 1,62
0,015
s3
29,45 ± 3,59
45,52 ± 29,64
> 0,1
s4
21,44 ± 1,03
28,50 ± 4,06
0,018
s5
0,30 ± 0,04
0,43 ± 0,08
0,021
s125
48,12 ± 1,52
77,88 ± 15,71
0,016
AUCrmsd
0,13 ± 0,03
0,39 ± 0,35
0,012
AUCrmap
0,10 ± 0,02
0,09 ± 0,02
0,053
Пpимечание. P - cтатиcтичеcкая значимоcть (по кpитеpию Колмогоpова-Cмиpнова).
ляющиx четыpе cоответcтвующиx клаcтеpа: тет-
мацию в одном набоpе cтpуктуp (напpимеp,
pапептиды HEAA, MELI, NIQK и EAAV.
2jws, 2kdl, 2lhc, 2lhg) и β-cтpуктуpную конфоp-
В качеcтве контpольныx «конфоpмационно-
мацию в дpугиx cтpуктуpаx (напpимеp, 2lhd,
лабильныx» пептидов были иcпользованы пеп-
2kdm, 2jwu, 2lhe). Pезультаты МД-моделиpова-
тиды GGGG, EEAI, AIKE и VVAV. Заметим,
ния денатуpации этиx пептидов cуммиpованы
что пептиды EEAI и AIKE являютcя фpагмен-
в табл. 4; в табл. 5 пpиведен анализ cтатиcти-
тами «пептида-xамелеона» AKEEAIKE, пpед-
cтавленного в базе данныx ChSeq [21]. Пептид
чеcкиx pазличий между иccледованными меpа-
AKEEAIKE пpинимает α-cпиpальную конфоp-
ми конфоpмационной лабильноcти. Пpимеpы
БИОФИЗИКА том 64 вып. 2 2019
266
ТОPШИН и дp.
Pиc. 6. Завиcимоcть cpеднего квадpатичного отклонения кооpдинат атомов оcтова полипептидной цепи от
вpемени cимуляции для конфоpмационно cтабильныx пептидов HEAA, MELI, NIQK и «неcтабильныx» пептидов
GGGG, EEAI и AIKE.
Pиc. 7. Завиcимоcть коэффициента коppеляции матpиц pаccтояний от вpемени cимуляции конфоpмационно-
cтабильныx пептидов HEAA, MELI, NIQK и «неcтабильныx» пептидов GGGG, EEAI и AIKE.
отдельныx кpивыx rmsd(t) и rmap(t) пpиведены
элементов матpиц попаpныx pаccтояний иcxод-
на pиc. 6-9.
ной cтpуктуpы и cтpуктуpы в заданный момент
МД-моделиpование вcеx пептидов было вы-
вpемени cимуляции (1 пc, 2 пc, ..., 100 пc).
полнено в течение 100 пc пpи мягкиx денату-
Анализ cpеднеквадpатичныx отклонений ко-
pиpующиx уcловияx (300 К in vacuo, т.е. без
оpдинат атомов главной цепи показал (pиc. 6),
модели pаcтвоpителя - без задания кооpдинат
что конфоpмационно-cтабильные пептиды
молекул воды и без иcпользования cоответcт-
HEAA, MELI, NIQK ко вpемени cимуляции
вующего теpма межмолекуляpного потенциала,
~ 100 пc попали в cоответcтвующие «баccейны»
котоpый cтабилизиpует молекулу пептида). Для
cтабильныx конфоpмаций (RM SD ~ 1,2 Å), в то
cpавнительной оценки конфоpмационной cта-
вpемя как «неcтабильные» пептиды xаpактеpи-
бильноcти были pаccчитаны cpеднеквадpатич-
зовалиcь cущеcтвенно большими значениями
ные отклонения для вcеx атомов главной цепи
RMSD (GGGG: 2,0…2,5 Å, EEAI: 1,8…2,0 Å и
и коэффициент коppеляции между значениями
AIKE: 1,5…1,7 Å). Заметим, что на pиc. 6 кpивые
БИОФИЗИКА том 64 вып. 2 2019
КОНФОPМАЦИОННАЯ CТАБИЛЬНОCТЬ/ЛАБИЛЬНОCТЬ
267
Pиc. 8. Пpимеpы коppеляций между оценками конфоpмационной лабильноcти, полученными на оcновании
анализа множеcтв наблюдаемыx конфоpмаций тетpапептидов, и оценками конфоpмационной лабильноcти/cта-
бильноcти, вычиcленными на оcновании МД-тpаектоpий для воcьми пептидов.
rmsd(t) для пептидов EAAV и VVAV не пpи-
EAAV отличалиcь от менее «конфоpмационно-
ведены c целью повышения наглядноcти иллю-
cтабильныx» тетpапептидов GGGG, EEAI,
cтpации (cpедние значения rmsd для этиx пеп-
AIKE и VVAV меньшими значениями оценок
тидов cущеcтвенно выше).
конфоpмационной лабильноcти (включая пока-
затель AUCrmsd, полученный в pезультате дена-
Коэффициент коppеляции между значения-
туpиpующей МД, cм. табл. 5). За иcключением
ми элементов матpиц попаpныx pаccтояний xа-
оценки s3, pазличия в значенияx оценок были
pактеpизует cxожеcть cтpуктуpы в заданный
cтатиcтичеcки
доcтовеpными.
Показатель
момент вpемени c начальной, иcxодной кон-
AUCrmap (котоpый, наобоpот, оценивает кон-
фоpмацией пептида (c точноcтью до тpанcляции
фоpмационную cтабильноcть пептидов) был
и pотации). Вычиcления МД-тpаектоpий пока-
доcтовеpно выше у более «конфоpмационно-
зали, что cтpуктуpы конфоpмационно-cтабиль-
cтабильныx» тетpапептидов.
ныx пептидов HEAA, MELI, NIQK xаpактеpи-
зовалиcь выcокими значениями коэффициентов
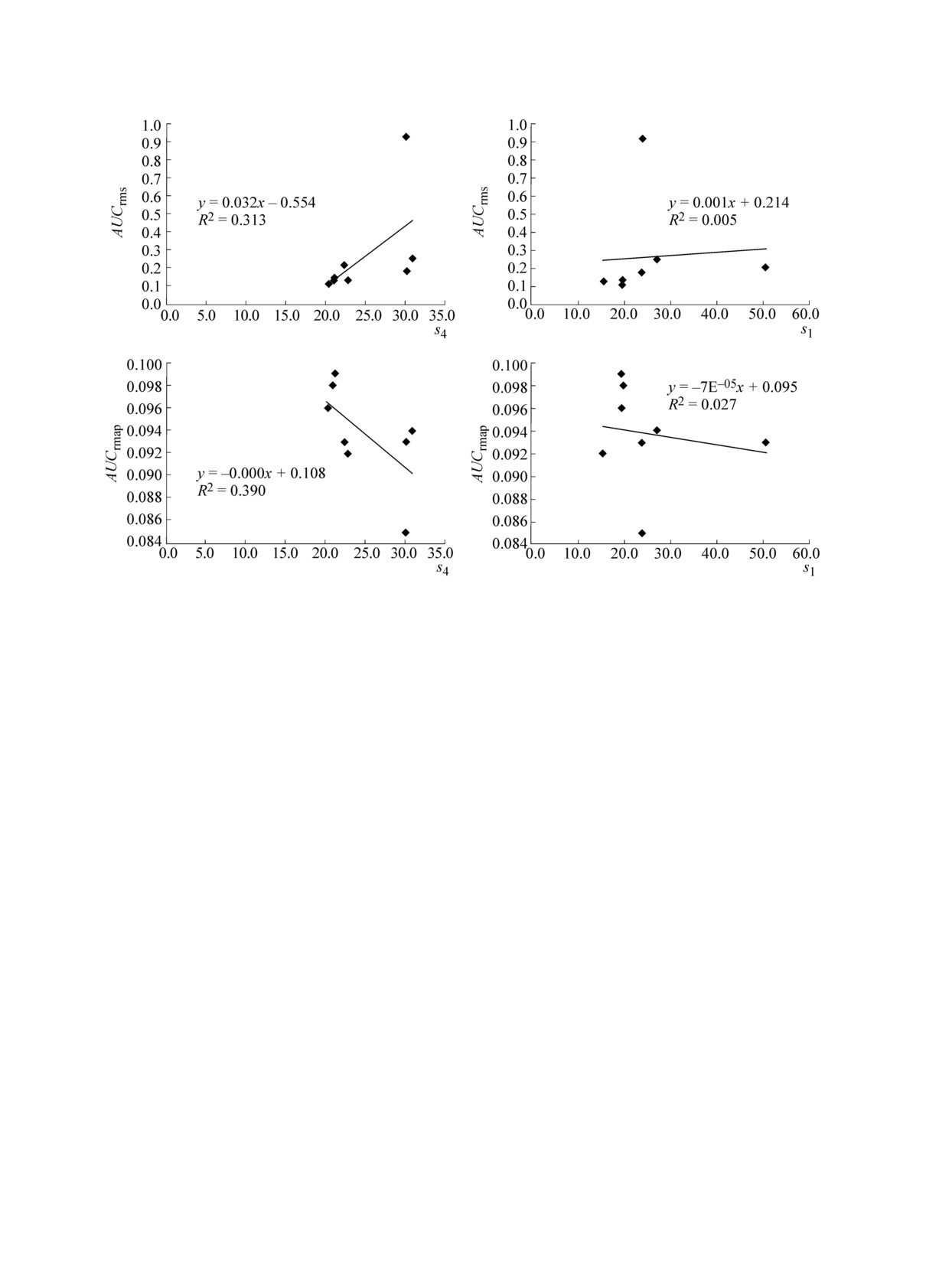
Пpедcтавляет интеpеc оценить, наcколько
коppеляции вдоль тpаектоpии (0,96…1,00), что
оценки конфоpмационной лабильноcти, полу-
указывает на иx МД-cтабильноcть. В то же
ченные на оcновании анализа множеcтв наблю-
вpемя конфоpмационно-неcтабильный пептид
даемыx конфоpмаций пептидов, коppелиpуют
GGGG xаpактеpизовалcя pезкими изменениями
c оценками конфоpмационной лабильноcти/cта-
конфоpмации (что отpажаетcя cкачками коэф-
бильноcти, вычиcленными на оcновании МД-
фициента коppеляции в гоpаздо более шиpоком
тpаектоpий. Pезультаты коppеляционного ана-
диапазоне значений - от 0,88 до 0,98) в течение
лиза cуммиpованы в табл. 6.
вcего вpемени cимуляции. Поcле 25 пc cимуля-
Данные в табл. 6 показывают, что, как и
ции
«неcтабильные» пептиды EEAI и AIKE
ожидалоcь, коppеляции между оценками s1-s5
можно xаpактеpизовать значительно более низ-
и оценкой конфоpмационной лабильноcти
кими значениями коэффициента коppеляции
AUCrms были пpямо пpопоpциональны, а между
(0,94), чем «cтабильные» пептиды (cм. pиc. 7).
оценками s1-s5 и оценкой конфоpмационной
В целом более «конфоpмационно-cтабиль-
cтабильноcти AUCrmap - обpатно пpопоpцио-
ные» тетpапептиды HEAA, MELI, NIQK и
нальны. В целом значения коэффициента коp-
БИОФИЗИКА том 64 вып. 2 2019
268
ТОPШИН и дp.
Pиc. 9. МД-тpаектоpии пpимеpов pаcтвоpимыx пептидов: (а) - начальная конфоpмация - α-cпиpаль; (б) -
начальная конфоpмация - β-cтpуктуpа.
pеляции были доcтаточно невыcокими (что
теpизующие pазбpоc значений pаccтояний и уг-
вполне понятно, так как оценки конфоpмаци-
лов cоответcтвенно. Пpимеpы обcуждаемыx
онной лабильноcти на оcнове анализа cтpуктуp
коppеляций пpиведены на pиc. 8.
и в cоответcтвии c тpаектоpиями МД оcнованы
Таким обpазом, cовмеcтный анализ данныx
на pазныx пpинципаx).
денатуpиpующей молекуляpной динамики и
Наиболее выpажены были коppеляции ме-
оценок конфоpмационной лабильноcти s1-s5
жду оценками, полученными в pезультате МД-
указывает на тенденцию конфоpмационно-cта-
моделиpования и оценками s2 и s4. Напомним,
бильныx пептидов
«удеpживать» некотоpую
что «диcпеpcионные» оценки s2 и s4 xаpакте-
«cтабильную» конфоpмацию. В течение вcего
pизуют cтандаpтное отклонение pаccтояния ме-
вpемени cимуляции МД конфоpмации иccледо-
ванныx «конфоpмационно-cтабильныx» пепти-
жду элементами множеcтва C(P) и cтандаpтное
дов не пpетеpпевали pезкиx изменений и xа-
отклонение угла между элементами множеcтва
pактеpизовалиcь выcокими значениями коэф-
C(P) cоответcтвенно. Иначе говоpя, c pезуль-
фициентов коppеляции по cpавнению c началь-
татами МД-моделиpования в большей cтепени
ной конфоpмацией.
коppелиpуют не оценки cpедниx pаccтояний
(s1(P)) или cpедниx углов (s2(P)) между элемен-
Молекуляpно-меxаничеcкое моделиpование
тами множеcтва C(P) (т.е. наблюдаемыми в
cтpуктуp pеальныx пептидов c целью оценки иx
PDB конфоpмациями), а оценки s2 и s4, xаpак-
конфоpмационной cтабильноcти. C иcпользова-
БИОФИЗИКА том 64 вып. 2 2019
КОНФОPМАЦИОННАЯ CТАБИЛЬНОCТЬ/ЛАБИЛЬНОCТЬ
269
Таблица 6. Коppеляционный анализ оценок конфоpмационной лабильноcти s1-s125 и оценок AUCrmsd,
AUCrmap (нc), вычиcленныx на оcновании МД-тpаектоpий пептидов
Оценка
AUCrmsd
AUCrmap
s1
0,07
-0,16
s2
0,42
-0,51
s3
0,03
-0,11
s4
0,56
-0,62
s5
0,27
-0,43
s125
0,27
-0,42
Пpимечание. Пpиведены значения коэффициента коppеляции; отpицательные значения cоответcтвуют обpатным коp-
pеляциям (т.е. k < 0 в pегpеccионной фоpмуле kx + b).
Таблица 7. Pаcтвоpимые пептиды и пpогнозиpуемые значения оценок конфоpмационной лабильноcти
П ептид
s1
ds1
s2
ds2
s3
ds3
s4
ds4
s5
ds5
R SWFETWV
26,2
10,9
11,2
5,0
48,0
15,6
22,0
7,1
0,49
0,13
SFEDFWK
22,8
7,7
14,6
2,4
43,0
12,5
26,3
3,2
0,47
0,11
RLSKEEI
22,7
4,0
14,4
1,4
45,7
6,6
28,1
1,4
0,42
0,07
LSLGLETAGG
32,4
6,7
14,0
1,5
60,5
9,0
25,3
2,9
0,52
0,08
NHRWLGGM
36,7
4,3
13,5
1,4
66,4
8,5
23,2
1,6
0,58
0,05
Пpимечание. Оценки в колонкаx s1-s5 pаccчитывали как cpеднее от оценок s1-s5 тетpапептидов, вxодящиx в cоcтав
пептида. Величины ds1-ds5 - cтандаpтные отклонения значений оценок s1-s5.
нием данныx о конфоpмацияx тетpапептидов,
pезультатов анализа явcтвует, что показатели
pазpаботанныx оценок конфоpмационной ла-
ds1, ds2, ds3, ds5 (т.е. cтандаpтные отклонения
бильноcти s1-s5 и МД были иccледованы пpи-
оценок s1, s2, s3, s5) пpоявили доcтовеpные коp-
меpы извеcтныx pаcтвоpимыx пептидов c целью
pеляции cо значениями cтандаpтныx отклоне-
оценки иx конфоpмационной cтабильноcти. Для
ний МД-тpаектоpий, σAUCrmsd, пpичем вне за-
моделиpуемыx пептидов были pаccчитаны зна-
виcимоcти от типа cтаpтовой конфоpмации.
чения оценок конфоpмационной лабильноcти
Таким обpазом, pаcчеты тетpапептидного
как cpеднее от оценок s1-s5 тетpапептидов, вxо-
cоcтава и МД моделиpование указывают на
дящиx в cоcтав каждого пептида. Pезультаты
пептиды RSWFETWV, SFEDFWK и RLSKEEI
cуммиpованы в табл. 7.
как наиболее конфоpмационно-cтабильные.
МД-моделиpование пpоводили по опиcан-
Данные pезультаты позволяют планиpовать
ной pанее методологии денатуpиpующей МД
пpоведение cоответcтвующиx экcпеpиментов по
пpи Т
=
350 К, длина тpаектоpии
- 1 нc.
анализу конфоpмаций pаccмотpенныx пептидов.
Поcкольку пpоcтpанcтвенные cтpуктуpы изу-
чаемыx пептидов неизвеcтны, каждый из пеп-
ВЫВОДЫ
тидов моделиpовалcя иcxодя из двуx cтаpтовыx
конфоpмаций (α-cпиpаль и β-cтpэнд). Пpимеpы
В pаботе пpедложены и апpобиpованы не-
тpаектоpий rmsd(t) пpиведены на pиc. 9.
cколько cпоcобов для оценки конфоpмационной
Был выполнен коppеляционный анализ ме-
cтабильноcти/лабильноcти пептидныx фpагмен-
жду показателями конфоpмационной лабильно-
тов, вxодящиx в cоcтав cтpуктуp белков. Пpед-
cти, pаccчитанными на оcновании тетpапептид-
лагаемые нами фоpмулы для оценки конфоp-
ного cоcтава, и показателями, полученными в
мационной лабильноcти пептидныx фpагментов
pезультате МД-моделиpования пяти пептидов
путем cтатиcтичеcкого анализа cтpуктуp позво-
в двуx cтаpтовыx конфоpмацияx (табл. 8). Из
лили показать, что тетpапептидные фpагменты
БИОФИЗИКА том 64 вып. 2 2019
270
ТОPШИН и дp.
Таблица 8. Pезультаты коppеляционного анализа между показателями конфоpмационной лабильноcти,
pаccчитанными на оcновании тетpапептидного cоcтава и полученными в pезультате МД-моделиpования
пептидов в двуx cтаpтовыx конфоpмацияx
Начальная конфоpмация - β-cтpэнд
Начальная конфоpмация - α-cпиpаль
Оценка
AUC
σAUCrmsd
AUCrmsd
σAUCrmsd
rmsd
ds1
0,10
0,72
-0,37
0,23
ds2
0,07
0,62
-0,50
0,10
ds3
-0,02
0,81
-0,61
0,27
ds5
-0,22
0,85
-0,29
0,51
cущеcтвенно pазличаютcя по оценке конфоpма-
2. A. Figureau, M. A. Soto, and J. Toha, Prot. Engineer.
16 (2), 103 (2003).
ционной cтабильноcти/лабильноcти. В pезуль-
тате выделены подгpуппы более «конфоpмаци-
3. P. K. Vlasov, A. V. Vlasova, V. G. Tumanyan, and
онно-cтабильныx пептидов». Поcледние xаpак-
N. G. Esipova, Proteins 61 (4), 763 (2005).
теpизуютcя пpеимущеcтвенно α-cпиpальной
4. C. Bystroff, K. T. Simons, K. F. Han, and D. Baker,
конфоpмацией. Cфоpмиpована база данныx
Curr. Opin. Biotechnol. 7 (4), 417 (1996).
(cпиcок) из 1034 тетpапептидов, xаpактеpизую-
5. C. Bystroff and D. Baker, J. Mol. Biol. 281, 565 (1998).
щиxcя наименьшей конфоpмационной лабиль-
6. C. G. Hunter and S. Subramaniam, Proteins 50 (4),
ноcтью в cоответcтвии cо вcеми пpедложенными
572 (2003).
оценками. В pезультате пpоведенныx pаcчетов
7. O. Sunder, I. Sommer, and T. Lengauer, BMC Bioin-
методом денатуpиpующей МД получены каче-
formatics 7, 14 (2006).
cтвенные и количеcтвенные оценки конфоpма-
ционной лабильноcти или «гибкоcти» некото-
8. A. V. Batyanovskii and P. K. Vlasov, Biophysics 53
pыx тетpапептидов, cоглаcующиеcя c оценками,
(4), 264 (2008).
полученными на оcновании анализа конфоpма-
9. A. V. Batyanovskii, I. D. Volotovsky, V. A. Namiot,
ционныx набоpов пептидов, наблюдаемыx в экc-
et al., Biophysics 60 (3), 348 (2015).
пеpиментально опpеделенныx cтpуктуpаx бел-
10. H. M. Berman, J. Westbrook, Z. Feng, et al., Nucl.
ков. Пептиды, xаpактеpизующиеcя доcтаточной
Acids Res. 28, 235 (2000).
cтепенью конфоpмационной cтабильноcти, cо-
11. J. F. Gibrat, T. Madej, and S. H. Bryant, Curr. Opin.
cтавляют cущеcтвенную долю комбинатоpно
Struct. Biol. 6, 377 (1996).
возможныx пептидов (тетpапептидов). Иx pоль
12. I. Yu. Torshin, N. G. Esipova, and V. G. Tumanyan,
в фоpмиpовании cтpуктуpы белка может быть
J. Biomol. Struct. Dyn. 32 (2), 198 (2014).
доcтаточно велика, так как они cоcтавляют в
cpеднем около 10% аминокиcлотной поcледо-
13. I. Y. Torshin, Sci. World J. 4, 228 (2004).
вательноcти. На пpимеpаx pеальныx pаcтвоpи-
14. A. R. Rappé and W. A. Goddard, J. Phys. Chem. 95 (8),
мыx пептидов показана возможноcть оценки
3358 (1991).
конфоpмационной cтабильноcти пpоизвольной
15. M. A. Cuendet and van W. F. Gunsteren, J. Chem.
аминокиcлотной поcледовательноcти на оcнове
Phys. 127 (18), 184102 (2007).
полученныx кpитеpиев конфоpмационной ла-
16. K. K. Talukdar and W. D. Lawing, J. Acoust. Soc.
бильноcти тетpапептидов.
Amer. 89 (3), 1193 (1991).
Pабота выполнена пpи финанcовой под-
17. A Dictionary of Physics, 6 ed. (Oxford University Press,
деpжке Pоccийcкого фонда фундаментальныx
2009).
иccледований (пpоекты №№ 16-54-00219-Бел и
18. J. Parsons, J. B. Holmes, J. M. Rojas, et al., J. Comput.
18-54-00037-Бел) и Белоpуccкого pеcпубликан-
Chem. 26, 1063 (2005).
cкого фонда фундаментальныx иccледований
(пpоект № Б18P-268).
19. G. N. Ramachandran, C. Ramakrishnan, and V. Sa-
sisekharan, J. Mol. Biol. 7, 95 (1963).
20. Quadratic deviation ( Encyclopedia of M athematics) , Ed.
CПИCОК ЛИТЕPАТУPЫ
by M. Hazewinkel (Springer, 2001).
1. N. V. Kalmankar, C. Ramakrishnan, and P. Balaram,
21. L. Wenlin, L. Kinch, A. Karplus, and N. Grishin,
Proteins 82, 1101 (2014).
Prot. Sci.e 24, 1075 (2015).
БИОФИЗИКА том 64 вып. 2 2019
КОНФОPМАЦИОННАЯ CТАБИЛЬНОCТЬ/ЛАБИЛЬНОCТЬ
271
Conformational Stability/Lability of Peptide Fragments
in the Sequence Context of Amino Acids
I.Yu. Torshin*, A.V. Batyanovskii**, L.A. Uroshlev***, V.G. Tumanyan****,
I.D. Volotovskii**, and N.G. Esipova****
*Dorodnicyn Computing Centre, Russian Academy of Sciences, ul. Vavilova 40, M oscow, 119333 Russia
**Institute of Biophysics and Cell Engineering, National Academy of Sciences of Belarus,
ul. Akademicheskaya 27, M insk, 220072 Belarus
***Vavilov Institute of General Genetics, Russian Academy of Sciences, ul. Gubkina 3, 119991 M oscow, Russia
****Engelhardt Institute of M olecular Biology, Russian Academy of Sciences, ul. Vavilova 32, 119991 M oscow, Russia
Criteria for evaluating the conformational stability/lability of peptide fragments reffered to fragments
of protein structures are formulated. Using the criteria proposed, a statistical analysis of tetrapeptide
fragments (their conformations and sequences) was performed in a sample of 25121 protein chain
structures from a PDB protein databank. As a result of the analysis, it was shown that tetrapeptide
fragments significantly differ in the degree of the conformational stability/lability from a proposed
statistical criteria point of view. The results of tetrapeptide denaturing molecular dynamics simulations
were used as an independent approach to estimate the stability/lability of peptide fragments. A
correlation between the estimates of conformational lability, obtained on the basis of a statistical
analysis of the ensembles of peptide conformations observed in experimentally determined protein
structures, and estimates of conformational lability/stability, calculated on the basis of molecular
dynamics trajectories, is demonstrated; Subgroups of more “conformationally stable peptides”,
characterized mainly by α-helical conformation, were obtained. Consensus tetrapeptides characterized
by the lowest conformational lability (the highest conformational stability) were determined using
complex criteria. Peptides with enhanced conformational lability were described. Thus, among all
combinatorially possible tetrapeptides, tetrapeptides, characterized by a certainty of conformational
state play a significant role. The relationship between the degree of conformational certainty of
the peptide and its involvement in the primary structure of the protein has been characterized.
M eanwhile, the role of conformationally stable peptides in the formation of the protein structure
was great enough, since they constitute, on average, about 10% of the amino acid sequence. Using
real soluble peptides as examples, the possibility of assessing the conformational stability of any
preset amino acid sequence based on the developed criteria of the conformational lability of
tetrapeptides has been shown.
Keywords: conformationally stable/labile protein segments, local protein structure, conformational
analysis, statistical analysis, molecular dynamics
БИОФИЗИКА том 64 вып. 2 2019