БИОФИЗИКА, 2019, том 64, № 3, с. 421-427
МОЛЕКУЛЯРНАЯ БИОФИЗИКА
УДК 577.3
О ШИРИНЕ КОНФОРМАЦИОННЫХ ПЕРЕХОДОВ БИОЛОГИЧЕСКИ
ВАЖНЫХ МАКРОМОЛЕКУЛ ПОД ВОЗДЕЙСТВИЕМ ДАВЛЕНИЯ
© 2019 г. С.А. Потехин, Р.С. Хусаинова*
Институт белка РАН, 142290, Пущино Московской области, ул. Институтская, 4
*Институт теоретической и экспериментальной биофизики РАН,
142290, Пущино Московской области, ул. Институтская, 3
E-mail: spot@vega.protres.ru
Поступила в редакцию 12.10.2018 г.
После доработки 12.10.2018 г.
Принята к публикации 20.10.2018 г.
Представлена теоретическая оценка полуширины конформационного перехода макромолекул,
вызванного увеличением давления. Анализ выполнен в рамках модели перехода между двумя
состояниями. Показано, что полуширина определяется в основном изменением (скачком) объема
при переходе. Получена формула, по смыслу подобная формуле Вант-Гоффа для полуширины
переходов, вызванных ростом температуры, которая позволяет оценить эффективное изменение
объема для одностадийного перехода под воздействием давления по величине его полуширины.
Выполненные оценки показывают, что переходы «гель-жидкий кристалл» фосфолипидов имеют
полуширину порядка нескольких мегапаскалей (десятки атмосфер), в то время как у белков эта
величина приблизительно в 100 раз больше и составляет сотни мегапаскалей (несколько тысяч
атмосфер). Показано, что при денатурации белков под воздействием давления скачок объема может
существенно меняться на интервале от начала до конца перехода.
Ключевые слова: сканирующая микрокалориметрия; высокое давление; теоретический анализ; переход
между двумя состояниями; ширина перехода; макромолекулы.
DOI: 10.1134/S0006302919030013
Существенное увеличение количества статей
под воздействием давления [54]. Изучается воз-
по влиянию высокого давления на самые разные
можность использования высокого давления для
биохимические процессы отражает растущий ин-
приготовления пищи [55-57].
терес к тем возможностям, которые открывает
В 2007-2009 гг. в Институте белка РАН сов-
это направление науки [1]. В частности, изуча-
местно с Институтом физики высоких давлений
лось влияние высокого давления на стабильность
им. Л.Ф. Верещагина РАН был разработан и изго-
структуры и кинетику денатурации белков [2-
товлен уникальный сканирующий микрокалори-
16], а также полинуклеиновых кислот [17-19].
метр, способный работать при давлениях до
Изучалось также влияние высокого давления на
6000 атмосфер [58,59]. Проведенные испытания
ДНК-белковые взаимодействия [20-22] и струк-
показали, что по своим техническим параметрам
турный полиморфизм липидов [23-28]. Особый
прибор не имеет аналогов. Для осуществления
интерес вызывают возможности применения вы-
надежных измерений требуется не более 0,3 мг
сокого давления для кристаллизации [29-32] и
биологического материала (белки, нуклеиновые
ренатурации белков [33-37], для изменения их
кислоты, липиды и т.д.). Подобные приборы, из-
агрегационных свойств [38,39]. Изучалось влия-
вестные по международным публикациям, спо-
ние давления на энзиматические свойства фер-
собны работать в лучшем случае при давлениях до
ментов [40-43], их субъединичный состав [44-46]
200 атмосфер и/или имеют на порядок меньшую
и связывание ими лигандов [47-50]. Перспектив-
чувствительность. Прибор позволяет получать
ным в биотехнологическом плане кажется ис-
необходимую информацию о зависимости эн-
пользования высокого давления для инактива-
тальпии конформационных переходов биологи-
ции вирусов и стерилизации продуктов [51-53].
чески важных макромолекул (белки, полинукле-
Показано, что возможной причиной подавления
иновые кислоты, липиды, полисахариды) от тем-
роста бактерий может быть диссоциация рибосом
пературы и давления, что, в свою очередь,
421
422
ПОТЕХИН, ХУСАИНОВА
позволило приступить к систематическому изу-
ские функции перехода с ростом давления и от
чению объемных изменений при конформацион-
чего зависят эти изменения. Была выведена фор-
ных превращениях биологически важных макро-
мула, определяющая температуру перехода от
молекул.
давления. Подводя итог проведенным исследова-
Наши первые экспериментальные работы по
ниям, можно утверждать, что сканирующая мик-
микрокалориметрии высокого давления на липи-
рокалориметрия при высоком давлении способна
дах [60-62], белках [63-65] и модельных полиме-
давать уникальную информацию об объемных
рах [66,67] показали перспективность этого на-
изменениях при конформационных переходах
правления исследований [68]. Но для того чтобы
макромолекул. Предлагаемая новая работа явля-
ясно себе представлять, как могут меняться тер-
ется продолжением этих исследований и посвя-
модинамические параметры того или иного тер-
щена теоретической оценке полуширин перехо-
модинамического процесса под воздействием
дов под воздействием давления.
давления и какую термодинамическую информа-
цию можно извлечь из полученных зависимо-
стей, необходимо, в частности, проанализировать
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
поведение простейших термодинамических мо-
Рассмотрим поведение макромолекулы, спо-
делей, в той или иной степени отражающих ре-
собной находиться в двух различных состояниях,
альные конформационные переходы в макромо-
например, в виде компактной глобулы (нативное
лекулах. В частности, ранее нами был проведен
анализ последствий воздействия высокого давле-
состояние) и развернутого клубка (денатуриро-
ния на термотропные конформационные перехо-
ванное состояние). Проанализируем распределе-
ды (например, денатурацию биополимеров) с ис-
ние молекул между этими двумя состояниями.
пользованием равновесной модели перехода
Пусть [N] и [D] - концентрации молекул в исход-
между двумя состояниями [69]. Было показано,
ном и конечном состояниях, K - константа рав-
как будут меняться основные термодинамиче-
новесия между молекулами в этих состояниях:
N ⇄ D
[D]
ΔG
Δ ΔH
Δ ΔE PΔV
K
=
=
exp
−
=
exp
−
=
exp
−
-
(
)
(
)
(
)
[
N
]
RT
R RT
R RT RT
Здесь P и T - давление и абсолютная темпера-
Тогда имеем:
тура, R - универсальная газовая постоянная. ΔG,
[D]
F
K
=
=
(1)
ΔS, H, ΔE, и ΔV - соответственно изменения пар-
[
N
]
1
-
F
циальных значений свободной энергии, энтро-
Получим частную производную логарифма
пии, энтальпии, энергии и объема при переходе.
константы равновесия по давлению:
Пусть при определенных значениях давления Pm
∂
ln K
∂ ΔG
1
∂ΔG
ΔV
=
−
= -
= -
(2)
и температуры Tm изменение свободной энергии
(
)
∂P
∂P RT
RT ∂P
RT
ΔG обращается в ноль и соответственно констан-
та равновесия K обращается в единицу. Такую
Из формулы (2) видно, что если реакция (пере-
ход) происходит с увеличением объема (ΔV > 0),
точку (Pm, Tm) обычно называют серединой пере-
то в соответствии с принципом Ле Шателье рав-
хода между состояниями N и D. Очевидно, что ес-
новесие будет смещаться в сторону исходного со-
ли есть хотя бы одна точка, удовлетворяющая вы-
стояния при увеличении давления, то есть доля
шеуказанному требованию, то будет и кривая на
молекул в исходном состоянии при данной тем-
двухмерной фазовой диаграмме P-T, отделяющая
пературе будет увеличиваться. Иными словами,
области, где молекула преимущественно натив-
исходное состояние будет увеличивать свою ста-
бильность по отношению к температуре, и сере-
ная, от области, где она преимущественно дена-
дина перехода Tm будет смещаться в область боль-
турированная.
ших температур. Такая ситуация наблюдается,
Пусть доля молекул в денатурированном состо-
например, при плавлении липидов [60-62] и
янии будет составлять F. Тогда концентрация мо-
плавлении суперспиральной структуры молеку-
лы белка коллагена [63]. Ясно, что в этой ситуа-
лекул в денатурированном [D] и нативном [N] со-
ции никакое сколь угодно большое увеличение
стояниях будет равна [D] = [N]0F и [N] = [N]0(1 - F)
давления не способно вызвать переход в денату-
соответственно, где [N]0 - полная концентрация
рированное состояние при некой температуре T,
молекул.
если молекула находилась в нативном состоянии
БИОФИЗИКА том 64
№ 3
2019
О ШИРИНЕ КОНФОРМАЦИОННЫХ ПЕРЕХОДОВ
423
при этой температуре и атмосферном давлении.
Возможно, именно по этой причине работ по изу-
чению влияния давления на конформационные
переходы, происходящие с увеличением объема,
крайне мало [70], так как работа с такими объек-
тами требует сканирования не только по давле-
нию, но и по температуре.
Если процесс идет с уменьшением объема, до-
ля молекул в исходном состоянии при данной
температуре в результате увеличения давления
будет уменьшаться, то есть исходное состояние
будет дестабилизироваться, а середина перехода
Tm будет смещаться в область более низких тем-
ператур. В этом случае увеличение давление при
фиксированной температуре неизбежно будет
приводить к денатурации образца. Пример такого
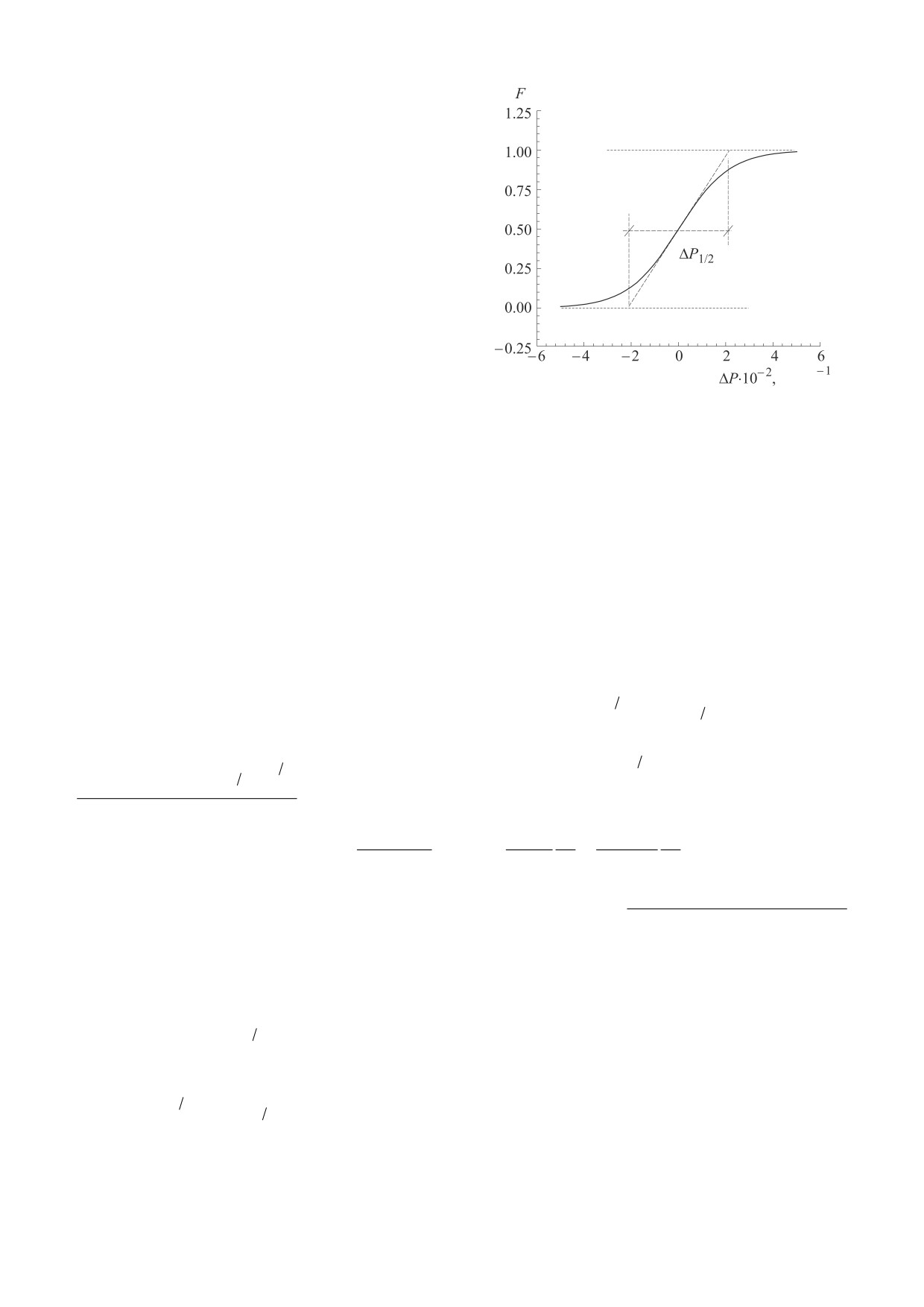
МПа
поведения макромолекул демонстрируют мио-
глобин и рибонуклеаза [3,10-12,16].
Рис. 1. Зависимость доли молекул в денатурирован-
Пусть макромолекула уменьшает парциальный
ном состоянии F от величины отклонения давления
объем при денатурации и при увеличении давле-
ΔP от середины перехода P0 при заданной температу-
ре. На рисунке также указана полуширина перехода
ния претерпевает конформационный переход. В
ΔP1/2 и продемонстрирован способ ее определения
данный момент нас будет интересовать, насколь-
через производную доли молекул в денатурированом
ко резко будет происходить этот переход, какова
состоянии в середине перехода. Зависимость соответ-
ширина этого перехода в единицах давления. На
ствует переходу при температуре 50°С с изменением
парциального объема ΔV = -25 см3/моль.
рис. 1 изображен такой переход по давлению.
Аналогично формуле Вант-Гоффа [71] для пере-
ходов по температуре, мы будем использовать по-
Таким образом, полуширина перехода, проис-
нятие полуширины перехода. По определению
ходящего при увеличении давления, может быть
полушириной перехода мы будем называть такую
оценена как величина, обратная частной произ-
величину изменения давления ΔP1/2, которая
водной доли молекул в денатурированном состо-
обеспечит переход из начального состояния в ко-
янии по давлению в середине перехода:
нечное при условии, что производная доли моле-
−1
кул в денатурированом состоянии по давлению
⎡
∂F
⎤
ΔP
(4)
постоянна в этом диапазоне давлений и равна
12
= ⎢
(
)
⎥
⎣
∂P
F
=12
⎦
производной в середине происходящего про-
цесса:
∂F
Для оценки
прологарифмируем урав-
(
)
∂F
∂P
F
=12
⋅ΔP
=
1.
(3)
(
)
12
∂P
F=12
нение (1) с последующим дифференцированием:
∂lnK
∂
lnF
∂ln(1−
F)
1
∂F
1
∂F
1
∂F
=
-
=
+
=
∂P
∂P
∂P
F ∂P
(1 −
F)∂P F
(1
−
F
)∂P
Учитывая соотношение (2), получим:
Таким образом, чем более значительное
∂F
Δ
уменьшение объема происходит при конформа-
=-
V F
(1−
F)
∂P RT
ционном переходе, тем более узкий переход бу-
дем наблюдать при увеличении давления. На
В середине перехода F=1/2 и соответственно
рис. 2 приведены расчетные зависимости доли
∂F
Δ
V
=-
(5)
молекул в денатурированном состоянии F от ве-
(
)
∂P
F=12
4RT
личины отклонения давления P от середины пе-
рехода P0 для трех переходов с различным изме-
Объединяя уравнения
(4) и
(5), получим:
−1
нением парциального объема. Изменения объема
⎡
∂F
⎤
4RT
выбраны в диапазоне значений, характерном для
ΔP
=
= -
(6)
12
⎢
(
)
⎥
⎣
∂P
F=12
⎦
ΔV
глобулярных белков. Проведенные до настояще-
БИОФИЗИКА том 64
№ 3
2019
424
ПОТЕХИН, ХУСАИНОВА
мости константы равновесия от давления требует-
ся, чтобы измерения проводились в широком диа-
пазоне - от давлений, при котором белок нативен,
до давлений, где белок полностью денатурирован.
Учитывая большие значения полуширин перехо-
дов, оценки объемов менее 40 см3/моль вряд ли
могут быть сколько-нибудь точными в таких экс-
периментах.
При переходе «гель - жидкий кристалл» ли-
пидного бислоя размеры кооперативного участка
обычно составляют порядка 150-200 молекул
[60,75]. Изменение объема в расчете на одну мо-
лекулу в зависимости от длины гидрофобного
ацильного «хвоста» (от 14 до 19 метиленовых
групп у диацилфосфатидилхолинов) меняется
приблизительно от 16 до 40 см3/моль [62]. Пола-
МПа
гая размер кооперативного участка равным
150 молекулам, получим, что полное изменение
объема при переходе для кооперативной еденицы
Рис. 2. Расчетные зависимости доли молекул в дена-
турированном состоянии F от величины отклонения
1,2-димиристоилфосфатидилхолина (14:0 PC) бу-
давления ΔP для трех переходов с различным измене-
дет равно 2340 см3, а для 1,2 динонадеконоилфос-
нием парциального объема, а именно -25 (1), -50 (2)
и -100 (3) см3/моль. Полагали, что переходы проис-
фатидилхолина (19:0 PC) - 6150 см3. Соответ-
ходят при температуре 50°С.
ственно, полуширины переходов для этих липи-
дов будут приблизительно в 100 раз уже, чем для
белков. Для 14:0 PC полуширина будет составлять
го времени исследования влияния давления на
4,2 МПа (≈ 41 атм), а для 19:0 PC - 1,8 МПа
стабильность структуры белков показали [70], что
(≈ 17 атм). Судя по результатам работ [76,77], вы-
у подавляющего большинства изученных белков
полненные оценки хорошо согласуются с экспе-
изменение объема при денатурации отрицатель-
риментальными данными.
но и не превосходит по абсолютной величине
По сравнению с другими биомакромолекула-
100 см3/моль. Используя формулу (6), легко оце-
ми влияние гидростатического давления на кон-
нить численные значения полуширин для пере-
формационную стабильность ДНК и РНК изуче-
ходов с использованными при построении кри-
но слабо. В большинстве случаев спиральная
вых изменениями объемов. При изменении объе-
форма ДНК или РНК стабилизировалась при
ма в -25, -50 и -100 см3/моль полуширины будут
увеличении давления. Степень стабилизации бы-
ла намного меньше тех эффектов, которые на-
соответственно равны 428 МПа (≈ 4240 атм),
блюдались для других макромолекул при тех же
214 МПа (≈ 2120 атм) и 107 МПа (≈ 1060 атм). По-
давлениях [78]. Таким образом, объемные изме-
лученные оценки достаточно хорошо согласуют-
ся с экспериментальными данными по полуши-
нения при разворачивании двойных спиралей
ринам денатурационных переходов реальных
полинуклеиновых кислот, вероятно, намного
меньше, чем при денатурационных переходах
белков (см., например, работы [2, 72-74]).
белков и переходах «гель - жидкий кристалл» у
Столь высокие значения полуширин перехо-
липидов.
дов, вызванных увеличением давления у белков,
Следует заметить, что формула (6) может быть
накладывают определенные ограничения на точ-
переписана в форму, удобную для оценки эффек-
ность оценки изменения парциальных объемов
тивного изменения объема реакции по полуши-
при денатурации. Обычно для оценки объемных
рине перехода:
денатурационных изменений исследователи ис-
4RT
ΔV
= -
пользуют несерийное оборудование, способное
эфф
(7)
Δ
P12
работать при давлениях до нескольких сотен мега-
паскаль (несколько тысяч атмосфер). Оценки де-
Как и в случае совпадения истинной энталь-
лаются на основании данных по влиянию давле-
пии процесса с ее эффективным значением при
ния на константу равновесия между нативным и
термотропных переходах, совпадение эффектив-
денатурированным белком. В свою очередь, для
ного значения изменения объема при баротроп-
оценки константы равновесия требуется экстра-
ном процессе с его истинным значением может
поляция наблюдаемого параметра для нативного
служить доказательством отсутствия промежу-
и денатурированного белка на область перехода.
точных состояний в ходе процесса. Однако надо
Таким образом, для корректной оценки зависи-
учитывать, что для достаточно широких перехо-
БИОФИЗИКА том 64
№ 3
2019
О ШИРИНЕ КОНФОРМАЦИОННЫХ ПЕРЕХОДОВ
425
дов изменение объема в разных точках процесса
СПИСОК ЛИТЕРАТУРЫ
(при разных давлениях) может быть разным. Ве-
1.
Advances in High Pressure Bioscience and Biotechnology
личина этих различий определяется различием
II (Proc. 2nd Int. Conf. on High Pressure Bioscience and
сжимаемости молекулы в конечном и начальном
Biotechnology), Ed. by R. Winter (Springer, Dortmund,
состоянии, т.е. скачком изотермического коэф-
2002).
фициента сжимаемости ΔχТ:
2.
C. Y. Tan, C. H. Xu, J. Wong, et al., Biophys. J. 88,
1
⎛∂V
2
⎞
1
⎛∂V
1
⎞
1
∂ΔV
1264 (2005).
Δχ
T
= -
⎜
⎟
+
⎜
⎟
≈ -
(
)
V
2
⎝∂P
⎠
T
V
1
⎝∂P
⎠
T
V ∂P
T
3.
F. Meersman, L. Smeller, and K. Heremans, Biophys.
J. 82, 2635 (2002).
Здесь индексы 1 и 2 означают соответственно
—
4.
R. Kitahara, A. Okuno, M. Kato, et al., Magn. Reson.
начальное и конечное состояния,
V - средний
Chem. 44, S108 (2006).
парциальный объем молекулы в этих состояниях.
5.
K. Ruan, R. Lange, F. Meersman, et al., Eur. J. Bio-
Используя полученные нами ранее параметры
chem. 265, 79 (1999).
переходов «гель - жидкий кристалл» для серии
6.
J. A. Kornblatt, M. J. Kornblatt, C. Clery, and C. Bal-
гомологичных фосфолипидов [62] и сделанные в
этой статье оценки полуширины этих переходов
ny, Eur. J. Biochem. 265, 120 (1999).
под воздействием давления, легко показать, что
7.
K. Ruan, C. Xu, Y. Yu, et al., Eur. J. Biochem. 268,
изменения скачка объема на интервале давлений,
2742 (2001).
равном их полуширине, не может превышать од-
8.
K. Goossens, J. Haelewyn, F. Meersman, et al., Bio-
ного процента. Из этого следует важный для экс-
chem. J. 370, 529 (2003).
периментаторов вывод: попытки оценки величи-
9.
H. Herberhold, S. Marchal, R. Lange, et al., J. Mol.
ны скачка коэффициента сжимаемости при рабо-
Biol. 330, 1153 (2003).
те с баротропными переходами при постоянной
температуре у липидов надо признать беспер-
10.
N. Takeda, M. Kato, and Y. Taniguchi, Biochemistry
спективными, а предположение о постоянстве
34, 5980 (1995).
изменения объема при обработке соответствую-
11.
T. Yamaguchi, H. Yamada, and K. Akasaka, J. Mol.
щих экспериментальных данных вполне адек-
Biol. 250, 689 (1995).
ватным.
12.
J. F. Brandts, R. J. Oliveira, and C. Westort, Biochem-
В случае денатурации белков ситуация корен-
istry 9, 1038 (1970).
ным образом отличается. У коллагена, например,
13.
J. Torrent, J. Font, H. Herberhold, et al., Biochim.
в состав кооперативной единицы входит около
Biophys. Acta (Proteins & Proteomics) 1764,
489
150 аминокислотных остатков и денатурацион-
(2006).
ный эффективный объем составляет около
14.
S. Marchal, J. Font, M. Ribó, et al., Acc. Chem. Res.
145 см3 [63]. Таким образом, полуширина перехо-
42, 778 (2009).
да по давлению, рассчитанная по формуле (6),
должна быть около 72 МПа (710 атм). Учитывая,
15.
J. Font, A. Benito, J. Torrent, et al., Biol. Chem. 387,
что у коллагена при постоянной температуре объ-
285 (2006).
ем меняется приблизительно на 35% при измене-
16.
M. Ribó, J. Font, A. Benito, et al., Biochim. Biophys.
нии давления на каждые 100 МПа, величина
Acta 1764, 461 (2006).
скачка объема может измениться на 25% на ин-
17.
A. R. Amiri and R. B. Macgregor Jr., Biophys. Chem.
тервале от начала до конца перехода. Это уже за-
156, 88 (2011).
метная величина, и возможность изменения объ-
ема при увеличении давления должна учитывать-
18.
C. G. Heden, T. Lindahl, and I. Toplin, Acta Chem.
ся при обработке экспериментальных данных.
Scand. 18, 1150 (1964).
19.
19. M. C. Lin, P. Eid, P. T. T. Wong, and R. B. Macgre-
У большинства других белков изменения скач-
ка объема на ширине перехода могут быть еще
gor Jr., Biophys. Chem. 76, 87 (1999).
больше из-за большой величины этой полушири-
20. L. M. T. R. Lima, D. Foguel, and J. L. Silva, Proc.
ны. Например, в случае лизоцима изменения
Natl. Acad. Sci. USA 97 14289 (2000).
скачка объема могут превосходить величину это-
21. D. F. Senear, V. Tretyachenko-Ladokhina, M. L. Opel,
го скачка [65]. Естественно, в таких случаях нали-
et al., Nucl. Acids Res. 35 1761 (2007).
чие конечной величины скачка коэффициента
22. D. Foguel, J. L. Silva, and G. de Prat-Gay, J. Biol.
сжимаемости должно учитываться в обязатель-
Chem. 273, 9050 (1998).
ном порядке при обработке экспериментальных
данных.
23. P. T. C. So, S. M. Gruner, and S. Erramilli, Phys. Rev.
Lett. 70, 3455 (1993).
Работа выполнена при финансовой поддержке
Российского фонда фундаментальных исследова-
24. R. Winter and C. Czeslik, Z. Kristallogr. 215, 454
ний, грант № 14-04-00993-а.
(2000).
БИОФИЗИКА том 64
№ 3
2019
426
ПОТЕХИН, ХУСАИНОВА
25. M. Pisani, T. Narayanan, G. Di Gregorio, et al., Phys.
49. M. J. Kornblatt, R. Lange, and C. Balny, Eur. J. Bio-
Rev. E 68, 21924 (2003).
chem. 271, 3897 (2004).
26. C. Czeslik, R. Winter, G. Rapp, and K. Bartels, Bio-
50. J.-M. Zhou, L. Zhu, and C. Balny, Eur. J. Biochem.
phys. J. 68, 1423 (1995).
267, 1247 (2000).
27. P. Mariani, B. Paci, P. Bosecke, et al., Phys. Rev. E 54,
51. J. L. Silva, A. C. Oliveira, A. M. Gomes, et al., Bio-
5840 (1996).
chim. Biophys. Acta 1595, 250 (2002).
28. M. Pisani, S. Bemstorff, C. Ferrero, and P. Mariani, J.
52. J. L. Silva, D. Foguel, A. T. Da Poian, and P. E. Preve-
Phys. Chem. B 105, 3109 (2001).
lige, Curr .Opin. Struct. Biol. 6, 166 (1996).
29. M. D. Collins, A Dissertation presented to the Faculty of
53. Y. Rigaldie, A. Largeteau, G. Lemagnen, et al., in Ad-
the Graduate School of Cornell University (Ithaca, NY,
vances in High Pressure Bioscience and Biotechnology II,
USA, 2006).
Ed. by R. Winter (Springer, 2002), pp. 315-319.
30. R. Fourme, I. Ascone, R. Kahn, et al., in Advances in
54. M. Gross, K. Lehle, R. Jaenicke, and K. H. Nierhaus,
High Pressure Bioscience and Biotechnology II, Ed. by R.
Eur. J. Biochem. 218, 463 (1993).
Winter (Springer, 2002), pp. 161-170.
55. R. Hayashi, in Engineering and Food, Ed. by
W. E. L. Spiess and H. Schubert (Elsevier Appl. Sci.,
31. Y. Suzuki, H. Suto, T. Sawada, and K. Tamura, in Ad-
vances in High Pressure Bioscience and Biotechnology II,
England, 1989), pp. 815-826.
Ed. by R. Winter (Springer, 2002), pp. 171-174.
56. Oey, M. Lille, A. V. Loey, and M. Hendrickx, Trends
Food Sci. Tech. 19, 320 (2008).
32. A. Kadri, C. Charron, M. C. Robert, et al., in Advances
in High Pressure Bioscience and Biotechnology II, Ed. by
57. N. K. Rastogi, K. S. M. S. Raghavarao, V. M. Balasu-
R. Winter (Springer, 2002), pp. 175-178.
bramaniam, et al., Crit. Rev. Food Sci. 47, 69 (2007).
33. B. E. Schoner, K. S. Bramlett, H. Guo, and T. P. Bur-
58. С. А. Потехин, А. А. Сенин, Н. Н. Абдурахманов и
ris, Mol. Genet. Metab. 85, 318 (2005).
Е. В. Межбурд, Дифференциальный адиабатный
сканирующий микрокалориметр высокого давления,
34. Q. Zong, P. A. Osmulski, and L. P. Hager, Biochemis-
Патент № 2364845 с приоритетом изобретения от
try 34, 12420 (1995).
19 марта 2008 г.
35. . J. St John, J. F. Carpenter, and T. W. Randolph, Bio-
59. A. A. Senin, L. N. Dzhavadov, and S. A. Potekhin, Rev.
technol. Prog. 18, 565 (2002).
Sci. Instrum., 87, 034901 (2016).
36. C. Böde, F. G. Tölgyesi, L. Smeller, et al., Biochem. J.
60. S. A. Potekhin, A. A. Senin, N. N. Abdurakhmanov,
370, 859 (2003).
and R. S. Khusainova, Biochim. Biophys. Acta
37. J. L. Silva, Y. Cordeiro, and D. Foguel, Biochim. Bio-
(Biomembranes) 1778, 2588 (2008).
phys. Acta 1764, 443 (2006).
61. S. A. Potekhin, A. A. Senin, N. N. Abdurakhmanov,
38. T. W. Randolph, M. Seefeldt, and J. F. Carpenter, Bio-
and R. S. Khusainova, Biochim. Biophys. Acta
chim. Biophys. Acta 1595, 224 (2002).
(Biomembranes) 1808, 1806 (2011).
39. D. Foguel and J. L. Silva, Biochemistry 43, 11361
62. S. A. Potekhin, A. A. Senin, and R. S. Khusainova,
(2004).
Thermochim. Acta 560, 17 (2013).
40. S. Kunugi, M. Kitayaki, Y. Yanagi, et al., Eur. J. Bio-
63. S. A. Potekhin, A. A. Senin, N. N. Abdurakhmanov,
chem. 248, 567 (1997).
and E. I. Tiktopulo, Biochim. Biophys. Acta (Proteins
41. Ohmae, C. Murakami, K. Gekko, and C. Kato, J. Biol.
and Proteomics) 1794, 1151 (2009).
Macromol. 7, 23 (2007).
64. A. Y. Yegorov and S. A. Potekhin, Thermochim. Acta
42. M. Trovaslet, S. Dallet-Choisy, F. Meersman, et al.,
610, 10 (2015).
Eur. J. Biochem. 270, 119 (2003).
65. А. Е. Егоров и С. А. Потехин, Молекуляр.
43. P. Masson, N. Bec, M.-T. Froment, et al., Eur. J. Bio-
биология 52, 36 (2018).
chem. 271, 1980 (2004).
66. V. Y. Grinberg, T. V. Burova, N. V. Grinberg, et al.,
44. S. Marchal, H. M. Girvan, A. C. F. Gorren, et al., Bio-
Polymer 87, 283 (2016).
phys. J., 85, 3303 (2003).
67.
6V. Y. Grinberg, A. A. Senin, N. V. Grinberg, et al.,
45. R. Lange, I. Heiber-Langer, C. Bonfils, et al., Biophys.
Polymer, 138, 288 (2018).
J. 66, 89 (1994).
68. С. А. Потехин, Успехи биол. химии 58, 285 (2018).
46. G. B. Ogunmola, A. Zipp, F. Chen, and W. Kauzmann,
69. С. А. Потехин, А. Е. Егоров и Р. С. Хусаинова,
Proc. Natl. Acad. Sci. USA 74, 1 (1977).
Биофизика 60, 837 (2015).
47. G. B. Ogunmola, W. Kauzmann, and A. Zipp, Proc.
70. C. A. Royer, Biochim. Biophys. Acta 1595, 201 (2002).
Natl. Acad. Sci. USA 73, 4271 (1976).
71. P. L. Privalov, Microcalorimetry of macromolecules. The
48. V. L. Valente-Mesquita, M. M. Botelho, and S. T. Fer-
physical basis of biological Structures (J. Wiley & Sons,
reira, Biophys. J. 75, 471 (1998).
Inc., 2012).
БИОФИЗИКА том 64
№ 3
2019
О ШИРИНЕ КОНФОРМАЦИОННЫХ ПЕРЕХОДОВ
427
72. K. Ruan, C. Xu, T. Li, et al., Eur. J. Biochem. 270, 1654
75. D. B. Mountcastle, R. L. Biltonen, and M. J. Halsey,
(2003).
Proc. Natl. Acad. Sci. USA 75, 4906 (1978).
76. S. Kaneshina, H. Ichimori, T. Hata, and H. Matsuki,
73. M. Kato, Y. Sato, K. Shirai, et al., Eur. J. Biochem.
Biochim. Biophys. Acta 1374, 1 (1998).
270, 4587 (2003).
77. H. Ichimori, T. Hata, H. Matsuki, and S. Kaneshina,
74. M. Dumoulin, H. Ueno, R. Hayashi, and C. Balny,
Biochim. Biophys. Acta 1414, 165 (1998).
Eur. J. Biochem. 262, 475 (1999).
78. R. B. Macgregor Jr., Biopolymers 48, 253 (1998).
On the Width of Conformational Transitions of Biologically Important Macromolecules
under the Influence of Pressure
S.A. Potekhin* and R.S. Khusainova**
*Institute of Protein Research, Russian Academy of Sciences, ul. Institutskaya 4, Pushchino, Moscow Region, 142290 Russia
**Institute of Theoretical and Experimental Biophysics, Russian Academy of Sciences,
ul. Institutskaya 3, Pushchino, Moscow Region, 142290 Russia
The paper presents a theoretical assessment of the half-width of the conformational transition of macromol-
ecules caused by an increase in pressure. The study was made using an equilibrium model of transition be-
tween two states. It is shown that the half-width of the transition is determined mainly by the volume incre-
ment upon this transition. Formula that on sense is akin to van’t Hoff equation for the half-width of the tran-
sitions caused by growth of temperature is formulated. The formula allows estimating the volume increment
for two state transition caused by pressure raising using its half-width. Our estimates show that gel to liquid
crystal transitions in phospholipids have a half-width of the order of several megapascals (dozens of atmo-
spheres), while for proteins this value is approximately 100 times more and reaches to hundreds of megapas-
cals (several thousands of atmospheres). It has been shown that at a denaturation of proteins under the pres-
sure raised, the volume increment can vary significantly over the interval from the beginning to the end of the
transition.
Keywords: scanning microcalorimetry, high pressure, theoretical analysis, two state transition, width of transition,
macromolecules
БИОФИЗИКА том 64
№ 3
2019