БИОФИЗИКА, 2019, том 64, № 3, с. 437-445
МОЛЕКУЛЯРНАЯ БИОФИЗИКА
УДК 577.3
ИЗУЧЕНИЕ СТРУКТУРЫ ТРИПСИН-ПОДОБНЫХ СЕРИНОВЫХ
ПРОТЕИНАЗ. 2. ИЗУЧЕНИЕ ФЛУОРЕСЦЕНЦИИ ТРИПТОФАНА
У ВАРИАНТОВ МИНИПЛАЗМИНОГЕНА
С ИЗМЕНЕННОЙ ПЕРВИЧНОЙ СТРУКТУРОЙ
© 2019 г. Т.И. Белянко, Е.С. Феоктистова, Н.А. Cкpыпина, А.В. Cкамpов, Я.Г. Гуpcкий,
Н.М. Pуткевич, Н.И. Добpынина, P.Ш. Бибилашвили, Л.П. Cавочкина
Национальный медицинcкий иccледовательcкий центp каpдиологии Минздрава России,
121552, Моcква, 3-я Чеpепковcкая ул., 15а
E-mail: Robert.Bibilashvili@gmail.com
Поступила в редакцию 28.02.2019 г.
После доработки 28.02.2019 г.
Принята к публикации 04.03.2019 г.
Для исследования описанного ранее изменения флуоpеcценции тpиптофана пpи активации
плазминогена уpокиназой получены варианты миниплазминогена с измененной первичной
структурой. Протестированы варианты с заменами Trp141, Trp215 и Leu217 (номеp аминокиcлотного
оcтатка указан по xимотpипcиновой номенклатуpе). Активация вариантов с одиночными заменами
тpиптофана сопровождается изменением спектра, тогда как при двойной замене сдвиг спектра не
наблюдается, т.е. оба триптофана (Trp141 и Trp215) вносят вклад в изменение спектра
флуоресценции. Как предполагалось ранее, наиболее существенное влияние на сдвиг оказывает
изменение микроокружения Тrp215. Замены Trp141, Trp215 и Leu217 в mPlg не влияют на скорость
активации плазминогена урокиназой. Показано, что замена консервативного у сериновых протеаз
Trp215 приводит к значительному снижению, но не к потере ферментативной активности плазмина.
Ключевые слова: плазминоген, флуоресценция триптофана, активация фермента, каталитический
домен, взаимосвязь структуры и ферментативной активности, мутации.
DOI: 10.1134/S0006302919030037
номенклатуре; обсуждаемые в тексте Trp141 и
Сериновая протеаза плазмин циркулирует в
Trp215 при использовании Glu-Plg-нумерации
крови в виде неактивного профермента плазми-
ногена. Активация плазминогена - ключевой
имеют координаты 685 и 761 соответственно), что
этап процесса растворения тромбов и сгустков
приводит к реорганизации пространственной
крови (фибринолиза). Кроме того, как плазмин,
структуры протеазного домена белка.
так и плазминоген участвуют в ряде других фи-
Как было показано в нашей предыдущей рабо-
зиологических и патологических процессов в ор-
те, активация плазминогена урокиназой сопро-
ганизме - деградации внеклеточного матрикса,
вождается значительными изменениями спектра
ангиогенезе, воспалении, миграции опухолевых
флуоресценции активируемого белка - спектр и,
клеток [1-6].
как следствие, максимум флуоресценции трипто-
Плазмин образуется активаторами плазмино-
фана для мини-плазмина (mPln) сдвигается на 6
гена (урокиназным или тканевым) при гидролизе
нм в длинноволновую область по сравнению с
пептидной связи между аминокислотными остат-
мини-плазминогеном (mPlg), а интенсивность
ками Arg и Val с координатами 15-16 (здесь и да-
флуоресценции повышается. Кривая, описываю-
лее координаты приводятся по химотрипсиновой
щая изменения спектра флуоресценции трипто-
фана от времени в процессе активации, хорошо
Сокращения: mPln - мини-плазмин, mPlg - мини-плазми-
ноген, sc_uPA
- одноцепочечная проформа активатора коррелирует с кинетическими кривыми актива-
плазминогена урокиназного типа, tc_uPA - двухцепочечная
ции, полученными как по результатам измерения
активированная форма активатора плазминогена уроки-
назного типа.
амидолитической активности образующегося
437
438
БЕЛЯНКО и др.
Рис. 1. Микроокружение Trp215 в плазминогене и плазмине.
БИОФИЗИКА том 64
№ 3
2019
ИЗУЧЕНИЕ СТРУКТУРЫ ТРИПСИН-ПОДОБНЫХ СЕРИНОВЫХ ПРОТЕИНАЗ
439
плазмина, так и по результатам анализа продук-
плазминоген представляет собой укороченный
тов расщепления плазминогена [7].
вариант (каталитический и один (пятый) крингл
Сравнение третичных структур плазмина и
домены) природного плазминогена. Структура
плазминогена позволило выделить два триптофа-
белка и продуцента описаны в работах [8-10].
на (Trp215 и Trp141), микроокружение которых
Мутации вносили стандартными методами гене-
существенно изменяется при активации, что мо-
тической инженерии и верифицировали секвени-
жет послужить причиной отличия спектров флуо-
рованием. Полученные рекомбинантные белки
ресценции у зимогена и активного фермента
очищали, как описано ранее [7].
(плазмина и плазминогена).
Продуцент урокиназы - модифицированный
Ранее нами было высказано предположение,
активатор плазминогена урокиназного типа (од-
что Trp215 ответственен за наблюдаемую разницу
ноцепочечная проформа - sc_uPA) - также скон-
спектров из-за радикального изменения микро-
струирован в нашей лаборатории. Двухцепочеч-
окружения при превращении плазминогена в
ную активированную форму (tc_uPA) получали
плазмин [7]. При активации происходит поворот
путем инкубации одноцепочечной проформы
Trp215 вокруг оси, проходящей через С-альфа 214
sc_uPA с плазмином [11].
и С-альфа 216. У плазминогена триптофан 215
Чистоту ферментов определяли электрофоре-
располагается в «субстрат-узнающем участке» и
тически, используя для оцифровки полученных
полностью перекрывает доступ боковой цепи Arg
электрофореграмм программные пакеты TotalLab
субстрата в эту зону (положение Z, рис. 1а). При
или GelAnalyzer2010a. Чистота tc_uPA и вариан-
повороте индольное кольцо покидает «субстрат-
тов mPlg составила 80% и 95% соответственно.
узнающий участок» (положение Z) и перемеща-
ется в положение А, которое находится между
Измерение спектров флуоресценции при актива-
петлей 170-175 и бета-цепями F2 (226-231) и C2
ции мини-плазминогена и его вариантов. Измере-
(179-184). При этом бензольное кольцо изменяет
ния проводили на флуориметре Cary Eclipse Fluo-
полярное окружение от отрицательно заряжен-
rescence Spectrophotometer (Agilent, США) при
ных аминокислотных остатков (Asp194 и Glu143)
24°C. Использовали стандартные кюветы с дли-
к положительно заряженному Arg175 и гидрофоб-
ной оптического пути 1 см. Время накопления
ному Leu217.
сигнала при кинетических измерениях составля-
На разницу в спектрах флуоресценции зимоге-
ло 0,2-0,5 с, обе щели - с оптическим разреше-
на и активного фермента может влиять и измене-
нием 5 нм, скорость сканирования - 100 нм/мин.
ние микроокружения Trp141. Сам Trp141 не меня-
В качестве относительной величины флуоресцен-
ет своего положения, однако дрейф Asp194 и
ции было принято отношение интенсивности
Val16 при активации плазминогена (рис. 2) может
флуоресценции при 320 нм к интенсивности при
влиять на флуоресценцию этого триптофана. Из
360 нм при длине волны возбуждения 279 нм
рис. 2 видно, что разрыв связи Arg15-Val16 при-
(I320/I360) [12]. Регистрировали спектры флуорес-
водит к радикальному изменению положения
ценции mPlg, затем добавляли tc_uPA к раствору
Lys156, Glu143 и Asp194 по отношению к Trp141.
mPlg, перемешивали и начинали запись флуорес-
С целью выяснения вклада вышеупомянутых
ценции во времени при длинах волн 320 и 360 нм.
триптофанов и их окружения в флуоресценцию
Запись данных проводили с момента добавления
mPln и mPlg нами сконструированы варианты
tc_uPA в раствор mPlg до выхода кривой интен-
миниплазминогена с измененной первичной
сивности флуоресценции на плато. По заверше-
структурой. Внесенные мутации затрагивали как
нии реакции регистрировали спектр флуоресцен-
сами триптофаны 141 и 215, так и соседние ами-
ции образовавшегося продукта.
нокислотные остатки. Настоящая работа посвя-
В предварительном опыте определяли моляр-
щена изучению свойств полученных белков.
ное соотношение mPlg и tc_uPA, при котором ак-
тивация mPlg W141W215 происходит медленно (с
МАТЕPИАЛЫ И МЕТОДЫ
выходом на плато за 20-30 мин). Для дальнейших
исследований было выбраны следующие условия:
Реагенты. В работе использовали реагенты
концентрация вариантов mPlg - 1000 нМ, кон-
фирмы Sigma (США) и хромогенный субстрат S-
центрация tc_uPA - 25 нM.
2251 фирмы Chromogenix (Италия).
Рекомбинантные белки. В качестве исходного
При выбранных концентрациях поглощение
материала для внесения мутаций использовали
раствора белков при 280 нм равно 0,06 о.е., что не
сконструированный нами продуцент мини-плаз-
потребовало введения коррекции на поглощение
миногена человека. Рекомбинантный мини-
при измерениях флуоресценции.
БИОФИЗИКА том 64
№ 3
2019
440
БЕЛЯНКО и др.
Рис. 2. Микроокружение Trp141 в плазминогене и плазмине.
Обработку результатов проводили в программ-
PЕЗУЛЬТАТЫ И ОБCУЖДЕНИЕ
ных пакетах MS Office 2003 и Cary Eclipse.
Мини-плазминоген, использованный в дан-
Ферментативную активность мини-плазминоге-
ной работе в качестве исходного варианта для
на и его вариантов в отношении хромогенного
внесения мутаций, подробно описан ранее [8-
субстрата S-2251 определяли описанным ранее
10]. Он представляет собой укороченный вариант
методом [7].
(каталитический домен и один (пятый) крингл-
БИОФИЗИКА том 64
№ 3
2019
ИЗУЧЕНИЕ СТРУКТУРЫ ТРИПСИН-ПОДОБНЫХ СЕРИНОВЫХ ПРОТЕИНАЗ
441
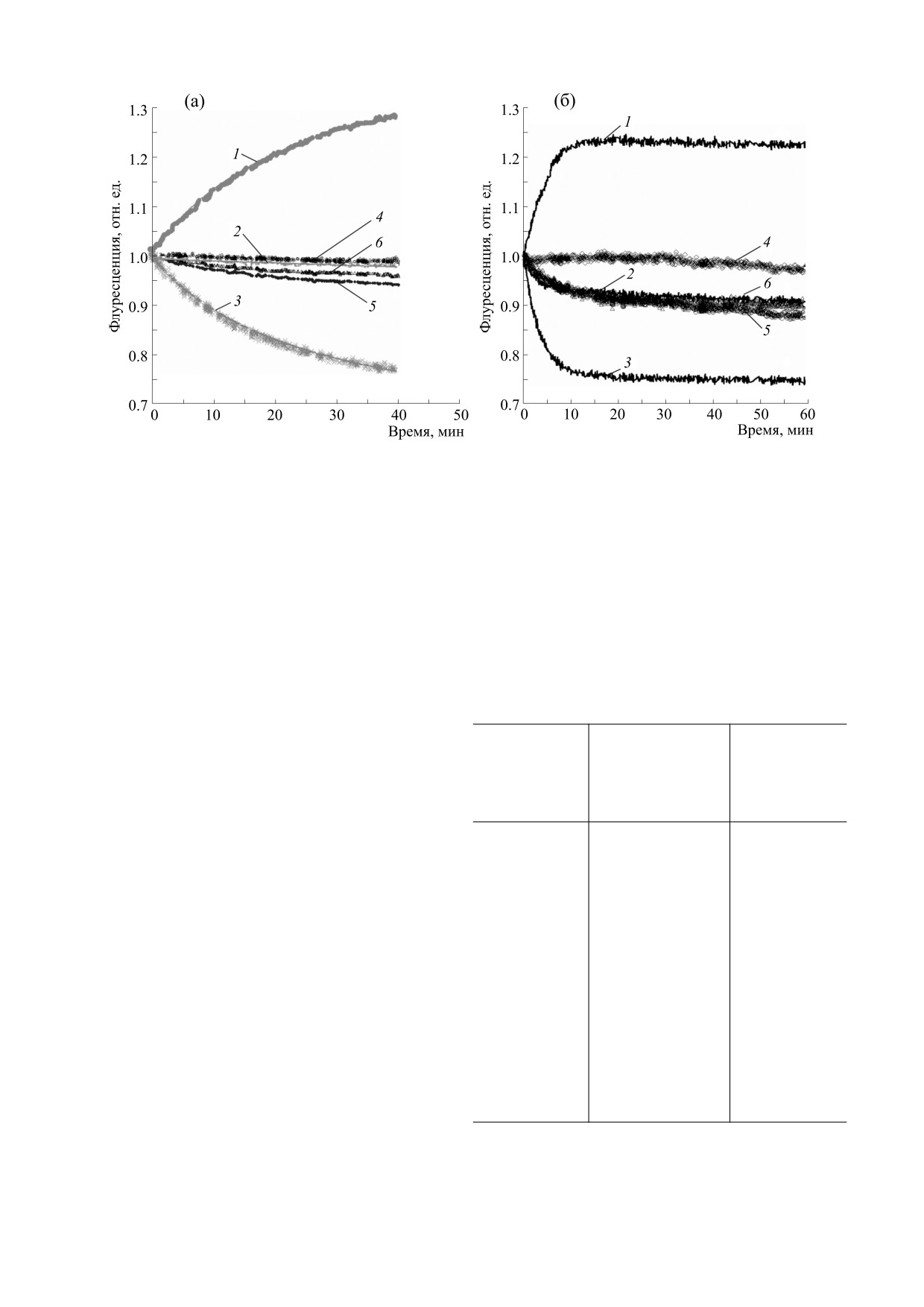
Рис. 3. Варианты мини-плазминогена. Замены аминокислотных остатков в исследованных вариантах мини-плазми-
ногена показаны в верхней части рисунка. Обозначения вариантов показаны слева (W141W215 (плазминоген) - исход-
ный вариант). В нижней части - выравнивание первичных структур фрагментов каталитического домена плазмино-
гена (P00747), трипсиногена (P07477), тромбина (P00734) и урокиназы (P00749) человека. Координаты аминокислот-
ных остатков приведены по химотрипсиновой номенклатуре (верхняя строка) и Glu-Plg (нижняя строка).
домен) природного плазминогена человека. Му-
другую аминокислоту (Ala, Tyr, Phe), наблюдает-
тации в кодирующую часть белка вносили с ис-
ся уменьшение интенсивности флуоресценции в
пользованием методов генетической инженерии.
коротковолновой (320 нм) и отсутствие измене-
Список проанализированных в настоящей работе
ний в длинноволновой области (360 нм) спектра
вариантов mPlg приведен на рис. 3.
(рис. 4в, 5б и 6).
Спектры флуоресценции вариантов mPlg с за-
Кинетические кривые для mPlg F141W215 мо-
менами Trp141 и Trp215 до и после активации
гут быть аппроксимированы экспонентой (или
приведены на рис. 4. Как видно из рисунка, акти-
гиперболой) с характерным временем t1/2 = 12 мин
вация вариантов с одиночными заменами сопро-
(рис. 5а, таблица). Активация вариантов с заме-
вождается покраснением максимума спектра, то-
ной триптофана в положении 215 происходит со
гда как при двойной замене изменения спектра
схожими характерными временами, при этом ки-
при активации mPlg не наблюдается. Следова-
нетические кривые совпадают для вариантов
тельно, оба триптофана (141 и 215) вносят вклад в
W141F215 и W141Y215, а при замене W141A215 на-
сдвиг спектра. Наиболее существенное влияние
блюдается более выраженный сдвиг флуоресцен-
на сдвиг оказывает изменение микроокружения
ции (рис. 6, таблица).
Тrp215 (ср. рис. 4б и 4в). Примечательно, что из-
Из анализа третичной структуры сериновых
менение интенсивности сигнала в максимуме
протеаз следует, что в состоянии активного фер-
флуоресценции при активации у вариантов mPlg
мента Trp215 тесно контактирует с аминокислот-
с одиночными заменами триптофанов имеет раз-
ным остатком, находящимся в положении 217
ный знак: флуоресценция активной формы вари-
(пример - на рис. 1). Нами проведен анализ вари-
анта с заменой Trp215 меньше, а Trp141 - больше,
антов mPlg с заменами лейцина (L) в этом поло-
чем у соответствующего зимогена.
жении на глутаминовую кислоту (E) или аргинин
На рис. 5 приведены кривые изменения ин-
(R). Выбор аминокислотных остатков для замены
тенсивностей флуоресценции при длинах волн
обусловлен тем, что глутаминовая кислота нахо-
320 и 360 нм, а также сдвигов (I360/I320) при акти-
дится в аналогичном положении у урокиназы, а
аргинин - у тромбина (см. рис. 3). Как и ожида-
вации зимогенов урокиназой. В процессе актива-
лось, изменение микроокружения W215 в актив-
ции урокиназой варианта mPlg с отсутствующим
ном ферменте (ср. рис. 1 и 2) привело к измене-
W141 интенсивность флуоресценции при длине
нию кинетических кривых (рис. 7).
волны 320 нм не изменяется, тогда как при 360 нм -
значительно возрастает (рис. 4б и 5а). При акти-
В нашей предыдущей работе были исследова-
вации вариантов mPlg с Trp215, замененным на ны зависимости спектров флуоресценции mPlg и
БИОФИЗИКА том 64
№ 3
2019
442
БЕЛЯНКО и др.
Рис. 4. Спектры флуоресценции вариантов mPlg до и после активации урокиназой: (а) - W141W215, (б) - F141W215,
(в) - W141Y215, (г) - F141F215; 1 - спектр до активации, 2 - спектр после активации.
mPln от температуры и pH [7]. Для всех проанали-
урокиназой. Из приведенных данных видно, что,
зированных в настоящей работе мутантов как
за исключением L217E, внесенные мутации при-
температурная, так и pH-зависимость не отлича-
водили к уменьшению активности. Примечатель-
лись от таковых для белка дикого типа как в со-
но, что при всей консервативности триптофана в
стоянии профермента, так и для активированно-
положении
215 у сериновых протеаз
[13,14]
го фермента (данные не приводятся).
(рис. 3) его замена приводит к значительному
снижению, но не к полной потере ферментатив-
Ферментативная активность. Амидолитиче-
ной активности mPln.
ские активности вариантов mPln представлены в
таблице. Следует подчеркнуть, что ни один из ис-
Интересно отметить, что для всех сериновых
следованных вариантов не обладал детектируе-
протеаз гемостаза, не требующих для проявления
мой ферментативной активностью до активации
ферментативной активности дополнительных
БИОФИЗИКА том 64
№ 3
2019
ИЗУЧЕНИЕ СТРУКТУРЫ ТРИПСИН-ПОДОБНЫХ СЕРИНОВЫХ ПРОТЕИНАЗ
443
Рис. 5. Кинетика изменения флуоресценции при активации урокиназой вариантов mPlg: (а) - варианты F141W215 (1 -
I360, 2 - I320, 3 - I320/I360) и F141F215 (4 - I360, 5 - I320, 6 - I320/I360); (б) - варианты W141W215 (1 - I360, 2 - I320, 3 -
I320/I360) и W141F215 (4 - I360, 5 - I320, 6 - I320/I360).
факторов, а также и для трипсина рассчитанная
Примечательно, что замена петли 170 у факто-
проекция вектора электрической индукции на
ра FVIIa на сокращенный по длине фрагмент
вектор, проведенный от центра бензольного
(аналогичный трипсиновому участку 170) делает
кольца к центру пирольного кольца индола
Trp215, имеет величину, близкую к описанной
для плазмина [7] (для расчета использованы
Амидолитическая активность вариантов мини-плаз-
структуры 1lmw (для tcuPA), 1rtf (tPA), 1bui (плаз-
мина
мин), 1eb1 (альфа тромбин), 4cr9 (фактор FXIa)).
Относительная
Это поле создается в основном отрицательно за-
Амидолитическая
скорость
ряженным аминокислотным остатком Asp102,
Вариант
активность
активации mPlg
локализованным вблизи пирольного кольца
tcu_PA
Trp215, и положительно заряженными аминокис-
лотными остатками петли 170-175 (или Arg217
W141W215
100%
100%
для tcuPA), расположенными вблизи бензольного
кольца индола Trp215 (см. рис. 1).
F141W215
40%
80%
Факторам свертывания крови FVIIa, FIXa и
FXa для перехода в активное состояние кроме
F14115F
10%
80%
расщепления пептидной связи между аминокис-
лотными остатками 15 и 16 требуется связывание
W141A215
14%
100%
с активаторными факторами TF (тканевый фак-
тор), FVIIIa и FVa соответственно[15]. Кофакто-
W141Y215
20%
100%
ры при связывании стабилизируют (делают менее
W141F215
9%
90%
подвижной) как позицию индольного кольца
Trp215, так и позицию петли 170-175. Петля 170-
217E
140%
100%
175 (подобно автолизной) часто оказывается
столь подвижной, что становится невидимой при
217R
40%
100%
рентгеноструктурном анализе [16,17].
БИОФИЗИКА том 64
№ 3
2019
444
БЕЛЯНКО и др.
активности фермента из-за дезориентации кар-
бонила пептидной связи между серином 214 и
аминокислотой 215. Поляризация индольного
кольца Trp215, вызванная полем положительно
заряженных аминокислот вблизи бензольного
кольца Trp215, по-видимому, не только играет
важную роль в спектре флуоресценции триптофа-
на, но и (из-за уменьшения парциального элек-
тронного заряда на пироле) усиливает способ-
ность протона при Nε1 пирола служить донором
при образовании водородной связи с ближайшим
карбоксилом (как в плазмине), карбонилом или с
молекулой воды, как описано в работах [19,20].
Расчеты структуры окружения аминокислоты
215, выходящие за пределы данной публикации,
показывают, что в плазминогене Trp215 может
быть заменен без существенной потери активно-
сти только на His.
Следует упомянуть, что мы не исследовали
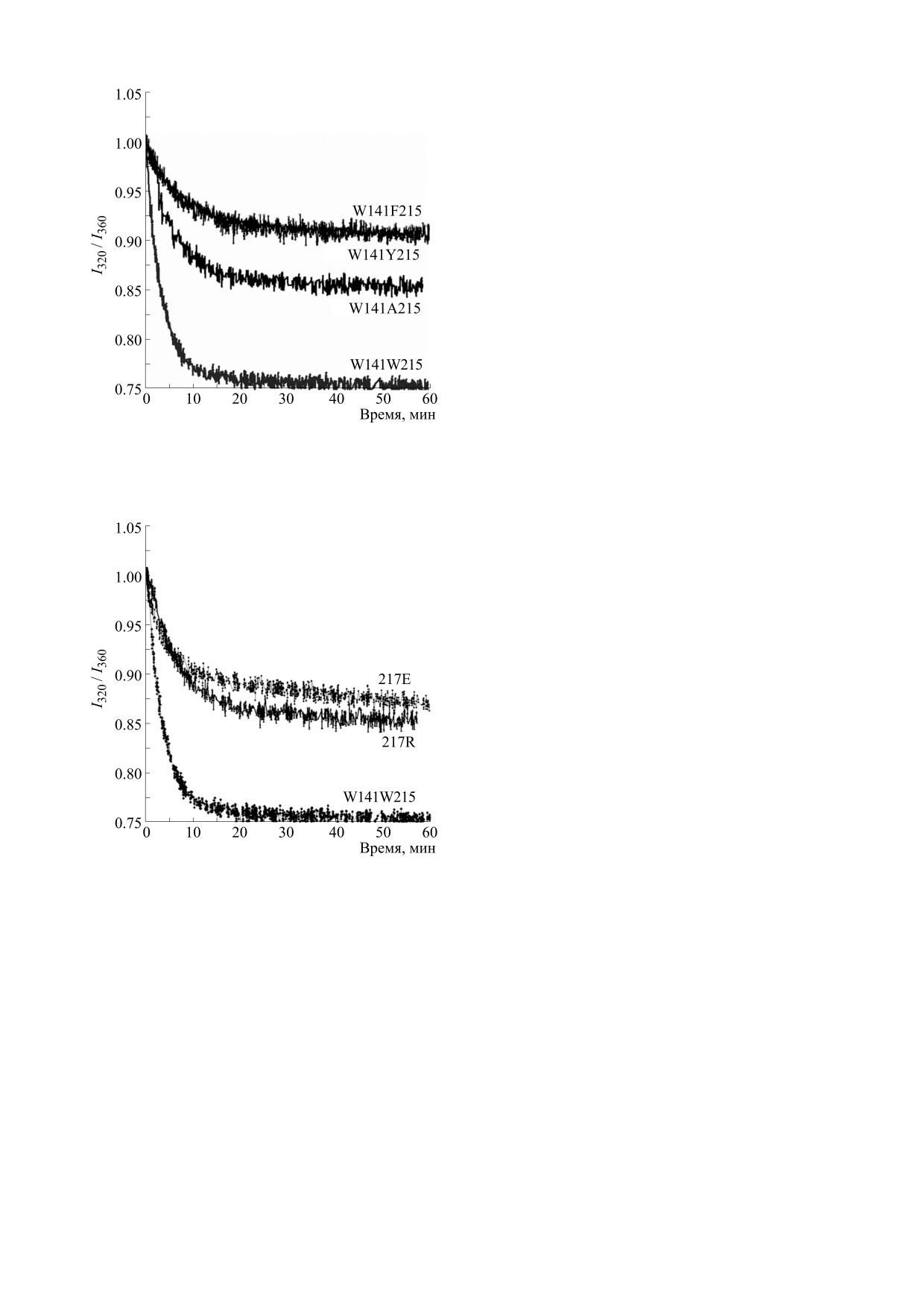
Рис. 6. Зависимость сдвига флуоресценции от време-
возможные изменения субстратной специфично-
ни при активации урокиназой вариантов mPlg с заме-
нами W215.
сти у мутантных вариантов mPln. В случае тром-
бина замена Trp215 на другую аминокислоту при-
водит к значительным изменениям скоростей
гидролиза для разных субстратов [21].
ВЫВОДЫ
В настоящей работе показано, что:
1. Изменение спектра флуоресценции при ак-
тивации плазминогена урокиназой вызвано из-
менением микроокружения Trp141 и Trp215.
2. Замены Trp141, Trp215 и Leu217 в mPlg не
влияют на скорость активации плазминогена
двухцепочечной урокиназой.
3. Замена консервативного у сериновых проте-
аз Trp в положении 215 не приводит к полному ис-
чезновению амидолитической активности.
СПИСОК ЛИТЕРАТУРЫ
1. Р. Б. Айсина и Л. И. Мухаметова, Биоорган. химия
40, 642 (2014).
Рис. 7. Зависимость сдвига флуоресценции от времени
2. J. C. Chapin and K. A. Hajjar, Blood Rev. 29, 17 (2015).
при активации урокиназой вариантов mPlg с заменами
3. D. A. Ayón-Núñez, G. Fragoso, R. J. Bobes, and
в положении 217 плазминогена. W141W215 - исходный
J. P. Laclette, Biosci. Rep. 38, BSR20180705 (2018).
вариант плазминогена (с Leu в положении 217).
4. Е. В. Кугаевская, Т. А. Гуреева, О. С. Тимошенко и
Н. И. Соловьева, Биомед. химия 64, 472 (2018).
5. E. I. Deryugina and J. P. Quigley, J. Biomed. Biotech-
активность FVIIa практически не зависящей от
nol. 2012, 564259 (2012).
связывания тканевого фактора [18].
6. C. Oh, J. Hoover-Plow, and E. F. Plow, J. Thromb.
Haemost. 1, 1683 (2003).
Нам представляется, что любое ослабление
7. Т. И. Белянко, Я. Г. Гурский, Н. И. Добрынина и
ван-дер-ваальсовых контактов индольного коль-
дp., Биофизика 63, 859 (2018).
ца Trp215 или замена самого триптофана (приво-
8. Р. Ш. Бибилашвили, А. А. Белогуров, Я. Г. Гур-
дящая к подвижности аминокислотного остатка
ский и дp., Патент на изобретение RUS 2432396
215) должны приводить к заметному снижению
24.11.2009 (2009).
БИОФИЗИКА том 64
№ 3
2019
ИЗУЧЕНИЕ СТРУКТУРЫ ТРИПСИН-ПОДОБНЫХ СЕРИНОВЫХ ПРОТЕИНАЗ
445
9.
Р. Ш. Бибилашвили, А. А. Белогуров, Я. Г. Гур-
15. H. H. Versteeg, J. W. M. Heemskerk, M. Levi, and
ский и дp., Патент на изобретение RUS 2432397
P. H. Reitsma, Physiol. Rev. 93, 327 (2013).
24.11.2009 (2009).
16. R. B. Peacock, J. R. Davis, P. R. L. Markwick, and
10.
Я. Г. Гурский, М. М. Минашкин, Е. С. Феоктисто-
E. A. Komives, Biochemistry 57, 2694 (2018).
ва и дp., Биотехнология 1, 25 (2010); Ya. G. Gurskii,
M. M. Minashkin, E. S. Feoktistova, et al., Appl. Bio-
17. J. J. Madsen, E. Persson, and O. H. Olsen, J. Thromb.
chem. Microbiol. 46, 776 (2010).
Haemost. 13, 262 (2015).
11.
А. Я. Шевелев, Т. Н. Баршевская, А. А. Белогуров
18. A. B. Sorensen, J. J. Madsen, L. A. Svensson, et al., J.
и дp., Молекуляр. биология 20, 778 (1986).
Biol. Chem. 291, 4671 (2016).
12.
E. A. Burstein, N. S. Vedenkina, and M. N. Ivkova,
19. L. J. Juszczak and A. S. Eisenberg, J. Am. Chem. Soc.
Photochem. Photobiol. 18, 263 (1973).
139, 8302 (2017).
13.
G. M. Yousef, M. B. Elliott, A. D. Kopolovic, et al.,
20. A. S. Eisenberg, M. Nathan, and L. J. Juszczak, J. Mol.
Biochim. Biophys. Acta - Proteins Proteomics 1698,
Struct. 1118, 56 (2016).
77 (2004).
14.
A. Jendroszek, J. B. Madsen, A. Chana-Muñoz, et al.,
21. D. Arosio, Y. M. Ayala, and E. Di Cera, Biochemistry
J. Biol. Chem. 294 (10), 3794 (2019).
39, 8095 (2000).
The Study of the Structure of Trypsin-Like Serine Proteases.
2. The Study of Tryptophan Fluorescence in Variants of Miniplasminogen
with the Altered Primary Structure
T.I. Belyanko, E.S. Feoktistova, N.A. Skrypina, A.V. Skamrov, Ya.G. Gurskii, N.M. Rutkevich,
N.I. Dobrynina, R.Sh. Bibilashvili, and L.P. Savochkina
Russian Cardiology Research and Production Complex, Ministry of Health of Russian Federation,
121552, Moscow, 3-ya Cherepkovskaya ul. 15a
Variants of miniplasminogen with altered primary structure were constructed to study previously described
changes in tryptophan fluorescence upon activation of plasminogen by urokinase. Miniplasminogens with
Trp141, Trp215 and Leu217 substitutions (amino acid residue position by Chymotrypsin numbering) were
tested. Activation of mutants with a single tryptophan substitution induced fluorescence spectrum change,
no changes in the fluorescence spectrum were observed in case of miniplasminogen with a double tryptophan
substitution. This indicates that both Trp141 and Trp215 contribute to the fluorescence spectrum shift. It has
been suggested earlier, that changes in the Trp215 microenvironment mostly cause a shift in the spectrum.
The amino acid substitutions, Trp141, Trp215 and Leu217, in miniplasminogen had no effect on the rate of
plasminogen activation by urokinase. It has been shown that the replacement of the conservative Trp215 in
serine proteases led to significant reduction but not losing the amidolytic activity of plasmin.
Keywords: plasminogen, tryptophan fluorescence, activation of enzyme, catalytic domain, relationship between
structure and enzymatic activity, mutations
БИОФИЗИКА том 64
№ 3
2019