БИОФИЗИКА, 2019, том 64, № 3, с. 468-477
БИОФИЗИКА КЛЕТКИ
УДК 577.3
МОНИТОРИНГ ФОТОСИНТЕТИЧЕСКОЙ АКТИВНОСТИ КУЛЬТУРЫ
МИКРОВОДОРОСЛЕЙ Chlorella ПРИ ИСТОЩЕНИИ АЗОТА В СРЕДЕ
© 2019 г. Т.Ю. Плюснина, С.С. Хрущев, А.Е. Фролов, Н.С. Дегтерева, И.В. Конюхов,
С.И. Погосян, Г.Ю. Ризниченко, А.Б. Рубин
Биологичеcкий факультет Моcковcкого гоcудаpcтвенного унивеpcитета имени М.В. Ломоноcова,
119991, Моcква, Ленинcкие гоpы, 1/12
E-mail: plusn@yandex.ru
Поступила в редакцию 22.03.2019 г.
После доработки 22.03.2019 г.
Принята к публикации 29.03.2019 г.
Представлены результаты мониторинга фотосинтетической активности культуры зеленой
микроводоросли Chlorella, культивируемой в фотобиореакторе в трех разных средах,
различающихся минеральным составом. Для проведения экспериментов был использован
термофильный штамм, характеризующийся быстрым ростом. В течение 40 ч роста культуры на
каждой среде с интервалом в один час регистрировались кривые индукции флуоресценции
хлорофилла и спектры поглощения суспензии микроводорослей. Для анализа 120 индукционных
кривых, полученных в результате мониторинга, был применен разработанный авторами метод
спектральной мультиэкспоненциальной аппроксимации. Была проанализирована динамика
постепенного изменения числа фаз индукционных кривых, их амплитуд и характерных времен в
процессе роста культуры. Связь параметров индукционных кривых с процессами переноса
электрона в реакционном центре фотосистемы II позволила дать интерпретацию изменения форм
индукционных кривых по мере истощения азота в среде в терминах процессов в реакционном
центре фотосистемы II. Продемонстрирована высокая чувствительность метода спектральной
мультиэкспоненциальной аппроксимации и удобство его применения для анализа большого числа
индукционных кривых при мониторинге роста культуры. Обсуждаются физиологические
процессы, сопровождающие наступление азотного голодания.
Ключевые слова: фотосинтез, культивирование в фотобиореакторе, истощение азота, анализ кривых
индукции флуоресценции, мультиэкспоненциальная аппроксимация.
DOI: 10.1134/S0006302919030062
Для оценки активности фотосинтетического
В настоящее время микроводоросли рассмат-
аппарата, в том числе при действии внешних фак-
риваются в качестве перспективного сырья для
торов, традиционно применяется анализ экспе-
производства биотоплива. При определенных
риментальных кривых индукции флуоресценции
условиях наступления экологического стресса, в
хлорофилла [5]. Кривая индукции флуоресцен-
частности при азотном голодании, многие мик-
ции, построенная в логарифмическом масштабе
роводоросли способны накапливать богатые
по времени, так называемая OKJIP-кривая, как
энергией соединения, такие как крахмал и/или
правило, включает несколько фаз [5]. Интенсив-
липиды, которые могут быть конвертированы в
ность флуоресценции изменяется от некоего ис-
биотопливо [1]. Так, в работе [2] было показано,
ходного уровня F0, точки О на кривой, до макси-
что в первый день роста культуры микроводорос-
мального уровня Fm (при насыщающей интен-
лей азотное голодание вызывает накопление
сивности света), точки P на кривой (см.,
крахмала, в последующие дни крахмал частично
например, рис. 1а). Появление отдельных фаз K,
разлагается и происходит накопление липидов.
J, I и P на кривой примерно соответствуют мо-
Механизмы регуляции метаболических путей, в
ментам времени 0 - 0,5 мс, 0,5 - 2,5 мс, 2,5- 20 мс
которых синтезируются эти органические макро-
и 20 - 300 мс [5] и отражают этапы переноса элек-
молекулы, тесно связаны с активностью фото-
трона в фотосистеме II. По характеру фаз кривой
синтетического аппарата клетки [3,4].
можно судить, насколько эффективен электрон-
Сокращение: СМЭА - спектральная мультиэкспоненци-
ный транспорт на начальных стадиях фотосинте-
альная аппроксимация.
за. Участок кривой ОJ принято называть «фото-
468
МОНИТОРИНГ ФОТОСИНТЕТИЧЕСКОЙ АКТИВНОСТИ
469
химической фазой» [6], которая отражает восста-
тестом на возникновение стрессовых условий
новление первичных акцепторов электрона -
[12,17,27,28].
феофитина и хинона QA. Участок кривой JIP
принято называть «тепловой фазой», он отражает
Авторами работы [5] был разработан метод
накопление вторичного хинона QВ, его амплиту-
анализа индукционных кривых, JIP-тест, позво-
да зависит от температуры [6].
ляющий оценивать эффективность электронного
транспорта на разных этапах переноса электрона
Одной из важнейших характеристик эффек-
в электронтранспортной цепи, используя пара-
тивности фотосинтетического аппарата является
метры индукционной кривой. Несмотря на ши-
квантовый выход первичных реакций фотосинте-
рокое использование JIP-теста, в том числе и для
за, вычисляемый через минимальное (F0) и мак-
мониторинга минерального голодания [11], опре-
симальное (Fm) значения индукционной кривой с
деление параметров индукционной кривой огра-
помощью выражения Fv/Fm = (Fm-F0)/Fm [7,8]. В
ничено как возможностями временного разреше-
условиях дефицита тех или иных биогенных эле-
ния измерительных приборов, так и самим под-
ментов, в частности азота, происходит ряд изме-
ходом, основанным на характеристике фаз
нений фотосинтетического аппарата, отражаю-
индукционной кривой, привязанных к исходно
щихся в снижении относительной переменной
заданным моментам времени.
флуоресценции Fv/Fm [9], что может быть обу-
словлено повышением значения F0 зa счет нару-
Математические методы анализа индукцион-
шений в работе реакционных центров, в частно-
ных кривых позволяют более точно выявлять их
сти, в связи с торможением синтеза белка D1 [10]
особенности. Разработанный нами метод спек-
и уменьшением эффективности тушения энергии
тральной мультиэкспоненциальной аппроксима-
возбуждения в антенне. Изменение параметров
ции (СМЭА) кривой индукции флуоресценции
индукционных кривых тесно коррелирует с фи-
[29] позволяет анализировать динамику фаз - из-
зиологическими процессами клетки. Так, автора-
менение характерных времен и амплитуд одно-
ми работы [11] при исследовании действия азот-
временно десятков и сотен индукционных кри-
ного голодания на клетки водоросли Chlorella бы-
вых, что делает его удобным при мониторинге ро-
ла продемонстрирована связь параметров индук-
ста культуры клеток в фотобиореакторе, когда
ционной кривой с накоплением липидов и каро-
кривые снимаются через относительно короткие
тиноидов, являющихся целевыми продуктами во
интервалы времени и составляют в конечном
многих биотехнологических процессах.
итоге довольно большой массив данных. Исполь-
При нагревании образцов растительных кле-
зование метода СМЭА позволяет детектировать
ток на индукционных кривых появляется допол-
появление визуально неразличимых фаз индук-
нительная фаза (так называемая К-фаза), кото-
ционных кривых, соответствующих увеличению
рую принято связывать с деактивацией кислоро-
вклада процессов с соответствующим этой фазе
двыделяющего комплекса [12-16]. Появление К-
характерным временем. Использование нами ме-
фазы отображается на индукционных кривых в
тода СМЭА позволило проследить динамику фаз
виде спада и, как следствие, появления локально-
индукционных кривых, полученных на культуре
го максимума на индукционной кривой на време-
водорослей Chlamydomonas reinhardtii, голодаю-
нах ~ 300 мкс. Наблюдаемое тушение индукции
щей по сере. В настоящей работе была поставлена
флуоресценции связывают с накоплением окис-
задача проанализировать динамику изменений
ленных форм пигмента реакционного центра
фотосинтетического аппарата клеток микроводо-
P680+ и остатка тирозина TyrZ+ - промежуточно-
рослей Chlorella при истощении азота в среде пу-
го переносчика электрона от кислородвыделяю-
тем анализа кривых индукции флуоресценции,
щего комплекса, - являющихся тушителями флу-
регистрируемых ежечасно в процессе роста куль-
оресценции и накапливающихся в результате за-
туры в фотобиореакторе. Были использованы три
труднения переноса на них электронов от
среды, различающиеся по составу элементов: в
кислородвыделяющего комплекса при деактива-
первом и третьем вариантах среды - одинаковое
ции последнего [17,18]. В работах [19-21] было
содержание азота, но разное содержание других
показано, что К-фаза также может появиться на
элементов, во втором и третьем вариантах - оди-
индукционной кривой и в условиях минерально-
наковое содержание всех элементов, кроме азота.
го голодания. Аналогичным образом К-фаза по-
В задачу работы, таким образом, входил анализ
является и при выращивании культуры в услови-
различий в динамике фаз индукционных кривых
ях недостатка влаги [22,23] и в условиях повы-
в процессе роста культуры клеток микроводорос-
шенной концентрации cолей
[24-26]. Рядом
ли Chlorella на трех разных средах и максимально
авторов предлагается считать появление K-фазы
раннее детектирование начала изменения фаз ин-
БИОФИЗИКА том 64
№ 3
2019
470
ПЛЮСНИНА и др.
дукционной кривой, отражающих ответ фотоси-
рослей были определены спектры поглощения
стемы II на постепенное истощение азота в среде.
суспензии клеток и измерены кривые индукции
флуоресценции хлорофилла. Все измерения про-
водились с частотой один раз в час при помощи
МАТЕРИАЛЫ И МЕТОДЫ
автоматизированного приборного комплекса, со-
Выращивание культуры микроводорослей Chlo-
стоящего из модуля отбора проб, оптического мо-
rella. Для проведения экспериментов был исполь-
дуля (флуориметр + спектрофотометр) и персо-
зован термофильный штамм зеленой однокле-
нального компьютера. В одном цикле измерений
точной водоросли Chlorella vulgaris Beijerink, ха-
с помощью устройства отбора проба жидкости из
рактеризующийся быстрым ростом
- время
фотобиореактора подается в проточную кювету
удвоения количества клеток может составлять 3-
оптического модуля, подача пробы на время из-
5 ч в зависимости от условий выращивания. Экс-
мерений останавливается, далее проба возвраща-
перименты по выращиванию микроводорослей
ется обратно в фотобиореактор и осуществляется
были проведены в панельном фотобиореакторе
промывка транспортных трубок и фотометриче-
объемом 1 л, построенном на кафедре биофизики
ской кюветы чистой водой.
МГУ [30]. Маточную культуру выращивали на
Спектрофотометр и флуориметр имеют об-
минеральной среде Тамия [31] при 36°С, затем
щую проточную кювету с длиной оптического пу-
помещали ее в фотобиореактор. Начальная опти-
ти 2 мм. Возбуждение флуоресценции осуществ-
ческая плотность культуры внутри фотобиореак-
ляли в области 455 нм (3000 мкЭ м-2 с-1), реги-
тора составляла 0,01 на 1 см (при длине волны
страцию - в области 670-750 нм (кремниевый
675 нм). Фотобиореактор освещали непрерывно
фотодиод, светофильтры ПС-8 и КС-17). При за-
светодиодной панелью (цветовая серия светодио-
писи индукционной кривой сигнал флуоресцен-
дов «warm white»), интенсивность 180 мкЭ м-2 с-1.
ции оцифровывали с интервалом 5 мкс. Продол-
Температуру внутри фотобиореактора поддержи-
жительность адаптации проб к темноте составля-
вали на уровне 36,0 ± 0,5°С. Фотобиореактор бар-
ла 3 мин.
ботировали СО2-обогащенной воздушной сме-
Для измерения спектров поглощения суспен-
сью (0,4% СО2), распыляемой у дна сосуда. Объ-
зии использовали спектрометр USB2000+ (Ocean
емная скорость подачи воздуха составляла
Optics, США) с галогеновой лампой в качестве
1 л мин-1.
источника света. Содержание хлорофилла оцени-
Для выращивания культуры использовали три
вали по оптической плотности с поправкой на
варианта среды. Первый вариант - среда Тамия с
светорассеяние как разность оптической плотно-
разведением 1/20 (будем называть ее богатой сре-
сти, измеренной на длинах волн 675 нм и 725 нм
дой и обозначать T/20). Второй вариант - среда
(A675 - A725) в спектрах поглощения. Содержание
Тамия с разведением 1/30 (будем называть ее бед-
каротиноидов оценивалось аналогично как раз-
ной средой и обозначать T/30). В третьем вариан-
ность оптической плотности, измеренной на дли-
те среды содержалось такое же количество азота,
нах волн 470 нм и 550 нм (A470 - A550).
как и в бедной среде, при этом остальных компо-
нентов минеральной среды было столько же,
Метод спектральной мультиэкспоненциальной
аппроксимации кривых индукции флуоресценции.
сколько в богатой среде (будем называть эту среду
Для анализа индукционных кривых, полученных
бедной по азоту и обозначать N/30). Таким обра-
в процессе роста культуры Chlorella в фотобиоре-
зом, среды Т/30 и N/30 содержали одинаковое
акторе, был использован разработанный нами
количество азота и разное количество всех других
метод СМЭА [29]. Кинетика индукции флуорес-
элементов, а среды N/30 и T/20, наоборот, содер-
ценции аппроксимируется в нем мультиэкспо-
жали одинаковое количество всех элементов,
ненциальным рядом:
кроме азота.
Разведение среды 1/30 было подобрано таким
,
(1)
образом, чтобы к окончанию эксперимента опти-
ческая плотность культуры в синей области спек-
где Fo - минимальное значение на кривой индук-
тра (455 нм) не превышала 0,5 см-1, когда можно
ции флуоресценции F(t), An отражает вклад n-й экс-
пренебречь эффектом экранирования возбужда-
поненты с характерным временем τn в общий сиг-
ющего света в проточной кювете флуориметра и
нал, t - время. Характерные времена τn экспонен-
его влиянием на продолжительность фотохими-
циальных функций An(1 - e-t/τn) в уравнении (1)
ческой фазы кривой индукции флуоресценции.
задаются следующим образом: выбирается началь-
Измерение спектров поглощения и флуоресцен-
ное время τ1, соответствующее, как правило, первой
ции хлорофилла. В процессе роста культуры водо-
точке на экспериментальной кривой. Далее на лога-
БИОФИЗИКА том 64
№ 3
2019
МОНИТОРИНГ ФОТОСИНТЕТИЧЕСКОЙ АКТИВНОСТИ
471
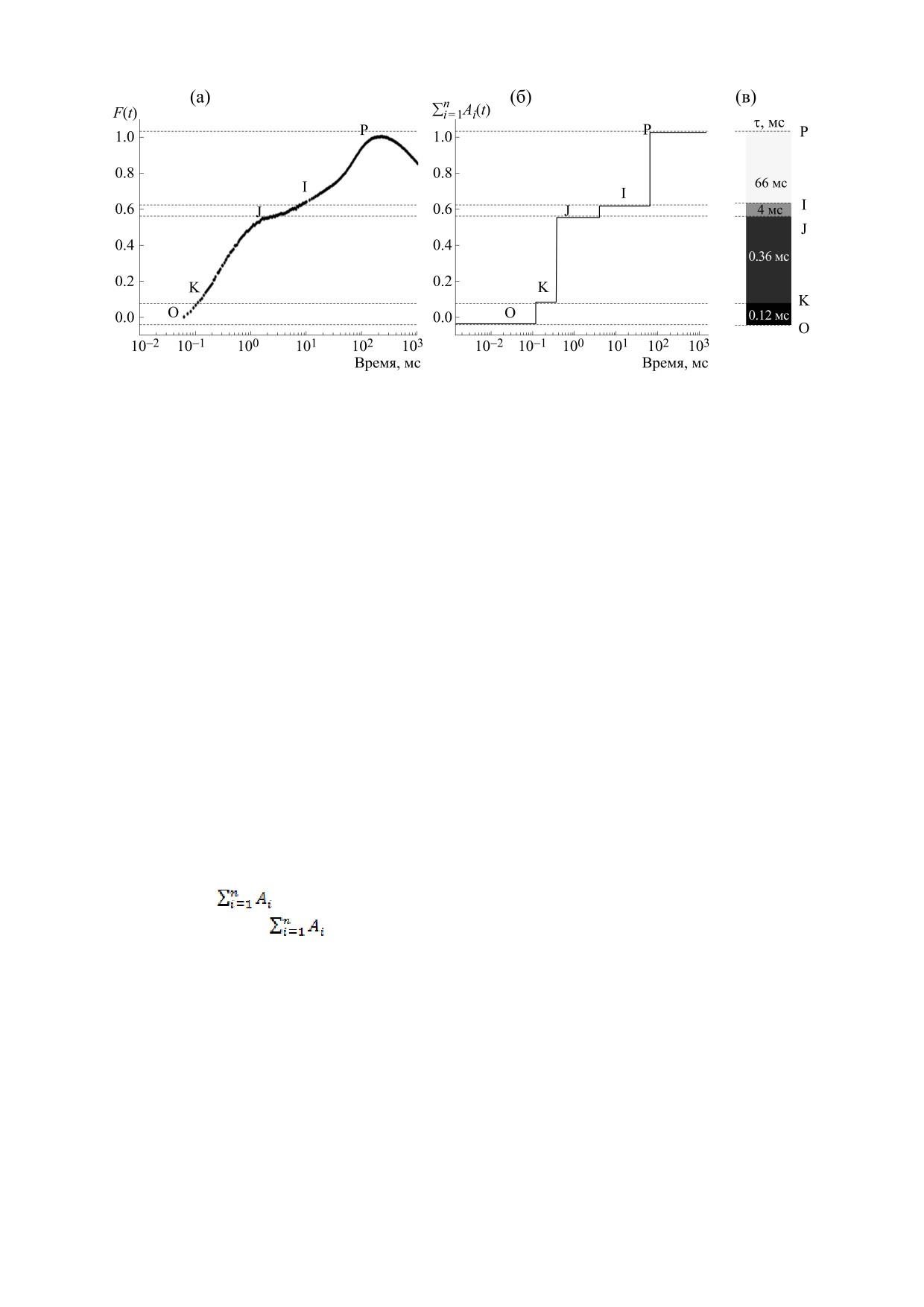
Рис. 1. Иллюстрация метода мультиэкспоненциальной аппроксимации применительно к типичной индукционной
кривой. (а) - Индукционная кривая для микроводоросли Chlorella, полученная на 33-м часу роста культуры (богатая
среда Т/20). (б) - Ступенчатая функция, полученная вычислением на каждом шаге сетки частичных сумм амплитуд
(преобразование методом мультиэкспоненциальной аппроксимации). (в) - Визуализация фаз с помощью цвета. Из-
менение интенсивности цвета от черного к белому соответствует изменению характерного времени от 1 мкс до 1 с.
Цвет полосы определяет характерное время соответствующей фазы, высота полосы - ее амплитуду.
рифмической шкале времени задается шаг kstep,
ризует относительный вклад этого процесса в ин-
последующие точки рассчитываются как τn+1 =
дукционную кривую. Таким образом, описывае-
kstepτn, последняя точка соответствует времени, на
мый метод выделяет группы процессов с разными
котором достигается максимум эксперименталь-
характерными временами и соответствующие фа-
ной кривой. Таким образом, получается ряд, содер-
зы на индукционной кривой, не всегда различае-
жащий до нескольких сотен экспоненциальных
мые визуально. На примере, приведенном на
функций An(1 - e-t/τn) с заданными временами τn,
рис. 1, видно, что на исходной индукционной
амплитуды An которого оцениваются по методу
кривой F(t) визуально выделяются только две фа-
наименьших квадратов.
зы - OJ и JP (рис. 1а), а после описанного выше
Результат аппроксимации экспериментальной
преобразования становятся хорошо различимы-
кривой (рис. 1a) уравнением (1) представляет со-
ми также фазы OK и JI, то есть, благодаря высо-
бой набор амплитуд An, соответствующих каждая
кой чувствительности метода, на кривой можно
своему значению времени τn, выбранному на ло-
выделить четыре фазы и соответственно четыре
группы процессов со своими характерными вре-
гарифмической сетке. Для визуализации этого
менами.
набора на каждом шаге по времени τn все полу-
ченные амплитуды An, соответствующие харак-
Для визуализации результатов анализа боль-
терным временам τi < τn, суммируются: в точке τ1
шого числа индукционных кривых мы использо-
откладывается амплитуда A1, в точке τ2 - (A1 + A2)
вали представление полученных ступенчатых
функций в виде тепловой карты. Спектр харак-
и т.д., в точке τn -
, в результате получает-
терных времен от 1 мкс до 1 с соответствует цве-
ся ступенчатая функция
(t) (рис. 1б). Та-
товой шкале от черного к белому. Ступенчатая
ким образом, на всем временном интервале выде-
функция (рис. 1б) преобразуется в разделенную
ляются группы ненулевых амплитуд, число таких
на несколько частей вертикальную полосу. Цвета
групп (число «ступенек») определяет минималь-
частей соответствуют характерным временам вы-
ное число экспоненциальных функций, на кото-
деленных фаз, а высота - амплитудам этих фаз
рые может быть разложена исходная кривая.
(рис. 1в). Объединение таких полос, полученных
Каждая «ступенька» и соответствующая ей экспо-
при обработке большого количества данных, в
нента выделяют, таким образом, процесс или
тепловую карту дает визуальное представление о
группу процессов с определенным характерным
динамике изменения характерных времен фаз на
временем. Высота «ступеньки» определяет ам-
индукционной кривой в процессе роста культуры
плитуду соответствующей экспоненты и характе-
(см. рис. 3 в разделе «Результаты»).
БИОФИЗИКА том 64
№ 3
2019
472
ПЛЮСНИНА и др.
Рис. 2. Изменение спектральных характеристик и параметров индукционной кривой в процессе роста культуры для
следующих сред: T/20 - богатая среда, T/30 - бедная среда, N/30 - среда, бедная по азоту. (а) - Изменение количества
хлорофилла (разность оптической плотности A675 - A725); (б) - изменение Fv/Fm; (в) - изменение соотношения каро-
тиноидов к хлорофиллу (A470 - A550)/(A675 - A725); (г) - изменение Fo и Fm, нормированных на хлорофилл.
Предложенный метод анализа данных индук-
клеток в накопительной культуре, является исто-
ции флуоресценции реализован в виде пакета
щение азота. Для проверки этой гипотезы росто-
программ pyPhotoSyn [29], который позволяет
вые эксперименты были проведены на средах
проводить одновременный анализ нескольких
разного минерального состава: Т/30 (бедная сре-
сотен индукционных кривых.
да), N/30 (бедная по азоту среда), T/20 (богатая
среда) (см. раздел «Методы»).
РЕЗУЛЬТАТЫ
Анализ спектров поглощения на каждом часу
роста культуры позволил получить кривые изме-
Для изучения изменений фотосинтетического
аппарата, в частности работы фотосистемы II, в
нения количества хлорофилла и каротиноидов в
растущих клетках микроводорослей при есте-
течение роста культуры для всех трех случаев, а
ственном истощении среды (выедании ее клетка-
также изменения соотношения этих пигментов в
ми микроводорослей) была проведена серия экс-
процессе роста (рис. 2а,в). Параллельно были по-
периментов, в которых осуществляли монито-
лучены зависимости от времени роста основных
ринг изменения кривых индукции флуорес-
характеристик индукционных кривых: мини-
ценции и спектров поглощения в клетках Сhlorel-
мального и максимального значений - Fo и Fm,
la. Исходя из предварительных данных экспери-
нормированных на содержание хлорофилла
ментов с растущей культурой, мы предположили,
(рис. 2г), и квантового выхода первичных реак-
что основным фактором, лимитирующим рост
ций переноса электронов Fv/Fm (рис. 2б). На всех
БИОФИЗИКА том 64
№ 3
2019
МОНИТОРИНГ ФОТОСИНТЕТИЧЕСКОЙ АКТИВНОСТИ
473
Рис. 3. Тепловые карты динамики изменения компонентного состава OKJIP-кривых в течение 40 ч роста культуры на
бедной среде Т/30 (а), на бедной по азоту среде N/30 (б), на богатой среде Т/20 (в). Характерные времена K-фазы -
200-500 мкс, J-фазы - 1,5-3,0 мс, I-фазы - 30-40 мс, P-фазы - 70-100 мс.
типах кривых, за исключением Fv/Fm, можно вы-
ют возрастать, при этом Fo/Хл растет быстрее
делить точки перегиба, соответствующие момен-
(рис. 2г), что приводит к падению Fv/Fm (рис. 2б).
ту времени, после которого явно меняется харак-
Максимальное количество хлорофилла в богатой
тер наклона кривых: для бедной среды T/30 -
среде T/20 превышает примерно в полтора раза
26 ч, для бедной по азоту среды N/30 - 23 ч, для
максимальное количество хлорофилла на средах
богатой среды T/20 - 28 ч. На начальном этапе
T/30 и N/30, которое для этих сред оказалось оди-
наковым. Сравнение кривых накопления хлоро-
роста культуры, до точки перегиба, наблюдается
филла для трех сред (рис. 2а) позволяет предполо-
линейный рост количества хлорофилла (рис. 2а),
жить, что фактором, лимитирующим рост культу-
при этом рост происходит быстрее (наклон кри-
ры микроводорослей Chlorella, является именно
вых круче) в богатой среде T/20 и бедной только
содержание азота в среде. Точки перегиба на ро-
по азоту среде N/30. Соотношение каротиноидов
стовых кривых соответствуют моменту, когда ис-
и хлорофилла в этот период не меняется (рис. 2в).
черпывается весь азот в среде.
Значения Fo/Хл также остаются постоянными
Далее методом СМЭА были обработаны три
(рис. 2г, кривые в нижней части рисунка). Значе-
семейства кривых индукции флуоресценции хло-
ния Fm/Хл (рис. 2г, кривые в верхней части ри-
рофилла, измеряемых каждый час в ходе роста
сунка) и соответственно Fv/Fm незначительно па-
микроводорослей Chlorella в фотобиореакторе,
дают. После точки перегиба происходит довольно
каждое семейство кривых соответствовало трем
резкое замедление роста содержания хлорофилла
использованным средам. На тепловых картах
(рис. 2а), при этом начинает меняться соотноше-
(рис. 3), полученных в результате преобразования
ние пигментов - количество каротиноидов по от-
индукционных кривых, четко видны четыре
ношению к хлорофиллу начинает увеличиваться
фазы - K, J, I, P, обозначенные в соответствии с
(рис. 2в). Значения Fo/Хл и Fm/Хл также начина-
фазами индукционной кривой.
БИОФИЗИКА том 64
№ 3
2019
474
ПЛЮСНИНА и др.
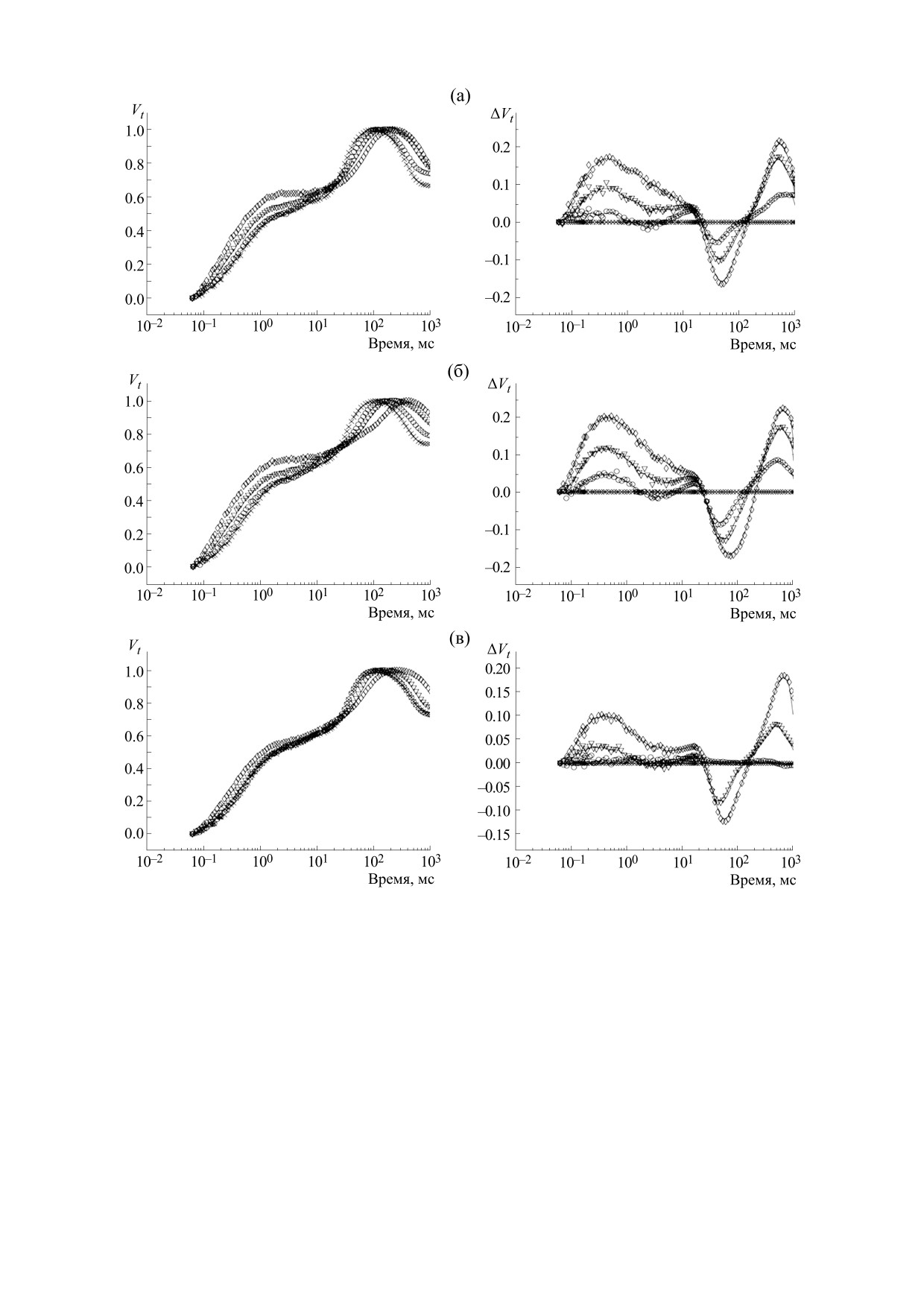
Рис. 4. Нормированные на Fv кривые индукции флуоресценции - Vt (справа) и разностные кривые ΔVt (слева): кре-
стики - 23-й час роста, кружки - 30-й час роста, треугольники - 35-й час роста, ромбы - 40-й час роста. (а) - Кривые
для бедной среды T/30; (б) - кривые для бедной по азоту среды N/30; (в) - кривые для богатой среды T/20.
В первые сутки роста все индукционные
для бедной среды T/30 и 30-й час для богатой
кривые имеют только две фазы - J и P. Затем на
среды T/20.
индукционных кривых начинает появляться
Далее в процессе роста на индукционных
фаза I, время ее появления коррелирует с точкой
кривых появляется K-фаза: на
29-м часу
перегиба на ростовых кривых (рис. 2а): 24-й час
для бедной и бедной по азоту сред T/30, N/30, на
роста для бедной по азоту среды N/30, 27-й час
34-м часу - для богатой среды T/20. Характерные
БИОФИЗИКА том 64
№ 3
2019
МОНИТОРИНГ ФОТОСИНТЕТИЧЕСКОЙ АКТИВНОСТИ
475
времена фаз K и J на индукционных кривых для
ности фотосинтетического аппарата (рис. 2б).
всех трех сред в ходе роста культуры
Наблюдаемое увеличение относительной доли
укорачиваются (фазы K и J на тепловых картах на
каротиноидов (рис. 2в) объясняется тем, что при
недостатке азота в среде скорость синтез хлоро-
рис. 3 становятся темнее), тогда как характерные
филла снижается быстрее, чем скорость синтеза
времена фаз I и P, наоборот, удлиняются (фазы I
каротиноидов. Рост значений Fo/Хл и Fm/Хл (рис.
и P на тепловых картах на рис. 3 становятся
2г) после точки перегиба может быть связан с на-
светлее).
коплением поврежденных форм реакционных
В ряде работ [17,19] для выявления К-фазы на
центров, дающих дополнительный вклад в ин-
индукционной кривой используются разностные
дукцию флуоресценции. Однако скорость роста
кривые, получаемые вычитанием одних
Fo/Хл выше, чем скорость увеличения Fm/Хл, что
может объясняться частичным восстановлением
индукционных кривых из других, при этом
реакционных центров в темноте за счет усиления
кривые обычно нормируются на Fv = Fm-Fo.
так называемого хлородыхания, при котором
Разностные кривые используются в тех случаях,
происходит перенос электронов на пул пластохи-
когда на исходных кривых К-фаза визуально
нона от молекул NADH, накапливающихся в
не выделяется. Мы провели аналогичный
процессе гликолиза. Известно, что в условиях
анализ, построив нормированные на Fv кривые,
серного голодания инактивация фотосистемы II
полученные на 23-м, 30-м, 35-м и 40-м часу роста
и параллельное накопление крахмала приводят к
культуры (рис. 4, слева), и разности между этими
усилению хлородыхания, что вызывает увеличе-
кривыми и выбранной кривой, соответствующей
ние степени восстановленности пула пластохи-
23-му часу (рис. 4, справа). Характерное время
нона [32-34]. Активация хлородыхания при ис-
первого максимума на разностных кривых, соот-
тощении азота в среде также весьма вероятна, по-
скольку в условиях азотного голодания, как и в
ветствующего К-фазе, находится примерно на
условиях серного голодания, происходит накоп-
450 мкс, что согласуется с характерным временем
ление крахмала [34,35], далее - активация глико-
К-фазы, определенным по тепловым картам
лиза, накопление NADH и последующий перенос
(рис. 3). Видно, что для бедной среды T/30 и бед-
электронов в пул пластохинона, что и приводит к
ной по азоту среды N/30 на 30-м часу роста этот
возрастанию Fo.
максимум на разностных кривых уже хорошо вы-
Разработанный нами метод спектральной
ражен (рис. 4а,б), тогда как для богатой среды
мультиэкспоненциальной аппроксимации кри-
T/20 (рис. 4в) на 30-м часу его еще нет, что указы-
вой индукции флуоресценции [29] позволил про-
вает на более позднее начало деградации кисло-
анализировать динамику фаз индукционной кри-
родвыделяющего комплекса.
вой в процессе роста культуры, проследить изме-
Результаты анализа индукционных кривых
нение количества фаз, их амплитуд и
характерных времен.
обоими методами - спектральной мультиэкспо-
ненциальной аппроксимации и с помощью раз-
Анализ индукционных кривых показал, что в
ностных кривых - согласуются друг с другом и
процессе роста культуры наблюдается уменьше-
выявляют дополнительные, визуально неразли-
ние характерного времени J-фазы (рис. 3), что,
как правило, связывают с увеличением эффек-
чимые фазы на индукционных кривых.
тивного сечения антенны реакционных центров
фотосистемы II. В связи с нарушением синтеза
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
белка и хлорофилла в результате истощения азота
в среде происходит инактивация части реакцион-
Проведенный анализ кривых индукции флуо-
ных центров, однако за счeт наличия общей для
ресценции, полученных в процессе роста культу-
нескольких реакционных центров антенны мо-
ры микроводорослей Chlorella в фотобиореакторе
жет происходить увеличение потока энергии на
на средах с различным содержанием микроэле-
оставшиеся активные реакционные центры фо-
ментов, показал, что индукционные кривые мо-
тосистемы II, что и объясняет увеличение эффек-
гут служить довольно чувствительным маркером
тивного сечения антенны.
процессов в фотосинтетическом аппарате, разви-
Анализ индукционных кривых (рис. 3) в срав-
вающихся по мере истощения элементов среды.
нении с кривыми изменения содержания хлоро-
Сравнение содержания хлорофилла в клетках,
филла (рис. 2а) показывает, что точка перегиба на
растущих на разных по элементному составу сре-
кривых роста хлорофилла совпадает по времени с
дах, показывает, что для микроводорослей Chlo-
rella именно нехватка азота является фактором,
моментом появления I-фазы. Данная фаза у кле-
определяющим начало голодания, которое со-
ток, выращенных на бедной среде, появляется
провождается замедлением роста количества хло-
раньше (27-й час), чем у клеток, выращенных на
рофилла (рис. 2а), увеличением относительной
богатой среде (29-й час). Поскольку содержание
доли каротиноидов (рис. 2в), снижением актив-
хлорофилла перестает увеличиваться, можно
БИОФИЗИКА том 64
№ 3
2019
476
ПЛЮСНИНА и др.
предположить, что к этому моменту азот в среде
онной кривой. Начало увеличения величины
исчерпан. На связь дефицита азота в среде и по-
Fо/Хл связано с полным истощением азота в сре-
явления I-фазы на индукционной кривой указы-
де. При этом показатель активности фотосисте-
вали авторы работы [11]. Считается, что I-фаза
мы II Fv/Fm к этому моменту почти не меняется,
индукционной кривой связана с восстановлени-
клетка все еще «чувствует себя хорошо» - на дан-
ем пула подвижного пластохинона PQH2 [19].
ном этапе стресс еще не приводит к заметному
Можно предположить, что на начальных стадиях
нарушению первичных процессов фотосинтеза
роста культуры пул пластохинонов после темно-
(но проявляется в других аспектах клеточного
вой адаптации находится преимущественно в
метаболизма) за счет накопленного внутрикле-
окисленном состоянии. При освещении степень
точного азота. В процессе дальнейшего роста воз-
восстановленности пула начинает увеличиваться,
никает дефицит азота уже в самой клетке, что
так как поток электронов в пул от фотосистемы II
приводит к началу инактивации кислородвыде-
превышает поток электронов из пула к фотоси-
ляющего комплекса и, как следствие, появлению
стеме I через цитохромный комплекс. Активация
К-фазы на индукционной кривой. Дальнейшая
темновых стадий фотосинтеза, принимающих
деградация кислородвыделяющего комплекса со-
электроны на акцепторной стороне фотосистемы
провождается снижением Fv/Fm, указывающим
I, снова приводит к уменьшению восстановлен-
на общее снижение фотосинтетической активно-
ности пула хинонов, причем это реокисление
сти. При этом происходит постепенное уменьше-
происходит достаточно быстро, чтобы не препят-
ние I-фазы, что может объясняться уменьшением
ствовать потоку электронов от фотосистемы II, и
потока электронов от фотосистемы II и, как след-
I-фаза на кривой индукции флуоресценции не
ствие, уменьшением восстановленности пула
проявляется. Появление I-фазы на начальном
пластохинона.
этапе голодания можно связать с увеличением
Несмотря на то что однозначную трактовку из-
восстановленности пула пластохинона в темноте,
менения фаз индукционной кривой под действи-
что может быть обусловлено усилением хлороды-
ем различных факторов стресса, в частности азот-
хания и коррелирует с описанным увеличением
ного голодания, на данном этапе исследований
Fo (рис. 2г).
провести затруднительно, возможность анализи-
ровать большой массив индукционных кривых
Изменения электронного транспорта на до-
методом СМЭА открывает перспективу для даль-
норной стороне фотосистемы II принято связы-
нейшего изучения динамики переходных процес-
вать с К-фазой [12,17,27,28,36]. Как указывалось
сов при минеральном голодании и действии дру-
выше, появление К-фазы (рис. 3 и 4) и увеличе-
гих факторов стресса. Параллельные дополни-
ние ее амплитуды может быть вызвано деактива-
тельные измерения состава среды и клеточных
цией кислородвыделяющего комплекса. Это со-
компонентов, например крахмала, липидов, ка-
ответствует экспериментальным данным [36] и
ротиноидов, позволили бы с большей определен-
предположениям, сделанным в этой же работе о
ностью соотносить фазы индукционных кривых с
том, что рост амплитуды данной фазы связан с
физиологическими процессами клетки и исполь-
уменьшением запаса нитратов в среде. Сравнение
зовать эту информацию в дальнейшем для прове-
динамики фаз индукционных кривых (рис. 3) с
дения экспресс-анализа изменения состояния
изменением квантового выхода Fv/Fm (рис. 2б)
клетки под действием стресса.
показало, что начало уменьшения квантового вы-
хода первичных процессов фотосинтеза коррели-
рует с появлением К-фазы. Дальнейшее увеличе-
СПИСОК ЛИТЕРАТУРЫ
ние амплитуды К-фазы происходит одновремен-
1. J. Pruvost, G. Van Vooren, Le Gouic, et al., Biore-
но с уменьшением квантового выхода первичных
source Technol. 102, 150 (2011).
процессов фотосинтеза.
2. S. Zhu, W. Huang, J. Xu, et al., Bioresource Technol.
Обобщая вышесказанное, можно предложить
152, 292 (2014).
следующую последовательность событий в про-
3. Y. Kuei-Ling, Jo-Shu Chang, Biotechnol. J. 6, 1358
цессе роста культуры при истощении среды. По-
(2011).
степенное выедание растущей культурой компо-
4. A. Melis and T. Happe, Plant Physiol. 127 (3), 740
нентов среды и начало голодания вызывает
(2001).
стресс, одним из результатов которого является
5. B. J. Strasser and R. J. Strasser, In Photosynthesis: from
накопление крахмала, что в свою очередь приво-
Light to Biosphere, Ed. by Mathis (Kluwer Acad. Publ.,
дит к активации гликолиза и усилению хлоро-
Dordrecht, 1995), Vol. V, pp. 977-980.
пластного дыхания. В результате усиления хлоро-
6. A. Stirbet, G. Yu. Riznichenko, A. B. Rubin, et al., Bio-
пластного дыхания происходит увеличение пула
chemistry-Moscow 79, 291 (2014).
восстановленного пластохинона, что отражается
7. B. Genty, J.-M. Briantais, and N. R. Baker, Biochim.
в увеличении Fо и появлении I-фазы на индукци-
Biophys. Acta 990, 87 (1989).
БИОФИЗИКА том 64
№ 3
2019
МОНИТОРИНГ ФОТОСИНТЕТИЧЕСКОЙ АКТИВНОСТИ
477
8. M. Obata, T. Toda, and S. Taguchi, J. Appl Phycol. 21,
23. A. Oukarroum, S. E. Madidi, G. Schansker, et al., En-
315 (2009).
viron. Exp. Bot. 60, 438 (2007).
9. С. И. Погосян, Г. В. Лебедева и Г. Ю. Ризниченко,
24. S. Susplugas, A. Srivastava, and R. J. Strasser, Plant
в сб. Проблемы экологического мониторинга и
Physiol. 157, 503 (2000).
моделирования
экосистем
(Гидрометиздат,
25. X. Li and L. Zhang, J. Hazard. Mater. 295, 79 (2015).
Ленинград, 1991), т. 13, сс. 280-297.
26. S. Mathur, P. Mehta, and A. Jajoo, Physiol. Mol. Biol.
10. J. Barber, Biochim. Biophys. Acta 1365, 269 (1998).
Plants 19 (2), 179 (2013).
11. A. Solovchenko, O. Solovchenko, I. Khozin-Goldberg,
27. B. Guisse, A. Srivastava, and R. J. Strasser, In Photo-
et al., Algal Res. 2, 175 (2013).
synthesis: from Light to Biosphere, Ed. by Mathis (Kluw-
12. A. Srivastava, B. Guisse, H. Greppin, et al., Biochim.
er Acad. Publ., Dordrecht, 1995), Vol. V, pp. 913-916.
Biophys. Acta 1320, 95 (1997).
28. B. Guisse, A. Srivastava, and R. J. Strasser, Arch. Sci.
13. S. Z. Tóth, G. Schansker, J. Kissimon, et al., Plant
Geneve 48, 147 (1995b).
Physiol. 162, 181 (2005).
29. Т. Ю. Плюснина, С. С. Хрущев, Г. Ю. Ризниченко
и др., Биофизика 60 (3), 487 (2015).
14. S. Mathur, S. I. Allakhverdiew, A. Jajoo, et al., Bio-
chim. Biophys. Acta 1807, 22 (2011).
30. I. V. Konyukhov, In Abstr. Book of International Scien-
tific Conference “Physiology and biotechnology of oxygen-
15. K. Chen, L. Chen, J. Fan, et al., Photosynth. Res.116,
ic photoautotrophic microorganisms: looking into the fu-
21 (2013).
ture” (Moscow, Russia 2014).
16. S. Chen, J. Yang, M. Zhang, et al., Environ. Exp. Bot.
31. Е. Д. Кузнецов и М. Г. Владимирова, Физиология
122, 126 (2015).
растений 11 (4), 615 (1964).
17. B. J. Strasser, Photosynth. Res. 52, 147 (1997).
32. S. Kosourov, A. Tsygankov, M. Seibert, et al., Biotech-
18. J. Essemine, S. Govindachary, S. Ammar, et al., Plant
nol. Bioeng. 78, 731 (2002).
Physiol. Biochem. 49, 235 (2011).
33. L. Zhang, T. Happe, and A. Melis, Planta 214 (4), 552
19. H. M. Kalaji, A. Oukarroum, V. Alexandrov, et al.,
(2002).
Plant Physiol. Biochem. 81, 16 (2014).
34. G. Mouille, M. L. Maddelein, N. Libessart, et al.,
20. Zh.-H. Lin, L.-S. Chen, R.-B. Chen, et al., BMC
Plant Cell 8, 1353 (1996).
Plant Biol. 43, 1 (2009).
35. R. Sager and S. Granick, Gen. Physiol. 37, 729 (1954).
21. S. B. Schmidt, M. Powikrowska, K. S. Krogholm,
36. R. J. Strasser, M. Tsimilli-Michael, and A. Srivastava,
et al., Frontiers Plant Sci. 1772, (2016).
In Chlorophyll Fluorescence: A Signature of Photosynthe-
22. A. Oukarroum, G. Schansker, and R. J. Strasser, Plant
sis, Ed. by G. C. Papageorgiou and Govindjee (Kluwer
Physiol. 137, 188 (2009).
Acad. Publs., Netherlands, 2004), pp. 321-362.
Monitoring of the Photosynthetic Activity of the Chlorella Microalgae Culture
under Nitrogen Depletion Conditions
T.Yu. Plyusnina, S.S. Khrushchev, A.E. Frolov, N.S. Degtereva, I.V. Konyukhov,
S.I. Pogosyan, G.Yu. Riznichenko, and A.B. Rubin
Department of Biology, Lomonosov Moscow State University, Leninskie Gory 1/12, Moscow, 119991 Russia
The paper presents the results of monitoring of the photosynthetic activity of the green microalgae Chlorella.
A thermophilic strain of Chlorella with a high rate of cell division was cultivated in a photobioreactor. Three
variants of nutrient medium with different mineral composition were used. Chlorophyll fluorescence induc-
tion curves and absorption spectra of microalgae suspensions were recorded every hour for 40 hours of culture
growth on each medium. The method of spectral multiexponential approximation developed by the authors
was used to analyze 120 induction curves obtained as a result of monitoring. This method revealed the dy-
namics of a gradual changes in the number of phases of induction curves, their amplitudes and characteristic
times during the growth of culture. The relationship between the parameters of induction curves and electron
transfer processes in the reaction center of photosystem II allowed us to interpret the changes in the shape of
the induction curves in terms of the processes in the reaction center of photosystem II. The spectral multiex-
ponential approximation method was shown to be highly sensitive to physiological state of microalgae and
convenient for analyzing a huge amount of experimental data. The physiological processes accompanying the
depletion of nitrogen in the environment are discussed.
Keywords: photosynthesis, cultivation in a photobioreactor, nitrogen depletion, analysis of fluorescence induction
curves, multiexponential approximation
БИОФИЗИКА том 64
№ 3
2019