БИОФИЗИКА, 2019, том 64, № 3, с. 486-493
БИОФИЗИКА КЛЕТКИ
УДК 577.334
ГИПОМАГНИТНОЕ ПОЛЕ МОДУЛИРУЕТ ЧУВСТВИТЕЛЬНОСТЬ
ЭРИТРОЦИТОВ КРЫСЫ К трет-БУТИЛГИДРОПЕРОКСИДУ
© 2019 г. M.A. Терпиловский*, Д.А. Хмелевской*, Б.Ф. Щеголев** ***, С.В. Сурма**,
В.Е. Стефанов****, С.М. Сухаржевский*****, Н.В. Гончаров*
*Институт эволюционной физиологии и биохимии им. И.М.Сеченова РАН,
194223, Санкт-Петербург, пр. Тореза, 44
**Институт физиологии им. И.П. Павлова РАН, 199034, Санкт-Петербург, наб. Макарова, 6
***Национальный медицинский исследовательский центр им. В.А. Алмазова,
197341, Санкт-Петербург, ул. Аккуратова, 2
*****Санкт-Петербургский государственный университет,
199034, Санкт-Петербург, Университетская набережная, д. 7-9
*****Научный Парк Санкт-Петербургского государственного университета,
198504, Петергоф, Ботаническая ул., 17
E-mail: ngoncharov@gmail.com
Поступила в редакцию 23.01.2018 г.
После доработки 23.07.2018 г.
Принята к публикации 12.02.2019 г.
Эритроциты крысы выдерживали в магнитном поле Земли, а также подвергали воздействию ослаб-
ленным магнитным полем Земли в присутствии трет-бутилгидропероксида как индуктора оксида-
тивного стресса. Проводили спектральный анализ (в диапазоне 500-700 нм) трех форм гемоглоби-
на: оксигемоглобина, метгемоглобина и гемихрома, высвобождавшихся при гемолизе эритроцитов.
Концентрацию кислородных радикалов в пробах определяли методом электронного парамагнитно-
го резонанса по методике спиновых ловушек. Установлено, что после 4 ч инкубации с высокими
концентрациями трет-бутилгидропероксида (>700 мкМ) экспонировавшиеся в ослабленном маг-
нитном поле эритроциты высвобождали значительно больше (p < 0,05) гемоглобина, преимуще-
ственно в форме метгемоглобина. В свою очередь, после 24 ч инкубации с низкими концентрация-
ми трет-бутилгидропероксида (≤ 350 мкМ) эритроциты под воздействием магнитного поля Земли
высвобождали сравнительно больше (p < 0,001) гемоглобина в форме метгемоглобина (в пропорции
от всего гемоглобина). Эритроциты, подвергавшиеся воздействию ослабленным магнитным полем,
продуцировали больше кислородных радикалов, чем экспонировавшиеся в магнитном поле Земли.
В условиях оксидативного стресса ослабленное магнитное поле может нарушать функциональное
состояние эритроцитов и способствовать гибели клеток. В то же время низкие концентрации актив-
ных форм кислорода могут нейтрализовать эффекты ослабленного магнитного поля.
Ключевые слова: эритроциты, гемоглобин, ослабленное магнитное поле Земли, активные формы
кислорода, гибель клеток.
DOI: 10.1134/S0006302919030086
ном пространстве, 0,3 мкТл на лунной поверхно-
Все живые организмы подвержены действию
сти, ~ 0,7 мкТл на высоте 200 км от поверхности
магнитного поля Земли (МПЗ), которое меняется
Марса [2-4].
в зависимости от широты, увеличиваясь к полю-
В работе [5] были классифицированы и про-
сам, так что средняя величина индукции МПЗ со-
анализированы результаты различных работ, в
ставляет 42 мкТл [1]. Величина индукции магнит-
которых изучались эффекты воздействия гипо-
ного поля в околоземном пространстве значи-
магнитного поля на биологические объекты. По-
тельно ниже, чем на поверхности Земли, и
добные исследования имеют высокую значи-
достигает, в частности, 0,0066 мкТл в межпланет-
мость при планировании межпланетных экспе-
диций для поддержания нормального состояния
Сокращения: МПЗ - магнитное поле Земли, ОМП - ослаб- и работоспособности космонавтов во время кос-
ленное магнитное поле, АФК - активные формы кислоро-
да, ТБГ - трет-бутилгидропероксид, ЭПР - электронный
мических полетов и пребывания на космических
парамагнитный резонанс.
станциях. В ряде экспериментальных работ было
486
ГИПОМАГНИТНОЕ ПОЛЕ МОДУЛИРУЕТ ЧУВСТВИТЕЛЬНОСТЬ ЭРИТРОЦИТОВ
487
показано, что воздействие статического магнит-
Подготовка эритроцитов. Эритроциты получа-
ного поля, ослабленного экранированием (ослаб-
ли из гепаринизированной крови аутбредных
ленное магнитное поле - ОМП) с величиной ин-
крыс линии Вистар массой 200-240 г в соответ-
дукции меньше, чем 20 мкТл, нарушает функци-
ствии с «Правилами доклинической оценки без-
ональное состояние живых организмов [6-9].
опасности фармакологических средств (GLP)»
ОМП способно влиять на скорость и продолжи-
(РД 64-126-91) и требованиями Приказа Мин-
тельность клеточного цикла, причем эффекты
здравсоцразвития РФ
№708н от
23.08.2010.
воздействия ОМП на лимфоциты человека более
Кровь, полученную при декапитации, центрифу-
значимы в G1-фазе [10,11]. Снижение величины
гировали 3 мин при 3000 об/мин, после чего отби-
индукции МПЗ до 300 нТл ведет к ингибирова-
рали плазму и слой лимфоцитов-тромбоцитов.
нию пролиферации и дифференцировке клеток
Эритроцитарную массу ресуспендировали в Ca2+-
скелетных мышц новорожденных мышей [9,12].
HEPES-буфере (конечные концентрации в мМ:
Предполагается, что механизм действия сла-
NaCl - 140, MgCl2 - 3, глюкоза - 10, 10 HEPES,
бых магнитного и электромагнитного полей на
CaCl2 - 2,5 и KCl - 5), pH 7,4 и центрифугировали
биологические системы связан с генерацией ак-
дважды 2 мин при 2000 об./мин. Один объем
тивных форм кислорода (АФК) [13,14]. В то же
Ca2+-HEPES-буфера добавляли к промытым
время имеются данные о подавлении внутрикле-
эритроцитам, ресуспендировали и проводили
точного образования АФК в раковых клетках, эн-
анализ крови на гематологическом анализаторе
дотелиальных клетках артерий и перитонеальных
Medonic M16 (Boule Medical AB, Швеция). Коли-
макрофагах в условиях ОМП [15-17]. Согласно
чество лимфоцитов в суспензии составляло
одной из гипотез, геомагнитная чувствительность
<0,1 · 109/л, тромбоцитов <0,01 · 109/л. Получен-
живых организмов зависит от генерации суперок-
ную суспензию эритроцитов доводили до кон-
сид-аниона (O2-) [18,19]. В частности, гипомаг-
центрации 0,5 · 1012/л, используя Ca2+-HEPES-бу-
нитные поля способны модулировать переход
фер, и разливали в тестовые пробирки. Трет-бу-
синглетной формы кислорода в триплетную и на-
тилгидропероксид (ТБГ) использовали для
оборот при участии супероксид-аниона [19-21].
индукции оксидативного стресса. Рабочие рас-
творы ТБГ получали ex tempore разведением ма-
Генерация АФК эритроцитами сопряжена с
точного раствора с концентрацией 7,7 М. Тесто-
автоокислением, суть которого состоит в спон-
вые пробирки инкубировали на орбитальном
танном окислении гемового железа (Fe2+). Этот
шейкере OS-20 (BioSan, Латвия) при 100 об/мин в
процесс, если он выходит из-под контроля анти-
течение 4 и 24 ч. При инкубации пробирки нахо-
оксидантной системы, обусловливает образова-
дились в горизонтальном положении при ком-
ние метгемоглобина (Fe3+) и O2- [22]. Супероксид
натной температуре
(24°C) под воздействием
способен реагировать с гемоглобином и дисмути-
ОМП или МПЗ.
ровать под действием супероксиддисмутазы с об-
Определение форм гемоглобина. После инкуба-
разованием H2O2. Если продуцируется слишком
ции пробы центрифугировали (3000 об/мин). За-
много АФК (оксидативный стресс), происходит
тем на спектрофотометре UV-2401PC (Shimadzu,
разрушение эритроцитов (гемолиз), гемоглобин
Япония) в диапазоне длин волн 500-700 нм были
высвобождается во внутрисосудистое простран-
зарегистрированы их спектры оптического по-
ство, а нейтрализация эндотелиального оксида
глощения с шагом 1 нм. Измерения проводили в
азота супероксид-анионом с образованием пе-
кювете толщиной 0,8 см. Данные спектры ис-
роксинитрита вызывает спазм сосудов или гипер-
пользовали для вычисления молярной концен-
тензию [23]. Кроме этого, оксидативный стресс
трации общего гемоглобина и трех его форм - ок-
может повысить ригидность эритроцитов в ре-
сигемоглобина, метгемоглобина и гемихрома -
зультате эриптоза и нарушение микроциркуля-
по значениям величин абсорбции, полученным
ции крови [24].
на длинах волн 577, 630 и 560 нм, и следующим
Цель настоящего исследования - изучить вли-
микромолярным коэффициентам экстинкции
яние ОМП на состояние эритроцитов крысы
[25]:
in vitro в условиях оксидативного стресса.
oxyHb = 119·A577 - 39·A630 - 89·A560,
МАТЕРИАЛЫ И МЕТОДЫ
metHb = 28·A577 + 307·A630 - 55·A560,
Реактивы. В работе были использованы
HC = -133·A577 - 114·A630 + 233·A560.
HEPES и TEMPO (4-amino-2,2,6,6-tetrameth-
ylpiperidine-1-oxyl) производства Sigma (США),
Концентрации гемоглобина выражали в мик-
остальные реактивы приобретены в АО «Вектон»
ромолях на 0,2 мл суспензии эритроцитов при
(Санкт-Петербург, Россия).
концентрации клеток 5 · 1011/л.
БИОФИЗИКА том 64
№ 3
2019
488
ТЕРПИЛОВСКИЙ и др.
ляются нитроксильные радикалы, которые
достоверно регистрируются методом электрон-
ного парамагнитного резонанса (ЭПР). Инте-
гральная интенсивность (площадь под линией
сигнала) пропорциональна количеству радикалов
в исследуемой пробе. Поскольку нитроксильные
радикалы химически и термически стабильны, их
можно надежно регистрировать в биологических
тканях in vitro и in vivo [27,28].
После 24 ч инкубации пробы замораживали в
жидком азоте (77 К). ЭПР-спектры полученного
лизата суспензии эритроцитов измеряли на ЭПР-
спектрометре Elexsys E580 (BRUKER, Германия)
при температуре 297,2 К. Для количественной ре-
гистрации в пробе гидроксильного радикала OH-
в наших исследованиях была использована спи-
новая ловушка TEMPO
(4-amino-2,2,6,6-te-
tramethylpiperidine-1-oxyl) (Sigma, США).
Ослабление магнитного поля Земли в экраниру-
ющих камерах. Для физического моделирования
слабого статичного магнитного поля были скон-
струированы две цилиндрические экранирующие
камеры (d = 10 см и l = 30 см; d = 25 см и l = 60 см),
покрытые десятками слоев экранирующего мате-
риала AMAG172 [29]. Все измерения индукции
магнитных полей проводили с использованием
магнитометров: Fluxmaster (Stefan Mayer Instru-
ments, Dinslaken, Германия) в диапазоне 1 нТл -
200 мкТл с разрешением 1 нТл и HB0302.1A (ООО
«Магнитные приборы», Санкт-Петербург, Рос-
сия) в диапазоне 0,1-100 мкТл с разрешением
0,1 мкТл.
Статистика. Формы гемоглобина определяли в
Рис. 1. Выделение общего гемоглобина (в мкМ в
десяти независимых экспериментах (n = 10). В
0,2 мл суспензии с 5 · 1011 эритроцитов) в супернатант
каждом эксперименте кровь получали от одной
эритроцитов под воздействием МПЗ (48 мкТл) или
крысы и делили на несколько образцов, которые
ОМП (0,192 мкТл) после 4 ч инкубации (а) и 24 ч
экспонировали в ОМП и МПЗ. Статистический
инкубации (б) с различными концентрациями ТБГ
анализ проводили с использованием программы
(0-1500 мкМ). Каждая точка представляет собой
GraphPad Prism 7 (GraphPad Software, Inc., San
среднее значение по меньшей мере трех повторов;
Diego, США). Данные были проанализированы с
погрешности не отображаются из-за неудобства
использованием парного t-теста Стьюдента, по-
шкалы.
сле чего к p-величинам применяли поправку Бе-
ньямини-Кригера-Екутиели [30].
Определение концентрации кислородных ради-
калов методом спиновой ловушки с использованием
РЕЗУЛЬТАТЫ
электронного парамагнитного резонанса. Для опре-
Гемоглобин в супернатанте эритроцитов после
деления количества короткоживущих кислород-
воздействия ОМП или МПЗ. Определение общего
ных радикалов в пробе использовался метод спи-
гемоглобина показало, что образцы с относитель-
новых ловушек [26]. Идея метода состоит в том,
но низкими концентрациями ТБГ (до 350 мкМ) и
что в биологическую систему, в которой ожидает-
относительно небольшим временем инкубации
ся образование короткоживущих радикалов, вво-
(4 ч) высвобождали одинаковое количество гемо-
дится спиновая ловушка - некое биологически
глобина при воздействии как МПЗ, так и ОМП
инертное вещество, способное вступать в реак-
(рис. 1a). Однако при высоких концентрациях
цию с этими радикалами и образовывать перси-
ТБГ (выше 700 мкМ) инкубация в течение 4 ч в
стентные парамагнитные соединения - спино-
условиях МПЗ обусловила высвобождение мень-
вые аддукты. Как правило, такими аддуктами яв-
шего количества гемоглобина, чем в условиях
БИОФИЗИКА том 64
№ 3
2019
ГИПОМАГНИТНОЕ ПОЛЕ МОДУЛИРУЕТ ЧУВСТВИТЕЛЬНОСТЬ ЭРИТРОЦИТОВ
489
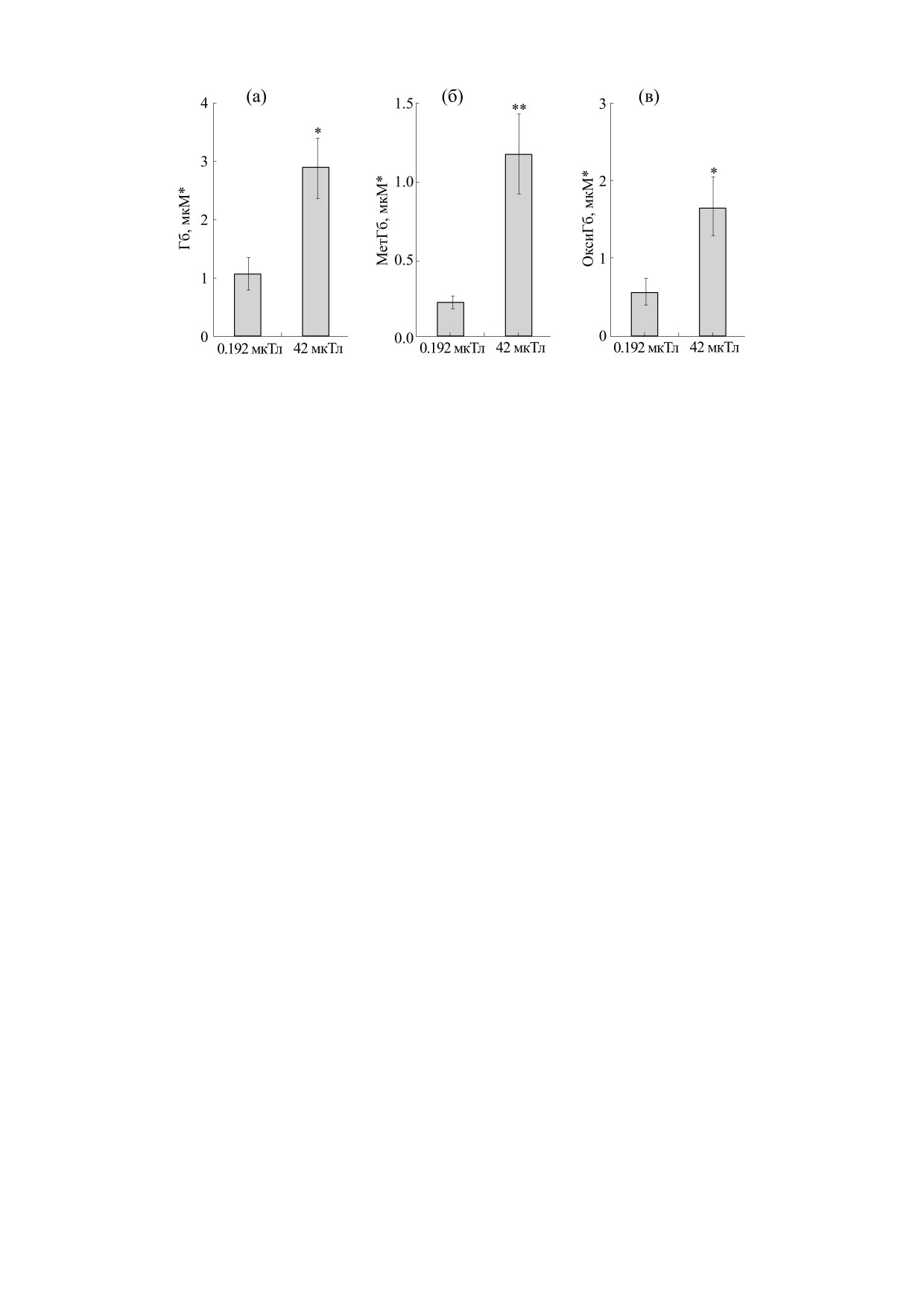
Рис. 2. Выделение общего гемоглобина (а), метгемоглобина (б) и оксигемоглобина (в) (в мкМ в 0,2 мл суспензии с
5 · 1011 эритроцитов) в супернатант эритроцитов под воздействием МПЗ (48 мкТл) или ОМП (0,192 мкТл) после 24 ч
инкубации в отсутствие ТБГ; * p < 0,05; ** p < 0,01.
ОМП, в среднем на 12% (p < 0,05) (рис. 1a). На-
бина из клеток, инкубированных в условиях
против, после 24 ч инкубации в условиях МПЗ в
ОМП, было на 162% ниже, чем для клеток, инку-
образцах с низкими концентрациями ТБГ (до
бированных при МПЗ (р < 0,01) (рис. 2а). Количе-
350 мкМ) общий выход гемоглобина был значи-
ство метгемоглобина и оксигемоглобина в супер-
тельно выше (от 74 до 316%, р < 0,001), чем в об-
натанте образцов после инкубации в условиях
разцах, которые инкубировали в условиях ОМП
МПЗ составило соответственно 457% (p < 0,001) и
(рис. 1б). В присутствии высоких концентраций
198% (p < 0,05) по сравнению с образцами, нахо-
ТБГ (выше 700 мкМ) высвобождение гемоглоби-
дящихся в условиях ОМП (рис. 2б и 2в).
на в образцах в условиях ОМП и МПЗ было прак-
Уровень кислородных радикалов в супернатанте
тически одинаковым. Примерно 90% гемоглоби-
эритроцитов после инкубации в условиях ОМП или
на высвобождается в узком диапазоне концентра-
МПЗ. Измерение относительного содержания
ций ТБГ: 400-500 мкМ через 4 ч и 350-450 мкМ
кислородных радикалов (главным образом гид-
через 24 ч. По-видимому, имеет место коопера-
роксильного радикала и супероксид-аниона) с
тивность лизиса за счет лавинообразного нарас-
помощью ЭПР с использованием спин-ловушки
тания количества АФК в эритроцитах, свидетель-
TEMPO выявило статистически значимое повы-
ствующая о принципиальном вкладе гемоглоби-
шение интенсивности спектра после 24 ч инкуба-
на в процесс генерации АФК. Выход кривой на
ции эритроцитов в присутствии малых концен-
плато свидетельствует о разрушении большей ча-
траций ТБГ (100 и 250 мкМ) в условиях ОМП
сти эритроцитов, некоторое снижение плато сви-
(рис. 3а, 3б; 4). Это означает, что в условиях ОМП
детельствует о денатурации гемоглобина.
эритроциты генерируют АФК и относительно
Определение трех форм гемоглобина показа-
низкие концентрации экзогенного ТБГ суммиру-
ло, что в образцах с относительно высокими кон-
ются с эндогенными радикалами в суспензии
центрациями ТБГ после 4 ч инкубации разница
эритроцитов.
была обнаружена главным образом по уровню
высвободившегося метгемоглобина (от 52 до 72%
от общей концентрации гемоглобина). В образ-
ОБСУЖДЕНИЕ
цах с низкими концентрациями ТБГ (до
В наших экспериментах установлено, что при
350 мкМ) после 24 ч инкубации разница была вы-
относительно низких концентрациях ТБГ через
явлена главным образом по уровню высвободив-
4 ч инкубации эритроцитов в условиях ОМП или
шегося оксигемоглобина (от 46 до 68% от общей
МПЗ различий в высвобождении общего гемо-
концентрации гемоглобина), хотя метгемоглобин
глобина нет. Также нет никакой разницы по
составлял значительную часть общего гемогло-
уровню высвобождаемого гемоглобина при дей-
бина.
ствии высоких концентраций ТБГ через 24 ч ин-
Следует отметить, что в случае спонтанного
кубации в условиях ОМП или МПЗ. В то же
окисления эритроцитов в отсутствие ТБГ после
время выявлено повышенное высвобождение об-
24 ч инкубации высвобождение общего гемогло-
щего гемоглобина - в основном в виде метгемо-
БИОФИЗИКА том 64
№ 3
2019
490
ТЕРПИЛОВСКИЙ и др.
Рис. 4. Изменение количества парамагнитных цен-
тров ТЕМРО (площади под линиями спектра ЭПР,
точность определения ±3%) лизата суспензии эрит-
роцитов после 24 ч инкубации при экспозиции МПЗ
(48 мкТл) или ГМП (0,192 мкТл) для различных кон-
центраций ТБГ - 0,0 мкМ (1), 100,0 мкМ (2) и
250,0 мкМ (3).
инкубации в условиях ОМП и МПЗ в присут-
ствии высоких концентраций ТБГ практически
одинаков, что объясняется временной зависимо-
стью процесса лизиса (некротической гибели) и
его выходом на плато. Наиболее интересным ре-
зультатом эксперимента является повышенный
выход гемоглобина в условиях МПЗ как в отсут-
ствие ТБГ, так и при низких концентрациях ТБГ,
когда форма оксигемоглобина преобладает, а
метгемоглобин составляет значительную часть
общего гемоглобина. Этот эффект может пока-
заться парадоксальным в связи с тем, что данные
ЭПР свидетельствуют о повышенном уровне
АФК в лизате эритроцитов, инкубировавшихся в
условиях ОМП, по сравнению с эритроцитами,
инкубировавшимися в условиях МПЗ. Объясне-
ние этому кажущемуся парадоксу состоит в том,
что, в отличие от лизата, в суспензии эритроцитов
Рис. 3. Спектр ЭПР ТЕМРО в лизате эритроцитов:
АФК находятся в разных компартментах, причем
(а) 24 ч экспозиции в МПЗ и ГМП; (б) - в присут-
внеклеточная среда является одним из них, и
ствии 100 мкМ ТБГ после 24 ч экспозиции в МПЗ и
определенная часть АФК, в том числе и в первую
ГМП; (в) - в присутствии 250 мкМ ТБГ после 24 ч
очередь экзогенный внеклеточный ТБГ, служит
экспозиции в МПЗ и ГМП.
акцепторами электронов, предотвращая накоп-
ление АФК в одном из внутриклеточных
компартментов и преждевременное разрушение
глобина - после 4 ч инкубации в условиях ОМП
клеток. Таким образом, ТБГ при относительно
по сравнению с МПЗ при наличии в среде инку-
низких концентрациях может выполнять антиок-
бации высоких концентраций ТБГ. Это свиде-
сидантную функцию, подавляя образование кис-
тельствует об увеличении лизиса клеток, т.е. о по-
лородных радикалов в суспензии эритроцитов.
вышении интенсивности гибели эритроцитов по
Мы не нашли в литературе данных подобного ро-
некротическому пути и, следовательно, о потен-
да. В многочисленных работах эксперименталь-
цировании действия ТБГ гипомагнитным полем.
ного и обзорного характера представлены лишь
Уровень общего гемоглобина в среде через 24 ч
сигнальные и токсические характеристики АФК
БИОФИЗИКА том 64
№ 3
2019
ГИПОМАГНИТНОЕ ПОЛЕ МОДУЛИРУЕТ ЧУВСТВИТЕЛЬНОСТЬ ЭРИТРОЦИТОВ
491
[31-33], тогда как двоякое действие (замедление
В отличие от «полноценных» ядерных клеток,
или ускорение гибели клеток) присуще некото-
да еще таких специализированных, как макрофа-
рым нутрицевтикам [34,35]. Что касается данных
ги (так называемые профессиональные фагоци-
о подавлении генерации АФК в условиях ОМП
ты), мы имели дело с эритроцитами, в которых
[15-17], причин этому может быть несколько, и
отсутствуют ядро и митохондрии. Плотность
они могут дополнять друг друга. Наиболее оче-
(концентрация) их намного больше (как в орга-
видным комплексом причин представляется сле-
низме, так и в пробе), и в них намного больше
дующий: использование флуоресцентных зондов
двухвалентного железа в составе гемоглобина, яв-
(чаще всего DCFH-DA) для исключительно внут-
ляющегося одним из основных генераторов
АФК, тогда как имеющаяся активность NADPH-
риклеточного измерения АФК, главным (или
оксидазы не является определяющей; имеется
первичным) из которых является супероксид-
многокомпонентная система антиоксидантной
анион (особенно в случае перитонеальных мак-
защиты; наконец, измерение АФК (главным об-
рофагов, где основным «генератором» суперок-
разом гидроксил-радикала) осуществляется в ли-
сида является NADPH-оксидаза 2-го типа, или
зате с помощью ЭПР, а спиновая ловушка TEM-
NOX2). Супероксид выделяется во внеклеточную
PO находится и «работает» преимущественно в
среду, где может спонтанно или ферментативно
гидрофобной фазе и не дает таких ложноположи-
(супероксиддисмутаза 3-го типа, СОД3) дисмути-
тельных эффектов как DCFН; наконец, время
ровать с образованием пероксида водорода, кото-
инкубации эритроцитов в условиях ОМП перед
рый через аквапорины проникает внутрь клеток и
измерением на ЭПР составило 24 ч.
там либо расщепляется пероксидазой, либо при
наличии ионов двухвалентного железа образует
В недавнем исследовании in vivo на крысах [37]
гидроксил-радикал (реакция Фентона). Суперок-
не наблюдали никакого эффекта воздействия
сид-анион через анионные каналы может вер-
ОМП на гематологические параметры, в частно-
нуться в клетку и там спонтанно или фермента-
сти, не было выявлено влияние на количество и
тивно (супероксиддисмутаза 1-го типа, СОД1)
средний объем эритроцитов или концентрацию
дисмутировать, ну а судьба образующегося Н2О2
гемоглобина внутри них. Это не означает, что эф-
фект воздействия ОМП на биохимию эритроци-
описана выше. Проблема в том, что DCFH не ре-
тов отсутствует в долгосрочной перспективе, но
агирует напрямую ни с супероксидом, ни даже с
может указывать либо на быстрое замещение
пероксидом водорода, но окисляется с образова-
поврежденных клеток благодаря гемопоэзу в
нием флуоресцентного продукта (DCF) лишь при
компенсаторной фазе и/или на отсутствие прояв-
взаимодействии с гидроксил-радикалом, хлорно-
лений слабого эффекта воздействия ОМП на ге-
ватистой кислотой (HClO) и продуктами распада
матологических параметрах в течение ограничен-
пероксинитрита
[36]. Дополнительно следует
ного времени эксперимента in vivo. Кроме того,
учесть ложноположительные эфекты: окисление
отсутствие ощутимого эффекта воздействия
DCFH происходит в два этапа, а продукт одно-
ОМП при обычных условиях существования жи-
электронного окисления DCF•- реагирует с кис-
вотных не означает, что в условиях оксидативно-
лородом с образованием супероксид-аниона и
го или других типов стресса эффект действия
далее по описанной выше схеме. Следующий
ОМП не проявится раньше и сильнее. Аддитив-
важный фактор - гидрофильная фаза, в которой
ность, синергизм или потенцирование различных
преимущественно находится и «работает» DCFH.
эффектов может усилить эффект воздействия
Далее - время воздействия ОМП, которое при
ОМП. Понимая существующие ограничения,
работе с клетками часто ограничено часами и ред-
присущие экспериментам in vivo с крысами, в на-
ко сутками. Следует помнить и о том, что NOX2 -
стоящей работе мы разработали модель in vitro для
это PKC-, Са- и NADPH-зависимый фермент.
экспресс-определения возможного влияния
Поэтому когда используют зонды (чаще всего -
ОМП на эритроциты. В связи с этим следует от-
DCFH-DA) и говорят о снижении АФК под дей-
метить, что в предыдущих экспериментах in vivo
ствием какого-либо агента, возникает целый ряд
не было получено доказательств повреждения
вопросов: это результат воздействия на актив-
эритроцитов из-за применения общедоступных и
низкоспецифических методов клинической био-
ность РКС, на уровень Са2+ или NADPH, на ак-
химии. Получив новые данные in vitro, уместно
тивность супероксиддисмутазы или каталазы, на
рассмотреть вопрос о разработке новой методо-
уровень железа, аквапоринов или анионных об-
логии, с помощью которой можно было бы вы-
менников, на скорость образования разных АФК
явить небольшие сдвиги в состоянии эритроци-
в разных компартментах клетки, гидрофильной
тов крысы in vivo.
или гидрофобной фазе, на уменьшение ложнопо-
ложительных эффектов или на что-то еще в от-
Воздействие на живые клетки высоких кон-
дельности, или на все вместе взятое?
центраций ТБГ приводит к значительному увели-
БИОФИЗИКА том 64
№ 3
2019
492
ТЕРПИЛОВСКИЙ и др.
чению цитотоксичности, генерации АФК и пере-
Измерения на ЭПР-спектрометре Elexsys E580
кисного окисления липидов. ТБГ генерирует
(BRUKER, Германия) были выполнены в Ресурс-
трет-бутоксильные (t-BuO) и трет-бутилперок-
ном Центре «Магнитно-резонансные методы ис-
сильные (t-BuOO) радикалы. Окислительные
следования» СПбГУ.
процессы, вызванные ТБГ в эритроцитах, приво-
Исследования выполнены при финансовой
дят к образованию свободных радикалов (в реак-
поддержке Государственной программы АААА-
ции между ТБГ и клеточным гемоглобином), ко-
А18-118012290142-9 и Программы фундаменталь-
торые реагируют с липидами в реакциях перекисно-
ных научных исследований государственных ака-
го окисления
[38]. Кроме того, высокие
демий на 2014-2020 годы (SP-14, раздел 63).
концентрации ТБГ (0,5 мМ) вызывают снижение
активности каталазы и супероксиддисмутазы [37].
СПИСОК ЛИТЕРАТУРЫ
Эффекты воздействия антиоксиданта/прооксидан-
та не только коррелируют с молекулярной структу-
1.
C. C. Finlay, S. Maus, C. D. Beggan, et al., Geophys.
рой, но и с состоянием их распределения в реакци-
J. Intern. 183 (3), 1216 (2010).
онной системе [40]. Следует учитывать, что окисли-
2.
F. Steinhilber, J. A. Abreu, J. Beer, et al.. J. Geophys.
тельно-восстановительный потенциал Δξ°' редокс-
Res. 115, 1 (2010).
3.
M. S. Berguig, M. Hamoudi, and J. L. Lemoueel, Arab.
пары ТБГ (t-BuO•/t-BuO2H) находится на уровне
J. Geosci. 6 (4), 1063 (2011).
1050 мВ, а logP составляет 1,23 [41,42]. Это означа-
4.
T. R. Watters, P. J. McGovern, and R. P. Irwin III. An-
ет, что при низких концентрациях ТБГ может ак-
nu. Rev. Earth Planetary Sci. 35, 621 (2007).
цептировать электроны кислородных радикалов,
5.
J. Ouyang and H. Li, J. Life Sci. Res. 4 (2), 14 (2017).
таких как супероксидный анион и пероксид водо-
6.
A. P. Dubrov. The geomagnetic field and life: geomagne-
рода (Δξ°' этой редокс-пары составляет около 360
tobiology (Plenum, New York, 1978).
мВ [43]) в гидрофобной фазе, защищая мембрану
7.
N. A. Belyavskaya, Adv. Space Res. 34, 1566 (2004).
эритроцитов от окисления. А в случае медленного
8.
B. Jia and P. Shang, Space Medicine & Medical Engi-
развития прооксидантных эффектов они могут
neering 22, 308 (2009).
инициировать развитие эриптоза с повышением
9.
S. V. Surma, G. B. Belostotskaya, B. F. Shchegolev,
ригидности мембран эритроцитов, устойчивых к
et al., Bioelectromagnetics 35 (8), 537 (2014).
лизису, что мы и наблюдали после 24 ч воздей-
10.
C. F. Martino, H. Perea, U. Hopfner, et al., Bioelectro-
ствия низких доз ТБГ.
magnetics 31, 296 (2010).
11.
I. Y. Belyaev, Y. D. Alipov, and M. Harms-Ringdahl,
Механизм усиления оксидативного стресса в
Biochim. Biophys. Acta 1336, 465 (1997).
условиях воздействия ОМП можно объяснить с
12.
И. С. Елдашев, Б. Ф. Щеголев, С. В. Сурма и др.,
точки зрения цитотоксической мощности, кото-
Биофизика 55 (3), 868 (2010).
рая предполагает расчет скорости развития цито-
13.
И. М. Спивак, М. Л. Куранова, Г. Р. Мавропуло-
токсических эффектов за единицу времени [44].
Столяренко и др., Биофизика 61 (3), 435 (2016).
Сочетание цитотоксического эффекта высокой
14.
A. L. Buchachenko and R. G. Lawler, Accounts Chem.
мощности (ТБГ в высокой концентрации), обу-
Res. 50 (4), 877 (2017).
словливающего некротический тип гибели кле-
15.
C. F. Martino and P. R. Castello, PLoS One 6 (8),
ток, с низким цитотоксическим эффектом воз-
e22753 (2011).
действия ОМП, обусловливающим апоптозную
16.
C. F. Martino, L. Portelli, K. Mccabe, et al., Bioelec-
гибель клеток, приводит к усилению и ускорению
tromagnetics 31, 649 (2010).
некротического пути. В то же время совместное
17.
В. В. Новиков, Е. В. Яблокова и Е. Е. Фесенко,
действие двух относительно слабых воздействий,
Биофизика 63 (3), 484 (2018).
каждое из которых индуцирует апоптотический
18.
T. Ritz, R. Wiltschko, P. J. Hore, et al., Biophys. J. 96,
путь, может либо ускорять развитие апоптоза, ли-
3451 (2009).
бо даже замедлять его (явление типа аннигиляции
19.
I. A. Solov’yov and K. Schulten, Biophys. J. 96, 4804
или нейтрализации одних АФК другими) в случае
(2009).
разделения общего пула АФК клеточной мембра-
20. T. Ritz, S. Adem, and K. Schulten. Biophys. J. 78, 707
ной или внутриклеточными структурами. Чтобы
(2000).
прояснить молекулярные механизмы взаимодей-
21. R. J. Usselman, C. Chavarriaga, P. R. Castello, et al.,
ствия ТБГ и ОМП, необходимо оценить уровень
Sci. Reports 6, 1 (2016).
восстановленного глутатиона, активность основ-
22. P. H. Misra and I. Fridovich, J. Biol. Chem. 10, 6960
ных антиоксидантных защитных систем эритро-
(1972).
цитов, активность NADPH-оксидазы и систему
23. C. Giulivi and E. Cadenas, Free Radic. Biol. Med. 24,
трансмембранного переноса электронов. Этим
269 (1998).
аспектам мы планируем уделить особое внимание
24. E. Lang and F. Lang, Seminars in Cell and Develop-
в наших дальнейших исследованиях.
mental Biology 39, 35 (2015).
БИОФИЗИКА том 64
№ 3
2019
ГИПОМАГНИТНОЕ ПОЛЕ МОДУЛИРУЕТ ЧУВСТВИТЕЛЬНОСТЬ ЭРИТРОЦИТОВ
493
25. I. I. Stepuro, N. A. Chaikovskauya, V. P. Vodoevich,
R. C. Gupta (Academic Press/Elsevier, Amsterdam,
et al., Biochemistry 62 (9), 967 (1997).
2016), pp. 319-332.
26. O. L. Lebedev and S. N. Kazarnowskii, Zhurn. Ob-
35. N. Goncharov, A. Orekhov, N. Voitenko, et al., in Nu-
shch. Khim. 30 (5), 1631 (1960).
traceuticals: Efficacy, Safety and Toxicity, Ed. by R. C.
Gupta (Academic Press/Elsevier, Amsterdam, 2016),
27. T. Ide, H. Tsutsui, S. Kinugawa, et al., Circ. Res. 86
pp. 555-568.
(2), 152 (2000).
36. B. Kalyanaraman, V. Darley-Usmar, K. J. Davies,
28. H. Utsumi, E. Muto, S. Masuda, and A. Hamada. Bio-
et al., Free Radic. Biol. Med. 52 (1), 1 (2012).
chem. Biophys. Res. Commun. 172, 1342 (1990).
37. В. Е. Стефанов, Б. Ф. Щеголев, О. В. Крячко и др.,
29. С. В. Сурма, П. А. Кузнецов, Р. С. Хрусталева и др.,
Клеточная биология 461 (4), 485 (2015).
Патент на изобретение № 2454675 «Устройство для
38. A. V. Domanski, E. A. Lapshina, and I. B. Zavodnik.
исследования влияния электромагнитных полей
Biochenistry (Moscow) 70 (7), 761 (2005).
на биологические объекты» (зарегистрировано в
Гос. реестре изобретений РФ 27 июня 2012 г.).
39. I. Sadowska-Woda, I. B. Sychta, M. Rachel, et al., En-
viron. Toxicol. Pharmacol. 30 (2), 141 (2010).
30. Y. Benjamini, A. M. Krieger, and D. Yekutieli. Bio-
40. Z. Liu, K. Han, Y. Lin, and X. Luo, Biochim. Biophys.
metrika 93, 491 (2006).
Acta 1570, 97 (2002).
31. А. Д. Надеев, В. П. Зинченко, П. В. Авдонин и др.,
41. T. N. Das, T. Dhanasekaran, Z. B. Alfassi, et al., J.
Токсикологич. вестн. 2, 22 (2014).
Phys. Chem. A 102 (1), 280 (1998).
32. А. Д. Надеев, И. В. Кудрявцев, М. К. Серебрякова
и др., Цитология 57 (12), 909 (2015).
43. P. S. Rao and E. Hayon, J. Phys. Chem. A 79 (4), 397
33. N. V. Goncharov, P. V. Avdonin, A. D. Nadeev, et al.,
(1975).
Curr. Pharm. Des. 21 (9), 1134 (2015).
44. N. V. Goncharov, M. A. Terpilowski, A. D. Nadeev,
34. I. Mindukshev, I. Kudryavtsev, M. Serebriakova, et al.,
et al., Biochemistry (Moscow), Suppl. Ser. A: Mem-
in Nutraceuticals: Efficacy, Safety and Toxicity, Ed. by
brane and Cell Biology 12 (2) 180 (2018).
A Hypomagnetic Field Modulates Susceptibility
of Erythrocytes to tert-Butyl Hydroperoxide
M.A. Terpilovskii*, D.A. Khmelevskoy*, B.F. Shchegolev** ***, S.V. Surma**, V.E. Stefanov****,
S.M. Sukharzhevskii*****, and N.V. Goncharov* ******
*Sechenov Institute of Evolutionary Physiology and Biochemistry, Russian Academy of Sciences,
prosp. Toreza 44, St. Petersburg, 194223 Russia
**Pavlov Institute of Physiology, Russian Academy of Sciences, nab. Makarova 6, St. Petersburg, 199034 Russia
***Almazov National Medical Research Center, ul. Akkuratova 2, St. Petersburg, 197341 Russia
****Saint Petersburg State University, Universitetskaya nab. 7/9, St. Petersburg, 199034 Russia
*****Research Park of Saint Petersburg State University, Botanicheskaya ul. 17, Peterhof, 198504 Russia
Rat red blood cells were exposed to the Earth’s magnetic field and an attenuated magnetic field, in the pres-
ence of tert-butyl hydroperoxide used as an inducer of oxidative stress. Spectral analysis (within the wave-
length range of 500-700 nm) was used to estimate the concentration of three forms of hemoglobin - oxyhe-
moglobin, methemoglobin, and hemichrome being released throughout erythrocyte hemolysis. Concentra-
tion of reactive oxygen species was determined in samples by spin trapping using electron paramagnetic
resonance. It was found that after 4-hour incubation at high tert-butyl hydroperoxide concentrations
(>700 μM), red blood cells, which were exposed to an attenuated magnetic field, released considerably more
(p < 0.05) hemoglobin, mostly methemoglobin. After 24-hour incubation at low tert-butyl hydroperoxide
concentrations (≤ 350 μM), erythrocytes, which were exposed to the Earth’s magnetic field released relatively
more (p < 0.001) hemoglobin, with methemoglobin as a major form of total hemoglobin. Red blood cells ex-
posed to the attenuated magnetic field generated more oxygen radicals than cells exposed to the Earth’s mag-
netic field. Under certain oxidative stress conditions, the attenuated magnetic field can impair the functional
state of red blood cells and provoke cell death. However, low reactive oxygen species concentrations can neu-
tralize attenuated magnetic field effects. .
Keywords: erythrocytes, hemoglobin, attenuated magnetic field, reactive oxygen species, cell death
БИОФИЗИКА том 64
№ 3
2019