БИОФИЗИКА, 2019, том 64, № 3, с. 494-499
БИОФИЗИКА КЛЕТКИ
УДК 577.3
ВЛИЯНИЕ ДИНИТРОЗИЛЬНЫХ КОМПЛЕКСОВ ЖЕЛЕЗА НА ФИЗИКО-
ХИМИЧЕСКИЕ ХАРАКТЕРИСТИКИ КОМПОНЕНТОВ КРОВИ КРЫС
© 2019 г. А.А. Тимошин*, В.Л. Лакомкин*, Э.К. Рууге* **
*Национальный медицинский исследовательский центр кардиологии МЗ РФ,
121552, Москва, 3-я Черепковская ул., 15а
**Физический факультет Московского государственного университета имени М.В. Ломоносова,
119991, Москва, Ленинские горы, 1
E-mail: timoshin_a_a@mail.ru
Поступила в редакцию 21.01.2019 г.
После доработки 21.01.2019 г.
Принята к публикации 18.02.2019 г.
Проанализировано действие динитрозильных комплексов железа с лигандом глутатионом, вводи-
мых внутривенно, на структурно-конформационные характеристики альбумина, как основного ли-
ганда этих комплексов в плазме, и молекул липидной фазы мембран эритроцитов, составляющих
микроокружение динитрозильных комплексов железа в эритроцитах. В ходе опытов проводился
анализ спектров электронного парамагнитного резонанса таких спиновых зондов, как 5- и 16-док-
силстеариновая кислота, в плазме и эритроцитарной массе, и их изменений в результате инъекции
динитрозильных комплексов железа с глутатионом. Установлено, что введение в организм этих
комплексов не приводит к изменениям молекулярного движения в гидрофобных областях альбуми-
на в плазме крови и мембран эритроцитов, но при этом стимулируется встраивание в их мембрану
заряженных спиновых зондов, что, вероятно, является следствием изменения заряда внешней по-
верхности этих клеток.
Ключевые слова: альбумин, динамика молекулярного движения, динитрозильные комплексы железа,
мембрана эритроцитов, спиновый зонд, электронный парамагнитный резонанс.
DOI: 10.1134/S0006302919030098
Учитывая то, что ДНКЖ являются природны-
Хорошо известно, что моноядерные и биядер-
ми высокоактивными комплексами, возникает
ные динитрозильные комплексы железа (ДНКЖ)
вопрос о возможном взаимном влиянии этих со-
являются одной из основных физиологических
единений и их лигандов. Известно, что тип тиол-
форм депонирования NO в организме животных
содержащих лигандов и их концентрация способ-
и человека [1-8]. Эти природные соединения вы-
ны эффективно влиять на состояние ДНКЖ в
полняют роль переносчиков и доноров NO, а так-
крови и в других компартментах организма, и
же они способны оказывать антиоксидантное
именно от них во многом зависит соотношение
действие [8,9]. К настоящему времени многими
моноядерных и биядерных форм этих комплек-
авторами получены данные о том, что переход
сов, их молекулярная подвижность, кинетика
этих комплексов с одних тиолсодержащих лиган-
спонтанного распада [1,2] и т. д. Следует отме-
дов на другие обеспечивают их перенос внутри
тить, что если влияние лиганда на эти комплексы
организма и, в частности, переход через клеточ-
достаточно широко исследовано, то обратный
ные мембраны [1,10]. Методом электронного па-
эффект, т.е. действие ДНКЖ, как высокоактив-
рамагнитного резонанса (ЭПР) показано, что в
ных комплексов, на свои тиолсодержащие лиган-
организме животных моноядерные ДНКЖ при-
ды, а также на их микроокружение исследовано
сутствуют главным образом с высокомолекуляр-
очень мало. При этом ДНКЖ, связанные с моле-
ными белковыми лигандами [2].
кулой-лигандом по SH-группе, могут оказывать
влияние на молекулярную динамику лиганда и
Сокращения: ДНКЖ - динитрозильные комплексы железа, другие характеристики, причем такое действие
ЭПР - электронный парамагнитный резонанс, ДНКЖ- наиболее вероятно на лиганды, связанные с наи-
Глт - динитрозильные комплексы железа с лигандом глута-
тионом, 5-ДС - 5-доксилстеариновая кислота, 16-ДС -
более значительным количеством этих форм де-
16-доксилстеариновая кислота.
понирования NO, а также на их микроокружение.
494
ВЛИЯНИЕ ДИНИТРОЗИЛЬНЫХ КОМПЛЕКСОВ ЖЕЛЕЗА
495
Хорошо известно, что сразу после внутривен-
а содержание вносимого при этом этанола было
ного введения ДНКЖ с низкомолекулярными
не более 2%.
лигандами их наиболее высокая концентрация
Кроме того, в ходе работы проводили реги-
регистрируется в крови животного, причем в
страцию спектров плазмы и эритроцитов, полу-
плазме концентрация ДНКЖ существенно выше,
ченных через 10 мин после введения ДНКЖ-Глт
чем в эритроцитарной массе. При этом в плазме и
без добавления спиновых зондов для контроля
эритроцитах ДНКЖ связываются с такими тиол-
содержания связанных с белками ДНКЖ.
содержащими лигандами, как альбумин и гемо-
Спектры ЭПР полученных образцов регистри-
глобин соответственно [11].
ровали при комнатной температуре с помощью
Целью данной работы является анализ дей-
ЭПР-спектрометра Х-диапазона Е-109Е (Varian,
ствия ДНКЖ с лигандом глутатионом (ДНКЖ-
США). Амплитуда модуляции магнитного поля
Глт), вводимого внутривенно, на структурно-
составляла 0,2 мТл (при регистрации спектров
конформационные характеристики альбумина
спиновых зондов) или 0,4 мТл (при регистрации
как основного лиганда этих комплексов в плазме
связанных с белками ДНКЖ) при частоте
и молекул липидной фазы мембран эритроцитов,
100 кГц. Уровень сверхвысокочастотной мощно-
составляющих микроокружение ДНКЖ в эрит-
сти спектрометра составлял 10 мВт. При записи
роцитах.
сигналов спиновых зондов проводили сканиро-
вание магнитного поля с центром при g = 2,00; а
при регистрации сигналов связанных с белками
МЕТОДИКА ЭКСПЕРИМЕНТА
ДНКЖ - g = 2,03.
Эксперименты проводили на крысах линии
Wistar (самцы массой 350-450 г). В начале каждо-
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
го опыта животным ставили венозный катетер
Для анализа действия ДНКЖ на молекуляр-
на хвостовую вену. После этого с помощью кате-
ную динамику в плазме крови и в эритроцитах
тера получали образец цельной крови животного
применяли такие липофильные спин-меченые
объемом 1,5 мл. Далее в полученную пробу добав-
производные стеариновой кислоты, как 5- и
ляли гепарин (10-20 МЕ/мл), далее ее центрифу-
16-ДС. После введения этих соединений в плазму
гировали и отделяли плазму от эритроцитарной
или эритроциты регистрировали их спектры
массы. Эритроциты ресуспендировали и промы-
ЭПР, исходя из которых судили об изменениях
вали в 1,0 мл физиологического раствора с после-
скорости молекулярного движения зондов, про-
дующим центрифугированием. Далее удаляли су-
исходящих в результате изменения их микро-
пернатант, осажденные эритроциты еще раз ре-
окружения вследствие внутривенной инъекции
суспендировали в
100 мкл физиологического
ДНКЖ-Глт.
раствора. Полученные в результате образцы плаз-
Известно, что в плазме такие липофильные
мы и эритроцитарной массы хранили при темпе-
спиновые зонды, как производные стеариновой
ратуре 0-4°С не более 1-2 ч до регистрации их
кислоты, связываются главным образом с моле-
спектров ЭПР.
кулами сывороточного альбумина [12,13]. В эрит-
Далее крысам вводили ДНКЖ-Глт, в качестве
роцитарной массе эти два спиновых зонда нахо-
которого применяли стандартный препарат «Ок-
дятся преимущественно в липидной фазе мем-
саком», изготовленный на Экспериментальном
бран эритроцитов [14], причем при встраивании
предприятии медико-биологических препаратов
этих зондов в мембрану парамагнитный фраг-
ФГБУ «Национальный медицинский исследова-
мент 5-ДС находится вблизи поверхности мем-
тельский центр кардиологии» Минздрава Рос-
браны, в области плотной упаковки липидов, а
сии, активным веществом которого являлся
16-ДС - ближе к середине мембраны, в зоне их
ДНКЖ-Глт. Данный препарат всегда вводили
рыхлой упаковки [15]. Молекулы этих зондов при
внутривенно болюсно в дозе 1,6 мкмоль/(кг мас-
физиологических значениях рН имеют отрица-
сы тела). Далее через венозный катетер получали
тельный заряд с одного конца углеводородной
еще одну пробу цельной крови объемом 1,5 мл и
цепи. Поэтому, несмотря на то, что данные со-
по аналогичной методике готовили образцы
единения обладают гидрофобными свойствами,
плазмы и эритроцитарной массы.
их небольшие количества могут находиться и в
Перед регистрацией спектров ЭПР в образцы
водном окружении [15].
плазмы и эритроцитарной массы вводили раство-
Известно также, что спектры ЭПР этих зондов
ренные в этаноле спиновые зонды, в качестве ко-
представляют собой триплетные сигналы с цен-
торых применяли 5- и 16-доксилстеариновую
тром при g = 2,00, причем расщепление и форма
кислоту (5-ДС и 16-ДС соответственно). Их кон-
линий этих спектров зависит от их микроокруже-
центрация во всех образцах составляла 200 мкМ,
ния. Так, при встраивании в мембрану они нахо-
БИОФИЗИКА том 64
№ 3
2019
496
ТИМОШИН и др.
ваться в его гидрофобные карманы, то изменения
структурно-функциональных характеристик аль-
бумина и характера его молекулярного движения
несомненно должны приводить к изменениям
формы спектров данных спиновых зондов.
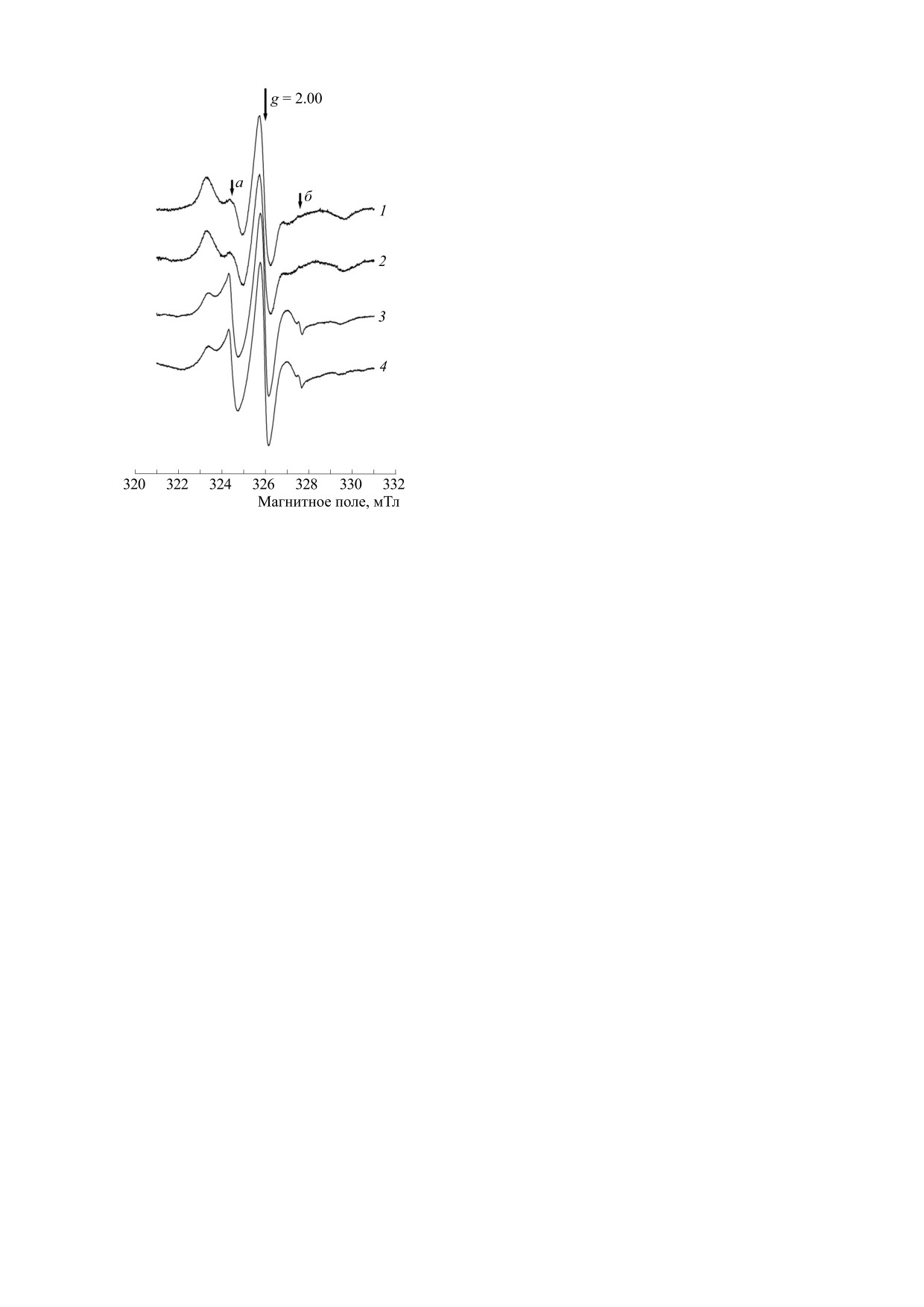
На рис. 1 представлены характерные спектры
ЭПР образцов плазмы крови, содержащих 5-ДС и
16-ДС, полученных как в начале опыта, так и че-
рез 10 мин после введения ДНКЖ-Глт. Из этого
рисунка видно, что в обоих случаях спектры 5-ДС
и 16-ДС представляли собой главным образом
триплетные уширенные сигналы, что свидетель-
ствовало о заторможенном движении парамаг-
нитных фрагментов этих зондов в гидрофобном
микроокружении. При этом на спектрах реги-
стрировались лишь очень слабые узкие компо-
ненты, соответствующие этим зондам в водном
окружении (линии а и б на рис. 1).
Из этого рисунка также видно, что форма и па-
раметры спектров практически не изменялись
при переходе от исходных образцов к пробам
плазмы крови, полученным после введения этих
комплексов. Следовательно, скорость и характер
вращательной диффузии зондов 5-ДС и 16-ДС
практически не меняются в результате введения
Рис. 1. Спектры ЭПР образцов плазмы крови: 1 - в
ДНКЖ-Глт. Учитывая то, что альбумин является
начале опыта, в присутствии 5-ДС; 2 - через 10 мин
основным тиолсодержащим белком в плазме кро-
после введения ДНКЖ-Глт, в присутствии 5-ДС; 3 -
ви, а также тот факт, что данные спиновые зонды
в начале опыта, в присутствии 16-ДС; 4 - через
способны интегрироваться в его гидрофобных
10 мин после введения ДНКЖ-Глт, в присутствии
карманах [12,13], полученные данные заставляют
16-ДС. Регистрация сигналов при комнатной темпе-
думать о том, что присутствие ДНКЖ, связанных
ратуре. Очень слабые узкие компоненты, соответ-
с этим белком по SH-группе, не приводит к за-
ствующие этим зондам в водном окружении, отмече-
метным структурно-конформационным измене-
ны стрелками а и б.
ниям этого лиганда в плазме.
Следует отметить, что, несмотря на то что инъ-
дятся в вязком гидрофобном окружении, в ре-
екция ДНКЖ-Глт не приводит к изменениям ха-
зультате чего могут быть охарактеризованы сиг-
рактера молекулярного движения 5-ДС и 16-ДС в
налами, состоящими из трех уширенных и
плазме, в крови животного происходило форми-
несколько асимметричных линий. Напротив, мо-
рование и накопление связанных с белками
лекулярное движение зондов в водном окруже-
ДНКЖ. Для контроля образования таких стаби-
нии менее заторможено и более изотропно,
лизированных форм NO в компонентах крови
вследствие чего их спектр ЭПР представляет со-
проводились специальные эксперименты, в ко-
бой триплет более узких и симметричных компо-
торых регистрировались сигналы ЭПР плазмы и
нентов. Кроме того, сигналы этих зондов, лока-
эритроцитарной массы через 10 мин после инъек-
лизованных в гидрофобном и полярном окруже-
ции ДНКЖ-Глт при отсутствии в них спиновых
ниях, различаются значениями константы
зондов. Характерный спектр ЭПР плазмы крови
изотропного расщепления [15].
после введения данного препарата представлен
на рис. 2. Из этого рисунка видно, что в этих об-
В ходе опытов проводили анализ спектров
разцах присутствовали связанные с белками мо-
ЭПР данных спиновых зондов в плазме и эритро-
ноядерные ДНКЖ, в то время как комплексы с
цитарной массе и изменений этих спектров в ре-
низкомолекулярным лигандом практически не
зультате введения ДНКЖ-Глт. Безусловно, в
регистрировались.
столь гетерогенной системе, как плазма крови,
нельзя назвать единственного места встраивания
Содержание связанных с белками моноядер-
молекул 5-ДС и 16-ДС. Однако, учитывая то, что
ных ДНКЖ в плазме на данном этапе опыта со-
содержание альбумина в плазме наиболее велико
ставляло в среднем 28 нмоль/г. В эритроцитарной
по сравнению с другими тиолсодержащими бел-
массе также регистрировались эти комплексы с
ками, и молекулы 5- и 16-ДС способны встраи-
белковыми лигандами, при этом их концентра-
БИОФИЗИКА том 64
№ 3
2019
ВЛИЯНИЕ ДИНИТРОЗИЛЬНЫХ КОМПЛЕКСОВ ЖЕЛЕЗА
497
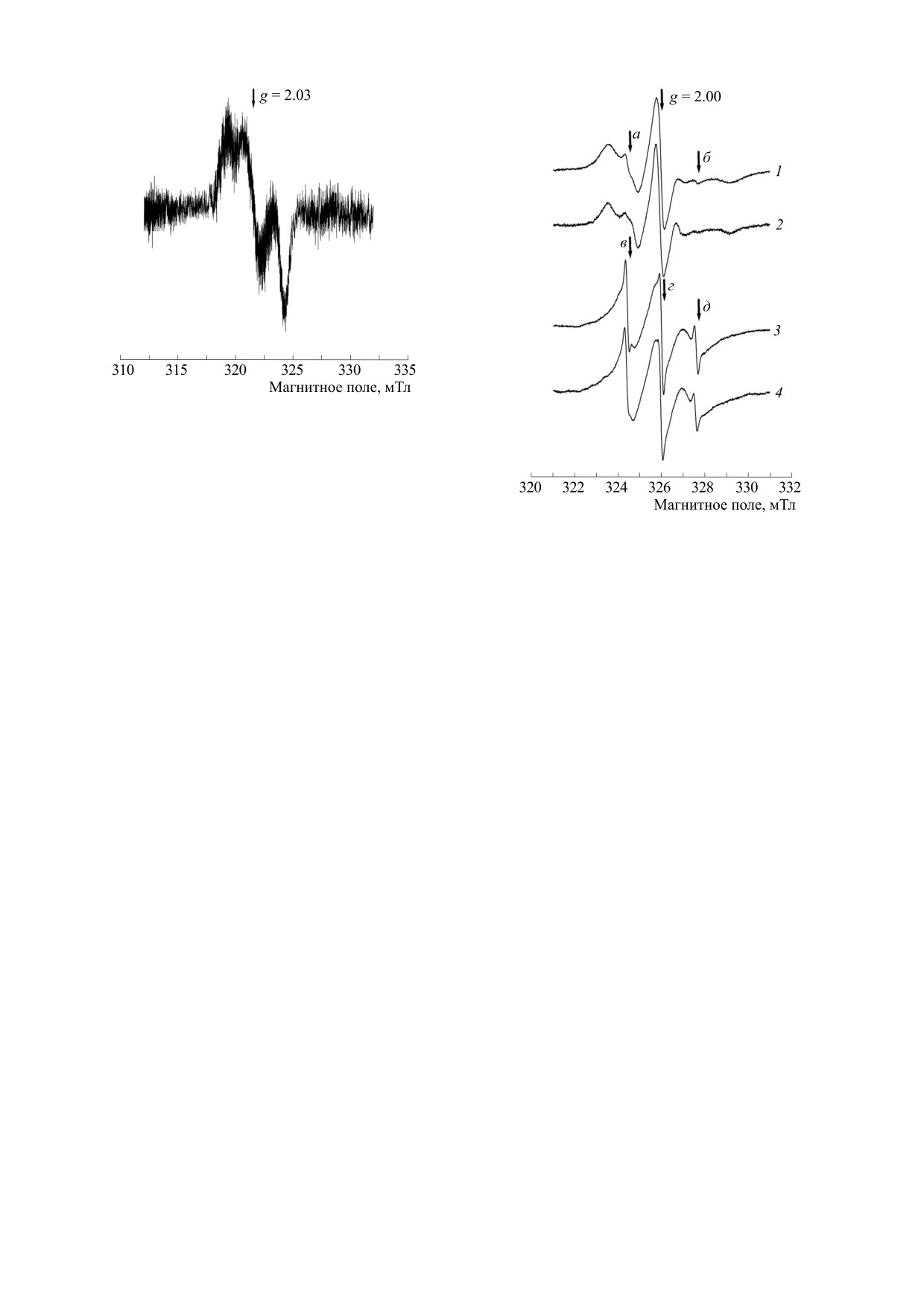
Рис. 2. Спектр ЭПР плазмы крови, полученной через
10 мин после введения ДНКЖ-Глт. Регистрация
сигнала при комнатной температуре.
ция была ниже, чем в плазме, в 10-12 раз. Анало-
гичное распределение этих комплексов с белко-
выми лигандами в компонентах крови было полу-
Рис. 3. Спектры ЭПР образцов эритроцитарной
чено нами ранее [11]. Следовательно, в результате
массы: 1 - в начале опыта, в присутствии 5-ДС; 2 -
инъекции ДНКЖ-Глт происходит формирование
через
10 мин после введения ДНКЖ-Глт, в
присутствии 5-ДС; 3 - в начале опыта, в присутствии
этих комплексов, связанных с белковыми лиган-
16-ДС; 4 - через 10 мин после введения ДНКЖ-Глт, в
дами, в плазме и эритроцитарной массе, при этом
присутствии
16-ДС. Регистрация сигналов при
моноядерные ДНКЖ с низкомолекулярными ли-
комнатной температуре.
гандами практически отсутствуют.
Необходимо отметить, что данный этап опыта
(10 мин после введения препарата ДНКЖ-Глт)
растворе, позволяло судить об изменениях заряда
может быть охарактеризован тем, что к этому мо-
на внешней поверхности мембран эритроцитов в
менту в организме уже завершена «быстрая фаза»
результате введения ДНКЖ-Глт.
гипотензивного эффекта данного препарата, ха-
рактеризуемая резким снижением среднего арте-
На рис. 3 представлены характерные спектры
риального давления с последующим его частич-
ЭПР образцов суспензии эритроцитов, получен-
ным восстановлением, и наблюдается более мед-
ных как в начале опыта, так и после введения
ленная фаза снижения давления, которая
ДНКЖ-Глт, и содержащих спиновые зонды 5-ДС
продолжается в течение более длительного вре-
или 16-ДС. Из этого рисунка видно, что сигналы
мени. В крови при этом формируется пул связан-
5-ДС (кривые 1 и 2 на рис. 3) представляли собой
ных с белками ДНКЖ, которые далее подверга-
триплет широких линий, что соответствовало за-
ются сравнительно медленному распаду с высво-
торможенному и анизотропному движению мо-
бождением NO [11,16].
лекул этого зонда в зоне плотной упаковки липи-
дов мембран эритроцитов [14,15]. Из рис. 3 также
В другой части работы исследовали действие
ДНКЖ на поведение спиновых зондов 5-ДС и
видно, что форма и ширина компонентов спек-
16-ДС, находящихся в суспензии эритроцитов. В
тров 5-ДС, а также общая ширина их сигналов,
этом случае применение данных производных
оцениваемая как расстояние между крайними
стеариновой кислоты позволяло провести анализ
экстремумами их компонентов, практически не
действия ДНКЖ, связанных с гемоглобином по
изменялись в результате введения животным
SH-группе, на динамику молекулярного движе-
ДНКЖ-Глт. Следовательно, введение этих ком-
ния в липидной фазе мембран эритроцитов. Кро-
плексов не приводило к изменениям скорости и
ме того, изменение распределения этих заряжен-
характера молекулярного движения липидов
ных зондов, встроенных в мембрану и находя-
мембран эритроцитов в области их плотной упа-
щихся за ее пределами в физиологическом
ковки.
БИОФИЗИКА том 64
№ 3
2019
498
ТИМОШИН и др.
Из рис. 3 также видно, что спектр 1 (кровь, по-
поэтому они не оказывают заметного влияния на
лученная в начале опыта и содержащая 5-ДС)
их молекулярное движение, а также подвижность
кроме широких асимметричных компонентов со-
и упорядоченность находящихся вблизи липидов
держал также небольшие компоненты, представ-
в областях их плотной и рыхлой упаковки.
ляющие собой узкие линии этого зонда в поляр-
Действие ДНКЖ-Глт, способное стимулиро-
ном окружении (компоненты а и б на рис. 3). При
вать встраивание 5-ДС и 16-ДС в мембрану эрит-
этом средняя компонента 5-ДС в водном окруже-
роцитов, можно объяснить следующим образом.
нии перекрывалась с соответствующей линией
Как известно, некоторые амфифильные препара-
этого зонда в гидрофобном микроокружении и
ты влияют на структуру и проницаемость мем-
поэтому практически не проявлялась в суммар-
бран эритроцитов [17]. Однако полученные нами
ном спектре. Из этого рисунка также видно, что
результаты свидетельствуют о том, что введение
спектр 2 (кровь, полученная после введения
ДНКЖ-Глт не оказывает заметного влияния на
ДНКЖ-Глт, содержащая 5-ДС) характеризовался
микроокружение 5-ДС и 16-ДС, локализованных
меньшей амплитудой этих узких компонентов, по
в липидной фазе мембран эритроцитов. В связи с
сравнению со спектром 1. Следовательно, в ре-
этим можно предположить, что стимулирование
зультате введения ДНКЖ-Глт стимулировалось
встраивания этих зондов в мембраны эритроци-
встраивание этого зонда в липидную фазу мем-
тов под действием исследуемых комплексов NO
браны.
связано с нитрозилированием белковых компо-
На рис. 3 представлены также характерные
нентов мембраны или изменением заряда ее
сигналы 16-ДС в образцах крови, полученных как
внешней поверхности.
в начале опыта (спектр 3), так и после введения
ДНКЖ-Глт (спектр 4). Видно, что эти спектры
Нельзя также исключить, что причиной на-
также представляют собой суперпозицию двух
блюдаемых эффектов является взаимодействие
сигналов. Присутствующий в обоих спектрах
гемоглобина с NO и его метаболитами, в резуль-
триплетный сигнал, состоящий из более широких
тате чего может происходить нитрозилирование
компонентов, как известно (см. работу [15]), со-
железа гемовых групп и SH-групп цистеиновых
ответствует зонду, локализованному в липидной
остатков гемоглобина, а также формирование
фазе мембраны эритроцитов, а три узкие линии
связанных с ними ДНКЖ [9]. Действительно, из-
(обозначенные буквами в, г, и д на рис. 3) принад-
менения молекулярного профиля и латеральной
лежат молекулам этого зонда в водном окруже-
организации молекул мембраны могут изменять
нии. Из рисунка видно, что форма и ширина ши-
распределение зарядов на ее поверхности [18]. В
роких компонентов практически не менялись в
частности, изменение потенциала мембран эрит-
результате введения ДНКЖ-Глт, что заставляет
роцитов происходит при их обработке нитритом
думать о том, что скорость молекулярного движе-
натрия, который, как и ДНКЖ, в физиологиче-
ния в середине мембраны эритроцитов, в области
ских условиях может быть источником NO, при-
рыхлой упаковки липидов, также не изменялась в
чем важную роль в этом процессе играет образо-
результате инъекции этой стабилизированной
вание связанного с мембраной гемихрома (про-
формы NO.
дукта
модификации гемоглобина)
[18].
Существенно, что в этом случае отрицательный
Из спектров 3 и 4 (рис. 3) также видно, что ам-
заряд поверхности мембраны снижается. Учиты-
плитуда узких компонентов 16-ДС, соответству-
вая то, что молекулы 5-ДС и 16-ДС, представляю-
ющих молекулам этого зонда в водном окруже-
щие собой спин-меченые аналоги стеариновой
нии, уменьшалась в результате введения ДНКЖ-
кислоты, в области физиологических значений
Глт, что может свидетельствовать о том, что дан-
рН имеют отрицательный заряд с одного конца
ный препарат стимулирует встраивание 16-ДС в
углеводородной цепи [15], можно предположить,
мембрану эритроцитов.
что изменение заряда мембраны эритроцитов в
результате действия комплексов NO будет спо-
Следовательно, введение в организм препара-
та ДНКЖ-Глт, приводящее к формированию и
собствовать встраиванию исследуемых зондов в
липидную фазу этих мембран.
накоплению в плазме и эритроцитах связанных с
белками ДНКЖ, не приводит к каким-либо изме-
Таким образом, введение в организм ДНКЖ-
нениям структурно-функциональных характери-
Глт не приводит к изменениям молекулярного
стик альбумина в плазме крови, а также молеку-
движения в гидрофобных областях альбумина в
лярной подвижности в липидной фазе мембран
плазме крови и мембран эритроцитов, но при
эритроцитов. Такой результат можно объяснить
этом стимулируется встраивание в их мембрану
тем, что молекулярная масса групп Fe+(NO+)2,
заряженных спиновых зондов, что, вероятно, яв-
связывающихся с белком, во много раз меньше,
ляется следствием изменения заряда внешней по-
чем самих тиолсодержащих белковых молекул,
верхности этих клеток.
БИОФИЗИКА том 64
№ 3
2019
ВЛИЯНИЕ ДИНИТРОЗИЛЬНЫХ КОМПЛЕКСОВ ЖЕЛЕЗА
499
Авторы выражают благодарность д. б. н.
9. K. B. Shumaev, A. A. Gubkin, V. A. Serezhenkov, et al.,
К.Б. Шумаеву за ценные советы при обсуждении
Nitric Oxide: Biol. Chem. 18, 37 (2008).
результатов.
10. Y.-J. Chen, W.-C. Ku, L.-T. Feng, et al., J. Am. Chem.
Работа выполнена при финансовой поддержке
Soc. 130 (33), 10929 (2008).
Российского фонда фундаментальных исследова-
11. A. A. Timoshin, A. F. Vanin, Ts. R. Orlova, et al., Nitric
ний, грант № 18-015-00027а.
Oxide: Biol.Chem. 16 (2), 286 (2007).
12. J. Reichenwallner and D. Hinderberger, Biochim. Bio-
phys. Acta 1830 (12), 5382 (2013).
СПИСОК ЛИТЕРАТУРЫ
13. A. A. Pavicevic, A. D. Popovic-Bijelic, M. D. Mojovic,
1.
A. F. Vanin, Nitric Oxide: Biol. Chem. 21, 1 (2009).
et al., J. Phys. Chem. B 118 (37), 10898 (2014).
2.
A. F. Vanin, A. P. Poltorakov, V. D. Mikoyan, et al., Ni-
14. K. Tsuda, Heart Vessels 31 (10), 1724 (2016).
tric Oxide: Biol. Chem. 23, 136 (2010).
15. Метод спиновых меток. Теория и применение, под
3.
Y. S. Rahmanto, D. S. Kalinowski, D. J. Lane, et al., J.
ред. Л. Берлинера (Мир, М., 1979).
Biol. Chem. 287 (10), 6960 (2012).
4.
A. F. Vanin, Nitric Oxide: Biol. Chem. 54, 156 (2016).
16. V. L. Lakomkin, A. F. Vanin, A. A. Timoshin, et al., Ni-
5.
V. D. Mikoyan, E. N. Burgova, R. R. Borodulin, et al.,
tric Oxide: Biol. Chem. 16, 413 (2007).
Nitric Oxide: Biol. Chem. 62, 1 (2017).
17. A. Alaarg, R. M. Schiffelers, W. W. van Solinge, et al.,
6.
6. А. Ф. Ванин, Биофизика 62 (4), 629 (2017).
Front Physiol.
4,
365
(2013). DOI:
10.3389/
7.
C.-H. Ke, C.-H. Chen, M.-L. Tsai, et al., J. Am.
fphys.2013.00365.
Chem. Soc. 139 (1), 67 (2017).
18. F. Tokumasu, G. A. Nardone, G. R. Ostera, et al.,
8.
K. B. Shumaev, A. L. Dudylina, M. V. Ivanova, et al.,
PLoS One 4 (6), e5828 (2009). DOI: 10.1371/jour-
BioFactors 44 (3), 237 (2018).
nal.pone.0005828.
The Influence of Dinitrosyl Iron Complexes on Physicochemical Characteristics
of Rat Blood Components
A.A. Timoshin*, V.L. Lakomkin*, and E.K. Ruuge* **
*National Medical Research Centre for Cardiology, Ministry of Health of the Russian Federation,
3-ya Cherepkovskaya ul. 15a, Moscow, 121552 Russia
**Faculty of Physics, Lomonosov Moscow State University, Leninskie gory 1, Moscow, 119991 Russia
The present research was designed to analyze the effect of dinitrosyl iron complexes with intravenous gluta-
thione as the primary ligand of these complexes in plasma on structural and conformational characteristics
of albumin and molecules of the lipid phase in the erythrocyte membrane, that constitute the microenviron-
ment of dinitrosyl iron complexes in red blood cells. We performed the analysis of EPR spectra of spin labels
such as 5- and 16-doxylstearic acid in plasma and red blood cells suspension before and after injection of di-
nitrosyl iron complexes with glutathione, It has been found that dinitrosyl iron complexes with glutathione
injected to rats had no effect on molecular motion in hydrophobic regions of albumin in plasma and red blood
cells, but herewith charged spin labels penetrated into the red blood cell membrane more effectively. Appar-
ently, it was due to a change in the charge on the outer surface of the red blood cells.
Keywords: albumin, dynamics of molecular motion, dinitrosyl iron complexes, erythrocyte membrane, spin label,
electron paramagnetic resonance
БИОФИЗИКА том 64
№ 3
2019