БИОФИЗИКА, 2019, том 64, № 3, с. 500-506
БИОФИЗИКА КЛЕТКИ
УДК 577.352.4
СОВМЕСТНОЕ ВЛИЯНИЕ ГЛЮКОЗЫ И β-ГИДРОКСИБУТИРАТА
НА МЕМБРАННЫЙ ПОТЕНЦИАЛ
ВНУТРИСИНАПТОСОМАЛЬНЫХ МИТОХОНДРИЙ
© 2019 г. Т.Г. Дубовская, С.В. Гриневич, С.В. Федорович
*Институт биофизики и клеточной инженерии НАНБ, ул. Академическая, 27, Минск, 220072, Республика Беларусь
E-mail: fedorovich@ibp.org.by
Поступила в редакцию 26.06.2017 г.
После доработки 01.10.2018 г.
Принята к публикации 18.03.2019 г.
Для лечения различных заболеваний головного мозга используется кетогенная диета, состоящая в
замене углеводов на жиры в ежедневном рационе, что приводит к образованию кетоновых тел,
прежде всего β-гидроксибутирата. Механизм ее защитного действия до сих пор неясен. В работе
изучено совместное действие глюкозы и β-гидроксибутирата на потенциалы плазматической мем-
браны и митохондрий синаптосом. Показано, что добавление кетоновых тел к глюкозосодержащей
инкубационной среде не ведет к изменению потенциала плазматической мембраны синаптосом,
как это было показано ранее для плазматической мембраны нейронов. Установлено, что при инку-
бации синаптосом в среде, содержащей только β-гидроксибутират, происходит деполяризация ми-
тохондрий (изменение ΔΨ). В то же время добавление кетоновых тел в глюкозосодержащую среду
приводит к гиперполяризации. Наблюдаемая деполяризация частично компенсируется увеличени-
ем ΔрН митохондрий, вызываемым именно деполяризацией митохондриальной мембраны, а не до-
бавлением β-гидроксибутирата. Таким образом, показано, что кетоновые тела могут использовать-
ся синапсами как энергетические субстраты, но β-гидроксибутират является менее эффективным
источником энергии, чем глюкоза.
Ключевые слова: синаптосомы, кетогенная диета, кетоновые тела, митохондрии, мембранный
потенциал, синапс.
DOI: 10.1134/S0006302919030104
недавно мы показали, что замена глюкозы на БГБ
Для лечения различных заболеваний цен-
в инкубационной среде приводит к ингибирова-
тральной нервной системы, прежде всего эпилеп-
нию эндоцитоза в пресинаптических окончаниях
сии и болезни Альцгеймера, используется кето-
нейронов, что может быть причиной антикон-
генная диета [1-3]. Суть метода состоит в том, что
вульсивного эффекта кетогенной диеты [4]. Мы
углеводы в рационе пациентов заменяются жира-
также не обнаружили какого-либо влияния кето-
ми. Жиры в печени преобразуются в кетоновые
новых тел на потенциал плазматической мембра-
тела, прежде всего в β-гидроксибутират (БГБ) и
ны [4]. В то же время в гиперполяризующее дей-
ацетоацетат, которые в дальнейшем могут ис-
ствие БГБ в нейронах наблюдалось в присутствии
пользоваться клетками мозга как энергетические
глюкозы в инкубационной среде [5]. Поэтому не-
субстраты. Основным кетоновым телом является
обходимы дополнительные эксперименты по
БГБ. Одновременно происходит снижение со-
совместному действию глюкозы и БГБ.
держания глюкозы в крови [1-3].
Ранее было установлено, что БГБ может ис-
Механизм защитного действия кетогенной ди-
пользоваться пресинаптическими окончаниями
еты до сих пор остается не совсем понятным. Бы-
нейронов в качестве энергетического субстрата и
ли предложены различные мишени для кетоно-
окисляться до СО2 [6]. В то же время остается не-
вых тел, в том числе гистондеацетилаза (эпигене-
известным, достаточно ли одних кетоновых тел,
тический механизм), потенциал плазматической
чтобы поддерживать потенциал не только плаз-
мембраны, калиевые каналы [1-3]. Кроме того,
матической мембраны, но и синаптических ми-
тохондрий. Нами было показано, что в условиях
Сокращения: БГБ - β-гидроксибутират, CCCP - карбонил-
цианид 4-(трифторметокси)фенилгидразона, DiSC3(5) -
гипогликемии митохондриальный потенциал из-
3,3’-дипропилтиадикарбоцианин.
меняется значительно сильнее, чем потенциал
500
СОВМЕСТНОЕ ВЛИЯНИЕ ГЛЮКОЗЫ И β-ГИДРОКСИБУТИРАТА
501
плазматической мембраны. Кроме того, падение
ΔΨ компенсируется увеличением ΔрН [7]. Неиз-
вестно, происходит ли то же самое в случае ис-
пользования синаптосомами кетоновых тел в ка-
честве энергетического субстрата.
В данной работе мы изучили совместное дей-
m
ствие глюкозы и БГБ на потенциал плазматиче-
ской мембраны изолированных пресинаптиче-
ских окончаний нейронов и мембранный потен-
p
циал внутрисинаптосомальных митохондрий.
В качестве объекта исследований использова-
ли синаптосомы, изолированные пресинаптиче-
ские окончания нейронов, сохраняющие основ-
Рис. 1. Схематическое изображение синаптосомы:
ные свойства интактных терминалей [8]. Они
ΔΨp - мембранный потенциал плазматической мем-
способны к экзоцитозу и эндоцитозу, поддержи-
браны, ΔΨm - мембранный потенциал митохондри-
вают потенциал плазматической мембраны и со-
альной мембраны.
держат активные митохондрии [7-9]. Мембран-
ный потенциал митохондрий является интеграль-
Выделение синаптосом. Синаптосомы изоли-
ным биофизическим показателем и достаточно
ровали из полушарий мозга крыс по методу Хайо-
полно характеризует их функциональную актив-
ша [11]. Полученный осадок суспендировали в
ность.
среде А следующего ионного состава (в мМ): Na-
Небольшие размеры синаптосом (600 нм) не
Cl - 132, KCl - 5, MgCl2 - 1,3, NaH2PO4 - 1,2,
позволяют применять электрофизиологические
глюкоза - 10, HEPES - 10, рН 7,4. В эксперимен-
методы для изучения изменений мембранного
тах по изучению влияния кетоновых тел глюкозу
потенциала, поэтому мы использовали флуорес-
замещали на 8 мМ DL-β-гидроксибутирата на-
центные зонды. В то же время следует отметить,
трия или дополнительно вносили 4 мМ DL-β-
что в отличие от высокоспециализированных
гидроксибутирата натрия к уже имеющейся в ин-
нейронов с гигантскими пресинаптическими
кубационной среде глюкозе (10 мМ). Перед экс-
окончаниями (например, биполярные нейроны
периментом суспензию синаптосом (10-20 мг/мл
сетчатки, каликс Хельда) синаптосомы представ-
белка) преинкубировали 30 мин при 37°С с соот-
ляют собой модель «усредненного» синапса и,
ветствующими энергетическими субстратами,
безусловно, результаты, полученные на этом объ-
после чего их ставили на лед и использовали в
екте, важны для понимания биофизики и физио-
эксперименте в течение 3 ч.
логии синапсов.
Определение потенциала плазматической мем-
Потенциал плазматической мембраны опре-
браны. Потенциал плазматической мембраны си-
деляли с помощью флуоресцентного зонда 3,3'-
наптосом определяли с помощью флуоресцент-
дипропилтиадикарбоцианина (DiSC3(5))
[9],
ного зонда DiSC3(5) согласно работе [12] c неко-
ΔΨ митохондрий - с помощью флуоресцентного
торыми модификациями [7,9]. Флуоресценцию
зонда родамин-123 [10], ΔрН митохондрий - с по-
измеряли на спектрофлуориметре Cary Eclipse
мощью флуоресцентного зонда акридиновый
(Varian, США) в термостатируемой кювете (37°С)
оранжевый [7]. Схематическое изображение си-
при λвозб = 640 нм, λрег = 688 нм, ширине щелей
наптосомы с обозначением изучаемых мембран и
5 нм и постоянном перемешивании. После выде-
указанием того, где и какая трансмембранная
ления синаптосомы предынкубировали в среде А
разность потенциалов измеряется, приведено на
с соответствующими энергетическими субстрата-
рис. 1.
ми 30 мин при 37°С. К 1,8 мл среды А, содержа-
щей 2 мМ СаСl2 и соответствующий энергетиче-
МАТЕРИАЛЫ И МЕТОДЫ
ский субстрат, добавляли 200 мкл суспензии си-
наптосом (до конечной концентрации белка
В работе использованы реактивы: HEPES
1 мг/мл), после чего на первой минуте инкубации
(4-(2-гидроксиэтил) пиперазин-1-этансульфоно-
в кювету вносили 1 мкМ DiSC3(5). Через две ми-
вая кислота; Merck, Германия), карбонилцианид
нуты добавляли 150 мМ KCl. В контрольном опы-
4-(трифторметокси)фенилгидразона (CCCP) (Cal-
те вносили только 150 мМ NaCl. В дальнейшем из
biochem, США), DiSC3(5), родамин-123, DL-β-
опытной кривой вычитали контрольную.
гидроксибутират натрия (Sigma, США), акриди-
новый оранжевый (Serva, Германия) Все осталь-
Определение мембранного потенциала митохон-
ные реактивы - квалификации не ниже «о.с.ч.».
дрий. Мембранный потенциал митохондрий (ΔΨ)
БИОФИЗИКА том 64
№ 3
2019
502
ДУБОВСКАЯ и др.
определяли с помощью флуоресцентного зонда
вещества изменяется от 0,1 мМ в норме до 5-
родамин-123 согласно работе [10] с некоторыми
8 мМ при голодании или кетогенной диете [3,13].
модификациями. Флуоресценцию измеряли на
В нашей прошлой работе [4] мы использовали
спектрофлуориметре Cary Eclipse (Varian, США) в
8 мМ DL-β-гидроксибутирата натрия. Так как
термостатируемой кювете (37С) при λвозб = 501 нм,
клетки могут использовать только D-изомер БГБ,
λрег = 525 нм, ширине щелей 5 нм и постоянном
то в наших экспериментах 50% этого вещества
могут использоваться митохондриями синапто-
перемешивании. После дополнительной отмыв-
сом как энергетический субстрат [4,5,15]. В каче-
ки десятикратным объемом инкубационной сре-
стве модели кетоза мы в данной работе в боль-
ды А синаптосомы ресуспендировали в 2 мл той
шинстве экспериментов использовали добавле-
же среды. К полученной суспензии добавляли
ние в стандартную инкубационную среду 4 мМ
10 мкМ флуоресцентного зонда родамин-123. Да-
DL-β-гидроксибутирата натрия, так как она
лее суспензию инкубировали 15 мин при 37°С. От
уже содержит другой энергетический субстрат
избытка зонда синаптосомы отмывали десяти-
глюкозу.
кратным объемом среды А. Далее синаптосомы
ресуспендировали в средах с различными пита-
Ранее было предложено, что одним из защит-
тельными субстратами и инкубировали 30 мин
ных механизмов действия кетогенной диеты яв-
при 37°С в темноте. Перед началом кинетических
ляется гиперполяризация плазматической мем-
измерений суспензии уравновешивали на льду
браны [5]. Нами было показано, что в синаптосо-
10 мин и использовали в эксперименте в течение
мах замена глюкозы на кетоновые тела в
одного-двух часов.
инкубационной среде способна компенсировать
деполяризацию плазматической мембраны, ин-
В кювету с 1,8 мл инкубационной среды А, со-
дуцированную гипогликемией [2,4]. В то же вре-
держащей 2,0 мМ СaCl2 и соответствующий ин-
мя мы не наблюдали гиперполяризацию [4]. Мы
кубационный субстрат, добавляли 200 мкл сус-
проверили гипотезу, что для этого эффекта необ-
пензии синаптосом (до конечной концентрации
ходимо совместное действие глюкозы и кетоно-
белка 1 мг/мл). Через одну минуту добавляли
вых тел.
10 мкМ СССР. В контрольном опыте добавляли
0,1% растворителя диметилсульфоксида. В даль-
Потенциал плазматической мембраны синап-
нейшем из опытной кривой вычитали кон-
тосом, как и потенциал нейронов, определяется
трольную.
прежде всего калиевым равновесным потенциа-
лом [16]. Поэтому увеличение экстраклеточной
Определение ΔрН митохондрий. ΔрН митохон-
концентрации калия до значений его внутрикле-
дрий определяли с помощью флуоресцентного
точной концентрации приводит к немедленной
зонда акридиновый оранжевый согласно работе
деполяризации плазматической мембраны [7,16].
[7]. Флуоресценцию измеряли на спектрофлуо-
Рис. 2а показывает, что калиевая деполяризация
риметре Cary Eclipse (Varian, США) в термостати-
приводит к увеличению флуоресценции DiSC3(5)
руемой кювете (37°С) при λвозб = 494 нм, λрег =
в суспензии синаптосом. Таким образом, этот
529 нм, ширине щелей 5 нм и постоянном пере-
зонд отражает изменения потенциала плазмати-
мешивании. После выделения синаптосомы
ческой мембраны синаптосом. Рис. 2б показыва-
предынкубировали в среде А с соответствующи-
ет, что инкубация в среде, содержащей как глю-
ми энергетическими субстратами 30 мин при
козу, так и кетоновые тела не ведет к гиперполя-
37°С. К 1,8 мл такой же инкубационной среды с
ризации синаптосомальной плазматической
2,0 мМ СaCl2 добавляли 200 мкл суспензии си-
мембраны.
наптосом (до конечной концентрации белка
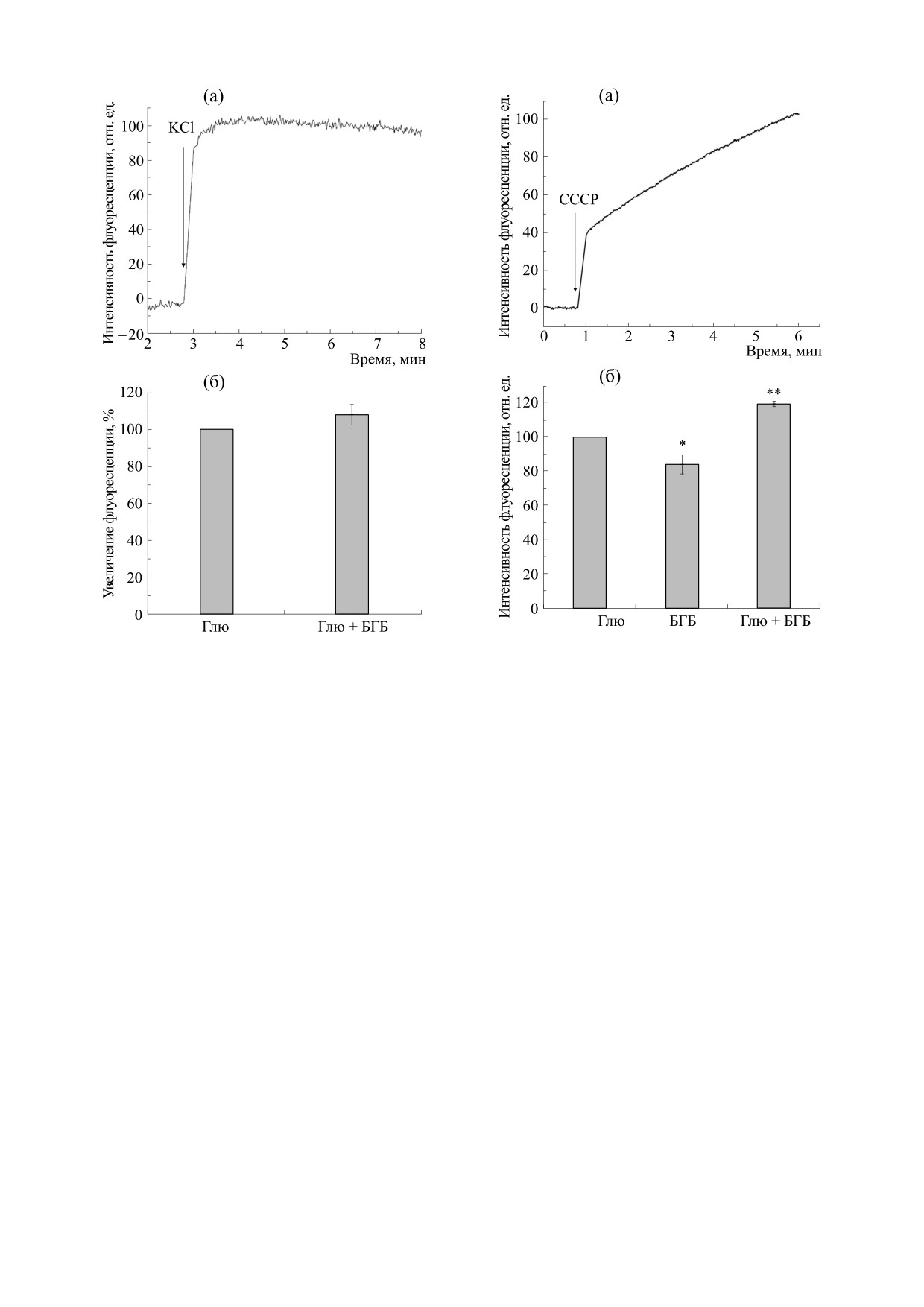
Рис. 3а показывает, что протонный ионофор
1 мг/мл), через 1 мин в кювету вносили 5 мкМ ак-
СССР, диссипирующий мембранный потенциал
ридинового оранжевого. На десятой минуте ин-
митохондрий, увеличивает флуоресценцию рода-
кубации добавляли 10 мкМ СССР. В контроль-
мин-123 в суспензии синаптосом. Таким обра-
ном опыте добавляли 0,1% диметилсульфоксида.
зом, этот зонд отражает изменения ΔΨ внутриси-
В дальнейшем из опытной кривой вычитали кон-
наптосомальных митохондрий. Замещение глю-
трольную.
козы на БГБ в инкубационной среде приводит к
Концентрацию белка определяли методом Ло-
деполяризации митохондрий по сравнению с
ури [13] c использованием бычьего сывороточно-
контрольной
глюкозосодержащей
средой
го альбумина как стандарта.
(рис. 3б). Сходную и даже более выраженную де-
поляризацию внутрисинаптосомальных мито-
хондрий мы наблюдали при полном удалении
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
глюкозы из инкубационной среды [7]. В то же
БГБ составляет 70% всех кетоновых тел, син-
время в среде, содержащей и глюкозу и кетоно-
тезируемых в печени [14]. Концентрация этого
вые тела, наблюдается гиперполяризация
БИОФИЗИКА том 64
№ 3
2019
СОВМЕСТНОЕ ВЛИЯНИЕ ГЛЮКОЗЫ И β-ГИДРОКСИБУТИРАТА
503
Рис. 3. Влияние различных энергетических субстра-
Рис. 2. Влияние различных энергетических субстра-
тов на мембранный потенциал (ΔΨ) внутрисинапто-
тов на потенциал плазматической мембраны синап-
сомальных митохондрий. (а) - Ответ флуоресцентно-
го зонда родамин-123 в суспензии синаптосом на
тосом. (а) - Ответ флуоресцентного зонда DiSC3(5) в
протонный ионофор СССР; стрелкой отмечен мо-
суспензии синаптосом на калиевую деполяризацию;
мент ввода в кювету 10 мкМ СССР. Представленная
стрелкой отмечен момент ввода в кювету 150 мМ KCl.
репрезентативная кривая отражает результаты вось-
Представленная репрезентативная кривая отражает
ми независимых измерений. (б) - Влияние кетоно-
результаты шести независимых измерений. (б) -
вых тел на мембранный потенциал внутрисинаптосо-
мальных митохондрий: Глю - инкубационная среда
Влияние кетоновых тел на потенциал плазматиче-
содержала 10 мМ глюкозы, БГБ - инкубационная
ской мембраны синаптосом: Глю - инкубационная
среда содержала 8 мМ БГБ, Глю + БГБ - инкубаци-
среда содержала 10 мМ глюкозы, Глю + БГБ - инку-
онная среда содержала 10 мМ глюкозы + 4 мМ БГБ.
бационная среда содержала 10 мМ глюкозы + 4 мМ
За 100% принято увеличение флуоресценции после
БГБ. За 100% принято увеличение флуоресценции
добавки 10 мкМ СССР за 4 мин в контрольной глю-
козосодержащей среде. * - P ≤ 0,05 по отношению к
после добавки 150 мМ КСl за 4 мин в контрольной
контролю (ответ на СССР в контрольной глюкозо-
глюкозосодержащей среде. Представлены средние
содержащей среде); ** - P ≤ 0,01 по отношению к
значения восьми экспериментов
± стандартная
контролю (ответ на СССР в контрольной глюкозо-
ошибка среднего.
содержащей среде). Представлены средние значения
14 экспериментов ± стандартная ошибка среднего.
(рис. 3б), связанная, вероятно, с дополнитель-
ным поступлением ацетильных групп в цикл
Как известно, протондвижущая сила митохон-
Кребса. Таким образом, наши результаты пока-
дрий (ΔμH+) определяется мембранным потен-
зывают, что синаптические митохондрии могут
циалом (ΔΨ) и рН-градиентом (ΔрН) [17]. Ранее
использовать как глюкозу, так и кетоновые тела
мы показали, что в случае гипогликемии в синап-
для поддержания мембранного потенциала. Од-
тических митохондриях деполяризация (измене-
нако последние являются менее эффективными
ние ΔΨ) компенсируется увеличением ΔрН, что,
энергетическими субстратами для синапсов.
вероятно, позволяет поддерживать ΔμH+ на уров-
БИОФИЗИКА том 64
№ 3
2019
504
ДУБОВСКАЯ и др.
пенсаторном увеличении рН градиента в синап-
тических митохондриях при гипогликемии. Мы
наблюдали также деполяризацию (изменение
ΔΨ) при полной замене глюкозы на БГБ в инку-
бационной среде (рис. 3б). Остается неизвест-
ным, компенсируется ли оно увеличением ΔрН.
Для оценки ΔрН мы использовали флуорес-
центный зонд акридиновый оранжевый [7]. Это
соединение концентрируется в кислых органел-
лах клетки, где флуоресценция зонда тушится. В
пресинаптических окончаниях нейронов низкие
значения рН наблюдаются в синаптических вези-
кулах, лизосомах и межмембранном простран-
стве митохондрий. При диссипации градиента
происходит увеличение флуоресценции. Обычно
предполагается, что в синаптосомах акридино-
вый оранжевый концентрируется исключительно
в синаптических везикулах и поэтому он исполь-
зуется для оценки экзоцитоза и эндоцитоза
[4,7,19]. В то же время мы показали, что флуорес-
ценция этого зонд также может увеличиваться и в
ответ на митохондриальные токсины [7]. Вероят-
но, его часть (по нашим оценкам в норме около
20% [4]) концентрируется в межмембранном про-
странстве внутрисинаптосомальных митохон-
дрий, где рН ниже цитозольного [7,20]. По оцен-
кам, сделанным в работе [20], рН межмембранно-
го пространства митохондрий составлял 6,88 при
рН цитозоля 7,59. По нашим оценкам рН цитозо-
ля синаптосом составляет 7,15 [21], что несколько
ниже, чем в клетках ECV304, использованных в
работе [20].
Рис. 4а показывает, что протонный ионофор
Рис. 4. Влияние различных энергетических субстра-
тов на ΔрН внутрисинаптосомальных митохондрий.
СССР вызывает увеличение флуоресценции ак-
(а) - Ответ флуоресцентного зонда акридиновый
ридинового оранжевого. Следует отметить, что
оранжевый в суспензии синаптосом на протонный
ионофор СССР; стрелкой отмечен момент ввода в
фактически это объединенный ответ митохон-
кювету 10 мкМ СССР. Представленная репрезента-
дрий и синаптических везикул, так как СССР
тивная кривая отражает результаты восьми независи-
диссипирует также потенциал синаптических ве-
мых измерений. (б) - Влияние кетоновых тел на
зикул [7,22]. В то же время ранее мы показали, что
ΔрН внутрисинаптосомальных митохондрий: Глю -
инкубационная среда содержала 10 мМ глюкозы,
накопление акридинового оранжевого синапти-
БГБ - инкубационная среда содержала 8 мМ БГБ,
ческими везикулами при переходе синаптосом на
Глю(5) + БГБ - инкубационная среда содержала
кетоновые тела в качестве энергетического суб-
5 мМ глюкозы + 4 мМ БГБ, Глю(10) + БГБ - инкуба-
страта не изменяется [4]. Поэтому все изменения
ционная среда содержала 10 мМ глюкозы + 4 мМ
БГБ. За 100% принято увеличение флуоресценции
ответа на СССР в данном случае можно интер-
после добавки 10 мкМ СССР за 5 мин в контрольной
претировать как изменения ΔрН митохондрий.
глюкозосодержащей среде. ** - P ≤ 0,01 по отноше-
нию к контролю (ответ на СССР в контрольной глю-
Рис. 4б показывает, что полная замена глюко-
козосодержащей среде). Представлены средние зна-
зы на 8 мМ БГБ приводит к почти двукратному
чения 16 экспериментов ± стандартная ошибка сред-
увеличению накоплению акридинового оранже-
него.
вого в СССР-чувствительном пуле синаптосом.
Это довольно выраженный эффект, однако в слу-
чае полной гипогликемии он был еще сильнее [7].
не, необходимом для синтеза АТФ [7]. Молеку-
Добавление даже половины от концентрации
лярная природа этого явления не ясна. Недавно
глюкозы в контрольных экспериментах к БГБ-
было показано, что митохондриальный белок
содержащей инкубационной среде приводит к
L-OPA1 обеспечивает колебания рН митохон-
значительному снижению СССР-чувствительно-
дрий при изменениях ΔΨ [18]. Вполне возможно,
го накопления акридинового оранжевого
что сходный механизм задействован и при ком-
(рис. 3б). Нам не удалось обнаружить различий в
БИОФИЗИКА том 64
№ 3
2019
СОВМЕСТНОЕ ВЛИЯНИЕ ГЛЮКОЗЫ И β-ГИДРОКСИБУТИРАТА
505
ΔрН внутрисинаптосомальных митохондрий при
живать все функции синапсов ([4], также см.
их инкубации в средах, содержащих 10 мМ глю-
рис. 2б в данной статье). Ранее уже высказыва-
козы или 10 мМ глюкозы + 4 мМ БГБ (рис. 3б).
лось предположение, что кетоновые тела могут
Таким образом, наши результаты показывают,
давать энергию для основных функций нейрона,
что деполяризация митохондрий частично ком-
но не так эффективны в поддержании синаптиче-
пенсируется увеличением ΔрН при переходе си-
ской трансмиссии, как глюкоза [25]. Таким обра-
наптосом на использование кетоновых тел в каче-
зом, можно предположить, что «контролируемый
стве энергетического субстрата. Так как этот эф-
гипометаболизм», возникающий при кетогенной
фект блокировался добавлением глюкозы в БГБ-
диете в синапсах, способен обеспечивать энерги-
содержащую инкубационную среду, то можно
ей основные функции нейрона в покое, но не
предположить, что он связан именно с деполяри-
способен удовлетворить повышенные энергети-
зацией (изменением ΔΨ), а не влиянием кетоно-
ческие потребности, возникающие в синапсах
вых тел или продуктов его метаболизма на мито-
при судорогах [26,27], что может приводить к пре-
хондрии.
кращению неконтролируемого освобождения
В итоге в данной работе, в продолжение
нейромедиаторов с последующим выходом из
эпилептического припадка.
предыдущей [4], мы показали, что кетоновое тело
БГБ приводит к следующим изменениям в синап-
Работа выполнена при финансовой поддержке
тосомах:
Белорусского республиканского фонда фунда-
Замена глюкозы на БГБ ведет к деполяризации
ментальных исследований (грант № Б17-006).
митохондрий (изменению ΔΨ) и увеличению
ΔрН митохондрий при сохранении неизменным
СПИСОК ЛИТЕРАТУРЫ
потенциала плазматической мембраны. Добавле-
1.
L. B. Gano, M. Patel, and J. M. Rho, J. Lipid Res. 55,
ние БГБ в глюкозосодержащую среду ведет к ги-
2211 (2014).
перполяризации митохондрии (изменению ΔΨ)
2.
S. V. Hrynevich, T. V. Waseem, and S. V. Fedorovich,
при сохранении неизменными ΔрН митохондрий
Int. J. Neurol. Res. 2, 285 (2016).
и потенциала плазматической мембраны.
3.
L. B. Achanta and C. D. Rae, Neurochem. Res. 42, 35
Для изучения данных показателей мы исполь-
(2017).
зовали
потенциал-чувствительные
зонды
4.
S. V. Hrynevich, T. V. Waseem, A. Hebert, et al., Neu-
DiSC3(5) и родамин-123, а также рН-чувстви-
rochem. Int. 93, 73 (2016).
тельный зонд акридиновый оранжевый. Специ-
5.
C. D. Holmgren, M. Mukhtarov, A. E. Malkov, et al.,
фичность ответа определялась не только специ-
J. Neurochem. 112, 900 (2010).
фичностью и даже не столько специфичностью
6.
M. C. McKenna, J. T. Tildon, J. H. Stevenson, et al.,
зонда, сколько специфичностью стимула, позво-
Dev. Neurosci. 15, 320 (1993).
ляющего зондам освободиться из различных ком-
7.
S. V. Hrynevich, T. G. Pekun, T. V. Waseem, et al,
партментов синаптосом. Потенциал плазматиче-
Neurochem. Res. 40, 1188 (2015).
ской мембраны определяется калиевым равно-
8.
B. G. Wilhelm, S. Mandad, S. Truckenbrodt, et al.,
весным потенциалом, и мы освобождали
Science 344, 1023 (2014).
накопившийся DiSC3(5) с помощью высокой
9.
T. V. Waseem and S. V. Fedorovich, Neurochem. Res.
концентрации экстраклеточного калия. Мито-
35, 1188 (2010).
хондриальный потенциал определяется, согласно
10.
A. V. Alekseenko, V. V. Lemeshchenko, T. G. Pekun,
теории Митчелла, протонным градиентом, по-
et al., Neurosci. Lett. 513, 238 (2012).
этому мы освобождали родамин-123 из внутриси-
11.
F. Hajos, Brain Res. 93, 485 (1975).
наптосомальных митохондрий при помощи про-
12.
S. B. Hladky and T. J. Rink, J. Physiol. 263, 287 (1976)
тонного ионофора СССР. Специфичность раз-
13.
O. Lowry, H. Rosenbrough, H. Farr, et al., J. Biol.
личных потенциалчувствительных зондов к
Chem. 193, 265 (1951).
различным компартментам клетки носит, без-
14.
E. N. Dedkova and L. A. Blatter, Front. Physiol. 5, 260
условно, довольно относительный характер [23],
(2014).
тем не менее, было продемонстрировано преиму-
15.
Y. C. Tsai, Y. C. Chou, A. B. Wu, et al., Life Sci. 78,
щественное накопление родамина-123 в мито-
1385 (2006).
хондриях [24].
16.
M. P. Blaustein and J. M. Goldring, J. Physiol. 247, 589
Мы показали, что БГБ может использоваться
(1975).
пресинаптическими окончаниями нейронов в
17.
R. Rizzuto, D. De Stefani, A. Raffaello, et al., Nature
качестве энергетического субстрата. В то же вре-
Rev. Mol. Cell. Biol. 13, 566 (2012).
мя кетоновые тела в концентрациях, близким к
18.
M. Rosselin, J. Santo-Domingo, F. Bermont, et al.,
тем, что наблюдаются при кетоновой диете, явля-
EMBO Rep. 18, 451 (2017).
ются менее эффективными по сравнению с глю-
19.
F. Zoccarato, L. Cavallini, and A. Alexandre, J. Neuro-
козой и, вероятно, могут не полностью поддер-
chem. 72, 625 (1999).
БИОФИЗИКА том 64
№ 3
2019
506
ДУБОВСКАЯ и др.
20. A. M. Porcelli, A. Ghelli, C. Zanna, et al., Biochem.
24. L. V. Johnson, M. L. Walsh, and L. B. Chen, Proc.
Biophys. Res. Comm. 326, 799 (2005).
Natl. Acad Sci. USA 77, 990 (1991).
21. T. G. Pekun, V. V. Lemeshchenko, T. I. Lyskova, et al.,
25. T. Arakawa, T. Goto, and Y. Okada, Neurosci. Lett.
J. Mol. Neurosci. 57, 454 (2013).
130, 53 (1991).
22. J. W. Hell, P. R. Maycox, and R. Jahn, J. Biol. Chem.
26. V. Rangaraju, N. Calloway, and T. A. Ryan, Cell 156,
265, 2111 (1990).
825 (2014).
23. Т. Г. Пекун, Т. В. Васим и С. В. Федорович,
27. G. Zsurka and W.S. Kunz, Lancet Neurol. 14, 956
Биофизика 59, 100 (2014).
(2015).
The Combined Influence of Glucose and β-Hydroxybutyrate on Membrane Potential
of Intrasynaptosomal Mitochondria
T.G. Dubouskaya, S.V. Hrynevich, and S.V. Fedorovich
Institute of Biophysics and Cell Engineering, National Academy of Sciences of Belarus,
ul. Akademicheskaya, 27, Minsk, 220072, Belarus
A ketogenic diet is used as a treatment for different brain diseases. This diet aims to replace carbohydrates with
fat throughout the day so ketone bodies, the predominant one is β-hydroxybutyrate, are produced. The
mechanism of the protective effect of the ketonic diet remains poorly studied. We investigate the combined
influence of glucose and β-hydroxybutyrate on synaptosomal plasma and mitochondrial membrane poten-
tials. We have shown that the presence of ketone bodies in a glucose-containing incubation medium causes
no alterations in synaptosmal plasma membrane potential as it was previously demonstrated for the neuronal
plasma membrane. It has been found that mitochondrial depolarization (ΔΨ changes) occurs during incuba-
tion of synaptosomes in the medium only with β-hydroxybutyrate. In contrast, the presence of ketone body
in the glucose-containing incubation medium leads to mitochondria hyperpolarization. The observed depo-
larization is partially compensated by mitochondrial ΔpH increase induced by mitochondrial depolarization
but not because of the presence of β-hydroxybutyrate. We have shown that ketone bodies can be used by syn-
apses as energetic substrates, but β-hydroxybutyrate used as an energy source is less effective than glucose.
Keywords: synaptosomes, ketogenic diet, ketone bodies, mitochondria, membrane potential, synapse
БИОФИЗИКА том 64
№ 3
2019