БИОФИЗИКА, 2019, том 64, № 3, с. 544-551
БИОФИЗИКА КЛЕТКИ
УДК 577.344.3:577.152.634
МОДИФИКАЦИЯ РЕДОКС-ПРОЦЕССОВ В КЛЕТКАХ ГЛИОМЫ С6
ПРОДУКТОМ ДЕСТРУКЦИИ СФИНГОЛИПИДОВ 2-ГЕКСАДЕЦЕНАЛЕМ
© 2019 г. Н.В. Амаэгбери*, Г.Н. Семенкова*, А.Г. Лисовская* **,
З.Б. Квачева***, О.И. Шадыро*
*Белорусский государственный университет, 220030, Минск, просп. Независимости, 4, Беларусь
**Университет Нотр-Дам, 46556 Нотр-Дам, Индиана, США
***Институт биофизики и клеточной инженерии НАН Беларуси, 220072, Минск, ул. Академическая, 27, Беларусь
E-mail: galina_semenkova@yahoo.com
Поступила в редакцию 22.01.2019 г.
После доработки 22.01.2019 г.
Принята к публикации 18.02.2019 г.
2-Гексадеценаль - ненасыщенный альдегид, который образуется при свободнорадикальной де-
струкции сфинголипидов в условиях оксидативного стресса и проявляет биологическую актив-
ность посредством ингибирования пролиферации и индуцирования апоптоза. Представлены ре-
зультаты исследования модифицирующего влияния этого альдегида на редокс-процессы, протека-
ющие в клетках глиомы крысы С6. Показано, что культивирование клеток с 2-гексадеценалем в
концентрациях от 3,5 до 35 мкмоль/л приводит к значительному увеличению, а при более высоких
концентрациях - снижению выхода индуцируемых менадионом супероксидных анион-радикалов.
Выявлено, что дополнительная продукция О2·- при действии 2-гексадеценаля на клетки полностью
подавляется в присутствии ингибиторов стресс-активируемых МАП-киназ, участвующих в запуске
апоптоза, таких как JNK, p38 и ERK1/2. Модифицирующие эффекты 2-гексадеценаля начинают
проявляться на ранних стадиях его взаимодействия с клетками, что проявляется в увеличении про-
дукции супероксидных анион-радикалов митохондриями и уменьшении внутриклеточного уровня
восстановленного глутатиона. Предположено, что модификация редокс-состояния клеток С6 явля-
ется начальным этапом процесса внутриклеточной сигнализации, в котором 2-гексадеценаль игра-
ет роль сигнальной молекулы.
Ключевые слова: 2-гексадеценаль, сфинголипиды, активные формы кислорода, клетки глиомы крысы С6,
митохондрии, глутатион.
DOI: 10.1134/S0006302919030153
церамидом и С1Ф в сторону образования одного
Сфинголипиды широко распространены в
мозге и представляют класс липидов, содержа-
из этих сфинголипидов является ключевым фак-
тором, определяющим судьбу клетки [3]. Измене-
щих фрагмент аминоспирта, среди которых наи-
более часто встречается сфингозин. Эти соедине-
ние содержания С1Ф в клетках приводит к моди-
ния участвуют в формировании мембранных
фикации их функций и развитию таких патологи-
структур, опосредуют в организме процессы меж-
ческих состояний, как диабет, атеросклероз,
клеточных коммуникаций, осуществляют ли-
остеопороз, рак. В частности, при раке простаты,
ганд-рецепторные взаимодействия [1]. Выполняя
поджелудочной железы, желудка, молочной же-
роль сигнальных молекул, сфинголипиды регу-
лезы, глиоме С1Ф способствует росту опухоли и
лируют ряд важных клеточных функций. Так,
метастазированию [4]. Количество С1Ф контро-
сфингозин и церамид индуцируют в клетках
лируется в организме сфингозинкиназами 1 и 2
апоптоз, в то время как их фосфорилированные
(2.7.1.91), фосфорилирующими сфингозин, и
производные сфингозин-1-фосфат (С1Ф) и цера-
сфингозин-1-фосфат-лиазой (4.1.2.273), которая
мид-1-фосфат способствуют росту и выживаемо-
катализирует деструкцию С1Ф с образованием
сти клеток [2]. Согласно концепции «сфинголи-
ненасыщенного алифатического альдегида
-
пидного реостата», смещение равновесия между
2-гексадеценаля (2-ГД). В то же время нами и
другими авторами установлен неферментатив-
Сокращения: 2-ГД - 2-гексадеценаль, АФК - активные ный путь образования 2-ГД при действии γ-, УФ-
формы кислорода, ФБР - фосфатный буферный раствор,
PI - иодид пропидиума, GSH - восстановленный глута-
излучения и HOCl на ряд сфинголипидов, таких
тион.
как cфингозин, сфингозин-1-фосфохолин, С1Ф
544
МОДИФИКАЦИЯ РЕДОКС-ПРОЦЕССОВ В КЛЕТКАХ ГЛИОМЫ С6
545
и др. [5-8]. Показано, что действие на клетки
5,4 ммоль/л KCl, 0,9 ммоль/л NaH2PO4 · H2O,
глиомы HOCl, продуцируемой в галогенирую-
0,8 ммоль/л MgSO4 · 7H2O, 1,8 ммоль/л CaCl2,
щем цикле миелопероксидазы, индуцирует сво-
26,2 ммоль/л NaHCO3, 5,6 ммоль/л глюкозы.
боднорадикальную деструкцию сфинголипидов с
образованием 2-ГД [8].
Приготовление дисперсий
2-гексадеценаля.
2-ГД синтезировали по методу, описанному в ра-
Биологическая роль 2-ГД практически не изу-
боте [14]. Полученный альдегид растворяли в
чена. Saba и соавторы показали, что 2-ГД прояв-
смеси хлороформ/метанол (соотношение 2 : 1, по
ляет биологическую активность посредством ре-
объему). Растворитель на роторном испарителе и
организации цитоскелета и индуцирования апо-
птоза по JNK-зависимому механизму в клетках
выдерживали в токе азота для полного удаления
HeLa, HEK293T, NIH3T3 [9]. Обладая высокой
растворителя. 2-ГД растворяли в ФБР, содержа-
реакционной способностью, этот ненасыщенный
щем 0,18% БСА и 150 ммоль/л хлорида натрия при
альдегид взаимодействует с белками, углеводами,
энергичном встряхивании, а затем обрабатывали
нуклеиновыми кислотами. Выявлено, что 2-ГД
на ультразвуковой бане Bandelin Sonorex (35 кГц,
образует конъюгаты с глутатионом и аддукты с
60/120 Вт) в течение трех минут. Концентрация
аминокислотами и белками. Такие продукты бы-
2-ГД в рабочем растворе составляла 35 ммоль/л
ли обнаружены в лизатах клеток HepG2, которые
[9].
предварительно инкубировали с 2-ГД. [10]. Этот
Культура клеток глиомы крысы линии С6. Пере-
альдегид вступает в реакции с дезоксигуанозином
виваемая линия клеток глиомы крысы С6 получе-
и ДНК, с образованием циклического аддукта,
на из коллекции культур клеток Института цито-
что может приводить к мутагенным последствиям
логии, г. Санкт-Петербург. Клетки (70 тыс/мл)
[11].
культивировали в питательной среде ДМЕМ,
Ранее нами установлено, что 2-ГД вызывает
обогащенной L-глютамином, NaHCO3 и HEPES,
снижение пролиферативной и митотической ак-
с добавлением 10 % сыворотки плодов коров
тивности клеток глиомы крысы С6, вызывая из-
и 100 мкг/мл гентамицина. В опытах использова-
менение динамики митоза, модифицируя цитос-
ли двухсуточную культуру, после образования 80-
келет и индуцируя апоптоз. Было также показа-
90 % монослоя.
но, что в процессы регуляции пролиферативной
Определение жизнеспособности клеток. Жизне-
активности клеток глиомы при действии 2-ГД во-
способность клеток определяли флуоресцентным
влечены стресс-активируемые МАП-киназы [12,
13]. Исходя из этого, мы предположили, что сни-
методом с использованием иодида пропидиума
жение пролиферативной активности при дей-
(PI) на спектрофлуориметре (СМ 2203 «Солар»,
ствии 2-ГД на клетки С6 сопряжено с изменени-
Беларусь) [15]. К образцам клеточных культур до-
ем протекающих в них редокс-процессов, обу-
бавляли ФБР, содержащий
0,18
% БСА и
словленных образованием активных форм
150 ммоль/л хлорида натрия (контроль) или 2-ГД
кислорода (АФК). Подтверждение этого предпо-
в диапазоне концентраций 0,1-350 мкмоль/л и
ложения и явилось целью настоящей работы. В
культивировали клетки в течение 24 ч. После это-
связи с этим, нами изучена модификация способ-
го клеточный монослой дважды промывали ФБР,
ности клеток глиомы крысы С6 генерировать
переводили клетки в суспензию и вносили рас-
АФК после обработки 2-ГД, установлено влия-
твор PI в концентрации 1 мкмоль/л. Образцы пе-
ние на этот процесс ряда специфических ингиби-
ремешивали в течение 5 мин и измеряли интен-
торов стресс-активируемых МАП-киназ, а также
сивность флуоресценции Fd1 (λвозб = 530 нм,
определено изменение продукции О2·- митохон-
λрег = 640 нм). Затем клетки разрушали с помо-
дриями и уровня восстановленного глутатиона в
щью 10 % раствора тритон Х-100 и регистрирова-
цитоплазме на ранних стадиях действия этого не-
ли интенсивность флуоресценции Ft1. Жизнеспо-
насыщенного альдегида.
собность клеток рассчитывали по формуле (1):
МАТЕРИАЛЫ И МЕТОДЫ
(F
t1
−
F
t2
)
−
(F
d1
−
F
d2
)
⋅100%
(1)
Материалы. Питательная среда ДMEM, сыво-
(
F
−
F
)
t1
t
2
ротка плодов коров, SP600125, SB202190,
PD98059, MitoSOX Red, монохлоробиман (MCB),
где Fd2 и Ft2 - параметры интенсивности флуо-
иодида пропидиум, бычий сывороточный альбу-
ресценции PI и тритон Х-100 в ФБР соответ-
мин (БСА), тритон Х-100, менадион, люцигенин,
ственно.
(Sigma, St. Louis, MO, USA), гентамицин, фос-
фатный буферный раствор (pH 7,4) (ФБР), Ана-
Изучение генерации супероксидных анион-ради-
лиз X (Минск, Беларусь). Сбалансированный бу-
калов клетками. Образование супероксидных
ферный солевой раствор (СБСР) Эрла собствен-
анион-радикалов клетками оценивали хемилю-
ного приготовления включал 116,2 ммоль/л NaCl,
минесцентным методом с применением в каче-
БИОФИЗИКА том 64
№ 3
2019
546
АМАЭГБЕРИ и др.
Жизнеспособность клеток С6 при действии 2-гексаде-
ФБР, переводили в суспензию и инкубировали с
ценаля
1,25 мкмоль/л MitoSOX Red в течение 20 мин. За-
тем клетки дважды отмывали ФБР, добавляли
Жизнеспособность
Концентрация 2-ГД, мкмоль/л
контрольный раствор либо 2-ГД в диапазоне кон-
клеток С6, %
центраций 0,1-350 мкмоль/л, инкубировали в те-
чение 40 мин при 37°С и регистрировали флуо-
0 (контроль)
100 ± 2,1
ресценцию. Генерацию О2·- в образце, содержа-
10
99,01 ± 1,9
щем контрольный раствор, принимали равной
35
99,74 ± 3,2
100%.
Определение уровня восстановленного глутати-
75
98,43 ± 2,4
она в клетках. Уровень восстановленного глутати-
она (GSH) в клетках С6 определяли с помощью
100
96,76 ± 2,6
флуоресцентного зонда монохлоробимана (MCB,
350
62,82 ± 1,5**
λвозб = 390 нм, λрег = 480 нм). К клеткам добавля-
ли контрольный раствор либо 2-ГД в диапазоне
Примечание. Время культивирования с 2-ГД составляло 24 ч.
концентраций 0,1-350 мкмоль/л и инкубировали
Измерения проводили с использованием PI (λвозб = 530 нм,
в течение 30 или 60 мин, либо 4 ч при 37°С. Полу-
λрег
= 640 нм). Результаты представлены как среднее
значение ± стандартное отклонение (n = 3), ** - P < 0.01 по
ченный монослой промывали ФБР, клетки пере-
сравнению с контролем.
водили в суспензию и инкубировали с
10 мкмоль/л MCB в течение 30 мин при 37°С, за-
тем дважды промывали ФБР и регистрировали
стве эмиттера свечения люцигенина при темпера-
флуоресценцию. Результаты представлены как
туре 37°С и рН 7,4 на установке для регистрации
отношение уровня GSH в клетках в присутствии
слабых световых потоков БХЛ-1 (БГУ, Беларусь)
2-ГД к уровню GSH в контрольном образце.
с использованием системы получения и обработ-
Статистическая обработка результатов. Для
ки информации «Unichrom» (Новые аналитиче-
статистической обработки результатов использо-
ские системы, Беларусь) [16]. Измерение люци-
вали однофакторный дисперсионный анализ
генинопосредованной
хемилюминесценции
(one-way ANOVA). Отличия между контрольной и
(ЛюцХЛ) проводили в сбалансированном буфер-
экспериментальными группами анализировали с
ном солевом растворе (СБСР) Эрла. В образцы
помощью теста Даннета. Результаты представле-
клеточных культур вносили контрольный рас-
ны как среднее значение трех и более независи-
твор либо
2-ГД в концентрациях от
0,1 до
мых экспериментов ± стандартное отклонение.
350 мкмоль/л и культивировали в течение 24 ч.
Результаты считали достоверными при Р < 0,05.
Для исследования влияния 2-ГД на процессы
внутриклеточной сигнализации, к клеткам до-
бавляли 20 мкмоль/л PD98059, 0,3 мкмоль/л
РЕЗУЛЬТАТЫ
SB202190 либо 0,1 мкмоль/л SP600125 и инкуби-
Влияние 2-ГД на жизнеспособность клеток. Для
ровали образцы в течение 30 мин, после чего до-
того чтобы определить, при каких концентрациях
бавляли контрольный раствор либо 2-ГД в кон-
2-ГД может оказывать регулирующее влияние на
центрации 35 мкмоль/л и культивировали в тече-
функции клеток, а при каких воздействие этого
ние 24 ч. Клеточный монослой промывали СБРЭ,
альдегида связано с его цитотоксичностью, нами
клетки переводили в суспензию, добавляли лю-
изучена жизнеспособность клеток С6 через 24 ч
цигенин (2,5 · 10-5 моль/л) и регистрировали ки-
после добавления 2-ГД в среду культивирования.
нетические зависимости интенсивности хемилю-
Результаты представлены в таблице. Методом
флуоресценции с использованием PI выявлено,
минесценции. Генерацию О·- клетками С6 ин-
что культивирование клеток с 2-ГД в концентра-
дуцировали добавлением 3 · 10-5 моль/л мена-
циях 10, 35, 75 и 100 мкмоль/л не влияет на их
диона. Затем определяли интегральную интен-
жизнеспособность. Из этого следует, что при та-
сивность хемилюминесценции (ΣΙХЛ) за 10 мин,
ких концентрациях 2-ГД не вызывает разруше-
прошедших после введения менадиона в клеточ-
ния клеток. При добавлении 350 мкмоль/л иссле-
ную суспензию.
дуемого альдегида в среду культивирования на-
блюдается снижение жизнеспособности клеток
Исследование генерации О·- в митохондриях
на (37,18 ± 1,6) %, что свидетельствует о гибели
клеток. Образование О·- в митохондриях клеток
части клеток в этих условиях по механизму не-
С6 изучали флуоресцентным методом с исполь-
кроза.
зованием зонда MitoSOX Red (λвозб = 510 нм,
Модификация процессов образования суперок-
λрег = 580 нм). Клеточный монослой промывали
сидных анион-радикалов в клетках глиомы. Для
БИОФИЗИКА том 64
№ 3
2019
МОДИФИКАЦИЯ РЕДОКС-ПРОЦЕССОВ В КЛЕТКАХ ГЛИОМЫ С6
547
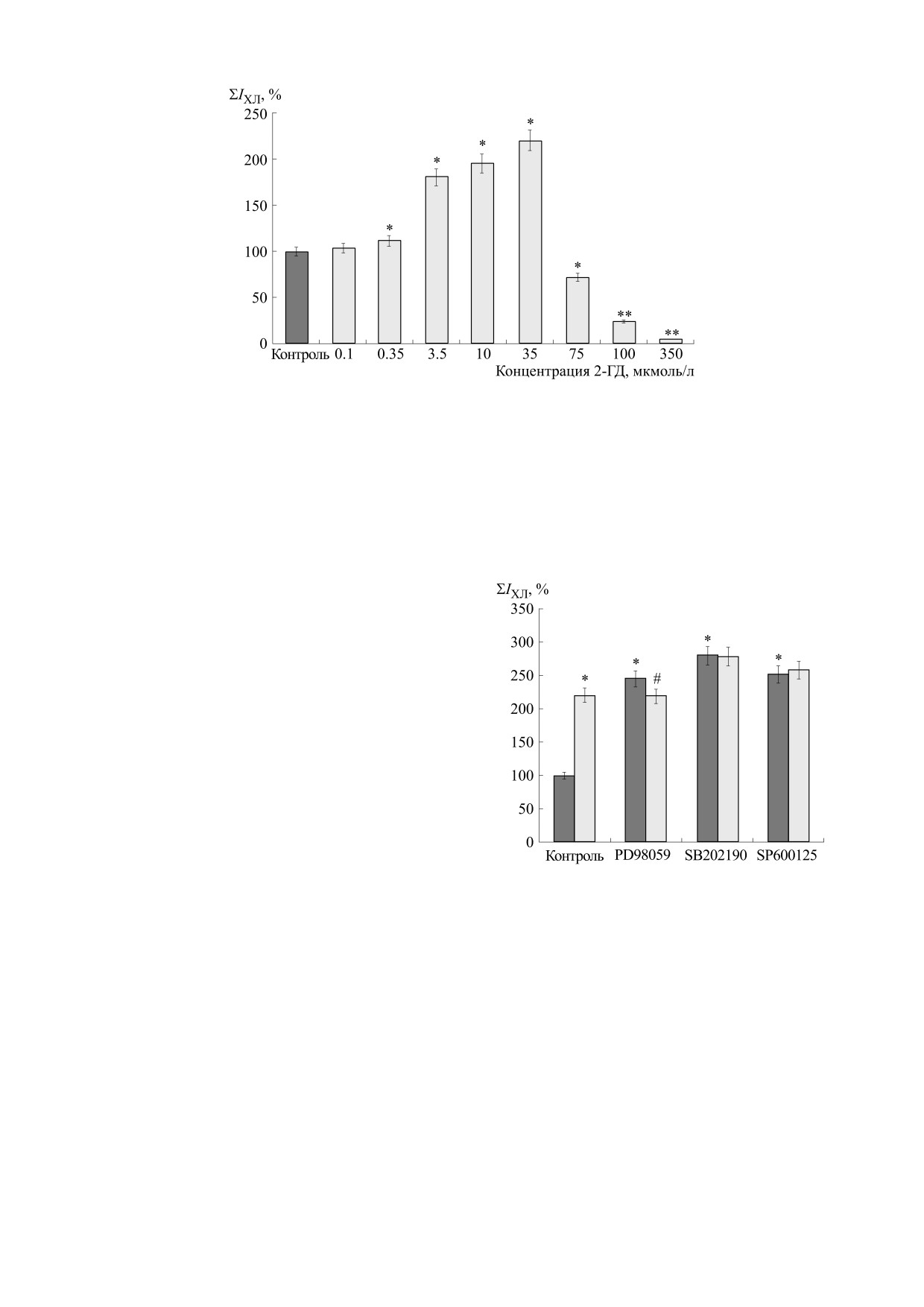
Рис. 1. Индуцированная менадионом генерация супероксидных анион-радикалов клетками С6, обработанными
(светлые столбики) и необработанными (контроль, темный столбик) 2-гексадеценалем. Время культивирования кле-
ток с 2-ГД - 24 ч. По оси ординат - суммарная интенсивность ЛюцХЛ, измеренная в течение 10 мин после добавления
менадиона. Концентрация люцигенина 2,5 · 10-5 моль/л, менадиона - 3 · 10-5 моль/л. Результаты представлены как
среднее значение ± стандартное отклонение (n = 3); * - P < 0,05, ** - P < 0,01 по сравнению с контролем.
изучения влияния 2-ГД на продукцию суперок-
цию супероксидных анион-радикалов клетками
сидных анион-радикалов в клетках С6 нами ис-
глиомы в присутствии специфических ингибито-
следована индуцированная менадионом люциге-
ров стресс-активируемых МАП-киназ. Как сле-
нин-опосредованная хемилюминесценция кле-
ток, обработанных этим альдегидом до начала
культивирования (рис. 1). Менадион (2-метил-
1,4-нафтохинон) проникает через плазматиче-
ские мембраны и подвергается либо одноэлек-
тронному, либо двухэлектронному восстановле-
нию внутриклеточными оксидоредуктазами до
семихинона или гидрохинона соответственно
[17]. В процессе аутоокисления семихинон про-
дуцирует супероксидные анион-радикалы. Из-
вестно, что интенсивность хемилюминесценции
клеток С6, зарегистрированной с помощью лю-
·-
цигенина, коррелирует с образованием в них О2
[19]. Из рис. 1 видно, что культивирование клеток
глиомы с
2-ГД в концентрациях
0,1 и
0,35 мкмоль/л в течение 24 ч практически не вли-
яет на генерацию супероксидных анион-радика-
лов. Добавление исследуемого альдегида в диапа-
зоне концентраций 3,5-35 мкмоль/л приводит к
Рис. 2. Влияние 2-гексадеценаля на генерацию су-
пероксидных анион-радикалов клетками глиомы в
увеличению выхода О·- на (80,7 ± 4,2) - (120 ± 4,6)%.
присутствии ингибиторов стресс-чувствительных
А при культивировании клеток с 2-ГД в концен-
МАПК (PD98059 - ингибитор ERK1/2-MAПK,
SB202190 - р38-MAПK, SP600125 - JNK-MAПK).
трациях от 75 до 350 мкмоль/л в течение 24 ч на-
Контроль - клетки, не обработанные ингибиторами;
блюдается снижение генерации супероксидных
серые столбики - клетки, не обработанные 2-ГД,
анион-радикалов по сравнению с контролем на
светлые столбики - клетки, обработанные 2-ГД.
(27,8 ± 3,8) - (95,8 ± 2,7)%.
Время культивирования клеток с 2-ГД - 24 ч. По оси
ординат - суммарная интенсивность ЛюцХЛ, изме-
Супероксидные анион-радикалы в клетках
ренная в течение 10 мин после добавления менадио-
трансформируются в пероксид водорода, кото-
на. Концентрация люцигенина 2,5 · 10-5 моль/л, ме-
рый в свою очередь активирует ряд белков, участ-
надиона - 3 · 10-5 моль/л. Результаты представлены
вующих в процессах внутриклеточной сигнализа-
как среднее значение ± стандартное отклонение
ции и отвечающих за пролиферацию и апоптоз
(n = 3); * - P < 0,05, # - P < 0,05 по сравнению с соот-
[20]. На рис. 2 показано влияние 2-ГД на генера-
ветствующим ингибитором, не содержащим 2-ГД.
БИОФИЗИКА том 64
№ 3
2019
548
АМАЭГБЕРИ и др.
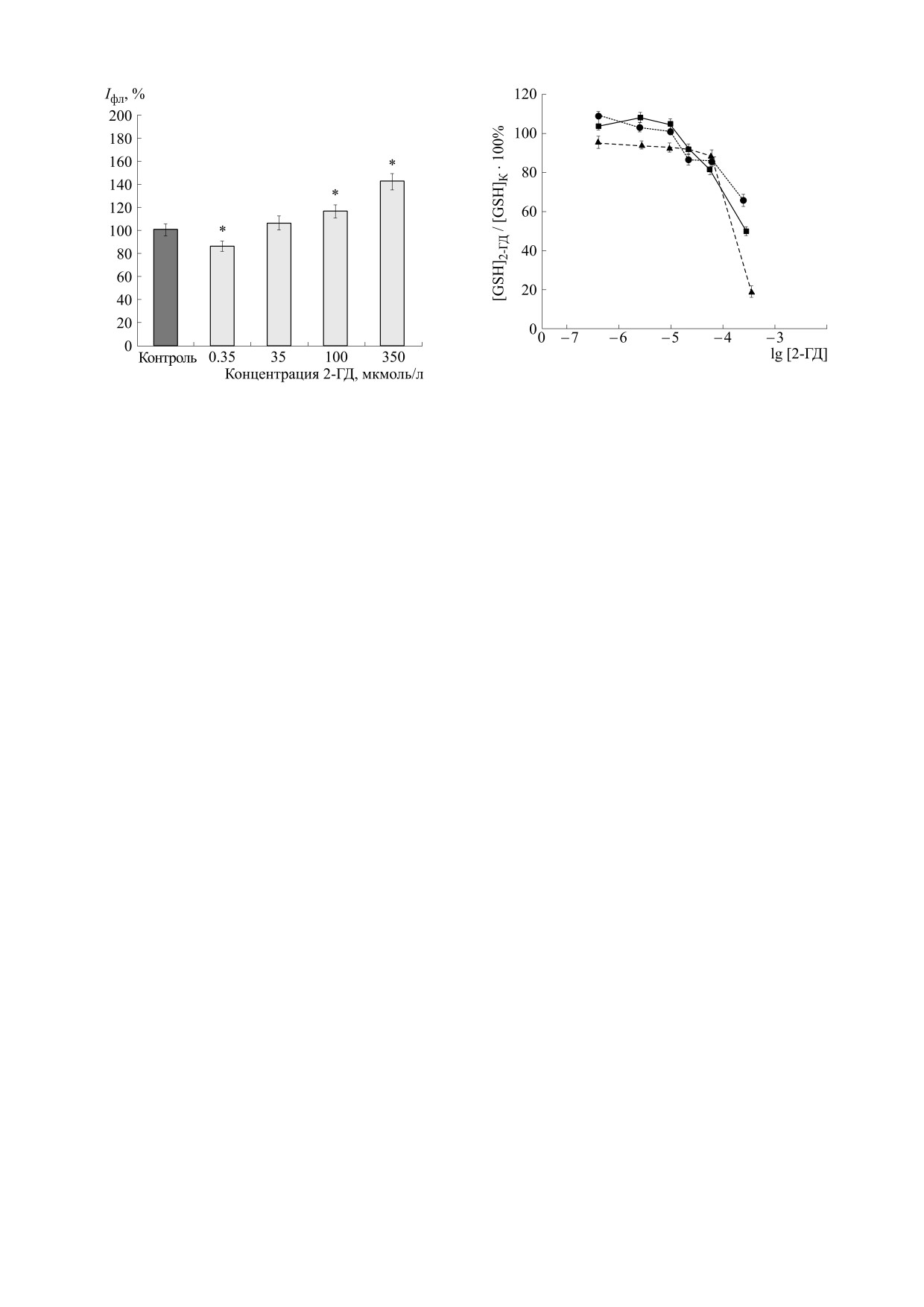
Рис. 4. Влияние 2-гексадеценаля на уровень восста-
Рис. 3. Влияние 2-гексадеценаля на генерацию суперок-
новленного глутатиона в клетках глиомы. Восстанов-
сидных анион-радикалов митохондриями клеток глио-
ленный глутатион измеряли с использованием флуо-
мы. Время инкубирования с 2-ГД - 40 мин. Измерения
ресцентного зонда MCB (λвозб = 390 нм, λрег = 480 нм)
проводили с использованием флуоресцентного зонда
через 30 мин (d), 60 мин (j) и 4 ч (m) после обработки
MitoSOX Red (λвозб = 510 нм, λрег = 580 нм). К - клетки,
клеток 2-ГД. [GSH]2-ГД - уровень восстановленного
необработанные 2-ГД, светлые столбики - клетки, об-
глутатиона в клетках, обработанных 2-ГД. [GSH]к -
работанные 2-ГД. По оси ординат - интенсивность
уровень восстановленного глутатиона в клетках, не-
флуоресценции. Результаты представлены как среднее
обработанных 2-ГД. Результаты представлены как
значение ± стандартное отклонение (n = 3); * - P < 0,05
среднее значение ± стандартное отклонение (n = 5),
по сравнению с контролем.
P < 0,05.
дует из представленных данных, предварительное
тельное уменьшение продукции О2·- митохон-
инкубирование клеток С6 с ингибиторами МАП-
дриями клеток глиомы на (14 ± 2,3) %.
киназ ERK1/2 (РD98059), р38 (SB202190) и JNK
Изменение уровня восстановленного глутатиона
(SP600125) в отсутствие 2-ГД приводит к росту
в клетках С6 после обработки 2-гексадеценалем.
продукции О·- в клетках глиомы на (124 ± 0,5) %,
Одним из ключевых элементов антиоксидантной
(178,8 ± 4,1) % и (150,9 ± 3,5) % соответственно. До-
системы клеток, обеспечивающих их защиту от
бавление 35 мкмоль/л 2-ГД к образцам клеток,
продуктов оксидативного стресса, является глу-
содержащим ингибиторы, практически не влияет
татион. Нами исследовано изменение уровня
на уровень ЛюцХЛ по сравнению с образцами, в
восстановленного глутатиона (GSH) в клетках С6
которых ингибиторы присутствовали, а 2-ГД от-
после инкубирования с 2-ГД в течение 30, 60 мин
сутствовал. Следовательно, 2-ГД в присутствии
и 4 ч (рис. 4). Видно, что инкубирование клеток с
ингибиторов стресс-активируемых МАПК не
2-ГД в концентрациях от 0,35 до 3,5 мкмоль/л 30
способен индуцировать дополнительное образо-
и 60 мин практически не влияет на уровень GSH.
вание О·- в клетках С6.
Увеличение концентрации исследуемого альде-
гида (35 и 100 мкмоль/л) приводит к снижению
Важным источником супероксидных анион-
уровня GSH на (20 ± 2,3) % и (36 ± 3,6) % соответ-
радикалов в клетках являются митохондрии [21].
ственно. Более значительные изменения содер-
В связи с этим нами изучено влияние 2-ГД на ге-
жания восстановленного глутатиона (уменьше-
нерацию супероксидных анион-радикалов мито-
ние на (40 ± 2,9) % и (54,5 ± 2,2) %) наблюдалось
хондриями клеток глиомы, которую регистриро-
через 30 и 60 мин после внесения в среду культи-
вали с использованием специфического флуорес-
вирования 350 мкмоль/л 2-ГД. Инкубирование
центного зонда MitoSOX Red через 40 мин после
клеток глиомы с 2-ГД (от 0,35 до 100 мкмоль/л) в
добавления этого альдегида. Из рис. 3 видно, что
течение 4 ч приводило к снижению уровня GSH
воздействие
2-ГД в диапазоне концентраций
на (10 ± 1,8) - (22 ± 2,4) %, а в концентрации
100-350 мкмоль/л приводит к увеличению про-
350 мкмоль/л - на (80 ± 1,4) %.
дукции О·- митохондриями клеток С6 на
ОБСУЖДЕНИЕ
(6 ± 2,1) - (42 ± 3,6) % по сравнению с контролем.
При снижении концентрации исследуемого аль-
Редокс-процессы, обусловленные образова-
дегида до 0,35 мкмоль/л наблюдается незначи-
нием АФК, считаются ключевыми в изменении
БИОФИЗИКА том 64
№ 3
2019
МОДИФИКАЦИЯ РЕДОКС-ПРОЦЕССОВ В КЛЕТКАХ ГЛИОМЫ С6
549
программ клеточной дифференцировки, проли-
ние концентрации 2-ГД вызывало значительное
ферации и апоптоза [22]. Известно, что АФК, с
снижение по сравнению с контролем выхода су-
одной стороны, стимулируют пролиферацию
пероксидных анион-радикалов. Следует отме-
опухолевых клеток, а с другой - индуцируют апо-
тить, что такой эффект не связан с цитотоксично-
птоз, посредством активации связанных с ростом
стью альдегида при его концентрации до
либо гибелью клеток сигнальных путей [23, 24].
100 мкмоль/л (табл. 1).
Пероксид водорода регулирует активность участ-
Мы предположили, что 2-ГД может влиять на
вующих в сигнализации белков через обратимое
функции клеток С6, изменяя вклад компонентов
окисление их мишеней, включая тирозинфосфа-
сигнальных путей в генерацию АФК. Это предпо-
тазы, тирозинкиназы и факторы транскрипции
ложение подтверждается результатами, представ-
[25-26]. В диапазоне физиологических концен-
ленными на рис. 2. Видно, что эффект усиления
траций H2O2 модифицирует морфологические и
индуцированной менадионом продукции су-
функциональные свойства клеток перевиваемой
пероксидных анион-радикалов клетками С6, об-
глиомы крысы С6, усиливая пролиферативную
работанными 2-ГД, подавляется в присутствии
активность и увеличивая продукцию супероксид-
специфических ингибиторов компонентов сиг-
ных анион-радикалов [27]. Для HOCl в микромо-
нальных путей, таких как ERK1/2-, р38- и JNK-
лярных концентрациях обнаружено стимулирую-
MAПK (рис.2). Эти результаты коррелируют с
щее действие на клетки, что выражается в усиле-
полученными ранее данными о механизмах влия-
нии секреторной дегрануляции в нейтрофилах
ния 2-ГД на пролиферацию клеток С6 [12]. Как
[28], а также в снижении пролиферативной и ми-
уже отмечалось, генерация супероксидных ани-
тотической активности клеток С6 посредством
он-радикалов при действии менадиона является
индуцирования апоптоза [29].
результатом одноэлектронного восстановления
При онкологических и нейродегенеративных
этого хинона до семихинона при участии флавин-
заболеваниях, инсульте, черепно-мозговых трав-
содержащих ферментов (NADH-убихинон-окси-
мах происходит инфильтрация нейтрофилами
доредуктаза (1.6.5.3) электронтранспортной цепи
пораженного участка головного мозга и форми-
митохондрий, Р-450-редуктаза (1.6.2.4), NADH-
руется очаг воспаления, в котором происходит
цитохром-b5-редуктаза (1.6.2.2)), который затем
образование активных метаболитов кислорода и
спонтанно взаимодействует с молекулярным
хлора [30, 31]. Гиперпродукция хлорноватистой
·-
кислородом с образованием О
[32]. В литерату-
кислоты может вызывать фрагментацию сфинго-
ре нет сведений об участии ингибируемых нами
липидов с образованием 2-ГД, как это было пока-
МАПК в генерации АФК, обусловленной дей-
зано нами ранее для клеток глиомы С6 [8]. Этот
ствием менадиона на клетки. В то же время эти
альдегид вызывает снижение пролиферативной
киназы являются стресс-чувствительными [13].
и митотической активности клеток С6, индуци-
Так, показано, что активация пероксидом водо-
руя апоптоз [12]. Примечательно, что при дей-
рода сигнальных путей с участием PI3K/AKT и
ствии 2-ГД на эти клетки в процессы регуляции про-
MAПK/ERK играет ключевую роль в регуляции
лиферативной активности вовлечены ERK1/2, JNK-
процессов онкогенеза, ангиогенеза и метастази-
и p38-МАП-киназы, которые по данным авторов
рования [33]. H2O2 активирует JNK-МАПК [34,
работы [13] активируются пероксидом водорода.
35], которая инактивирует антиапоптотические
Следовательно, стресс-активируемые MAПK ли-
белки Bcl-2 и Bcl-XL [32]. Воздействие АФК на
бо вовлечены в процессы генерации О2·- клетка-
клетки вызывает активацию p38-МАПК, также
ми глиомы под действием 2-ГД, либо эти белки
участвующей в индукции апоптоза [33]. Сумми-
эффективно утилизируют H2O2, образуемый при
руя полученные нами результаты и литературные
дисмутации супероксидных анион-радикалов.
данные можно полагать, что индуцированное ме-
надионом дополнительное образование суперок-
Результаты, представленные в этой работе, де-
сидных анион-радикалов в клетках С6 через 24 ч
монстрируют модифицирующее влияние 2-ГД на
после их обработки 2-ГД необходимо для даль-
редокс-активность клеток С6. При низких кон-
нейшей активации МАПК, участвующих в регу-
центрациях 2-ГД увеличивает индуцированную
ляции пролиферации и запуске апоптоза.
менадионом продукцию супероксидных анион-
радикалов. При этом максимальный выход О2·-, в
Важным источником АФК в клетках являются
2,3 раза превышающий контрольные значения,
митохондрии. Образование АФК в митохондриях
наблюдается при такой же концентрации 2-ГД
происходит в результате утечки электронов с
(35 мкмоль/л) (рис. 1), при которой наблюдалось
комплексов I и III электронтранспортной цепи
заметное ингибирование пролиферативной и ми-
[4]. Первичной формой митохондриальных АФК
тотической активности клеток С6 за счет усиле-
являются супероксидные анион-радикалы, кото-
ния апоптоза [12]. Однако дальнейшее повыше-
рые преобразуются в пероксид водорода. Н2О2
БИОФИЗИКА том 64
№ 3
2019
550
АМАЭГБЕРИ и др.
митохондрий регулирует процессы дезактивации
Полученные данные позволяют рассматривать
генов-супрессоров опухолей [36], экспрессии он-
2-ГД, который образуется в результате свободно-
когенов, мутации мДНК [37]. Однако, несмотря
радикальной деструкции сфинголипидов, инду-
на митогенное действие АФК митохондрий, в
цируемой при гиперпродукции HOCl, в качестве
больших концентрациях эти активные интерме-
нового биомаркера развития оксидативного
диаты проявляют токсическое действие на опухо-
стресса в организме.
левые клетки, индуцируя апоптоз или некроз [38,
Работа выполнена при финансовой поддержке
39]. Нами показано, что уже на ранних стадиях
Министерства образования Республики Беларусь
воздействия 2-ГД (через 40 мин после добавления
(№ гранта 20170712).
альдегида к клеткам) наблюдается дозозависимое
увеличение продукции супероксидных анион-ра-
дикалов митохондриями (рис. 3). Это дает осно-
СПИСОК ЛИТЕРАТУРЫ
вание полагать, что повышение выхода митохон-
1.
N. Bartke and Y. A. Hannun, J. Lipid Res. 50, 591
дриальных АФК после обработки клеток глиомы
(2009).
2-ГД может быть сопряжено с индуцированием
2.
R. P. Rao, N. Vaidyanathan, M., et al., J. of Lipids.
апоптоза.
2013, Article ID 178910, 12 (2013).
Нарушение редокс-состояния клеток связано
3.
J. Newton, S. Lima, M. Maceyka, et al., Exp. Cell Res.
с изменением уровня внутриклеточного восста-
333 (2), 195 (2015).
новленного глутатиона. GSH является антиокси-
4.
N. C. Hait and A. Maiti, Mediators Inflamm. 2017, Ar-
дантом и принимает участие в регуляции клеточ-
ticle ID 4806541, 17 (2017).
ного цикла [40], процессов внутриклеточной сиг-
5.
A. G. Lisovskaya, O. I. Shadyro and I. P. Edimecheva,
нализации, активации транскрипционных
Lipids 46, 271 (2011).
факторов [41]. Уменьшение уровня внутрикле-
6.
A. G. Lisovskaya, I. P. Edimecheva and O. I. Shadyro,
точного GSH связано с ростом продукции АФК и
Photochem. Photobiol. 88, 899 (2012).
является сигналом к индукции апоптоза путeм
7.
V. V. Brahmbhatt, F.-F. Hsu, J. L.-F. Kao, et al., Chem.
активации рецептора смерти либо запуска мито-
Phys. Lipids 145, 72 (2007).
хондриального апоптотического пути [41]. По-
8.
O. Shadyro, A. Lisovskaya, G. Semenkova, et al., Lipid
этому поддержание постоянного уровня GSH не-
Insights 8, 1 (2015).
обходимо для обеспечения нормальной жизнеде-
9.
A. Kumar, H. S. Byun, R. Bittman, et al., Cell Signal.
ятельности клетки. В настоящей работе
23, 1144 (2011).
показано, что уменьшение внутриклеточного
10.
F. Schumacher, C. Neuber, H. Finke, et al., J. Lipid
GSH наблюдается уже через 30 мин после добав-
Res. 58, 1648 (2017).
ления в среду культивирования 2-ГД и не изменя-
11.
P. Upadhyayaa, A. Kumar, H. Byun, et al., Biochem.
ется в течение 4 ч для нетоксичных концентраций
Biophys. Res. Commun. 424 (1), 18 (2012).
этого альдегида (до 100 мкмоль/л включительно)
12.
N. Amaegberi, G. Semenkova, A. Lisovskaya, et al.,
(рис. 4), при которых наблюдается повышение
FEBS J. 284 (Suppl. 1), 243 (2017).
продукции АФК. Эти данные также свидетель-
13.
Y. Son, Y.-K. Cheong, N.-H. Kim, et al., J. Signal
ствуют о ранних изменениях редокс-состояния
Transduc. 2011, Article ID 792639, 6 (2011).
клеток после воздействия 2-ГД.
14.
Z. Liu, Y. Gong, H.-S. Byun, et al., New J. Chem. 34
(3), 470 (2010).
Таким образом, 2-ГД в нетоксичных концен-
15.
F. Kato, M. Tanaka and K. Nakamura, Toxicol. in
трациях вызывает модификацию редокс-процес-
vitro 13, 923 (1999).
сов в клетках глиомы, что подтверждается увели-
16.
T.A. Kulahava, G.N. Semenkova, Z.B. Kvacheva,
чением продукции супероксидных анион-ради-
et al., Med Sci Monit. 16 (6), 11 (2010).
калов в цитоплазме клеток, обработанных
17.
G. M. Cohen and M. d'Ar. Doherty, Br. J. Cancer 55
менадионом, и митохондриях, а также уменьше-
(8), 46 (1987).
нием уровня внутриклеточного восстановленно-
18.
S. B. Hollensworth, C. C. Shen, J. E. Sim, et al., Free
го глутатиона. Поскольку модифицирующие эф-
Rad. Biol. Med. 28 (8), 1161 (2000).
фекты 2-ГД начинают проявляться на ранних
19.
Г. Н. Семенкова, Т. А. Кулагова, З. Б. Квачева,
стадиях его взаимодействия с клетками, а увели-
и др., Нейроиммуннология. 3 (1), 23 (2005).
чение менадион-индуцированного образования
20.
B. C. Dickinson and C. J. Chang, Nat. Chem. Biol. 7,
О·- полностью подавляется ингибиторами
504 (2011).
МАП-киназ (JNK-, p38- и ERK1/2), участвую-
21.
D. F. Stowe and A. K. S. Camara, Antioxid. Redox
щих в запуске апоптоза, можно полагать, что мо-
Signal. 11 (6), 1373 (2009).
дификация редокс-состояния клеток С6 является
22.
Е. Б. Меньщикова, Н. К. Зенков, В. З. Ланкин,
начальным этапом процесса внутриклеточной
и др. Окислительный стресс: Патологические
сигнализации, в котором 2-ГД играет роль сиг-
состояния и заболевания (АРТА, Новосибирск.,
нальной молекулы.
2008).
БИОФИЗИКА том 64
№ 3
2019
МОДИФИКАЦИЯ РЕДОКС-ПРОЦЕССОВ В КЛЕТКАХ ГЛИОМЫ С6
551
23. G. U. Bae, D. W. Seo, H. K. Kwon, et al., J. Biol.
32. Н. Г. Крылова, Т. A. Кулагова, Г. Н. Семенкова,
Chem. 274, 32596 (1999).
и др., Укр. біохім. журн. 81 (6),77 (2009).
24. J. Abe, M. Okuda, Q. Huang, et al., J. Biol. Chem. 275,
33. W. Mu and L.-Z. Liu, React. Oxyg. Species. 4 (10), 251
1739 (2000).
(2017).
25. S. G. Rhee, Y. S. Bae, S.-R. Lee, et al., Sci. STKE 53,
34. E. Cadenas, Mol. Aspects Med. 25, 17 (2004).
1 (2000).
35. P. Storz, Trends Cell Biol. 17 (1), 13 (2007).
26. P. Storz, Front. Biosci. 10, 1881 (2005).
36. B. Vurusaner, G. Poli and H. Basaga, Free Radic. Biol.
27. T. A. Kulahava, G. N. Semenkova, Z. B. Kvacheva,
Med. 52, 7 (2012).
et al., Cell tissue biol. 1 (1), 8 (2007).
37. S. Dasgupta, E. Soudry, N. Mukhopadhyay, et al., J.
28. T. Kuznetsova, T. Kulahava, I. Zholnerevich, et al.,
Cell Physiol. 227, 2451 (2012).
Mol. Immunol. 87, 317 (2017).
38. L. B. Sullivan and N. S. Chandel, Cancer Metab. 2, 17
29. A. Lisovskaya, N. Amaegberi and G. Semenkova, Free
(2014).
Radic. Biol. Med. 108, S23 (2017).
39. M. P. S. Idelchik, U. Begley, T. J. Begley, et al., Semin.
30. R. S. B. Clark, J.K. Schiding, S.L. Kaczorowski, et al.,
Cancer Biol. 47, 57(2017).
J. Neurotrauma. 11, 499 (1994).
40. A. Meister, J. Nutrit. Sci. Vitaminol. 1992 Spec No, 1
31. C. L. Mayer, B.R. Huber and E. Peskind, Headache. 53
(1992).
(9), 1523 (2013).
41. M. L. Circu and T. Y. Aw, BBA 1823, 1767 (2012).
Modification of Redox Processes in C6 Glioma Cells by 2-Hexadeсenal,
Formed during Destruction of Sphingolipids
N.V. Amaegberi*, G.N. Semenkova*, A.G. Lisovskaya* **, Z.B. Kvacheva***, and O.I. Shadyro*
*Belarusian State University, prosp. Nezavisimosti 4, Minsk, 220030 Belarus
**University of Notre Dame, Notre Dame, 46556 Indiana, USA
***Institute of Biophysics and Cell Engineering, National Academy of Sciences of Belarus,
Akademicheskaya ul. 27, Minsk, 220072 Belarus
2-hexadecenal is an unsaturated aldehyde, which is formed during the free radical destruction of sphingolip-
ids under oxidative stress and exhibits biological activity by inhibiting proliferation and inducing apoptosis.
This paper presents the results from the investigation of the modifying effects of this aldehyde on redox pro-
cesses which occur in rat C6 glioma cells. It has been shown that cultivation of cells with 2-hexadecenal (in
concentrations from 3.5 to 35 μmol/l) leads to a significant increase, and at the higher concentrations, a de-
crease in the yield of superoxide anion radicals induced by menadione. It has been ascertained that the addi-
tional production of О2·- under the action of 2-hexadecenal on cells is completely suppressed in the presence
of inhibitors of stress-activated MAP-kinases involved in apoptosis induction, such as JNK, p38- and
ERK1/2 MAP kinase. The modifying effects of 2-hexadecenal were observed during the early stages of inter-
action of this aldehyde with the cells leading to an increase in the production of superoxide anion radicals
by mitochondria and a decrease in the intracellular level of reduced glutathione. It has been suggested that
the modification of the redox state of C6 cells is the initial stage of the intracellular signaling process where
2-hexadecenal acts as a signaling molecule.
Keywords: 2-hexadecenal, sphingolipids, reactive oxygen species, rat C6 glioma cells, mitochondria, glutathione
БИОФИЗИКА том 64
№ 3
2019