БИОФИЗИКА, 2019, том 64, № 3, с. 614-621
БИОФИЗИКА CЛОЖНЫX CИCТЕМ
УДК 004.942
АНАЛИЗ ИЗГИБНОЙ ЖЕСТКОСТИ СОСУДИСТЫХ ГРАФТОВ
С ИСПОЛЬЗОВАНИЕМ МЕТОДОВ ЧИСЛЕННОГО МОДЕЛИРОВАНИЯ
© 2019 г. Е.А. Овчаренко*, К.Ю. Клышников*, М.А. Резвова*, Л.В. Антонова*,
Т.В. Глушкова*, С.Е. Винокуров*, В.В. Севостьянова*, Е.О. Кривкина*, А.В. Батранин**,
Ю.Н. Захаров***, В.Г. Борисов***, Ю.А. Кудрявцева*, Л.С. Барбараш*
*НИИ Комплексных проблем сердечно сосудистых заболеваний, 650002, Кемерово, Сосновый б-р, 6
**Томский политехнический университет, 634050, Томск, просп. Ленина, 30
***Кемеровский государственный университет, 650000, Кемерово, ул. Красная, 6
E-mail: KlyshnikovK@gmail.com
Поступила в редакцию 15.03.2018 г.
После доработки 14.02.2019 г.
Принята к публикации 18.02.2019 г.
Работа посвящена численной оценке эффективности полимерного упрочнения сосудистых граф-
тов малого диаметра. Работа, основанная на анализе методом конечных элементов, описывает ал-
горитм подбора оптимальных параметров армирующего слоя и его оценку с точки зрения напря-
женно-деформированного состояния в условиях воспроизведения продольного изгиба. Результаты
исследования могут быть транслированы в производственную и экспериментальную практику при
исследовании упрочняющих свойств аналогичных изделий.
Ключевые слова: сосудистый протез, армирование, метод конечных элементов, полимер.
DOI: 10.1134/S0006302919030244
Основной технологией создания синтетиче-
Патология артерий малого и среднего диамет-
ских биодеградиремых сосудистых графтов мало-
ра является одной из основных причин смертно-
го диаметра является метод электроспиннинга,
сти населения во всем мире. Ежегодно несколько
который позволяет имитировать микроархитек-
миллионов пациентов нуждаются в реконструк-
тонику природного внеклеточного матрикса и
ции сосудов данного типа [1]. Использование
моделировать цилиндрическую форму сосудов с
подходов тканевой инженерии при создании со-
учетом сохранения неразрывного округлого сече-
судистых графтов малого диаметра привело к по-
ния [4]. Данная технология дает возможность
явлению нового класса синтетических биодегра-
контролировать морфологию волокон с диамет-
дируемых протезов для проведения шунтирую-
ром от десятков до нескольких микрон [4], благо-
щих операций
[2,3]. Условием успешного
даря чему удается создавать поверхности, облада-
функционирования подобных изделий является
ющие высокой проницаемостью и взаимосвязан-
соответствие их основных характеристик натив-
ной пористой структурой, что предпочтительно
ным сосудам - помимо высокой биосовместимо-
для подобного рода изделий. Однако, несмотря
сти, контролируемой кинетики деградации, спо-
на указанные преимущества, механические свой-
собности поддерживать структурную и функцио-
ства графтов, полученных методом электроспин-
нальную целостность непосредственно после
нинга, в некоторых аспектах неудовлетворитель-
имплантации и на этапах ремоделирования, сосу-
ны, в частности, перегиб сосуда может приводить
дистые графты должны обладать удовлетвори-
к частичному, либо полному перекрытию его
тельными механическими характеристиками,
просвета. Данный риск необходимо учитывать
обеспечивающими сохранение естественной ге-
при имплантации сосудов значительной длины в
модинамики в области имплантируемого сосуда
области, подверженные высоким динамическим
(поддержание просвета сосуда за счет необходи-
нагрузкам перегиба со стороны окружающих тка-
мой изгибной жесткости графта, равномерное
ней - сосуды нижних конечностей в области су-
проведение пульсовых волн - соответствующей
ставов (например, бедренно-подколенное шун-
тирование). Исходя из этого, актуальным направ-
комплаенсности).
лением исследований является разработка
Сокращения: FDM - метод послойного плавления (fused de-
сосудистого каркаса, способного сохранять
position modeling), PCL - поликапролактон (polycaprolactone).
функциональность при нагрузках сдвига и пере-
614
АНАЛИЗ ИЗГИБНОЙ ЖЕСТКОСТИ СОСУДИСТЫХ ГРАФТОВ
615
гиба. Одним из возможных решений данной зада-
чи может быть использование в процессе изго-
товления изделий принципов метода послойного
плавления (fused deposition modeling (FDM)) —
технологии аддитивного производства, широко
распространенного для создания объемных моде-
лей, в том числе для новой области так называе-
мой компьютерной инженерии тканей [5]. FDM-
технология заключается в создании моделей из
нагретого термопластичного материала, посред-
ством экструзии через сопло, расположенного
над коллектором заданной формы, где скорость
экструзии полимера и перемещение головки кон-
тролируется с помощью числового программного
управления [6]. Паттерны, сформированные ме-
тодом FDM, могут выступать в качестве армиру-
ющих конструкций в сочетании с другими техно-
логиями изготовления скаффолдов, к примеру,
создания сосудистых графтов методом двухфаз-
ного электроспиннинга, предусматривающего
Рис. 1. Сосудистые биополимерные графты: (а) - без
инкорпорирование в состав каркаса биологиче-
армирующего слоя, (б) - с армирующим покрытием.
ски активных пептидов [7-9].
Форма армирующего слоя может быть различ-
ной оптимизации конструкции в идентичных
ной и определяется целями получаемого графта.
В процессе изготовления биодеградируемых со-
условиях на базе заданных свойств материала. На-
судистых графтов методом электроспиннинга,
стоящая статья посвящена вопросу выбора пара-
метров армирующего каркаса графта на основе
спираль плотной структуры, нанесенная наплав-
описанного выше метода.
лением на внешнюю стенку сосуда, является од-
ним из решений проблемы коррекции механиче-
ских свойств графтов - комплаенсности, изгиб-
МАТЕРИАЛЫ И МЕТОДЫ
ной жесткости, давления разрыва. Целостность
Объект исследования. В настоящей работе бы-
медицинского изделия достигается за счет непо-
ли исследованы биодеградируемые сосудистые
средственного приплавления армирующего слоя
графты диаметром 4 мм (рис. 1), изготовленные
к поверхности сосуда в процессе изготовления
из композиции полимеров полигидроксибутира-
конечного протеза. Успешность такой идеи за-
та/валерата с долей валерата не менее 8% (Sigma
ключается в одинаковой природе исходных мате-
Aldrich, США) и поликапролактона с молекуляр-
риалов различных слоев и, как следствие, одина-
ной массой 80 кДа (Sigma Aldrich, США) в хлоро-
ковой температуре их плавления. В настоящем
форме («Вектон», Россия) в соотношении 1:2 ме-
исследовании в качестве базового компонента
тодом двухфазного электроспиннинга, позволя-
был использован поликапролактон (polycaprolac-
ющего вводить жидкую фазу в скаффолд в
tone - PCL) - синтетический биодеградируемый
процессе изготовления. Жидкая фаза, в качестве
низкотемпературный пластик.
которой выступил 0,9% раствор хлорида натрия
(NaCl), составила 1/20 от общего объема поли-
Ключевым вопросом проектирования и разра-
мерного раствора и необходима для инкорпори-
ботки армирующего каркаса является адекватно
рования в состав графтов биологически активных
обоснованный выбор его базовых параметров: шаг
спирали, ее толщина и диаметр в сечении. На сего-
пептидов различного состава. Армирующий слой
дняшний день в арсенале разработчика есть целый
в форме спирали изготовлен методом FDM. В ка-
честве основного полимерного материала для вы-
ряд различных методов, позволяющих выполнить
полнения армирующего слоя использовали поли-
расчет искомых параметров, среди которых наибо-
капролактон с молекулярной массой 80 кДа.
лее предпочтительным является метод компьютер-
ного моделирования за счет возможности
Физико-механические испытания. Оценка ме-
итеративного анализа свойств конструкции в зави-
ханических свойств исследуемых образцов была
симости от ее конфигурации [10]. Связка парамет-
выполнена в условиях одноосного растяжения на
ризованной модели графта, построенной в среде
универсальной испытательной машине серии Z
автоматизированного проектирования, с последу-
(Zwick/Roell, Германия). Исследование графтов
ющим инженерным анализом напряженно-дефор-
было проведено в продольном и радиальном на-
мированного состояния графта в условиях физио-
правлениях в соответствии с ГОСТ ИСО 7198-
логических нагрузок на основе метода конечных
2013. Отдельно была выполнена оценка механи-
элементов, обеспечивает возможность итератив-
ческих свойств экстрадированной PCL-нити, ис-
БИОФИЗИКА том 64
№ 3
2019
616
ОВЧАРЕНКО и др.
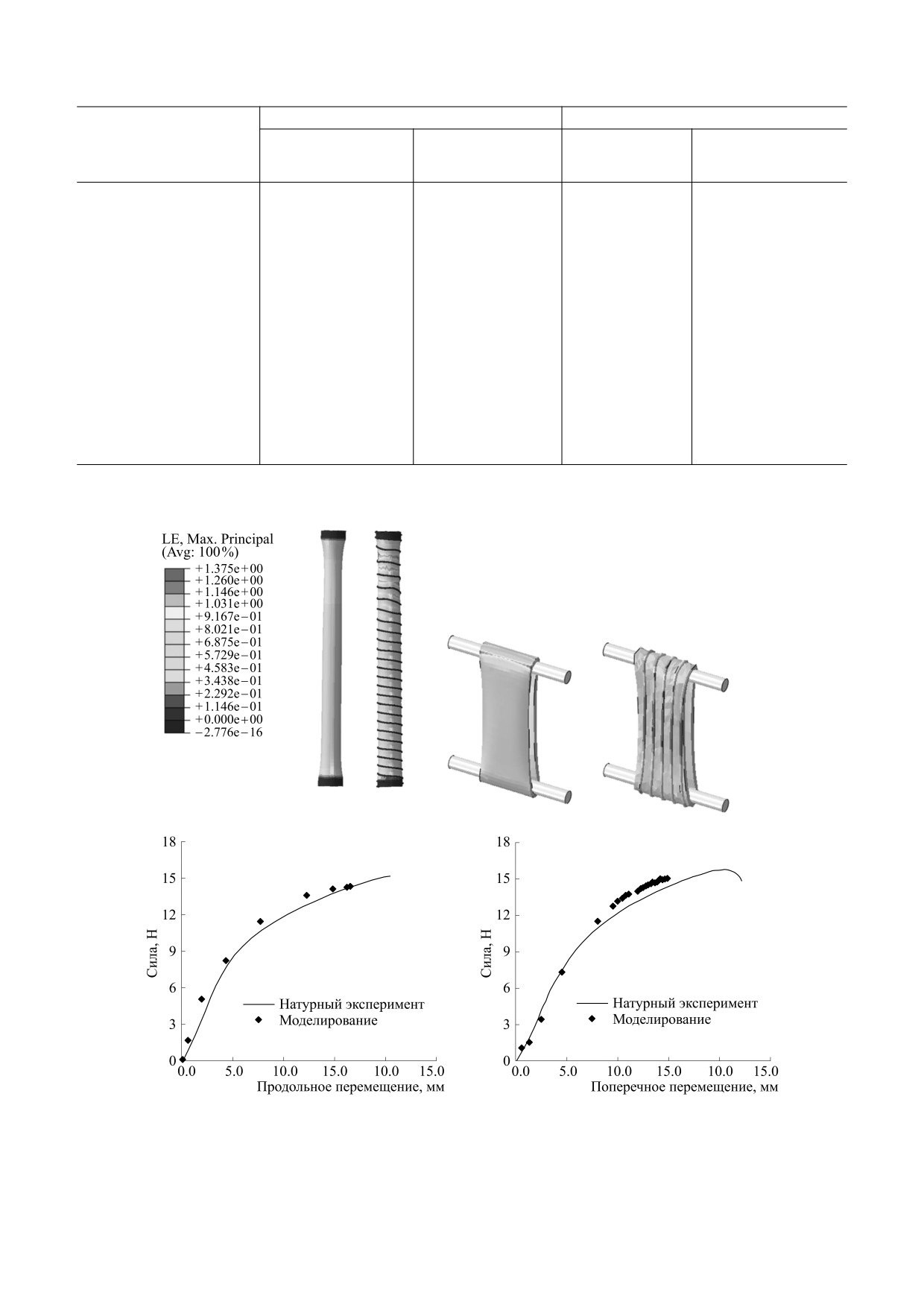
Рис. 2. Образцы графтов, фиксированные в зажимах универсальной испытательной машины с использованием
оригинальных приспособлений. Слева - фиксация графта при оценке механических свойств в продольном направ-
лении, справа - в поперечном направлении.
пользуемой для армирования графтов. При испы-
ми считали различия при уровне значимости
тании использовали датчик силы номиналом
р < 0,05.
50 Н с пределом допустимой погрешности ±1%.
Подбор параметров модели материала. Для по-
Скорость перемещения траверсы составила
лучения моделей материала, описывающих фи-
50 мм/мин. Для фиксации графтов применяли
зико-механическое in silico поведение сосудистых
оригинальные приспособления, изготовленные
графтов и обмотки, в среде инженерного анализа
методом 3D-печати (рис. 2). Предел прочности
Abaqus/CAE (Dassault Systemes, Франция) вос-
оценивали по силе (Fmах), приложенной к образ-
производили натурные эксперименты, проведен-
цу до начала разрушения. Напряжение было ис-
ные на универсальной испытательной машине -
ключено из анализа по причине того, что армиру-
одноосное растяжение и радиальное растяжение
ющий слой представляет собой спираль, что де-
сосуда до и после нанесения обмотки. Импорти-
лает невозможным адекватный расчет площади
рованную компьютерную модель цилиндриче-
поперечного сечения образца и определение ис-
ского сосуда разбивали на четырехгранные при-
тинного напряжения в материале. Упруго-дефор-
митивы - конечные элементы C3D10-типа, пред-
мативные свойства графтов оценивали по отно-
ставляющие собой четырехгранные пирамиды с
сительному удлинению при растяжении и моду-
10 точками интегрирования. К полученным ко-
лю Юнга (Емод), который определяли на участке
нечно-элементным сеткам трехмерных объектов
прикладывали соответствующие нагрузки:
деформационный кривой, подчиняющемся зако-
ну Гука.
1) одноосное растяжение сосудистого протеза
25 мм вдоль центральной оси с удлинением 50 мм
Для оценки влияния армирующего слоя на ме-
(200%);
ханические свойства PHBV/PCL/NaCl графтов
2) поперечное растяжение 5 мм участка сосуда
(n = 10) каждый образец был разделен на два рав-
на 8 мм (200%).
ных сегмента по 30 мм, один из которых был ар-
В ходе подбора модели материала итеративно
мирован PCL-нитью.
изменяли модуль упругости, коэффициент Пуас-
Обработку данных производили с помощью
сона и характер кривой пластической деформа-
программного пакета Statistica (StatSoft, Inc.,
ции таким образом, чтобы полученная в результа-
США). Тип распределения оценивали, используя
те моделирования зависимость «сила-деформа-
критерий Колмогорова-Смирнова. Данные
ция» соответствовала данной кривой для
представлены в виде медианы, 25 и 75 проценти-
натурного эксперимента.
лей. Статистическую значимость различий между
Компьютерное моделирование. На основе оцен-
двумя независимыми группами оценивали с по-
ки физико-механических свойств в системе авто-
мощью U-критерия Манна-Уитни, достоверны-
матизированного проектирования SolidWorks
БИОФИЗИКА том 64
№ 3
2019
АНАЛИЗ ИЗГИБНОЙ ЖЕСТКОСТИ СОСУДИСТЫХ ГРАФТОВ
617
Рис. 3. Схема моделирования изгиба сосудистого графта до 90° и 180°. УТ - управляющая точка.
2016 была построена серия трехмерных компью-
перечном направлениях (р = 0,67) относительно
терных моделей, конструктивно представляющих
показателей прочности, относительного удлине-
собой полый цилиндр с габаритами, аналогичны-
ния и модуля Юнга. Сравнение с полимерными
ми натурным образцам, - диаметр внутреннего
графтами, армированными нитью из PCL, пока-
просвета 4 мм, толщина стенки 0,3 мм, длина
зало отсутствие (р = 0,75) различий прочностных
30 мм. Полученный цилиндр соединяли с трех-
и упруго-деформативных свойств в продольном
мерной спиралью, расположенной снаружи, для
направлении, но в то же время в поперечном на-
которой варьировали диаметр
(0,1;
0,3;
0,4;
правлении было отмечено повышение прочности
0,8 мм) и шаг (1,0; 2,0; 3,0 мм), формируя, таким
и модуля Юнга после армирования графтов в 3,5
образом, модель армированного сосуда. Дальней-
и 3,2 раза соответственно при снижении относи-
шее моделирование изгибной жесткости произ-
тельного удлинения в 2,2 раза (р < 0,05). Проч-
водили в среде инженерного анализа Abaqus/
ность нити PCL диаметром 270 мкм, полученной
CAE. Для этого производили разбиение постро-
после экструзии при 130°С, составила 1,28 (1,14;
енных трехмерных моделей армированного граф-
1,4) Н при относительном удлинении
1053
та на элементы C3D10 типа с заданием раздель-
(1004,4; 1102,3) % и модуле Юнга 236,0 (228,0;
ных свойств линейного материала для армирую-
244,0) МПа.
щей спирали и основного «тела» сосудистого
Подбор параметров модели материала. В ре-
протеза. Непосредственное моделирование из-
зультате итеративного подбора, выполненного
гибной жесткости протеза с армированием про-
методом моделирования воспроизведения натур-
водили при воспроизведении последовательного
ного эксперимента (рис. 4), были получены сле-
изгиба до 90° и 180° (рис. 3). Описанный перегиб
дующие показатели модели материала сосуда и
осуществляли с помощью приложения управля-
его обмотки: модуль Юнга - 1,7 и 350 МПа соот-
ющих точек к концам сосуда и последующим на-
ветственно, коэффициент Пуассона - 0,3.
ложением вращающих усилий на данные точки.
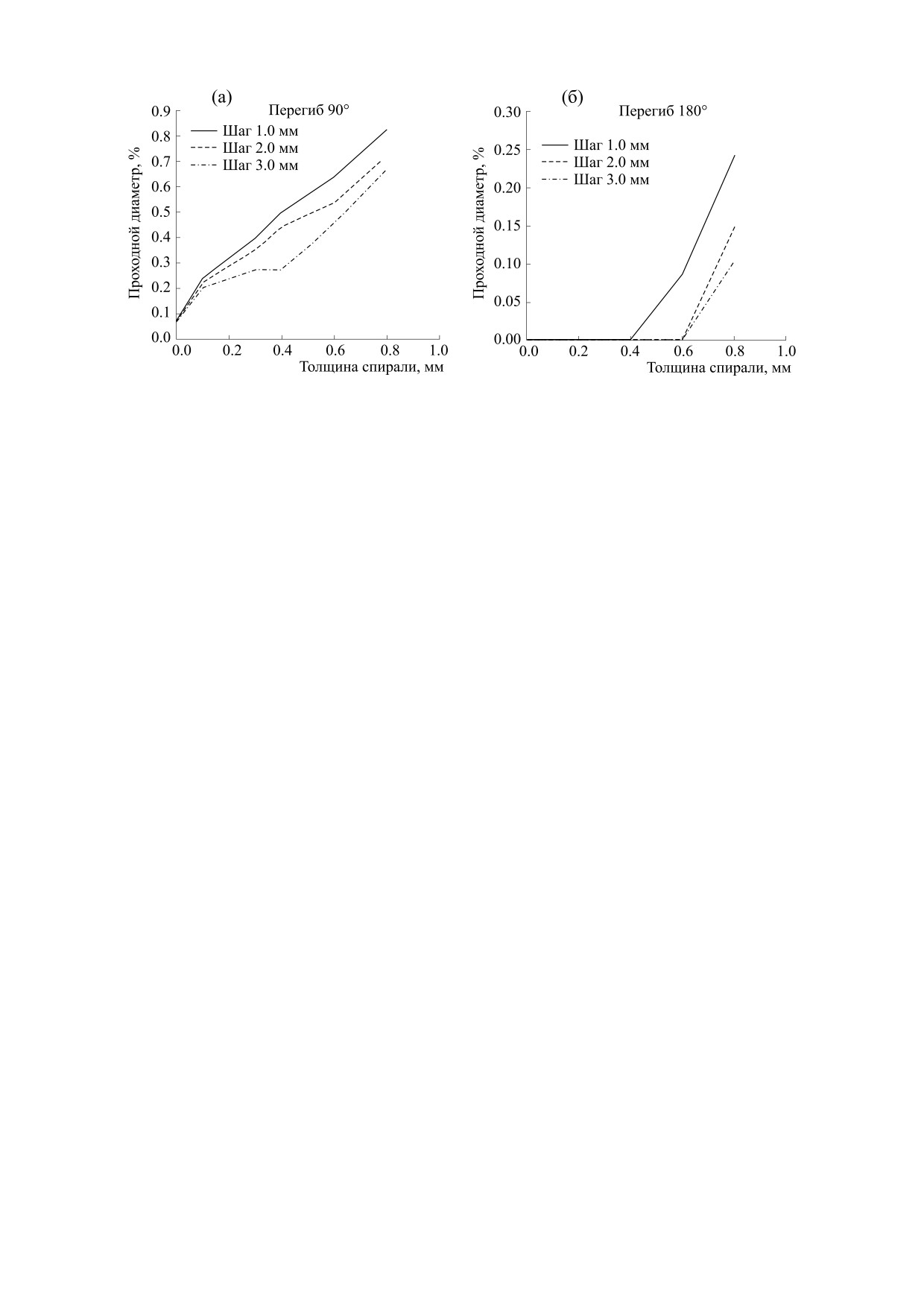
Компьютерное моделирование. В результате
Для наиболее полного воспроизведения физио-
эксперимента было показано, что при изгибе 90°
логических условий моделировали действие нор-
все исследуемые сосудистые графты были прохо-
мального давления (120 мм рт.ст.) на внутреннюю
димы, т.е. имели ненулевой просвет: остаточный
поверхность сосуда. В ходе расчета степени пере-
проходной диаметр варьировал от 0,81 до 3,28 мм.
гиба анализировали минимальный остаточный
В процентном соотношении относительно исход-
проходной диаметр при углах 90° и 180°, а также
ного внутреннего диаметра (4 мм) данный пока-
напряженно-деформированное состояние стен-
затель составил 20-82% (рис. 5а). В свою очередь,
ки протеза и армирующей спирали для оценки
перегиб на 180° продемонстрировал поведение
риска разрушения данных объектов. В качестве
сосуда, значительно отличающееся от малых из-
решателя использовали Abaqus/Standard, с авто-
гибов: большинство вариантов, смоделирован-
матической стабилизацией расчета на основе
ных в исследовании, продемонстрировали нуле-
фракции рассеяния энергии 0,0002 и с использо-
вой просвет при полном перегибе (рис. 5б). Из
ванием параметра больших деформаций.
графиков видно, что лишь комбинации спирали с
шагом 1 мм и толщиной 0,6 мм, а также с шагом 2
РЕЗУЛЬТАТЫ
и 3 мм при толщине 0,8 способны в минимальной
степени сохранять просвет в условиях полного
Физико-механические испытания. Полученные
перегиба сосуда: 9-24%.
результаты исследования (табл. 1) образцов без
армирующего слоя продемонстрировали отсут-
Анализ напряженно-деформированного со-
ствие достоверных различий в продольном и по-
стояния при моделировании перегиба продемон-
БИОФИЗИКА том 64
№ 3
2019
618
ОВЧАРЕНКО и др.
Таблица 1. Результаты физико-механического исследования графтов
Вдоль сосуда
Поперек сосуда
Графт
Графт
Показатель
Графт
Графт
ПГБВ/PCL/NaCl,
ПГБВ/PCL/NaCl,
ПГБВ/PCL/NaCl
ПГБВ/PCL/NaCl
армированный PCL
армированный PCL
3,33
4,34
5,3
9,96
Fmax, Н
(1,45; 4,41)
(3,63; 8,25)
(4,47; 7,82)
(8,54; 14,3)*
)
Относительное
129,83
119,37
127,18
56,77
удлинение, %
(69,57; 140,77)
(116,87; 135,41)
(78,6; 131,01)
(45,1; 58,78)*
3,1
2,17
2,03
6,55
Eмод, МПа
(2,31; 3,41)
(1,93; 2,45)
(1,7; 2,43)
(5,02; 6,84)*
Внутренний диаметр
4,0
4,0
0,66
0,92
графта/толщина
(4,0; 4,0)
(4,0; 4,0)
(0,34; 0,83)
(0,9; 1,32)
стенок, мм
Внешний диаметр
4,6
5,0
5,0
5,0
графта/ширина
(4,54; 4,89)
(5,0; 5,22)
(5,0; 5,0)
(5,0; 5,0)
образца, мм
4,05
7,07
3,3
4,6
S, МПа
(3,62; 6,21)
(7,07; 8,83)
(1,7; 4,15)
(4,5; 6,6)
Примечание. Данные представлены в виде медианы, 25 и 75 процентилей. Fmax - предел прочности по силе, Eмод - модуль
упругости, S - напряжение разрыва; * - р < 0,05 относительно неармированного сегмента.
Рис. 4. Воспроизведение физико-механического тестирования методом конечных элементов in silico.
БИОФИЗИКА том 64
№ 3
2019
АНАЛИЗ ИЗГИБНОЙ ЖЕСТКОСТИ СОСУДИСТЫХ ГРАФТОВ
619
Рис. 5. Остаточный проходной диаметр в процентном соотношении относительно исходного: (а) - при перегибе
армированного сосуда на 90°; (б) - то же при перегибе на 180°.
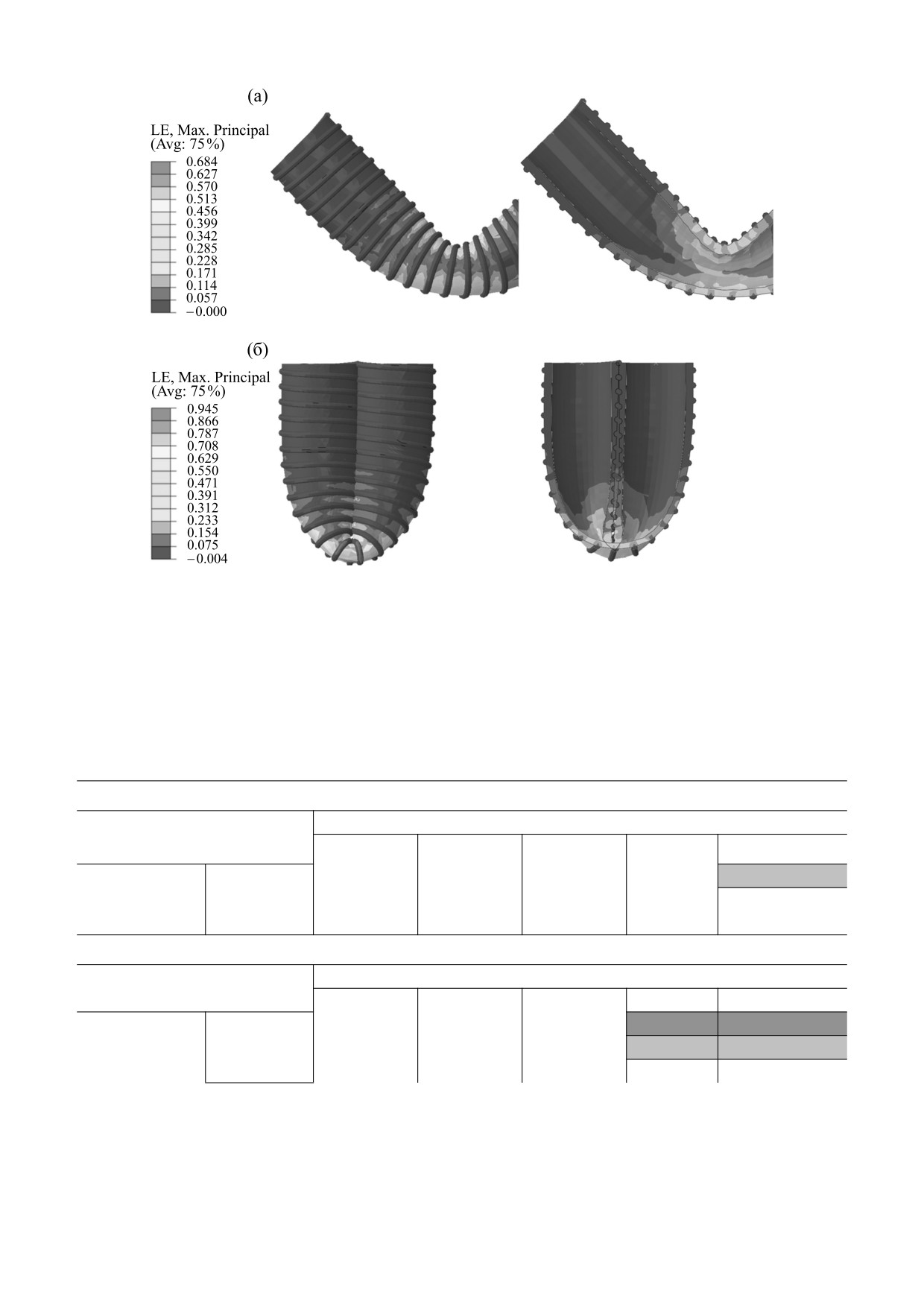
стрировал существенный рост показателя лога-
ки ограничена показателем деформации ее узлов,
рифмической деформации в зависимости от уве-
возникающих в случае перегиба сосуда, что в кри-
личения толщины спирали. При этом основные
тических случаях может приводить к разрушению
концентраторы локализованы в центральной ча-
стенки графта. Таким образом, оптимальная кон-
сти графта (рис. 6).
фигурация армирующего каркаса является след-
ствием баланса как минимум двух факторов: из-
Максимальное значение логарифмической де-
гибная жесткость против максимального напря-
формации при перегибе на 90° было получено для
жения узлов, лимитированного исходными
наиболее плотного армирующего слоя 0,8 мм с
шагом 1 мм - 1,225 (122,5%); минимальное - для
свойствами полимера. В нашем случае сечение
наименее плотной и тонкой спирали (0,1 мм с ша-
спирали, равное 0,4, в первом приближении мож-
гом 3 мм) - 0,717 (71,7%). При перегибе на 180°
но считать оптимальным. Необходимо также
значительного качественного различия в распре-
подчеркнуть, что в действительности существует
делении поля деформации отмечено не было:
также ряд неучтенных факторов, влияющих на
наибольшие значения также характерны для наи-
выбор оптимальной конфигурации армирующего
более плотной спирали (167,3%) и, наоборот,
слоя: динамическая нагрузка, возникающая в ре-
наименее плотная спираль вызывает наимень-
зультате распространения пульсовой волны и
шую логарифмическую деформацию
(83,7%).
функционирования окружающих тканей (напри-
Важно отметить, что два варианта модели превы-
мер, в процессе хождения). По этой причине опи-
сили порог разрушения для тканой части графта,
санная проблема перегиба сосудистых графтов
составляющий 127,18% при перегибе на 180°, и
наиболее актуальна для бедренно-подколенного
две модели продемонстрировали критически
сегмента [11]. Выполненное моделирование глу-
близкие значения к пороговому (табл. 2).
бокого перегиба сосудистого протеза не является
моделированием реальной возможной ситуации,
ОБСУЖДЕНИЕ
а скорее носит постановочный характер с целью
оценки возможности возникновения стенозиру-
Результаты настоящего исследования ожидае-
ющего эффекта как такового. Подобная ситуация
мо продемонстрировали прямо пропорциональ-
может иметь критическое значение в меньшей
ную зависимость остаточного просвета графтов
степени для гемодинамики нижних конечностей,
от диаметра сечения спирали и плотности ее на-
в большей - для надежности самого протеза с
мотки в условиях предельного перегиба сосуда
учетом напряжения сдвига, возникающего под
90°-180°. Анализ проходного диаметра сосудов
действием кровотока и развивающегося в резуль-
наглядно продемонстрировал необходимость ис-
пользования армирующего каркаса, поскольку
тате образования локальных турбулентностей и
без армирования, даже с учетом моделирования
возрастания линейной скорости кровотока. В
гидростатического давления и отсутствия внеш-
этом отношении логичным продолжением пред-
него сдавливающего воздействия со стороны
ставленного исследования является более углуб-
окружающих тканей, стеноз сосуда становится
ленное моделирование гемодинамики графта с
критическим. В то же время толщина нити обмот-
учетом его перегиба методом жидкостно-струк-
БИОФИЗИКА том 64
№ 3
2019
620
ОВЧАРЕНКО и др.
Рис. 6. Эпюры логарифмической деформации при моделировании перегиба на 90° (а) и 180° (б). Модели
представлены на примере сосуда с армированием 0,4 мм с шагом 1 мм целиком и в разрезе.
турного взаимодействия на основе методов ко-
была ранее выполнена в сопоставимых по методоло-
нечных элементов и конечных объемов [12].
гии задачах моделирования перегиба AAA-стентов
Валидация предложенного анализа изгибной
[13,14]. Сравнение результатов численного модели-
жесткости на основе компьютерного моделирования рования и натурных экспериментов продемонстри-
Таблица 2. Логарифмическая деформация различных вариантов сосудистых графтов с армированием в результа-
те моделирования перегиба
Деформация при перегибе на 90°
Диаметр спирали, мм
0,1
0,3
0,4
0,6
0,8
1,0
0,805
0,794
0,684
0,932
1,225
Шаг, мм
2,0
0,752
0,712
0,685
0,911
0,917
3,0
0,717
0,841
0,781
0,753
0,716
Деформация при перегибе на 180°
Диаметр спирали, мм
0,1
0,3
0,4
0,6
0,8
1,0
0,954
1,070
0,945
1,283
1,673
Шаг, мм
2,0
0,923
0,928
0,969
1,149
1,250
3,0
0,837
0,840
1,409
0,976
0,971
Примечание. Темно-серым цветом выделены варианты сосудистых протезов, превысивших порог прочности; светло-серым
цветом - приближающиеся к порогу прочности.
БИОФИЗИКА том 64
№ 3
2019
АНАЛИЗ ИЗГИБНОЙ ЖЕСТКОСТИ СОСУДИСТЫХ ГРАФТОВ
621
ровало относительно высокую точность метода ком-
тальных научных исследований СО РАН II.1
пьютерного моделирования [14], что позволяет не
(№ 0546-2018-0001).
только использовать данный подход с целью каче-
ственного анализа распределения напряженно-де-
СПИСОК ЛИТЕРАТУРЫ
формированного состояния, но также опираться и на
1.
Cardiovascular diseases, Fact Sheet No. 317 (World
конкретные количественные показатели, получен-
Health Organization, 2012).
ные в эксперименте. В то же время необходимо под-
2.
Л. С. Барбараш, Л. В. Антонова, Ю. А. Кудрявцева
черкнуть, что точность метода конечных элементов
и др., Биодеградируемые сосудистые графты. Мето-
критическим образом зависит от используемых мо-
ды и подходы к модификации, под ред. Л. С. Барба-
делей материала, в связи с чем описанную в настоя-
раша и Л. В. Антоновой (Ареал, Новосибирск,
2016).
щей работе линейную изотропную модель материала
3.
Л. В. Антонова и Ю. А. Кудрявцева, Комплексные
следует рассматривать как ограничение. Кроме того,
проблемы сердечно-сосудистых заболеваний 5 (3),
в будущих исследованиях целесообразно использо-
6 (2016).
вать более детализированные модели конечного ме-
4.
A. Hasan, A. Memic, N. Annabi, et al., Acta Biomater.
дицинского устройства на основе томограмм высо-
10 (1), 11 (2014). DOI: 10.1016/j.actbio.2013.08.022.
кого разрешения с целью моделирования зоны
5.
S. M. Giannitelli, D. Accoto, M. Trombetta, and
сплавления компонентов графта, что является тех-
A. Rainer, Acta Biomater. 10 (2), 580 (2014). DOI:
нологической особенностью FDM-метода.
10.1016/j.actbio.2013.10.024.
6.
H. V. Raeisdasteh, S. Davaran, A. Ramazani, and R.
ЗАКЛЮЧЕНИЕ
Salehi, J. Biomater. Sci. Polym. Ed. 28 (16), 1797
(2017). doi: 10.1080/09205063.2017.1354674.
Настоящее исследование подтверждает целе-
7.
G. S. Kim, J. Park, S. A. Kim, and D. Wan, Macro-
сообразность армирования биодеградируемых
molec. Rapid Commun.
29,
1577
(2008). DOI:
сосудистых графтов на основе полигидроксибу-
10.1002/marc.200800277.
тирата/валерата и поликапролактона, изготов-
8.
C. Spadaccio, F. Nappi, F. De Marco, et al., Drug Tar-
ленных методом электроспининга, с целью со-
get Insights
28
(10),
1
(2016). DOI:
10.4137/
хранения их остаточного просвета в условиях пе-
DTI.S35202.
региба. В то же время выбор оптимальной
9.
M. Centola, A. Rainer, C. Spadaccio, et al., Biofabrica-
конфигурации армирующего каркаса, нанесен-
tion 2 (1), 014102 (2010). DOI: 10.1088/1758-5082/2/
1/014102.
ного методом послойного наплавления из поли-
капролактона, требует проведения расширенного
10.
M. L. Neal and R. Kerckhoffs, Brief. Bioinformatics 11
(1), 111 (2010). DOI: 10.1093/bib/bbp049.
исследования на основе более точных моделей
конечного устройства и моделей материала.
11.
H. B. Smouse, A. Nikanorov, and D. LaFlash, Endo-
vasc. Today 4, 60 (2005).
Работа выполнена при поддержке гранта «Раз-
12.
A. Swillens, J. Degroote, J. Vierendeels, et al., Med.
работка научных основ изготовления и модифи-
Phys. 37 (8), 4318 (2010).
кации биодеградируемого сосудистого графта и
13.
N. Demanget, P. Latil, L. Orgéas, et al., Ann Biomed
его тестирования in vitro», блок проекта «Биоде-
Eng. 40 (12), 2674 (2012). DOI: 10.1007/s10439-012-
градируемый сосудистый графт малого диаметра,
0618-0.
модифицированный функционально активными
14.
N. Demanget, A. Duprey, P. Badel, et al., J. Endovasc.
пептидами» комплексной программы фундамен-
Ther. 20 (4), 523 (2013). DOI: 10.1583/12-4063.1.
Analysis of the Flexural Rigidity of Vascular Grafts
with the Use of Numerical Simulation Methods
E.A. Ovcharenko*, K.U. Klyshnikov*, M.A. Rezvova*, L.V. Antonova*, T.V. Glushkova*,
S.E. Vinokurov*, V.V. Sevostyanova*, E.O. Krivkina*, A.V. Batranin**, Yu.N. Zakharov***,
V.G. Borisov***, Yu.A. Kudryavtseva*, and L.S. Barbarash*
*Research Institute for Complex Issues of Cardiovascular Diseases, Sosnovyi bul’var 6, Kemerovo, 650002 Russia
** Tomsk Polytechnic University, prosp. Lenina 30, Tomsk, 634050 Russia
*** Kemerovo State University, Krasnaya ul. 6, Kemerovo, 650000 Russia
This paper is devoted to a numerical evaluation of the effectiveness of the hardening of small-diameter vascular
grafts made of polymeric materials. The study we consider here is based on finite element analysis describing the
algorithm for finding optimal parameter settings with respect to the reinforcing layer and evaluating it in view of a
stress-strain state under conditions of longitudinal bending simulation. Research findings can be useful for indus-
trial and laboratory trials associated with the study of the strengthening properties of similar products.
Keywords: vascular prosthesis, reinforcement, finite element analysis, polymer
БИОФИЗИКА том 64
№ 3
2019