БИОФИЗИКА, 2019, том 64, № 4, с. 629-645
МОЛЕКУЛЯРНАЯ БИОФИЗИКА
УДК 577.32
СОВРЕМЕННЫЕ ПОДХОДЫ К АНАЛИЗУ ВЗАИМОДЕЙСТВИЯ
БЕЛКОВ И ЛИГАНДОВ
© 2019 г. А. В. Коршунова* **, Ю. Н. Лопанская**, Н. Б. Гудимчук* **
*Центр теоретических проблем физико-химической фармакологии РАН, 119991, Москва, ул. Косыгина, 4
**Физический факультет Московского государственного университета имени М.В. Ломоносова,
119191, Москва, Ленинские горы, 1/2
E-mail: gudimchuk@phys.msu.ru
Поступила в редакцию 13.05.2019 г.
После доработки 13.05.2019 г.
Принята к публикации 24.05.2019 г.
Благодаря развитию методов молекулярного моделирования и прогрессу вычислительной техники,
стремительно растут возможности компьютерного анализа конформационных свойств белков и ха-
рактера их взаимодействия с лигандами. Несмотря на это, существующие теоретические методы
все еще далеки от идеала, и их предсказания нуждаются в экспериментальной верификации. По-
этому крайне востребованы точные экспериментальные методы измерения параметров взаимодей-
ствия белков и малых молекул для решения фундаментальных и прикладных задач, таких как изу-
чение внутриклеточных процессов и создание новых лекарств. В этом обзоре мы рассматриваем три
хорошо зарекомендовавших себя современных биофизических подхода для определения аффинно-
сти, стехиометрии энергетики взаимодействия белков и лигандов: метод изотермической титраци-
онной калориметрии, метод микротермофореза и метод поверхностного плазмонного резонанса.
Особое внимание уделяется развитию технических возможностей этих методов в последние годы,
тонкостям их практического использования и иллюстрациям их применения для решения конкрет-
ных биофизических задач в фармакологии.
Ключевые слова: изотермическая титрационная калориметрия, микротермофорез, поверхностный
плазмонный резонанс, белки, лиганды, разработка лекарств.
DOI: 10.1134/S000630291904001X
важных путей метаболизма в бактериальной клет-
Значимость взаимодействия белков и лиган-
ке [1].
дов в живых организмах сложно переоценить.
Связываясь с малыми молекулами различной
Современные методы предоставляют широкие
возможности для поиска новых лигандов для за-
природы, белки могут менять свою конформа-
дач фармакологии. В классическом варианте для
цию и свойства, и благодаря этому выполнять са-
отбора молекул-лигандов используют многоэтап-
мые разные задачи - от катализа биохимических
ный процесс, включающий в себя предваритель-
реакций до переноса внутриклеточных грузов.
ный биоинформатический анализ потенциаль-
Такие лиганды, как природные и синтетические
ных лигандов, экспериментальную проверку вза-
яды, подавляют физиологические функции бел-
имодействия,
дальнейшую модификацию
ков. Лиганды-лекарства создаются или подбира-
молекулы для улучшения ее лекарственных
ются человеком для того, чтобы непосредственно
свойств [2,3]. Вычислительные методы позволя-
взаимодействовать с ключевыми участниками
ют моделировать взаимодействие лигандов с вы-
бранной мишенью in silico и предсказывать с по-
биохимических реакций и модифицировать их
мощью молекулярного докинга и других методов
свойства для достижения нужного медицинского
вероятность связывания конкретного лиганда с
эффекта. Так, например, большинство антибио-
активным центром выбранной мишени. Это дает
тиков с точки зрения влияния на внутриклеточ-
возможность отсеять малоперспективные соеди-
ные процессы являются ингибиторами жизненно
нения еще до начала эксперимента in vitro и
уменьшить временные и ресурсные затраты [2].
Сокращения: ИТК - изотермическая титрационная кало-
Однако отобранные на этом этапе молекулы в
риметрия, МТФ - микротермофорез, ППР - поверхност-
ный плазмонный резонанс, LpxC - уридиндифосфат-3-O-
дальнейшем требуют экспериментальной про-
ацил-N-ацетилглюкозаминадеацетилаза.
верки по ряду параметров, целью которой в
629
630
КОРШУНОВА и др.
первую очередь является установление факта вза-
лиганд» [8,9]. Под основными термодинамиче-
имодействия потенциальных лигандов с белком-
скими параметрами подразумеваются изменение
мишенью. Во-вторых, следует учитывать, что по-
энтальпии (ΔН), изменение энтропии (ΔS), изме-
нимание взаимодействия белка и лиганда в тер-
нение свободной энергии Гиббса (ΔG), а также
минах поиска эффективного лекарственного
равновесная константа диссоциации (Кd) и сте-
средства лежит за пределами простого принципа
хиометрия (n) взаимодействия взаимодействие
«все или ничего», есть взаимодействие или нет.
лиганда с белком-мишенью.
Для эффективной оценки молекулы в качестве
потенциального ингибитора требуются количе-
Впервые титрационная калориметрия была
ственные характеристики, такие как аффинность
предложена для измерения константы равнове-
и специфичность образования комплекса. Для
сия реакций формирования металл-ионных ком-
определения этих величин на помощь классиче-
плексов и окислительно-восстановительных ре-
ской биологии приходит физика, а именно тер-
акций [10]. В оригинальных работах были оцене-
модинамика и оптика.
ны погрешности метода: случайные, привно-
симые в процессе титрования погрешности со-
На настоящий момент существует несколько
ставили 0,4%, ошибка оценки калориметром вы-
методик, позволяющих экспериментально изме-
деляемого тепла не превышала 0,1%. В сумме ме-
рять ключевые параметры взаимодействия лиган-
дов с белком-мишенью. Они широко применя-
тод позволял вычислить равновесную константу
ются в фармакологии и лабораторных исследова-
ассоциации в пределах 104-105 М-1. С появлени-
ниях для создания новых лекарственных
ем более чувствительных калориметров метод
препаратов. Какой из подходов выбрать для про-
ИТК был применен для изучения биологических
ведения исследования зависит от доступности
объектов [11]. В последующем развитие метода
метода, его возможностей, преимуществ и недо-
шло в плоскости количественной оценки равно-
статков. Для определения ключевой характери-
весной константы диссоциации биологических
стики взаимодействия молекул, константы свя-
молекул. Более широкое практическое примене-
зывания, в арсенале современного исследователя
ние метод получил после создания первого ком-
есть ряд методик, из которых широкое практиче-
мерческого прибора MicroCal. В работе [4] приво-
ское применение имеют методы изотермической
дится подробные схема работы прибора и прин-
титрационной калориметрии (ИТК) [4], микро-
цип метода ИТК. На сегодняшний день
термофореза (МТФ) [5] и поверхностного плаз-
производится несколько модификаций калори-
монного резонанса (ППР) [6]. В настоящем обзо-
метров с разной степенью автоматизации процес-
ре эти три метода будут рассмотрены с точки зре-
са и производительностью.
ния области применения, точности, инфор-
мативности и удобства использования для потен-
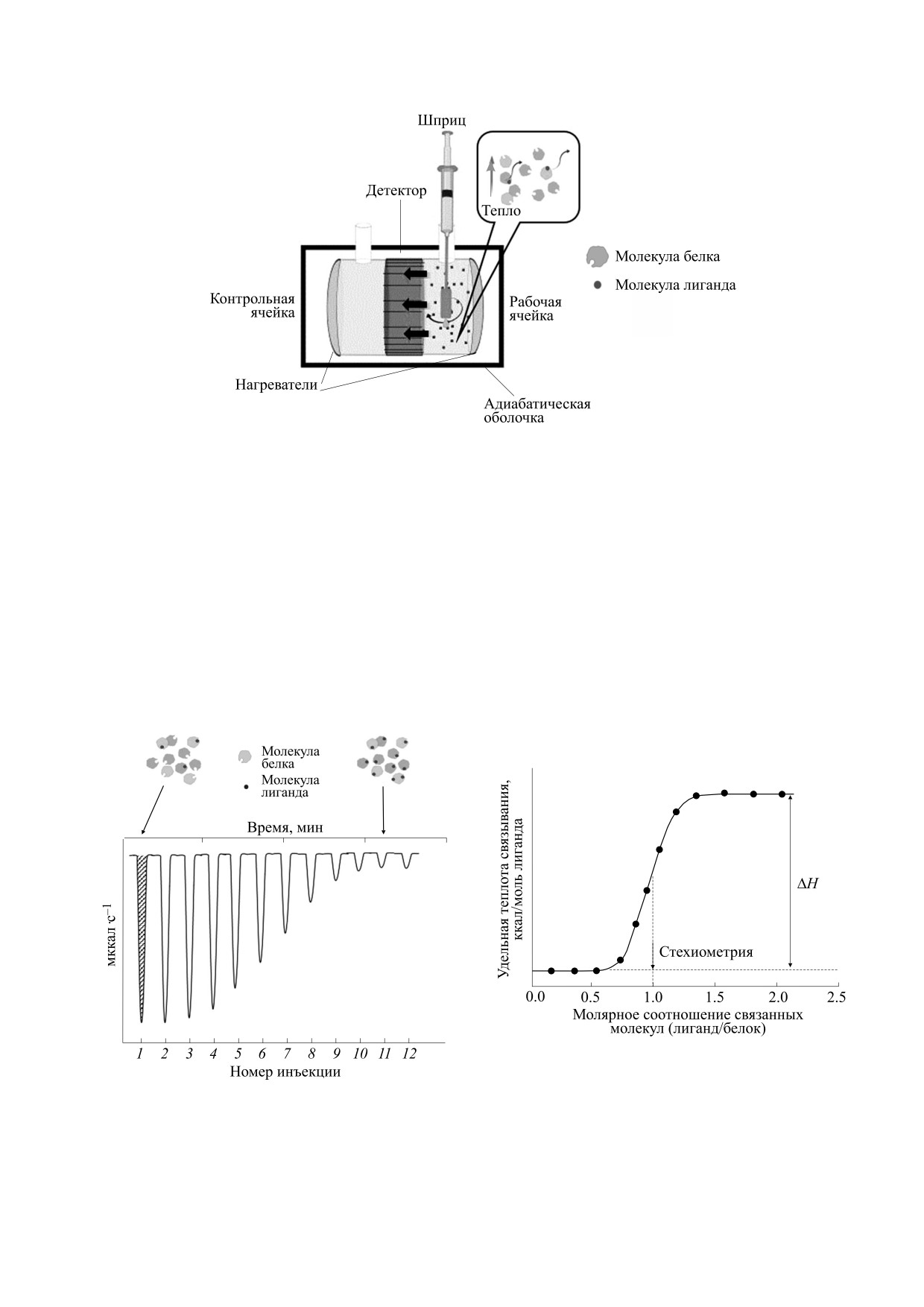
Рассмотрим принцип работы ИТК. Если со-
циального исследователя.
здать условия, отвечающие понятию «закрытая
система», и измерить тепло, выделяемое или по-
глощаемое в результате взаимодействия молекул
ИЗОТЕРМИЧЕСКАЯ ТИТРАЦИОННАЯ
в этой системе, то мы можем рассчитать измене-
КАЛОРИМЕТРИЯ
ние энтальпии системы и связанные с нею пара-
метры [7]. Этот принцип и лежит в основе метода
Метод изотермической титрационной калори-
ИТК. Измерительная часть прибора для опреде-
метрии (ИТК) основан на прямом измерении
температуры в системе взаимодействующих мо-
ления констант равновесия методом ИТК состо-
ит из двух ячеек, контрольной и рабочей, окру-
лекул. Выделение или поглощение тепла является
женных адиабатической оболочкой. К каждой
практически универсальным свойством реакций
взаимодействия и наблюдается как при образова-
ячейке подсоединен сверхчувствительный кало-
нии ковалентных связей, так и при перестройке и
риметр, сенсор и нагреватель (рис. 1). В рабочую
образовании нековалентных, в первую очередь
ячейку с раствором макромолекул с помощью
водородных, связей [7]. В отличие от оптических
шприца вносится определенное количество рас-
и химических методов, измерение тепла в системе
творенного лиганда с последующим автоматиче-
не требует специальных реагентов и модифика-
ским перемешиванием (шприц оснащен ротаци-
ций изучаемых веществ, таких как, например,
онной установкой, которая позволяет перемеши-
присоединение флуорофора. Все это позволяет
вать раствор в ячейке с образцом). Изменение
изучать методом ИТК взаимодействие широкого
тепла регистрируется сверхчувствительным кало-
спектра молекул в водном растворе в среде, при-
риметром (чувствительность ±0,5 нкал). При вза-
ближенной к естественной. На настоящий мо-
имодействии внесенной доли лиганда с белком
мент метод ИТК является общепринятым и од-
выделяется тепло ΔQ согласно следующему урав-
ним из наиболее употребительных способов из-
нению:
мерения
основных
термодинамических
показателей взаимодействия в системе «белок-
ΔQ = ΔH·Δ[Lb]V,
(1)
БИОФИЗИКА том 64
№ 4
2019
СОВРЕМЕННЫЕ ПОДХОДЫ К АНАЛИЗУ
631
Рис. 1. Схема устройства изотермического титрационного калориметра с рабочей и контрольной ячейками, шприцом
для введения раствора лиганда и детектором изменения температуры.
где ΔH - удельная энтальпия взаимодействия од-
прибор регистрирует сигнал в виде пика мощно-
ного белка и одного лиганда, Δ[Lb] - изменение
сти, потребовавшейся для компенсации выделен-
концентрации связанного лиганда при добавле-
ной в результате взаимодействия теплоты (рис. 2).
нии очередной инъекции лигандов в раствор с
Высота и ширина регистрируемого пика зависят
белком, V - объем экспериментальной камеры.
от разницы температур и времени, потребовав-
шемся на возвращение температуры к исходной
В ответ на введение очередной порции лиганда
[4]. Затем процесс повторяется с равным шагом
в раствор с белком-мишенью сенсор обнаружива-
по времени для следующего объема добавленного
ет разницу температур между ячейками, происхо-
лиганда. В результате система достигает момента,
дит включение нагревателей и температура вы-
когда добавление очередной порции лиганда уже
равнивается до исходного уровня. В результате
не приводит к детектируемому изменению темпе-
Рис. 3. Схематическое изображение кривой зависи-
мости удельной теплоты связывания лиганда и белка
от их молярного соотношения, получаемой в резуль-
Рис. 2. Схематическое изображение изменения тем-
тате обработки экспериментальных данных, полу-
пературы в рабочей камере изотермического титра-
ченных методом изотермической титрационной ка-
ционного калориметра при титровании лиганда.
лориметрии.
БИОФИЗИКА том 64
№ 4
2019
632
КОРШУНОВА и др.
ратуры ячейки, так как весь белок образовал ком-
P + L ↔ PL.
(2)
плекс с лигандами.
Константа связывания Ka такой реакции вы-
Затем каждый пик, соответствующий измене-
ражается как соотношение концентраций ком-
нию температуры в системе, интегрируется по
плекса «белок-лиганд» [PL] и произведения кон-
времени (рис. 2, заштрихованная область) и де-
центраций свободного белка [P] и свободного ли-
лится на количество добавленных лигандов для
ганда [L]:
получения зависимости удельной теплоты реак-
ции от молярного соотношения концентраций
[PL]
K
=
(3)
белка и лиганда (рис. 3). Этот график позволяет
a
[P][L]
вычислить термодинамические параметры взаи-
модействия «белок-лиганд» следующим обра-
Параметр связывания ν в случае n независи-
зом.
мых эквивалентных сайтов связывания на по-
Рассмотрим связывание лиганда L с белком P,
верхности белка определим как отношение кон-
предполагая простейшую реакцию их взаимодей-
центрации связанных лигандов [Lb] к полной
ствия:
концентрации белка [PT] [12]
[
L
b
]
n
[
PL
]
nK
a
[P][L]
nK
a
[
L
]
ν=
=
=
=
(4)
[
T
]
P P]
+
[
PL
]
[P]
+
K
a
[P][L]
1+
K
a
[
L
]
Суммарное количество тепла Q после добавле-
может быть вычислена как разность между общей
ния некоторого количества инъекций лиганда к
концентрацией лигандов [LT] и концентрацией
раствору белка можно представить в виде следую-
связанных лигандов [Lb]:
щего уравнения:
Q
[L]
=
[L
]
−
[L
]
=
[L
]
(6)
nK L
T
b
T
a
Q=ΔH[L
]V =ΔH
ν[P
]V =ΔH
[
P
]
V
(5)
−ΔHV
b
T
T
1+
a
K L
Точная концентрация несвязавшихся лиган-
Подставляя уравнение (6) в уравнение в (5),
дов [L] в каждый момент времени неизвестна, но получим:
K
2
a
Q
-
(1 +
K
[
L
]
+
nK
[
L
])
Q+ΔHnK
[
P
][
L
]
V
=
0.
(7)
a
T
a
T
a T
T
ΔHV
Отсюда можем выразить Q:
ΔHV
2
2
Q
=
1+
K
[
L
]
+
nK
[
P
]
−
(1
+
K
[
L
]
+
nK
[
P
]
)
−
4nK
[
P
][
L
]
(8)
(
a
T
a
T
a
T
a
T
a
T
T
)
2
K
a
При условии, что смешивание происходит не-
Значит, для получения графика зависимости
большими порциями, можем приближенно счи-
удельной теплоты, выделившейся при добавле-
тать:
нии лиганда к раствору белка, от молярного соот-
[L
T
]
ношения лиганда и белка
, можем продиффе-
[P
]
Δ
Q dQ
T
≈
(9)
ренцировать выражение (8) по [LT] и разделить
Δ[
L
T
]
d[L
T
]
обе части уравнения на объем эксперименталь-
ной камеры V:
⎛
⎞
1
dQ
ΔH
1+
K
a
[
L
T
]
−
nK
a
[
P
T
]
=
⎜
1
−
⎟
(10)
⎜
2
2
⎟
V d
[
L
]
2
T
⎝
(
1
+
K
a
[
L
T
]
+
nK
a
[
P
T
])
−
4
nK
a
[
P
T
][
L
T
]
⎠
БИОФИЗИКА том 64
№ 4
2019
СОВРЕМЕННЫЕ ПОДХОДЫ К АНАЛИЗУ
633
Это уравнение описывает кривую на рис. 3.
[LT]
При стремлении соотношения
к нулю полу-
[P ]
T
чаем значение удельного изменения энтальпии
ΔH при связывании лиганда с белком. Оно пред-
ставляет собой количество тепла, выделенного
или поглощенного системой, которое отражается
на графике как высота кривой от основания до
плато. При известных Ка и ΔН можно рассчитать
такие термодинамические параметры как свобод-
ную энергию Гиббса (ΔG) и изменение энтропии
системы (ΔS). Эти параметры связаны с вычис-
ленными Ка и ΔН следующим уравнением:
ΔG0 = - RTlnKa = ΔН0 - TΔS0,
(11)
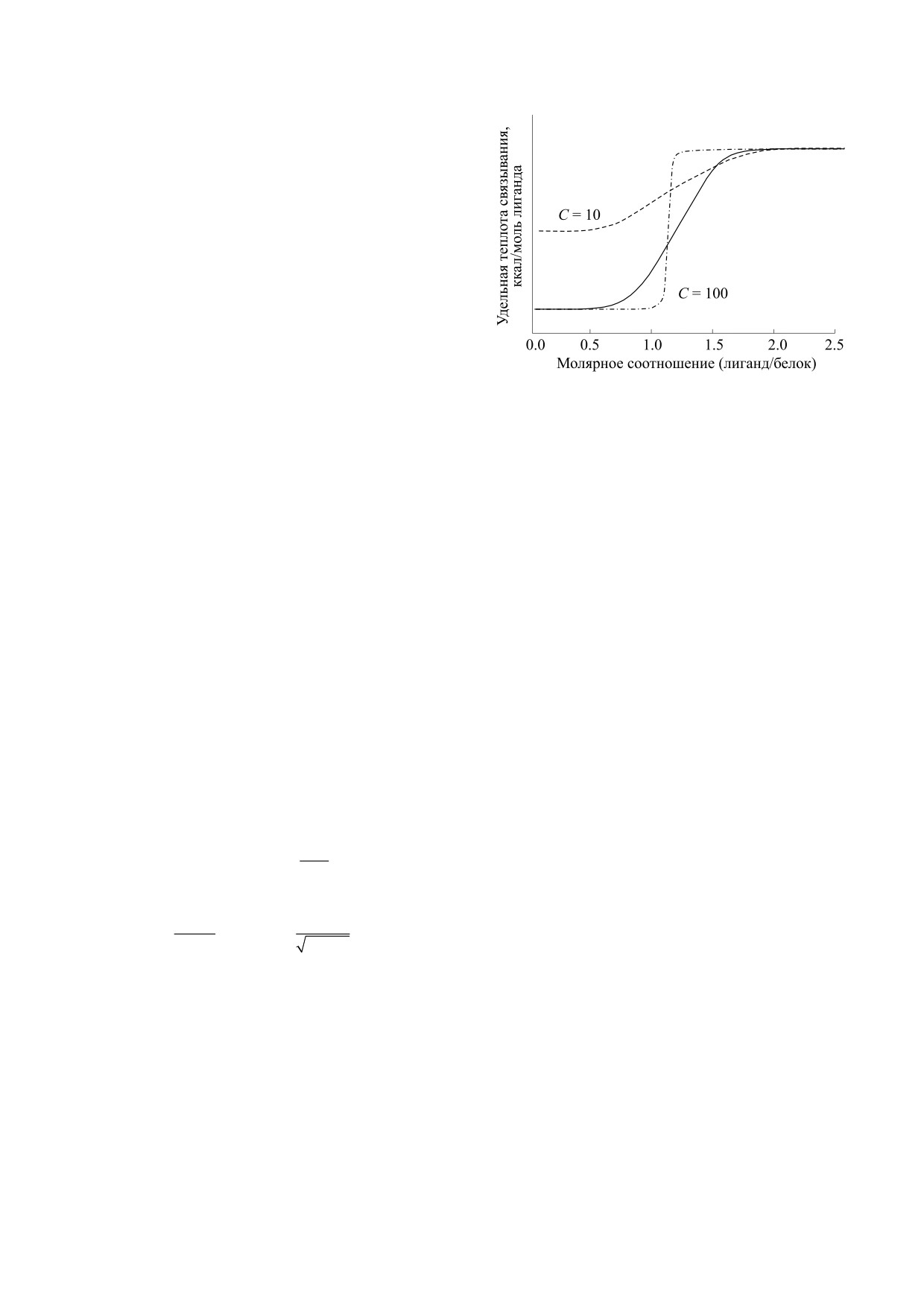
Рис. 4. Схематическое изображение кривых, получае-
мых при обработке экспериментальных данных, по-
где R - газовая постоянная, T - абсолютная тем-
лученных методом изотермической титрационной
пература.
калориметрии, при разных значениях параметра С.
Пунктирные линии соответствуют значениям С = 10
Таким образом, метод ИТК позволяет количе-
и С = 100. Для сравнения приведена кривая при опти-
ственно оценить целый ряд термодинамических
мально подобранном параметре С около 30 (сплош-
параметров взаимодействия белка и лиганда: Ka,
ная линия).
n, ΔH, ΔG, ΔS. При этом только Ka, n и ΔH изме-
ряются напрямую из уравнения (10), а ΔG и ΔS
точку перегиба. Как правило, при С < 20 ошибка
вычисляются косвенно на основе уравнений (11).
измерения Ka становится существенной [8].
От чего зависит точность определения этих па-
Само значение аффинности связывания «бе-
раметров? В межлабораторном исследовании,
лок-лиганд» определяет требования к минималь-
проведенном Ассоциацией биомолекулярных ис-
ной концентрации белка, необходимой для изме-
следовательских центров (Association of Biomolec-
рения методом ИТК. Чем выше аффинность свя-
ular Resource Facilities - ABRF, Bethesda, США),
зывания
«белок-лиганд», тем меньшая
метод ИТК применяли для изучения взаимодей-
концентрация белка требуется. Так, для пар «бе-
ствия хорошо изученной пары «фермент - инги-
лок-лиганд» с высокой аффинностью взаимо-
битор». Один из выводов этого исследования со-
действия, например, антитело и его мишень, тре-
стоял в том, что наибольший вклад в ошибку из-
буется низкая концентрация белка в растворе
мерения константы связывания вносят
[13]. При проведении поиска веществ в качестве
неточности приготовления растворов при взве-
лигандов для некоторого белка-мишени, как в
шивании и растворении [8]. Вторым фактором,
случае скрининга потенциальных лекарств, кон-
влияющим на точность измерения, является со-
станта связывания априори неизвестна, а значит,
отношение концентраций белка и лиганда в экс-
проблематично не только выбрать оптимальную
перименте. Чтобы более детально понять харак-
концентрацию белка для измерений, но и соот-
тер этой зависимости, обратимся к формуле (10).
ношение белка и лиганда, определяющее значе-
[
L
T]
ние параметра С. В таких случаях общими эмпи-
Рассмотрим случай, когда
=
n, вводя пара-
[
P
]
рическими рекомендациями являются следую-
T
метр С = nKa[PT]:
щие: концентрация лиганда должна быть в 10 раз
больше концентрации белка, концентрация бел-
1
dQ
Δ
1
ка - не менее 5 мкМ [14].
=
1−
(12)
H(
)
V d
[
L
T
]
2
1
+
4C
Следует также учитывать, что изменения эн-
тальпии, регистрируемые при измерениях, про-
На рис. 4 схематически представлены кривые с
исходят от различных взаимодействий, включаю-
разным значением С при равных Ka. Как видно,
щих перегруппировку молекул, образование не-
при достаточно большом С на графике различи-
специфических
связей,
перемешивание
мы ΔH и точка перегиба функции, абсцисса кото-
растворителей и прочее [9]. Поскольку прибор
рой дает значение стехиометрического коэффи-
ИТК не в состоянии различить источники появ-
циента n, а наклон графика в этой точке дает кон-
ления разницы температур в системе, чрезвычай-
станту равновесия Ka. При малых значениях
но важна постановка соответствующих контро-
параметра С определение характеристик взаимо-
лей. Для проведения реакции желательно исполь-
действия «белок-лиганд» становится затрудни-
зовать препараты белка и лиганда высокой
тельным, так как не удается легко определить
степени очистки, сравнимой с требованиями для
БИОФИЗИКА том 64
№ 4
2019
634
КОРШУНОВА и др.
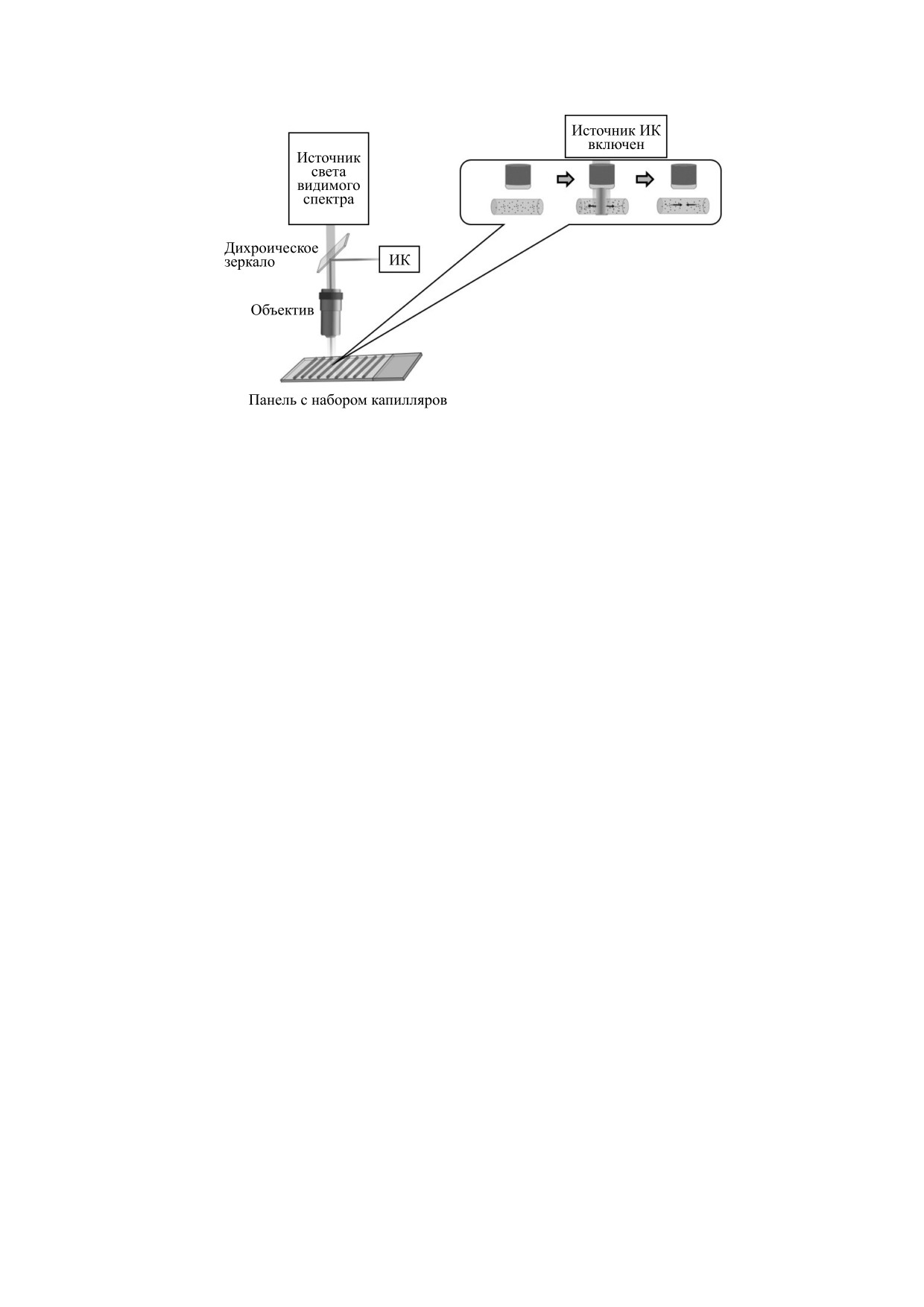
Рис. 5. Схема устройства прибора для измерения равновесной константы диссоциации методом микротермофореза с
двумя источниками света - видимого и инфракрасного. На врезке - процесс термодиффузии и диффузии
флуоресцентно меченного белка в капилляре в результате включения и выключения инфракрасного света
соответственно.
кристаллизации белка в рентгеноструктурном
оболочки и других параметров [20,21]. Чаще это
анализе [15].
движение направлено из области с более высокой
температурой в область с более низкой [5]. Таким
Таким образом, постановка эксперимента ме-
тодом ИТК требует тщательной предварительной
образом, в области нагрева инфракрасным лазе-
подготовки, включающей в себя внимательное
ром концентрация молекул изменяется. Если мо-
лекулы пометить флуоресцентной меткой, то из-
приготовление растворов исследуемых веществ и
менение концентрации приведет и к изменению
оптимальный подбор соотношения их концен-
флуоресценции в области нагрева. Измеряя отно-
траций для получения релевантных данных. Учи-
сительное изменение флуоресценции, можно су-
тывая существенный объем исследуемого препа-
рата (около 300 мкл), необходимый для проведе-
дить об изменении концентрации вещества.
ния одного эксперимента, для скрининга новых
При отсутствии внешних сил устанавливается
лигандов требуется большое количество белка
равновесие между потоками молекул, стремящи-
высокой степени очистки. Это объясняет, почему
мися выйти или зайти в нагретую область про-
ИТК в настоящее время часто используют для
странства из-за термодиффузии и потоками мо-
вторичного скрининга целевых молекул, способ-
лекул, стремящимися выровнять концентрацию
ность которых связываться с белком-мишенью
из-за обычной диффузии. В результате в более
уже была установлена другими методами [16-18].
нагретой и менее нагретой частях пространства
устанавливается соотношение концентраций
[21]:
МИКРОТЕРМОФОРЕЗ
C
Метод микротермофореза основан на явлении
hot
=
exp(−S
ΔT),
(13)
t
термодиффузии молекул в растворе с градиентом
C
cold
температуры. Это явление было обнаружено и
где Chot и Ccold - концентрации молекул в теплой
описано в 1856 г. [19], однако практическое при-
и холодной областях соответственно; ΔT - раз-
менение явление получило только с появлением
ность температур между этими областями, St -
современных оптических технологий и точных
методов детекции флуоресценции.
коэффициент Соре, равный отношению коэф-
фициента термодиффузии к коэффициенту
Для измерения аффинности молекул методом
обычной диффузии молекул.
микротермофореза небольшую область стеклян-
ного капилляра (около 25 мкм) с образцами в рас-
Теория термофореза на данный момент до конца
творе облучают инфракрасным лазером, в резуль-
не построена и продолжают разрабатываться модели
тате чего происходит нагрев на 2-6 K (рис. 5).
этого явления. Ниже приведем некоторые сообра-
Под действием градиента температуры молекулы
жения, которые были предложены для расчета ко-
начинают диффундировать в нагретую область
эффициента Соре. Предполагая, что малые измене-
или из нее. Скорость и направление движения
ния концентрации молекул в нагретой области (δc)
молекул зависят от размера, заряда, сольватной
приводят к малым изменения свободной энергии
БИОФИЗИКА том 64
№ 4
2019
СОВРЕМЕННЫЕ ПОДХОДЫ К АНАЛИЗУ
635
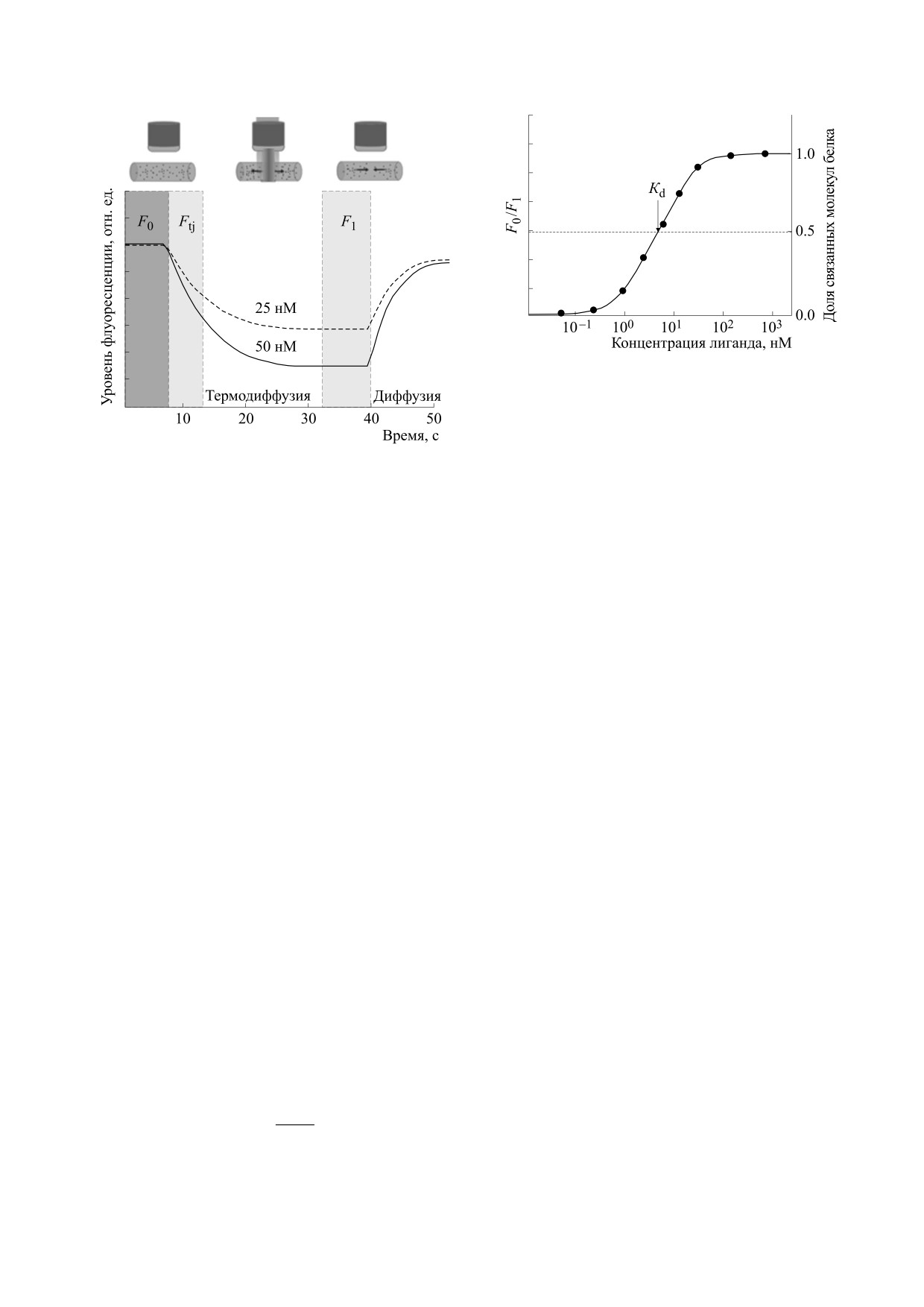
Рис. 7. Схема графика зависимости удельного уровня
флуоресценции ΔFnorm от концентрации лиганда для
определения равновесной константы диссоциации
по данным микротермофореза
Рис.
6.
Схема кривой изменения уровня
где А - эффективная площадь поверхности ча-
флуоресценции при микротермофорезе, где F0
-
стицы, Δshyd - приведенная энтропия гидратации
начальный уровень флуоресценции до включения
инфракрасного лазера, Ftj и F1
- изменение
(на единицу поверхности), ε - диэлектрическая
флуоресценции в измеряемой области капилляра
проницаемость среды; ε0 - электрическая посто-
после включения инфракрасного лазера. На рисунке
янная; β - фактор, вычисляемый по зависимости
схематично представлены графики для двух
концентраций лиганда - 50 и 25 нМ.
диэлектрической проницаемости раствора от
температуры.
Таким образом, из формулы (15) становится
(δG), можно записать уравнение термодинамиче-
очевидно, что на термодиффузию частицы влияет
ского равновесия: δc/c = δG/kT [20]. С другой сторо-
ны, δc/c = St δT. Отсюда коэффициент Соре можно
ряд ее характеристик, изменение каждой из кото-
рых при связывании частицы с другой частицей
вывести как производную свободной энергии по
(например, лигандом) может менять величину
температуре:
коэффициента Соре. Так, например, взаимодей-
ствие двух белков будет изменять площадь по-
∂G
St = Dt /D = (kT)-1×
(14)
верхности молекулы А и приведенную энтропию
∂T
гидратации Δshyd. Взаимодействие небольших за-
ряженных молекул с белком должно повлиять на
Изменение свободной энергии
∂G можно
поверхностную плотность заряда комплекса σeff.
представить как сумму: ∂G = - S∂T + V∂p + μ∂N,
где S - энтропия системы, V - объем, p -
Применение термофореза для определения
давление, μ - химический потенциал, N - число
констант связывания биомолекул предложено
частиц. Отсюда при постоянном давлении и для
сравнительно недавно [23]. Довольно скоро после
отдельной частицы имеем, что коэффициент
начальной формулировки концепции метода был
Соре равен отрицательной энтропии системы
проведен ряд экспериментов на пробной уста-
«частица-растворитель»,
выраженной
в
новке для капиллярного термофореза. Эта поста-
единицах абсолютной температуры (kT).
новка измерений получила название микротер-
Основной вклад в энтропию S вносят два
мофорез [5]. Современные приборы для измере-
слагаемых: энтропия гидратации (ΔShydr) и
ния аффинности взаимодействий биомолекул
энтропия экранирования заряженной частицы
методом МТФ совмещают в себе элементы флуо-
ионами
[22]. Вынося за скобки площадь
ресцентного микроскопа и капиллярного элек-
поверхности частицы и выражая энтропию
трофореза (рис. 5). Одним из основных произво-
экранирования ионами через поверхностный
дителей является компания NanoTemper Technol-
заряд (σeff) и Дебаевский радиус экранировки
ogies (Германия). Производимый ею прибор
(λDH), имеем [20]:
включает источник инфракрасного излучения
2
(инфракрасный лазер, 1480 нм), источники света
⎛
βσ
⎞
A
eff
с разной длиной волны, детектор флуоресценции
S
=
-Δs
+
Δλ
,
(15)
t
⎜
hyd
DH
⎟
kT
⎝
4εε
0
T
⎠
и подложку с 16 тонкими капиллярами.
БИОФИЗИКА том 64
№ 4
2019
636
КОРШУНОВА и др.
Съемка уровня флуоресценции в областях с
высокой и низкой температурой происходит в ре-
жиме реального времени. На рис. 6 представлен
цикл работы прибора МТФ, включающий в себя
регистрацию флуоресценции раствора белка до
включения инфракрасного источника (участок
F0), затем изменение флуоресценции после вклю-
чения инфракрасного лазера в процессе термо-
фореза (участок F1), и последующее восстановле-
ние уровня флуоресценции в результате диффу-
зии молекул после его выключения. Оценка
термодиффузионной подвижности молекул опи-
рается на изменение флуоресценции ΔFnorm со-
0
F
гласно следующему уравнению:
ΔF
(%)
=
norm
F1
Рис. 8. Вид кривых изменения уровня флуоресцен-
Измеряя изменение флуоресценции ΔFnorm
ции относительно начальной флуоресценции при
для различных концентраций добавленного ли-
проведении микротермофореза в оптимальных усло-
виях (отсутствие адсорбции и агрегации меченых мо-
ганда, определяется константа его взаимодей-
лекул): 1 - изменение уровня флуоресценции кон-
ствия с белком Kd (рис. 7). Вид кривых изменения
трольных образцов (меченая молекула в буфере) в ре-
относительной флуоресценции в реальном экс-
зультате термодиффузии,
2
- изменение уровня
перименте представлен на рис. 8.
флуоресценции в результате термодиффузии при вза-
имодействии меченой мишени с лигандом A, 3 - из-
Метод МТФ основан на оптическом измере-
менение уровня флуоресценции в результате термо-
нии флуоресценции, что накладывает свои огра-
диффузии при взаимодействии меченой мишени с
лигандом Б.
ничения и требования при подготовке и проведе-
нии эксперимента. В частности, поскольку боль-
шинство
флуоресцентных
органических
красителей присоединяется через генно-инже-
нерные таги или аминокислотные остатки цисте-
ина или лизина, процесс мечения требует предва-
рительного анализа структуры белка и в некото-
рых случаях - внесения модификаций, что может
Рис. 9. Вид кривых изменения уровня флуоресцен-
ции относительно начальной флуоресценции в экс-
периментах по микротермофорезу при возникнове-
нии проблем: 1 - изменение уровня флуоресценции
контрольных образцов (меченая молекула в буфере) в
результате термодиффузии, 2 - изменение уровня
флуоресценции в результате термодиффузии при
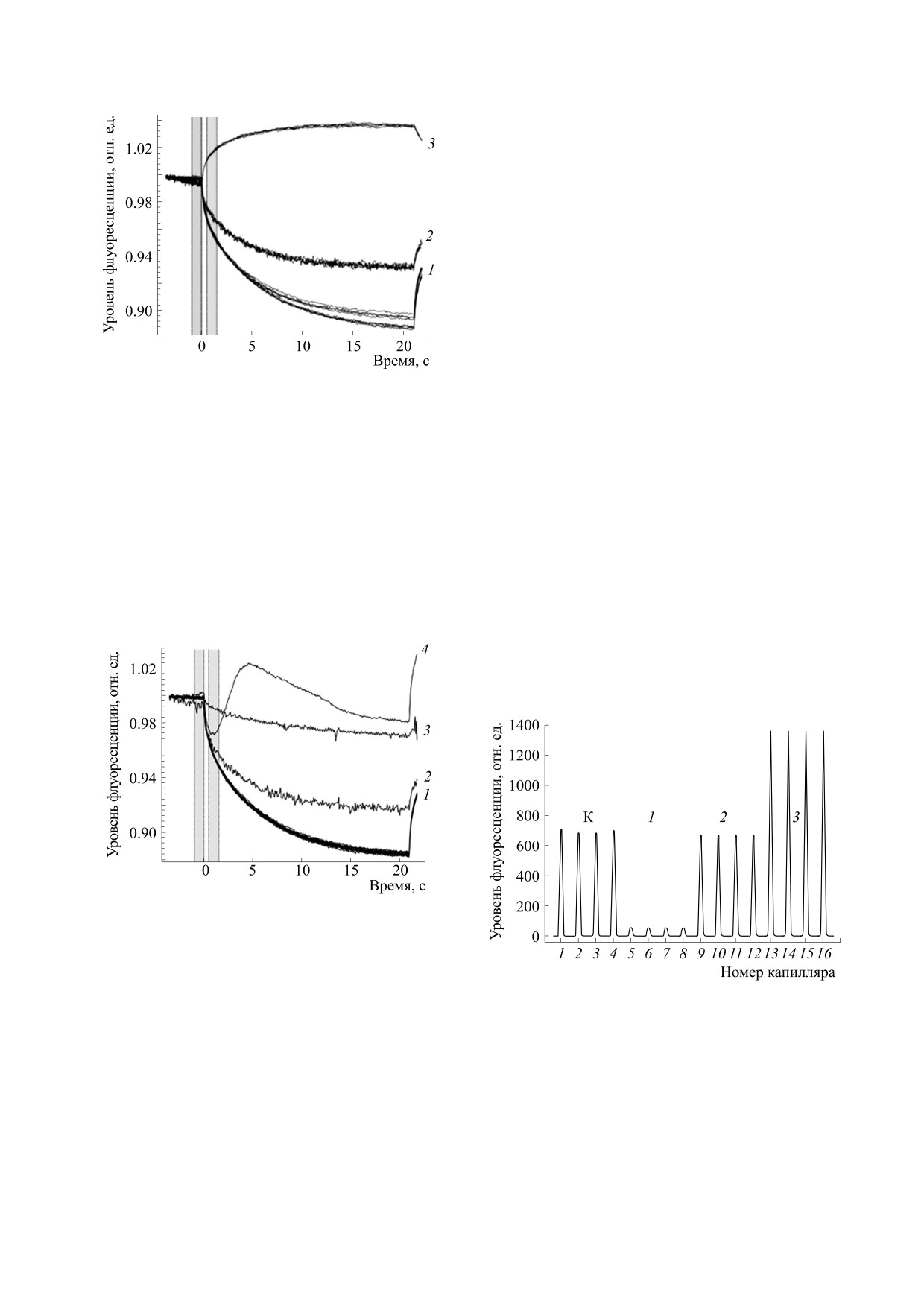
Рис. 10. Влияние лигандов на начальную флуорес-
низком уровне начальной флуоресценции с высоким
ценцию меченой молекулы в экспериментах по мик-
шумом(слабая степень мечения молекулы), 3 - изме-
ротермофорезу: 1-4 - капилляры с контролем к (ме-
нение уровня флуоресценции в результате термодиф-
ченая молекула в буфере), 5-8 - капилляры с мече-
фузии при адсорбции меченой мишени на стенках
ной молекулой и веществом
1
(гашение
капилляра в контрольных образцах (наблюдается
флуоресценции), 9-12 - капилляры с меченой моле-
слабая термодиффузия), 4 - изменение уровня флуо-
кулой и веществом 2 (нет влияния на начальный уро-
ресценции в результате термодиффузии при образо-
вень флуоресценции), 13-16 - капилляры с меченой
вании агрегатов меченой мишени в контрольных об-
молекулой и веществом 3 (усиление начальной флуо-
разцах.
ресценции) (наши экспериментальные данные)
БИОФИЗИКА том 64
№ 4
2019
СОВРЕМЕННЫЕ ПОДХОДЫ К АНАЛИЗУ
637
Рис. 11. Схема устройства прибора для измерения равновесной константы диссоциации методом поверхностного
плазмонного резонанса с источником света, детектором отраженного света и чипом с иммобилизованным белком. На
врезке - изменение интенсивности отраженного света, регистрируемое детектором при возникновении плазмона и
принцип регистрации резонансного угла θ.
повлиять на функциональную активность иссле-
единенным зеленым флуоресцентным белком
дуемой мишени и исказить данные о связывании
EGFP (Enhanced Green Fluorescent Protein) в кон-
с лигандом [24-26]. На настоящий момент суще-
центрации 50 нМ с тремя разными веществами в
ствует подход измерения термодиффузии в МТФ
сравнении с контролем (белок с растворителем).
без внесения флуоресцентной метки по внутрен-
Изменение флуоресценции в присутствии лиган-
ней флуоресценции остатков тирозина в белке
да может происходить по различным механиз-
[27]. Однако этот подход требует использования
мам, наиболее распространенными из которых
высокоочищенного белка из-за неспецифично-
являются динамическое и статическое тушение
сти возникающего флуоресцентного сигнала и
[33]. При динамическом тушении квантовый вы-
подходит не для всех белков.
ход флуоресценции уменьшается за счет повыше-
Поскольку измерение флуоресценции прово-
ния вероятности безызлучательных переходов
дится в небольшом объеме капилляра, любые по-
флуорофора из возбужденного состояния. Это
грешности в толщине стенки и диаметре капил-
может происходить как в результате столкнови-
ляра будут сказываться на наблюдаемом уровне
тельных взаимодействий между лигандом и бел-
флуоресценции. Как следствие, метод требовате-
ком, так и при их непосредственном связывании.
лен к качеству капилляров с точки зрения про-
В этих случаях тушение может быть обусловлено
зрачности стекла и допустимого диапазона раз-
ферстеровским резонансным переносом энергии
меров [28]. Погрешность в методе может внести
от флуорофора белка к лиганду или изменением
адсорбция флуоресцентно меченых молекул на
локального водно-ионного окружения флуоро-
стенки капилляра или их агрегация в растворе,
фора в результате связывания лиганда в его
что приводит к искажению кривых термодифузии
окрестности [34]. При статическом тушении флу-
(рис. 9). Избавиться от нежелательной адсорбции
оресценции лиганд ингибирует, наоборот, само
можно, используя специальные капилляры с гид-
формирование возбужденного состояния флуо-
рофобным или гидрофильным покрытием, а так-
рофора, с которым он связан, полностью подав-
же добавляя детергент в раствор [29,30].
ляя его флуоресценцию. Метод МТФ, как прави-
В некоторых случаях лиганды могут вызывать
ло, не учитывает изменение флуоресценции при
гашение или усиление начальной флуоресценции
добавлении лиганда, поскольку уровень сигнала
молекул еще до включения инфракрасного лазе-
до нагревания всегда принимается за единицу, и
ра, что также может отразиться на результатах
рассматривается его относительное изменение в
расчета Kd методом МТФ [16,31,32]. На рис. 10
результате повышения температуры. При нали-
представлены данные, полученные с помощью
чии тушения появляется выраженное изменение
прибора Monolith NT.115 (NanoTemper Technolo-
интенсивности сигнала МТФ (temperature-related
gies, Германия), иллюстрирующие гашение и уси-
intensity change). Это происходит потому, что
ление начальной флуоресценции в эксперименте
квантовый выход флуоресценции понижается с
по исследованию взаимодействия белка с присо-
повышением температуры при динамическом ту-
БИОФИЗИКА том 64
№ 4
2019
638
КОРШУНОВА и др.
Рис. 12. Общий вид кривой зависимости от времени изменения угла Δθ, при котором возникает плазмонный резонанс
в металлическом покрытии чипа, при связывании лиганда с иммобилизованной молекулой. На рисунке схематично
представлены графики для двух концентраций лиганда - 50 и 25 нМ.
шении, и, наоборот, повышается при статичес-
числяемая величина Ka может различаться в пять
ком тушении (из-за уменьшения аффинности в
раз в зависимости от выбранной зоны сравнения.
си-стеме «лиганд-белок») [35]. При этом, как
Отдельного внимания заслуживает проблема
понят-но из описания его природы, данный
неклассической формы кривой зависимости из-
эффект не обязательно свидетельствует о су-
менения флуоресценции от концентрации лиган-
ществовании прямого взаимодействия между
да. Определение Ka методом МТФ по умолчанию
белком и лигандом и может иметь, например,
предполагает стехиометрию связывания 1:1. При
столкновительный механизм. Поэтому для пра-
наличии в системе «белок-лиганд» двух сайтов
вильной интерпретации результатов эксперимен-
связывания и более возникает наложение кривых
тов требуетcя контрольное дополнительное изме-
связывания, что затрудняет вычисление Ka
рение в присутствии флуорофора без белка и с
[28,36]. Расчет констант для каждого сайта связы-
тем же лигандом [33].
вания по данным МТФ возможен только при
Отличить вклад влияния лиганда на флуорес-
условии достаточной разницы между Ka первого и
ценцию от термофореза можно по кинетике на-
второго сайта связывания [37].
блюдаемого явления. Термофорез занимает не-
сколько секунд, в то время как температурная за-
висимость эффекта лиганда как правило
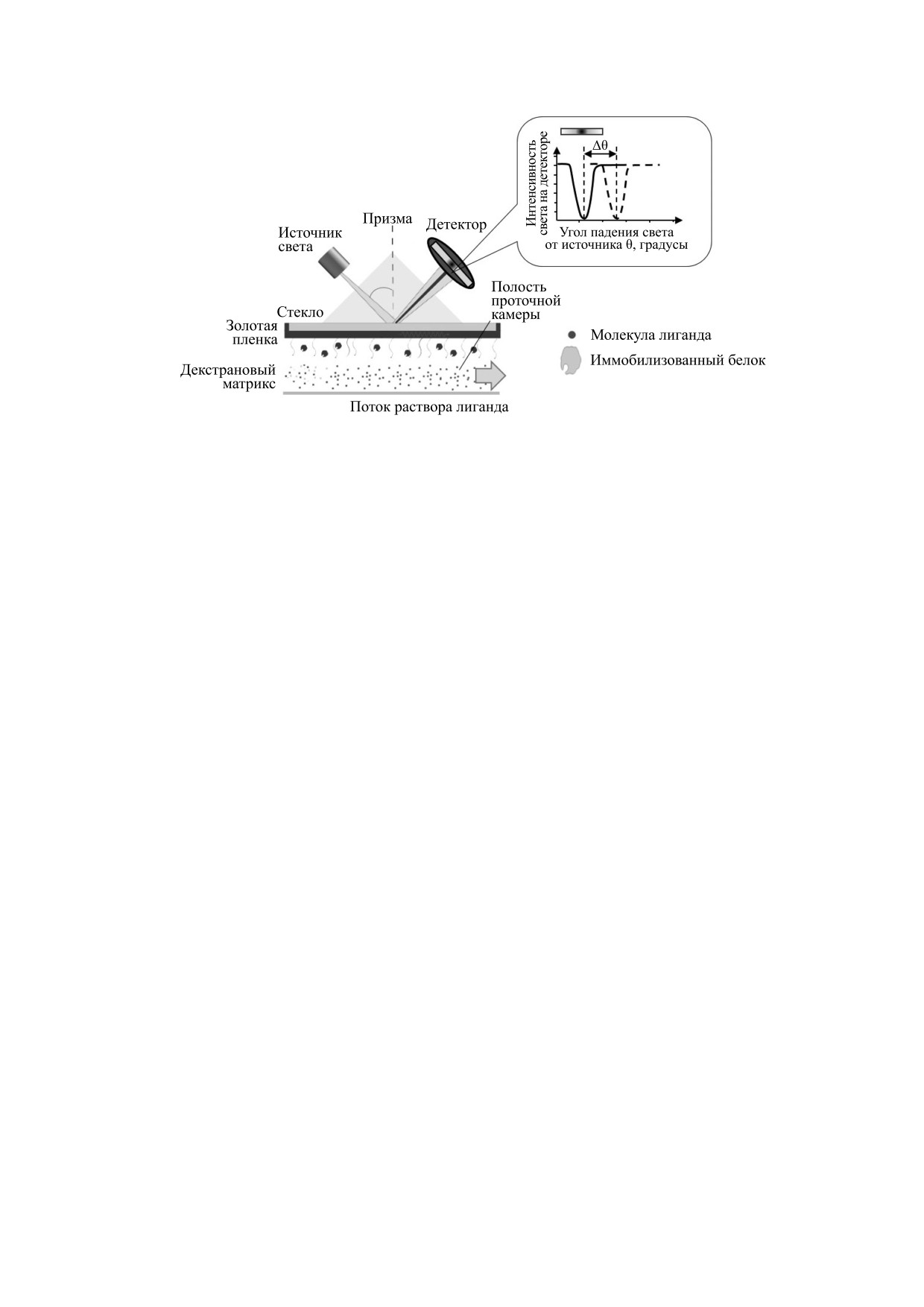
ПОВЕРХНОСТНЫЙ ПЛАЗМОННЫЙ
проявляется значительно быстрее, с постоянной
РЕЗОНАНС
времени до 100 мс. Это позволяет использовать
Измерение равновесных констант связывания
зону быстрой кинетики (Ftj на рис. 6) для расчета
«белок-лиганд» с помощью поверхностного
константы связывания вместо зоны F1 при клас-
плазмонного резонанса основано на регистрации
сическом подходе. В работе [29] показано, что вы- уменьшения доли отраженного от металлической
Рис. 13. Схематическое изображение графика зависимости Δθ от концентрации лиганда для расчета равновесной
константы диссоциации методом поверхностного плазмонного резонанса.
БИОФИЗИКА том 64
№ 4
2019
СОВРЕМЕННЫЕ ПОДХОДЫ К АНАЛИЗУ
639
пленки света в результате перехода части энергии
соответствует 1000 RU. Обычно величина 1 RU
в плазмон. Плазмоном называют волну электрон-
соответствует изменению плотности связывания
ной плотности, которая возникает в тонких ме-
белка на чипе в 1 пг/мм2.
таллических пленках (толщина несколько десят-
На основании полученных данных вычисляет-
ков нанометров) при облучении электромагнит-
ся константа скорости ассоциации белка и лиган-
ным излучением, например, видимым светом,
да kon. После достижения плато в проточную ка-
под определенным углом. Этот угол называется
меру вводится раствор без лиганда для регистра-
резонансным и обозначается θ.
ции процесса диссоциации связавшихся молекул
Впервые метод ППР для измерения аффинно-
с последующей оценкой константы скорости
сти биологических объектов был применен в
диссоциации (koff, рис. 12). Затем в камеру можно
1983 г. [38], а его широкое практическое примене-
ввести следующий раствор лиганда и т.д. На ос-
ние началось после выпуска первого коммерче-
новании полученных кинетических констант
ского прибора «Biacore» (Упсала, Швеция) [6,39].
можно рассчитать равновесную константу диссо-
Основа аппарата для измерения равновесных
k
констант методом ППР включает в себя оптиче-
off
циации:
K
d
скую часть и чип (рис. 11).
=k
on
Оптическая часть прибора в классическом ва-
Альтернативно равновесную константу диссо-
рианте включает в себя источник поляризованно-
циации (Kd) получают при построении графика
го света, призму с большим коэффициентом пре-
зависимости изменения резонансного угла на
ломления np и детектор для измерения интенсив-
плато кинетического графика от концентрации
ности отраженного света (рис. 11). Световая
лиганда в серии экспериментов (рис. 13).
волна источника, распространяющаяся в призме,
Таким образом, метод ППР позволяет напря-
падает на металлическую пленку чипа. Часть све-
мую определить кинетические константы взаи-
та при этом отражается на детектор, а часть про-
модействия молекул без использования каких-
ходит в металл в форме экспоненциально затуха-
либо меток. При проведении серии эксперимен-
ющей волны перпендикулярно поверхности раз-
тов методом ППР по связыванию пары «белок-
дела сред. При падении света под резонансным
лиганд» при разных температурах можно рассчи-
углом волна способна возбудить поверхностный
тать изменение энтальпии ΔH, энтропии и сво-
плазмон в металлической пленке. При этом ин-
бодной энергии Гиббса по измеренной зависимо-
тенсивность отраженного света на детекторе рез-
сти Kd от температуры [42]. Получаемые с помо-
ко падает (рис. 11), что регистрируется прибором.
щью метода ППР термодинамические параметры
Вторая часть прибора (чип) представляет со-
сравнимы с данными, полученными в экспери-
бой проточную камеру, одна сторона которой по-
ментах с ИТК [8]. Дополнительно, используя
крыта тонким слоем металла (толщиной порядка
уравнение Эйринга, по температурным зависи-
десятков нанометров). Материалом для металли-
мостям кинетических констант ассоциации и
ческой пленки обычно служат золото или сереб-
диссоциации белка можно рассчитать энтропию
ро. К поверхности пленки прикрепляется (иммо-
и энтальпию активации в рамках теории активи-
билизуется) один из участников взаимодействия
рованного комплекса [42].
в планируемом эксперименте. На сегодняшний
Метод ППР подходит для скрининга больших
день компаниями производится огромное разно-
библиотек веществ благодаря относительно вы-
образие готовых чипов с покрытием на металле
сокой скорости (2300 веществ в сутки) и проверке
для иммобилизации целевой молекулы широким
не только факта связывания, но и получения ко-
набором способов [40]. На рис. 11 показан пример
личественных параметров реакции. Возможность
чипа с декстрановым слоем для ковалентного
использовать чип повторно в серии опытов суще-
связывания белка на поверхности [41]. Второй
ственно снижает расход белка и сокращает время
партнер взаимодействия прокачивается в водном
подготовки и проведения эксперимента.
растворе через проточную камеру при постоян-
Метод ППР имеет ряд своих особенностей,
ной скорости потока.
которые могут отразиться на точности получае-
При введении раствора лиганда в проточную
мого результата. Так, при взаимодействии моле-
камеру, по мере его связывания с целевой моле-
кул метод ППР дает более точные результаты при
кулой белка, резонансный угол θ начинает сме-
большой массе связывающегося лиганда (чем
щаться в результате изменения локального коэф-
больше масса связывающегося лиганда, тем боль-
фициента преломления на поверхности чипа, что
ше сигнал, получаемый на приборе и тем легче и
регистрируется прибором в реальном времени в
точнее его можно измерить). Таким образом, в
виде графика, представленного на рис. 12. Угол θ
экспериментах с проверкой взаимодействия ма-
изменяется в узком диапазоне, поэтому для оцен-
лых молекул с белками целесообразнее иммоби-
ки его величины применяют условные единицы
лизовать белки на поверхности чипа, а свобод-
ответа (response unit, RU). Смещение угла θ на 0,1°
ный белок вводить в растворе. Однако стандарт-
БИОФИЗИКА том 64
№ 4
2019
640
КОРШУНОВА и др.
Таблица 1. Сравнение параметров методик по определению равновесной константы связывания белка и лиганда
Параметры
ИТК
МТФ
ППР
Измеряемые параметры
Ka, n, ΔH, ΔG, ΔS
Ka
Ka, kon, koff
в одной реакции
Чувствительность определения
10-9 < M < 10-2
10-9 < M < 10-2
10-7 < M < 10-3
константы связывания
Где измеряется
В растворе
В растворе
На металлической
взаимодействие?
подложке (чипе)
Объем образца белка
280-370 мкл
4 мкл
30 мкл
для одной реакции
Концентрация белка
До 5 мкМ
1-10 нМ
Зависит от эксперимента
для одной реакции
и способа иммобилизации
Объем раствора лиганда
40-300 мкл
< 1 мкл
30 мкл
для одной реакции
Концентрация раствора
До 100 мкМ
В 20 раз больше
не менее 1 нМ для молекул
лиганда для одной реакции
ожидаемой Kd
меньше 10 кДа
Чистота образца белка
Необходима как можно
Не важно, можно
Рекомендуется
и лиганда
более высокая степень
использовать клеточный
(желательно) хорошо
очистки
лизат или сыворотку крови
очищенный препарат
Требование дополнительных
Нет
Да, флуоресцентный
Нет
модификаций мишени
краситель
Временные затраты
42 образца за 24 ч
8-16 образцов за 8 ч
15 образцов за 5-15 мин;
на эксперимент
(автоматические
до 400 образцов за 24 ч;
приборы);
до 5000 образцов для
8-12 образцов за 8 ч
автоматических приборов
(неавтоматические
(зависит от их конфигурации)
приборы)
Примечание. Данные приведены на основе методических пособий к приборам MicroCal (Malvern Instruments Limited, Вели-
кобритания), Monolith NT.115 (NanoTemper Technologies GmbH, Германия ), Biacore (GE Healthcare, США).
БИОФИЗИКА том 64
№ 4
2019
СОВРЕМЕННЫЕ ПОДХОДЫ К АНАЛИЗУ
641
ная химия иммобилизации не всегда позволяет
тур, таких как микротрубочки [48-50]. Однако
проводить эксперимент в таком режиме, что
необходимость использовать большой объем реа-
ограничивает чувствительность метода.
гентов и высокие требования к их чистоте и кон-
центрации затрудняет его применение для массо-
В свою очередь, процесс иммобилизации бел-
вого скрининга молекул. На настоящий момент
ка может изменить его функциональность и до-
данный метод, как правило, используется при
ступность активного сайта для связывания, внося
проверочном скрининге для подтверждения свя-
ошибку в измеряемую равновесную константу в
зывания лигандов, отобранных более высокопро-
результате двух эффектов - ограниченности ско-
изводительными и низкозатратными методами,
рости транспорта вещества в измерительной ка-
например, такими как МТФ, ППР или ядерный
мере и возникновения дополнительных сайтов
магнитный резонанс [16-18,51]. Большим пре-
связывания. Ограниченность скорости транспор-
имуществом метода ИТК является определение
та вещества оказывает влияние на доступ лиганда
к ППР-чипу, что может мешать правильному
стехиометрии и удельной энтальпии взаимодей-
ствия. Изменение энтальпии зависит от количе-
определению кинетики изучаемой реакции. Та-
ства образованных связей между молекулами и
кое явление играет большую роль в случае высо-
степени погружения лигандов в глобулу белка
кой константы ассоциации в паре «белок-ли-
ганд» при низкой скорости диффузии лиганда к
[9,52], что помогает оценивать более перспектив-
ные лиганды согласно уравнению эффективно-
поверхности. Для борьбы с этим эффектом важно
сти энтальпии (ЕЕ) для выработки стратегии
устанавливать достаточно высокую скорость по-
дальнейшей модификации потенциальных ле-
тока, более 30 мкл/мин, и использовать низкую
плотность белка на поверхности [43]. Учесть и
ΔH
карственных препаратов [46]:
EE
=
, где ML -
скорректировать наблюдаемые негативные эф-
M
L
фекты также можно при построении и анализе
молекулярная масса лиганда, ΔH -изменение эн-
модели взаимодействия на основе эксперимен-
тальпии.
тальных данных [44].
Оценка термодинамических параметров взаи-
При иммобилизации и использовании про-
модействия позволяет получать представление о
точной камеры может наблюдаться частичная де-
механизме связывания молекул с белком, что
градация белка. В некоторых случаях это приво-
способствует более глубокому пониманию кле-
дит к появлению искусственных низкоаффинных
точных процессов [31,53-55] и оптимизации ди-
сайтов связывания, взаимодействие изучаемых
зайна потенциальных лекарственных средств
молекул с которыми может регистрироваться как
[56-58]. В качестве иллюстрации приведем при-
ложноположительный сигнал [43]. Учесть дан-
мер поиска ингибиторов LpxC-2 и LpxC-4 к бак-
ную ошибку можно постановкой различных кон-
териальному ферменту уридиндифосфат-3-O-
трольных реакций.
ацил-N-ацетилглюкозаминадеацетилазе (LpxC).
Следует учитывать, что метод оценивает общее
LpxC - ключевой фермент в синтезе компонен-
изменение свойств поверхности, но не показыва-
тов наружной мембраны грам-отрицательных
ет напрямую специфичность и стехиометрию вза-
бактерий, что делает его перспективной мише-
имодействия. Эти данные можно получить в ре-
нью для разработки новых антибиотиков [59].
зультате анализа модели взаимодействия изучае-
Однако 20 лет поиска ингибиторов к этому белку
мых молекул [45].
не привели к обнаружению вещества с действием
на широкий спектр патогенных видов бактерий.
Были обнаружены лишь узкоспецифичные инги-
ОСНОВНЫЕ НАПРАВЛЕНИЯ
биторы к конкретным вариантам этого белка,
ПРИМЕНЕНИЯ РАССМОТРЕННЫХ
синтезируемым у двух разных видов бактерий
МЕТОДОВ
[60,61]. При молекулярном моделировании взаи-
Рассмотренные в статье три биофизических
модействия этих белков с лигандами оба ингиби-
метода измерения равновесной константы связы-
тора образовывали по две водородные связи с
вания (диссоциации) имеют свои особенности и
белком при примерно равных расчетных кон-
специфические характеристики, которые влияют
стантах диссоциации. Экспериментальная оцен-
на дизайн эксперимента по определению аффин-
ка Kd методом ИТК также показала равные значе-
ности взаимодействующих веществ (таблица).
ния константы диссоциации. Однако значения
Метод ИТК зарекомендовал себя как высоко-
ΔH и ΔS у этих веществ различались, что указыва-
точный и дающий наибольшее количество термо-
ло на образование дополнительных связей при
динамических показателей взаимодействия в од-
взаимодействии с белком [62]. Последующие ис-
ном эксперименте [46,47]. Метод применяется
следования с использованием методов флуорес-
для исследования взаимодействия белков и пеп-
центной спектроскопии и спектроскопии цирку-
тидов с различными молекулами в диапазоне раз-
лярного дихроизма показали изменения конфор-
меров от отдельных ионов до полимерных струк-
мации белка при взаимодействии с лигандами.
БИОФИЗИКА том 64
№ 4
2019
642
КОРШУНОВА и др.
Эти данные и результаты по изменению энталь-
ми оптической части прибора и чипов [47,73].
пии и энтропии позволили вычислить наиболее
Учитывая малые объемы реагентов, из трех рас-
вероятные конформационные изменения LpxC и
смотренных в обзоре методик именно ППР явля-
построить более точную модель взаимодействия в
ется наиболее привлекательным выбором с точки
молекулярном докинге, что имеет важное значе-
зрения скрининга больших библиотек веществ
ние для разработки перспективных антибиотиков
(таблица) при разработке новых лекарственных
следующего поколения.
препаратов [74-77]. Метод хорошо подходит для
исследования взаимодействия широкого спектра
Микротермофорез позволяет исследовать вза-
веществ и измерения аффинности как белок-бел-
имодействие молекул в широком диапазоне раз-
ковых взаимодействий [78], так и взаимодей-
мера и химической природы. Малый объем ис-
ствий белков с нуклеиновыми кислотами [79] и
пользуемых компонентов и нетребовательность к
вирусами [80,81].
составу буфера делает его удобным для первично-
го скрининга потенциальных лигандов. В обзор-
Отдельного упоминания заслуживает возмож-
ной статье [63] подробно разобраны примеры ис-
ность исследовать методом ППР взаимодействия
пользования метода для определения констант
с мембранными белками. Мембранные белки
равновесия для взаимодействия различных моле-
представляют собой привлекательный объект для
кул. Наиболее успешно МТФ применяют для
разработки лекарственных препаратов, посколь-
проверки и определения Kd белков и нуклеино-
ку они составляют около трети всех белок-коди-
вых кислот, в том числе аптамеров [23,30,64], что
рующих генов в геноме эукариот [82,83] и вклю-
связано c высокой термофоретической подвиж-
чают в себя рецепторы и ионные каналы, которые
ностью таких заряженных молекул, как ДНК и
часто ассоциированы с различными заболевания-
РНК [65]. Линейная зависимость коэффициента
ми. Однако в растворе без мембран эти белки ча-
Соре от размера частиц позволяет использовать
сто имеют неправильную конформацию, что за-
МТФ для поиска лигандов к агрегатам белков,
трудняет определение аффинности их взаимо-
что важно, например, для изучения болезней
действия с лигандами в растворе. В случае ППР
Альцгеймера и Паркинсона [21,66]. Обе патоло-
можно создать на чипе липидный бислой, кото-
гии развиваются на фоне образования в клетках
рый позволит иммобилизовать такие белки в
мозга агрегатов белков, богатых бета-слоями (на-
условиях, приближенных к естественным. При-
пример, альфа-синуклеин в случае болезни Пар-
менение ППР для исследования мембранных
кинсона, тау-белок и AB40/42 в случае болезни
белков хорошо освещено в обзоре [84].
Альцгеймера). Повышенная склонность подоб-
Возможность измерения термодинамических
ных белков к олигомеризации и агрегации за-
параметров, как и в случае ИТК, позволяет при-
трудняет изучение взаимодействия их нативных
менять метод для оптимизации лигандов [85] и
форм с малыми молекулами методами ИТК и
исследования механизма взаимодействия [77].
ППР и вынуждает использовать в исследовании
короткие фрагменты, стабильные в мономерном
Хотя все рассматриваемые методики зареко-
состоянии [67-70].
мендовали себя как надежные в отношении вы-
числения констант равновесия на контрольных
Зависимость метода МТФ от многих физиче-
хорошо изученных парах белок-ингибитор, в экс-
ских и химических параметров позволяет исполь-
периментах по поиску новых лигандов результа-
зовать его для скрининга структурно близких мо-
ты, полученные разными методами, могут не пе-
лекул. Например, при изучении связывания зеле-
рекрываться в той или иной степени. Например,
ного флуоресцентного белка GFP (green
при первичном скрининге 500 малых молекул ме-
fluorescent protein) со специфическим к нему ан-
тод ППР выявил 12 веществ с положительным от-
тителом GBP (GFP-binding protein) замена всего
ветом, в то время как методом ядерно-магнитно-
одной аминокислоты в паратопе антитела приве-
го резонанса обнаружено 19 положительных сиг-
ла к увеличению термодиффузии молекулы белка
налов. Только четыре вещества в этих
почти в два раза (изменение флуоресценции на
библиотеках совпали. Вторичная проверка всех
4,5% по сравнению с исходной, составившей
этих молекул проводилась методом ИТК, в ре-
2,1%) [5]. Это открывает возможности для более
зультате чего только одно вещество вызывало эк-
эффективного поиска лигандов к белкам из раз-
зотермическую реакцию и позволило определить
ных генетических аллелей, что важно при разра-
константу связывания. Константы диссоциации,
ботке лекарств [16,71,72].
полученные методами ИТК и ППР для этого ве-
Метод ППР, в свою очередь, отличается от
щества, были близки по значению [17]. В другом
ИТК и МТФ большей производительностью.
недавнем исследовании при скрининге малых
Сейчас на основе ППР производятся различные
молекул для выявления специфического связы-
аппараты для определения аффинности молекул
вания с белком ApoE аллеля гена ε4, который, в
с пропускной способностью от 400 до 5000 образ-
отличие от аллелей ε2 и ε3, ассоциирован с повы-
цов в сутки и с дополнительными модификация-
шенным риском развития болезни Альцгеймера у
БИОФИЗИКА том 64
№ 4
2019
СОВРЕМЕННЫЕ ПОДХОДЫ К АНАЛИЗУ
643
человека, первичный скрининг из 707 кандидатов
12.
J. C. Martinez, J. Murciano-Calles, E. S. Cobos, et al., in:
выявил 14 веществ с положительным ответом
Applications of Calorimetry in a Wide Context - Differential
[16]. Вторичная проверка была проведена мето-
Scanning Calorimetry, Isothermal Titration Calorimetry and
дом МТФ, в результате которой только восемь ве-
Microcalorimetry, Ed. by A. A. Elkordy (Intech, Croatia,
ществ дали положительный сигнал в термофоре-
2013), Chapt. 4, pp. 74-104.
зе. Дополнительно эти восемь кандидатов были
13.
M. M. Pierce, C. S. Raman, and B. T. Nall, Methods
проверены методом ИТК (шесть веществ под-
19 (2), 213 (1999).
твердилось, два не показали активности). Вычис-
ленные константы связывания в целом совпадали
14.
Protein-ligand interactions: methods and applications,
по значению, однако в ряде случаев одним из ме-
Ed. by M. A. Williams and T. Daviter, 2nd ed. (Huma-
тодов, ИТК или МТФ, не удавалось вычислить
na Press, Springer, New York, 2013).
точное значение Kd.
15.
J. A. Liberman, J. T. Bogue, J. L. Jenkins, M. Salim,
Таким образом, методы ИТК, МТФ и ППР
and J. E. Wedekind, Methods Enzymol. 549, 435
позволяют определить равновесные константы
(2014).
связывания изучаемых веществ в диапазоне от
16.
L. Kraft, L. Serpell, and J. Atack, Biomolecules 9 (2),
нано- до микромолярных концентраций. Однако
48 (2019).
каждый из методов может дать как ложнополо-
17.
S. Nagatoishi, et al., Bioorg. Med. Chem. 26 (8), 1929
жительный, так и ложноотрицательный резуль-
(2018).
тат, что трудно отследить в экспериментах по ис-
следованию неизученных пар «лиганд-мишень».
18.
D. Wu, et al., Haematologica 103 (9), 1472 (2018).
Выходом из этого положения является продуман-
19.
C. Ludwig, Diffusion zwischen ungleich erwärmten Orten
ное использование нескольких методов для од-
gleich zusammengesetzter Lösung. Aus der K.K. Hof-
ной библиотеки веществ и внимательный дизайн
und Staatsdruckerei,
in
Commission bei
эксперимента с учетом возможностей и ограни-
W. Braumüller, Buchhändler des K. K. Hofes und der
чений каждого из подходов.
K. Akademie der Wissenschaften, 1856.
Работа выполнена при финансовой поддержке
20.
S. Duhr and D. Braun, Proc. Natl. Acad. Sci. 103 (52),
Российского научного фонда (проект № 17-74-
19678 (2006).
20152).
21.
M. Wolff, E. Nicholls1, A. M. Reynolds, et al., Sci.
Rep. 6 (1), 32612 (2016). DOI: 10.1038/srep32612.
СПИСОК ЛИТЕРАТУРЫ
22.
M. Reichl, M. Herzog, A. Götz, and D. Braun, Phys.
1. G. Kapoor, S. Saigal, and A. Elongavan, J.
Rev. Lett. 112 (19), 198101 (2014).
Anaesthesiol. Clin. Pharmacol. 33 (3), 300 (2017).
23.
P. Baaske, C. J. Wienken, P. Reineck, et al., Angew.
2. W. P. Walters and M. Namchuk, Nat. Rev. Drug Dis-
Chem. Int. Ed. 49 (12), 2238 (2010).
cov. 2 (4), 259 (2003).
24.
C. P. Toseland, J. Chem. Biol. 6 (3), 85 (2013).
3. J. Hughes, S. Rees, S. Kalindjian, and K. Philpott, Br.
25.
M. M. Baksh, A. K. Kussrow, M. Mileni, et al., Nat.
J. Pharmacol. 162 (6), 1239 (2011).
Biotechnol. 29 (4), 357 (2011).
4. T. Wiseman, S. Williston, J. F. Brandts, and L.-N. Lin,
26.
V. Ratner, E. Kahana, M. Eichler, and E. Haas, Bio-
Anal. Biochem. 179 (1), 131 (1989).
conjug. Chem. 13 (5), 1163 (2002).
5. C. J. Wienken, P. Baaske, U. Rothbauer, et al., Nat.
27.
S. A. I. Seidel, et al., Angew. Chem. Int. Ed., 51 (42),
Commun. 1 (7), 100 (2010).
10656 (2012).
6. M. Raghavan and P. J. Bjorkman, Struct. Lond. Engl.
28.
S. A. I. Seidel, et al., Methods 59 (3), 301 (2013).
1993, 3 (4), 331 (1995).
29.
T. H. Scheuermann, S. B. Padrick, K. H. Gardner, and
7. P. W. Atkins and J. De Paula, Physical chemistry for the
C. A. Brautigam, Anal. Biochem. 496, 79 (2016).
life sciences, 2nd ed. (W. H. Freeman and Co., New
30.
C. Entzian and T. Schubert, J. Vis. Exp. 119, 55070
York; Oxford University Press, Oxford, 2011).
(2017). DOI: 10.3791/55070.
8. D. G. Myszka, et al., J. Biomol. Tech. 14 (4), 247
31.
T. Rogez-Florent, et al., J. Mol. Recognit. 27 (1), 46
(2003).
(2014).
9. G. A. Holdgate and W. H. J. Ward, “Drug Discov. To-
32.
T. Rogez-Florent, et al., J. Pharm. Biomed. Anal. 137,
day 10 (22), 1543 (2005).
113 (2017).
10. J. J. Christensen, R. M. Izatt, L. D. Hansen, and
33.
M. van de Weert and L. Stella, J. Mol. Struct. 998 (1),
J. A. Partridge, J. Phys. Chem. 70 (6), 2003 (1966).
144 (2011).
11. N. V. Beaudette and N. Langerman, Anal. Biochem. 90
34. P. R. Callis and T. Liu, J. Phys. Chem. B 108 (14), 4248
(2), 693 (1978).
(2004).
БИОФИЗИКА том 64
№ 4
2019
644
КОРШУНОВА и др.
35. J. R. Lakowicz, Principles of Fluorescence Spectroscopy,
60.
J. M. Clements, et al., Antimicrob. Agents Chemother.
3rd ed. (Springer US, 2006).
46 (6), 1793 (2002).
36. M. Jerabek-Willemsen, et al., J. Mol. Struct. 1077, 101
61.
M. C. Pirrung, et al., J. Med. Chem. 45 (19), 4359
(2014).P
(2002).
37. S.-C. Tso, Q. Chen, S. A. Vishnivetskiy, et al., Anal.
62.
X. Du, et al., Int. J. Mol. Sci. 17 (2), 144 (2016).
Biochem. 540-541, 64 (2018).
63.
M. Asmari, R. Ratih, H. A. Alhazmi, and S. El Deeb,
Methods 146, 107 (2018).
38. B. Liedberg, C. Nylander, and I. Lunström, Sens. Ac-
tuators 4, 299 (1983).
64. A. M. Mueller, D. Breitsprecher, S. Duhr, et al., Meth-
ods Mol. Biol. 1654, 151 (2017).
39. R. L. Rich and D. G. Myszka, J. Mol. Recognit. 14 (4),
223 (2001).
65.
P. Reineck, C. J. Wienken, and D. Braun, Electropho-
resis 31 (2), 279 (2010).
40. B. Johnsson, S. Löfås, G. Lindquist, et al., J. Mol. Rec-
ognit. 8 (1-2), 125 (1995).
66.
E. Fisher, et al., ACS Chem. Neurosci. 8 (9), 2088
(2017).
41. B. Johnsson, S. Löfås, and G. Lindquist, Anal. Bio-
67.
С. А. Хмелёва и др., Молекуляр. биология 49 (3),
chem. 198 (2), 268 (1991).
507 (2015).
42. Y. S. N. Day, C. L. Baird, R. L. Rich, and D. G. Mysz-
68.
Ф. О. Цветков, А. А. Макаров, А. Н. Арчаков и
ka, Prot. Sci. Publ. Prot. Soc. 11 (5), 1017 (2002).
С. А. Козин, Биофизика 54 (2), 197 (2009).
43. P. Schuck and H. Zhao, Methods Mol. Biol. 627, 15
69.
L. M. F. Gomes, et al., Chem. Sci. 10 (6), 1634 (2018).
(2010).
70.
C. Cheignon, et al., Chem. Sci. 8 (7), 5107 (2017).
44. D. G. Myszka, X. He, M. Dembo, et al., Biophys. J. 75
71.
71. S. A. Khmeleva, et al., J. Alzheimers Dis. 54 (2),
(2), 583 (1998).
809 (2016).
45. 45. J.-P. Renaud, et al., Nat. Rev. Drug Discov. 15 (10),
72.
F. Wu, T. Song, Y. Yao, and Y. Song, PloS One 14 (5),
679 (2016).
e0216203 (2019).
46. M. Ui and K. Tsumoto, Recent Pat. Biotechnol. 4 (3),
73.
73. S. Zeng, D. Baillargeat, H.-P. Ho, and K.-T. Yong,
183 (2010).
Chem. Soc. Rev. 43 (10), 3426 (2014).
47. V. Linkuvienė, G. Krainer, W.-Y. Chen, and D. Matu-
74.
E. Fabini and U. H. Danielson, J. Pharm. Biomed.
lis, Anal. Biochem. 515, 61 (2016).
Anal. 144, 188 (2017).
48. I. Y. Petrushanko, et al., PloS One 11 (7), e0158726
75.
A. Meneghello, S. Tartaggia, M. D. Alvau, et al., Curr.
(2016).
Med. Chem. 25 (34), 4354 (2018).
49. S.-J. Lin, Y.-F. Chen, K.-Ch. Hsu, et al., Toxins 11 (4),
76.
R. Mowla, Y. Wang, S. Ma, and H. Venter, Biochim.
233 (2019).
Biophys. Acta - Biomembranes 1860 (4), 878 (2018).
50. P. O. Tsvetkov, A. A. Makarov, S. Malesinski, et al.,
77.
P. Taghipour, M. Zakariazadeh, M. Sharifi, et al., J.
Biochimie 94 (3), 916 (2012).
Photochem. Photobiol. B 183, 11 (2018).
51. E. H. Mashalidis, P. Śledź, S. Lang, and C. Abell, Nat.
78. D. G. Drescher, D. Selvakumar, and M. J. Drescher, in
Protoc. 8 (11), 2309 (2013).
Advances in Protein Chemistry and Structural Biology,
52. J. Cramer, S. G. Krimmer, A. Heine, and G. Klebe, J.
vol. 110, Ed. by R. Donev (Academic Press, 2018),
Med. Chem. 60 (13), 5791 (2017).
pp. 1-30.
79. M. F. Rollins, J. T. Schuman, K. Paulus, et al., Nucl.
53. Ф. О. Цветков, А. А. Куликова, Ф. Девред и др.,
Acids Res. 43 (4), 2216 (2015).
Молекуляр. биология 45 (4), 697 (2011).
80. L. Dai, et al., Cell Host Microbe 19 (5), 696 (2016).
54. M. K. Zia, T. Siddiqui, S. S. Ali, et al., Int. J. Biol.
Macromol., Apr. (2019).
81. X. Meng, R. Deng, X. Zhu, and Z. Zhang, Virol. J. 15
(1), 21 (2018).
55. W. Du, et al., J. Biol. Chem., Apr. (2019).
82. E. Wallin and G. von Heijne, Prot. Sci. Publ. Prot. Soc.
56. M. Amaral, et al., Nat. Commun. 8 (1), 2276 (2017).
7 (4), 1029 (1998).
57. Q. Dan, et al., Food Res. Int. Ott. Ont. 120, 255 (2019).
83. L. Fagerberg, K. Jonasson, G. von Heijne, et al., Pro-
58. J. D. Chodera and D. L. Mobley, Annu. Rev. Biophys.
teomics 10 (6), 1141 (2010).
42, 121 (2013).
84. S. G. Patching, Biochim. Biophys. Acta 1838 (1, Pt A),
43 (2014).
59. T. J. Wyckoff, C. R. Raetz, and J. E. Jackman, Trends
Microbiol. 6 (4), 154 (1998).
85. C. Rechlin, et al., ACS Chem. Biol. 12 (5), 1397 (2017).
БИОФИЗИКА том 64
№ 4
2019
СОВРЕМЕННЫЕ ПОДХОДЫ К АНАЛИЗУ
645
Modern Approaches to Analysis of Protein-Ligand Interactions
A. V. Korshunova* **, J. N. Lopanskaya**, and N. B. Gudimchuk* **
*Center for Theoretical Problems of Physico-Chemical Pharmacology, Russian Academy of Sciences,
ul. Kosygina 4, Moscow, 119991 Russia
**Physics Department of Lomonosov Moscow State University, Leninskie Gory 1/2, Moscow, 119191 Russia
The development of molecular simulation methods and advances in computing technology provide rapidly
growing opportunities for computational analysis of conformational properties of proteins and the nature of
their interaction with ligands. Nevertheless, existing theoretical methods are not entirely satisfactory, and
their predictions are in dire need of validation experiment. Therefore, precise experimental methods for
quantifying strength of interaction between proteins and small molecules are in great demand. These methods
are important both for deciphering the fundamental mechanisms of regulation of protein functions by small
molecules in living cells, as well as for creating new medical drugs. In this review, we consider three well-prov-
en modern biophysical techniques for the determination of affinity, stoichiometry, and energetics in protein-
ligand interactions such as isothermal titration calorimetry, microscale thermophoresis, and surface plasmon
resonance. Special attention is focused on the development of the technical advances of these methods in re-
cent years, the subtleties of their practical use and illustrations of their application for solving specific bio-
physical problems in pharmacology.
Keywords: isothermal titration calorimetry, microscale thermophoresis, surface plasmon resonance, proteins, li-
gands, drug development
БИОФИЗИКА том 64
№ 4
2019