БИОФИЗИКА, 2019, том 64, № 4, с. 646-660
МОЛЕКУЛЯРНАЯ БИОФИЗИКА
УДК 577.322.9
УНИКАЛЬНОСТЬ ПРИРОДЫ МИКРОЭЛЕМЕНТА СЕЛЕНА
И ЕГО КЛЮЧЕВЫЕ ФУНКЦИИ
© 2019 г. Е. Г. Варламова, В. Н. Мальцева
Институт биофизики клетки РАН - обособленное подразделение ФИЦ «Пущинский научный центр
биологических исследований РАН»,
142290, Пущино Московской области, ул. Институтская, 3
E-mail: 1928lv@mail.ru
Поступила в редакцию 03.04.2019 г.
После доработки 03.04.2019 г.
Принята к публикации 30.04.2019 г.
Микроэлемент селен, открытый Берцелиусом еще в 1817 году, на сегодняшний день остается до
конца не познанным и не перестает удивлять многообразием своих функций. Уникальность данно-
го микроэлемента в первую очередь заключается в том, что он входит в состав не только органиче-
ских и неорганических соединений, но и является ключевым компонентом аминокислот селеноци-
стеина и селенометионина в селенопротеинах, встречающихся во всех доменах жизни. Во-вторых,
селеноцистеин является 21-й аминокислотой в универсальном генетическом коде, уникальность
которой заключается не только в том, что она кодируется одним из трех стоп-кодонов трансляции,
но и особенностями биосинтеза и уникальными цис- и транс-активными факторами, необходимы-
ми для распознавания данного триплета как селеноцистеинового, что позволяет избежать прежде-
временной терминации трансляции и синтезировать полноразмерные селенопротеины. Поддержа-
ние данных цис- и транс-активных факторов является весьма энергозатратным для клетки, что дает
основание говорить о важности и жизненной необходимости селенопротеинов для живого организ-
ма. Кроме того, во всех доменах жизни существуют некоторые особенности механизмов биосинтеза
как самой аминокислоты, так и селенопротеинов. В-третьих, поражает многообразие процессов и
эффектов соединений селена различного происхождения, в которых данный микроэлемент играет
ключевую роль, особенно в регуляции жизненно важных функций млекопитающих. В рамках дан-
ного обзора на основании последних данных представлена полная картина свойств и функций се-
лена, позволяющая понять уникальность данного микроэлемента в природе.
Ключевые слова: селен, селеноцистеин, селенопротеины, функции селена, селенсодержащие соединения.
DOI: 10.1134/S0006302919040021
Поначалу селен нашел свое применение в
Микроэлемент селен получил свое название в
греческом варианте от слова «луна», поскольку он
электронике, поскольку является отличным по-
является спутником теллура, сходным с ним хи-
лупроводником. Так, на основе его физического
мическими свойствами. В основном селен скон-
свойства повышать электрическое сопротивле-
центрирован в земной коре, где его среднее коли-
ние в зависимости от освещения было создано
чество составляет 500 мг/т. Однако сам элемент
первое в мире устройство для передачи на боль-
получают из шлама медных электролитных про-
шие расстояния звуков при помощи света, в 30-х
изводств. Главные химические свойства селена
годах прошлого века началось массовое произ-
связаны с его окислением и восстановлением,
водство селеновых выпрямителей - полупровод-
именно восстанавливающие свойства этого мик-
никовых диодов на основе этого вещества. Ши-
роэлемента лежат в основе его активного взаимо-
рокое применение селена в промышленности по-
действия с окружающими веществами, в том чис-
казало его высокую токсичность, и на многие
ле со свободными радикалами.
годы за селеном закрепилась репутация исключи-
Сокращения: Sec - селеноцистеин, Cys - цистеин, SeMet -
тельно опасного для здоровья вещества, однако в
селенометионин, SECIS-элемент (SecInsertionSequence) -
середине XX века начали появляться научные
цис-активный фактор трансляции селенопротеинов, SBP2 публикации о том, что развитие некоторых тяже-
(SECIS BindingProtein)
- транс-активный фактор
трансляции селенопротеинов, АФК - активные формы
лых заболеваний связано с дефицитом селена в
кислорода, TXNRD - тиоредоксинредуктаза
организме человека. Это стало серьезным толч-
646
УНИКАЛЬНОСТЬ ПРИРОДЫ МИКРОЭЛЕМЕНТА СЕЛЕНА
647
ком к подробному исследованию функций дан-
210°С и выдержкой при этой температуре. Его ре-
ного микроэлемента.
шетка построена из расположенных параллельно
спиральных цепочек атомов. При обычной тем-
В настоящее время большое количество работ
пературе селен устойчив к действию кислорода,
посвящено важности селена для поддержания
воды и разбавленных кислот. При нагревании
нормального функционирования организма. По-
данный микроэлемент взаимодействует со всеми
скольку данный микроэлемент входит в состав
металлами, образуя селениды. В кислороде при
активного ядра более чем 200 ферментов, пере-
дополнительном нагревании он медленно горит
чень его функций достаточно внушителен, осо-
синим пламенем, превращаясь в диоксид.
бое место в данном списке занимают канцероге-
нез и проблема старения [1-10]. Однако данный
В природе селен в большей степени представ-
обзор посвящен характеристике селена как уни-
лен в качестве селеноцистеиновой аминокисло-
кального компонента селенопротеинов, в первую
ты, отличающейся от цистеиновой наличием се-
очередь, аминокислоты селеноцистеина (Sec),
лена вместо серы. Подобная замена вполне по-
которая с молекулярной и биохимической точек
нятна и объясняется тем фактом, что по своим
зрения обладает рядом исключительных особен-
физико-химическим свойствам - размеру атом-
ностей. Являясь компонентом селенопротеинов,
ного радиуса, значению электроотрицательно-
представленных во всех доменах жизни, селен
сти, степени окисления - селен ближе именно к
участвует во многих жизненно важных процессах
сере, чем к другим вышеперечисленным халько-
в клетке и организме в целом. Кроме того, нали-
генам. Несмотря на это, все же существуют био-
чие большого разнообразия селена в природе в
химические различия между цистеином (Cys) и
виде органических и неорганических соедине-
Sec в белках [11].
ний, роль которых в регуляции важнейших про-
В первую очередь, это обусловлено значитель-
цессов неоднократно доказана, а также данные о
ной разницей в величине pKa (отрицательный ло-
филогенетическом распределении селенсодержа-
гарифм константы кислотности Ka), которая для
щих белков дают основание говорить об уникаль-
Sec (селенолата) составляет 5,2, а в случае Cys
ном биоразнообразии селена в природе и его ис-
(тиолата) равна 8,5 [12], следовательно, селенсо-
ключительной жизненной важности. Особое
держащие белки обладают большей каталитиче-
внимание в обзоре уделено описанию последних
ской активностью, что и было экспериментально
данных о биосинтезе аминокислоты Sec и меха-
подтверждено рядом авторов [13,14]. Во-вторых,
низме его встраивания в селенопротеины, анали-
установлено, что нуклеофильность (или нуклео-
зу основных функций селенсодержащих органи-
фильная активность), которая определяется ве-
ческих и неорганических соединений и белков,
личиной pKa, поляризуемостью, электроотрица-
их филогенетическому распределению, а также
тельностью и атомным радиусом, у Sec выше, чем
описанию физико-химических свойств селена и
у Cys [11,12]. При сравнении химических актив-
его преимуществ перед серой.
ностей производных 2,6-диметоксифенила с со-
единениями серы и селена последние проявили
ФИЗИКО-ХИМИЧЕСКИЕ СВОЙСТВА
более высокую нуклеофильность и тем самым
СЕЛЕНА, ПРЕИМУЩЕСТВА ПЕРЕД СЕРОЙ
большую реакционную способность [15]. Кроме
того, с помощью ЯМР-спектроскопии было по-
Селен наряду с кислородом, серой, теллуром и
казано, что благодаря более высокой нуклео-
полонием относится к элементам главной под-
фильности селена при физиологических значе-
группы VI группы периодической системы, назы-
ниях рН реакции селенол/диселенидного обмена
ваемым халькогенами, атомы которых имеют
протекают в 107 быстрее, чем реакции тиол/ди-
одинаковое строение внешнего энергетического
сульфидного обмена [16]. Sec взаимодействует с
уровня, что обусловливает схожесть их физико-
электрофильными соединениями, такими как
химических свойств. Разнообразие молекулярно-
хлоруксусная кислота или хлорацетамид, и тем
го строения обусловливает существование селена
более с йодоацетатной кислотой или йодацетами-
в разных аллотропных модификациях - аморф-
дом, намного быстрее, чем Cys.
ной и кристаллической. Аморфный (красный)
Все вышеперечисленные преимущества селе-
порошкообразный селен получают при восста-
новлении из раствора селенистой кислоты быст-
на перед серой и Sec перед Cys дают основание
рым охлаждением паров селена. Стекловидный
полагать, что замещение серы в селенопротеинах
на селен имеет важное эволюционное значение.
(черный) селен получают при нагревании любой
модификации селена выше 220°С с последующим
быстрым охлаждением. Он обладает стеклянным
УНИКАЛЬНЫЙ МЕХАНИЗМ БИОСИНТЕЗА
блеском, хрупок. Термодинамически наиболее
СЕЛЕНОПРОТЕИНОВ
устойчив гексагональный (серый) селен, который
получается из других форм селена нагреванием до
Если говорить об уникальности селена, то в
плавления с медленным охлаждением до 180-
первую очередь следует упомянуть о механизме
БИОФИЗИКА том 64
№ 4
2019
648
ВАРЛАМОВА, МАЛЬЦЕВА
биосинтеза селенопротеинов, в состав которых
модификации других тРНК являются: небольшое
он входит в виде аминокислоты Sec. Основной
количество модификаций нуклеотидов и наличие
особенностью является то, что Sec кодируется од-
уникальной модификации в антикодоновой пет-
ним из трех терминирующих трансляцию трипле-
ле
- 5'-метилкарбоксиметилуридина (mcm54)
тов (UGA), поэтому в природе существуют допол-
[27]. Уникальна и структура этой тРНК, так, у
нительные цис- и транс-активные факторы
млекопитающих идентифицированы две «разно-
трансляции таких белков, что позволяет распо-
видности» ее вторичной структуры типа клевер-
знать данный триплет как селеноцистеиновый и
ного листа: 9/4 и 7/5, в зависимости от количества
синтезировать полноразмерные, а не укорочен-
спаренных оснований в акцепторном плече
ные селенсодержащие белки. К настоящему вре-
(9 или 7) и в псевдоуридиновом плече (TψC)
мени существует большое количество работ, по-
(4 или 5). Для бактерий характерна форма 8/5
священных данной проблеме и подробному опи-
Sec-тРНК[Ser]Sec [28]. Sec-тРНК[Ser]Sec - самая
санию уникального механизма биосинтеза,
длинная эукариотическая тРНК, она состоит из
поэтому в рамках данного обзора имеет смысл
90 н. и содержит нетипично длинную вариабель-
привести обобщенную картину этих процессов с
ную петлю, а также дополнительный нуклеотид в
учетом последних данных [17-20].
псевдоуридиновой петле (TψC), а у E. coli ее дли-
на равна 95 н. В отличие от канонических амино-
Несмотря на достаточно быструю идентифи-
кислот Sec не имеет специфичной аминоацил-
кацию всех цис- и транс-активных факторов
тРНК-синтетазы, поэтому сначала Sec-тРНК
трансляции селенопротеинов - SECIS-элемента
ацетилируется с L-серином при участии серило-
(структуры в мРНК селенопротеиновых генов,
вой-тРНК-синтетазы (SerRS), которая приобрела
представленной спаренными и одноцепочечны-
дополнительный уникальный N-концевой до-
ми участками) [19], SBP2 (белка, специфично вза-
мен, необходимый для распознавания вариабель-
имодействующего с SECIS-элементом) [20], спе-
ного плеча Sec-тРНК вместо антикодоновой по-
цифичной Sec-тРНК[Ser]Sec с необычным меха-
следовательности [29]. Далее происходит превра-
низмом транскрипции [21], факторов элонгации
щение L-серина в L-селеноцистеил-тРНК,
трансляции eEFSec [22] и др. - в настоящее время
данный этап протекает по-разному у прокариот и
не существует четкого понимания того, каким об-
эукариот. У бактерий эта реакция катализируется
разом и в какой последовательности они взаимо-
Sec-синтазой [30,31], при этом альфа-аминогруп-
действуют друг с другом.
па L-серина взаимодействует с формильной
Очевидным является то, что центральными
группой SelA с образованием оснований Шиффа.
участниками процесса встраивания Sec в белки
Данная реакция сопровождается дегидратацией
являются SECIS-элемент и Sec-тРНК[Ser]Sec. По
Ser и формированием промежуточного продукта
своей первичной структуре SECIS-элементы яв-
аминоакрилилSec-тРНКSer, ковалентно связан-
ляются высококонсервативными, особенно у эу-
ного с Sec-синтазой в области акцепторного пле-
кариот, их вторичная структура более вариабель-
ча. На втором этапе происходит перенос селена
ная и представлена спаренными и неспаренными
путем нуклеофильного замещения, что приводит
участками (петлями). Однако существуют два
к образованию Sec-тРНК[Ser]Sec, при этом био-
консервативных мотива во вторичной структуре
логически активный селен в виде моноселено-
SECIS-элементов: коровая часть, представленная
фосфата доставляется селенофосфатсинтетазой
квартетом не уотсон-криковских пар оснований,
SelD (рис. 1а) [32]. У архей и эукариот в данном
и AAA/G-мотив. Эти структуры разделены спа-
процессе участвуют два фермента: О-фосфосе-
ренными участками (спирали 1 и 2). Более по-
рил-тРНК-киназа и О-фосфосерил-селеноци-
дробное описание структуры и функций SECIS-
стеилсинтетаза. На первом этапе сериловая-
элементов приведено в многочисленных работах
тРНК фосфорилируется димерным ферментом
[19,23-25].
тРНК-киназой, после чего фосфорильная группа
заменяется селеном в реакции, которую катали-
Гены необычной Sec-тРНК[Ser]Sec, описан-
зирует второй фермент -селеноцистеилсинтетаза
ной в работе [21], представлены во всех доменах.
(рис. 1б) [33].
У бактерий они распределены по геному как часть
оперонов рРНК. У большинства эукариотиче-
Еще одним уникальным транс-активным фак-
ских организмов Sec-тРНК[Ser]Sec находятся
тором, необходимым для встаривания Sec в селе-
под регуляцией промотора типа II, узнаваемого
нопротеины, является SBP2 - белок с молекуляр-
РНК-полимеразой III в нуклеоплазме. Гены ар-
ной массой 94 кДa, специфично взаимодейству-
хей котранскрибируются в опероны с помощью
ющий либо с SECIS-элементом в области
РНК-полимеразы, по структуре похожей на эука-
квартета, либо с предшествующей ему последова-
риотические РНК-полимеразы I, II и III [26]. По-
тельностью с образованием комплекса SBP2-SE-
сттранскрипционная
модификация
Sec-
CIS [20]. Структурно-функциональный анализ
тРНК[Ser]Sec наиболее хорошо описана для по-
выявил в SBP2 три основных домена: N-конце-
звоночных, отличительными особенностями от
вой домен, найденный только у высших эукари-
БИОФИЗИКА том 64
№ 4
2019
УНИКАЛЬНОСТЬ ПРИРОДЫ МИКРОЭЛЕМЕНТА СЕЛЕНА
649
Рис. 1. Схематическое изображение биосинтеза Sec-тРНК[Ser]Sec у прокариот (а), у архей и эукариот (б).
от, который содержит сигнальную последова-
ФИЛОГЕНЕТИЧЕСКОЕ РАСПРЕДЕЛЕНИЕ
тельность для ядерной локализации; централь-
СЕЛЕНСОДЕРЖАЩИХ БЕЛКОВ
ный
функциональный
домен
SID
Данные, касающиеся филогенеза и эволюции
(SecIncorporationDomain) - домен в структуре
селенсодержащих белков, свидетельствуют о зна-
SBP2, необходимый для связывания Sec и SECIS-
чительных различиях и мозаичности их распреде-
элемента, мутации в нем приводят к снижению
ления. Например, некоторые семейства этих бел-
эффективности связывания SBP2 с рибосомами;
ков присутствуют только у прокариот, тогда как
геномы эукариотических организмов не содержат
С-концевой РНК-связывающий домен RBD
даже их Cys-содержащих гомологов [37].
(RNA Binding Domain) с консервативной после-
Первым шагом при изучении эволюции селе-
довательностью L7AeRNA, необходимой для вза-
нопротеинов В.Н. Гладышевым и коллегами [38,
имодействия с 28S рРНК [34].
39] был анализ последовательностей, входящих в
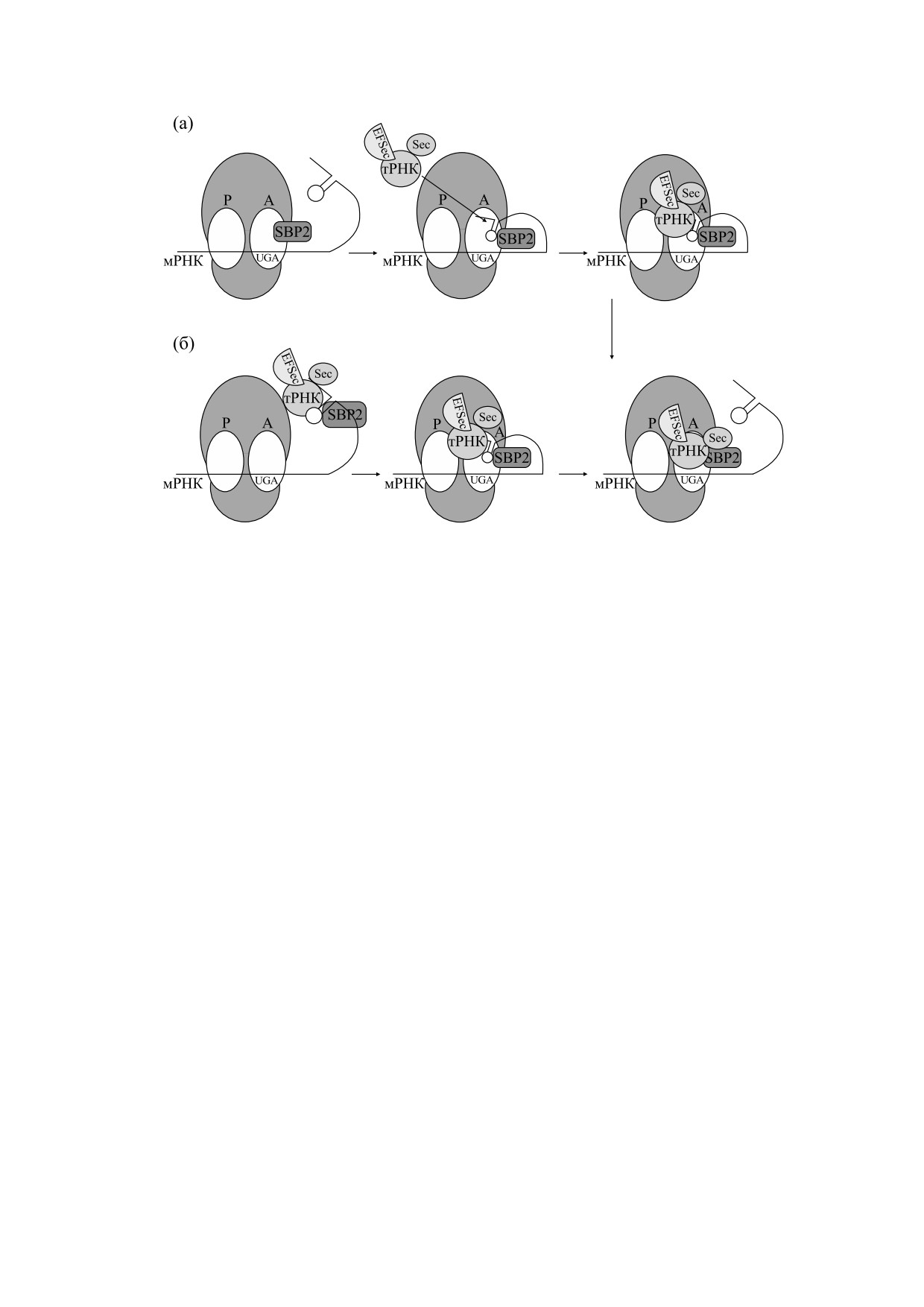
Однако на сегодняшний день до конца не по-
состав большой базы данных Саргассового моря,
который осуществлялся с помощью методов
нятно, в какой последовательности происходит
in silico, описанных выше. Результаты данного
взаимодействие всех участников процесса био-
анализа показали, что три селенопротеиновых се-
синтеза селенопротеинов. Согласно первой моде-
мейства, которые, как считалось ранее, имеют
ли (рис. 2а), SBP2 предварительно связывается с
исключительно эукариотическое происхожде-
рибосомами, далее происходит его взаимодей-
ние, встречаются и у бактерий, обитающих в Сар-
ствие с SECIS-элементом, после чего они связы-
гассовом море: дейодиназы, глутатионперокси-
ваются со сложным комплексом: Sec-
дазы и семейство SELW-гомологичных белков.
тРНК[Ser]Sec-eEFSec-GTP [35]. В этой модели
Помимо этого, выяснилось, что встречаемость
непонятно, остается ли SBP2 в связанном состоя-
гена α-цепи формиатдегидрогеназы в геномах
нии с рибосомой или диссоциирует после каждо-
этой базы данных минимально (приблизительно
3% от всех селенопротеиновых генов). Таким об-
го цикла трансляции. Согласно второй модели,
разом, всего было идентифицировано 310 извест-
SBP2 сначала связывается с SECIS-элементом,
ных и новых селенопротеинов при анализе 811372
после чего взаимодействие с комплексом Sec-
последовательностей, причем 88% Sec-содержа-
тРНК[Ser]Sec-eEFSec-GTP осуществляется по-
щих белков относятся к одному из трех семейств:
средством 3'-нетранслируемой области мРНК ге-
SELW-подобных белков, пероксиредоксинов и
нов селенопротеинов. В данной модели неясно,
пролинредуктаз. Остальные 12% имеют принад-
остается ли SBP2 связанным с SECIS-элементом
лежность к 22 другим семействам селенопротеи-
или диссоциирует каждый раз [36] (рис. 2б). Та-
нов [40].
ким образом, экспрессия селенопротеинов в ос-
Поскольку база данных Саргассова моря пред-
новном регулируется на уровне трансляции и яв-
ставлена 1800 видами, сложно было сделать пред-
ляется сложным процессом.
положение относительно процентного соотно-
БИОФИЗИКА том 64
№ 4
2019
650
ВАРЛАМОВА, МАЛЬЦЕВА
Рис. 2. Схематическое изображение двух моделей процесса встраивания Sec в селенопротеины.
шения видов, несущих гены селенопротеинов к
тельствуют о том, что изначально данные фер-
видам без них. Однако поиск в этой базе данных
менты были вовлечены в катаболические процес-
высококонсервативных генов, содержащих
сы, тогда как эукариотические селенопротеины,
UGA-кодон, в открытой рамке считывания иден-
чьи функции известны, участвуют в NADPH-за-
тифицировал от 341 до 569 видов. Такое мозаич-
висимых дисульфидоксидоредуктазных анаболи-
ное распределение селенопротеиновых генов, на-
ческих и регуляторных процессах (тиоредоксин-
блюдаемое при анализе геномов, представленных
редуктазы, глутатионпероксидазы, дейодиназы).
в базе данных Саргассова моря, характерно для
При сравнении последовательностей селенопро-
всех доменов жизни.
теинов бактерий, архей и эукариотических орга-
низмов, было установлено, что только фермент
Существует гипотеза относительно данного
селенофосфатсинтетаза, участвующий в процес-
феномена, согласно которой, подобная мозаич-
сах биосинтеза Sec, присутствует в селенопротео-
ность объясняется снижением утилизации селен-
мах организмов, относящихся к трем различным
содержащих белков организмами, обитающими в
доменам жизни, что является очередным доказа-
морской воде ввиду относительно постоянного
тельством отсутствия связи эволюционного раз-
поступления в нее селена [37]. В то же время на
вития этих селенопротеомов [41].
суше локальное распределение данного микро-
элемента привело к существенной необходимо-
Если говорить об эволюции селенопротеинов
сти утилизации селенсодержащих белков назем-
от низших к высшим эукариотическим организ-
ными организмами, особенно обитающими в тех
мам, то существует ряд данных, свидетельствую-
местах, где наблюдается острый дефицит селена.
щих о том, что она шла в направлении замещения
Так или иначе, обнаружение новых селенопроте-
Cys на Sec в их первичной последовательности.
иновых прокариотических семейств в базе дан-
Так, например, фермент тиоредоксинредуктаза
ных Саргассова моря позволило расширить пред-
(TXNRD) во всех охарактеризованных геномах
ставление о филогенезе и явилось свидетель-
грибов и низших растений, у которых она носит
ством независимой эволюции трех селено-
название малой тиоредоксинредуктазы, пред-
протеиновых семейств (глутатионпероксидазно-
ставлена как цистеиновый гомолог большой тио-
го, дейодиназного и семейства SELW-гомологич-
редоксинредуктазы животных. Более того, в гено-
ных белков), встречающихся и у прокариот, и у
ме Drosophilamelanogaster содержится два гена,
эукариотических организмов.
кодирующих цистеиновую форму большой тио-
Функции, которые выполняют различные се-
редоксинредуктазы, в геноме Caenorhabditisele-
ленсодержащие белки бактерий и архей, свиде- gans - два гена большой тиоредоксинредуктазы,
БИОФИЗИКА том 64
№ 4
2019
УНИКАЛЬНОСТЬ ПРИРОДЫ МИКРОЭЛЕМЕНТА СЕЛЕНА
651
один из которых кодирует селенсодержащую
степени зависит от условий их выращивания. Хи-
форму данного фермента, а в геноме млекопита-
мические формы селена в растениях или расти-
ющих обнаружено три гена, каждый из которых
тельных продуктах могут существенно отличаться
кодирует ее цистеиновый вариант [40].
[48]. SeMet является преобладающей формой в
большинстве продуктов, обогащенных селеном.
Помимо этого, существует предположение о
том, что гены, кодирующие некоторые селено-
При низких концентрациях селена в почвах ос-
протеины, могли возникнуть путем дупликации
новной формой его соединений у растений явля-
отдельных генов. Ярким примером, свидетель-
ется SeMetSec, а при повышенных - глутамил-
SeMetSec, который, скорее всего, является носи-
ствующим в пользу данной гипотезы, является
телем SeMetSec [47]. На дрожжах было показано,
наличие удвоенных копий генов некоторых эука-
риотических селенопротеинов (GPX-1, GPX-4 и
что состав соединений селена может также силь-
SELT), а также Sec-тРНК[Ser]Sec, гены которых
но варьировать в зависимости от условий роста,
были обнаружены в геноме Zebrafish. Интересно
так, содержание SeMet варьирует от 16% до 63%
[48].
также, что селенопротеин SELP, представленный
исключительно у позвоночных, содержит в своем
У животных и человека селен присутствует в
составе несколько остатков Sec (от 10 до 17 в зави-
организме в виде аминокислоты Sec и выводится
симости от вида) [42,43].
из организма с мочой в виде 1β-метилселено-N-
Таким образом, несмотря на то что к настоя-
ацетил-D-галактозамина [50]. Недавно было по-
щему моменту накоплено достаточно много ин-
казано, что селеноцианат также является селено-
формации о селенсодержащих белках, входящих
вым метаболитом в клетках животных [51].
в состав селенопроетомов различных организ-
Известно, что съедобные грибы могут накап-
мов, большое количество вопросов, касающихся
ливать высокие концентрации селена, который
их эволюции, остаются открытыми. Хотя суще-
присутствует в них в виде селенсодержащих ами-
ствует немало доказательств в пользу гипотезы о
нокислот. Относительно недавно было показано,
независимом развитии селенопротеинов в трех
что лекарственные базидиомицеты Lentinulaedo-
доменах жизни, наличие противоречивых дан-
des способны синтезировать наночастицы селена
ных, все же дает основания для рассмотрения
путем восстановления органоселенового соеди-
других объяснений процесса их эволюции. По-
нения диацетофенонилселенида DAPS-25 и не-
мимо этого, преимущества Sec перед Cys ранее
органического соединения селена - селенита на-
были выявлены при рассмотрении механизма ак-
трия, а также накапливать эти наночастицы внут-
тивации Sec в каталитических реакциях с участи-
ри гиф [52].
ем известных селенопротеинов - тиоредоксинре-
дуктазы млекопитающих, формиатдегидрогеназы
В бактериях и археях селен легко метаболизи-
и глутатионпероксидазы [44-46].
руется и участвует в ряде метаболических функ-
ций, которые включают ассимиляцию, метили-
рование, детоксикацию и анаэробное дыхание
СЕЛЕНСОДЕРЖАЩИЕ СОЕДИНЕНИЯ,
[53-55]. Селен в виде аминокислоты Sec иденти-
ВСТРЕЧАЮЩИЕСЯ В РАЗЛИЧНЫХ
фицирован в составе активного центра фермента
ДОМЕНАХ ЖИЗНИ, ИХ ФУНКЦИИ
формиатдегидрогеназы [56]. Обнаружено, что об-
Определение химических видов селена в орга-
разование аморфного красного элементарного
низмах, принадлежащих к различным таксоно-
нанопреципитата является стабильным конеч-
мическим группам, является очень актуальным в
ным продуктом восстановления оксианиона се-
настоящее время. За последние два десятилетия
лена микроорганизмами. Различные гипотезы
большое внимание было уделено исследованию
были сформулированы, чтобы объяснить появле-
содержания селена в агрономических культурах и
ние наносфер селена как внутри клетки, так и во
других продуктах питания [47]. В тканях расте-
внеклеточной среде. Селенсодержащие выступы
ний, животных и грибов встречаются несколько
на поверхности клеток и частицы селена во вне-
селенсодержащих соединений. Селеновые соеди-
клеточной среде наблюдались у Enterobactercloa-
нения, присутствующие у растений, были описа-
cae - SLD1a-1 при воздействии на них SeO42-
ны в работе [48] и включают селенат, селенит,
или SeO32- [57]. Было предположено, что реак-
Sec, селенометионин (SeMet), селеногомоцисте-
ция восстановления происходит через мембрано-
ин, Se-метилселеноцистеин, γ-глутамил-селено-
связанную редуктазу. Во внеклеточной среде фо-
цистатионин, селенометионинселеноксид, диме-
тосинтетической бактерии Rhodospirillumrubrum
тилдиселенид, селеносинигрин, селенометио-
было обнаружено большое количество селенсо-
нинселенооксид. До 80% селеновых соединений,
держащих наночастиц после восстановления
представленных в растениях, приходится на долю
SeO32- [58]. Предполагается, что эта бактерия
селенметилселеноцистеина (SeMetSec), причем
участвует в транспортировке селеновых частиц из
его содержание, а также разнообразие других се-
клеток через везикулярную систему секреции.
леновых соединений в растениях в значительной
Напротив, высвобождение частиц элементного
БИОФИЗИКА том 64
№ 4
2019
652
ВАРЛАМОВА, МАЛЬЦЕВА
селена в среду, окружающую Desulfovibriodesulfu-
GPX-1 и включает пероксид водорода, трет-бу-
ricans, было предположительно вызвано лизисом
тилгидропероксид, гидроперекиси линолевой
клеток [59], подробное описание микроорганиз-
кислоты, но не фосфатидилхолина [90]. Было
мов, использующих селенат и селенит в качестве
подтверждено, что этот фермент участвует в регу-
терминальных электронных акцепторов, приве-
ляции различных злокачественных опухолей. На-
дено в обзоре [60]. В таблице приведены функции
пример, сверхэкспрессия гена GPX-2 наблюда-
наиболее распространенных селенсодержащих
лась в клетках аденомы прямой кишки, слизи-
соединений, встречаемых в природе.
стой оболочке пищевода Барретта, раковых клет-
ках печени [91,92]. Инактивация GPX-2 была вы-
явлена у пациентов с плоскоклеточным раком
КЛЮЧЕВЫЕ ФУНКЦИИ СЕЛЕНА В БЕЛКАХ
кожи, вызванным ультрафиолетовым облучени-
И РОЛЬ В ЗДОРОВЬЕ ЧЕЛОВЕКА
ем [93]. Использование иммунногистохимиче-
ских методов показало, что при раке молочной
Антиоксидантная функция и участие в канцеро-
генезе. Селен в виде аминокислоты Sec присут-
железы повышается экспрессия гена, кодирую-
ствует в большом количестве селенопротеинов,
щего GPX-2, который участвует в совместной ре-
относящихся к различным семействам и пред-
гуляции этого типа опухоли наряду с белком р53.
ставленных во всех доменах жизни. Большое ко-
Известно, что в 20-35% случаев появление рака
личество работ, посвящено исследованию функ-
молочной железы вызывается наличием мутиро-
ций селенопротеинов, однако в настоящий мо-
ванного р53 [94]. Фермент GPX3 - единственный
мент в этой области существуют пробелы,
представитель данного семейства, который пред-
связанные с недостатком информации о некото-
ставляет собой секреторный белок, и 20% селена
рых из них. У человека идентифицировано 25 се-
плазмы крови приходится на его долю [95]. Ос-
ленопротеинов, большинство из которых явля-
новным источником GPX-3 в плазме крови слу-
ются оксидоредуктазами, участвующими в под-
жат почки, фермент секретируется эпителиаль-
держании оптимального антиоксидантного
ными клетками проксимальных канальцев и па-
статуса в клетке, а также в регенерации и актива-
риетальными клетками Боуменовой капсулы и
ции низкомолекулярных антиоксидантов (Q10,
выбрасывается в кровь [96]. Делеция или гипер-
витаминов С и Е и др.). Отдельного внимания за-
метилирование в промоторной области гена
служивают два семейства ферментов-селенопро-
GPX-3, приводящее к значительному снижению
теинов: глутатионпероксидазы и тиоредоксинре-
экспрессии, было продемонстрировано на раз-
дуктазы, представляющие собой основные ре-
личных типах раковых клеток - предстательной
докс-системы в клетке. По этой причине эти
железе, слизистой оболочке Барретта пищевода,
ферменты и селен, входящий в состав их актив-
желудке, мочевом пузыре, различных миеломах,
ных центров, вовлечены в регуляцию важнейший
при раке толстой кишки, в мышцах, стволовых
процессов в организме с участием активных форм
клетках, шейке матки и др. [97,98]. Наоборот,
кислорода (АФК). Большое количество работ по-
сверхэкспрессия GPX-3 сдерживает рост опухоли
священо исследованию роли данных селенопро-
и метастазирование. Кроме того, этот фермент
теинов в процессах канцерогенеза. У млекопита-
участвует в регуляции чувствительности клеток
ющих идентифицировано восемь глутатионпе-
аденокарциномы яичника к цисплатину [99].
роксидаз, пять из которых селенсодержащие:
GPX-4 представляет собой мономерный белок,
GPX-1, GPX-2, GPX-3, GPX-4 и GPX-6. Исклю-
содержащий Sec в активном центре, и восстанав-
чение составляет отряд грызунов, в частности,
ливает широкий спектр гидропероксидов: от пе-
Musmusculus и Rattusnorvegicus, у которых фер-
роксида водорода до гидропероксидных групп
мент GPX6 является цистеиновым гомологом
сложных липидов биологических мембран [100].
[38]. GPX-1 представляет собой тетрамерный бе-
Высокий уровень гонадотропин-зависимой экс-
лок, содержащий четыре одинаковых субъедини-
прессии GPX-4 в семенниках позволяет расши-
цы, каждая из которых имеет один Sec и восста-
рить представления о функциональной значимо-
навливает большое число органических гидропе-
сти этого фермента. В семенниках ген GPX-4, ре-
роксидов
[84]. Ряд работ свидетельствует о
ализуя альтернативные пути использования
взаимосвязи этого белка с раком молочной желе-
зы [85], легкого [86], мочевого пузыря [87]. Суще-
стартовых кодонов, экспрессируется в трех раз-
ствуют также доказательства того, что замена
личных формах - цитозольной, ядерной и мито-
Pro198 в гене человеческого GPX-1 может приве-
хондриальной [101]. В настоящее время доступ-
сти к раку простаты [88], хотя риск незначителен.
ной информации о GPX-6 мало: мРНК этого бел-
Также было продемонстрировано, что GPX-1
ка синтезируется исключительно в обонятельном
действует как супрессор роста опухоли головного
эпителии [38] на всех этапах постнатального раз-
мозга [89]. GPX2 - фермент желудочно-кишеч-
вития животного, начиная с первой недели жиз-
ного тракта, локализуется в цитозоле и ядре клет-
ни вплоть до 18-месячного возраста [102], фер-
ки. Субстратная специфичность GPX-2 подобна
мент локализуется в ядре и цитоплазме [103].
БИОФИЗИКА том 64
№ 4
2019
УНИКАЛЬНОСТЬ ПРИРОДЫ МИКРОЭЛЕМЕНТА СЕЛЕНА
653
Таблица 1. Основные функции наиболее распространенных органических и неорганических селенсодержащих
соединений
Название соединения
Функции
Неорганические селенсодержащие соединения
Диоксид селена (SeO2)
Предотвращает окислительные повреждения ДНК, вызванные взаимодействием
Fe(II), Cr(III) и Cu(II) с перекисью водорода, путем формирования
комплексов с металлами [61].
Селенит натрия (Na2SeO3)
Потенциальный противораковый агент, принимает непосредственное участие
в ингибировании пролиферации различных опухолевых клеток, индукции
апоптоза путем активации каспаз, проапоптотического UPR, ингибирования
ангиогенеза, однако может инициировать канцерогенез, стимулируя клеточную
иммунную систему [5, 6, 62, 63].
Окисляет сульфгидрильные группы на мембранах опухолевых клеток до
соответствующих дисульфидов, что делает невозможным взаимодействие
с другими белками плазмы [64].
Является перспективным противовоспалительным средством, способным
спонтанно уменьшать объем лимфедемы [65] и вызывать гибель клеток путем
независимого пути митохондриального апоптоза, стресса эндоплазматического
ретикулума, процессов аутофагии или некроза [66].
Селенат натрия (Na2SeO4)
Является активатором протеин фосфатазы 2А (PP2A) и обладает антиангиогенными
свойствами [67].
Способен замедлять эпилептогенез, замедляя процессы нейродегенерации, снижать
гиперфосфорилирование tau-белка [68].
Органические селенсодержащие соединения
Селенометионин (SeMet)
Способствует снижению генной репарации, скорее всего, путем усиления
экспрессии Ref-1, который, в свою очередь, регулирует активность p53 в процессе
клеточного цикла [69].
Наряду с метилселеноцистеином обладает антиангиогенным свойством, но является
более токсичным, для активации требуется несколько ферментативных реакций
[70].
Метилселеноцистеин
Участвует в деградации фактора 1α, индуцируемого гипоксией (HIF-1α), за счет
подавления АФК и стабилизации пролилгидроксилаз 2 и 3 (PHD2,3), которые
гидроксилируют молекулы пролина HIF-1α, приводя к убиквитилированию путем
опухолевого супрессора VonHippel-Lindau и деградации протеосомами [71].
Усиленное ингибирование HIFs метилселеноцистеином в сочетании с топотеканом,
ингибитором синтеза HIFs, приводит к значительному повышению эффективности
лечения. Напротив, лечение терапевтическими дозами только метилселеноцистеи-
ном (без топотекана) на примере колоректальных опухолей с низкой экспрессией
HIFs приводило к выраженному ингибированию HIF1α и чувствительности
раковых клеток к различным противораковым агентам [72].
В терапевтических дозах способен подавлять экспрессию онкогенной miRNA и
усиливать экспрессию супрессорных опухолевых miRNA зернисто-клеточной
почечной карциномы (ccRCC) при трансплантологии [71].
Селективно ингибирует факторы транскрипции, что усиливает противоопухолевую
активность химиотерапии и лучевой терапии при раке легкого A549 и колоректаль-
ном раке HT29 [73].
Регулирует процессы, связанные с репарацией ДНК, путем селективного
ингибирования специфического гена репарации ДНК и специфических типов
транскрипционных факторов [74].
БИОФИЗИКА том 64
№ 4
2019
654
ВАРЛАМОВА, МАЛЬЦЕВА
Таблица 1. Окончание
Название соединения
Функции
Диселениды
Обладают различными активностями: антиоксидантной, прооксидантной,
антипролиферативной, цитотоксической и рядом других [75].
Применяются в качестве редокс-чувствительных эпитопов в составе полимеров,
используемых для приготовления мицелл. Так, например, Park с коллегами
создали подобный полимер с диселенидом, который селективно доставляет
противоопухолевый препарат доксорубицин (DOX) в раковые ткани [76].
Используются в качестве селенохорматического агента - химически синтезиро-
ванного соединения, наделенного способностью «тренировать» клетки
приобре-тать ими устойчивость к различным стрессорам [77].
Метилселениновая кислота
Обладает антиоксидантной, прооксидантной, противовирусной активностями
и участвует в регуляции клеточной сигнализации и окислительно-восстанови-
тельной системы [78, 79].
Способна индуцировать апоптоз раковых клеток путем образования суперок-
сидных анионных радикалов [80].
Препятствует пролиферации раковых клеток простаты путем активации ответа
на накопление неправильно свернувшихся белков (UPR-путь)и может индуци-
ровать апоптоз посредством стресса эндоплазматического ретикулума [63].
В раковой клеточной линии человека A549 снижает уровень внутриклеточного
содержания АФК в дозо-зависимой манере, что приводит к ингибированию
клеточного цикла в фазе G1 [81].
Вызывает проапоптотический ответ путем активации каспазы-3 и регуляции
провоспалительных цитокинов [82], а также может выступать в качестве инги-
битора.
В раковых клетках простаты MSA может действовать как ингибитор андроген-
нового рецептора (AR) [83].
Тиоредоксинредуктазы (TXNRD(s)) живот-
экспрессируется в семенниках и в ранних спер-
ных являются NADPH-зависимыми, FAD-содер-
матидах, предполагается, что он участвует в окис-
жащими белками, входящими в состав пиридин
лительно-восстановительных реакциях в процес-
нуклеотид дисульфид оксидоредуктазного семей-
се созревания сперматозоидов [107].
ства [104]. У млекопитающих обнаружено три
Репродуктивная функция. Известно, что селен
тиоредоксин редуктазы. TXNRD1 и TXNRD2 яв-
играет важную роль для биологической функции
ляются основными тиоредоксин редуктазами ци-
яичек и в нормальных условиях его концентрация
тозоля и митохондрий, соответственно, и экс-
в данном органе поддерживается на стабильном
прессируются в различных тканях и типах клеток
уровне из-за приоритета использования данного
и являются гомодимерными селенопротеиновы-
микроэлемента по сравнению с другими тканя-
ми оксидоредуктазами, содержащими FAD и
ми; он влияет на гистологическую морфологию
имеющими C-концевой
-Gly-Cys-Sec-Gly-ак-
яичка [108,109]: добавление селената натрия в ко-
тивный сайт [105]. Тиоредоксинредуктаза 1 (TX-
личестве 0,1 ppm сухого вещества в рацион бара-
NRD1) является ключевым регулятором окисли-
нов приводило к увеличению длины и окружно-
тельно-восстановительного баланса в клетках
сти мошонки [110], в то время как употребление
млекопитающих, участвуя в защите нормальных
грызунами диетического селена в количестве 2-7
и раковых клеток от окислительного стресса. TX-
мкг/кг, наоборот, способствовало задержке роста
NRD1 и TXNRD2 рассматриваются как маркеры
яичек и полового созревания; во втором и третьем
рака предстательной железы, тогда как SNP в ге-
поколениях дефицит селена повлиял на морфо-
нах TXNRD1 и TXNRD2 дают дополнительное
логию тестикулярных сосудов, а в четвертом по-
подтверждение для предположения, что эти бел-
колении у животных была обнаружена двусто-
ки участвуют в прогрессировании опухоли [106].
ронняя атрофия яичек без митотичекой активно-
Изофермент тиоредоксинредуктазы, кодируе-
сти сперматогония, наблюдалось уменьшение
мый геном TXNRD3, по своей структуре похож
диаметра семясодержащих канальцев, окружен-
на две другие TXNRD, но имеет дополнительный
ных клетками Сертоли или другими стволовыми
монотиоловый глутаредоксиновый домен (Grx)
клетками, костная метаплазия и неполноценная
на N-конце. Данный белок преимущественно
сперматогенная активность [108]. Кроме того,
БИОФИЗИКА том 64
№ 4
2019
УНИКАЛЬНОСТЬ ПРИРОДЫ МИКРОЭЛЕМЕНТА СЕЛЕНА
655
было показано, что дефицит селена приводит к
ные цитокины способствуют снижению активно-
значительному снижению веса яичек у крыс, что
сти D1, хотя анализ ферментативной активности
существенно ухудшало их репродуктивную спо-
D1 в клетках печени крыс под действием TNF-α,
собность [109], и что наноселен влияет на уль-
IL-1β и IL-G, проведенный авторами работы
траструктуру семенников [111].
[118], не подтвердил это предположение. Фер-
Помимо глутатионпероксидаз и тиоредоксин-
мент D2 играет ключевую роль в контроле внут-
риклеточной концентрации T3. Было установле-
редуктаз в семенниках локализуется еще ряд се-
но, что ген d2 в значительной степени экспресси-
ленопротеинов, играющих важную роль в регуля-
руется в медуллярной карциноме ЩЖ человека,
ции процессов сперматогенеза. Так, SELP пре-
опухоли, которая развивается из С-клеток [119].
имущественно локализуется в семенниках и их
придатках, мРНК SELP экспрессируется в клет-
Результаты, полученные в течение последних де-
сятилетий, показали, что D3 необходим для под-
ках Лейдига, но не в эпителии семяносных пу-
держания пролиферации клеток при некоторых
зырьков [112]. Направленная делеция гена Selp у
патологических состояниях и хронических забо-
самцов мыши даже при достаточном потребле-
леваниях.
нии ими селена вызывает прогрессивное разви-
тие структурных нарушений сперматозоидов как
Иммунная функция. Показано, что у селенде-
в процессе сперматогенеза, так и на поздних ста-
фицитных крыс снижен как клеточный, так и гу-
диях развития семенников, что в конечном итоге
моральный иммунитет [120]. Селен улучшает
приводит к бесплодию. Было показано, что снаб-
способность лимфоцитов отвечать на стимуля-
жение селеном семенников с помощью SELP
цию антигена, пролиферировать и дифференци-
происходит посредством рецептора 2-аполипо-
ровать, а прием препаратов селена уменьшает ко-
протеина (ApoRE2), принадлежащего к семей-
личество циркулирующих лейкоцитов и увеличи-
ству рецепторов липопротеинов низкой плотно-
вает отношение агранулоцитов к гранулоцитам у
сти и экспрессирующегося в семенниках клетка-
мышей
[121]. Селенопротеины необходимы
ми Сертоли [113]. Еще одним селенопротеином,
для активации функции Т-клеток. Т-клетки осо-
локализующимся исключительно в семенниках, в
бенно чувствительны к окислительному стрессу,
семенных канальцах, является SELV [38]. Мы
а дефицитные по селенопротеину Т-клетки
идентифицировали физиологических белковых
не могут пролиферировать в ответ на стимуляцию
партнеров SELV с помощью аффинной хромато-
Т-клеточных рецепторов из-за своей неспособ-
графии в сочетании с масс-спектрометрией, и
ности подавлять выработку АФК. Существует
различные подходы позволили подтвердить спе-
прямая корреляция между потреблением селена и
цифичность белок-белковых взаимодействий
пролиферацией лимфоцитов, которой предше-
[114,115]. Методом ПЦР в реальном времени нами
ствует усиленная экспрессия высокоаффинного
также было показано, что мРНК SELV экспресси-
рецептора интерлейкина-2
[122]. У мышей,
руется на поздних этапах сперматогенеза (зрелые
потребляющих высокий уровень селена, наблю-
сперматозоиды), которым соответствуют 31-й и
далась повышенная экспрессия как интерлейки-
36-й дни постнатального развития крысы, а также
на-2, так и высокоаффинной цепи рецептора ин-
на всем протяжении периода полового созрева-
терлейкина-2, сопровождающаяся усиленной пе-
ния (2, 4 месяца) и репродуктивного периода
редачей сигналов Т-клетками in vivo [123].
(15 месяцев). Кроме того, SELV обладает глутати-
онпероксидазной и тиоредоксинредуктазной ак-
Регуляция дифференциальной экспрессии селе-
нопротеинов. Известно, что концентрация селена
тивностями [116].
в организме существенным образом влияет на со-
Регуляция активности тироидных гормонов.
став селенопротеома. В ответ на дефицит данного
Гормоны щитовидной железы являются важны-
микроэлемента поддерживается экспрессия кон-
ми регуляторами первичных клеточных процес-
кретных селенопротеинов, чаще всего глутатион-
сов, включая пролиферацию, апоптоз, метабо-
пероксидаз [124-126]. На грызунах было показа-
лизм и так далее. Передача сигналов опосредуется
но, что дефицит селена приводил к усилению
действием специфических рецепторов [117], ко-
экспрессии GPX-1, но не GPX-4 [127]. Кроме то-
торые напрямую регулирует экспрессию генов с
го, показано, что при действии на клетки переки-
помощью лиганд-зависимого механизма. Рецеп-
си водорода ряд селенопротеинов (GPX-1, SELK,
тор, связанный с лигандом, представляет собой
SPS2, GPX4, TRXR1, SELS) в разной степени ак-
3,5,3'-трийодтиронин (Т3), который в основном
тивировались в ответ на окислительный стресс,
синтезируется путем селективного удаления йо-
вызванный перекисью водорода, только в усло-
дида из 3,5,3', 5'-тетраиодтиронина (Т4). Эта ре-
виях дефицита селена [128].
акция катализируется тремя типами селенсодер-
жащих йодтиронин-дейодиназ (D1, D2, D3), ко-
Высказано предположение, что для регуляции
торые играют ключевую роль в регуляции
«иерархии» использования селена селенопротеи-
активности гормонов щитовидной железы. Было
нами важную роль играет структура SECIS-эле-
высказано предположение, что провоспалитель-
мента [129]. Другим объяснением данной регуля-
БИОФИЗИКА том 64
№ 4
2019
656
ВАРЛАМОВА, МАЛЬЦЕВА
ции является модель репликативного старения,
кальным некрозом миокарда, циррозом, повре-
при которой дефицит селена усиливает выработ-
ждением скелетных мышц. Заболевание имеет
ку АФК, индуцирует клеточное повреждение, ак-
высокий процент летальности. Смертность при
тивирует репликативное старение, связанное с
болезни Кэшана связана с нарушением анти-
сигнальными путями p53, p16, p21, pRb [130]. Хо-
окислительной активности крови и патологией
рошей моделью репликативного старения служит
обмена жирных кислот [132].
пролиферация фибробластов WI-38, что схоже с
Другим заболеванием, вызванным дефицитом
органическим старением: морфологические из-
селена и распространенным, главным образом, в
менения, укорачивание теломер, рост окисли-
эндемических очагах Забайкалья, особенно в
тельного повреждения клеток и др. Показано, что
районе реки Уров, является болезнь Кашина-
от концентрации селена в питательной среде при
Бэка (уровская болезнь), описанная в 1848 г. Это
культивировании клеток WI-38 зависела экспрес-
остеопатия, поражающая преимущественно де-
сия GPX-4, SELS, SELK, SELP, TXNRD1 и TXN-
тей 6-13 лет (пик заболеваемости приходится на 8
RD2, которые могут служить новыми биомарке-
лет), приводящая к некрозу суставов, вызванному
рами репликативного старения в этих клетках
окислительным стрессом в хрящевой ткани, де-
[130].
формации костей, структурному недоразвитию
Эндемические заболевания, вызванные дефици-
пальцев и костей, задержке роста и карликовости.
том селена. Известно, что недостаток поступле-
Болезнь купируется при переезде в здоровую
ния селена в организм человека и животных вы-
местность, но изменения костей и суставов необ-
зывает одну из разновидностей гипомикроэле-
ратимы.
ментозов, называемую гипоселенозом. Дефицит
К другим эндемическим районам можно отне-
селена у домашних животных и птиц вызывает
сти Восточную Финляндию, Новую Зеландию,
беломышечную болезнь, которая характеризует-
Белоруссию, некоторые районы Украины, Яро-
ся замедлением роста, потерей массы тела, нару-
славскую область и некоторые районы северо-за-
шением репродуктивной функции и выпадением
пада России. Симптоматика заболеваний, вы-
шерсти. Патоморфологические изменения про-
званных недостаточным поступлением данного
являются очаговыми деструктивно-некробиоло-
микроэлемента в организм человека, достаточно
гическими процессами в скелетных мышцах и
разнообразна.
миокарде, исчезновением миоглобина из пора-
женных мышечных волокон, некрозом печени,
дистрофией почек. Введение в рацион питания
ЗАКЛЮЧЕНИЕ
селена предупреждает эти процессы.
Слово «уникальность» означает неповтори-
Гипоселенозы наиболее вероятно развиваются
мость, исключительность. В данном обзоре рас-
у жителей, проживающих в районах с выражен-
смотрены физико-химические свойства селена и
ным недостатком селена в почвах и продуктах пи-
его основные функции, механизм биосинтеза
тания. Наиболее ярким проявлением эндемиче-
аминокислоты Sec, в состав которой он входит,
ского гипоселеноза является болезнь Кэшан, по-
филогенетическое распределение данного мик-
лучившая название от города Кэшань на северо-
роэлемента, его встречаемость в природе и роль в
востоке Китая, где в 1935 г. была зарегистрирова-
здоровье человека. Все это позволяет говорить о
на массовая вспышка данного заболевания, пора-
селене как об уникальном микроэлементе перио-
зившего около 5 млн человек. В этом эндемиче-
дической таблицы Менделеева.
ском районе наблюдается острый недостаток се-
лена в почвах и пищевых продуктах, а его
Во-первых, поражает тот факт, что долгие го-
содержание в крови и волосах больных резко сни-
ды селен считался ядом, обладающим высокой
жено соответственно до 5-10 мкг/л и 0,03-
токсичностью, и рассматривался исключительно
0,12 мкг/л при норме
90-150 мкг/л и
0,2-
как микроэлемент, опасный для здоровья и жиз-
0,8 мкг/л соответственно. Долгое время счита-
ни. И только в середине XX века появилась ин-
лось, что дефицит селена - единственный фак-
формация о его пользе. Для поддержания здоро-
тор, способствующий развитию данного заболе-
вья необходимо получать всего приблизительно
вания. В настоящее время показано, что причина
20-50 мкг селена в сутки, тогда как превышение
болезни Кэшан
- энтеровирусная инфекция
данной дозы в 10 раз является токсичным для ор-
(Coxsackievirus B3) [131]. При этом пищевой ок-
ганизма. В обзоре особое внимание уделено его
сидативный стресс (недостаток селена и витами-
неоценимой роли для человеческого организма,
на Е) позволяет Coxsackievirus B3 мутировать в
следует отметить его антиоксидантные и проти-
вирулентный штамм, вызывающий поражение
вораковые свойства, участие в регуляции работы
сердца, сопровождающееся увеличением его раз-
щитовидной железы, иммунитета и репродуктив-
меров (кардиомегалией), аритмией, фокальными
ной функции человека. С другой стороны, чуть
некрозами миокарда. У взрослых основные пато-
более высокий уровень селена в организме может
логические изменения представлены мультифо-
привести к отравлению и стать потенциально фа-
БИОФИЗИКА том 64
№ 4
2019
УНИКАЛЬНОСТЬ ПРИРОДЫ МИКРОЭЛЕМЕНТА СЕЛЕНА
657
тальным, привести к сердечному приступу и ре-
находится в субтоксичной дозе, которая клини-
спираторной депрессии. Конечно, данными
чески доступна.
свойствами обладают и некоторые другие важные
микроэлементы, но селен является единствен-
СПИСОК ЛИТЕРАТУРЫ
ным микроэлементом, для которого четко дока-
зана противоопухолевая активность.
1.
S. Menon, K. S. Shrudhi Devi, R. Santhiya, et al., Col-
loids Surf. B. Biointerfaces 170, 280 (2018).
Во-вторых, из всех микроэлементов периоди-
2.
E. G. Varlamova, M. V. Goltyaev, and E.E. Fesenko,
ческой таблицы Менделеева только пять (железо,
молибден, марганец, цинк и селен) входят в со-
Dokl. Biochem. Biophys. 468, 203 (2016).
став ферментов, однако селен - единственный
3.
E. G. Varlamova and I. V. Cheremushkina, J. Trace El-
микроэлемент, который является важнейшим
em. Med. Biol. 39, 76 (2017).
компонентом ферментов, относящимся к раз-
4.
E. G. Varlamova, M. V. Goltyaev, V. I. Novoselov, and
личным классам и семействам - оксидоредукта-
E. E. Fesenko, Dokl. Biochem. Biophys. 476, 320
зы, дейодиназы, синтетазы и др.
(2017).
В-третьих, селен входит в состав Sec - 21-й
5.
E. G. Varlamova, J. Trace Elem. Med. Biol. 48, 172
аминокислоты, которая наряду с пирролизином
(2018).
является нестандартной аминокислотой универ-
6.
E. G. Varlamova, M. V. Goltyaev, J. P. Kuznetsova,
сального генетического кода. Sec кодируется од-
Molecular Biology. 52, 446 (2018).
ним из трех стоп-кодонов трансляции UGA. Се-
7.
Y. P. Kuznetsova, M. V. Goltyaev, O. S. Gorbacheva, et
лен может встраиваться в белок после трансляции
al., Dokl. Biochem. Biophys. 480, 131 (2018).
полипептидной цепи в качестве совместимого
кофактора, что характерно лишь для нескольких
8.
U. Peters and Y. Takata, Mol. Nutr. Food Res. 52,
молибденсодержащих ферментов, так и котранс-
1261(2008)
ляционно, что широко распространено в мире
9.
J. P. Richie Jr., A. Das, A. M. Calcagnotto, et al., Exp.
про- и эукариот. Иногда селен может быть встро-
Gerontol. 47, 223 (2012).
ен в белок неспецифически, в результате получа-
10.
C. van Dronkelaar, A. van Velzen, M. Abdelrazek, et
ется селеноаминовая кислота - селеноамин или
al., J. Am. Med. Dir. Assoc. 19, 6 (2018).
селенометионин. Котрансляционное встраива-
ние Sec в селенопротеины осуществляется при
11.
L. A. Wessjohann, A. Schneider, M. Abbas, and
участии специфичных цис- и транс-активных
W. Brandt, J. Biol Chem. 388, 997 (2007).
факторов, некоторые из которых являются строго
12.
E. S. Arnér, J. Exp. Cell Res. 316, 1296 (2010).
специфичными для синтеза селенопротеинов,
13.
C. Jacob, G. I. Giles, N. M. Giles, et al., Chem. Int.
что еще раз подчеркивает уникальность данной
Ed. Engl. 42, 4742 (2003).
аминокислоты и селена, входящего в ее состав.
14.
L. Johansson, G. Gafvelin, and E. S. Arnér, Biochim.
Ведь известно, что Sec отличается от Cys только
Biophys. Acta 1726, 1 (2005).
наличием селена вместо серы, однако подобная
замена наделяет селенопротеины большей реак-
15.
M. Wada, S.-I. Nobuki, and Y. Tenkyuu, J. Organomet.
ционной способностью, что доказано в много-
Chem. 580, 282 (1999).
численных экспериментах. Вопрос эволюцион-
16.
16. J. C. Pleasants, W. Guo, and D. L. Rabenstein, J.
ного происхождения селенопротеинов и их фило-
Am. Chem. Soc. 111, 6553 (1989).
генетическое распределение в природе, позво-
17.
X. M. Xu, B. A. Carlson, H. Mix, et al., PLoS Biol. 5,
ляющий понять биологическую значимость заме-
122 (2007).
ны серы на селен в этих белках, остается от-
крытым и является еще одной нерешенной про-
18.
M. J. Berry, R. M. Tujebajeva, P. R. Copeland, et al., J.
блемой в данной области. Понятно, что селено-
Biofactors 14, 17 (2001).
протеины встречаются во всех доменах жизни,
19.
D. J. Klein, T. M. Schmeing, P. B. Moore, and T. A.
эволюционное происхождение шло нескольки-
Steitz, EMBO J. 20, 4214 (2001).
ми независимыми путями, а замена Sec на Cys
20.
P. R. Copeland, J. E. Fletcher, B. A. Carlson, et al.,
представляет собой длительный процесс, иногда
EMBO J. 19, 306 (2000).
зависящий от условий окружающей среды и
21.
A. M. Diamond, B. Dudock, and D. L. Hatfield, Cell
метаболических особенностей разных видов.
25, 497 (1981).
В-четвертых, внушительное количество иссле-
22.
D. A. G. Noble and H. Song, Cell Mol. Life Sci. 65,
дований in vitro и in vivo за последние два десяти-
1335 (2008).
летия продемонстрировало противораковый по-
23.
G. R. Andersen, L. Pedersen, L. Valente, et al., Mol.
тенциал соединений селена. Это свойство указы-
вает на то, что данный микроэлемент является
Cell 6, 1261 (2000).
перспективным химиотерапевтическим сред-
24.
G. W. Martin III, J. W. Harney, and M. J. Berry, RNA
ством, а его терапевтический диапазон действия
2, 171 (1996).
БИОФИЗИКА том 64
№ 4
2019
658
ВАРЛАМОВА, МАЛЬЦЕВА
25. G. W. Martin III, y J.W. Harne, and M. J. Berry, RNA
53. J. F. Stolz and R. S. Oremland, FEMS Microbiol. Rev.
4, 65 (1998).
23, 615 (1999).
26. 26. F. Werner, Chem. Rev. 113, 8331 (2013).
54. J. F. Stolz, P. Basi, and R. S. Oremland, Int. Microbiol.
5, 201 (2002).
27. C. Sturchler, A. Lescure, G. Keith, et al., Nucl. Acids
Res. 22, 1354 (1994).
55. B. Soboh, C. Pinske, and M. Kuhns, BMC Microbiol.
28. C. Baron, E. Westhof, A. Böck, and R. Giege, J. Mol.
11, 173 (2011).
Biol. 231, 274 (1993).
56. M. E. Losi and W. T. Frankenberger, Appl. Environ.
29. K. M. Holman, A. K. Puppala, J. W. Lee, et al., RNA
Microbiol. 63, 3079 (1997).
23, 1685 (2017).
57. H. Ridley, C. A. Watts, D. J. Richardson and C. S. But-
30. Y. Itoh, M. J. Broecker, S.-I. Sekine, et al., Science
ler, Appl. Environ. Microbiol. 72, 5173 (2006).
340, 75 (2013).
58. J. Kessi, M. Ramuz, E. Wehrli, et al., Appl. Environ.
31. L. R. Manzine, V. H. B. Serrao, L. Lima, et al., FEBS
Microbiol. 65, 4734 (1999).
Lett. 587, 906 (2013).
59. F. A. Tomei, L. L. Barton, C. L. Lemanski, et al., J. Ind.
32. N. Noinaj, R. Wattanasak, D.-Y. Lee, et al., J. Bacteri-
Microbiol. 14, 329 (1995).
ol. 194, 499 (2012).
60. Y. V. Nancharaiah and P. N. L. Lens, Microbiol. Mol.
33. T. Stock, M. Selzer, S. Connery, et al., Mol. Microbiol.
Biol. Rev. 79, 61 (2015).
82, 734 (2011).
61. W. E. Hart, S. P. Marczak, A. R. Kneller, et al., J. In-
34. P. R. Copeland, V. A. Stepanik, and D. M. Driscoll, J.
org. Biochem. 125, 1 (2013).
Mol. Cell Biol. 21, 1491 (2001).
62. S. Ansar, M. Abudawood, S. S. Hamed, and M. M. Al-
35. J. Donovan and P. R. Copeland, Antioxid. Redox Sig-
eem, Biol. Trace Elem. Res. 175, 161 (2017).
nal. 12, 881 (2010).
63. Z. Shigemi, K. Manabe, and N. Hara, Chem. Biol. In-
36. L. Chavatte, B. A. Brown, and D. M. Driscoll, Nat.
teract. 266, 28 (2017).
Struct. Mol. Biol. 12, 408 (2005).
64. M. Kieliszek, B. Lipinski, and S. Błażejak, Cells 24, 39
37. P. R. Copeland, J. Genome Biol. 6, 221 (2005).
(2017).
38. G. V. Kryukov, S. Castellano, S. V. Novoselov, et al.,
65. E. D. Paskett, J. A. Dean, J. M. Oliveri, and J. P. Har-
Science 300, 1439 (2003).
rop, J. Clin. Oncol. 30, 3726 (2012).
39. G. V. Kryukov and V. N. Gladyshev, EMBO Rep. 5,
66. N. Xiang, R. Zhao, and W. Zhong, Cancer Chemother.
538 (2004).
Pharmacol. 63, 351 (2009).
40. Y. Zhang, D. E. Fomenko, and V. N. Gladyshev, Ge-
67. N. M. Corcoran, M. Najdovska, and A. J. Costello, J.
nome Biol. 6, 37 (2005).
Urol. 171, 907 (2004).
41. Q. A. Sun, Y. Wu, F. Zappacosta, et al., J. Biol. Chem.
68. S. R. Shultz, D. K. Wright, P. Zheng, et al., Brain 138,
274, 24522 (1999).
1297 (2015).
42. R. F. Burk and K. E. Hill, Bioessays 21, 231 (1999).
69. T. R. Schwartz, E. B. Kmiec, BMC Mol. Biol. 8, 7
43. L. Flohe, W. A. Gunzler, and H. H. Schock, FEBS
(2007).
Lett. 32, 132 (1973).
70. S. Cao, F. A. Durrani, K. Toth, and Y. M. Rustum,
44. J. T. Rotruck, A. L. Pope, H. E. Ganther, et al., Science
Brit. J. Cancer 110, 1733 (2014).
179, 588 (1973).
71. S. Chintala, K. Tóth, and S. Cao, Cancer Chemother
45. S. Gromer, J. Wissing, D. Behne, et al., J. Biochem.
Pharmacol. 66, 899 (2010).
332, 591 (1998).
72. M. Puppo, F. Battaglia, and C. Ottaviano, Mol. Cancer
46. M. P. Rayman, H. G. Infante, and M. Sargent, Brit. J.
Therapeutics 7, 1974 (2008).
Nutr. 100, 238 (2008).
73. M. E. Crosby, R. Kulshreshtha, M. Ivan, and P. M.
47. P. D. Whanger, J. Am. Coll. Nutr. 21, 223 (2002).
Glazer, Cancer Res. 69, 1221 (2009).
48. Y. Dong, D. Lisk, E. Block, and `C. Ip, Cancer Res. 61,
74. A. Bhattacharya, K. Toth, and A. Sen, Clin. Colorectal
2923 (2001).
Cancer 8, 155 (2009).
49. Y. Kobayashi, Y. Ogra, and K. Ishiwata, Proc. Natl.
75. A. Kim, J. Lee, and M. S. Park, Arch. Pharmacol. Res.
Acad. Sci. USA 99, 15932 (2002).
38, 659 (2015).
50. Y. Anan, M. Kimura, M. Hayashi, et al., Chem. Res.
76. V. G. Deepagan, S. Kwon, and D. G. You, Biomaterials
Toxicol. 28, 1803 (2015).
103, 56 (2016).
51. E. Vetchinkina, E. Loshchinina, V. Kursky, and V. Ni-
77. D. Bartolini, J. Commodi, M. Piroddi, Free Radic.
kitina, J. Microbiol. 51, 829 (2013).
Biol. Med. 88, 466 (2015).
52. J. F. Stolz, P. Basu, J. M. Santini, and R. S. Oremland,
78. A. P. Fernandes and V. Gandin, Biochim. Biophys. Ac-
Annu. Rev. Microbiol. 160, 107 (2006).
ta 1850, 1642 (2015).
БИОФИЗИКА том 64
№ 4
2019
УНИКАЛЬНОСТЬ ПРИРОДЫ МИКРОЭЛЕМЕНТА СЕЛЕНА
659
79. A. Liu, H. Liu, and Y. Li, Mol. Carcinog. 51, 303
106. C. Méplan, S. Rohrmann, A. Steinbrecher, et al., PloS
(2012).
One 7, e48709 (2012).
80. J. E. Spallholz, B. J. Shriver, and T. W. Reid, Nutrition
107. D. Su, S. V. Novoselov, Q. A. Sun, et al., J. Biol. Chem.
and Cancer 40, 34 (2001).
280, 26491 (2005).
81. M. Tarrado-Castellarnau, R. Cortes, and M. Zanuy,
108. A. S. H. Wu, J. E. Oldfield, L. R. Shull, and
Pharmacol. Res. 102, 218 (2015).
P. R. Cheeke, Biol. Reprod. 20, 793 (1979).
82. H. Zeng and M. Wu, Nutrition and Cancer 67, 831
109. D. Behne, H. Weiler, A. Kyriakopoulos, J. Reprod.
(2015).
Fert. 106, 291 (1996).
110. I. F. M. Marai, A. A. El-Darawany, E. A. Ismail, and
83. B. Husbeck, R.S. Bhattacharyya, D. Feldman, and
M. A. M. Abdel-Hafez, Arch. Tierz 52, 402 (2009).
S. J. Knox, Mol. Cancer Therapeutics 5, 2078 (2006).
111. L. G. Shi, R. J. Yang, and W. B. Yue, Anim. Reprod.
84. G. C. Mills, J. Biol. Chem. 229, 189 (1957).
Sci. 118, 248 (2010).
85. G. Ravn-Haren, A. Olsen, and A. Tjonneland, Car-
cinogenesis 27, 820 (2006).
112. M. Koga, H. Tanaka, K. Yomogida, et al., Biol Re-
prod. 58, 261 (1998).
86. M. Cao, X. Mu, C. Jiang, et al., Tumour Biol. 35, 759
113. G. E. Olson, V. P. Winfrey, S. K. Nagdas, et al., Biolo-
(2014).
gy of reproduction. 73, 201 (2005).
87. J. A. Moscow, L. Schmidt, D. T. Ingram, et al., Car-
114. E. G. Varlamova and V. I. Novoselov, Mol. Biol. (Mos-
cinogenesis 15, 2769 (1994).
cow) 46, 819 (2012).
88. Z. Kote-Jarai, F. Durocher, S. M. Edwards, et al.,
115. E. G. Varlamova and V. I. Novoselov, Mol. Biol. (Mos-
Prostate Cancer Prostatic Dis. 5, 189 (2002).
cow) 46, 250 (2012).
89. I. Dokic, C. Hartmann, C. Herold-Mende, and
116. E. G. Varlamova, S. V. Novoselov, and V. I. Novoselov,
A. Régnier-Vigouroux, Glia 60, 1785 (2012).
Mol. Biol. (Moscow) 49, 700 (2015).
90. F. F. Chu, J. H. Doroshow, and R. S. Esworthy, J. Biol.
117. 117. S. Y. Cheng, J. L. Leonard, and P. J. Davis, Endo-
Chem. 268, 2571 (1993).
cr. Rev. 31, 139 (2010).
91. F. F. Chu, R. S. Esworthy, and P. G. Chu, Cancer Res.
64, 962 (2004).
118. 118. P. H. Davies, M. C. Sheppard, and J. A. Franklyn,
Mol. Cell Endocrinol. 129, 191 (1997).
92. R. S. Esworthy, R. Aranda, M. G. Martin, et al., Am. J.
Physiol. Gastrointest. Liver Physiol. 281, 848 (2001).
119. 119. E. L. Meyer, I. M. Goemann, J. M. Dora, et al.,
93. J. Walshe, M. M. Serewko-Auret, and N. Teakle, Can-
Mol. Cell Endocrinol. 289, 16 (2008).
cer Res. 67, 4751 (2007).
120. 120. R. Kukreja and A. Khan, Ind. J. Exp. Biol. 36, 203
94. S. B. Bull, H. Ozcelik, and D. Pinnaduwage, J. Clin.
(1998).
Oncol. 22, 86 (2004).
121. G. R. Hogan, J. Toxicol. Environ. Health 53, 113
95. C. Schmutzler, B. Mentrup, L. Schomburg, et al., Biol.
(1998).
Chem. 388, 1053 (2007).
122. M. Roy, L. Kiremidjian-Schumacher, and H. I. Wishe,
96. F. G. Ottaviano, S. S. Tang, D. E. Handy, and J. Lo-
Biol. Trace. Elem. Res. 41, 103 (1994).
scalzo, Mol. Cell. Biochem. 327, 111 (2009).
123. F. W. Hoffmann, A. C. Hashimoto, L. A. Shafer, et al.,
97. X. Zhang, J. J. Yang, Y. S. Kim, et al., Int J Oncol. 36,
J. Nutr. 140, 1155 (2010).
405 (2010).
124. 1G. Bermano, J. R. Arthur, and J. E. Hesketh, Bio-
98. Z. L. Yang, L. Yang, and Q. Zou, Dis. Markers 35, 163
chem. J. 320, 891 (1996).
(2013).
125. G. Bermano, J. R. Arthur, and J. E. Hesketh, FEBS
99. Y. Saga, M. Ohwada, and M. Suzuki, Oncol. Rep. 20,
Lett. 387, 157 (1996).
1299 (2008).
126. 126. G. Bermano, F. Nicol, J. A. Dyer, et al., Biochem.
100. F. Ursini, S. Heim, M. Kiess, et al., Science 277, 1393
J. 311, 425 (1995).
(1999).
127. X. G. Lei, J. K. Evenson, K. M. Thompson, and
101. T. Pushpa Rekha, L. M. Burdsal, G. M. Chilsom, and
R. A. Sunde, J. Nutr. 125, 1438 (1995).
D. M. Driscoll, J. Biol. Chem. 270, 26993 (1985).
128. Z. Touat-Hamici, Y. Legrain, A. L. Bulteau, and
102. M. V. Goltyaev, E. G. Varlamova, V. I. Novoselov, and
L. Chavatte, J. Biol. Chem. 289, 14750 (2014).
E.E. Fesenko, Dokl. Biochem. Biophys. 457, 132
129. L. Latreche, S. Duhieu, Z. Touat-Hamici, et al., RNA
(2014).
Biol. 9, 681 (2012).
103. Е. Г. Варламова, Фундаментальные исследования
130. Y. Legrain, Z. Touat-Hamici, and L. Chavatte, J. Biol.
9, 326 (2011).
Chem. 289, 6299 (2014).
104. A. Holmgren and M. Bjornstedt, Methods Enzymol.
131. M. A. Beck, P. C. Kolbeck, L. H. Rohr, et al., J. Med.
252, 16644 (1995).
Virol. 43, 166 (1994).
105. L. Zhong and A. Holmgren, J. Biol. Chem. 275, 1812
132. D. D. Hensrud, D. C. Heimburger, J. Chen, and
(2000).
B. Parpia, Eur. J. Clin . Nutr. 48, 455 (1994).
БИОФИЗИКА том 64
№ 4
2019
660
ВАРЛАМОВА, МАЛЬЦЕВА
Uniqueness of the Microelement Selenium and Its Key Functions
E.G. Varlamova and V.N. Maltseva
Institute of Cell Biophysics, Russian Academy of Sciences, ul. Institutskaya 3, Pushchino, Moscow
The trace element selenium, discovered by Berzelius in 1817, today remains largely unknown and continuous-
ly exhibit a range of its amazing and diverse functions. This trace element is unique because, firstly, it is part
of not only organic and inorganic compounds, but also is a key component of amino acids of selenocysteine
and selenomethionine in selenoproteins found in all domains of life. Secondly, selenocysteine is the 21st ami-
no acid in the universal genetic code. Its uniqueness lies not only in the fact that it is encoded by one of the
three stop codons of translation, but also that its biosynthesis possesses unique features and that this process
involves unique cis- and trans-active factors necessary for recognition of this triplet as selenocysteine that
helps avoid premature translation termination and synthesize full-sized selenoproteins. Maintaining these
cis- and trans-active factors is very energy-intensive for the cell, which suggests the importance and vital role
of selenoproteins for a living organism. In addition, in all domains of life the mechanisms by which amino
acid and selenoprotein biosyntheses occur have some distinctive features. Thirdly, the variety of processes and
effects of selenium compounds of different origin, in which this trace element plays a key role, especially in
the regulation of the vital functions of mammals, is striking. In the framework of this review, on the basis of
the latest data, a complete picture of the properties and functions of selenium is presented, providing deep
insight into the uniqueness of this trace element in nature.
Keywords: selenium, selenocysteine, selenoproteins, selenium functions, selenium-containing compounds
БИОФИЗИКА том 64
№ 4
2019