БИОФИЗИКА, 2019, том 64, № 4, с. 674-685
МОЛЕКУЛЯРНАЯ БИОФИЗИКА
УДК 577.357.464.23
ВНУТРИКЛЕТОЧНАЯ ЛОКАЛИЗАЦИЯ И МЕХАНИЗМЫ
ФОТОТОКСИЧНОСТИ ПРОИЗВОДНЫХ ХЛОРИНА е6
И ИХ ЛИПОСОМАЛЬНЫХ ФОРМ
© 2019 г. Т.Е. Зорина, И.В. Янковский, И.В. Яковец, И.Е. Кравченко, Т.И. Ермилова*,
Т.В. Шман*, М.В. Белевцев*, В.П. Зорин
Белорусский государственный университет,
220030 Минск, проспект Независимости, 4, Республика Беларусь
E-mail: zorinate@mail.ru
*Республиканский научно-практический центр детской онкологии, гематологии и иммунологии,
223053, д. Боровляны Минской области, ул. Фрунзенская, 43, Республика Беларусь
Поступила в редакцию 16.01.2019 г.
После доработки 16.01.2019 г.
Принята к публикации 05.03.2019 г.
Методами конфокальной микроскопии и колокализационного анализа с использованием коэффи-
циентов корреляции Пирсона показано, что этерифицированные производные хлорина е6 и их ли-
посомальные формы локализуются преимущественно в эндоплазматическом ретикулуме, комплек-
се Гольджи, митохондриях клетки и имеют низкий уровень локализации в лизосомах. Фармаколо-
гические формы введения фотосенсибилизаторов существенно влияют на уровень и кинетику
накопления их в клетках, но не оказывают значительного влияния на внутриклеточную локализа-
цию производных хлорина е6. Установлены отличия в активности и механизмах действия для про-
изводных хлорина е6 и их липосомальных форм по сравнению с хлорином е6 при фотосенсибилизи-
рованном воздействии на клетки К562. Предполагается, что различия в механизмах повреждения
клеток в значительной степени определяются особенностями локализации фотосенсибилизаторов.
Ключевые слова: производные хлорина е6, липосомальные формы, внутриклеточная локализация,
цитотоксичность, апоптоз.
DOI: 10.1134/S0006302919040057
структуры, в которых он накапливается, поэтому
Фотодинамическое воздействие на клетки и
внутриклеточная локализация ФС имеет суще-
ткани в присутствии фотосенсибилизаторов
ственное значение при определении механизмов
(ФС) происходит с участием радикальных реак-
повреждений клеток.
ций и активных форм кислорода. В случае ФС
Накопление и распределение ФС в различных
порфиринового ряда синглетный кислород (1О2)
клеточных, тканевых системах в решающей сте-
является основным агентом окислительных реак-
пени определяются их физико-химическими и
ций при фотосенсибилизированных процессах
структурными характеристиками. Наличие кати-
[1,2]. Эффективность фотоповреждения биоло-
онных или анионных групп, симметрия располо-
гических систем непосредственно связана с лока-
жения боковых заместителей в порфириновой
лизацией ФС, поскольку время жизни 1О2 неве-
молекуле существенным образом сказываются на
лико (порядка 0,03-0,04 мкс) и длина свободного
взаимодействии ФС с клеточными, тканевыми
пробега молекулы за это время не превышает
структурами и определяют процессы их локали-
0,1 мкм [1,3]. Первичными мишенями окисли-
зации и накопления [4,5].
тельного действия ФС являются те клеточные
Ранее было показано, что хлорин е6 (Хл е6) и
его этерифицированные производные (ПХл е6) -
Сокращения: ФС - фотосенсибилизаторы, Хл е6 - хлорин
е6, ПХл е6 - этерифицированные производные Хл е6,
диметиловый и триметиловый эфиры хлорина е6
ДМЭ - диметиловый эфир хлорина е6,
ТМЭ
- (ДМЭ и ТМЭ соответственно) - могут быть ис-
триметиловый эфир хлорина е6, ЛФ - липосомальные
пользованы для различных приложений техники
формы, ДМФХ - димеристоилфосфатидилхолин, ЭСТ -
эмбриональная сыворотка телят, ККП - коэффициент
фотодинамической терапии, включая лечение
корреляции Пирсона, CMXRos - хлорметил-Х-розамин.
онкологических заболеваний, сосудистых пато-
674
ВНУТРИКЛЕТОЧНАЯ ЛОКАЛИЗАЦИЯ И МЕХАНИЗМЫ
675
логий, избирательное повреждение клеток с по-
вышенным пролиферативным статусом
[5,6].
Низкая растворимость данных соединений в вод-
ной среде обуславливает необходимость приме-
нения для их введения специальных носителей.
Наноразмерные липидные везикулы являются
наиболее популярной фармакологической фор-
мой для введения неполярных лекарственных со-
единений [7,8]. Однако использование липосо-
мальных форм (ЛФ) для введения ФС требует
проведения дополнительных исследований, так
как характеристики препарата в этом случае зави-
сят не только от свойств самого ФС, но и от
структурных характеристик наноразмерных ли-
пидных везикул.
В данной работе исследованы характеристики
взаимодействия хлоринов с клетками в культуре и
изучено влияния на эти процессы особенностей
химической структуры и форм введения сенсиби-
лизатора. Методами конфокальной флуоресцент-
Рис.
1. Структурные формулы хлорина е6 и его
ной микроскопии и цитометрии изучены локали-
производных: для Хл е6 R1 = R2 = R3 = H; для ДМЭ
зация и накопление в культуральных клетках
R1 = Н, R2 = R3 = СH3; для ТМЭ R1 = R2 = R3 = СH3.
К562 хлорина е6, его этерифицированных произ-
водных, введенных в суспензию клеток в органи-
флуориметра SFL-1211А (SOLAR, Беларусь) и
ческих растворителях и в составе ЛФ. Проведен
спектрофотометра PV1251C ( SOLAR, Беларусь).
анализ механизмов повреждения клеток, фото-
сенсибилизированных хлоринами и их липосо-
Концентрацию Хл е6 в растворе ацетона опре-
мальными формами.
деляли по величине оптической плотности на
длине волны 664 нм, коэффициент молярной
МАТЕРИАЛЫ И МЕТОДЫ
экстинкции 50000 М-1 см-1л. Концентрацию ДМЭ
и ТМЭ определяли на длине волны 666 нм, коэф-
Фотосенсибилизаторы и их липосомальные фор-
фициент молярной экстинкции 54000 М-1 см-1л.
мы. Синтез хлоринов проводили по модифициро-
Для определения концентрации ФС, включенно-
ванной методике [9]. При синтезе этерифициро-
го в липидные везикулы, липосомы предвари-
ванных прозводных Хл е6, ДМЭ и ТМЭ, в каче-
тельно разрушали добавлением
0,2%-го ней-
стве исходных субстанций использовали
трального детергента тритон X-100 (Panreac, Ис-
феофитин или Хл е6. Чистоту Хл е6 и его произ-
пания).
водных контролировали хроматографически.
Клеточные культуры. В работе были использо-
Структурные формулы исследуемых хлоринов
ваны клетки лейкемической линии миелоидного
представлены на рис. 1.
происхождения К562 (Коллекция клеточных
Липосомы, нагруженные хлоринами в опреде-
культур РНПЦ детской онкологии, гематологии
ленном соотношении липид : пигмент, готовили
и иммунологии). Суспензии клеток культивиро-
из синтетического насыщенного липида димири-
вали в среде RPMI-1640 (Sigma, США). При ис-
стоилфосфатидилхолина (ДМФХ), производства
следовании клетки отмывали и переводили в сре-
Sigma (США), на ручном экструдере Avanti Mini-
ду с 5%-м содержанием эмбриональной сыворот-
Extruder (метод Бенгема), используя поликарбо-
ки телят (ЭСТ) (Sigma, США).
натные мембранные фильтры
«Nuclepore®»
Для исключения влияния агрегации спирто-
(Whatman, Великобритания) с порами 100 нм.
вые растворы ФС предварительно инкубировали
Фотосенсибилизаторы вводили в липидные вези-
в среде RPMI-1640 с 5%-м содержанием ЭСТ. В
кулы на стадии получения липидной пленки. Вы-
пробы, содержащие ЭСТ, добавляли Хл е6 или его
сушенную липидную пленку гидратировали фос-
производные в растворах в концентрациях от
фатно-солевым буфером Дюльбекко (рН 7,4) при
постоянном перемешивании. Степень включе-
5 · 10-6 М до 1 ∙ 10-5 М и инкубировали в термо-
ния хлоринов в липидные везикулы составляла
стате (37°С) в течение 1 ч. Клетки К562 в концен-
более 90% для ДМЭ и более 85% для ТМЭ.
трации 1 · 106 клеток/мл помещали в подготов-
Спектрально-люминесцентные и абсорбционные
ленные пробы и икубировали при 37°С в течение
методы исследования. Спектральные характери-
необходимого для накопления ФС времени, за-
стики хлоринов исследовали с помощью спектро-
тем трижды отмывали средой от несвязавшегося
БИОФИЗИКА том 64
№ 4
2019
676
ЗОРИНА и др.
ФС. Липосомальные формы добавляли непо-
Цитофлуориметрический анализ. Определение
средственно к клеткам в среде RPMI-1640 с 5%
механизмов повреждения клеток. Изменения в
ЭСТ и проводили инкубирование по той же схе-
клетках, индуцированные фотодинамическим
ме. Затем клетки осаждали центрифугированием
воздействием, анализировали с применением ме-
и разводили свежей средой культивирования до
тодов проточной цитофлуориметрии (цитофлуо-
концентрации 5 · 106 клеток/мл.
риметр FC 500, Beckman Coulter, США). Средние
значения интенсивности флуоресценции клеточ-
Конфокальная лазерная сканирующая микро-
ных популяций в каждом временном интервале
скопия. Определение локализации хлоринов в клет-
рассчитывали с помощью статистического пакета
ках. Прижизненный анализ локализации ФС в
программ CXP (Beckman Coulter, США).
культуральных клетках К562 проводили на лазер-
ном сканирующем конфокальном флуоресцент-
Структурные изменения в клетках при фото-
ном микроскопе TCS SPE (Leica, Германия).
сенсибилизации оценивали на основании анали-
Клетки наносили на стекла SuperFrost и накрыва-
за распределения клеток по интенсивности пря-
ли покровными стеклами толщиной 0,17 мм. Ис-
мого и бокового светорассеяния. При исследова-
пользовали иммерсионный объектив с увеличе-
нии динамики апоптоза анализ светорассеяния
нием 63× (Leica, Германия). Флуоресценцию ФС
совмещали с изменениями флуоресценции флуо-
возбуждали аргоновым лазером (λ = 488 нм), ре-
рохрома иодида пропидиума, связывающегося с
гистрацию флуоресценции осуществляли в диа-
ДНК, а также с изменениями флуоресценции ли-
пазоне 620-700 нм.
пофильного флуорохрома Mito Tracker® Red -
Для идентификации внутриклеточного рас-
хлорметил-Х-розамина (CMXRos), который ис-
пределения хлоринов использовали технику ко-
пользуется для оценки трансмембранного потен-
локализации. Накопление ФС в клетках прово-
циала митохондрий.
дили по схеме, указанной выше, затем клетки от-
мывали и ресуспендировали в среде RPMI-1640 c
Для оценки механизмов фотосенсибилизиро-
конечной концентрацией 2 · 106 клеток/мл. Далее
ванного воздействия пробы готовили следующим
клетки инкубировали с колокализаторами со-
образом. Клетки К562 инкубировали в средах с
гласно стандартным протоколам для определения
различным содержанием ПХл е6 или их ЛФ в те-
внутриклеточной локализации исследованных
чение 1 ч (для ТМЭ - 3 ч) при температуре 37°С,
ФС. Были использованы флуоресцентные зонды,
дважды отмывали от несвязавшегося ФС, ресус-
обладающие высокой избирательностью накоп-
пендировали в свежей среде и облучали диодным
ления в органеллах: митохондриальный зонд Mito
лазером (λ = 660 нм) с регулируемой мощностью
Traker® Green FM (λвозб = 490 нм, λрег = 511 нм) в
облучения (ИЛМ-660-0,5; «ЛЭМТ», Беларусь).
Фотооблучение проводили при комнатной тем-
концентрации
4·10-7 М; лизосомальный зонд
пературе в течение 20 с. Конечная световая доза
Lyso Traker® Green DND-26 (λвозб = 504 нм,
облучения составляла 0,4 Дж/см2. Затем клетки
λрег = 511 нм) в концентрации 1 · 10-7 М; колока-
помещали в термостат при температуре 37°С. Го-
лизаторы: для комплекса Гольджи
- NBD-
товили две серии образцов: аликвоты суспензии
BODYPY-Labeled Sphingolipids (λвозб = 505 нм,
клеток отбирали через определенные промежут-
λрег = 511 нм) в концентрации 5 · 10-6 М; для эн-
ки времени - 30 и 180 мин - для определения
доплазматического ретикулума- ER Traker® TM
числа поврежденных клеток (некроз или поздний
Green (λвозб = 504 нм, λрег = 511 нм) в концентра-
апоптоз) в тесте с иодидом пропидиума (конеч-
ная концентрация 1 мкг/мл), а также в тесте с
ции 1 · 10-6 М.
CMXRos (конечная концентрация 150 нМ) - для
Флуоресценцию колокализаторов исследова-
оценки ранних апоптотических изменений. В об-
ли в канале, регистрирующем излучение в диапа-
разцы клеток перед измерением на цитофлуори-
зоне 505-550 нм. В другом канале (620-700 нм)
метре вводили иодид пропидиума за 5 мин, CMX-
регистрировали флуоресценцию ФС. Наложение
Ros - за 25 мин. Время инкубирования с флуоро-
изображений двух каналов позволило сравнить
хромами учитывали в общем времени
характер распределения зонда и исследуемого
инкубирования образцов. При соблюдении тем-
ФС в клетке. Количественный анализ степени
нового режима добавление CMXRos в концентра-
колокализации осуществляли с использованием
ции до 250 нМ не приводило к дополнительной
коэффициента корреляции Пирсона (ККП) со-
гибели клеток.
гласно работе [10].
Для компьютерной обработки полученных
При измерении на цитофлуориметре уровня
флуоресцентных изображений клеток и количе-
флуоресценции красителей использовали узко-
ственного анализа параметров накопления и рас-
полосный оптический фильтр на 620 нм. Длина
пределения ФС в клетках использовали програм-
волны возбуждения флуоресценции - 488 нм (од-
му ImageJ.
нофазный аргоновый лазер).
БИОФИЗИКА том 64
№ 4
2019
ВНУТРИКЛЕТОЧНАЯ ЛОКАЛИЗАЦИЯ И МЕХАНИЗМЫ
677
Определение темновой цитотоксичности ФС
ДМЭ и ТМЭ в составе ЛФ, приготовленных экс-
проводили с помощью МТТ-теста по методике,
трузионным способом, практически не изменя-
описанной в работе [11].
лись при увеличении степени нагрузки в диапа-
зоне 1:1000 -1:100.
Из приведенных данных следует, что фотофи-
РЕЗУЛЬТАТЫ
зические и спектрально-флуоресцентные харак-
Анализ процессов локализации и накопления
теристики Хл е6 и его этерифицированных произ-
исследованных ФС осуществляли на основании
водных в составе липосом при связывании с мем-
определения их флуоресцентных характеристик в
бранными структурами близки и могут быть
клетках.
использованы для оценки накопления и распре-
Фотофизические и спектрально-флуоресцент-
деления ФС в клетке.
ные характеристики хлоринов. Ранее было показа-
Внутриклеточная локализация и накопление
но, что Хл е6 и его этерифицированные производ-
хлоринов при введении в растворах и в составе ли-
ные в мономерном состоянии в растворах орга-
посомальных форм. При исследовании локализа-
нических растворителей обладают близкими
ции и накопления ФС анализировали распреде-
спектрально-флуоресцентными свойствами [12].
ление интенсивности их флуоресценции в куль-
Положения максимумов спектров поглощения и
туральных клетках К562. Для Хл е6 в первые
флуоресценции исследуемых хлоринов в моно-
минуты инкубирования наблюдалось флуорес-
мерной форме различаются на 1-2 нм. Модифи-
центное свечение преимущественно в составе
кация боковых заместителей значительно изме-
плазматической мембраны, лишь через
10-
няет полярные свойства молекул хлоринов, что
12 мин окрашивания в цитоплазме регистрирова-
приводит к снижению их растворимости и, как
ли уровни свечения Хл е6, превышающие авто-
следствие, к агрегации в водных растворах. Ре-
флуоресценцию клеток. Распределение Хл е6 от-
зультатом этого являются различия параметров
носительно равномерно по цитоплазме. В случае
флуоресценции Хл е6 и его этерифицированных
ДМЭ и ТМЭ интенсивность флуоресценции кле-
производных в водных растворах. Так, если флу-
ток была заметно выше уже на малых временах
оресцентные характеристики в органических рас-
инкубирования. Кроме того, существенно отли-
творителях для Хл е6 и его производных близки,
чался характер внутриклеточного распределения:
то при переводе хлоринов в фосфатно-солевой
в случае ТМЭ выделялись отдельные сайты, име-
буфер величины их квантовых выходов и времени
ющие интенсивность флуоресценции на порядок
жизни флуоресценции существенно различают-
выше, чем в среднем по цитоплазме. Для ДМЭ
ся. Квантовый выход флуоресценции для Хл е6
наблюдалась наиболее высокая скорость накоп-
при переводе в водную среду изменялся с 19,2% в
ления, яркая флуоресценция и относительно рав-
ацетоне до 5,5% в фосфатно-солевом буфере, для
номерное распределение ФС по цитоплазме
ДМЭ и ТМЭ с 18,0 и 18,2 % в ацетоне до 1,3 и 1,1 %
клетки (рис. 3).
в фосфатно-солевом буфере соответственно.
Представляет интерес сравнение процессов
Время жизни флуоресценции (τ) для Хл е6, ДМЭ,
накопления и локализации этерифицированных
ТМЭ и его производных в ацетоне - 5,32 нс,
ПХл е6 в клетках при введении их в растворе и в
5,21 нс, 5,23 нс соответственно. При переводе в
ЛФ. На рис. 4 представлены изображения клеток
фосфатно-солевой буфер величина τ для Хл е6 со-
К562 в свете флуоресценции после окрашивания
ставляла 4,53 нс, для ДМЭ - 2,4 нс, для ТМЭ ве-
ДМЭ, ТМЭ и комплексами ДМЭ-ДМФХ и
личина τ не была определена [12-14].
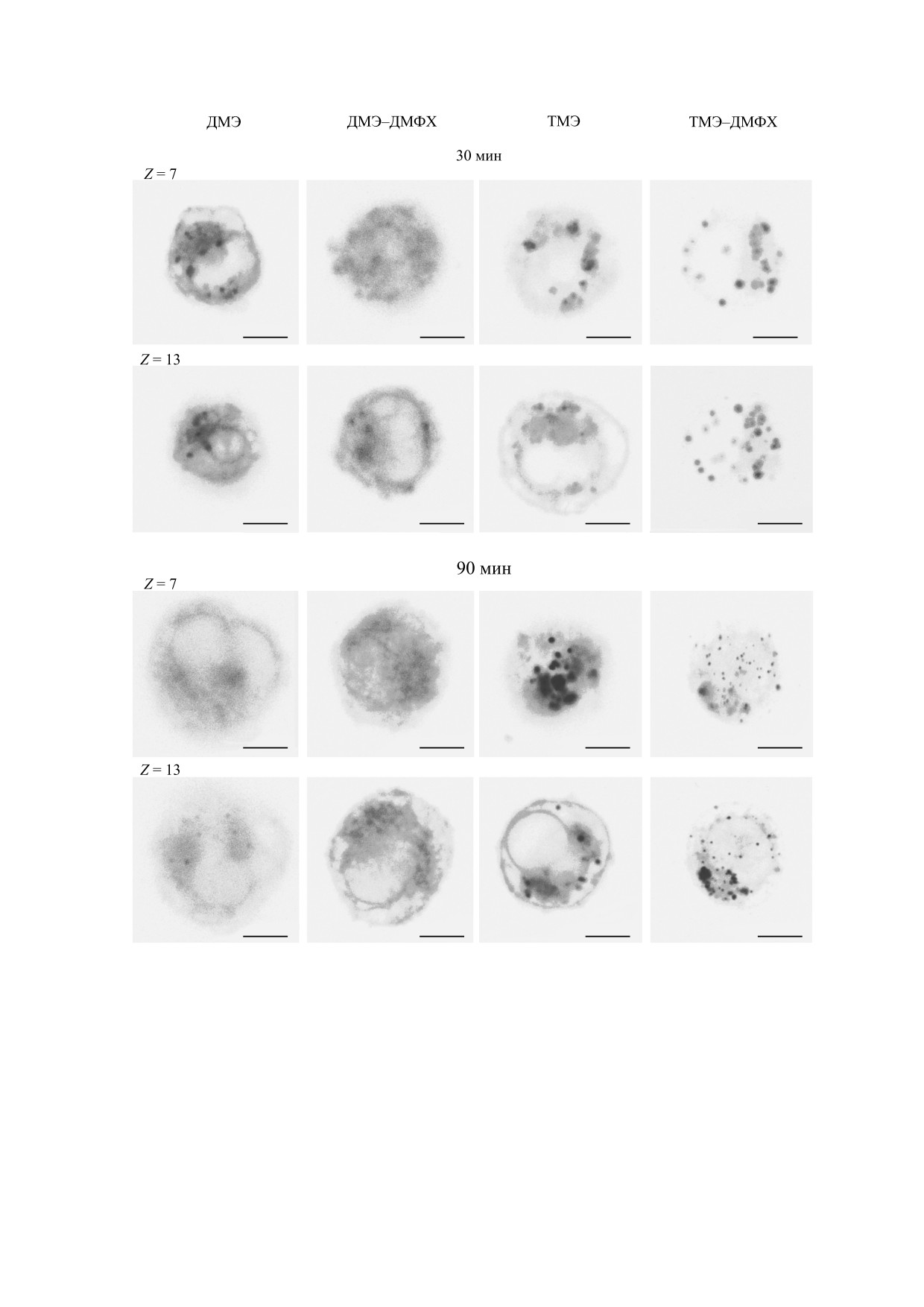
ТМЭ-ДМФХ. Из рисунка видно, что ДМЭ и
ТМЭ, введенные в липосомах, локализовались,
Включение ПХл е6 в липосомы позволяет со-
как и свободные пигменты, в плазматической
хранить мономерное состояние ФС в водной сре-
мембране клеток, в цитоплазме, в мембранных
де. Для ПХл е6, включенных в состав липидных
структурах. Для образцов с 30-минутной инкуба-
везикул, квантовый выход флуоресценции и вре-
цией наблюдается более высокий уровень флуо-
мя жизни флуоресценции близки к максимально-
ресценции для ДМЭ и липосомальных форм
му значению, характерному для растворов пиг-
ДМЭ по сравнению с ТМЭ и его липосомальны-
ментов в органических растворителях [12]. Так,
ми формами. Распределение ЛФ ДМЭ - относи-
для липосомальных форм ДМЭ и ТМЭ кванто-
тельно равномерно по цитоплазме. Характер рас-
вый выход флуоресценции составлял 16,9 % и
пределения липосомальных форм ТМЭ по телу
17,1 %, время жизни флуоресценции - 5,12 нс и
клетки существенно отличался. Так же, как и для
5,22 нс соответственно. Не наблюдалось суще-
ТМЭ, введенного в растворе, для ТМЭ в ЛФ вы-
ственных различий в характере спектров элек-
делялись отдельные сайты, имеющие интенсив-
тронного поглощения и флуоресценции ДМЭ и
ность флуоресценции значительно выше, чем в
ТМЭ в этаноле и в липосомах из ДМФХ (рис. 2).
среднем по цитоплазме. Через 90 мин инкубиро-
Спектрально-флуоресцентные характеристики
вания существенно увеличивалась интенсив-
БИОФИЗИКА том 64
№ 4
2019
678
ЗОРИНА и др.
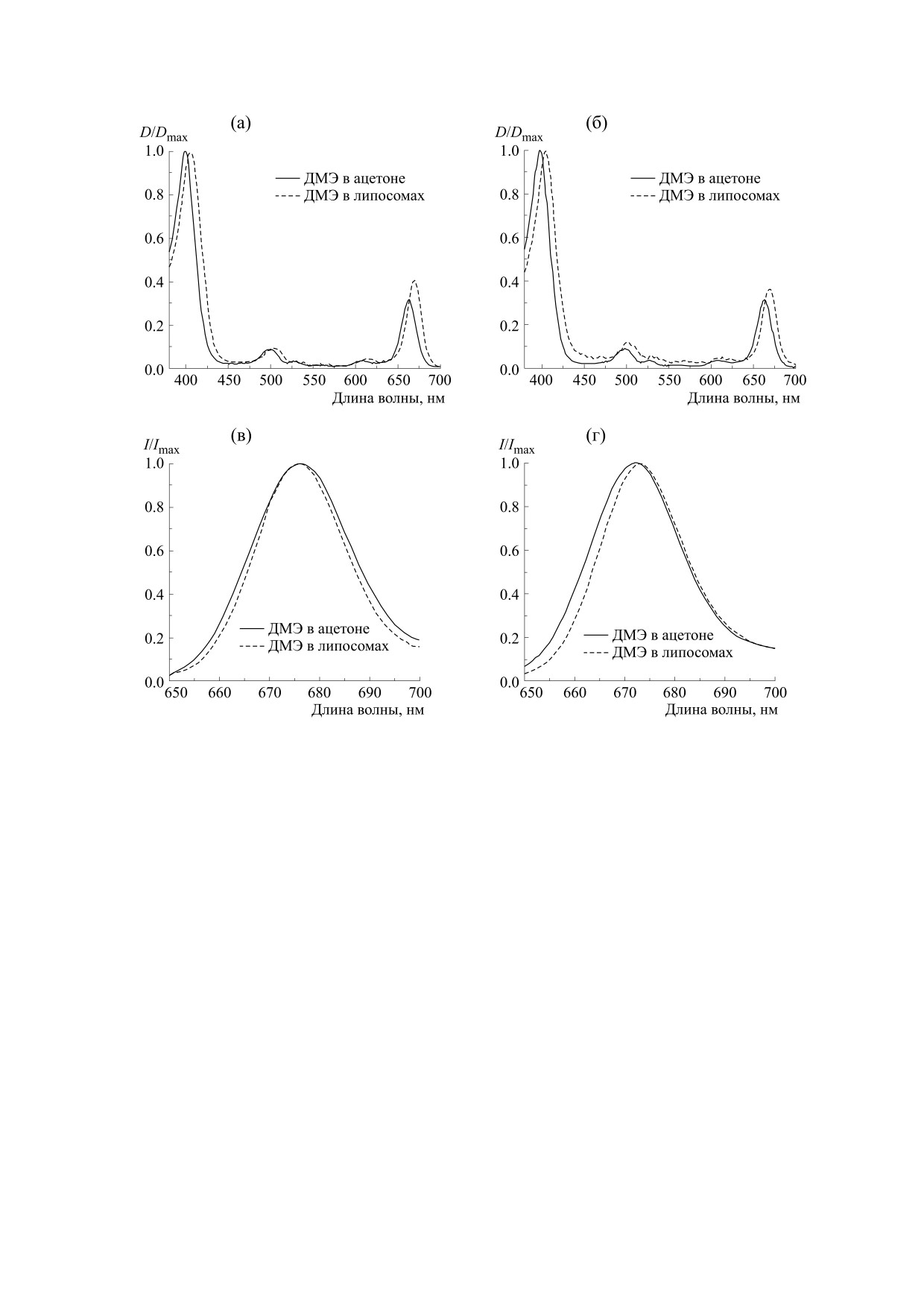
Рис. 2. Спектры электронного поглощения ДМЭ (а) и ТМЭ (б) и спектры флуоресценции ДМЭ (в) и ТМЭ (г) в этаноле
и в экструзионных липосомах из ДМФХ в растворе фосфатно-солевого буфера. Концентрация ДМЭ и ТМЭ
для спектров электронного поглощения равна 5 ∙ 10-6 М; концентрация ДМЭ и ТМЭ для спектров флуоресценции -
2 ∙ 10-7 М. Соотношение ДМЭ (ТМЭ) : ДМФХ = 1 : 40.
ность флуоресценции в пробах с ТМЭ, однако
флуоресценции исследованных ФС и флуорес-
уровень интенсивности флуоресценции оставал-
ценции субклеточных колокализаторов - эндо-
ся более низким по сравнению с пробами с ДМЭ.
плазматического ретикулума, митохондриально-
Следует отметить, что как для исследованных
го, комплекса Гольджи и лизосомального зондов.
хлоринов, так и для их ЛФ флуоресценция в обла-
В качестве примера на рис. 5 представлены изоб-
сти ядра клетки отсутствовала.
ражения клеток К562 при окрашивании ДМЭ
(клетки в свете флуоресценции ДМЭ), изображе-
Анализ интегральной флуоресценции единич-
ние клеток в свете флуоресценции колокализато-
ных клеток, показал, что при инкубировании в
ров и комбинированное свечение клеток в ре-
течение 2 ч в одинаковых условиях исследован-
зультате наложения двух каналов регистрации
ные ФС, введенные в суспензию клеток К562 в
флуоресценции. Внутриклеточное распределе-
растворах и в липосомах из ДМФХ, имеют раз-
ние флуоресценции ДМЭ умеренно коррелиро-
личный уровень накопления в клетках (табл. 1).
вало с распределением флуоресценции зондов
С использованием колокализаторов клеточ-
эндоплазматического ретикулума и комплекса
ных органелл была проведена конкретизация
Гольджи и в меньшей степени совпадало с флуо-
внутриклеточной локализации хлоринов и их ли-
ресценцией митохондриального зонда, что ука-
посомальных форм. С этой целью проводилось
зывает на возможную локализацию ДМЭ в этих
сопоставление распределения в клетках К562
органеллах. Следует отметить, что при этом прак-
БИОФИЗИКА том 64
№ 4
2019
ВНУТРИКЛЕТОЧНАЯ ЛОКАЛИЗАЦИЯ И МЕХАНИЗМЫ
679
Рис. 3. Изображения клеток К562 в свете флуоресценции хлоринов (инвертированы): (а) - Хл е6; (б) - ДМЭ; (в) - ТМЭ.
Концентрация пигмента 5 · 10-6 М; концентрация ЭСТ в среде инкубирования 5%, время инкубирования - 60 мин. Сре-
зы клеток представлены для Z = 10 .Число срезов Z = 20, шаг - 1 мкм. Масштабные отрезки на всех фотографиях - 5 мкм.
тически отсутствовало перекрытие областей флу-
Уровень колокализации Хл е6 с митохондрия-
оресценции ДМЭ и лизотрэкера.
ми имеет умеренную корреляцию (ККП порядка
0,5), при этом определен высокий уровень его ко-
Для оценки значимости совпадения локализа-
локализации с зондами эндоплазматического ре-
ции хлоринов и колокализаторов в отдельных ор-
тикулума и комплекса Гольджи (ККП > 0,7). В
ганеллах были использованы критерии Пирсона.
наименьшей степени Хл е6 накапливается в лизо-
Значения коэффициентов корреляции Пирсона,
сомах (ККП = 0,3-0,4).
количественно характеризующие степень коло-
кализации исследованных хлоринов, их ЛФ и
Из полученных данных видно, что этерифици-
специфических маркеров органелл в клетках
рованные ПХл е6 и их липосомальные формы
К562, приведены в табл. 2.
имеют однотипное распределение: области флуо-
Таблица 1. Накопление в клетках К562 Хл е6 и ПХл е6, введенных в суспензию клеток в растворе и в составе ли-
посом
Фотосенсибилизатор
Хл е6
ДМЭ
ТМЭ
ДМЭ-ДМФХ
ТМЭ-ДМФХ
Интегральная интенсивность
72.6 ± 6.0
610.4 ± 24.3
340.4 ± 16.7
320.2 ± 16.1
170.4 ± 12.2
флуоресценции
Примечание. Концентрация клеток 1 · 106/мл; концентрация хлоринов 5 · 10-6 М; концентрация ЭСТ в среде инкубирования
5%. Время инкубирования 120 мин; температура инкубирования 37°С. Соотношение пигмент : ДМФХ = 1 : 40. Ошибка рас-
считана по трем идентичным экспериментам.
Таблица 2. Значения коэффициентов корреляции Пирсона для Хл е6, этерифицированных ПХл е6, их ЛФ и ко-
локализаторов для органелл в клетках К562
Коэффициенты Пирсона для различных компартментов клетки
ФС
эндоплазматический
комплекс
митохондрии
ЛТ
ретикулум
Гольджи
Хл е6
0.517 ± 0.073
0.905 ± 0.081
0.802 ± 0.072
0.386 ± 0.046
ДМЭ
0.641 ± 0.059
0.820 ± 0.073
0.866 ± 0.079
0.380 ± 0.048
ДМЭ-ДМФХ
0.684 ± 0.061
0.852 ± 0.074
0.744 ± 0.067
0.400 ± 0.051
ТМЭ
0.652 ± 0.058
0.684 ± 0.069
0.560 ± 0.058
0.340 ± 0.041
ТМЭ-ДМФХ
0.664 ± 0.061
0.676 ± 0.058
0.520 ± 0.057
0.361 ± 0.043
Примечание. Время инкубирования при накоплении ФС - 3 ч; концентрация хлоринов - 5 · 10-6 М; концентрация ЭСТ в
среде инкубирования - 5%. Окрашивание колокализаторами - по протоколу. Величина ККП от 1.00 до 0.70 указывает на от-
носительно сильную корреляцию, 0.69-0.36 - на умеренную корреляцию, 0.35-0.20 - на слабую корреляцию, меньше 0.20 -
отсутствие корреляции [15].
БИОФИЗИКА том 64
№ 4
2019
680
ЗОРИНА и др.
Рис. 4. Изображения клеток К562, окрашенных ПХл е6 и их липосомальными формами, в режиме флуоресценции
(инвертированы) через 30 и 90 мин инкубирования. Концентрация пигмента 1 · 10-5 М; концентрация ЭСТ - 5%. Срезы
клеток представлены для Z = 7 и Z = 13, число срезов Z - 20. Соотношение пигмент : ДМФХ = 1 : 40. Масштабные отрезки
на фотографиях - 10 мкм.
ресценции ПХл е6 и их ЛФ в клетке с относитель-
0,5 до 0,7). Совпадение областей флуоресценции
но высокой вероятностью перекрываются с флу-
ПХл е6, их ЛФ и митохондриального зонда было
оресценцией зонда эндоплазматического ретику-
умеренным (ККП > 0,6). Отмечена очень слабая
лума (ККП ≥ 0,7) и аппарата Гольджи (ККП от
корреляция между областями флуоресценции ли-
БИОФИЗИКА том 64
№ 4
2019
ВНУТРИКЛЕТОЧНАЯ ЛОКАЛИЗАЦИЯ И МЕХАНИЗМЫ
681
Рис. 5. Конфокальное изображение клеток К562 (инвертировано), окрашенных комплексом ДМЭ-ДМФХ (1 : 40) в свете
флуоресценции ДМЭ (а); (б) - в свете флуоресценции колокализаторов и (в) - комбинированное свечение клеток в
результате наложения двух каналов регистрации флуоресценции (а и б).
зосомальных зондов и ДМЭ, ТМЭ и их ЛФ
Оценка механизмов фотоцитотоксического дей-
(ККП = 0,34-0,40) - что позволяет сделать за-
ствия этерифицированных производных Хл е6 и их
ключение об относительно низком уровне накоп-
липосомальных форм. При исследовании влияния
ления ПХл е6 и их ЛФ в лизосомах.
свойств различных типов и форм введения на ак-
БИОФИЗИКА том 64
№ 4
2019
682
ЗОРИНА и др.
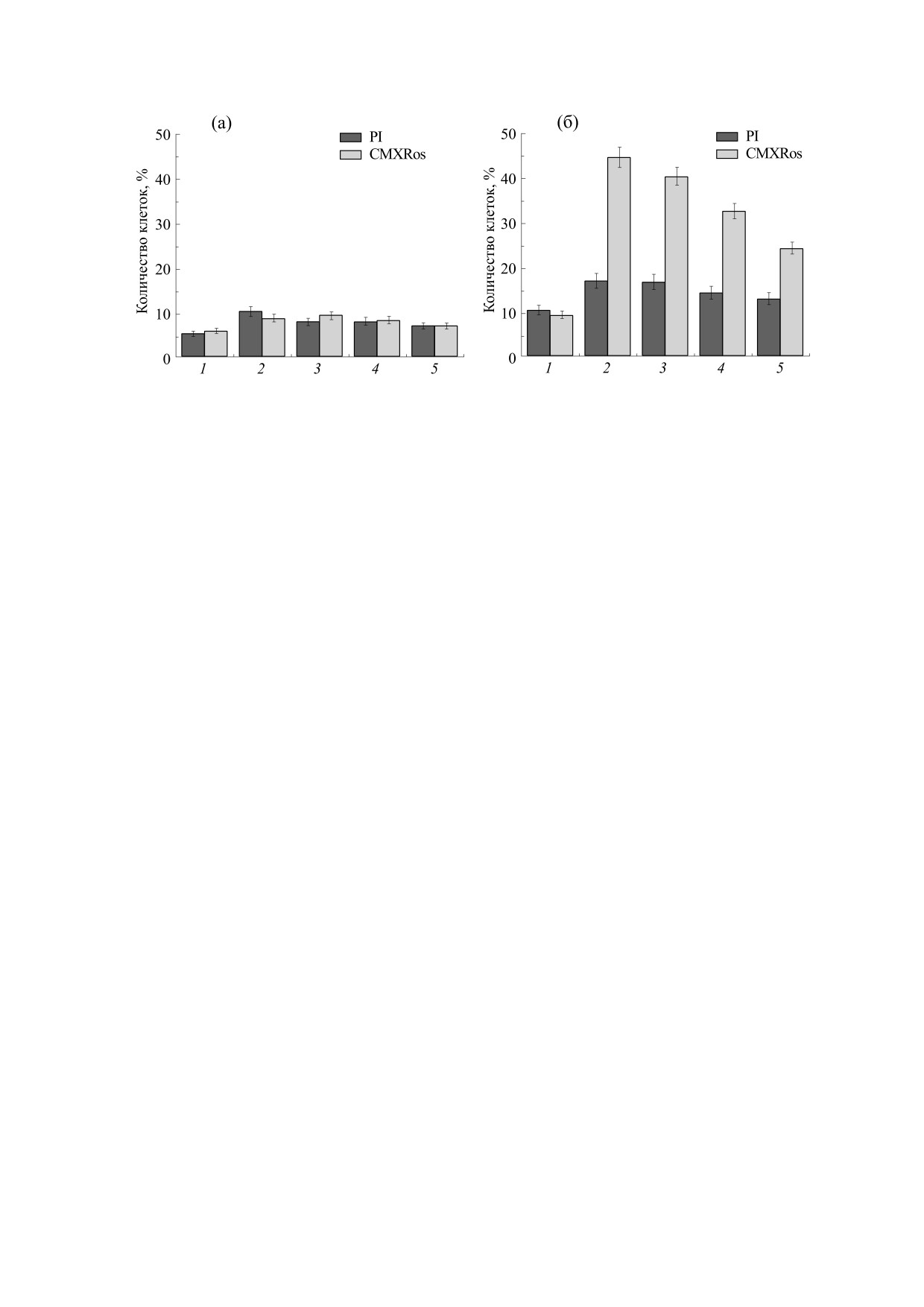
Рис. 6. Относительное содержание апоптотических (по тесту с CMXRos) и некротических (по тесту с иодидом
пропидиума) клеток при фотосенсибилизации Хл е6, ПХл е6 и их ЛФ при времени инкубирования после фотооблучения
30 мин (а) и 180 мин (б). 1 - Хл е6; 2 - ДМЭ; 3 - ДМЭ-ДМФХ; 4 - ТМЭ; 5 - ТМЭ-ДМФХ. Концентрация клеток К562 -
1 ∙ 106/мл. Общее количество клеток в образце принято за 100 %. Соотношение ДМЭ (ТМЭ) : ДМФХ = 1 : 40;
концентрация хлоринов - 2 ∙ 10-7 М; концентрация сыворотки в среде инкубирования - 2%. Доза светового
воздействия - 0,4 Дж/см2, λ = 660 нм. Представлены средние значения и ошибка среднего (M ± m) для трех независимых
экспериментов.
тивность ФС представляет значительный интерес
ло, что выход некротически измененных клеток
сравнение их способности сенсибилизировать
для ПХл е6, их ЛФ был также выше по сравнению
некротические и апоптотические повреждения
с Хл е6. Наиболее высокая эффективность фото-
клеток.
сенсибилизации апоптотических повреждений
Оценка цитотоксичности исследованных ФС
клеток наблюдалась в случае ДМЭ и его ЛФ.
и их ЛФ по МТТ-тесту показала, что при концен-
трациях хлоринов от 2·10-7 до 1·10-5М в необлу-
ченных образцах не наблюдалось изменения жиз-
ОБСУЖДЕНИЕ
неспособности клеток К562. Действие световых
Представленные в данной работе результаты
потоков с дозой от 0,5 до 2 Дж/см2 в отсутствие
показывают, что химическая модификация из-
ФС также не приводило к росту гибели клеток.
вестного фотосенсибилизатора Хл е6 посред-
Результативность фотосенсибилизированно-
ством последовательной этерификация боковых
го воздействия на клетки оценивали после фото-
облучения суспензии клеток К562, нагруженных
карбоксильных групп оказывает неоднозначное
Хл е6, ПХл е6 или их ЛФ, с использованием мето-
влияние на скорость накопления ПХл е6 в клет-
да цитофлуориметрии с СМХRos и флуоресциру-
ках. Использование ЛФ для введения этерифици-
ющим ДНК-красителем иодидом пропидиума.
рованных ПХл е6 практически не влияет на кине-
С использованием описанных выше методик
тику накопления этих ФС в клетках, в тоже время
проведено сравнение результативности фотопо-
увеличение центров связывания, при введении
вреждения клеток К562 при их сенсибилизации
ПХл е6 в составе липосом, сопровождалось сни-
хлоринами и их липосомальными формами
жением уровня накопления ФС (табл. 1). Исходя
(рис. 6). При использовании в качестве фотосен-
из полученных данных по уровню накопления в
сибилизаторов ПХл е6 и их липосомальных форм
клетках К562 исследованные ФС располагаются в
степень как некротического, так и апоптотиче-
ряду ДМЭ > ТМЭ > ЛФ ДМЭ > ЛФ ТМЭ >> Хл е6.
ского повреждения клеток К562 через 30 мин по-
Отличия в скоростях накопления ПХл е6 в клет-
сле облучения была выше по сравнению с Хл е6
(рис. 6а). После 3 ч инкубирования число апопто-
ках не связаны с влиянием процессов агрегации
тически поврежденных клеток для Хл е6 увеличи-
ФС во внеклеточной среде: с целью мономериза-
лось в 1,5 раза, для ДМЭ, ЛФ ДМЭ, ТМЭ и ЛФ
ции неполярные ФС в растворах вводили в куль-
ТМЭ - в 2,1, 2,8, 2,6 и 2,4 раза соответственно.
туральную среду с ЭСТ за 60 мин до добавления
Сравнение эффективности воздействия показа-
клеток.
БИОФИЗИКА том 64
№ 4
2019
ВНУТРИКЛЕТОЧНАЯ ЛОКАЛИЗАЦИЯ И МЕХАНИЗМЫ
683
Ранее проведенные исследования с использо-
жить, что процессы эндоцитоза не играют важной
ванием клеток лейкемической линии Raji, моно-
роли при накоплении как ПХл е6, так и их липо-
нуклеарных клеткок периферической крови до-
сомальных форм.
норов, лейкемических клеток пациентов с ост-
Способность ФС накапливаться в отдельных
рым лимфобластным лейкозом и пациентов с
клеточных структурах, наряду с режимами фото-
острым миелоидным лейкозом показали, что ос-
облучения, во многом определяет тип механизма
новными детерминантами, определяющими уро-
фотосенсибилизированного повреждения клеток
вень накопления и эффективность сенсибилиза-
[1,19].
ции повреждения клеток, являются различия
скоростей перераспределения ФС на плазматиче-
Результаты исследования сенсибилизации
скую мембрану с белков сыворотки и наноноси-
ПХл е6 клеток К562 подтверждают наличие кор-
телей, а также скорость их трансмембранного пе-
реляции между уровнем накопления ФС и отно-
реноса [13-16]. Согласно работам [14,17], при уве-
сительной эффективностью фотоповреждения
личении степени этерификации боковых групп
клеток. Процент поврежденных клеток в образ-
Хл е6 данные кинетические параметры претерпе-
цах с Хл е6 в 3,0 и 2,5 раза меньше в сравнении с
вают значительные разнонаправленные измене-
ДМЭ и ТМЭ соответственно. В образцах, содер-
ния. Процесс накопления относительно поляр-
жащих ЛФ ДМЭ и ТМЭ, процент некротически
ного Хл е6, способного быстро перераспределять-
поврежденных клеток остается неизменным в
ся с белков среды и связываться с поверхностью
пределах статистической погрешности в сравне-
клеток, ограничен крайне низкой скоростью
нии со свободными ПХл е6. Существенной осо-
трансмембранного переноса. Вследствие этого
бенностью процессов фотоповреждения клеток
флуоресценция данного ФС регистрируется в
К562 при использовании в качестве ФС Хл е6 и
первые 15-20 мин окрашивания клеток преиму-
его производных являются отличия в относитель-
щественно в составе плазматической мембраны,
ном выходе апоптотически и некротически по-
а величина интегральной флуоресценции клеток,
врежденных клеток. При использовании Хл е6 от-
инкубированных с Хл е6, значительно ниже ана-
носительное количество поврежденных клеток,
логичной характеристики для клеток, окрашен-
определяемое в тестах с иодидом пропидиума и
ных ДМЭ и ТМЭ. Основным фактором, контро-
СMXRos, одинаково. При облучении клеток в
лирующим скорость накопления ТМЭ в клетках,
присутствии ДМЭ, ТМЭ и их ЛФ процент апо-
является низкая скорость диссоциации из ком-
птотически поврежденных клеток значительно
плексов с белками среды или из липидных вези-
превышает процент числа клеток с поврежден-
кул [18]. Умеренно неполярный ДМЭ, сочетаю-
ной плазматической мембраной (некротические
щий высокую проницаемость в мембранных
изменения). Полученные в данной работе резуль-
структурах с относительно высокой диффузион-
таты о различиях механизмов фотосенсибилизи-
ной подвижностью во внеклеточной среде накап-
рованного Хл е6 и его производными поврежде-
ливается в клетках с максимальной эффективно-
стью.
ния клеток полностью согласуются с данными
анализа степени экспрессии фосфатидилсерина -
Локализация ФС в клетке является важной де-
известного маркера апоптотических клеток, на
терминантой в определении эффективности ме-
внешней поверхности плазматической мембра-
ханизмов повреждения клетки. Использование
ны. Как показано в работе [17], фотосенсибили-
колокализаторов для различных клеточных орга-
зированное ПХл е6 воздействие на культуру лей-
нелл позволило провести оценку внутриклеточ-
кемических клеток пациентов с острым лимфоб-
ного распределению ПХл е6. Полученные значе-
ластным лейкозом приводило к увеличению в
ния коэффициентов корреляции Пирсона между
2,5-4,0 раза числа Annexin V - положительного
флуоресценцией ДМЭ, ТМЭ, ЛФ ПХл е6 и свече-
пула клеток по сравнению с Хл е6.
нием митохондриального зонда, а также колока-
лизаторов эндоплазматического ретикулума и ап-
Отличия в клеточных механизмах фотоцито-
парата Гольджи свидетельствуют о преимуще-
токсичности Хл е6 и его производных не связаны
ственной локализации ФС и их ЛФ в этих
с различной интенсивностью фотосенсибилизи-
компартментах клетки. Проведенные исследова-
рованного воздействия на клетки вследствие от-
ния с лизосомальным зондом показали низкий
личий количества накопленных ими фотосенси-
уровень корреляции между флуоресценцией ли-
билизаторов. При уменьшении в 3-10 раз кон-
зосомальных зондов и флуоресценцией ПХл е6 и
центрации ДМЭ и ТМЭ в клеточных суспензиях
их ЛФ. На основании этого можно предполо-
фотоповреждения клеток протекают преимуще-
БИОФИЗИКА том 64
№ 4
2019
684
ЗОРИНА и др.
ственно по механизму апоптоза (данные не при-
Работа выполнена при финансовой поддержке
ведены).
Белорусского республиканского фонда фунда-
ментальных исследований, проект № Б17-106.
Следует отметить, что основные фотофизиче-
ские характеристики всех исследованных соеди-
нений в мономерной форме, в том числе при
СПИСОК ЛИТЕРАТУРЫ
включении их в липосомы, практически совпада-
1.
Y. Li, Y. Yu, L. Kang, and Y. Lu, Int. J. Clin. Exp. Med.
ют. В выбранных условиях экспериментов для
7 (12), 4867 (2014).
Хл е6 и его производных практически отсутству-
2.
А. А. Красновский мл., в кн.
«Проблемы
ют различия в генерации синглетного кислорода,
регуляции в биологических системах», под ред.
основного интермедиатора фотохимических по-
А. Б. Рубина (М.-Ижевск, 2006), cc. 223-244.
вреждений в клетках [12,14]. Можно предполо-
жить, что различия в механизмах повреждения
3.
M. H. Teiten, L. Bezdetnaya, P. Morliere, et al., Brit. J.
обусловлены особенностями внутриклеточной
Cancer 88, 146 (2003).
локализации и, как следствие, различиями в ми-
4.
H. Abrahamse, M. R. Hamblin, Biochem. J. 473, 4,
шенях фотосенсибилизированного действия ис-
347 (2016).
следуемых ФС в клетках. В этой связи следует об-
5.
V. P. Zorin, V. P. Savitskiy, and M. P. Potapnev, Exper-
ратить внимание на отличия в локализации Хл е6
iment. Oncol. 24, 142 (2002).
и его производных в митохондриях клетки. Ряд
экспериментальных данных свидетельствует, что
6.
Т. Е. Зорина, А. А. Далидович, Л. Н. Марченко и
сенсибилизированное фотовоздействие на мито-
др., Офтальмология. Восточная Европа
4,
93
хондрии клеток активизирует преимущественно
(2011).
апоптотические пути их гибели [15,20]. Повы-
7.
M. K. Riaz, M. A. Riaz, X. Zhang, et al, Int. J. Mol.
шенное сродство ПХл е6 к митохондриям при бо-
Sci. 19, 195 (2018).
лее высоком общем уровне накопления в клетках
8.
L. A. S. Abu and T. Ishida, Biol. Pharm. Bull. 40, 1
обеспечивает значительно более высокую интен-
(2017).
сивность (степень) сенсибилизированного воз-
действия на эти органеллы и, как следствие, пре-
9.
H. Fischer and H. Orth, Die chemie des pyrrolis (Acad.
имущественную гибель клеток по механизму апо-
Verlag, 1937).
птоза.
10.
R. Taylor, J. Liagn. Med. Sonogr. 6, 35 (1990).
ЗАКЛЮЧЕНИЕ
11.
А. П. Шпакова, К. С. Палова и Т. И. Булычева,
Иммунология 2, 20 (2000).
1. Физико-химические свойства ФС и фарма-
кологические формы их введения определяют
12.
Т. Е. Зорина, И. В. Янковский, И. Е. Кравченко и
уровень и кинетику накопления ФС в клетках.
др., Биофизика 60, 922 (2015).
2. Липосомальные формы позволяют предот-
13.
V. P. Zorin., I. I. Khludeyev, T. E. Zorina, et al., Proc.
вратить агрегацию хлоринов и не приводят к сни-
SPIE. Lazer Use in Oncology II. 4059, 139 (2000).
жению их фотосенсибилизирующей активности.
14.
В. П. Зорин, И. И. Хлудеев и Т. Е. Зорина,
3. Этерифицированные производные хлорина е6 -
Биофизика 45, 313 (2000).
ДМЭ и ТМЭ и их ЛФ преимущественно локализу-
15.
E. Bastein, R. Schneider, S. Hackbarth, et al., Photo-
ются в эндоплазматическом ретикулуме клетки и
chem. Photobiol. Sci. 14, 2203 (2015).
комплексе Гольджи, а также имеют умеренную ло-
кализацию в митохондриях. Установлено более низ-
16.
В. П. Савицкий, В. П. Зорин, М. П. Потапнев и
кое значение ККП для митохондриального зонда и
А. Я. Потапенко, Бюл. эксперим. биологии и
Хл е6 по сравнению с его производными и их ЛФ. В
медицины 138 (8), 180 (2004).
лизосомах отмечен низкий уровень локализации
17.
В. П. Савицкий. Автореферат дис. … канд. биол.
для Хл е6, его производных и их ЛФ.
наук (РНПЦ детской онкологии,гематологии и
4. Различия в механизмах повреждения клеток
иммунологии, Минск, 2008).
Хл е6, его производными и их ЛФ определяются
18.
В. П. Зорин, И. C. Михаловский, Т. Е. Зорина и
различной векторизацией (направленностью)
др., Биофизика 40, 328 (1995).
сенсибилизированного действия исследуемых
ФС в клетках К562: более высокая апоптотиче-
19.
I. O. Basselar, T. M. Tsubone, C. Pavani, and
ская активность ПХл е6 и их ЛФ, по сравнению с
M. S. Baptista, Int. J. Mol. Sci. 16, 20523 (2015).
Хл е6, обусловлена различиями в уровне накопле-
20. J. Wu, Q. Xiao, Na Zhang, et al., Phtodiagnosis and
ния в митохондриях клетки.
Photodynamic Therapy 15 (2016).
БИОФИЗИКА том 64
№ 4
2019
ВНУТРИКЛЕТОЧНАЯ ЛОКАЛИЗАЦИЯ И МЕХАНИЗМЫ
685
Intracellular Localization and Mechanisms of Phototoxicity of Chlorin E6 Derivatives
and Their Liposomal Formulations
T.E. Zorina*, I.V. Yankovsky*, I.V. Yakovets*, I.E. Kravchenko*, T.I. Ermilova**, T.V. Shman**,
M.V. Belevtsev**, and V.P. Zorin*
*Belarusian State University, prosp. Nezavisimosti 4, Minsk, 220030 Republic of Belarus
**Belarusian Research Center of Pediatric Oncology, Hematology and Immunology,
Frunzenskaya ul. 43, Borovlyany, Minsk Region, 223053 Republic of Belarus
Сonfocal microscopy and colocalization analysis with Pearson correlation coefficients were used to show that
esterified chlorin e6 derivatives and their liposomal forms are mainly localized in the endoplasmic reticulum,
Golgi complex, cell mitochondria and levels of their localization in lysosomes are low. Routes of photosen-
sitizer administration in pharmacology strongly affect the level and kinetics of photosensitizer accumulation
in cells, but do not have a considerable effect on intracellular localization of chlorin e6 derivatives. Differences
in the photodynamic activity and sensitization mechanisms for chlorin e6 derivatives and their liposomal
forms were shown when compared to those of chlorine e6 photosensitizers in K562 cells. It is assumed that
observed differences in the mechanisms of cellular damage are to a greater extent due to specific photosensi-
tizer localization.
Keywords: chlorin e6 derivatives, liposomal formulations, intracellular localization, cytotoxicity, apoptosis
БИОФИЗИКА том 64
№ 4
2019