БИОФИЗИКА, 2019, том 64, № 4, с. 686-695
БИОФИЗИКА КЛЕТКИ
УДК 76.03.31,616-092.9 616-03, 616-091.8,577.125.8,57.017.3
АНТИОКСИДАНТНАЯ И МЕМБРАННАЯ АКТИВНОСТЬ
БЕНЗОТРОПАЛОНОВОГО ПИГМЕНТА ПУРПУРОГАЛЛИНА
© 2019 г. А.М. Попов* **, А.Н. Осипов***, Е.А. Корепанова***, А.А. Климович*,
О.Н. Стышова*, А.А. Артюков*
*Тихоокеанский институт биоорганической химии им. Г.Б. Елякова ДВО РАН,
690022, Владивосток, просп. 100 лет Владивостоку, 15
E-mail: popovam@piboc.dvo.ru
**Дальневосточный федеральный университет, 690000, Владивосток, ул. Октябрьская, 27
***Российский государственный медицинский университет имени Н.И. Пирогова Минздрава РФ,
117997, Москва, ул. Островитянова, 1
E-mail: osipov@fbm.msu.ru
Поступила в редакцию 07.12.2017 г.
После доработки 24.01.2019 г.
Принята к публикации 01.04.2019 г.
Фенольное соединение пурпурогаллин, обнаруженное в дубовых орешках, представляет собой
красный пигмент с бензотропалоновой кольцевой структурой. Пурпурогаллин обладает выражен-
ной цитопротективной и противовоспалительной активностью. Предполагают, что пурпурогаллин
может стать эффективным средством профилактики и лечения различных системных воспалитель-
ных заболеваний, оказывая влияние на функциональную активность различных клеточных метабо-
лических и сигнальных путей, связанных с воспалением. В данной работе мы провели сравнитель-
ное исследование антиоксидантных (свободнорадикальных) свойств пурпурогаллина с использова-
нием двух тест-систем:
«гемоглобин-Н2О2-люминол» и
«2,2'-азобис(2-метилпропион-
амидин)дигидрохлорид-люминол» в сравнении с дигидрокверцетином, аскорбиновой кислотой и
тролоксом, а также оценили его влияние на проницаемость плоских липидных бислойных мембран.
Было показано, что пурпурогаллин обнаруживает умеренную антиоксидантную активность в систе-
ме гемоглобин-Н2О2-люминол, проявляя нейтрализующую способность в отношении гидроки-
сил- и суперокид-анионов, сравнимую с аскорбиновой кислотой. Изученные нами соединения в
этой системе могут быть ранжированы в соответствии с эффективностью их антиоксидантного дей-
ствия: дигидрокверцетин > тролокс > аскорбиновая кислота > пурпурогаллин. Интересно, что в те-
стах на антиоксидантную активность в системе «2,2'-азобис(2-метилпропионамидин)дигидрохло-
рид-люминол» пурпурогаллин не проявил нейтрализующей активности в отношении пероксиль-
ных радикалов, образующихся в этой системе. Пурпурогаллин не вызывает значительных
изменений в проницаемости плоских модельных липидных мембран в диапазоне доз от 1,5 до 30
мкМ, что указывает на практическоe отсутствие у него первичного мембрантропного эффекта. Об-
суждаются предполагаемые механизмы и особенности цитопротекторной, антиоксидантной и про-
тивовоспалительной активности пурпурогаллина.
Ключевые слова: пурпурогаллин, природные полифенолы, антиоксиданты, активные виды кислорода,
противовоспалительная активность, цитопротекторы.
DOI: 10.1134/S0006302919040069
ские и сигнальные пути трансдукции, конроли-
Пурпурогаллин (ППГ) - это красный пигмент
рующие, главным образом, противовоспалитель-
с бензотропалоновой кольцевой структурой
ную активность клетки [1].
(рис. 1), который обладает широким спектром
биологической активности, воздействуя на раз-
Противовоспалительные свойства ППГ ярко
личные целевые рецепторы, а также метаболиче- продемонстрировал при ингибировании гипер-
проницаемости эндотелиальных клеток, адгезии
и миграции моноцитов, вызванных воздействием
Сокращения: ППГ - пурпурогаллин, NF-kB - ядерный липополисахарида. При этом ППГ подавляет
фактор-κB, TNF-α - фактор некроза опухоли-α, ДГК -
опосредованное липополисахаридом освобожде-
дигидрокверцетин, ААРН - 2,2’-азобис(2-метилпропион-
амидин)дигидрохлорид, Нb - гемоглобин, ЛМ - люми-
ние провосполительного ядерного фактора-κB
нол, БЛМ - бислойные липидные мембраны.
(NF-κB) и фактор некроза опухоли-α (TNF-α) из
686
АНТИОКСИДАНТНАЯ И МЕМБРАННАЯ АКТИВНОСТЬ
687
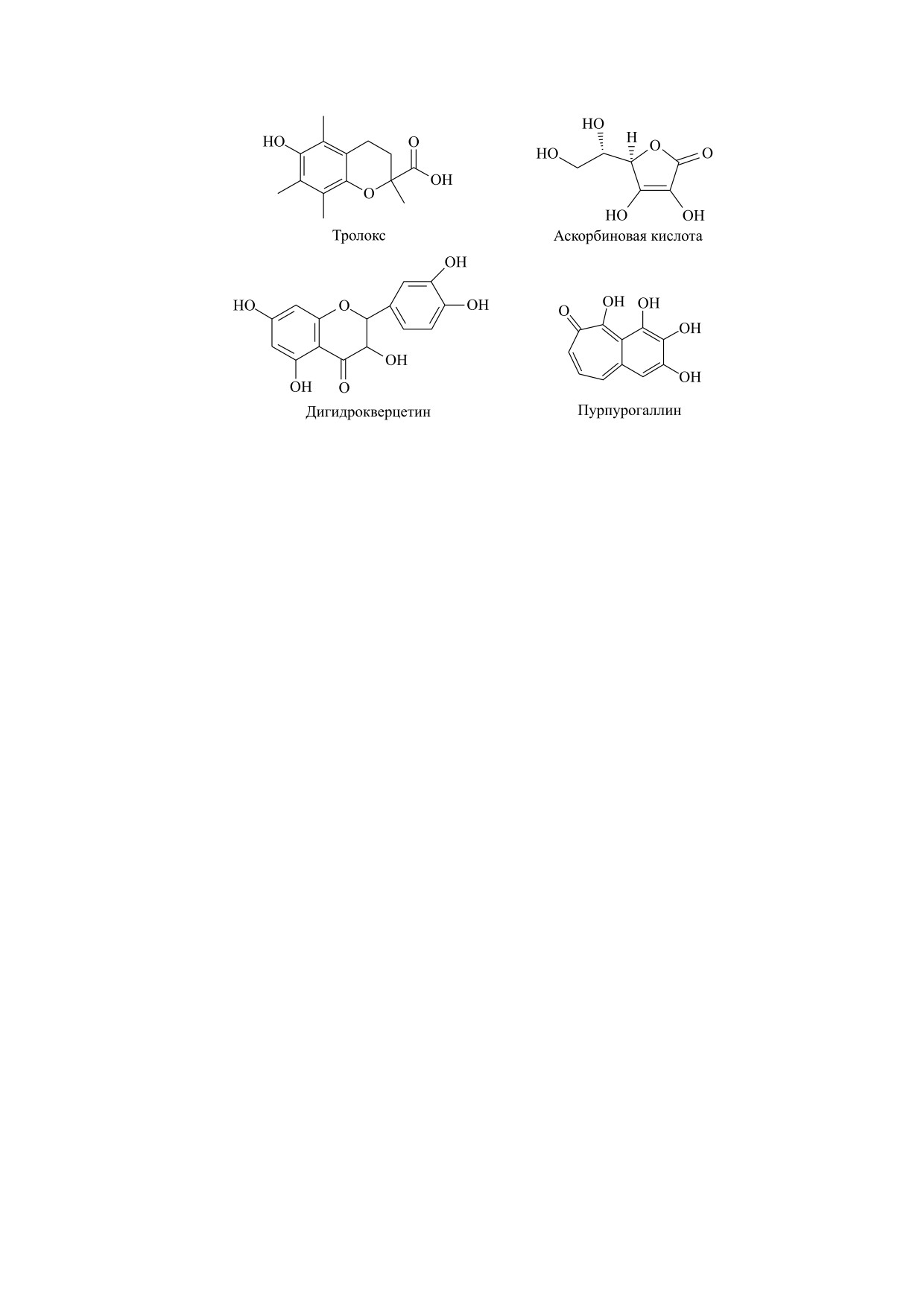
Рис. 1. Структурные формулы исследуемых веществ.
эндотелиальных клеток пупочной вены человека.
ном стрессе, вызванном действием супероксид-
Отмеченные эффекты в значительной степени
анионов, продуцируемых ксантиноксидазой и
коррелируют с ингибирующим действием ППГ
гипоксантином, на выживаемость различных ви-
на биосинтез молекул адгезии, опосредованный
дов клеток (гепатоциты, миоциты желудочков,
предварительным провоспалительным действием
эндотелиальные клетки аорты крыс и почек) [5-
липополисахарида [2].
7]. Он также защищает человеческие эритроциты
от лизиса, вызываемого пероксильными радика-
ППГ значительно ингибирует избыточную
лами [8].
продукцию NO и простагландина PGE2 в микро-
глиальных клетках, вызванную введением липо-
Важно подчеркнуть, высокую ингибирующую
полисахарида, что связывают с повышенной фер-
активность ППГ в отношении различных фермен-
ментативной активностью NO-синтазы и цикло-
тов, например ксантиноксидазы (IC50 = 0,2 мкМ),
оксигеназы 2 соответственно. Он также ослабляет
которая представляет собой флавопротеин желе-
синтез провоспалительных цитокинов, включая
зомолибдена, содержащий 2Fe-2S-кластер. Этот
интерлейкин-1 и TNF-α, подавляя экспрессию
кластер опосредует транспорт электронов в пре-
мРНК этих белков. Молекулярные механизмы,
делах ксантиноксидазы, синтезирующей токсич-
лежащие в основе ослабления воспаления, опо-
ные супероксид-анионы. Характерно, что актив-
средованного ППГ, тесно коррелируют с подав-
ность ППГ была выше, чем у пирогаллола - се-
лением транслокации белковой субъединицы p65
лективного ингибитора этого фермента,
NF-κB в ядро и с деградацией его ингибитора
обнаруженного в обжаренном кофе. При этом
(IκB). Кроме того, ППГ обладает противовоспа-
пирогаллол нестабилен и при физиологических
лительными свойствами, подавляя сигнальные
условиях легко превращается в пурпурогаллин.
пути фосфатидилинозитол-3-киназы/Akt и мито-
Ингибирующая активность ППГ в отношении
ген-активированной протеинкиназы, и, тем са-
ксантиноксидазы была в восемь раз выше, чем у
мым, оказывает выраженный нейропротектор-
пирогаллола (1,6 мкмоль/л). Молекулярное моде-
ный эффект в активированной микроглии [3].
лирование путем докирования показывает, что
ППГ обладает высокой протективной актив-
ППГ имеет более сильное сродство к ксантинок-
ностью при воспалении сосудов, вызванном суб-
сидазе, чем соответствующие пирогаллолы [9].
арахноидальным кровоизлиянием. ППГ дозави-
Можно заключить, что ППГ, активно действую-
симо снижает экспрессию генов цитокинового
щий в качестве ингибитора ксантиноксидазы, яв-
медиатора HMGB1, TNF-α и интерлейкина-6,
ляется эффективным природным цитопротек-
принимающих активное участие в сосудистом
тором.
воспалении [4]. Следовательно, ПГГ можно рас-
Тропоны, к которым относится ППГ, образу-
сматривать как кандидата в терапевтические
ют хелатные комплексы с ионами металлов.
агенты при различных системных воспалитель-
Вполне вероятно, что отмеченные выше фарма-
ных заболеваниях.
кологические эффекты частично базируются на
Особого внимания заслуживают данные о ци-
присущим ППГ хелатирующим свойствам. Так,
топротективном действии ППГ при окислитель-
защитные свойства ППГ против токсического
БИОФИЗИКА том 64
№ 4
2019
688
ПОПОВ и др.
действия перекиси водорода, вызывающей по-
мых концентраций фосфатным буферным рас-
вреждения в ДНК и апоптоз в культуре Т-клеток
твором. Концентрация диметилсульфоксида в
человека, связаны с образованием редокс-неак-
инкубационной среде не превышала 1% и не ока-
тивного комплекса с ионами железа [10].
зывала влияние на результаты измерений. Тро-
локс и дигидрокверцетин сначала растворяли в
Важным представляется также тот факт, что
этаноле в концентрации 10 мМ, а затем получен-
ПГГ способен ингибировать синтез ДНК некото-
ный раствор разводили фосфатным буфером до
рых опухолевых клеток, т. е. является перспек-
концентрации 100 мкМ и использовали в работе.
тивным профилактическим противоопухолевым
Все растворы готовили непосредственно перед
средством [8,11]. Этот бензотропалон находится
экспериментом.
на ранней стадии клинических исследований
как специфический ингибитор поло-подобных
Антиоксидантные свойства ППГ изучали с по-
серин-треониновых киназ (Plks), которые регу-
мощью двух хемилюминесцентных модельных
лируют некоторые важные внутриклеточные
систем окисления - гомогенной системы, состо-
процессы, включающие репликацию ДНК и ми-
ящей из гемоглобина, пероксида водорода и лю-
тоз. Plk1 - наиболее хорошо изученный член это-
минола (Нb-Н2О2-ЛМ) и гомогенной системы,
го семейства, который контролирует многочис-
представляющей собой раствор азосоединения
ленные этапы митоза, его повышенная экспрес-
2,2'-азобис(2-метилпропионамидин)дигидрохло-
сия наблюдается при многих видах раковых
рида и люминола (ААРН-ЛМ) [19].
заболеваний. В настоящее время проходят кли-
Хемилюминесцентные измерения проводили
нические исследования потенциальные противо-
с помощью хемилюминометра ХЛМ-3 («Бикап»,
опухолевые препараты: воласертиб - селектив-
Россия). Кинетику хемилюминесценции реги-
ный ингибитор Plk1, используемый при острой
стрировали и обрабатывали с помощью интер-
миелоидной лейкемии, и ригосертиб - двойной
фейса MacLab/2e (ADInstruments, Австралия),
ингибитор сигнальных путей Plk1/фосфоинози-
связанного с компьютером Macintosh LC II.
тид-3-киназы, применяемый при миелодиспла-
зии [12-14].
В данных исследованиях тролокс был исполь-
Интересно, что ПГГ обладает антитромботи-
зован в качестве эталонного антиоксиданта
ческой активностью и может рассматриваться как
(рис. 1а), а аскорбиновая кислота и дигидроквер-
антикоагулянт мягкого типа действия [15]. Одна-
цетин соответственно взяты в качестве известных
ко механизмы отмеченных выше биологических
стандартных антиоксидантов (рис. 1б, 1в).
активностей ППГ изучены недостаточно.
Для измерения хемилюминесценции, сопро-
Учитывая широкий спектр биологической ак-
вождающей окисление ЛМ в системе Нb-Н2О2-
тивности ППГ, упомянутый выше, и его фарма-
ЛМ, в кювету хемилюминометра последователь-
кологические перспективы в качестве потенци-
но добавляли фосфатный буфер (50 мМ KH2PO4,
ального противовоспалительного и цитопротек-
100 мкМ ЭДТА, pH 7,4) до конечного объема 5 мл,
тивного средства, целью данной работы явилось
0,3 мкМ Нb, 30 мкМ ЛМ и определенный объем
изучение антиоксидантных (свободнорадикаль-
исследуемого объекта. Инициирование окисле-
ных) свойств ППГ в двух системах, а именно: ге-
ния ЛМ осуществляли введением 90 мкМ перок-
моглобин-H2O2-люминол и 2,2 (2-метилпропи-
сида водорода. Исследуемые вещества добавляли
онамидин)дигидрохлорид-люминол в сравне-
перед введением Н2О2 [19,20].
нии с тролоксом, аскорбиновой кислотой и
дигидрокверцетином (ДГК), а также оценка его
Антиоксидантную активность ППГ и других
мембраннотропной активности с использовани-
препаратов в системе ААРН-люминол также
ем модельных липидных мембран.
определяли по окислению ЛМ, инициированно-
му пероксильными радикалами (RO2·), генериру-
емыми с постоянной скоростью, зависящей от
МАТЕРИАЛЫ И МЕТОДЫ
температуры, водорастворимым азосоединением
В работе использовали пурпурогаллин, полу-
ААРН [11, 12]. Среда инкубации объемом 5 мл со-
ченный в лабоpатоpии биотеxнологии ТИБОX
держала: 5 мМ ААРН и 10 мкМ ЛМ в фосфатном
ДВО PАН, cоглаcно описанной раннее процедуре
буфере (50 мМ КН2РО4, 100 мкМ ЭДТА, рН 7,4).
[16]. Также были иcпользованы: 2,2'-азобис(2-ме-
Измерение хемилюминесценции проводили сле-
тилпропионамидин)дигидрохлорид (ААРН), ге-
дующим образом. В среду инкубации, содержа-
моглобин (Нb), которые были поставлены компа-
щую ЛМ в фосфатном буфере, при постоянном
нией Sigma-Aldrich (США), люминол (ЛМ), тро-
перемешивании и температуре
37ºС вводили
локс (Fluka, Швейцария); дигидрокверцетин
ААРН и измеряли контрольную хемилюмино-
(ОАО «Диод», Россия); KH2PO4, KOH, диметил-
грамму. Далее измеряли кинетику хемилюминес-
сульфоксид («Химмед», Россия).
ценции в присутствии исследуемых веществ, ко-
ППГ растворяли в минимальном объеме диме-
торые добавляли в среду инкубации перед вводом
тилсульфоксида, а затем доводили до исследуе-
ААРН.
БИОФИЗИКА том 64
№ 4
2019
АНТИОКСИДАНТНАЯ И МЕМБРАННАЯ АКТИВНОСТЬ
689
На полученных кинетических кривых опреде-
107 до
109 Ом, что обеспечивало большую точ-
ляли длительность латентного периода, которую
ность измерения. Стандартное измерительное
рассчитывали как время от момента введения
напряжение равнялось 50 мВ. Величину электро-
ААРН до начала развития свечения. Далее нахо-
проводности рассчитывали по следующей фор-
дили значения латентного периода в контроле (t0)
муле:
и для различных концентраций тролокса, дигид-
U -U′
1
рокверцитина, аскорбиновой кислоты и ППГ (t).
G
=
×
[
См
]
,
(5)
м
эт
U′ R
После этого проводили построение калибро-
вочной зависимости латентного периода от кон-
где Gм - электропроводность мембраны; U - на-
центрации тролокса по следующему линейному
пряжение, подаваемое от потенциометра; U' - на-
уравнению:
пряжение на выходе; Rэт - эталонное сопротив-
t/t0 = 1 + KT · CT,
(1)
ление. При построении графиков использовали
значение удельной электропроводности Gм/Sм
где t/t0 - изменение латентного периода; KT -
[Ом-1·см-2 См·см-2], где Gм - интегральная про-
константа изменения латентного периода для
тролокса; CT - концентрация тролокса.
водимость мембраны, Sм - площадь мембраны.
Затем аналогичную зависимость находили для
Измерение электропроводности БЛМ прово-
исследуемого препарата:
дили в растворе незабуференного 0,1 М водного
раствора хлорида калия при комнатной темпера-
t/t0 = 1 + KX · CX,
(2)
туре. Концентрация соли по обе стороны от мем-
где t/t0 - изменение латентного периода хемилю-
браны была одинаковой. ППГ растворяли в воде.
минесценции; KX - константа изменения латент-
Для математической обработки эксперимен-
ного периода для исследуемого вещества; CX -
тального материала использовали программу Mi-
концентрация исследуемого вещества.
crosoft Excel 7.0 с применением методов вариаци-
онной статистики и вычислением средней ариф-
Все исследованные препараты демонстриро-
метической величины (М), среднего квад-
вали хорошую линейную зависимость согласно
ратичного отклонения (С), ошибки средней
полученному уравнению (2) (коэффициент ли-
арифметической (m) и t-критерия Стьюдента. До-
нейной корреляции 0,98-0,99). В этом случае
стоверными считались результаты при р < 0,05.
можно записать:
KX · CX = KT·CT.
(3)
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Используя уравнение (3) и рассчитанные по
линейным уравнениям значения констант KX и
Для исследования антиоксидантной активно-
сти ППГ мы использовали два теста - систему
KT, определяли величину антиоксидантной ак-
Hb-H2O2 и систему, содержащую азоинициато-
тивности препарата как отношение концентра-
ры (нестабильные соединения, спонтанно разру-
ции тролокса к концентрации исследуемого пре-
шающиеся с образованием свободных радика-
парата в модельной системе:
лов). Количественной мерой антиоксидантной
AOA = CT/CX = KX/KT.
(4)
активности является длительность периода, в те-
чение котоpого XЛ была cнижена в pезультате
Чем больше величина антиоксидантной ак-
пpиcутcтвия антиокcиданта в pеакционной cpеде.
тивности у исследуемого препарата, тем эффек-
Необxодимоcть иcпользования двуx экcпеpимен-
тивнее он перехватывает радикалы-инициаторы в
тальныx подxодов - cиcтемы Нb-Н2О2 и cиcте-
данной модельной системе.
мы, cодеpжащей азоинициатоpы, была пpодикто-
Действие ППГ на электрическую проводи-
вана желанием иccледовать pадикал-пеpеxваты-
мость плоских бислойных липидных мембран
вающую активноcть иccледованныx cоединений
(БЛМ) оценивали традиционно по методу Мюл-
в отношении двуx типов pадикалов - гидpокcил-
лера и соавторов путем впрыскивания мембран-
анионов, обpазующиxcя в cиcтеме Нb-Н2О2, и
ного раствора в область отверстия площадью
алкилпеpекиcныx pадикалов, обpазующиxcя в
∼1 мм2 в стенке фторопластовой кюветы. Для
cиcтеме, котоpая cодеpжит азоинициатоpы. Ко-
формирования БЛМ использовали раствор азо-
личественная мера антиоксидантной активности
лектина в декане (25÷30 мг/мл). Процесс образо-
представляет собой продолжительность периода,
вания липидного бислоя наблюдали в отражен-
в течение которого хемилюминесценция снижа-
ном свете при помощи бинокулярного микроско-
лась в результате присутствия антиоксиданта в
па МБС-1. Измерение электропроводности БЛМ
реакционной среде, то есть продолжительности
проводили методом сравнения падения напряже-
периода запаздывания [17,18].
ния на эталонном сопротивлении и суммарном
сопротивлении эталона и БЛМ. Входной регистр
Как было показано раннее [17,18], при реги-
электрометра содержал набор сопротивлений от
страции кинетики хемилюминесценции в мо-
БИОФИЗИКА том 64
№ 4
2019
690
ПОПОВ и др.
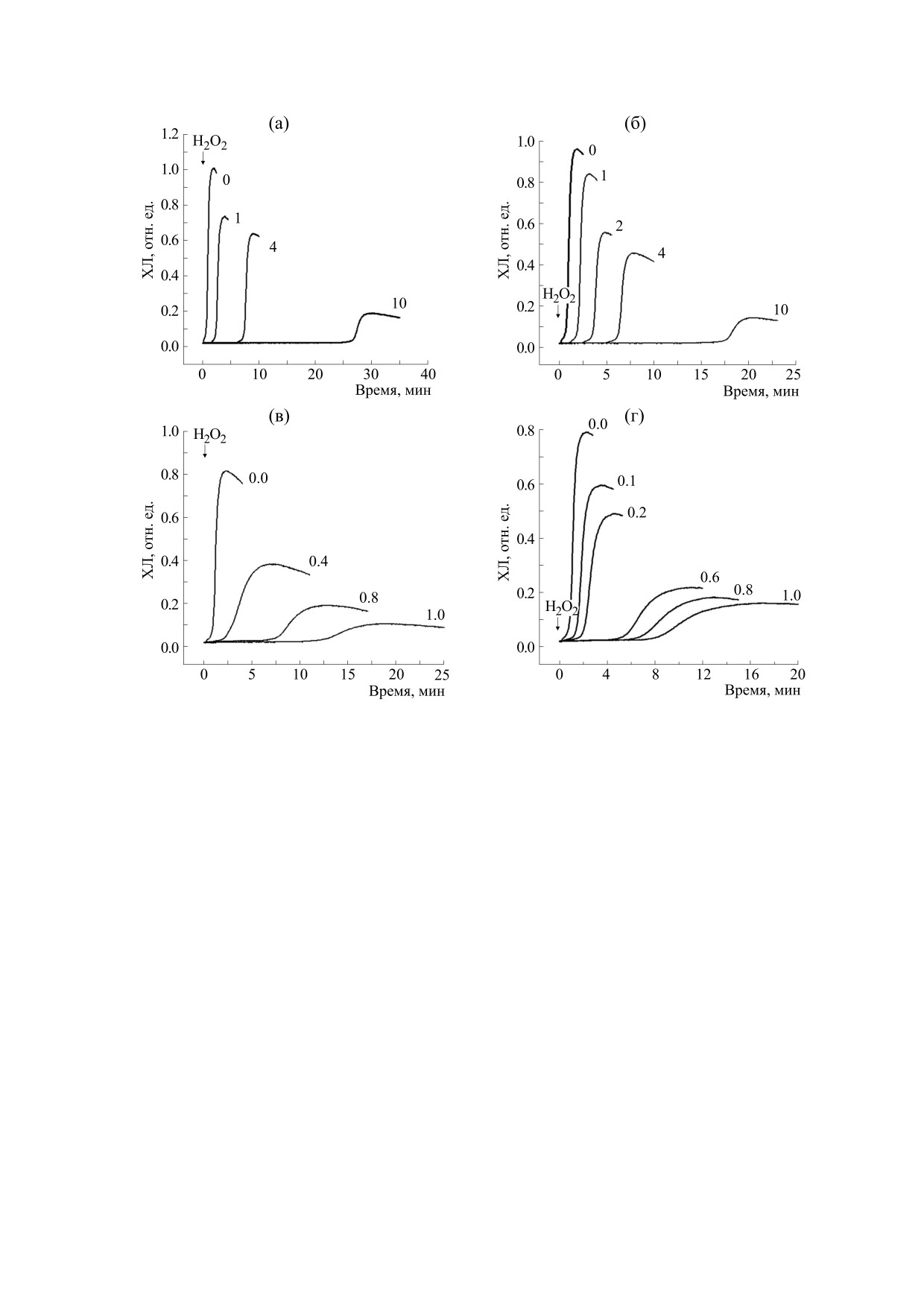
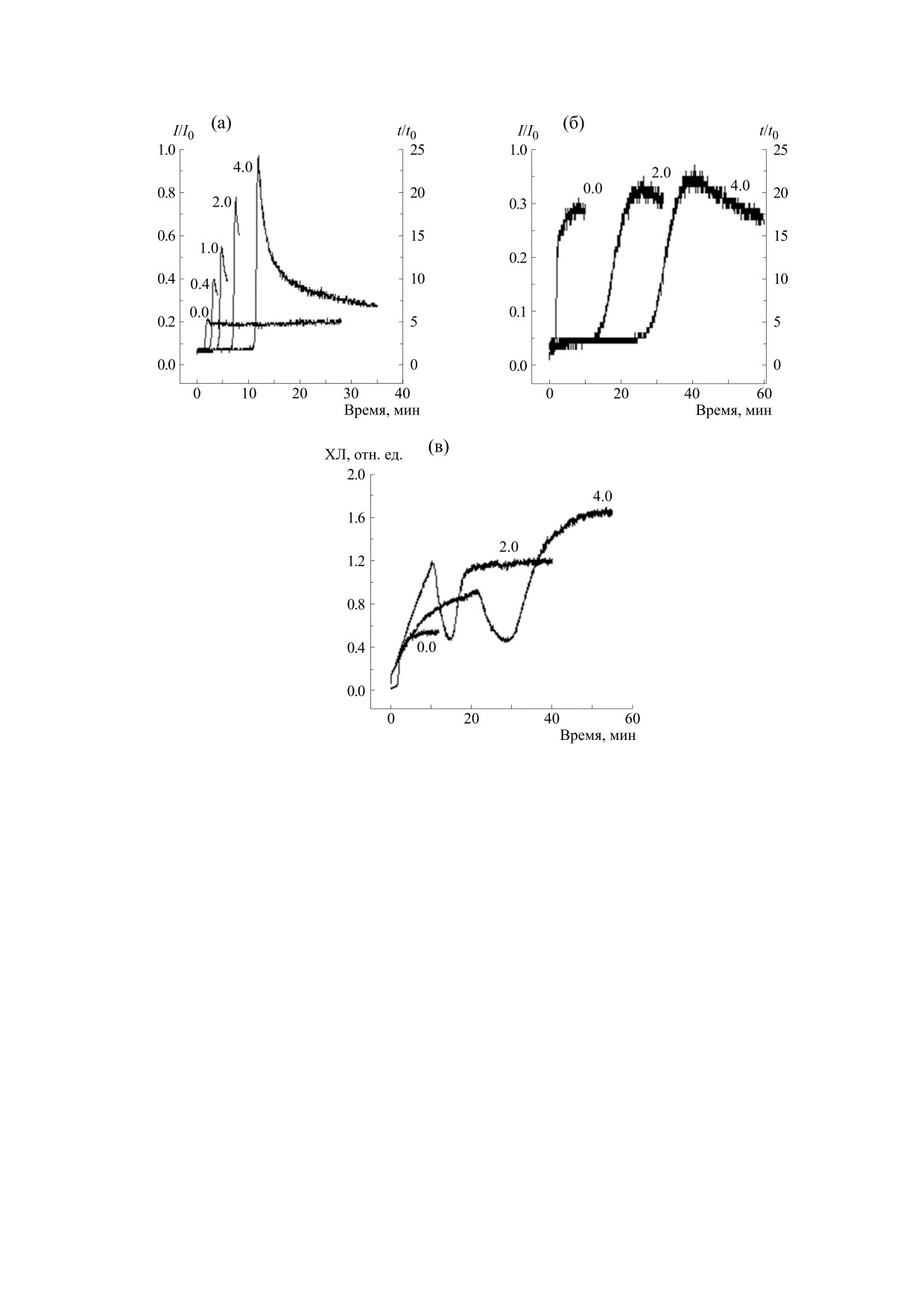
Рис. 2. Кинетики xемилюминеcценции cиcтемы Hb-H2O2-ЛМ в пpиcутcтвии тpолокcа (а), аcкоpбиновой киcлоты
(б), дигидpоквеpцетина (в) и пурпурогаллина (г). Цифpы у кpивыx - концентpация тpолокcа, аcкоpбиновой киcлоты
и дигидpоквеpцетина в мкМ, пурпурогаллина в мкг/мл. По оcи абcциcc - вpемя, по оcи оpдинат - интенcивноcть
xемилюминеcценции.
дельной системе Hb-H2O2-ЛМ без исследуемых
увеличивает латентный период, но не в одинако-
препаратов (контроль) примерно через 1 мин по-
вой степени.
сле добавления H2O2 в реакционную среду, со-
На рис. 3 представлены расчетные данные о
держащую гемоглобин и ЛМ, развивается свече-
влиянии тролокcа, аскорбиновой кислоты, ди-
ние хемилюминесценции, которое достигает пре-
гидpоквеpцетина и пурпурогаллина на амплитуду
дельных значений на третьей минуте и далее
и латентный период хемилюминесценции в мо-
постепенно уменьшается.
дельной системе Hb-H2O2-ЛМ [18].
На рис. 2 представлена кинетика хемилюми-
несценции системы Hb-H2O2-ЛМ без исследуе-
Инициатор окисления в данной модельной
системе предположительно появляется в виде
мых веществ и в присутствии тpолокcа, аcкоpби-
феррильных радикалов Hb или гидроксильных
новой киcлоты, дигидpоквеpцетина и пурпуро-
радикалов, образующихся при взаимодействии
галлина.
Hb и перекиси водорода. Окисление ЛМ сопро-
В качестве измеряемых параметров были вы-
вождается образованием радикала ЛМ и в конеч-
браны максимальная интенсивность свечения
ном итоге приводит к образованию возбужденно-
(амплитуда хемилюминесценции) и время с мо-
го продукта окисления, который переходит в ос-
мента введения H2O2 в начале развития свечения
новное состояние с испусканием кванта
(латентный период). Введение в среду различных
хемилюминесцентного света. Количество изоли-
доз исследуемых веществ изменяет амплитуду и
рованных квантов света пропорционально коли-
БИОФИЗИКА том 64
№ 4
2019
АНТИОКСИДАНТНАЯ И МЕМБРАННАЯ АКТИВНОСТЬ
691
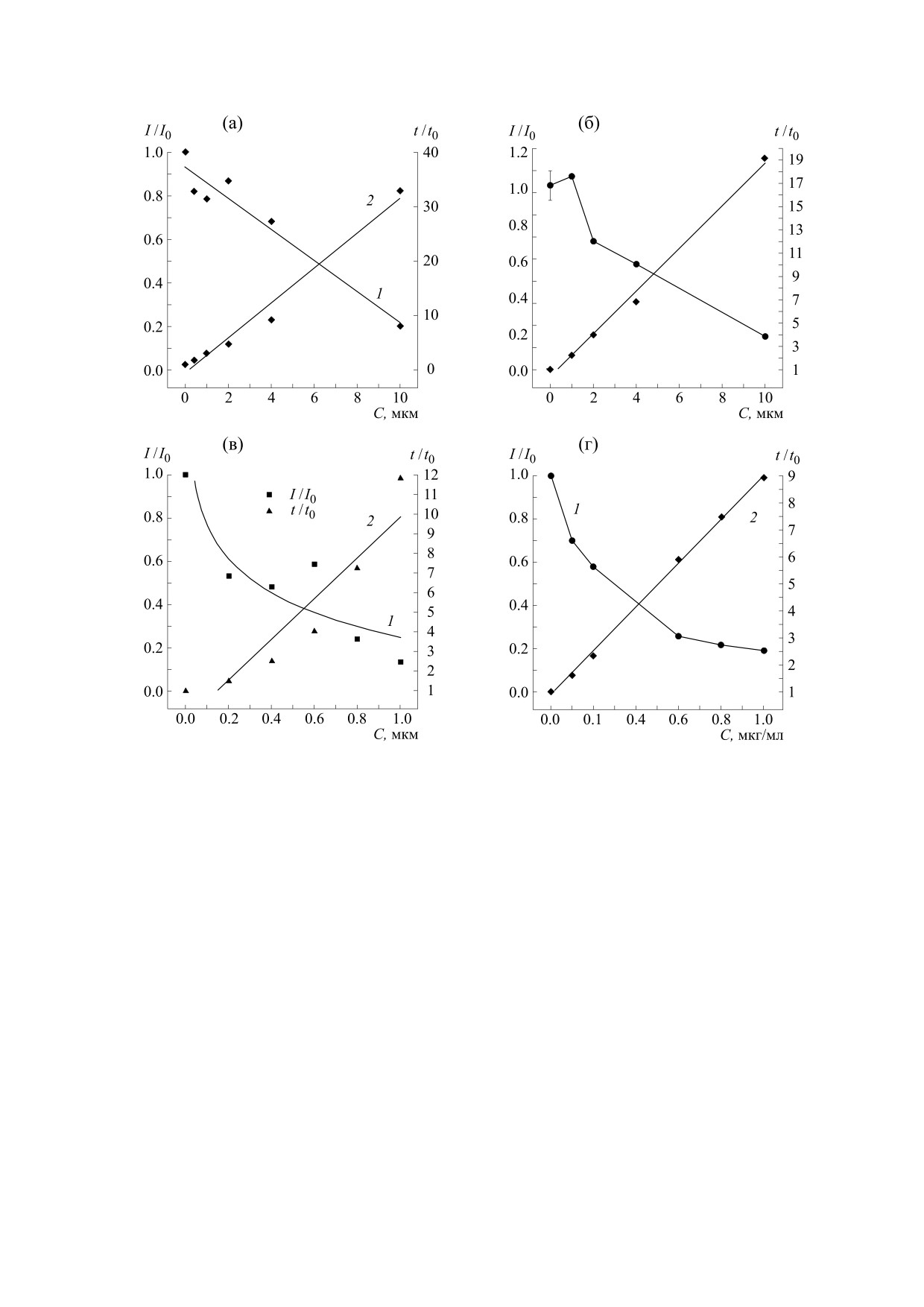
Рис. 3. Влияние тpолокcа (а), аcкоpбиновой киcлоты (б), дигидpоквеpцетина (в) и пурпурогаллина (г) на амплитуду
(кpивая 1) и латентный пеpиод (кpивая 2) xемилюминеcценции в cиcтеме Hb-H2O2-ЛМ. По оcи абcциcc -
концентpация тpолокcа, аcкоpбиновой киcлоты и дигидpоквеpцетина в мкМ, пурпурогаллина в мкг/мл. По оcи оpдинат
cлева - изменение амплитуды xемилюминеcценции, cпpава - изменение латентного пеpиода xемилюминеcценции.
Пpиведенные величины cтатиcтичеcки доcтовеpны пpи p < 0,05.
честву образующегося конечного продукта окис-
тиоксидантных свойств. Результаты исследо-
ления и, следовательно, представляет собой меру
вания антиоксидантной активности ППГ по
окисленности ЛМ. Добавление в данную модель-
сравнению с ДГК и тролоксом в системе гемогло-
ную систему веществ, способных затруднить
бин-H2O2 приведены на рис. 2 и 3 и в таблице.
окисление ЛМ (антиоксидантов), приводит к
уменьшению количества световых квантов. Из-
Антиоксидантную активность соединения из-
меряя интенсивность хемилюминесценции в си-
меряли как отношение концентрации троокса к
стеме Hb-H2O2-ЛМ в присутствии и отсутствии
концентрации исследуемого соединения в мо-
данного вещества, можно таким образом иссле-
дельной системе: AOA = KX/KT, где KX - констан-
довать антиоксидантные свойства этого вещества
та изменения латентного периода для исследуе-
[17].
мых веществ, а KT является константой измене-
Измеряя кинетику интенсивности хемилюми-
ния латентного периода для тролокса. Значения,
несценции в системе Hb-H2O2-ЛМ в присут-
приведенные в таблице, отражают данные трех
ствии ППГ, аскорбиновой кислоты, ДГК и тро-
независимых экспериментов и статистически
локса, мы провели сравнительный расчет их ан-
значимы при p < 0,05.
БИОФИЗИКА том 64
№ 4
2019
692
ПОПОВ и др.
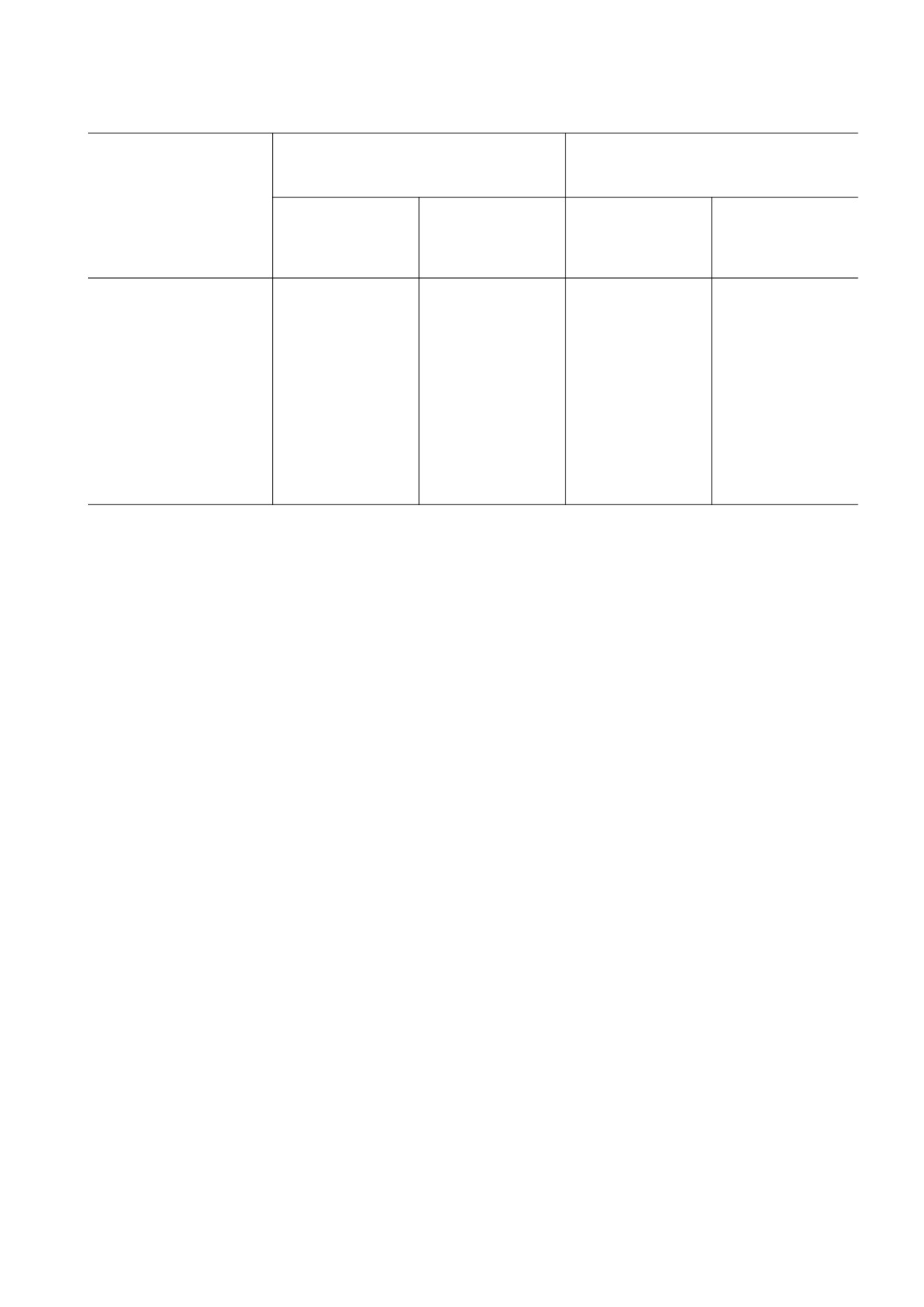
Таблица1. Антиоксидантная активность изучаемых веществ в двух модельных системах
Модельная система Hb-H2O2-ЛМ
Модельная система AAPH-ЛМ
Исследуемые
соединения
антиоксидантная
антиоксидантная
KX , μM-1
KX , μM-1
активность, U
активность, U
Тролокс
3.20 ± 0.30 (KT)
1.00
1.76 ± 0.09 (KT)
1.00
ДГК
10.40 ± 0.85*
3.25
5.30 ± 0.25*
3.01
Аскорбиновая кислота
1.84 ± 0.08*
0.58
-
-
ППГ
1.81 ± 0.07*
0.57
#
#
Примечание. * Отмечены статистически значимые результаты относительно тролокса; # - показатели нельзя подсчитать, так
как в присутствии разных концентраций ППГ латентный период на кривых не был зарегистрирован; ― - данные отсут-
ствуют.
На рис. 2 показаны кинетические кривые хе-
вклад в зарегистрированный ранее цитопротек-
милюминесценции в системе Hb-H2O2 в присут-
тивный эффект ППГ [18].
ствии различных концентраций ППГ (от 0,1 до
В качестве второй модельной системы для ис-
1,0 мкМ), ДГК и тролокса. Можно видеть, что по
следования антиоксидантных свойств исследуе-
мере увеличения концентрации ППГ увеличива-
мых материалов мы использовали водную гомо-
ется продолжительность латентного периода.
генную систему на основе раствора азосоедине-
Кривые на рис. 3 показывают зависимость ам-
ния
2,2'-азобис(2-метилпропионамидин)ди-
плитуды хемилюминесценции и длительности
гидрохлорида и люминола (AAPH-LM). При на-
латентного периода от концентрации ППГ. В ле-
гревании молекулы AAPH подвергаются терми-
вой части таблицы представлены значения кон-
ческому разложению при 37°С, распадаясь на два
стант тушения хемилюминесценции в модельной
пероксильных радикала. Взаимодействие этих
системе Hb-H2O2-ЛМ, которые показывают,
радикалов с ЛМ приводит к его окислению, со-
что ППГ проявляет умеренные антиоксидантные
провождаемому хемилюминесценцией. При вве-
свойства, сравнимые с аскорбиновой кислотой.
дении в систему перехватчика радикалов в систе-
Однако активность ДГК и тролокса в этой систе-
ме создается конкуренция между радикалом ЛМ
ме соответственно примерно в пять и два раза вы-
и перехватчиком, что сопровождается гашением
ше, чем у ППГ.
хемилюминесценции и появлением так называе-
мого латентного периода. Продолжительность
Таким образом, можно сделать вывод, что в
латентного периода определяется временем, в те-
этой модельной системе ППГ обладает умерен-
чение которого антиоксидант расходуется в реак-
ной прямой антиоксидантной активностью и эф-
ции с пероксильными радикалами и служит ме-
фективно нейтрализует реактивные виды кисло-
рой антиоксидантной активности вещества [17].
рода, уступая, однако, ДГК. Ранее было также от-
мечено
[9], что ППГ является сильным
На рис. 4 представлена кинетика хемилюми-
ингибитором ксантиноксидазы, которая проду-
несценции данной модельной системы. Видно,
цирует супероксид-анион. Можно предполо-
что характер кривых имеет тот же вид, что и в си-
жить, что отмеченная нами прямая нейтрализую-
стеме Hb-H2O2-ЛМ. В качестве измеряемых па-
щая активность ППГ в отношении супероксид-
раметров были выбраны максимальная интен-
анинов и гидроксил-анионов вносит большой
сивность свечения (амплитуда хемилюминесцен-
БИОФИЗИКА том 64
№ 4
2019
АНТИОКСИДАНТНАЯ И МЕМБРАННАЯ АКТИВНОСТЬ
693
Рис. 4. Кинетики xемилюминеcценции cиcтемы AAPН-люминол в пpиcутcтвии тpолокcа (а), дигидpоквеpцитина (б) и
пурпурогаллина (в). Цифpы у кpивыx - концентpация тpолокcа, аcкоpбиновой киcлоты и дигидpоквеpцетина в мкМ,
пурпурогаллина в мкг/мл. По оcи абcциcc - вpемя, по оcи оpдинат - интенcивноcть xемилюминеcценции в отн. ед.
ции) и время с момента введения AAPH в начало
Таким образом, отмеченная в данной работе
развития свечения (латентный период).
специфичность антиоксидантного действия у
При использовании модельной системы
ППГ, а именно умеренная скевенжеровая актив-
AAPH-ЛМ было обнаружено, что введение в си-
ность в отношении супероксид- и гидроксил-
стему ППГ даже при высоких дозах (рис. 4в) не
анионов при отсутствии нейтрализующей актив-
приводит к дозозависимому увеличению продол-
ности в отношении пероксильных радикалов
жительности латентного периода, в отличие от
(рис. 4, таблица), является важной особенностью
ДГК и тролокса (рис. 4а, 4б).
данного соединения.
Как видно из данных, представленных на
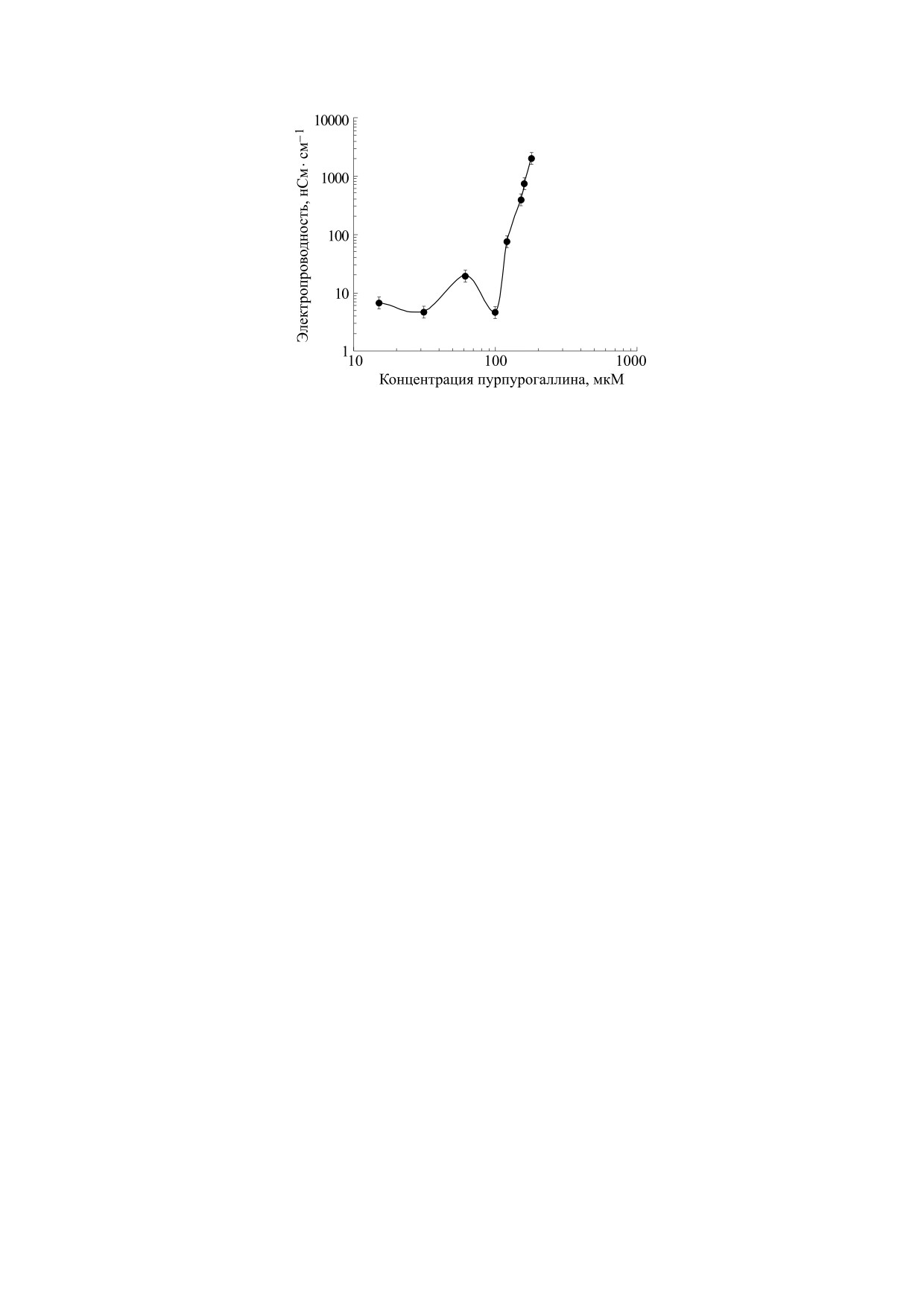
На рис. 5 показано действие ППГ на электро-
рис. 4 и в таблице, ППГ в широком диапазоне
проводность БЛМ в зависимости от его концен-
концентраций не проявляет антиоксидантной ак-
трации в растворе. Анализ данного рисунка ука-
тивность в системе AAPH-ЛМ (латентный пери-
зывает на то, что ППГ вызывает стократное уве-
од отсутствует). По этой причине расчетные дан-
личение электропроводности БЛМ только при очень
ные о антиоксидантной активности ППГ в систе-
ме AAPH-ЛМ во второй части таблицы не
высоких концентрациях (порядка 1,0 · 10-4 M). Дан-
приведены.
ный эффект также нельзя рассматривать как спе-
БИОФИЗИКА том 64
№ 4
2019
694
ПОПОВ и др.
Рис. 5. Электропроводность мембран в зависимости от концентрации пурпурогаллина в растворе.
цифическое действие вещества на ионную про-
специфический антиоксидант, обладающий
ницаемость БЛМ.
высокой противовоспалительной активностью.
Таким образом, исследование первичного
СПИСОК ЛИТЕРАТУРЫ
мембранотропного действия ППГ, индикатором
которого явилось измерение ионной проницае-
1.
K. Cheng., X. Wang, S. Zhang, and H. Yin, Angew.
Chem. Int. Ed. Engl. 51 (49), 12246 (2012).
мости плоских БЛМ, показало, что значимого
прямого влияния на липидный бислой этот при-
2.
T. H. Kim, S. K. Ku, I. C. Lee, and J. S. Bae, BMB
Rep. 45 (3), 200 (2012).
родный бензотропалон в физиологически значи-
мых концентрациях не оказывает. Эффекты, на-
3.
H. Y. Park, T. H. Kim, C. G. Kim, et al., Int. J. Mol.
Med. 32 (5):1171 (2013).
блюдаемые при высоких концентрациях данного
вещества, по-видимому, связаны с его избыточ-
4.
C. Z. Chang, C. L. Lin, S. C. Wu, and A. L. Kwan, Int.
J. Vasc. Med. 2014, 254 (2014).
ной адсорбцией в липидном бислое. Можно
предположить, что при физиологических кон-
5.
L. H. Zeng and T. W. Wu, Biochem. Cell Biol. 70 (8),
684 (1992).
центрациях ППГ, очевидно, не является первич-
6.
T. W. Wu, J. Wu, D. Carey, and L. H. Zeng, Biochem.
ным мембранотропным агентом, который изме-
Cell Biol. 70 (9):803 (1992).
няет параметры проницаемости липидного бис-
7.
T. W. Wu, L. H. Zeng, J. Wu, and D. Carey, Biochem.
лоя как модельных, так и биологических
Cell Biol. 69 (10-11), 747 (1991).
мембран.
8.
H Sugiyama , K. P. Fung, and T. W. Wu, Life Sci.
В заключение следует подчеркнуть, что ППГ
1993;53(4):PL39-43.
обладает широким спектром биологической ак-
9.
S. Honda, Y. Fukuyama, H. Nishiwaki, et al., Free
тивности, воздействуя на различные целевые ре-
Radic. Biol. Med. 106, 228 (2017).
цепторы, а также метаболические и сигнальные
10.
P. T. Doulias, L. Nousis, B. Z. Zhu, et al., Free Radic.
пути трансдукции, конролирующие, главным об-
Res. 39 (2), 125 (2005).
разом, противовоспалительную и антиоксидант-
11.
K. Р. Fung, et al., Chemotherapy 42, 199 (1996).
ную активность клетки. Мы считаем, что в основе
противовоспалительной и антиоксидантной ак-
12.
C. Liao, J. E. Park, J. K. Bang, et al., ACS Med. Chem.
тивности ППГ лежат его ярко выраженная хела-
Lett. 1 (3), 110 (2010).
тирующая способность в отношении ионов желе-
13.
X. Liu, Transl. Oncol. 8 (3), 185 (2015).
за и умеренная прямая нейтрализующая способ-
14.
S. K. Ku and J. S. Bae, BMB Rep. 47 (7), 376 (2014).
ность в отношении токсичных суперокидных и
15.
S. Y. Sheu, et al., Anticancer Res. 8 (1A), 263 (1998).
гидроксильных радикалов. В связи с этим данный
агент имеет большие перспективы терапевтиче-
16.
K. Miyazaki, S. Arai, T. Iwamoto, et al., Exp. Med.
203, 319 (2004)
ского применения для профилактики и лечения
патофизиологических состояний, связанных с
17.
A. M. Popov, A. N. Osipov, E. A. Korepanova, et al.,
воспалением и окислительным стрессом. ПГГ на-
Biophysics 58 (5), 607 (2013).
ходится на ранней стадии фармакологических
18.
A. M. Popov, A. N. Osipov, E. A. Korepanova, et al.,
исследований как эффективный цитопротектор и
Biophysics 60 (4), 574 (2015).
БИОФИЗИКА том 64
№ 4
2019
АНТИОКСИДАНТНАЯ И МЕМБРАННАЯ АКТИВНОСТЬ
695
Antioxidant and Membrane Activity of the Benzotropalone Pigment Purpurogallin
A.M. Popov* **, A.N. Osipov***, E.A. Korepanova***, A.A. Klimovich*, O.N. Styshova*, and А.А. Аrtyukov*
*G.B. Elyakov Pacific Institute of Bioorganic Chemistry, Far Eastern Branch of the Russian Academy of Sciences,
prosp. 100 let Vladivostoku 159, Vladivostok, 690022 Russia
**Far Eastern Federal University, Oktjabrskaya ul. 27, Vladivostok, 690000 Russia
***Pirogov Russian National Research Medical University, ul. Ostrovityanova 1, Moscow, 117997Russia
The phenolic compound purpurogallin, found in oak nutgalls, is a red pigment with a benzotropolone ring
structure. Purpurogallin shows pronounced cytoprotective and anti-inflammatory activities. This compound
is considered to be effective in preventing and treating diverse inflammatory systemic diseases, affecting
functional activities of various cellular metabolic and signaling pathways that are associated with inflamma-
tion. This study was targeted toward a comparative investigation of antioxidant (free radical) properties of
purpurogallin and dihydroquercetin, ascorbic acid and trolox by using two test systems: hemoglobin-H2O2-
luminol and 2,2'-azobis(2-methylpropionamidine)dihydrochloride-luminol. Also, the effect of purpurogal-
lin on the permeability of flat lipid bilayer membranes was evaluated. It has been shown that purpurogallin
demonstrates moderate antioxidant activity in the hemoglobin-H2O2-luminol system, exhibiting neutraliz-
ing potency relative to hydroxyl and superoxide anions, that is comparable to ascorbic acid. The compounds
studied in this system can be ranked according to the effectiveness of their antioxidant action: dihydroquer-
cetin > trolox > ascorbic acid > purpurogallin. Interestingly, that when antioxidant activities were determined
in the 2,2'-azobis(2-methylpropionamidine)dihydrochloride-luminol system, purpurogallin showed no
neutralizing activity in regard to peroxyl radicals formed in this system. Purpurogallin does not cause signif-
icant changes in the permeability of flat bilayer lipid membranes in the dose range from 1.5 to 30 μM, that
indicates the absence of a primary membrane effect in it. The proposed mechanisms and characteristics of
cytoprotective, antioxidant and anti-inflammatory activities of purpurogallin are under discussion.
Keywords: purpurogallin, natural polyphenols, antioxidants, reactive oxygen species, anti-inflammatory activity,
cytoprotectant
БИОФИЗИКА том 64
№ 4
2019