БИОФИЗИКА, 2019, том 64, № 4, с. 696-705
БИОФИЗИКА КЛЕТКИ
УДК 577.15.03:541.18:532;541.8.532.77
ВЗАИМОСВЯЗЬ МЕЖДУ ПЕРЕКИСНЫМ ОКИСЛЕНИЕМ ЛИПИДОВ
И МИКРОВЯЗКОСТЬЮ В ЛИПОСОМАХ ИЗ ФОСФАТИДИЛХОЛИНА.
ВЛИЯНИЕ РАСТИТЕЛЬНОГО АНТИОКСИДАНТА И БЕЛКА
© 2019 г. Н.П. Пальмина, Н.Г. Богданова, Н.Н. Сажина, В.В. Каспаров,
В.И. Бинюков, И.Г. Плащина, А.С. Антипова, М.Г. Семёнова
Институт биохимической физики имени Н.М. Эмануэля РАН,
119334 Москва, ул. Косыгина, 4
E-mail: npalm@mail.ru
Поступила в редакцию 15.04.2019 г.
После доработки 15.04.2019 г.
Принята к публикации 30.04.2019 г.
Влияние перекисного окисления липидов на структуру биологических мембран и липосом
исследуется уже достаточно давно, однако до сих пор существует ряд невыясненных вопросов,
которые требуют дополнительного изучения. В частности, имеются противоречия в оценке
состояния структуры глубоко лежащих липидов мембран в процессе развития перекисного
окисления липидов. В данной работе проведены целенаправленные исследования изменения
микровязкости липидной компоненты методом ЭПР с применением спинового зонда (16-доксил-
стеариновой кислоты) в процессе инициированного перекисного окисления липидов в липосомах
из фосфатидилхолина и фосфатидилхолина с добавкой растительного антиоксиданта и
инкапсуляцией в белковую оболочку при двух температурах - физиологической (37°С) и
повышенной (60°С). Было установлено, что развитие перекисного окисления липидов во всех
экспериментах сопровождается увеличением микровязкости глубоко лежащих слоев липидов,
которое прямо пропорционально степени развития перекисного окисления липидов. Этот эффект
обусловлен, главным образом, увеличением относительного содержания насыщенных жирных
кислот в липидах липосом, хотя некоторый вклад в него могут вносить и новые структурные формы
окисленных липидов. Методами динамического светорассеяния и атомно-силовой микроскопии
показано, что перекисное окисление липидов вызывает увеличение среднего диаметра и объема
индивидуальных липосом, возрастание абсолютной величины их отрицательного дзета-
потенциала. Растительный антиоксидант и белок тормозят этот процесс.
Ключевые слова: липосомы, перекисное окисление липидов, микровязкость липидов, диаметр и объем
липосом, дзета-потенциал.
DOI: 10.1134/S0006302919040070
Наличие в ФХ полиненасыщенных жирных кис-
Липосомы из фосфатидилхолина (ФХ) широ-
лот обусловливает их подверженность перекис-
ко используются в биологии и медицине как в ка-
ному окислению и вызывает необходимость в его
честве модели для изучения механизмов перекис-
предотвращении или торможении за счет введе-
ного окисления липидов (ПОЛ) и скрининга ан-
ния антиоксидантов. Кинетика ПОЛ в липосомах
тиоксидантов [1,2], так и в качестве контейнеров
является более сложным процессом, нежели
для доставки в организм животных и человека
окисление в гомогенных растворах [1,2,5], так как
различных лекарственных препаратов и нутри-
реакции ПОЛ в липосомах чрезвычайно чувстви-
цевтиков - антиоксидантов, незаменимых полине-
тельны к таким параметрам, как структура липид-
насыщенных жирных кислот (омега-3 и омега-6),
ной компоненты липосом и их способности к со-
фосфолипидов, витаминов (группы В, Е и др.),
зданию агрегатов [5,6]. Кроме того, само ПОЛ
витаминоподобных веществ (L-карнитина, ли-
может приводить к изменению агрегационной
поевой кислоты, холина, убихинона и др.) [3,4].
способности липосом и, соответственно, влиять
Сокращения: ФХ - фосфатидилхолин, ПОЛ - перекисное
на скорость процесса ПОЛ [5,6].
окисление липидов, Cas-Na - казеинат натрия, С16 - 16-
Несмотря на то что данные предположения
доксилстеариновая кислота, ЭМГ
- эфирное масло
гвоздики, ЭПР - электронный парамагнитный резонанс,
были высказаны достаточно давно, их экспери-
АСМ - атомно-силовая микроскопия.
ментальная проверка осуществлялась в основном
696
ВЗАИМОСВЯЗЬ МЕЖДУ ПЕРЕКИСНЫМ ОКИСЛЕНИЕМ ЛИПИДОВ
697
на качественном уровне, причем большинство
озвучивания раствор охлаждали во льду. Далее
исследований было направлено на изучение
смесь липосом центрифугировали 20 мин при
структуры липосом, в которые встраивались ин-
13000 об/мин на настольной микроцентрифуге
дивидуальные окисленные липиды [7-9], в ос-
Micro 22 R Hettich Zentrifugen (Германия) при
новном они касаются поверхностных слоев липи-
4°С. Супернатант представлял собой готовые ли-
дов (не более 8 Å). Сведения об изменении состо-
посомы, которые затем хранили при 4°С и ис-
яния глубоко лежащих слоев липидов, размеров и
пользовали в течение двух суток. Инкапсулирова-
формы липосом в процессе их окисления носят
ние липосом казеинатом натрия осуществляли
отрывочный и противоречивый характер: есть от-
согласно методике, изложенной в работах [14,15],
дельные данные как об увеличении [1,10], так и об
со следующим весовым соотношением компо-
уменьшении
[1,12,13] микровязкости липидов
нентов: Cas-Na : ФХ = 10 : 1, а для липосом с
при ПОЛ.
ЭМГ - Cas-Na : ФХ : ЭМГ = 10 : 1 : 0,04 при кон-
центрации ФХ в липосомах 1 мг/мл.
В связи с этим цель данной работы состояла в
последовательном изучении изменения микро-
Перекисное окисление липидов. Для иницииро-
вязкости глубоких слоев липидов (22-24 Å), где
вания окисления липосом использовали водорас-
расположены жирнокислотные хвосты ФХ, сред-
творимый азо-инициатор ААРН
(2.2'-азо-
него диаметра и объема липосом из ФХ сои с
бис(амидинопропан)дигидрохлорид) с конечной
встроенным в них растительным антиоксидантом
концентрацией в растворе липосом 2 мМ. Окис-
и инкапсулированных в казеинат натрия в про-
ление липосом проводили в пробирках, термо-
цессе их инициированного окисления.
статированных при физиологической (37°С) или
повышенной (60°С) температуре. Степень разви-
МАТЕРИАЛЫ И МЕТОДЫ
тия ПОЛ контролировали спектрофотометриче-
ски при регистрации во времени ультрафиолето-
Материалы. В работе использовали фосфати-
вых спектров поглощения (от 200 до 300 нм) на
дилхолин фирмы Lipoid GmbH (Германия); казе-
спектрофотометре Lambda-25 (Perkin Elmer,
инат натрия (Cas-Na) фирмы Sigma (Новая Зе-
США). Продукты ПОЛ (диеновые конъюгаты)
ландия); парамагнитный зонд 16-доксилстеари-
определяли по максимуму поглощения при
новую кислоту (С16) фирмы Sigma (США);
λ = 233 нм [16].
органические растворители фирмы Merk (Герма-
Метод спиновых зондов. Для характеристики
ния), азо-инициатор ААРН - 2,2’-азо-бис(ами-
структурного состояния мембран липосом ис-
динопропан)дигидрохлорид (Fluka, Германия). В
пользовали метод электронного парамагнитного
качестве растительного антиоксиданта использо-
резонанса (ЭПР). Параметры, характеризующие
вали эфирное масло фирмы Plant Lipids Ltd (Ин-
структуру мембран, рассчитывали из спектров,
дия), которое вводили в липосомы в количестве
полученных при температуре 293 К на ЭПР-спек-
4% от веса ФХ.
трометре Bruker 200D (ФРГ) методом спинового
Приготовление растворов казеината натрия.
зонда [17], в качестве которого для изучения мик-
1%-е растворы казеината натрия готовили в фос-
ровязкости глубоколежащих областей липидного
фатном буфере (рН 7,0, I = 0,001 M, с добавкой
бислоя (~20 Å) использовали С16 (16-доксилстеа-
0,02% азида натрия), перемешивая с помощью
риновую кислоту). Микровязкость мембраны в
магнитной мешалки до полного растворения,
области локализации зонда С16 оценивали на ос-
центрифугировали (30 мин, 1800 g, 20°С.)
новании времен вращательной корреляции зонда
Приготовление липосом. Для приготовления
τс1 и τс2, которые определяли по формулам для
липосом использовали суспензию ФХ (1,2-диа-
быстрого анизотропного вращения радикалов
цил-sn-глицеро-3-фосфохолин, фирмы Lipoid
[17]
GmbH, Германия) с концентрацией 1 мг/мл в
фосфатном буфере (рН 7,2, I = 0,001 M, с добав-
⎛
I
⎞
−10
0
τ
=
6,5⋅ΔН
−1
⋅10
c,
кой 0,02% (вес/объем) азида натрия) [14]. Смесь
с
1
0
⎜
⎟
⎝
I-
⎠
перемешивали в течение 20 мин в шейкере, до-
бавляя эфирное масло гвоздики (ЭМГ), раство-
⎛
I
⎞
-10
+1
τ
=
6.65⋅ΔH
−1
⋅10
c.
ренное в 100-200 мкл этанола (4 вес.% по отно-
c
2
+
⎜
⎟
⎝
I
-
⎠
шению к ФХ). Затем проводили механическую
гомогенизацию полученной смеси при помощи
Измерения проводили в Центре коллективно-
го пользования ЭПР ИБХФ РАН.
гомогенизатора (Heidolph, Германия) - 2 мин
при 20000 об/мин. Для формирования липосом
Метод атомно-силовой микроскопии. Форму и
использовали ультразвуковой гомогенизатор
объем липосом определяли методом атомно-си-
VCX-130 (Sonics & Materials, США), работающий
ловой микроскопии (АСМ). Метод АСМ позво-
в режиме (15 с : 15 с) при мощности 50% от макси-
ляет исследовать рельеф поверхности образца с
мальной в течение 3 × 5 мин. Для предохранения
разрешением порядка нескольких нанометров
липосом от нагревания и окисления во время
[18].
БИОФИЗИКА том 64
№ 4
2019
698
ПАЛЬМИНА и др.
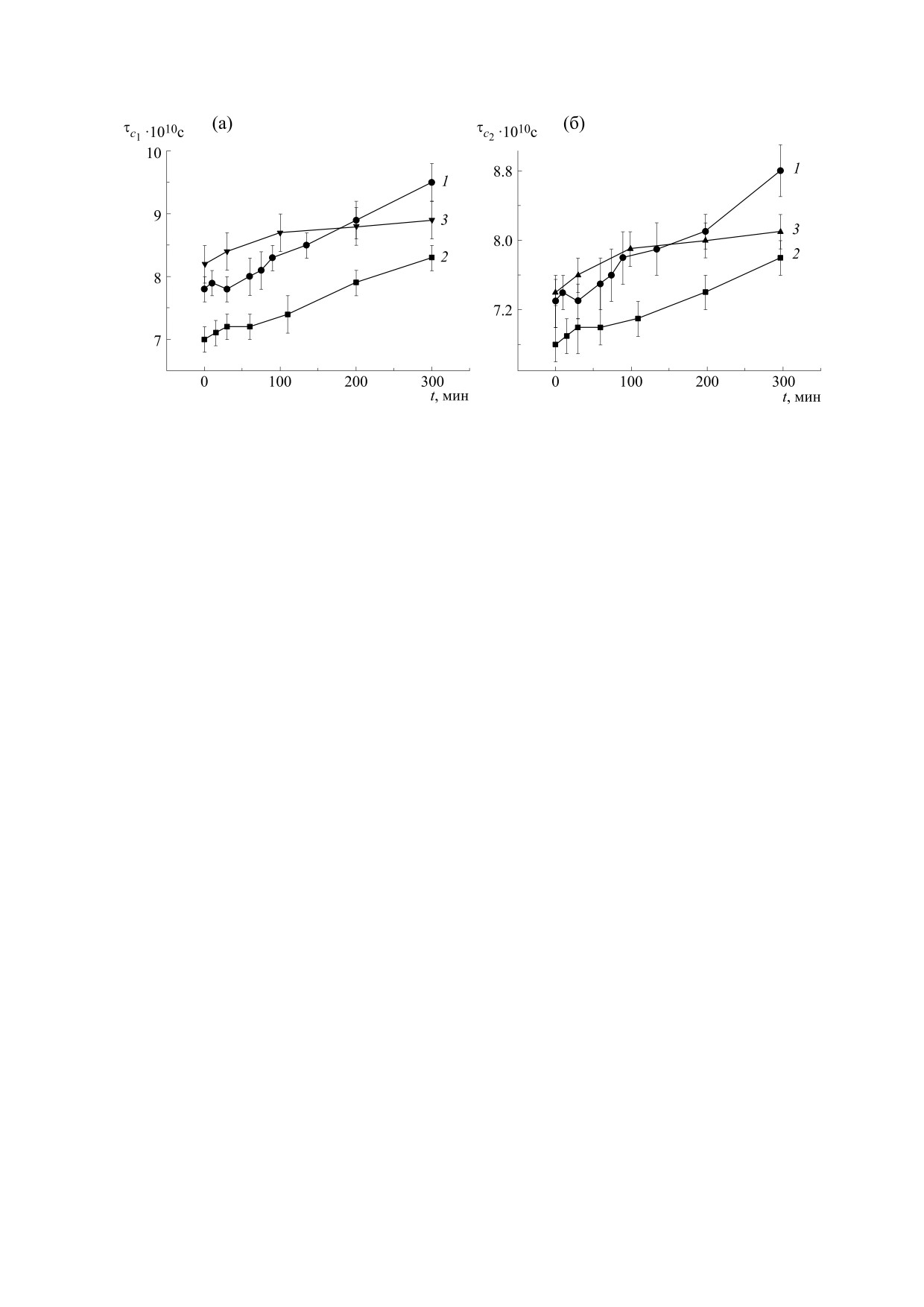
Рис. 1. Изменение времен вращательной корреляции τс1 (а) и τс2 (б) парамагнитного зонда С16 в липосомах из ФХ
(кривые 1), ФХ с ЭМГ (кривые 2) и ФХ с казеинатом натрия (кривые 3) в процессе их инициированного окисления
при 37°С.
АСМ-изображения липосом были получены с
оболочку из казеината натрия [16]. Следует отме-
помощью атомно-силового микроскопа SMENA
тить, что антиоксидантное действие этих веществ
на платформе SOLVER P47 (NT-MDT, Россия), в
сохранялось и при высокой температуре окисле-
полуконтактном режиме при частоте колебаний
ния (60°С). Поэтому мы провели эксперименты
150 кГц, с использованием кантилевера NSG 11.
по определению микровязкости в глубоко лежа-
Измерения проводили на воздушно-сухих плен-
щих слоях липидного бислоя липосом как
ках препарата [18]. Размер сканируемой области
при развитии инициированного (ПОЛ) в липосо-
составлял 20× 20 мкм. Полученные АСМ-изобра-
мах из ФХ, так и в липосомах с добавками ЭМГ и
жения обрабатывали с помощью программы Im-
Cas-Na.
age Analysis V. 2.2.0 (NT-MDT, Россия). Измере-
ния проводили в Центре коллективного пользо-
На рис. 1 приведены кинетические кривые из-
вания АСМ ИБХФ РАН.
менения времен вращательной корреляции τс1 и
Метод динамического светорассеяния. Измере-
τс2 в процессе развития ПОЛ при температуре
ния среднего диаметра и дзета-потенциала липо-
37°C. Видно, что по мере развития ПОЛ микро-
сом в растворе проводили методом динамическо-
вязкость липидов в области локализации зонда
го светорассеяния на высокочувствительном ана-
С16 увеличивается (кривые 1), а растительный ан-
лизаторе Zetasizer Nano ZS (фирма Malvern
тиоксидант ЭМГ задерживает этот процесс (кри-
Instrument, Великобритания) [19] при температу-
вые 2). ЭМГ сразу после его введения в липосому
ре 25оС. Каждую пробу измеряли от 7 до 10 раз с
уменьшает микровязкость липидов на 10-15%,
15 накоплениями.
что было показано нами ранее [21] и подтверди-
лось в этой работе («нулевая» точка кривых 2 на
Статистическая обработка данных. Статисти-
рис. 1). Далее, после инициации ПОЛ, микровяз-
ческую обработку данных осуществляли метода-
ми непараметрической статистики с использова-
кость возрастает, но остается на более низком
нием пакета компьютерных программ Origin® 6.1
уровне по сравнению с контролем (кривые 1).
при статистической надежности 95% [20].
Можно полагать, что ингибирование ПОЛ ЭМГ,
которое было зарегистрировано нами в работе
[16], осуществляется как за счет взаимодействия
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
ЭМГ с перекисными радикалами, так и за счет
снижения исходного уровня микровязкости ли-
Изменение структурного состояния липидного
пидов. Инкапсуляция липосом в белковую обо-
бислоя липосом в процессе ПОЛ. Ранее нами было
лочку существенно увеличивает исходные значе-
показано, что растительный антиоксидант, эфир-
ния τс, что было показано нами ранее [21], но по-
ное масло гвоздики (ЭМГ), существенно ингиби-
рует инициированное окисление липосом из
том они держатся приблизительно на том же
фосфатидилхолина [16], аналогичный эффект на-
уровне в течение всего времени окисления (кри-
блюдался и в том случае, когда ЭМГ использова-
вые 3). Аналогичный эффект ЭМГ мы наблюдали
ли одновременно с инкапсуляцией липосом в
и при повышении температуры окисления до
БИОФИЗИКА том 64
№ 4
2019
ВЗАИМОСВЯЗЬ МЕЖДУ ПЕРЕКИСНЫМ ОКИСЛЕНИЕМ ЛИПИДОВ
699
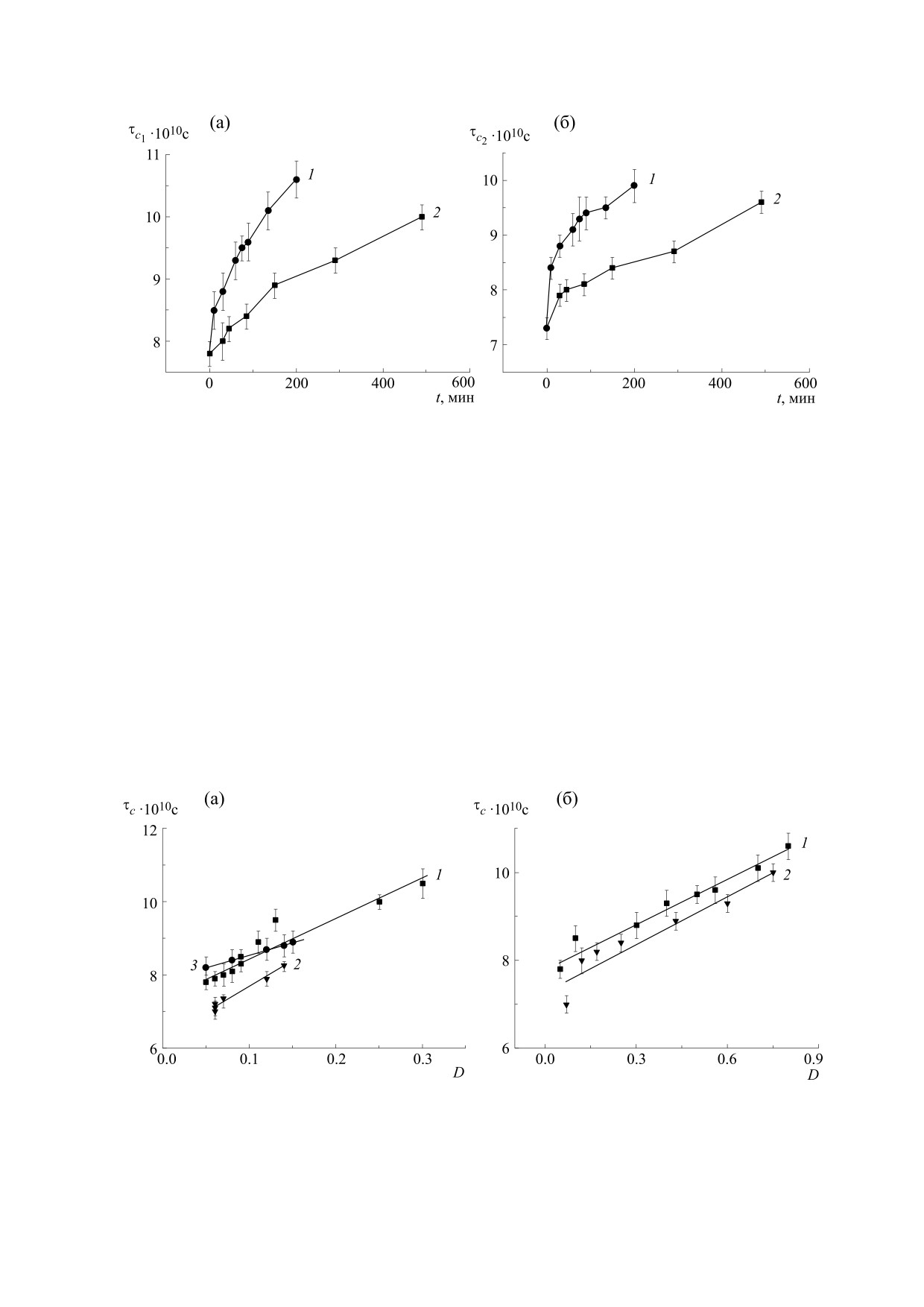
Рис. 2. Изменение времен вращательной корреляции парамагнитного зонда С16 τс1 (а) и τс2 (б) в липосомах из ФХ
(кривые 1) и ФХ с ЭМГ (кривые 2) в процессе инициированного ПОЛ при 60°С.
60°С и по критерию изменения τс1, и по критерию
мере развития ПОЛ, как в контрольных липосо-
τс2 (рис. 2).
мах из ФХ, так и при использовании липосом с
ЭМГ. Существует ли взаимосвязь между содер-
Так как данные об изменении содержания
жанием продуктов ПОЛ и микровязкостью липо-
продуктов ПОЛ в липосомах из ФХ, ФХ с ЭМГ и
сом? Для выяснения этого вопроса мы проводили
ФХ с Cas-Na подробно приведены и проанализи-
инициированное окисление липосом, отбирали
рованы нами с кинетической точки зрения в ра-
параллельные пробы, в одной из которых фикси-
боте [16], а условия проведения экспериментов
ровали уровень продуктов ПОЛ, в другой - изме-
были абсолютно идентичными, мы сравним ре-
ряли микровязкость на приборе ЭПР. Далее мы
зультаты, полученные в работе [16] и в данном ис-
построили зависимость параметра τс1 от оптиче-
следовании. Сопоставив кривые накопления
ской плотности растворов липосом при
продуктов ПОЛ, полученные в работе [16], и кри-
λ = 233 нм, которая пропорциональна содержа-
вые увеличения микровязкости липидов (рис. 1
нию диеновых коньюгатов, первичных продуктов
и 2) в зависимости от времени окисления, можно
окисления липидов. Эти результаты приведены
отметить их аналогию: обе величины растут по
на рис. 3.
Рис. 3. Зависимости от степени развития ПОЛ времени вращательной корреляции зонда С16 τc1 в липосомах из ФХ
(кривые 1), ФХ и ЭМГ (кривые 2); ФХ и казеината натрия (кривая 3) при инициированном окислении при 37°С (а) и
при 60°С (б).
БИОФИЗИКА том 64
№ 4
2019
700
ПАЛЬМИНА и др.
Таблица 1. Данные статистической обработки показателей для прямолинейных зависимостей τc1 от D
а
+\-
b
+\-
R2
P
ФХ
7.34
0.12
11.1
1.01
0.9306
0.001
37°С
ФХ + ЭМГ
6.29
0.10
14.0
1.11
0.9691
0.001
37°С
ФХ + казеинат
7.85
0.02
6.92
0.02
0.9974
0.001
37°С
ФХ
7.80
0.10
3.43
0.2
0.9660
0.001
60°С
ФХ + ЭМГ
7.30
0.20
3.65
0.5
0.985
0.001
60°С
Из рис. 3 следует, что как для контрольных ли-
телей [7,8,12], которые использовали различные
посом из ФХ, так и для липосом с добавками ЭМГ
спиновые зонды для картирования мембраны ли-
и Cas-Na наблюдается линейная зависимость
посом из ФХ с жирными кислотами различной
между концентрацией первичных продуктов
степени ненасыщенности после введения в их
ПОЛ и микровязкостью липидов. Зависимости
структуру нескольких продуктов окисления ле-
для параметра τс2 были абсолютно аналогичны,
цитина, выделенных и очищенных хроматогра-
поэтому в работе не приводятся.
фическим методом. Им удалось установить, что
окисленные липиды в большей степени влияют
В табл. 1 представлены результаты статистиче-
на поверхностные слои липидов (области локали-
ской обработки полученных данных. Видно, что
зации зондов 5-доксилстеарата и 3-доксилхоле-
для всех экспериментов между τс1 и оптической
стана), уменьшая степень упорядоченности ли-
плотностью D существует статистически досто-
пидов в этой области и снижая температуру фазо-
верная (R близко к 1; p < 0,01) линейная зависи-
вых переходов, ликвидируя анизотропию в
мость, подчиняющаяся уравнению y = a + bx, где
поведении указанных зондов. В то же время окис-
а - отрезок, отсекаемый на оси ординат, а b -
ленные липиды практически не влияли на мик-
угол наклона прямой. Из рис. 3 и табл. 1 следует,
ровязкость глубоко лежащих слоев липидов (об-
что прямые для липосом из ФХ и (ФХ+ЭМГ)
ласть локализации зонда
16-доксилстеарата).
практически параллельны и различаются только
Полный анализ действия еще более широкого
величинами а, в то время как инкапсуляция ли-
круга окисленных липидов на биофизические
посомы в Cas-Na, напротив, почти не изменяет а,
свойства мембран проведен в обзоре [13], где
но в 1,6 раза уменьшает угол наклона соответству-
обобщены результаты об эффекте нескольких
ющей прямой (кривая 3 на рис. 3а). При повыше-
классов окисленных липидов на структуру и про-
нии температуры окисления до 60°С мы наблюда-
ницаемость мембран. Помимо влияния окислен-
ем параллельные изменения τс1 в липосомах из
ных липидов на указанные выше физико-хими-
ФХ и липосомах из ФХ с добавлением ЭМГ
ческие характеристики липидов, авторы отмеча-
(рис. 3б).
ют такие изменения в мембранах, как
утоньшение липидного бислоя, изменение про-
Таким образом, мы ответили на основной во-
филя гидратации, увеличение латеральной по-
прос, стоявший перед нами в начале нашего ис-
движности липидов и облегчение флип-флопа,
следования: микровязкость липидов увеличива-
создание дефектов в мембране и дезинтеграцию
ется в процессе ПОЛ , причем это изменение пря-
липидного бислоя [13]. Необходимо подчеркнуть,
мо пропорционально образованию продуктов
что все эти изменения относятся исключительно
ПОЛ. Что же является причиной данных измене-
ний? Можно высказать следующие предположе-
к поверхностным слоям липидов, в более глубоко
ния: изменение микровязкости липидов вызвано
лежащих липидах (область локализации зонда 16-
либо накоплением продуктов ПОЛ в липосомах,
доксилстеарата) незначительные изменения мик-
либо изменениями в жирнокислотном составе
ровязкости (увеличение) было отмечено только в
липосом. Следует отметить, что в литературе
том случае, когда использовались липосомы из
очень подробно и обстоятельно был изучен во-
дипальмитоилфосфатидилхлина, а на липосомы
прос о том, как могут влиять различные окислен-
из линолеил-пальмитоил-фосфатидилхолина
ные продукты липидов на структуру мембраны
окисленные продукты эффекта не оказывали во-
липосом [7-13]. Наиболее планомерно эти иссле-
обще [12]. К аналогичным заключениям о пре-
дования велись группой итальянских исследова-
имущественной регидизации поверхностных об-
БИОФИЗИКА том 64
№ 4
2019
ВЗАИМОСВЯЗЬ МЕЖДУ ПЕРЕКИСНЫМ ОКИСЛЕНИЕМ ЛИПИДОВ
701
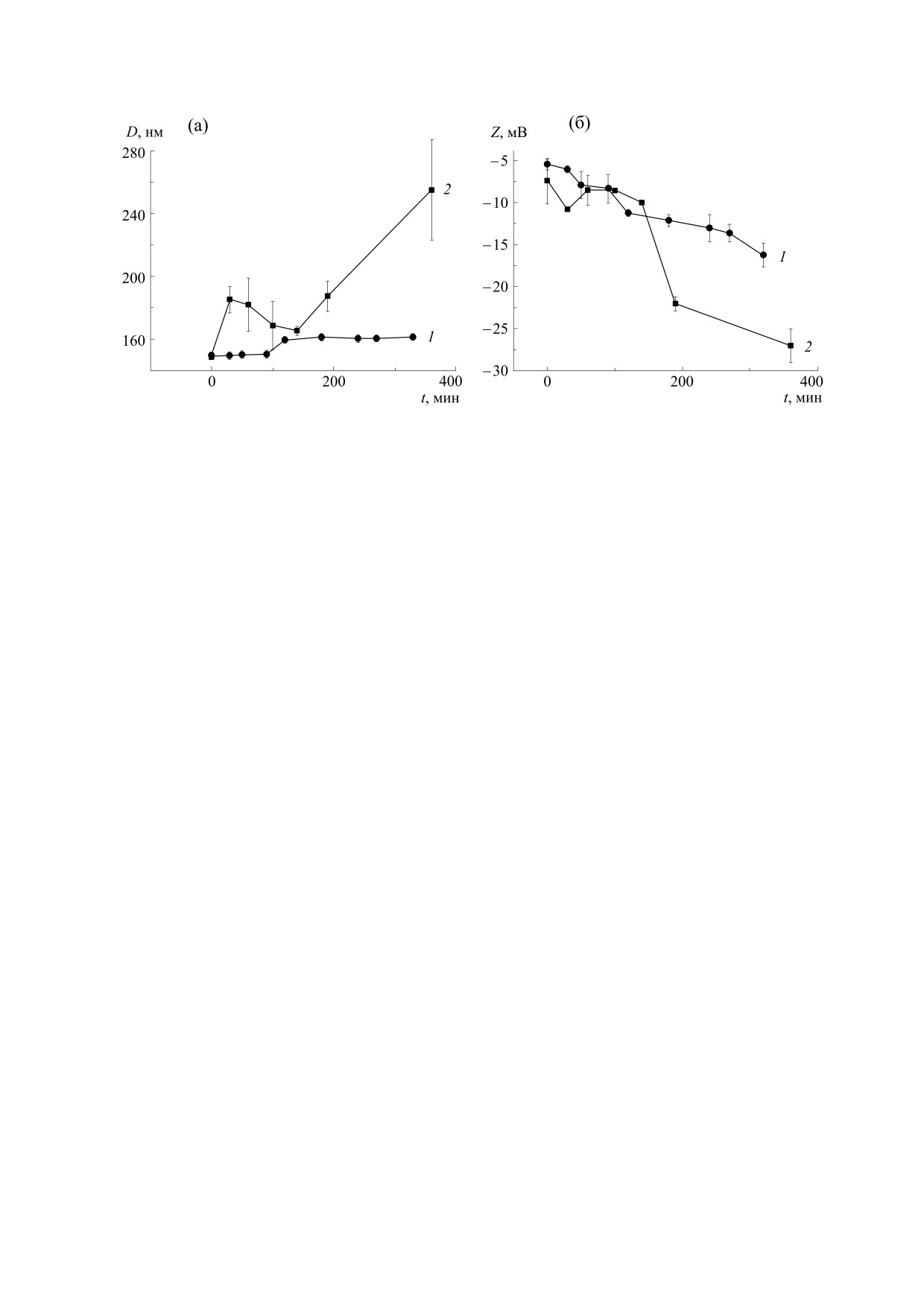
Рис. 4. Изменение среднего диаметра (а) и дзета-потенциала (б) липосом из ФХ в процессе их инициированного
окисления при температуре 37°С (кривые 1) и 60°С (кривые 2).
ластей мембраны пришла и группа авторов, изу-
ные липиды, несколько увеличивая их микровяз-
чавшая ПОЛ в липосомах методом флуорес-
кость.
центных зондов [22].
Изменение размеров и заряда липосом различно-
Совсем недавно появилась интересная работа
го состава в процессе инициированного ПОЛ. В об-
бразильских исследователей [23], в которой, ис-
зоре [1] на основании анализа большого литера-
следуя поведение гигантских однослойных вези-
турного материала авторы приходят к заключе-
кул под действием гидроперекисного ФХ и окис-
нию, что в процессе ПОЛ в липосомах из яичного
ленного ФХ с укороченной цепью, авторы делают
ФХ преимущественно образуются транс-транс-,
вывод о том, что гидроперекисный липид образу-
а не цис-транс-гидроперекиси. Также ими было
ет цилиндрическую молекулярную форму и спо-
высказано предположение, что именно эти пере-
собствует созданию мембранных микродоменов,
стройки в конфигурации ацильных цепей фосфо-
увеличивающих микровязкость бислоя. ФХ с
липидов приводят к важным изменениям в струк-
укороченной цепью имеет коническую форму, не
туре липосомальной мембраны, и, как след-
вызывает фазовой сегрегации, не влияет на
ствию, в размерах и дзета-потенциале липосом
структуру мембраны. Таким образом, эти данные
[1,6]. Увеличение микровязкости глубоко лежа-
говорят о том, что однозначное отрицание влия-
щих слоев липидов было убедительно продемон-
ния продуктов окисления на микровязкость ли-
стрировано нами в предыдущем разделе. Теперь
пидов, частично подтвержденное в работах
мы поставили своей задачей изучить размеры
[7,8,12], не является исчерпывающим. Однако
среднего диаметра липосом из ФХ с различными
остается вопрос о том, какой процесс является ве-
добавками и их дзета-потенциала в процессе
дущим в увеличении данного параметра по мере
ПОЛ методом динамического светорассеяния.
окисления липосом.
Учитывая данные о том, что при развитии
На рис. 4 представлены изменения среднего
ПОЛ в первую очередь расходуются полиненасы-
диаметра липосом из ФХ и их дзета-потенциала в
щенные жирные кислоты [13], вполне естествен-
процессе ПОЛ при 37°С (кривые 1) и при 60°С
но предположить, что по мере их расходования
(кривые 2). Видно, что ПОЛ сопровождается уве-
происходит относительное обогащение липосом
личением диаметра липосом и возрастанием аб-
НЖК и соответственно увеличивается вязкость
солютной величины их отрицательного дзета-по-
глубоко лежащих слоев липидов.
тенциала, причем при более высокой температуре
Таким образом, можно сделать заключение о
эти отличия более выражены. Эти результаты не
том, что увеличение микровязкости глубоко ле-
являются неожиданными, так как они совпадают
жащих слоев липидов обусловлено, главным об-
с наблюдениями авторов работы [6]. При боль-
разом, их относительным обогащением насы-
ших глубинах окисления при 60°С наблюдалось
щенными жирными кислотами, хотя некоторый
уширение пиков светорассеяния и увеличение
вклад в это явление вносят и продукты ПОЛ, ко-
ошибки среднего для диаметра липосом (рис. 4а,
торые, как установлено в работах [8,9,13], пре-
кривая 2). В работе [24] было установлено, что
имущественно действуют именно на насыщен-
окисленные липиды занимают большее молеку-
БИОФИЗИКА том 64
№ 4
2019
702
ПАЛЬМИНА и др.
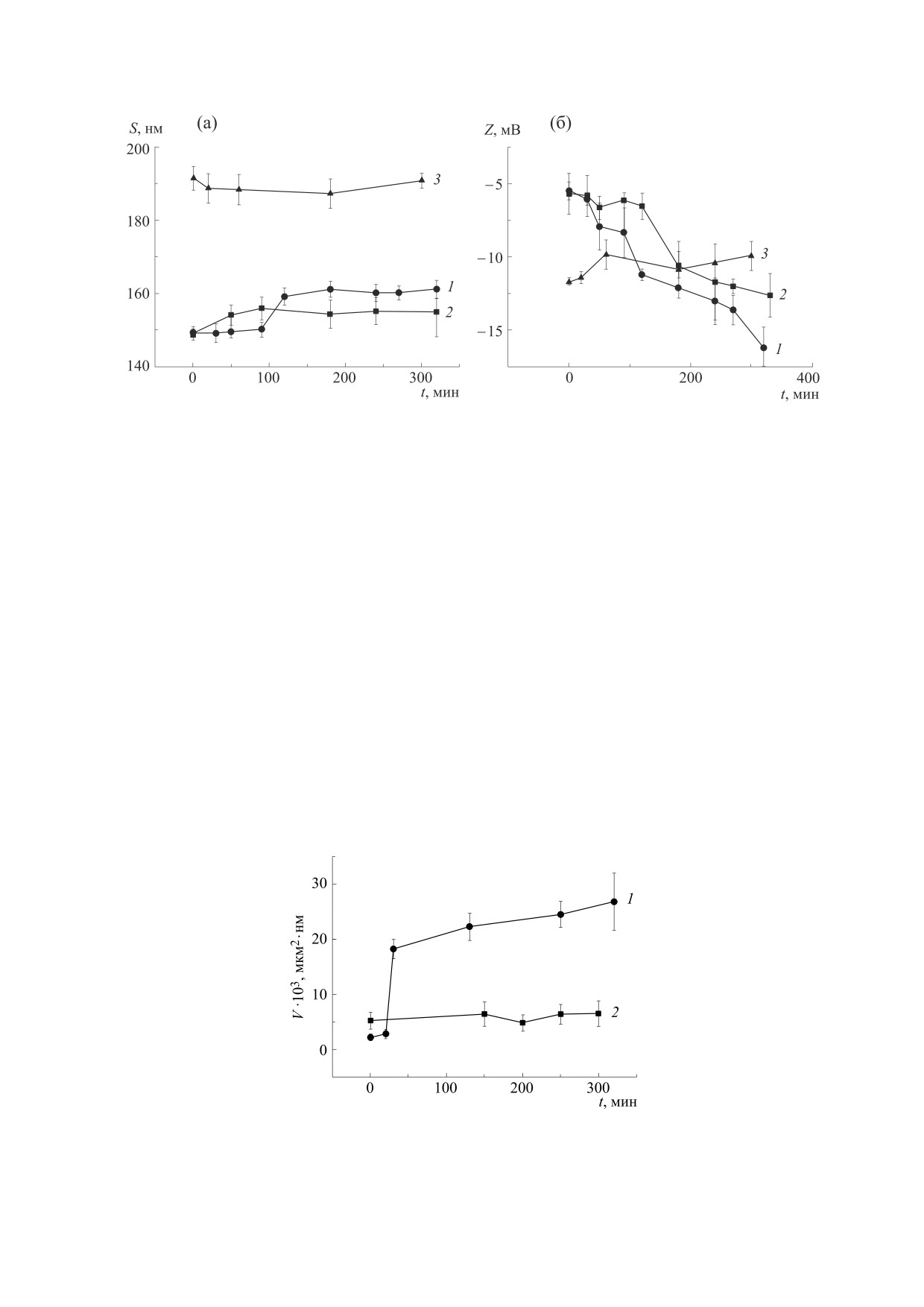
Рис. 5. Изменение среднего диаметра (а) и дзета-потенциала (б) липосом из ФХ (кривые 1), ФХ и ЭМГ (кривые 2), ФХ
и казеината натрия (кривые 3) в процессе ПОЛ при 37°С.
лярное пространство, чем неокисленные, а сфор-
тельного дзета-потенциала в липосомах с ЭМГ
мированные из них мембраны - на 20% тоньше.
возрастает медленнее, чем в контрольных липо-
сомах из ФХ, а казеинат натрия увеличивает абсо-
Далее мы провели эксперименты по определе-
лютную величину отрицательного дзета-потен-
нию влияния на изменения диаметра и дзета-по-
циала в нулевой точке и затем держит ее на посто-
тенциала липосом растительного антиоксиданта
янном уровне в течение всего времени
(ЭМГ) и белка (казеината натрия), которые, как
окисления.
было установлено нами ранее, при встраивании в
липосомы существенно тормозят ПОЛ. Результа-
Таким образом, нами установлено, что расти-
ты этих экспериментов представлены на рис 5.
тельный антиоксидант и белок предохраняют
структуру липосомы от физико-химических из-
Из рис 5а следует, что введение в липосомы
менений, вызываемых ПОЛ.
ЭМГ несколько снижает величины среднего диа-
метра липосом в процессе ПОЛ (до 100 мин окис-
Изменения формы и объема липосом в процессе
ления, затем увеличивает его по сравнению с кон-
инициированного ПОЛ, фиксируемые методом
тролем). Инкапсуляция липосом из ФХ в белко-
АСМ. В качестве дополнительного метода иссле-
вую оболочку сразу значительно (в 1,3 раза)
дования размеров и формы липосом в процессе
увеличивает диаметр наночастицы, но затем он
ПОЛ мы использовали метод атомно-силовой
не изменяется в процессе развития ПОЛ. Из
микроскопии. Хотя известно, что метод динами-
рис. 5б видно, что абсолютная величина отрица-
ческого светорассеяния дает более надежные ко-
Рис. 6. Изменение среднего объема липосом из ФХ (кривая 1), ФХ и ЭМГ (кривая 2) в процессе ПОЛ при 37°С.
БИОФИЗИКА том 64
№ 4
2019
ВЗАИМОСВЯЗЬ МЕЖДУ ПЕРЕКИСНЫМ ОКИСЛЕНИЕМ ЛИПИДОВ
703
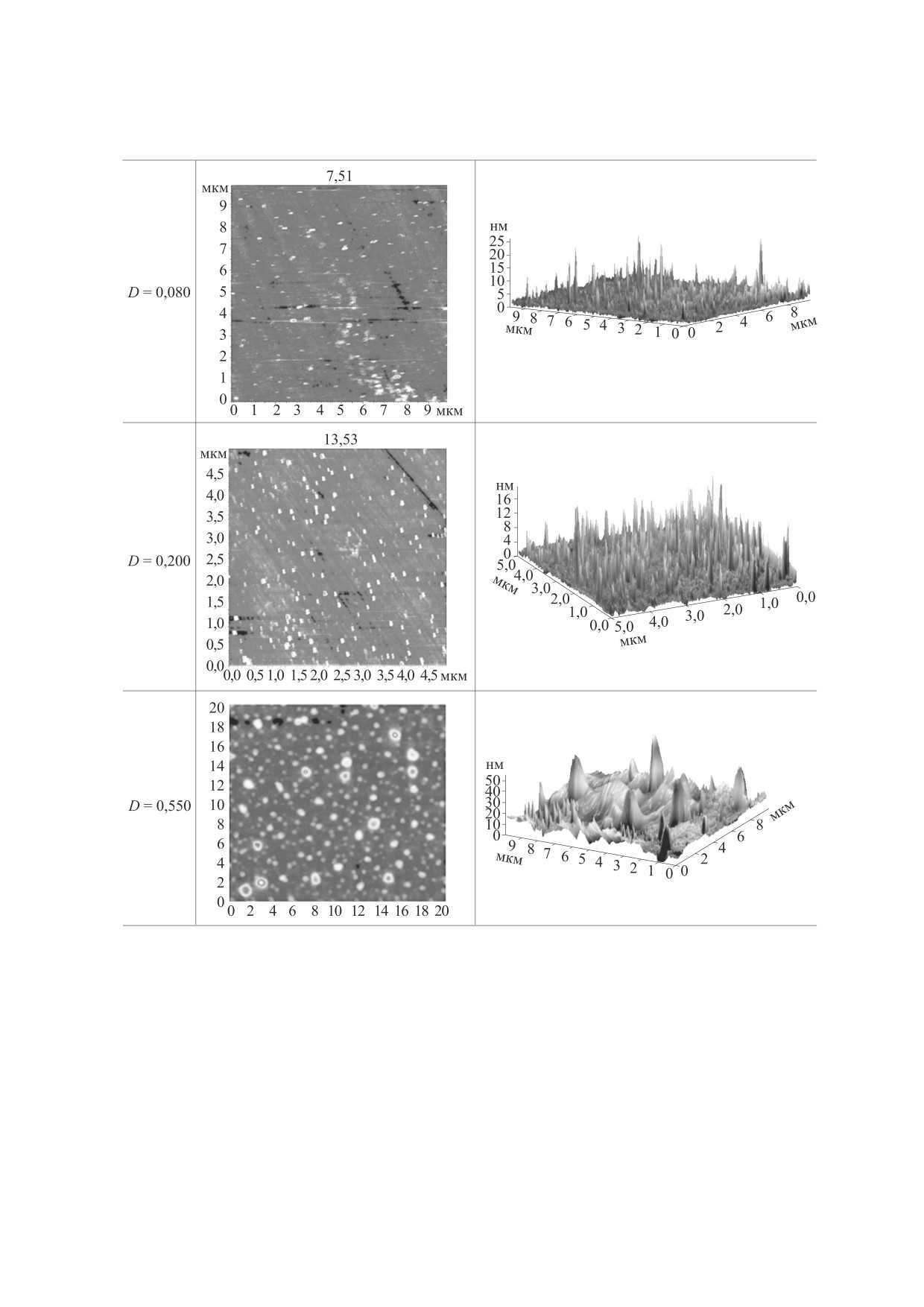
Таблица 2. Двухмерные и трехмерные имиджи липосом из фосфатидилхолина в зависимости от
степени их окисленности (уровня диеновых коньюгатов, первичных продуктов ПОЛ)
личественные результаты размеров липосом, ме-
ческом режиме определить диаметр, высоту и
тод АСМ позволяет получить более наглядные
объем каждой липосомы и провести статистиче-
качественные изображения. Поэтому, на наш
скую обработку полученных данных. Наиболее
взгляд, при разумном сочетании этих методов ис-
достоверными являются результаты об объеме ча-
следования можно составить более всесторонюю
стиц. На рис. 6 представлены изменения среднего
картину изменений, происходящих в форме ли-
объема липосом из ФХ (кривая 1) и ФХ с ЭМГ
посом при различных воздействиях. Программа
(кривая 2) в процессе их инициированного окис-
NT- Image Analysis V. 2.2.0 позволяет в автомати-
ления при 37°С. Видно, что ПОЛ в контрольных
БИОФИЗИКА том 64
№ 4
2019
704
ПАЛЬМИНА и др.
липосомах из ФХ приводит к значительному уве-
СПИСОК ЛИТЕРАТУРЫ
личению их объема, в то время как введение анти-
1.
E. Schnitzer, I. Pinchuk, and D. Lichtenberg, Eur. Bio-
оксиданта несколько увеличивает объем до нача-
phys. J. 36, 499 (2007).
ла окисления, но потом держит его на постоян-
ном уровне (кривая
2). Следовательно, мы
2.
A. Catala, Chem. Phys. Lipids 157, 1 (2009).
получили принципиально те же закономерности,
3.
D. J. McClements, Nanoparticle- and microparticle-
что и при использовании метода динамического
based delivery systems: Encapsulation,protection and re-
светорассеяния. Качественную картину измене-
lease of active compounds (CRC Press Taylor and Fran-
ний в липосомах из ФХ при разных глубинах
cis Group, New York, 2014).
окисления можно видеть в табл. 2, где представ-
4.
M. G. Semenova and E. Dickinson, Biopolymers in
лены двумерные и трехмерные имиджи липосом
Food Colloids: Thermodynamics and Molecular Interac-
из ФХ. Увеличиние глубины окисления от 0,08 до
tions (Brill, Leiden, 2010).
0,550 сопровождается увеличением объема и из-
5.
B. Bose and S. N. Chatterjee, J. Photochem. Photobiol.
менением формы липосом. Введение ЭМГ прак-
28, 149 (1995).
тически не влияло на эти параметры; инкапсуля-
ция липосом в казеинат натрия увеличивала ис-
6.
M. Mosca, A. Ceglie, and L. Ambrosone, Chem. Phys.
ходные размеры липосом, которые не
Lipids 164, 158 (2011).
изменялись в процессе ПОЛ, поэтому эти данные
7.
F. M. Megli and K. Sabatini, Chem. Phys. Lipids 125,
не приводятся из-за ограниченности объема
161 (2003).
статьи.
8.
F. M. Megli, E. Conte, and L. Russo, Biochim. Bio-
Таким образом, результаты, полученные мето-
phys. Acta 1798, 1886 (2010).
дом АСМ, подтверждают выводы, сделанные на
9.
M. L. Wratten, G. Vangincel, A. A. Vantveld, et al.,
основании метода динамического светорассея-
Biochemistry 31, 10901 (1992).
ния, а также соответствуют результатам, получен-
10.
M. Duda, K. Kawula, A. Pawlak, et al., Cell. Biochem.
ным в работах [23,24].
Biophys. 75, 433 (2017).
11.
W.-Yu Tai, Yi-C. Yang, H.-J. Lin, et al., J. Phys. Chem.
114, 15642 (2010).
ЗАКЛЮЧЕНИЕ
12.
F. M. Megli, L. Russo, and K. Sabatini, FEBS Lett.
Несмотря на то что взаимосвязь ПОЛ в липо-
579, 4577 (2005).
сомах и биологических мембранах и структуры их
13.
13. P. Jurkeviwicz, A. Olzynska, L. Cwiklik, et al., Bio-
липидного бислоя уже долгие годы находится в
chim. Biophys. Acta 1818, 2388 (2012).
центре внимания мембранологов, до настоящего
времени существует ряд невыясненных вопросов.
14.
M. G. Semenova, D. V. Zelikina, A. S. Antipova, et al.,
В частности, имеются определенные противоре-
Food Hydrocoll. 52, 144 (2016).
чия в оценке состояния микровязкости глубоко
15.
M. G. Semenova, A. S. Antipova, T. A. Misharina,
лежащих слоев липидов при различных глубинах
et al., in Gums and Stabilisers for the Food Industry
ПОЛ [7-13]. В данной работе нами были проведе-
(Royal Soc. of Chem., Cambridge, 2016), V. 18,
ны целенаправленные исследования методом
pp. 182-189.
ЭПР изменения этого параметра в процессе ини-
16.
Н. Н. Сажина, А. С. Антипова, М. Г. Семенова и
циированного ПОЛ в липосомах из ФХ и ФХ с до-
Н. П. Пальмина, Биоорган. химия 45, 193 (2019).
бавкой растительного антиоксиданта и белка при
17.
А. Н. Кузнецов, Метод спинового зонда (Наука, M.,
двух температурах - физиологической (37°С) и
1976).
повышенной (60°С). Было установлено, что раз-
витие ПОЛ во всех экспериментах сопровождает-
18.
В. И. Бинюков, О. М. Алексеева, Е. М. Миль и др.,
Докл. РАН 441, 114 (2011).
ся увеличением микровязкости глубоко лежащих
слоев липидов, которое прямо пропорционально
19.
R. Pecora, J. Nanopart. Res. 2, 123.(2000).
степени развития ПОЛ. Этот эффект обусловлен
20. Н. Бейли, Математика в биологии и медицине
главным образом увеличением относительного
(Наука, М., 1970).
содержания насыщенных жирных кислот в липи-
дах липосом, хотя некоторый вклад в него могут
21. Н. П. Пальмина, Е. Л. Мальцева, В. И. Бинюков и
вносить и новые структурные формы окисленных
др., Биофизика 63, 78 (2018).
липидов, о которых указывается в работе [23].
22. M. A. Soto-Arriaza, C. P. Sotomayor, and E. A. Lissi,
J. Coll. Interface Sci. 323, 70 (2008).
ПОЛ вызывает увеличение среднего диаметра
индивидуальных липосом, возрастание абсолют-
23. T. M. Tsubone, H. C. Junqueira, M. S. Baptista, and
ной величины их дзета-потенциала. Раститель-
R. Itri, Biochim. Biophys. Acta 1861, 660 (2019).
ный антиоксидант и белок тормозят этот про-
24. R. De Rosa, F. Spinozzi, and R. Itri, Biochim. Bio-
цесс.
phys. Acta 1860, 2299 (2018).
БИОФИЗИКА том 64
№ 4
2019
ВЗАИМОСВЯЗЬ МЕЖДУ ПЕРЕКИСНЫМ ОКИСЛЕНИЕМ ЛИПИДОВ
705
The Relationship Between Lipid Peroxide Oxidation and Microviscosity in Liposomes
from Phosphatidylcholine. Effects of Plant Antioxidant and Protein
N.P. Palmina, N.G. Bogdanova, N.N. Sazhina, V.V. Kasparov, V.I. Binyukov, I.G. Plashchina,
A.S. Antipova, and M.G. Semenova
Emanuel Institute of Biochemical Physics, Russian Academy of Sciences, ul. Kosygina 4, Moscow, 119334 Russia
The effect of lipid peroxidation on the structure of biological membranes and liposomes has been studied for
a long time, but there are still a number of unexplained issues that require additional study. In particular, there
are inconsistencies in the assessment of the state of the structure of deep-lying membrane lipids during the
development of lipid peroxidation. In this work we have studied the change in the microviscosity of the lipid
component by the electron spin resonance method using a spin probe (16-doxyl-stearic acid) in the process
of lipid peroxidation initiated by the water-soluble azo-initiator AAPH. The liposomes from phosphatidyl-
choline and phosphatidylcholine with the addition of a plant antioxidant and liposomes incorporated in pro-
tein were used; lipid peroxidation was carried out at two temperatures: normal body (37°C) and increasing
(60°C) temperatures. It was found that the development of lipid peroxidation in all experiments is accompa-
nied by an increase in microviscosity of deep-lying layers of lipids, which is directly proportional to the lipid
peroxidation level. This effect is mainly due to an increase in the relative content of saturated fatty acids
in lipids of liposomes, although new structural forms of oxidized lipids also may play a role in the develop-
ment of this effect. Using dynamic light scattering and atomic force microscopy, it has been shown that lipid
peroxidation induces an increase in the average diameter of individual liposomes, a change in the absolute
ζ- potential value from negative to positive value. The plant antioxidant and protein inhibit this process.
Keywords: liposomes, lipid peroxidation, lipid microviscosity, diameter and volume of liposomes, ζ-potential
БИОФИЗИКА том 64
№ 4
2019