БИОФИЗИКА, 2019, том 64, № 4, с. 706-715
БИОФИЗИКА КЛЕТКИ
УДК 577.1:577.24:577.352:57.086.13
ОБРАЗОВАНИЕ АКТИВНЫХ ФОРМ КИСЛОРОДА В ЭРИТРОЦИТАХ
ЧЕЛОВЕКА ПРИ КРИОКОНСЕРВИРОВАНИИ С ГЛИЦЕРОЛОМ
И ПОЛИЭТИЛЕНГЛИКОЛЕМ
© 2019 г. Н.Г. Землянских, Л.А. Бабийчук
Институт проблем криобиологии и криомедицины НАН Украины,
Украина, 61016, Харьков, ул. Переяславская, 23
E-mail: nzemliansky@gmail.com
Поступила в редакцию 09.04.2019 г.
После доработки 09.04.2019 г.
Принята к публикации 30.04.2019 г.
Изучено образование активных форм кислорода в эритроцитах человека при инкубации в присут-
ствии глицерол-маннитольной смеси и полиэтиленгликоля с молекулярной массой 1500 Да, а также
при гипотермическом хранении криоконсервированных под их защитой клеток. Анализ образова-
ния активных форм кислорода проведен методом проточной цитометрии по показателям флуорес-
ценции дихлорфлуоресцеина. Установлено, что инкубация в глицерол-маннитольной смеси, а так-
же криоконсервирование и последующее гипотермическое хранение не вызывали активации обра-
зования активных форм кислорода в эритроцитах. Действие полиэтиленгликоля приводило к
интенсификации образования активных форм кислорода как при инкубации, так и при хранении
криоконсервированных эритроцитов в условиях гипотермии. Особенности изменений интенсив-
ности образования активных форм кислорода в эритроцитах под влиянием криопротекторных
агентов и криоконсервирования могут оказывать значительное влияние на стабильность клеток в
стрессовых условиях и их способность поддерживать функциональную полноценность при возвра-
щении в физиологические условия.
Ключевые слова: активные формы кислорода, эритроцит, криоконсервирование, криопротектор,
полиэтиленгликоль, глицерол.
DOI: 10.1134/S0006302919040082
ния барьерно-транспортных функций и механо-
Процессы замораживания-отогрева клеток со-
эластических свойств мембраны эритроцитов. В
провождаются целым спектром экстремальных
стрессовых условиях криоконсервирования воз-
физико-химических факторов [1], которые могут
можно усиление процессов автокисления гемо-
вызвать негативные изменения в структуре от-
глобина, сопровождаемых формированием ак-
дельных белков, белковых комплексов и мем-
тивных форм кислорода (АФК) - супероксидно-
бранных систем. Сохранность и функциональная
полноценность криоконсервированных эритро-
го радикала О•-, перекиси водорода Н2О2 и
цитов человека определяется состоянием мем-
гидроксил-радикала •ОН, которые вступают в
бранно-цитоскелетного комплекса [2] и струк-
дальнейшие химические реакции окисления ли-
турными изменениями основного цитозольного
пидных и белковых компонентов мембранно-ци-
белка гемоглобина, содержащего металл с пере-
тоскелетного комплекса. Даже в условиях, когда
менной валентностью в составе гемма [3]. Нару-
образование АФК незначительно превышает
шения в структуре гемоглобина могут способ-
контрольные значения, клеточные компоненты
ствовать развитию окислительных процессов и
могут реагировать на такие изменения, воспри-
дальнейшей химической модификацией данного
нимая их как регуляторный сигнал. В частности,
белка и компонентов мембранно-цитоскелетного
на повышение образования АФК может отреаги-
комплекса, вследствие чего возникают наруше-
ровать пероксиредоксин 2 [4], который содержит
в структуре функциональную -SH-группу цисте-
Сокращения: АФК - активные формы кислорода, КПА - ина и участвует в защите клеток от окислительно-
криопротекторные агенты, ПЭГ - полиэтиленгликоль с го стресса. Пероксиредоксин очень чувствителен
молекулярной массой 1500 Да, DCF - 2′,7′-дихлорфлуо-
ресцеин, DCFH-DA - 2′,7′-дихлорфлуоресцеина диацетат,
к Н2О2 и первым отвечает на изменения содержа-
NOX - NADPH-оксидазы, СаМ - кальмодулин.
ния АФК, поскольку его -SH-группы реагируют
706
ОБРАЗОВАНИЕ АКТИВНЫХ ФОРМ КИСЛОРОДА
707
с Н2О2 на несколько порядков величины быстрее,
клеток в физиологические условия in vitro с тече-
чем -SH-группы других белков [5]. Важно также
нием времени отмечается постепенное увеличе-
отметить, что пероксиредоксин участвует в сиг-
ние гемолиза. Исследование пространственно-
нальной трансдукции окисления белков [6] и мо-
конформационных модификаций белков мем-
жет выполнять шаперонную функцию [7]. Все это
бранно-цитоскелетного комплекса эритроцитов,
может быть важным для модификации белков
криоконсервированных под защитой ПЭГ, с ис-
мембранно-цитоскелетного комплекса в услови-
пользованием белок-сшивающего реагента диа-
ях криоконсервирования. Возникает вопрос, мо-
мида [15], показало изменение относительного
гут ли криопротекторные агенты (КПА) иниции-
содержания пероксиредоксина 2 (белка полосы 8
ровать окислительные процессы на этапе контак-
[16]) в белковом профиле теней при электрофоре-
та с эритроцитами при положительной
зе в полиакриламидном геле, что может свиде-
температуре и в какой мере процессы заморажи-
тельствовать об окислительных процессах в
вания-отогрева, при которых в клетках происхо-
клетке.
дят более существенные изменения, способны за-
В связи с этим целью исследования было изу-
трагивать образование АФК? Известно, что в
чение действия криопротекторных смесей на ос-
процессе криоконсервирования часть клеток
нове глицерола и ПЭГ на образование АФК в
подвергается летальным или сублетальным по-
эритроцитах человека на разных этапах процесса
вреждениям, в таких условиях возможность нару-
криоконсервирования.
шений в структуре гемоглобина значительно уве-
личивается, что существенно повышает и вероят-
ность развития окислительных процессов.
МАТЕРИАЛЫ И МЕТОДЫ
В медицинской практике для обеспечения ста-
В работе использовали следующие реактивы:
бильности эритроцитов человека в процессе за-
2′,7′-дихлорфлуоресцеина диацетат (DCFH-DA),
мораживания-отогрева используется глицерол в
Трис, HEPES, (Sigma, США), ПЭГ и CaCl2 (Flu-
качестве основного компонента криопротектор-
ka, США), глицерол, маннитол, NaCl, КCl, MgCl2
ной среды [8]. Однако необходимость его удале-
(квалификации «х.ч.» или «ос.ч.») и другие реак-
ния из клеток перед трансфузией делает процесс
тивы производства России и Украины.
криоконсервирования длительным и трудоем-
ким. Данный этап обусловлен проникновением
Объектом исследования служили эритроциты
глицерола в клетки, поэтому в процессе подго-
крови доноров, заготовленной с использованием
товки размороженных эритроцитов к возвраще-
глюкозо-цитратного раствора в Центре службы
нию в физиологические условия необходимо
крови г. Харькова. Эритроциты осаждали центри-
предотвратить развитие осмотического шока.
фугированием при 1200 g в течение 10 мин при
Эффективный экзоцеллюлярный, т.е. не прони-
комнатной температуре, удаляли плазму и лейко-
кающий через мембрану, КПА мог бы позволить
цитарные компоненты крови. Затем к осадку до-
применять размороженные клетки без его удале-
бавляли раствор 150 мМ NaCl, 10 мМ трис-HCl
ния. Однако эритроциты, криоконсервирован-
(pH 7.4) в объеме, пяти-семикратно превышаю-
ные под защитой различных экзоцеллюлярных
щем объем клеточной массы, и отмывали от
веществ, оказываются нестабильными в физио-
остатков плазмы и белых клеток трехкратным
логических условиях [8-10]. Для того чтобы по-
центрифугированием в аналогичном режиме.
нять причины нестабильности клеток, заморо-
К 500 мкл раствора Рингера с глюкозой при
женных в присутствии экзоцеллюлярных КПА,
37оС добавляли 50 мкл отмытых эритроцитов (ко-
необходим детальный анализ вызванных ими
нечный гематокрит около 10% или 109 клеток/мл)
структурных и фунциональных модификаций
и инкубировали в течение 15 мин. После этого из
различных субклеточных систем, ответственных
клеточной суспензии отбирали аликвоты по
за поддержание целостности и функциональной
10 мкл и соединяли с 250 мкл сред, содержащих
полноценности эритроцитов, что может послу-
криопротекторные среды (конечная концентра-
жить своего рода инструментом целенаправлен-
ция 4 · 107 кл./мл), и инкубировали в течение 18 ч
ной корректировки или предотвращения нега-
при 37°С. В работе использовали следующие сре-
тивных процессов. Возможность биохимической
ды: (1) - раствор Рингера с глюкозой (125 мМ Na-
стабилизации клеток в процессе криоконсерви-
Cl, 5 мМ КCl, 1 мМ MgCl2, 1 мМ CaCl2, 32 мМ
рования была продемонстрирована на эритроци-
тах человека [11] и других типах клеток [12-14].
HEPES (pH 7,4), 5 мМ глюкозы); (2) - раствор,
содержащий 3,25 М глицерола, 0,22 М маннито-
Одним из перспективных экзоцеллюлярных
ла, 120 мМ NaCl, 10 мМ трис-HCl (pH 7,4); (3) -
КПА может быть полиэтиленгликоль с молеку-
раствор, содержащий 0,2 М ПЭГ, 150 мМ NaCl,
лярной массой 1500 Да (ПЭГ), который обеспечи-
10 мМ трис-НСl (pH 7,4).
вает высокий уровень сохранности эритроцитов
человека после размораживания [10], но при пе-
По окончании инкубации к отобранным
реносе криоконсервированных под его защитой
50 мкл из каждой клеточной суспензии добавляли
БИОФИЗИКА том 64
№ 4
2019
708
ЗЕМЛЯНСКИХ и др.
раствор DCFH-DA (конечная концентрация
нение). Выборки являются зависимыми, экспе-
рименты проведены на крови четырех разных до-
4 · 10-5 М) и инкубировали при 37°С в течение
норов (n = 4). Статистическую значимость разли-
30 мин в темноте. Затем добавляли 250 мкл соот-
чий между экспериментальными группами
ветствующих сред, снижая концентрацию клеток
оценивали с помощью множественного рангово-
для измерений показателей флуоресценции 2,7-
го теста Фишера по процедуре группировки вы-
дихлорфлуоресцеина (DCF) (длина волны воз-
борок с наименьшей значимой разницей. При
буждения/эмиссии 495 нм / 529 нм) методом про-
р < 0,05 данные считали статистически значи-
точной цитометрии на приборе FACS Calibur
мыми.
(Becton Dickenson, США).
Для оценки влияния криоконсервирования на
образование АФК эритроциты, отмытые от плаз-
РЕЗУЛЬТАТЫ
мы и белых клеток крови, обрабатывали криоза-
щитными средами, состав которых описан выше.
Оценка интенсивности окислительных про-
цессов в эритроцитах была выполнена с помо-
Глицеролсодержащий раствор добавляли в рав-
щью H2DCF-DA, который деэтерифицируется
ном объеме к эритроцитам, постоянно переме-
шивая, при комнатной температуре. ПЭГ-содер-
после прохождения через плазматическую мем-
жащий раствор добавляли к охлажденным эрит-
брану, но остается нефлуоресцентным соедине-
роцитам в равном объеме при температуре
нием (H2DCF) до момента его взаимодействия с
около 5°С. Затем эритроциты переносили в кон-
АФК, преимущественно с Н2О2, с образованием
тейнеры для замораживания и погружали в жид-
флуоресцирующей окисленной формы DCF. Для
кий азот (-196°С). Отогрев проводили в водяной
определения интенсивности флуоресценции
бане при температуре 42-44°С. После размора-
DCF в эритроцитах человека использовали про-
живания эритроциты отмывали от криопротекто-
точную цитометрию, позволяющую учитывать
ров. Для глицеролсодержащих образцов процеду-
индивидуальные особенности отдельных эритро-
ра отмывки включала осаждение клеток центри-
цитов, обусловленные, прежде всего, их возраст-
фугированием (1200 g, 5-7 мин) и три этапа
ной гетерогенностью [17]. Изменения интенсив-
отмывки с использованием 600 мМ NaCl (первая
ности флуоресценции DCF в эритроцитах под
отмывка) и 150 мМ NaCl (вторая и третья отмыв-
влиянием КПА и замораживания-отогрева ха-
ка). Для образцов, криоконсервированных с
рактеризуются двумя параметрами - количе-
ПЭГ, процедура отмывки включала осаждение
ством клеток в зоне, соответствующей маркеру
клеток центрифугированием (800 g, 5-7 мин) с
контрольных показателей, и значением медианы
последующим разведением осажденных клеток
гистограммы распределения, показывающей ве-
равным объемом раствора, содержащего 150 мМ
личину, относительно которой клетки в выделен-
NaCl, 10 мМ трис-HCl (pH 7,4) с аналогичным ре-
ной зоне разделены на две равные по численно-
жимом центрифугирования. Аликвоты криокон-
сти части. Медиана гистограммы позволяет объ-
сервированных клеток (50 мкл), отобранные по-
ективно оценить сдвиг интенсивности окис-
сле размораживания, разводили в соответствую-
лительных процессов в клеточной суспензии по-
щих средах, содержащих КПА
(500 мкл), а
сле определенных воздействий на эритроциты,
клетки, отмытые от КПА, разводили аналогич-
даже если количество клеток в зоне, соответству-
ным образом в растворе Рингера с глюкозой и
ющей маркеру контрольных показателей, не ме-
хранили на протяжении 18 ч при 5°С. По оконча-
няется. Инкубирование эритроцитов в среде
нии периода хранения концентрацию клеток
Рингера с глюкозой характеризует контрольные
снижали до 4 · 107 кл./мл путем разведения в со-
параметры интенсивности флуоресценции DCF в
ответствующих средах аналогично тому, как опи-
эритроцитах, относительно которых фиксируют-
сано выше. Инкубирование эритроцитов с
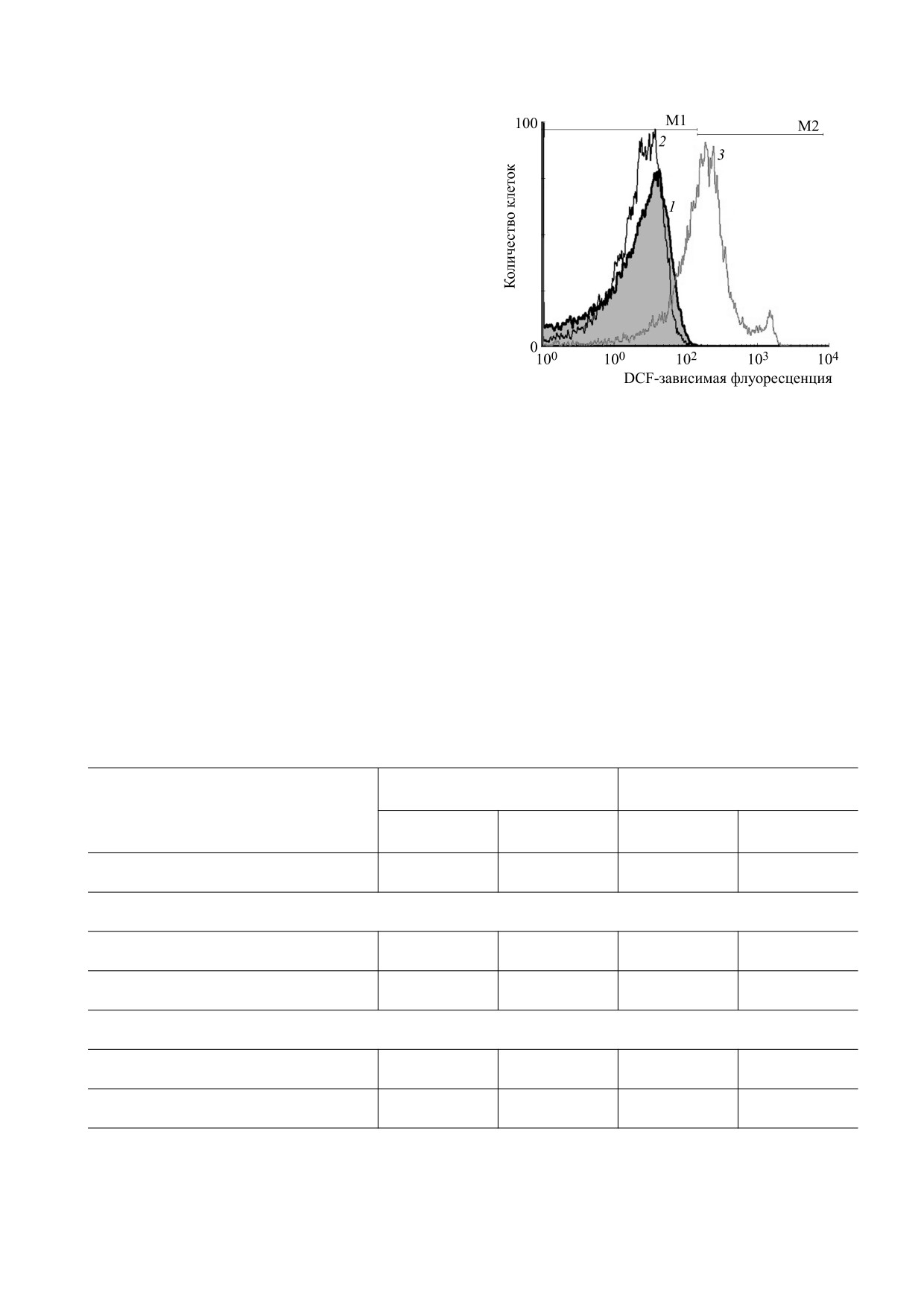
ся изменения (рис. 1, кривая 1).
DCFH-DA и измерение показателей флуоресцен-
На первом этапе криоконсервирования клетки
ции DCF методом проточной цитометрии выпол-
инкубируют с КПА, поэтому необходимо пони-
нено в соответствии с вышеописанными проце-
мать, как сами криопротекторные среды влияют
дурами.
на баланс окислительно-восстановительных про-
Данные анализировали с помощью програм-
цессов в эритроцитах. Действие глицерол-манни-
мы WinMDI 2.8 (Scripps Research Institute, США).
тольной смеси не приводило к появлению клеток
Статистическую обработку результатов выполня-
с более интенсивным свечением (рис.
1,
ли с использованием программного пакета Stat-
кривая 2), чем в контроле, что подтверждалось
graphics plus 2.1 for Windows (Statistical Graphics
данными количественного анализа гистограмм
Corp., США). Данные были протестированы на
распределения клеток (табл. 1). Однако медиана
нормальность распределения с помощью теста
гистограммы указывает на изменение интенсив-
Колмагорова-Смирнова и представлены в виде
ности образования АФК в таких клетках, по-
M ± SD (среднее значение ± стандартное откло-
скольку отмечается ее сдвиг в сторону меньших
БИОФИЗИКА том 64
№ 4
2019
ОБРАЗОВАНИЕ АКТИВНЫХ ФОРМ КИСЛОРОДА
709
количество клеток в зоне маркера контрольных
показателей (табл. 1). Кроме того, значение меди-
аны гистограмм более чем в два раза превосходит
аналогичный показатель контрольных образцов
(табл. 1). Такие изменения свидетельствуют об
интенсификации окислительных процессов в
эритроцитах в присутствии ПЭГ. Очевидно, что
главное отличие ПЭГ от глицерола связано с эк-
зоцеллюлярным механизмом его действия, что,
прежде всего, предполагает потерю клетками во-
ды, повышение внутриклеточной концентрации
солей и перераспределение ионов. Изменения
ионного состава внутриклеточной среды могут
повлиять на структурное состояние белков и их
конформационные переходы, связанные с осу-
ществлением ферментативных процессов, что
увеличивает риск образования АФК.
Рис. 1. Влияние КПА на интенсивность образования
Оценка изменений интенсивности образова-
АФК в эритроцитах после инкубации в течение 18 ч
при 37°С: 1 - контроль (гистограмма серого цвета),
ния АФК в размороженных эритроцитах была
2 - глицерол (3,25 М) + маннитол (0,22 М), 3 - ПЭГ
выполнена после гипотермического хранения
(0,2 М).
клеток. Гипотермическое хранение позволяет
лучше понять отсроченные последствия крио-
консервирования для функционирования раз-
значений. Такие изменения могут быть обуслов-
личных субклеточных компонентов. Кроме того,
лены замедлением интенсивности метаболиче-
при использовании криоконсервированных кле-
ских процессов и стабилизацией белков в присут-
ток нередко возникают ситуации, при которых
ствии глицерола, что снижает вероятность обра-
трансфузия откладывается на определенный пе-
зования АФК в клетках. Кроме того, оба
риод, что предполагает необходимость их хране-
компонента криопротекторной смеси, глицерол
ния в условиях гипотермии. При этом криопро-
и маннитол [18,19], обладают свойствами скавен-
текторы могут оставаться в среде в течение всего
джеров свободных радикалов, что также может
периода хранения или предварительно удаляют-
объяснять снижение уровня АФК в эритроцитах в
ся. Удаление эндоцеллюлярного криопротектора
процессе инкубирования, поскольку данные ве-
глицерола из суспензии криоконсервированных
щества конкурируют с DCF при взаимодействии
клеток - важный этап их подготовки к возвраще-
с Н2О2.
нию в физиологические условия [8]. Экзоцеллю-
Инкубация эритроцитов в присутствии ПЭГ
лярный криопротектор можно не удалять из кле-
приводила к сдвигу гистограммы распределения
точной суспензии, поскольку он не проникает че-
клеток по показателям интенсивности флуорес-
рез мембрану, и его концентрация могла бы
ценции DCF в сторону больших значений (рис. 1,
уменьшаться путем разведения в плазме в случае
кривая 3). Прежде всего, значимо уменьшается
трансфузии. Однако перенос эритроцитов, крио-
Таблица 1. Количественная оценка гистограмм распределения эритроцитов по показателям интенсивности
флюоресценции DCF при инкубации в растворах криопротекторов
Среды инкубирования
Количество клеток, %
Медиана, усл. ед.
Раствор Рингера с глюкозой (контроль)
99.8 ± 0.01
26.9 ± 3.1
Глицерол (3.25 М) + маннитол (0.22 М)
99.8 ± 0.01
16.3 ± 3.2*
ПЭГ (0.2 М)
87.9 ± 7.6*
66.7 ± 5.9*
Примечание. * Данные значимо отличаются от контрольных показателей с уровнем значимости р < 0.05.
БИОФИЗИКА том 64
№ 4
2019
710
ЗЕМЛЯНСКИХ и др.
консервированных под защитой экзоцеллюляр-
ного криопротектора, в раствор Рингера с глюко-
зой после удаления защитного соединения позво-
ляет оценить, насколько обратимыми являются
модификации субклеточных компонентов, вы-
званных процессами замораживания-отогрева
клеток. Поэтому эритроциты хранили как в при-
сутствии КПА, так и в растворе Рингера с глюко-
зой после их удаления.
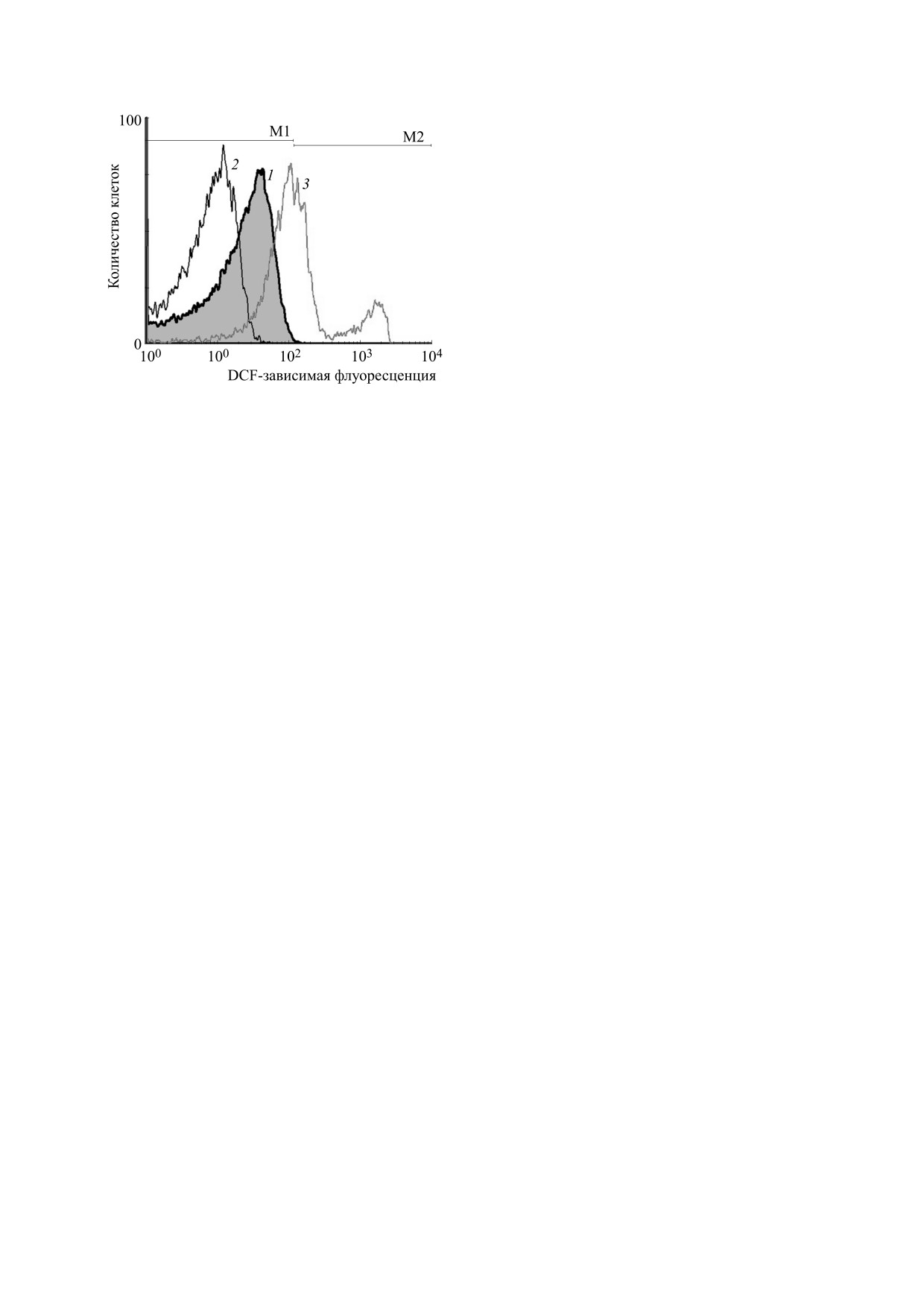
Этап размораживания клеток характеризует их
наиболее существенные повреждения, поскольку
в присутствии защитных сред многие сублеталь-
ные нарушения не обнаруживают себя и количе-
ство целых клеток на данном этапе может быть
значительно выше, чем количество жизнеспособ-
ных. После гипотермического хранения разморо-
женных эритроцитов в присутствии глицерола
Рис. 2. Интенсивность образования АФК в криокон-
(рис. 2, кривая 2) образование АФК в клетках не
сервированных эритроцитах после хранения в тече-
отличалось от показателей контрольных клеток.
ние 18 ч при 4°С в присутствии криопротекторных
Тем не менее гистограммы распределения размо-
агентов: 1 - контроль (гистограмма серого цвета), 2 -
роженных клеток по интенсивности флуоресцен-
глицерол (3,25 М) + маннитол (0,22 М), 3 - ПЭГ
ции DCF все же значимо отличались от клеток,
(0,2 М).
инкубированных в присутствии данного крио-
протектора без замораживания (табл. 1 и 2). Та-
граммах можно выделить вторую зону М2, кото-
кой прирост значений медианы может указывать
рая охватывает клетки с высокой интенсивно-
на возможность структурных нарушений в клет-
ках, приводящих к некоторому увеличению обра-
стью образования АФК. Анализ гистограмм
зования АФК, компенсирующему предшествую-
(табл. 2) показывает, что количество таких клеток
щее снижение данных показателей.
может достигать 45%, а значение медианы зоны
М2 по интенсивности флуоресценции DCF семи-
Гипотермическое хранение размороженных
эритроцитов в присутствии ПЭГ характеризова-
восьмикратно превышает контрольные значения.
лось существенной активизацией образования
Кроме того, в зоне М1 интенсивность флуорес-
АФК (рис. 2, кривая 3). В данном случае на гисто-
ценции DCF превышает контрольные показате-
Таблица 2. Количественная оценка гистограмм распределения криоконсервированных эритроцитов по показа-
телям интенсивности флюоресценции DCF в присутствии криопротекторов и после их удаления
Количество клеток, %
Медиана, усл. ед.
Экспериментальные группы
М1
М2
М1
М2
Раствор Рингера с глюкозой (контроль)
100
-
25.9 ± 3.1
-
Криоконсевированные эритроциты в присутствии криопротекторов
Глицерол (3.25 М) + маннитол (0.22 М)
99.9 ± 0.01
-
27.5 ± 4.9
-
ПЭГ (0.2 М)
55.2 ± 19.1*
45.94 ± 18.9
36.6 ± 15.8*
191.0 ± 40.6
Криоконсевированные эритроциты после удаления криопротекторов
Глицерол (3.25 М) + маннитол (0.22 М)
99.85 ± 0.01
-
9.6 ± 1.7*
-
ПЭГ (0.2 М)
64.2 ± 15.2*
37.0 ± 14.2
43.8 ± 7.0*
155.7 ± 24.3
Примечание. * Данные значимо отличаются от контрольных показателей с уровнем значимости р < 0.05.
БИОФИЗИКА том 64
№ 4
2019
ОБРАЗОВАНИЕ АКТИВНЫХ ФОРМ КИСЛОРОДА
711
медиан гистограмм распределения после удале-
ния криопротекторов.
Анализ гистограмм распределения показате-
лей флуоресценции DCF в эритроцитах, крио-
консервированных в присутствии ПЭГ после уда-
ления криопротектора и переноса в среду Ринге-
ра с глюкозой показал, что в условиях
гипотермического хранения интенсивность
окислительных процессов в целом не отличается
от показателей при хранении эритроцитов в при-
сутствии криопротектора (рис.
3, кривая
3;
табл. 2). Даже потеря части клеток на этапе удале-
ния КПА не останавливает развитие окислитель-
ных процессов, что указывает на достаточно се-
рьезные нарушения в таких эритроцитах струк-
турных и функциональных свойств субклеточных
элементов, являющихся источниками образова-
Рис. 3. Образование АФК в криоконсервированных
ния АФК. По-видимому, неспособность крио-
эритроцитах в отсутствиe КПА при хранении в
консервированнных в присутствии ПЭГ эритро-
течение 18 ч при 4°С: 1 - контроль (гистограмма
серого цвета); 2 - глицерол (3,25 М) + маннитол
цитов поддерживать свою целостность после пе-
(0,22 М); 3 - ПЭГ (0,2 М).
реноса в физиологические условия in vitro в
значительной мере может быть связана с окисли-
тельными повреждениями субклеточных элемен-
ли почти в два раза, о чем свидетельствует значе-
тов.
ние медианы (табл. 2). Интенсификация образо-
Таким образом, использование глицерол-ман-
вания АФК в криконсевированных под защитой
нитольной смеси снижает образование АФК при
ПЭГ клеток характеризует значительные субли-
положительной температуре и предотвращает
тические повреждения клеток. Сохранив целост-
развитие окислительных процессов в процессе
ность, такие клетки фиксируются датчиками про-
криоконсервирования и последующего гипотер-
точного цитометра и вносят существенный вклад
мического хранения. В присутствии ПЭГ даже в
в показатели интенсивности образования АФК.
процессе инкубации при положительной темпе-
Гипотермическое хранение криоконсервиро-
ратуре отмечается активация образования АФК, а
ванных эритроцитов после удаления глицерола и
замораживание-отогрев и последующее хранение
ПЭГ также выявляет существенные различия в
криоконсервированных клеток в условиях гипо-
образовании АФК в таких клетках. Как видно из
термии еще усиливают развитие окислительных
данных, представленных на рис. 3 и в табл. 2, ме-
процессов.
диана гистограмм распределения интенсивности
флуоресценции DCF в эритроцитах, криоконсер-
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
вированных в присутствии глицерола, статисти-
чески ниже, чем в контрольной среде. Кроме то-
Определение окисленных форм гемоглобина,
го, в суспензии отсутствуют клетки, которые име-
а именно метгемоглобина как маркера развития
ли бы показатели флуоресценции, превышающие
окислительных процессов в эритроцитах, показа-
контрольные значения. Все это указывает на ста-
ло, что его уровень не меняется при криоконсер-
бильность метаболических характеристик кле-
вировании и длительном хранении эритроцитов
ток, криоконсервированных в присутствии гли-
при -80°С в присутствии 40%-го глицерола [20].
церола после удаления криопротектора и перено-
Использование экзоцеллюлярных КПА трегало-
са в среду Рингера с глюкозой в условиях
зы и декстрана для защиты эритроцитов при за-
гипотермического хранения. Причины снижения
мораживании также не вызывало изменений
интенсивности флуоресценции в первую очередь
уровня метгемоглобина [21]. Вместе с тем необхо-
могут быть связаны с изменениями субпопуляци-
димо отметить, что метгемоглобин (HbFe(III))
онного состава суспензий эритроцитов после
может обратимо восстанавливаться до дезоксиге-
криоконсервирования и удаления КПА, что обу-
моглобина с помощью фермента NADH-цито-
словлено лизисом части эритроцитов на каждом
хром b5-metHb-редуктазы [22], что влияет на об-
из этих этапов. Логично предположить, что лизи-
щую оценку окислительных процессов в клетке.
су подвергаются субпопуляции старых эритроци-
К тому же окислению подвергается не только ге-
тов, чувствительных к различным стрессам [17].
моглобин, но и другие макромолекулы, вслед-
Поэтому преобладание в суспензиях зрелых и
ствие чего могут существенно изменяться свой-
юных эритроцитов с высоким антиоксидантным
ства мембраны [23,24]. Поэтому определение об-
потенциалом обусловливает снижение значений
разующихся АФК является более чувстви-
БИОФИЗИКА том 64
№ 4
2019
712
ЗЕМЛЯНСКИХ и др.
тельным методом оценки развития окислитель-
мораживания-отогрева связана с присутствием
ных процессов.
КПА в непосредственном окружении белковых
молекул.
Известно, что основным источником АФК в
эритроцитах является спонтанное автоокисление
В противоположность трегалозе и декстрану,
гемоглобина, в результате чего образуется метге-
которые в процессе криоконсервирования эрит-
моглобин (HbFe(III)) и супероксидный радикал
роцитов не выявили признаков стимулирования
(O•-), который имеет очень короткий период
окислительных процессов [21], ПЭГ даже при по-
«жизни» и быстро превращается в Н2О2 под влия-
ложительной температуре способствовал интен-
сификации образования АФК, и данная тенден-
нием супероксиддисмутазы [25]. Образовавшаяся
Н2О2 может участвовать в дальнейшем окисле-
ция усиливалась при гипотермическом хранении
криоконсервированных эритроцитов. По своим
нии гемоглобина. В результате таких реакций ге-
физико-химическим свойствам ПЭГ существен-
моглобин окисляется с образованием оксофер-
рил-гемоглобина (HbFe(IV)=O) и радикальной
но отличается от глицерола [35]. Основное отли-
чие данных соединений связано с их способно-
формы феррилгемоглобина (•HbFe(IV)=O) [26].
стью исключаться из гидратных слоев воды, окру-
Взаимодействие белковой и геммовой частей
окисленного гемоглобина ослабевает [27,28], что
жающих макролекулы и биомикроповерхности,
приводит к диссоциации гемма и его дальнейшей
на которых экспонированы различные химиче-
деградации. В частности, возможно образование
ские группы, или преимущественно взаимодей-
необратимых зеленых производных гемоглобина,
ствовать с ними [35]. Благоприятные взаимодей-
включая холеглобин и сульфгемоглобин [29,30],
ствия между сольвентами (глицерол и ПЭГ) и
которые имеют ковалентно модифицированное
презентующими макромолекулы химическими
порфириновое кольцо и могут взаимодействовать
группами означают, что сольвент предпочтитель-
с клеточными компонентами по гидрофобному
но связывается с ними, а не водой. В то же время
механизму.
при неблагоприятных взаимодействиях для соль-
Вторым важным источником образования
вента, равно как и химических групп, энергетиче-
АФК в эритроцитах могут быть NADPH-оксида-
ски более выгодно связываться с водой, а не меж-
зы (NOX). В серповидных эритроцитах было по-
ду собой. Способность глицерола лишь слабо
казано, что значительная часть образования АФК
благоприятно взаимодействовать с атомами С
опосредуется ферментативной активностью NOX
ароматических соединений и атомами N амид-
[31]. В эритроцитах были идентифицированы че-
ных и катионных групп и неблагоприятно взаи-
тыре из пяти известных типов NOX (NOX1, 2, 4
модействовать с атомами О амидов и карбоксила-
и 5), которые существенно различаются по меха-
тов, а также ионами солей делает его хорошим
низму сборки и регуляции их активности [32,33].
стабилизатором макромолекул. В тоже время
Следует отметить, что Ca2+ играет особую роль в
ПЭГ через внутренние группы полимерной цепи
регуляции NOX, поскольку он является ключе-
может сильно благоприятно взаимодействовать с
вым активатором протеинкиназ C, фосфорили-
атомом С алифатических соединений. Это позво-
рующих составные компоненты NOX-комплек-
ляет предположить, что в стрессовых условиях
сов, и прямым активатором наиболее простой
структурной формы NOX5 [32,34].
осмотического сжатия клеток или в процессе за-
мораживания-отогрева, когда молекулы мембра-
Очевидно, что влияние КПА на образование
ны изменяют свои структурные характеристики,
АФК в эритроцитах в процессе криоконсервиро-
ПЭГ может включаться в благоприятные взаимо-
вания носит индивидуальный характер, т.е. опре-
действия с отдельными химическими группами
деляется физико-химическими свойствами рас-
макромолекул, изменяя их функциональные ха-
твора исследованных химических соединений.
Глицерол-маннитольная смесь не только не спо-
рактеристики. В частности, это может касаться
собствовала окислительным процессам, но даже
активности Са2+-АТФазы, единственной систе-
снижала интенсивность образования АФК в
мы активного транспорта Ca2+ в эритроцитах че-
эритроцитах при инкубации. Кроме того, замора-
ловека. Ранее было установлено, что ПЭГ и гли-
живание-отогрев и последующее гипотермиче-
ское хранение продемонстрировали стабиль-
церол по-разному влияют на активность Са2+-
ность метаболических и структурных характери-
АТФазы [36-38]. В присутствии ПЭГ отмечалось
стик эритроцитов, с которыми связаны реакции
резкое снижение ферментативной активности
образования АФК. Установленные факты согла-
Са2+-насоса [36,37] и
10-кратное увеличение
суются с ранее отмеченными данными об отсут-
[Ca2+]in в эритроцитах [39] даже в изотонической
ствии метгемоглобина в криоконсервированных
под защитой глицерола эритроцитах [20]. Воз-
полиэтиленгликольсодержащей среде. В то же
можно, стабильность гемоглобина в процессе за-
время инкубирование эритроцитов в гипертони-
БИОФИЗИКА том 64
№ 4
2019
ОБРАЗОВАНИЕ АКТИВНЫХ ФОРМ КИСЛОРОДА
713
ческом растворе глицерола сопровождалось мед-
тов связаны в значительной степени с окислени-
ленным ростом интенсивности флуоресценции
ем белков мембранно-цитоскелетного комплек-
Fluo-4 на протяжении 30 мин, не превышая кон-
са, в частности белка полосы 3 [47]. Во фракции
трольные значения более чем на 30% [40]. Поэто-
старых эритроцитов, характеризующихся повы-
шенным содержания MetHb, обнаружено взаи-
му Са2+-зависимый механизм образования АФК,
модействие последнего с белком полосы 3, кото-
связанный с активацией NOX, может вносить су-
рое, однако, происходит только в случае, если
щественный вклад в интенсификацию окисли-
данный интегральный белок также подвергается
тельных процессов в эритроцитах в присутствии
перекисному окислению. Предполагают, что ме-
ПЭГ. При этом усиление образования АФК мо-
ханизм комбинированного действия перекисного
жет еще более инактивировать Са2+-АТРазу, по-
окисления белка полосы 3 и MetHb включает вы-
скольку повышение уровня АФК как во вне-, так
сокоаффинное кооперативное связывание
и внутриклеточной среде сопровождалось окис-
MetHb с цитоплазматическим доменом окислен-
лением -SH групп белков и уменьшением актив-
ной формы белка полосы 3 благодаря его карбо-
ности Са2+-АТФазы [41,42]. Инактивация фер-
нилированию. Эта модификация приводит к дис-
ментативной активности Са2+-насоса имела как
социации анкирина от белка полосы
3 и
обратимую, так и необратимую составляющую,
позволяет тетрамерному MetHb сшивать полу-
что было связано с окислением -SH-групп, недо-
ченные димеры с образованием кластеров [47].
ступных для восстанавливающего действия глу-
Кроме того, при значительных физических на-
грузках, сопровождаемых окислительным стрес-
татиона в клетке. Кроме того, окисление Са2+-
сом, было установлено повышение фосфорили-
АТФазы приводит к нарушениям ее регуляции
рования тирозина белка полосы 3, что приводило
кальмодулином (СаМ) [43], что не позволяет
к изменению его структуры [48]. Фосфорилиро-
клетке адекватно реагировать на сигналы, на-
вание белка полосы 3 в таких условиях происходит
правленные на контроль уровня внутриклеточно-
благодаря окислению критических
-SH-групп
го Ca2+. Увеличение образования АФК может
мембранной фосфатазы, регулирующей баланс
также приводить к структурным изменениям са-
фосфорилирования-дефосфорилирования. По-
мого кальмодулина, который опосредует Ca2+-
добные изменения, связанные с окислением бел-
сигнал в регуляции структурного состояния и
ка полосы 3, его взаимодействием с окисленными
функциональной активности различных типов
формами гемоглобина и диссоциацией анкири-
белков, включая Са2+-АТФазу. В частности,
на, могут происходить в криоконсервированных
окисление метиониновых остатков СаМ стабили-
под защитой ПЭГ эритроцитах, что определяет их
нестабильность в физиологических условиях
зирует Са2+-АТФазу плазматической мембраны в
in vitro. Важно отметить, что антиоксидантный
неактивной конформации, что может быть ча-
белок пероксиредоксин-2 также взаимодействует
стью адаптивного ответа клетки [44] или сигна-
с цитоплазматическим доменом белка полосы 3
лом к развитию эриптоза. Кроме того, окислен-
[49]. Пероксиредоксин подвергается конформа-
ный СаМ влияет на активность протеинкиназ, в
ционному изменению после его связывания с
частности Ca2+/СаМ-зависимую протеинкиназу
белком полосы 3 без потери его пероксидазной
II [45], осуществляющую регуляторное фосфори-
активности. Было показано, что окисление белка
лирование некоторых белков. Таким образом,
полосы 3, индуцированное фенилгидразином,
интенсификация образования АФК в эритроци-
предотвращало ассоциацию пероксиредоксина с
тах, наблюдаемая при криоконсервировании в
мембраной, что указывает на снижение возмож-
присутствии ПЭГ, может иметь существенное
ностей для его функционирования в пределах
влияние на Ca2+- и СаМ-зависимые процессы
клетки. В этом свете представляет интерес ранее
регуляции структурно-функционального состоя-
обнаруженный факт изменения содержания пе-
ния компонентов мембранно-цитоскелетного
роксиредоксина 2 (белка полосы 8) в тенях крио-
комплекса, ответственных на поддержание це-
консервированных под защитой ПЭГ эритроци-
лостности клетки в условиях стресса.
тов [16], что косвенно может свидетельствовать
об окислении белка полосы 3 в таких условиях.
Последствия окислительных процессов для
эритроцитов связаны со снижением деформируе-
Таким образом, особенности изменения ско-
мости мембран, повышением мембранной дина-
рости образования АФК в эритроцитах под влия-
мической жесткости и уменьшением механиче-
нием инкубирования и замораживания-отогрева
ской стабильности
[46]. Данные изменения
в присутствии КПА могут оказывать значитель-
структурно-функциональных свойств эритроци-
ный регуляторный эффект на состояние мем-
БИОФИЗИКА том 64
№ 4
2019
714
ЗЕМЛЯНСКИХ и др.
бранно-цитоскелетного комплекса и стабиль-
21. C. Pellerin-Mendes, L. Million, M. Marchand-Arvier,
et al., Cryobiology 35 (2), 173 (1997).
ность клеток в стрессовых условиях, а также спо-
собность поддерживать их функциональную
22. T. J. Moore, C. S. Walsh, and M. R. Cohen, Arch. In-
tern. Med. 164 (11), 1192 (2004).
полноценность в физиологических условиях
23. A. N. Hashmi and M. Saleemuddin., Biochem. Mol.
in vitro после криоконсервирования. Особенно-
Biol. Int. 40 (3), 543 (1996).
сти физико-химических свойств глицерола и
24. A. G. Kriebardis, M. H. Antonelou, K. E. Stamoulis,
ПЭГ, очевидно, определяют структурно-функци-
et al., J. Cell. Mol. Med. 11 (1), 148 (2007).
ональные изменения клеточных компонентов, от
25. H. P. Misra and I. Fridovich, J. Biol. Chem. 247 (21),
которых зависит интенсивность образования
6960 (1972).
АФК. Допуская, что такие изменения включают
26. T. Kanias and J. P. Acker, FEBS J. 277 (2), 343 (2010).
Ca2+-зависимые механизмы активации образова-
27. N. Shaklai, N. Avissar, E. Rabizadeh, et al., Biochem.
ния АФК, можно попытаться использовать фар-
Int. 13 (3), 467 (1986).
мацевтические ингибиторы, блокирующие рост
28. J. W. Wyse and D. A. Butterfield, Biochim. Biophys.
[Ca2+]in, или дополнить криопротекторные среды
Acta. 979 (1), 121 (1989).
определенными антиоксидантами, чтобы снизить
29. C. C. Winterbourn, Environ. Health Perspect. 64, 321
негативные проявления нарушений субклеточных
(1985).
систем эритроцитов в процессе криоконсервиро-
30. M. Sztiller, M. Puchala, A. Kowalczyk, et al., Redox
вания в присутствии ПЭГ. Это может способство-
Rep. 11 (6), 263 (2006).
вать продвижению в разработке эффективных
31. A. George, S. Pushkaran, D. G. Konstantinidis, et al.,
способов низкотемпературного хранения клеток
Blood 121 (11), 2099 (2013).
под защитой экзоцеллюлярного КПА.
32. S. H. Goh, M. Josleyn, Y. T. Lee, et al, Physiol. Ge-
nomics 30 (2), 172 (2007).
33. A. Panday, M. K. Sahoo, D. Osorio, et al., Cell Mol.
СПИСОК ЛИТЕРАТУРЫ
Immunol. 12 (1), 5 (2015).
1. D. Gao and J. K. Critser, ILAR J. 41 (4), 187 (2000).
34. R. P. Brandes, N. Weissmann, and K. Schröder, Free
2. N. Mohandas and E. Evans, Annu. Rev. Biophys. Bio-
Radic. Biol. Med. 76, 208 (2014).
mol. Struct. 23, 787 (1994).
35. D. B. Knowles, I. A. Shkel, N. M. Phan, et al., Bio-
3. S. Voskou, M. Aslan, P. Fanis, et al., Redox Biol. 6, 226
chemistry 54 (22), 3528 (2015).
(2015).
36. N. G. Zemlyanskikh and M. V. Khomenko, Biologich-
4. S. G. Rhee, Mol. Cells 39 (1), 1 (2016).
eskie Membrany 23 (6), 484 (2006).
5. A. V. Peskin, N. Dickerhof, R. A. Poynton, et al., J.
37. N. G. Zemlianskykh and L. A. Babiychuk, Tsitologiia,
Biol. Chem. 288 (20), 14170 (2013).
58 (12), 964 (2016).
6. H. Sies, J. Biol. Chem. 289 (13), 8735 (2014).
7. H. H. Jang, K. O. Lee, Y. H. Chi, et al., Cell 117 (5),
38. N. G. Zemlyanskikh and O. A. Kofanova. Biochemis-
625 (2004).
try (Moscow) 71 (8), 900 (2006).
8. K. L. Scott, J. Lecak, and J. P. Acker, Transfus. Med.
39. Y. V. Kucherenko and I. Bernhardt, Ukr. Biokhim. Zh.
Rev. 19 (2), 127 (2005).
78 (6), 46 (2006).
9. K. Singbartl, R. Langer, and A. Henrich, Cryobiology
40. O. A. Kofanova, N. G. Zemlyanskikh, L. Ivanova,
36 (2), 115 (1998).
et al., Bioelectrochemistry 73 (2), 151 (2008).
10. L. A. Babijchuk and N. G. Zemlianskykh, Probl. Cryo-
41. R. P. Hebbel, O. Shalev, W. Foker, et al., Biochim. Bio-
biol., № 1, 35 (2001).
phys. Acta. 862 (1), 8 (1986).
11. C. T. Wagner, M. L. Martowicz, S. A. Livesey, et al.,
Cryobiology 45 (2), 153 (2002).
42. N. Pengpanichpakdee, T. Thadtapong, S. Auparakkita-
12. E. Jiménez-Trigos, C. Naturil-Alfonso, J. S. Vicente, et
non, et al., Southeast. Asian J. Trop. Med. Public.
al., Reprod. Domest. Anim. 48 (1), 15 (2013).
Health. 43 (5), 1252 (2012).
13. R. Morató, D. Izquierdo, J. L. Albarracín, et al., Mol.
43. K. D. Osborn, A. Zaidi, R. J. Urbauer, et al., Biochem-
Reprod. Dev. 75 (1), 191 (2008).
istry 44 (33), 11074 (2005).
14. M. N. Banday, F. A. Lone, F. Rasool, et al., Cryobiol-
44. B. Chen, M. U. Mayer, and T. C. Squier. Biochemistry
ogy 74, 25 (2017).
44 (12), 4737 (2005).
15. N. G. Zemlianskykh and L. A. Babijchuk, Biologiches-
kie Membrany 36 (2), 125 (2019).
45. A. J. Robison, D. G. Winder, R. J. Colbran, et al., Bio-
16. S. Sharma, V. Punjabi, S. M. Zingde, et al., J. Membr.
chem. Biophys. Res. Commun. 356 (1), 97 (2007).
Biol. 247 (11), 1181 (2014).
46. F. A. Kuypers, M. D. Scott, M. A. Schott, et al., J. Lab.
17. K. Gwozdzinski, A. Pieniazek, S. Tabaczar, et al., Exp.
Clin. Med. 116 (4), 535 (1990).
Physiol. 102 (2), 190 (2017).
47. N. Arashiki, N. Kimata, S. Manno, et al., Biochemistry
18. K. J. Davies and A. L. Goldberg. J. Biol. Chem. 262
52 (34), 5760 (2013).
(17), 8227 (1987).
48. Y. Xiong, Y. Li, Y. Xiong, et al., Cell Physiol. Biochem.
19. J. Bhattacharyya and A. G. Datta, J. Physiol. Pharma-
32 (4), 1060 (2013).
col. 52 (1), 145 (2001).
20. J. Lecak, K. Scott, C. Young, et al., Transfusion 44 (9),
49. A. Matte, M. Bertoldi, N. Mohandas, et al., Free Rad-
1306 (2004).
ic. Biol. Med. 55, 27 (2013).
БИОФИЗИКА том 64
№ 4
2019
ОБРАЗОВАНИЕ АКТИВНЫХ ФОРМ КИСЛОРОДА
715
Production of Reactive Oxygen Species in Human Erythrocytes on Cryopreservation
with Glycerol and Polyethylene Glycol
N.G. Zemlyanskikh and L.A. Babiychuk
Institute for Problems of Cryobiology and Cryomedicine, National Academy of Sciences of Ukraine,
Pereyaslavskaya ul. 23, Kharkov, 61016 Ukraine
The study is aimed to examine reactive oxygen species production in human erythrocytes during incubation
of erythrocytes with a glycerol-mannitol mixture and polyethylene glycol with a molecular weight of 1500, as
well as when red blood cells were frozen with a glycerol-mannitol mixture and polyethylene glycol and stored
under hypothermic conditions. Analysis of reactive oxygen species production was performed by fluores-
cence-based flow cytometry using dichlorofluorescein as a fluorescent probe for reactive oxygen species
measurement. It has been established that incubation in the glycerol-mannitol mixture, as well as cryopres-
ervation and subsequent hypothermic storage did not favor production of reactive oxygen species in erythro-
cytes. Polyethylene glycol caused a significant increase in the reactive oxygen species production both in
terms of incubation and storage of cryopreserved erythrocytes under hypothermic conditions. Peculiarities of
changes in the intensity of reactive oxygen species production in erythrocytes under the influence of cryopro-
tective agents and cryopreservation can have a significant impact on the stability of cells under stressful con-
ditions and their capacity to maintain functional adequacy when returning to physiological conditions.
Keywords: reactive oxygen species, erythrocyte, cryopreservation, cryoprotectant, polyethylene glycol, glycerol
БИОФИЗИКА том 64
№ 4
2019