БИОФИЗИКА, 2019, том 64, № 4, с. 720-725
БИОФИЗИКА КЛЕТКИ
УДК 577.3
К ВОПРОСУ О МОЛЕКУЛЯРНЫХ МЕХАНИЗМАХ ДЕЙСТВИЯ
«НУЛЕВОГО» МАГНИТНОГО ПОЛЯ НА ПРОДУКЦИЮ АКТИВНЫХ
ФОРМ КИСЛОРОДА В НЕАКТИВИРОВАННЫХ НЕЙТРОФИЛАХ
© 2019 г. В.В. Новиков, Е.В. Яблокова, Э.Р. Валеева, Е.Е. Фесенко
Институт биофизики клетки РАН - обособленное подразделение ФИЦ «Пущинский научный центр
биологических исследований РАН»,
142290, Пущино Московской области, ул. Институтская, 3
E-mail: docmag@mail.ru
Поступила в редакцию 17.03.2019 г.
После доработки 15.04.2019 г.
Принята к публикации 24.04.2019 г.
Показано, что обнаруженное нами ранее снижение интенсивности процессов окисления 2,7-ди-
хлордигидрофлуоресцеина в неактивированных нейтрофилах в гипомагнитных условиях (остаточ-
ное постоянное магнитное поле 20 нТл) не зависит от кальций-опосредованных регуляторных ме-
ханизмов, о чем свидетельствует отсутствие действия внутриклеточного хелатора ионов кальция
(ацетоксиметилового эфира 1,2-бис(2-аминофенокси)этан-N,N,N',N'-тетрауксусной кислоты) на
интенсивность этого процесса. Это снижение вряд ли обусловлено влиянием гипомагнитных усло-
вий на фосфорилирование компонентов НАДФН-оксидазы, так как добавка ингибитора протеин-
киназы С (Ro 31-6233) практически не отразилась на интенсивности флуоресценции внутриклеточ-
ного дихлордигидрофлуоресцеина. Добавка ингибитора фосфолипазы С (U73122) незначительно и
приблизительно одинаково снизила продукцию активных форм кислорода как в контроле, так и в
опыте. Апоцинин в разных концентрациях вызывал рост продукции активных форм кислорода в
неактивированных нейтрофилах, приблизительно в два раза менее выраженный в гипомагнитных
условиях. Об участии электрон-транспортной цепи митохондрий в механизме эффекта «нулевого»
поля свидетельствует снижение продукции активных форм кислорода при добавке ротенона, зна-
чительно более выраженное в опытных образцах.
Ключевые слова: гипомагнитное поле, нейтрофилы, активные формы кислорода, флуоресценция, ионы
кальция, протеинкиназа С, фосфолипаза С, митохондрии.
DOI: 10.1134/S0006302919040100
Met-Leu-Phe или форболового эфира форбол-12-
В литературе имеется ряд сообщений о сниже-
меристат-13-ацетата - этот эффект гипомагнит-
нии продукции активных форм кислорода (АФК)
в гипомагнитных условиях в различных типах
ного поля сохранялся [5]. Учитывая то, что эф-
клеток и при различной экспозиции [1-4]. Ранее
фект действия гипомагнитного поля проявлялся
нами было показано, что 1,5-часовое экспониро-
в опытах на нейтрофилах без дополнительной их
вание перитонеальных нейтрофилов мышей при
стимуляции и, следовательно, был обусловлен не
магнитном экранировании в гипомагнитных
нарушением ответа нейтрофилов на активаторы
условиях (остаточное постоянное магнитное поле
респираторного взрыва, нами, с целью определе-
менее 20 нТл) вызывает снижение базовой внут-
ния возможных молекулярных механизмов этого
риклеточной продукции активных форм кисло-
действия «нулевого» поля, проведен комплекс
рода, регистрируемое по изменению интенсивно-
специальных исследований на неактивирован-
сти флуоресценции продуктов окисления 2,7- ди-
ных нейтрофилах. Напротив, в условиях воздей-
хлордигидрофлуоресцеина и дигидрородамина
ствия комбинированных магнитных полей с
123 [5]. При дополнительном введении малых
определенными параметрами [6,7] отмечено сти-
концентраций активаторов респираторного
мулирующее действие этих магнитных полей на
взрыва - формилированного пептида N-formyl-
продукцию АФК в суспензии нейтрофилов [8]. В
этой связи особый интерес представляет сравне-
DA - 2,7-дихлордигидрофлуоресцеина диацетат, BAPTA ние ключевых моментов молекулярных механиз-
AM - ацетоксиметиловый эфир 1,2-бис(2-аминофенок-
мов действия комбинированных магнитных по-
си)этан-N,N,N',N'-тетрауксусной кислоты.
лей [9-12] и «нулевого» магнитного поля.
720
К ВОПРОСУ О МОЛЕКУЛЯРНЫХ МЕХАНИЗМАХ
721
На данном этапе для анализа эффектов гипо-
в полипропиленовых пробирках типа Эппендорф
магнитных условий мы применили метод флуо-
при световой депривации. Заданную температуру
ресцентной спектроскопии с использованием хо-
поддерживали с помощью циркуляционного тер-
рошо изученного проникающего в клетки флуо-
мостата. Типичное время инкубации составляло
ресцентного зонда на АФК
-
2,7-
полтора часа. Образцы контрольных групп нахо-
дихлордигидрофлуоресцеина
диацетата
дились в локальном геомагнитном поле с посто-
(H2DCF-DA) [13-16]. H2DCF-DA проникает в
янной составляющей ∼42 мкТл и уровнем маг-
клетку, где под действием внутриклеточных эсте-
нитного фона на частоте 50 Гц 15-50 нТл.
раз переходит в форму H2DCF. H2DCF - слабо
флуоресцирующий агент, который в реакциях с
Установка для формирования гипомагнитных
окислителями превращается в сильно флуорес-
условий состояла из трех, вставленных соосно
цирующий продукт - дихлорфлуоресцеин.
один в другой, цилиндрических экранов магнит-
ного поля из пермаллоя (толщиной 1 мм). Вели-
Основными источниками АФК в неактивиро-
чина остаточного постоянного магнитного поля
ванных нейтрофилах могут являться ферментный
комплекс оксидазы фагоцитов, содержащей
не превышала 20 нТл. Ее определяли прямым из-
NOX2, а также единичные митохондрии [17-19].
мерением с помощью феррозондового датчика
Сборка и активность НАДФН-оксидазы напря-
Mag-03 MS 100 (Bartington, Великобритания).
мую зависят, прежде всего, от активностей фос-
Контрольные (геомагнитное поле) и опытные
фолипазы С и протеинкиназы С, и часто сопря-
(гипомагнитные условия) образцы по десять
жены с кальций-опосредованными регуляторны-
штук инкубировали одновременно. Опыты по-
ми механизмами [20]. В этой связи в работе для
вторяли не менее трех раз.
анализа молекулярного механизма действия ги-
До начала инкубации к части образцов добавля-
помагнитных условий на продукцию АФК в не-
ли по отдельности различные химические добавки:
активированных нейтрофилах были использова-
ны соответствующие химические ингибиторы.
хелатор внутриклеточного кальция - BAPTA AM
(ацетоксиметиловый эфир 1,2-бис(2-аминофенок-
си)этан-N,N,N',N'-тетрауксусной кислоты) (Sigma,
МАТЕРИАЛЫ И МЕТОДЫ
США) в концентрациях 2 или 4 мкМ; ингибитор
электрон-транспортной цепи митохондрий - роте-
Получение суспензии нейтрофилов. Работа вы-
нон (Sigma, США) в концентрации 1 мкМ; ингиби-
полнена на перитонеальных нейтрофилах мы-
тор НАДФН-оксидазы - апоцинин в концентраци-
шей. Для получения нейтрофилов использовали
ях 20 и 500 мкМ; ингибитор фосфолипазы С -
лабораторных мышей самцов линии CD-1 массой
U73122 (Sigma, США) в концентрации 2 мкМ и ин-
24-26 г, полученных из питомника лабораторных
гибитор протеинкиназы С - бисиндолилмалеимид
животных ФИБХ РАН (Пущино Московская об-
IV (Ro 31-6233) (Sigma, США) в концентрации
ласть). В перитонеальную полость мыши инъеци-
ровали 150 мкл суспензии опсонизированного
1 мкМ .
зимозана с концентрацией 5 мг/ мл (Zymozan A из
Флуоресцентное определение внутриклеточных
Saccharomyces carevisiae, Sigma, США). После
АФК. После 1,5-часовой инкубации в гипомаг-
этого через 12 ч животных умерщвляли методом
нитных условиях к суспензии нейтрофилов до-
ульнарной дислокации, их брюшную полость
бавляли флуоресцентный зонд на внутриклеточ-
промывали 3 мл охлажденного раствора Хенкса
ные АФК - 2,7-дихлордигидрофлуоресцеин ди-
без кальция. Экссудат собирали пипеткой и цен-
ацетат (H2DCF-DA) (Sigma, США) до конечной
трифугировали в течение 10 мин при 600 g. Супер-
концентрации 0,01 мг/мл. Пробы продолжали
натант декантировали, а осадок разводили в 2 мл
инкубировать в течение 30 мин при 37°С в темно-
бескальциевого раствора Хенкса и оставляли на
те, чтобы минимизировать фотооксидацию кра-
1 час при 4°C. Количество выделенных клеток
подсчитывали в камере Горяева. Жизнеспособ-
сителя. Затем клетки отмывали, центрифугируя
ность клеток определяли, используя витальный
при 600 g 10 мин при комнатной температуре в
краситель трипановый синий. Содержание жи-
растворе Хенкса. Далее к осадку добавляли 1 мл
вых клеток при этом составляло не менее 98%.
среды, ресуспендировали и регистрировали спек-
Для опытов образцы получали, разводя суспен-
тры флуоресценции образцов на приборе Thermo
зию нейтрофилов стандартной средой Хенкса
Scientific Lumina Fluorescence Spectrometer (Ther-
(138 мM NaCl, 6 мM KCl, 1 мМ MgSO4, 1 мM
mo Fisher Scientific, США) при возбуждении на
Na2HPO4, 5 мM NaHCO3, 5,5 мM глюкозы, 1 мM
длине волны 488 нм.
CaCl2, 10 мМ HEPES, pH 7,4; Sigma, США) до
Результаты статистически обработаны с при-
концентрации 1 млн кл/мл.
менением t-критерия Стьюдента. Часть результа-
Экспонирование суспензии нейтрофилов в гипо-
тов представлена как отношение максимальной
магнитном поле. Нейтрофилы инкубировали при
интенсивности флуоресценции при длине волны
37,0 ± 0,2°С в концентрации 1 млн/мл по 250 мкл
528 нм в опытах к контролю, принятому за 100%.
БИОФИЗИКА том 64
№ 4
2019
722
НОВИКОВ и др.
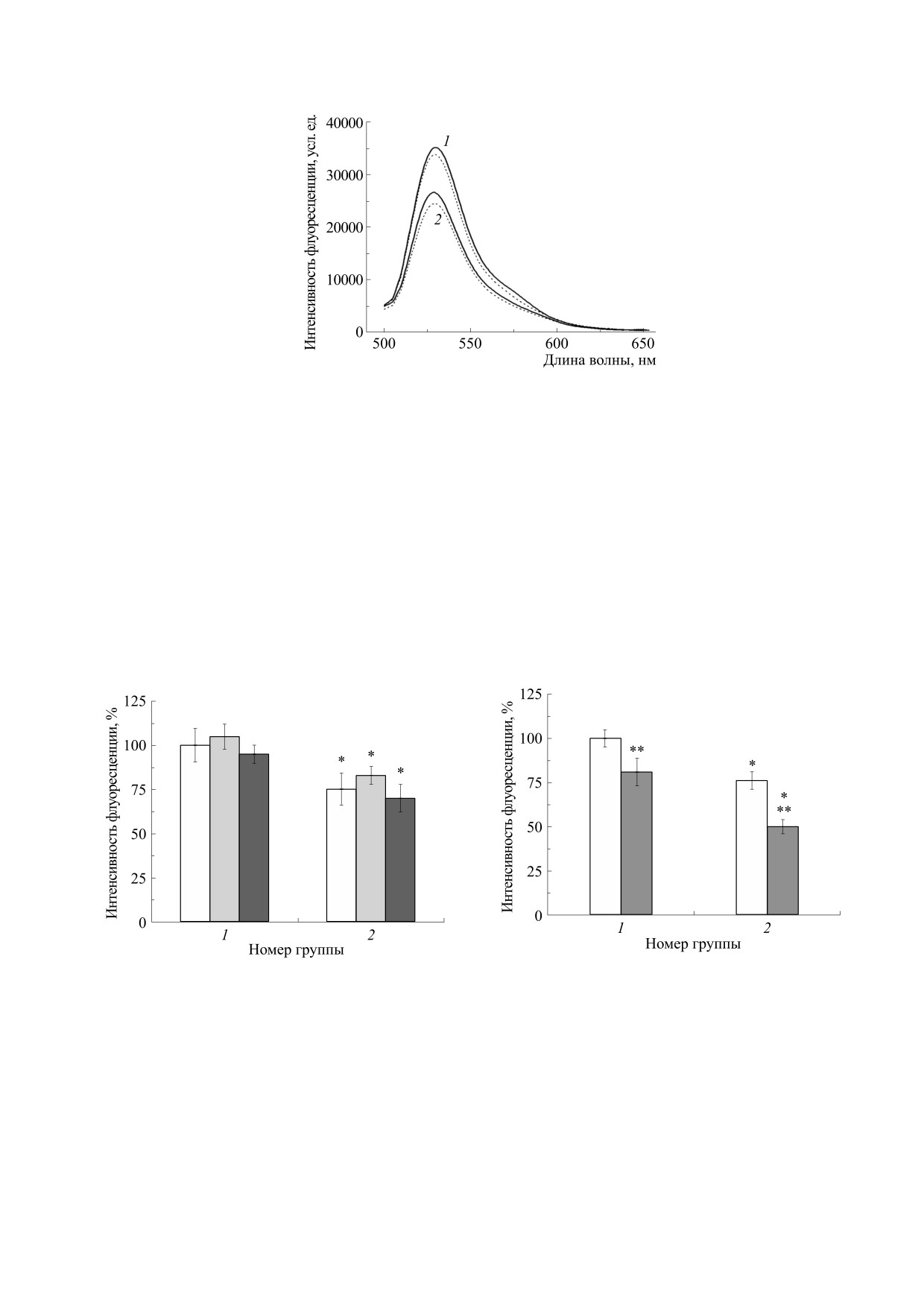
Рис. 1. Спектры флуоресценции дихлорфлуоресцеина в суспензии нейтрофилов в контроле (кривая 1) и в опыте (кри-
вая 2) - после действия гипомагнитного поля. Пунктирными линиями обозначены стандартные отклонения.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
нялись при использовании химических добавок,
примененных в дальнейших экспериментах.
Экспонирование перитонеальных нейтрофи-
Добавка в среду для инкубации нейтрофилов
лов в гипомагнитных условиях (при ослаблении
хелатора внутриклеточного кальция BAPTA AM в
геомагнитного поля примерно в 2000 раз) вызы-
концентрациях 2 и 4 мкМ практически не отрази-
вает значительное (на 25%) уменьшение интен-
лась на продукции внутриклеточных АФК в ней-
сивности флуоресценции внутриклеточного ди-
трофилах, как в контроле, так и в опыте (гипомаг-
хлорфлуоресцеина (рис. 1 и 2). Следует отметить,
нитные условия) (рис. 2). Это, по-видимому, сви-
что форма спектров и положение максимума ин-
детельствует
о независимости эффекта
тенсивности флуоресценции зонда в «нулевом»
«нулевого» магнитного поля от уровня внутри-
магнитном поле не изменялись относительно
клеточного кальция и в целом от кальций-зави-
этих параметров в контроле. Также они не изме-
Рис. 2. Влияние гипомагнитного поля на интенсив-
Рис. 3. Влияние гипомагнитного поля на интенсив-
ность флуоресценции дихлорфлуоресцеина в суспен-
ность флуоресценции дихлорфлуоресцеина в суспен-
зии нейтрофилов в отсутствие и в присутствии хела-
зии нейтрофилов в отсутствии и в присутствии роте-
тора внутриклеточного кальция - BAPTA AM. По оси
нона. По оси ординат - максимальная интенсив-
ординат - максимальная интенсивность флуорес-
ность флуоресценции в процентах по отношению к
ценции в процентах по отношению к базовому кон-
базовому контролю (средние значения и стандартные
тролю (средние значения и стандартные отклонения,
отклонения, n = 10), по оси абсцисс - номер группы
n = 10), по оси абсцисс - номер группы (1 - контроль,
(1 - контроль. 2 - опыт). Белый столбик - без доба-
2 - опыт). Белый столбик - без добавок, серый стол-
вок, серый столбик - добавка 1 мкМ ротенона. Звез-
бик - добавка 2 мкМ BAPTA AM, темный столбик -
дочкой отмечены достоверные отличия между груп-
добавка 4 мкМ BAPTA AM. Звездочкой отмечены до-
пами (P < 0,05), двумя звездочками - достоверные от-
стоверные отличия между группами (P < 0,05).
личия внутри группы (P < 0,05).
БИОФИЗИКА том 64
№ 4
2019
К ВОПРОСУ О МОЛЕКУЛЯРНЫХ МЕХАНИЗМАХ
723
опыте (на 35%) (рис. 3). Это свидетельствует об
участии митохондрий в исследуемом эффекте ги-
помагнитного поля и подтверждает их роль как
одного из основных продуцентов АФК в неакти-
вированных нейтрофилах [17,18]. В этой связи
следует отметить, что эффект комбинированных
магнитных полей был независим от введения
данного ингибитора в среду культивирования
нейтрофилов [12].
Добавка ингибитора фосфолипазы С U73122
снизила приблизительно одинаково (на ∼20%)
продукцию АФК как в контроле, так и в опыте
(рис. 4), тогда как добавка ингибитора протеин-
киназы С Ro 31-6233 практически не отразилась
на интенсивности флуоресценции внутриклеточ-
ного дихлорфлуоресцеина (рис. 5). Эти данные
коррелируют с показанной здесь ранее независи-
Рис. 4. Влияние гипомагнитного поля на интенсив-
ность флуоресценции дихлорфлуоресцеина в суспен-
мостью этого эффекта «нулевого» поля от каль-
зии нейтрофилов в отсутствиe и в присутствии инги-
ций-опосредованных регуляторных механизмов
битора фосфолипазы С - U73122. По оси ординат -
и в целом не подтверждают участия процессов
максимальная интенсивность флуоресценции в про-
фосфорилирования компонентов НАДФН-окси-
центах по отношению к базовому контролю (средние
дазы в механизмах этого эффекта.
значения и стандартные отклонения, n = 10), по оси
абсцисс - номер группы (1 - контроль, 2 - опыт). Бе-
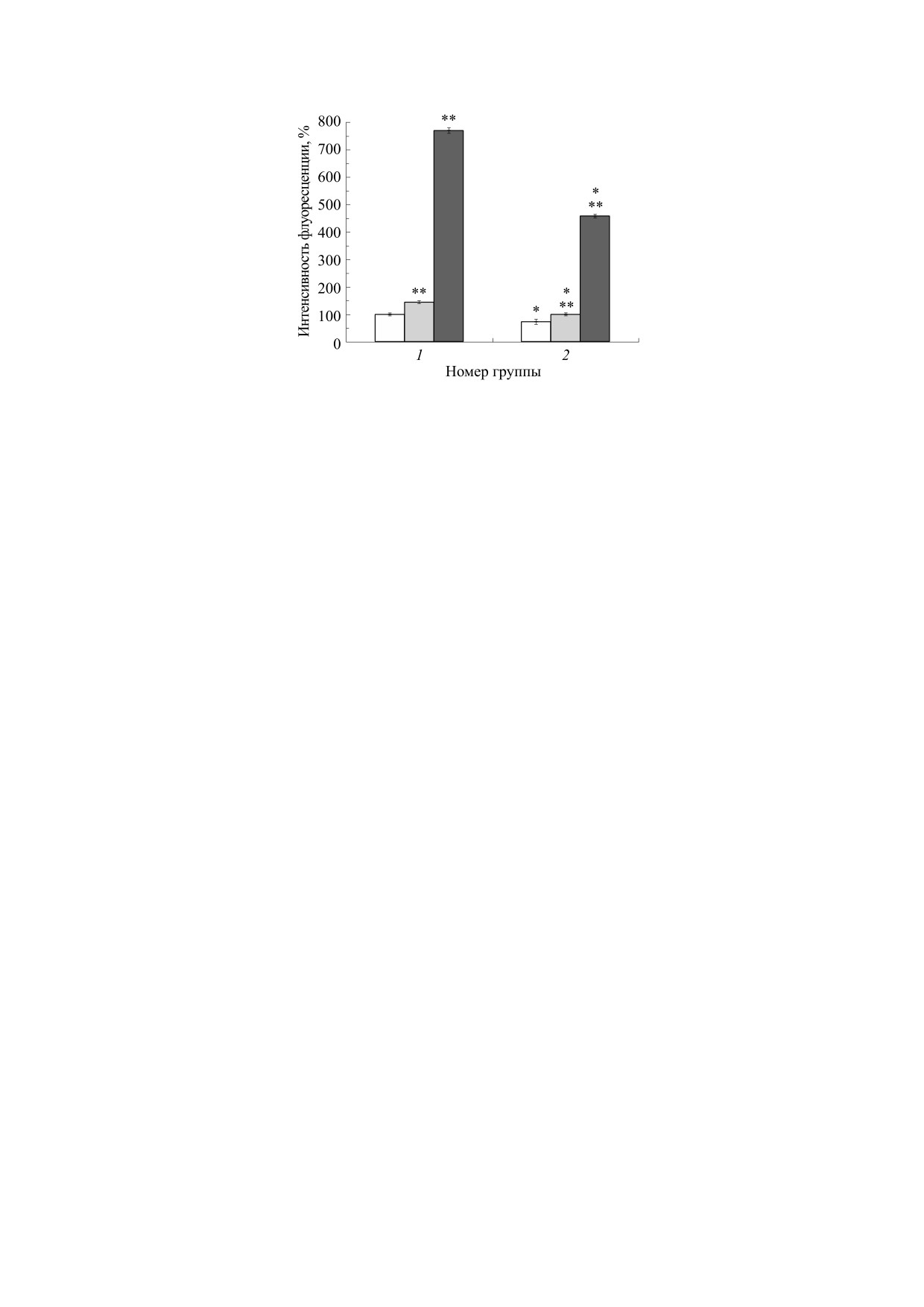
Добавка
специфического
ингибитора
лый столбик - без добавок, серый столбик - добавка
2 мкМ U73122. Звездочкой отмечены достоверные от-
НАДФН-окидазы апоцинина в разных концен-
личия между группами (P < 0,05), двумя звездочками -
трациях привела к «парадоксальному» росту про-
достоверные отличия внутри группы (P < 0,05).
дукции АФК в неактивированных нейтрофилах,
пропорциональному концентрации этого инги-
битора, и приблизительно в два раза более выра-
симых механизмов. Что резко отличает этот эф-
женному в контрольных случаях (рис. 6). Этот ре-
фект от эффекта комбинированных магнитных
зультат можно объяснить, исходя из известного
полей на этом же объекте (нейтрофилах), при ко-
факта, что для проявления ингибирующей
тором, напротив, уже низкие концентрации BAP-
НАДФН-оксидазу активности апоцинина необ-
TA AM полностью его блокируют [9].
ходима его димеризация, которая происходит в
Добавка ротенона - ингибитора электрон-
присутствии пероксидаз и перекиси водорода
транспортной цепи митохондрий - в концентра-
[21,22], например, в активированных нейтрофи-
ции 1 мкМ снизила продукцию внутриклеточных
лах. В неактивированных клетках апоцинин мо-
АФК на 20% в контроле и значительно сильнее в
жет стимулировать продукцию АФК за счет его
Рис. 5. Влияние гипомагнитного поля на интенсивность флуоресценции дихлорфлуоресцеина в суспензии нейтрофи-
лов в отсутствиe и в присутствии ингибитора протеинкиназы С - Ro 31-6233. По оси ординат - максимальная интен-
сивность флуоресценции в процентах по отношению к базовому контролю (средние значения и стандартные откло-
нения, n = 10), по оси абсцисс - номер группы (1 - контроль. 2 - опыт). Белый столбик - без добавок, серый
столбик - добавка 1 мкМ Ro 31-6233. Звездочкой отмечены достоверные отличия между группами (P < 0,05).
БИОФИЗИКА том 64
№ 4
2019
724
НОВИКОВ и др.
Рис. 6. Влияние гипомагнитного поля на интенсивность флуоресценции дихлорфлуоресцеина в суспензии нейтрофи-
лов в отсутствиe и в присутствии апоцинина. По оси ординат - максимальная интенсивность флуоресценции в про-
центах по отношению к базовому контролю (средние значения и стандартные отклонения, n = 10), по оси абсцисс -
номер группы (1 - контроль. 2 - опыт). Белый столбик - без добавок, серый столбик - добавка 20 мкМ апоцинина,
темный столбик - добавка 500 мкМ апоцинина. Звездочкой отмечены достоверные отличия между группами
(P < 0,05), двумя звездочками - достоверные отличия внутри группы (P < 0,05).
предшествующего окисления, приводящего к об-
6. V. V Novikov., G. V. Novikov, and E. E. Fesenko, Bio-
разованию переходных свободных радикалов
electromagnetics 30, 343 (2009).
[23]. В нашем случае важно отметить, что интен-
7. В. В. Новиков, Е. В. Яблокова и Е. Е. Фесенко,
сивность этого процесса в опыте (после пребыва-
Биофизика 60 (3), 530 (2015).
ния в гипомагнитных условиях) значительно
8. В. В. Новиков, Е. В. Яблокова и Е. Е. Фесенко,
снижается.
Биофизика 61 (6), 1159 (2016).
В целом приведенные данные свидетельству-
9. В. В. Новиков, Е. В. Яблокова и Е. Е. Фесенко,
ют о снижении интенсивности процессов окис-
Биофизика 62 (3), 547 (2017).
ления использованного флуоресцентного зонда
10. В. В. Новиков, Е. В. Яблокова, Г. В. Новиков и
(H2DCF) в нейтрофилах в гипомагнитных усло-
Е. Е. Фесенко, Биофизика 62 (5), 926 (2017).
виях, участии митохондрий и их электрон-транс-
11. В. В. Новиков, Е. В. Яблокова и Е. Е. Фесенко,
портной системы в этом эффекте «нулевого» по-
Биофизика 63 (2), 277 (2018).
ля, возможном снижении интенсивности про-
12. В. В. Новиков, Е. В. Яблокова, Н. И. Новикова и
цессов окисления и других веществ (например,
Е. Е. Фесенко, Биофизика 64 (2), 290 (2019).
апоцинина), не зависимости эффекта «нулевого
13. J. P. Crow, Nitric Oxide: Biology and Chemistry 1 (2),
поля» от кальций-зависимых регуляторных меха-
145 (1997).
низмов, что позволяет предположить его метабо-
14. S. L. Hempel, G. R. Buettner, Y. Q. O'Malley, et al.,
лическую основу. Все это резко отличает эффект
Free Radic. Biol. Med. 27 (1-2), 146 (1999).
«нулевого» поля от эффектов комбинированных
15. G. Bartosz, Clin. Chim. Acta 368, 53 (2006).
магнитных полей, с определенными параметрами
16. M. Freitas, J. L. Lima, and E. Fernandes, Anal. Chim.
[6,7], в основе которых обнаруживается влияние
Acta 649, 8 (2009).
на регуляторные кальций-зависимые механизмы
[9], контролирующие респираторный взрыв в
17. G. Fossati, D. A. Moulding, D. G. Spiller, et al., J. Im-
нейтрофилах.
munol. 170, 1964 (2003).
18. Ю. А. Владимиров и Е. В. Проскурина, Успехи
биол. химии 49, 341 (2009).
СПИСОК ЛИТЕРАТУРЫ
19. Н. В. Воробьева, Иммунология 34 (4), 227 (2013).
1. H. Zhang, Z. Zhang, W. Mo, et al., Prot. Cell 8 (7), 527
20. А. Н. Маянский, Цитокины и воспаление 6 (3), 3
(2017).
(2007).
2. C. F. Martino and P. R. Castello, PLoS One 6 (8),
21. J. Stolk, T. J. Hiltermann, J. H. Dijkman, and A. J. Ver-
e22753 (2011).
hoeven, Am. J. Respir. Cell Mol. Biol. 11 (1), 95
3. P. Politanski, E. Rajkowska, M. Brodecki, et al., Bio-
(1994).
electromagnetics 34, 333 (2013).
22. M. Vejrazka, R. Mícek, and S. Stípek, Biochim. Bio-
4. V. N. Binhi and F. S. Prato, PLoS One 12 (6), e0179340
phys. Acta 1722 (2), 143 (2005).
(2017).
5. В. В. Новиков, Е. В. Яблокова и Е. Е. Фесенко,
23. L. R. Castor, K. A. Locatelli, and V. F. Ximenes, Free
Биофизика 63 (3), 484 (2018).
Radic. Biol. Med. 48 (12), 1636 (2010).
БИОФИЗИКА том 64
№ 4
2019
К ВОПРОСУ О МОЛЕКУЛЯРНЫХ МЕХАНИЗМАХ
725
On Molecular Mechanisms of the Effect of a “Zero” Magnetic Field on the Production
of Reactive Oxygen Species in Inactivated Neutrophils
V.V. Novikov, E.V. Yablokova, E.R. Valeeva, and E.E. Fesenko
Institute of Cell Biophysics, Russian Academy of Sciences, Institutskaya ul. 3, Pushchino, Moscow Region, 142290 Russia
It has been shown that the decrease in intensity of 2,7-dichlorodihydrofluorescein oxidation processes in in-
activated neutrophils under hypomagnetic field exposure (the residual static magnetic field of 20 nT) is not
related to the calcium-mediated mechanisms as evidenced by the absence of the effect of cell-permeant Ca2+
chelators such as 1,2-bis-(2-amino-phenoxy)ethane-N,N,N',N'-tetraacetic acid acetoxymethyl ester on the
intensity of the process alluded. This decrease is hardly caused by effects of exposure to hypomagnetic field
on phosphorylation of NADPH-oxidase components because addition of a protein kinase C inhibitor, Ro 31-
6233, did not virtually decrease the fluorescence intensity of intracellular dichlorodihydrofluorescein. Addi-
tion of a phospholipase C inhibitor, U73122, led to a negligible decrease in ROS production in control (al-
most same extent as in the experiment). In the presence of apocynin at different concentrations ROS produc-
tion in inactivated neutrophils increased and it was 2 times lower under hypomagnetic field conditions. A de-
crease in ROS production which was more apparent during the experiment after addition of rotenone is
indicative of the fact that the mitochondrial electron-transport chain is involved in the mechanism of the ef-
fect of a “zero” magnetic field.
Keywords: hypomagnetic field, neutrophils, reactive oxygen species, fluorescence, calcium ions, protein kinase C,
phospholipase C, mitochondria
БИОФИЗИКА том 64
№ 4
2019