БИОФИЗИКА, 2019, том 64, № 4, с. 778-785
БИОФИЗИКА CЛОЖНЫX CИCТЕМ
УДК 612.014.464, 577.23, 577.346, 576.32/36, 577.175.5, 577.152.198
РОЛЬ БИОФИЗИЧЕСКИХ МЕХАНИЗМОВ В ЭФФЕКТАХ
100%-Й ГИПЕРОКСИИ, ЗАКЛЮЧАЮЩИХСЯ В ИЗМЕНЕНИИ
РАДИОЧУВСТВИТЕЛЬНОСТИ ОРГАНИЗМА
© 2019 г. М.В. Васин*, И.Б. Ушаков** ***
*Российская медицинская академия непрерывного профессионального образования Минздрава России,
123995, Москва, ул. Баррикадная, 2/1
**Федеральный медицинский биофизический центр имени А.И. Бурназяна ФМБА России,
123182, Моcква, ул. Живопиcная, 46
***Вcеpоccийcкий центp экcтpенной и pадиационной медицины им. А.М. Никифоpова МЧC Pоccии,
194044, Cанкт-Петеpбуpг, ул. Академика Лебедева, 4/2
E-mail: mikhail-v-vasin@yandex.ru
Поступила в редакцию 16.01.2019 г.
После доработки 16.01.2019 г.
Принята к публикации 05.03.2019 г.
Представлена гипотеза о механизме радиосенсибилизирующего действия гипероксии во время об-
лучения на течение и исход кишечного синдрома острой лучевой болезни при отсутствии в этом
случае существенной модификации течения костномозгового синдрома острой лучевой болезни.
Рассматривается большая роль повышенной продукции активных форм кислорода при гипероксии
в усилении лучевого поражения кишечника при отсутствии существенного вклада «кислородного
эффекта» в данный процесс. Подчеркивается роль кумуляции токсических эффектов активных
форм кислорода при повторном воздействии гипероксии при фракционированном облучении в
утяжелении течения острой лучевой болезни. Обращено внимание на роль предварительного еже-
дневного стрессорного воздействия вибрации на усиление радиосенсибилизирующего эффекта ги-
пероксии на течение кишечного синдрома острой лучевой болезни. Анализированы метаболиче-
ские сдвиги в регуляции энергетического обеспечения организма при сочетанном воздействии
ионизирующего излучения и гипероксии. Рассмотрены возможные механизмы радиомитигирую-
щего действия гипероксии на кроветворную ткань, проявляющегося при кратковременном дыха-
нии 100%-м кислородом до или сразу после облучения животных. Подчеркивается сигнальная роль
активных форм кислорода и цитостатического эффекта, вызванных гипероксией, в усилении про-
цессов пострадиационного восстановления кроветворной ткани.
Ключевые слова: гамма-радиация, нормобарическая гипероксия, активные формы кислорода,
«кислородный эффект», радиочувствительность, глиоксилатный шунт, блокада клеточного деления.
DOI: 10.1134/S0006302919040185
жения, проведенные ранее на мелких лабора-
Гипероксию рассматривали в радиобиологии
торных животных, обнаружили отсутствие или
как фактор, способствующий повышению радио-
небольшое повышение их радиочувствительно-
чувствительности опухолей при радиотерапии за
сти при дыхании во время облучения чистым кис-
счет частичного устранения их гипоксического
лородом при нормальном и повышенном давле-
состояния [1-3]. Гипероксия по этой причине
нии [4,7-10]. В наших предыдущих исследовани-
подавляет проявление радиозащитного эффекта
ях было выявлено четкое различие в степени и
радиопротекторов, где гипоксический фактор иг-
характере изменения радиочувствительности
рает существенную роль в реализации их дей-
кроветворной ткани и кишечника животных под
ствия [4-6]. Единичные исследования по влия-
воздействием нормобарической гипероксии [11].
нию гипероксии на течение радиационного пора-
Цель настоящего исследования - исходя из
современных представлений о механизмах ра-
Сокращения: ОЛБ - острая лучевая болезнь, рО2 - давле-
диорезистентности, проанализировать (помимо
ние кислорода в среде, АФК - активные формы кислоро-
очевидного действия гипероксии, связанного со
да, НАДФ-оксидаза - никотинамидадениндинуклеотид-
фосфатоксидаза.
снижением уровня локальной гипоксии в тка-
778
РОЛЬ БИОФИЗИЧЕСКИХ МЕХАНИЗМОВ
779
Таблица 1. Влияние нормобарической гипероксии в течение 20 мин во время облучения на радиочувствитель-
ность беспородных крыс при костномозговом и кишечном синдроме острой лучевой болезни [11]
Выживаемость, %
Доза
Группа
n
СПЖ, сут
облучения, Гр
к 7-м суткам
к 30-м суткам
8,5
Облучение
18
94.4
16.7
11.7
Гипероксия + облучение
20
85.5
10.0
10.6
10,0
Облучение
20
50.0
0
9.2
Гипероксия + облучение
20
10.0*
0
6.4*
Примечание. СПЖ - средняя продолжительность жизни погибших в течение 30 сут после облучения животных; * P < 0.05 по
сравнению с контрольной группой на облучение; n - количество крыс.
нях), насколько биофизические и иные эффекты
ражение кишечника при отсутствии его суще-
дыхания чистым кислородом могут быть ответ-
ственного влияния на выраженность костномоз-
ственны за изменение радиочувствительности
гового синдрома (табл.
1)
[11]. При тех же
организма, включая отдельные системы и ткани.
условиях гипероксии (до или сразу после облуче-
ния) отмечен радиомитигирующий эффект при
типичной форме острой лучевой болезни (ОЛБ),
МОДИФИЦИРУЮЩИЙ ЭФФЕКТ
обуславливающий 20-30% выживаемость мышей
СОВМЕСТНОГО И СОЧЕТАННОГО
при полной гибели животных в контрольной
ВОЗДЕЙСТВИЯ ГИПЕРОКСИИ
группе облучения (табл. 2) [12].
И ИОНИЗИРУЮЩЕЙ РАДИАЦИИ
Важно отметить, что реализация «кислородно-
НА ТЕЧЕНИЕ ОСТРОЙ ЛУЧЕВОЙ БОЛЕЗНИ
го эффекта» как радиобиологического феномена,
ПРИ КОСТНОМОЗГОВОМ
проявляющего в усилении проявления лучевого
И КИШЕЧНОМ СИНДРОМАХ
поражения клеток в присутствии в среде кисло-
Раннее было выявлено, что кратковременное
рода, при воздействии нормобарической гипе-
(до 20 мин) дыхание животными 100%-м кисло-
роксии во время облучения животных весьма
родом во время облучения усиливало лучевое по-
ограничена. Причина не столько в том, что при
Таблица 2. Влияние нормобарической гипероксии в течение 20 и 120 мин при воздействии до облучения на ра-
диочувствительность мышей (CBA × C57Bl/6)F1 при костномозговом синдроме острой лучевой болезни [12]
Выживаемость, %
Продолжительность
Группа
n
СПЖ, сут
гипероксии, мин
к 7-м суткам
к 30-м суткам
Облучение
-
40
95.0
32.5
12.7
Гипероксия до облучения
20
40
100
60.0*
12.9
Облучение
-
40
92.5
2.5
13.5
Гипероксия до облучения
120
40
95.0
22.5*
14.1
Примечание. СПЖ - средняя продолжительность жизни погибших в течение 30 сут после облучения животных; * P < 0.05 по
сравнению с контрольными группами на облучение, n- количество мышей.
БИОФИЗИКА том 64
№ 4
2019
780
ВАСИН, УШАКОВ
Более высокая оксигенация кишечника пред-
определяет более высокую скорость потребления
кислорода его тканью по сравнению с костным
мозгом. При интенсификации тканевого дыха-
ния, в том числе при повышении поступления
кислорода в среду при гипероксии, имеет место
повышенная продукция митохондриальных ак-
тивных форм кислорода (АФК) [15]. Гипероксия
также может увеличивать уровень АФК через ак-
тивацию никотинамидадениндинуклеотидфос-
фатоксидазы (НАДФ-оксидазы) [16,17]. О прояв-
лении данных процессов в течение 20 мин дыха-
ния мышами чистым кислородом косвенно
можно судить по активации фермента цикла
Кребса сукцинатдегидрогеназы в лимфоцитах
крови мышей (рис. 1) [6], тесно связанного с про-
дукцией АФК [18,19].
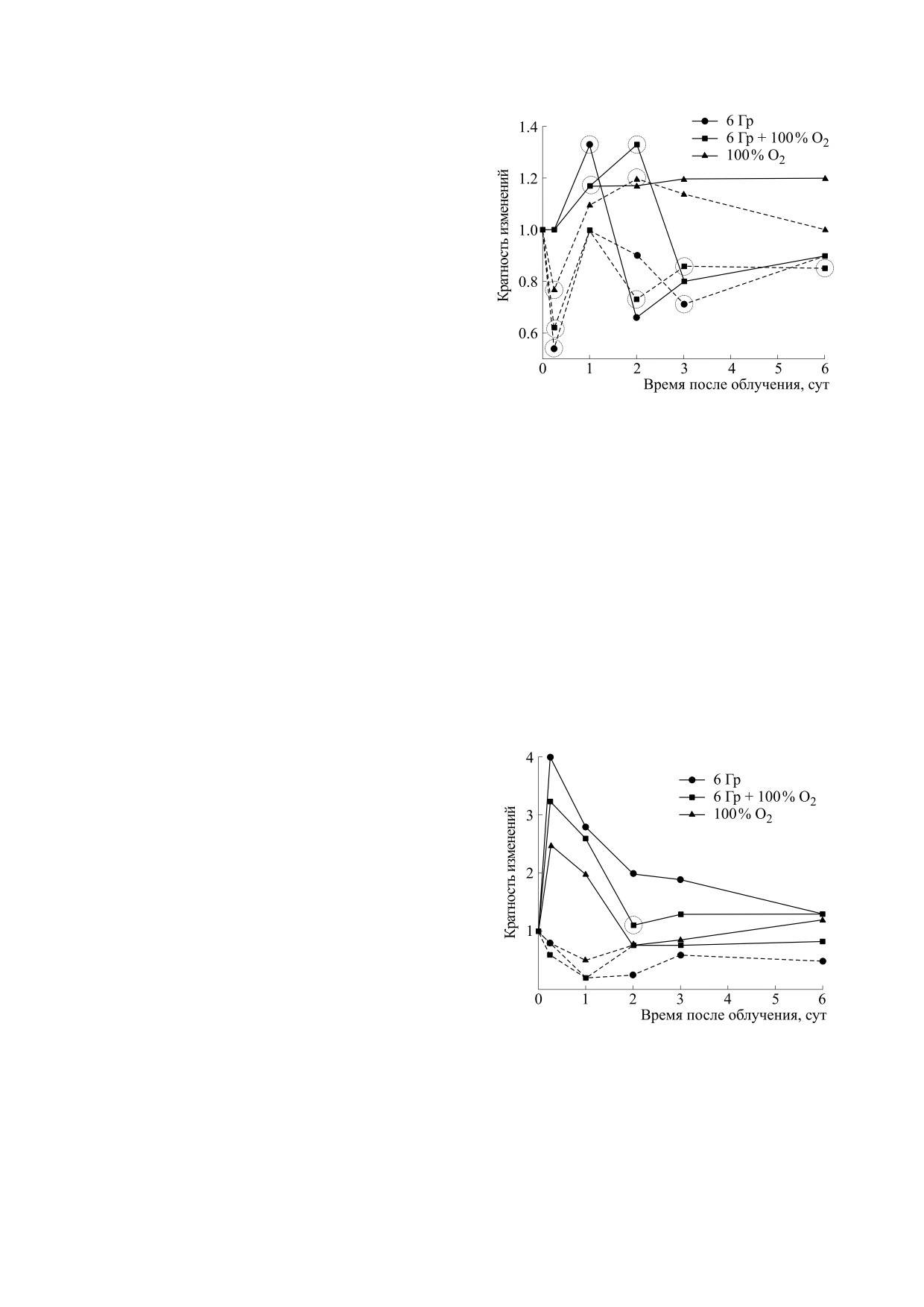
Рис. 1. Изменение активности сукцинатдегидроге-
Вызванная гипероксией повышенная продук-
назы лимфоцитов крови мышей при дыхании жи-
вотных 100%-м кислородом при нормальном атмо-
ция АФК [20,21] в условиях воздействия ионизи-
сферном давлении. По оси абсцисс - время время
рующего излучения приводит к усилению лучево-
действия гипероксии, по оси ординат - изменение
го поражения организма и, прежде всего, в радио-
активности сукцинатдегидрогеназы лимфоцитов
чувствительных
тканях
с
повышенной
крови по отношению к исходному уровню.
оксигенацией, что имеет место в криптах кишеч-
ника. Так, например, при повторном воздействии
кратковременной (по 10 мин) нормобарической
ней поступление в организм кислорода увеличи-
гипероксии перед облучением, в условиях, когда
вается не более чем на 7%. Важно то, что в обыч-
исключается ее влияние на проявление «кисло-
ной воздушной среде с содержанием 21% кисло-
родного эффекта», в режиме фракционированно-
рода у животных и человека в ряде радиочувстви-
го облучения имеет место усиление лучевого по-
тельных тканей давление кислорода в среде (рО2)
ражения животных, прежде всего по кишечному
приближается или превышает предел, близкий к
синдрому ОЛБ [22]. Данный факт может быть
40 мм рт. ст., при котором по дозовой кривой Хо-
связан с кумуляцией токсического действия на
варт-Фландерса достигает максимума реализа-
организм продуцируемого гипероксией АФК.
ция «кислородного эффекта».
Токсический эффект длительной гипероксии от-
Существуют большие различия в васкулириза-
мечен в легких, почках и кишечнике, что связано
ции и оксигенации отдельных тканей организма.
с повышенной оксигенацией тканей данных ор-
Так, например, при напряжении кислорода в ар-
ганов при дыхании животными чистым кислоро-
териальной крови 100 мм рт. ст. в области крипт
дом [23]. При предварительном ежедневном в те-
кишечника рО2 достигает 85 мм рт. ст. [13] при
чение пяти суток стрессорном воздействии в виде
рО2 10-30 мм рт. ст. в костном мозге [14]. По этой
вибрации под действием гипероксии во время об-
причине выявленный радиосенсибилизирующий
лучения происходит выраженная радиосенсиби-
эффект гипероксии при кишечном синдроме
лизация животных по проявлению кишечного
ОЛБ не может быть объяснен реализацией «кис-
синдрома ОЛБ (табл. 3) [24]. Известно, что про-
лородного эффекта» как радиобиологического
должительные сеансы вибрации вызывают повы-
феномена.
шенную продукцию АФК и истощение антиокси-
Таблица 3. Влияние предварительного до облучения воздействия вибрации (перегрузка 0,5 ед. при частоте 10 Гц
в течение 1 ч) на течение кишечного синдрома острой лучевой болезни мышей ([BALB/c × BioCW/Y] [CC57W ×
× A/SnY])F2 в условиях дыхания 100%-м кислородом во время облучения [23]
Группы
n
ЛД50/7
ФИД
Облучение
140
10.50 (10.17-10.84)
-
Вибрация 5 раз ежедневно + облучение
80
9.86 (9.55-10.19)
1.07
Гипероксия + облучение
130
10.16 (9.92-10.30)
1.03
Вибрация 5 раз ежедневно + гипероксия + облучение
60
8.50 (7.52-9.61)
1.24*
Примечание. ЛД50/7 - средняя смертельная доза облучения на седьмые сутки ОЛБ; ФИД - фактор изменения дозы в виде
отношения ЛД50 контрольной группы к ЛД50 подопытной группе; * P < 0.05 по сравнению с контрольной группой на облуче-
ние, n - количество мышей.
БИОФИЗИКА том 64
№ 4
2019
РОЛЬ БИОФИЗИЧЕСКИХ МЕХАНИЗМОВ
781
дантной системы организма [25], что способно
потенцировать токсический эффект гипероксии
и лучевое поражение организма.
В тех же условиях влияние нормобарической
гипероксии во время облучения на радиочувстви-
тельность кроветворной ткани и на течение кост-
номозгового синдрома ОЛБ практически отсут-
ствует при теоретически существующей возмож-
ности частичной реализации
«кислородного
эффекта» за счет низкого уровня рО2 в костном
мозге. Данный факт во многом определяется на-
личием радиомитигирующего эффекта гиперок-
сии на кроветворной ткани, выявленного при ды-
хании 100%-м кислородом мышами в течение 20
мин до или сразу после облучения животных
[11,12,26]. Роль гипероксии как индуктора АФК в
костном мозге менее существенна, чем в ткани
кишечника из-за его более низкой оксигенации,
Рис. 2. Влияние гипероксии во время облучения на
а также благодаря тому факту, что в стволовых
изменение активности кислой фосфатазы и НАДФ-
клетках костного мозга тканевое дыхание в ос-
дегидрогеназы тонкого кишечника мышей после
гамма-облучения в дозе 6 Гр. По оси абсцисс -
новном осуществляется через гликолиз. Нельзя
время после облучения и гипероксии при
также исключить региональный вазоконстрик-
совместном их воздействии в течение 20 мин, по оси
торный эффект, вызванный гипероксией и в
ординат - отношение показателей опытной группы
определенной степени нейтрализующий дей-
к группе биологического контроля. Непрерывная
ствие гипероксии по повышению рО2 в тканях
линия - кислая фосфатаза, прерывистая линия -
НАДФ-дегидрогеназа. Кружком отмечено р < 0.05
[27].
по отношению к группе биологического контроля.
БИОФИЗИЧЕСКИЕ ЭФФЕКТЫ
зу в кишечнике, не затрагивая при этом данные
ГИПЕРОКСИИ В ТКАНЯХ
процессы в ткани печени. Одновременное дей-
ПРИ ЕЕ СОВМЕСТНОМ ВОЗДЕЙСТВИИ
ствие радиации и нормобарической гипероксии
С ИОНИЗИРУЮЩИМ ИЗЛУЧЕНИЕМ
приводит к увеличению продолжительности ак-
Повреждающее действие ионизирующего из-
тивации кислой фосфатазы в кишечнике до двух
лучения на ткани организма связано с радиоли-
зом воды и органических веществ вследствие по-
глощения его энергии. Образование, прежде все-
го,
гидроксильного радикала вследствие
радиолиза воды приводит к росту АФК, вызыва-
ющих перекисные процессы в тканях с развитием
в них патофизиологических сдвигов. Наиболее
радиочувствительными органеллами клетки яв-
ляются мембраны, содержащие повышенное со-
держание ненасыщенных липидов, наиболее чув-
ствительных к цепным перекисным процессам.
После облучения повышение проницаемости
мембран приводит к увеличению активности
кислой фосфатазы вследствие повреждения лизо-
сом и последующему снижению щелочной фос-
фатазы тканей [28,29]. При несмертельных дозах
облучения (6 Гр для мышей) активация кислой
фосфатазы наступает на следующий день после
воздействия радиации и исчезает на вторые сутки
опыта (рис. 2) [30]. Этот эффект имеет место в ра-
Рис. 3. Влияние гипероксии во время облучения на
диочувствительной ткани тонкого кишечника и
изменение содержания гликогена и липидов в пече-
отсутствует в обладающей большей радиорези-
ни мышей после гамма-облучения в дозе 6 Гр. По
оси абсцисс - время после облучения и гипероксии
стентностью ткани печени. Дыхание чистым
при совместном их воздействии в течение 20 мин, по
100%-м кислородом мышами в течение 20 мин
оси ординат - отношение показателей опытной
также способно активизировать кислую фосфата-
группы к группе биологического контроля.
БИОФИЗИКА том 64
№ 4
2019
782
ВАСИН, УШАКОВ
бете у животных [34]. Глиоксилатный цикл непо-
средственно связан с активацией сукцинатдегид-
рогеназы [35]. АФК как токсический продукт при
действии гипероксии усиливает процессы глико-
лиза, сопровождаемые активацией лактатдегид-
рогеназы [36]. Данный патофизиологический эф-
фект кратковременной гипероксии (в течение
20 мин) завершается ко вторым суткам после на-
чала ее воздействия (рис. 3) [30].
Более глубокие и продолжительные процессы,
связанные с активацией глиоксилатного цикла,
были выявлены при облучении животных в не-
смертельной дозе 6 Гр. Увеличение содержания
гликогена в печени под действием радиации было
в два раза выше, чем при дыхании чистым кисло-
родом и не завершалось к шестым суткам после
Рис. 4. Влияние гипероксии во время облучения на
облучения (рис. 3). Пиковый подъем содержания
изменение содержания РНК в селезенке мышей по-
гликогена в печени отмечался на шестой час по-
сле гамма-облучения в дозе 6 Гр. По оси абсцисс -
сле облучения и сопровождался повышением ак-
время после облучения и гипероксии при совмест-
ном их воздействии в течение 20 мин, по оси орди-
тивности сукцинатдегидрогеназы, никотинами-
нат - отношение показателей опытной группы к
дадениндинуклеотид- и НАДФ-дегидрогеназ
группе биологического контроля.
[30,37]. Активация гликолиза происходила на сут-
ки позже.
суток. Эти данные свидетельствуют об усилении
Гипероксия, самостоятельно вызывая подоб-
перекисных процессов в клеточных мембранах и
ные изменения в метаболизме клеток, сокращала
усилении лучевого поражения кишечника под
время проявления данных процессов в печени об-
воздействием гипероксии. Важно отметить, что
лученных животных до двух суток. Радиомитиги-
данным процессам предшествует (через 6 ч после
рующее действие гипероксии по ограничению
облучения) подавление активности НАДФ-де-
развития лучевого поражения тканей может быть
гидрогеназы в ткани кишечника при ее актива-
связано с адаптивной реакцией организма на ин-
ции в печени, играющей большую роль в под-
дуцированную АФК воспалительную реакцию с
держке антиоксидантной системы клеток (рис. 2)
последующей активацией противовоспалитель-
[31,32]. Гипероксия, благодаря повышению про-
ных и антиапоптических цитокинов, ограничива-
дукции АФК, обладает прямыми и непрямыми
ющих развитие лучевого поражения организма
эффектами на сигнальные пути, действуя на про-
[38].
теинкиназы JNK и p38, рецепторы тирозинкина-
Помимо того, что кислород способствует уси-
зы, про- и антиапоптические и транскриптаци-
лению радиационно-химических процессов и ра-
онные факторы AP-1, Nrf2 и NF-kB. Эти эффек-
диационного повреждения тканей, он одновре-
ты связаны с развитием таких патофизио-
менно является жизненно важным и необходи-
логических процессов, как стрессорный ответ,
мым для энергообеспечения и функционирования
воспалительная реакция, митотическая блокада
любой клетки организма. Кислород и связанные с
клеток и апоптоз [16,33].
ним АФК участвуют в регуляции клеточного цик-
Знаменательно, что к шести часам после воз-
ла и обеспечения пролиферации стволовых крове-
действия гипероксии в печени мышей увеличива-
творных клеток. Гипероксия положительно влияет
лось содержание гликогена и снижалось количе-
на пострадиационные восстановительные процес-
ство липидов (рис. 3) [30]. Данное явление явля-
сы в кроветворной ткани [25]. Как отражение этих
ется свидетельством адаптивной реакции
процессов является увеличение содержание РНК в
организма, связанной с индукцией глиоксилат-
клетках селезенки облученных животных, начиная
ного шунта и направленной на поддержание
со вторых суток с достижением максимума эффек-
энергетического гомеостаза при его нарушении
та к шестым суткам после облучения (рис. 4) [30].
под воздействием патофизиологических процес-
Кратковременное дыхание чистым кислоро-
сов за счет экстренной интенсификации процес-
дом (в течение 20 мин) способно вызывать у мы-
сов синтеза глюкозы и гликогена из липидов
шей в течение суток блокаду митоза клеток кост-
клетки. Данное явление обнаружено при острой
ного мозга без существенного влияния на дина-
гипоксии, голодании и экспериментальном диа-
мику деления клеток крипт кишечника [39,40]. В
БИОФИЗИКА том 64
№ 4
2019
РОЛЬ БИОФИЗИЧЕСКИХ МЕХАНИЗМОВ
783
Таблица 4. Изменение митотической активности костного мозга мышей (СBA × C57Bl)F1 и его клеточного со-
става после воздействия кратковременной (20 мин) нормобарической гипероксии (в % к группе биологического
контроля [37])
Время после воздействия дыхания чистым кислородом
Группы
часы
сутки
2
4
6
1
2
3
6
Митотический индекс
63.2
74.3*
66.0*
116.3*
138.5*
117.7
136.5*
Клеточный состав
-
-
98.7
100.6
101.3
100.9
109.7
Количество мышей
10
12
25
45
26
21
51
Примечание. * P < 0.05 по сравнению с группами биологического контроля.
дальнейшем, начиная с одних суток и до конца
ных процессов [45]. Из кратковременных и ран-
наблюдения (шестеро суток), идет усиление ми-
них эффектов гипероксии (с шести часов и на
тотической активности костного мозга с неболь-
протяжении суток) отмечен рост числа лейкоци-
тов крови на 30% и снижение количества ретику-
шим ростом его клеточного состава к шестым
лоцитов на 40% [40]. Эти процессы возможны
суткам после воздействия гипероксии (табл. 4).
при сигнальном уровне концентрации АФК при
Причинами отмечаемых изменений в физиоло-
дыхании чистым кислородом, поддерживаемой
гии клетки являются повышение их оксигенации
относительно низкой оксигенацией костного
во время гипероксии и активация в этих условиях
мозга [14,36].
комплекса II дыхательной цепи, сопровождаемая
увеличением продукции АФК [19,41]. Механизм
подавления гипероксией митоза практически на
ВЫВОДЫ
всех фазах, но прежде всего на фазе S, связан со
1. Кратковременная (в течение 20 мин) нормо-
снижением в клетке содержания белка циклина
барическая гипероксия усиливает тяжесть и ис-
В1 и повышением активности р21, ингибитора
ход кишечного синдрома ОЛБ за счет повышения
циклин-зависимой киназы
[42]. Гипероксия
митохондриальной продукции АФК, сопровож-
обеспечивает экспрессию р21 через активацию
даемого подавлением антиоксидантной системы
р53, что предотвращает переход из фазы G1 кле-
клеток, регистрируемого по уровню снижения
точного цикла и тем самым ограничивает репли-
активности НАДФ-дегидрогеназы и щелочной
кацию ДНК [43,44].
фосфатазы, а также по активации лизосомальной
кислой фосфатазы в ткани кишечника.
Радиомитигирующее действие гипероксии на
кроветворную систему может отчасти быть связа-
2. Нормобарическая гипероксия способна вы-
но с задержкой митотической активности под
зывать ограничение по времени активации гли-
действием гипероксии, что позволяет выделить
колиза и глиоксилатного шунта в печени облу-
больше времени для ранних пострадиационных
ченных животных, проявляющееся в виде увели-
восстановительных процессов в ДНК клеток. Ес-
чения количества гликогена и снижения
ли принять во внимание, что лучевое воздействие
содержания липидов в печени.
также вызывает задержку прохождения клеточно-
3. Кратковременное дыхание чистым кислоро-
го цикла, отмеченное блокирующее влияние ги-
дом обладает радиомитигирующим действием на
пероксии на митоз может потенцировать данный
течение костномозгового синдрома ОЛБ, сопро-
эффект.
вождающимся повышением выживаемости жи-
Кроме того, радиомитигирующее действие
вотных на 20-30% при смертельных дозах гамма-
кратковременной гипероксии на костный мозг
облучения, благодаря наличию у гипероксии спо-
поддерживается стимуляцией дифференцировки
собности подавлять митотическую активность
стволовых кроветворных клеток и их миграцион-
клеток костного мозга в течение шести часов с
БИОФИЗИКА том 64
№ 4
2019
784
ВАСИН, УШАКОВ
последующей ее активацией через сутки после
22.
М. В. Васин и Л. В. Королева, Радиобиология 23
воздействия.
(5), 692 (1983).
4. Радиомитигирующий эффект нормобариче-
23.
D. Torbati, G. H. Tan, S. Smith, et al. J. Crit. Care 21
ской гипероксии отражается в ускорении постра-
(1), 85 (2006).
диационных восстановительных процессов в
24.
М. В. Васин и Л. А. Семенова, Радиобиология 27
кроветворной ткани, регистрируемом по увели-
(5), 704 (1987).
чению эндогенного колонии образования и уве-
25.
K. Krajnak and S. Waugh, J. Occupat. Environm. Med.
личению РНК в ткани селезенки.
60 (10) (2018). DOI: 10.1097/JOM.0000000000001396.
26.
М. В. Васин, И. Б. Ушаков, Л. В. Королева и В. В.
СПИСОК ЛИТЕРАТУРЫ
Антипов. Радиац. биол. Радиоэкология 58 (6), 619
1. U. M. Carl, G. Ewert, and P. Vaupel, Strahlenther.
(2018).
Onkol. 172 (Suppl. 2), 2 (1996).
27.
J. A. Spencer, F. Ferraro, E. Roussakis, et al., Nature
2. M. Rijpkema, J. H. Kaanders, F. B. Joosten, et al., Int.
508 (7495), 269 (2014). DOI: 10.1038/nature13034.
J. Radiat. Oncol. Biol. Phys. 53 (5), 1185 (2002).
28.
M. Kumar, M. K. Sharma, P. S. Saxena, and A. Kumar,
3. M. I. Rijpkema, J. Schuuring, P. L. Bernsen, et al.,
Biol. Pharm. Bull. 26 (3), 308 (2003).
Magn. Reson. Imaging. 22 (6),761 (2004).
4. H. A. van den Brenk, and D. Jamieson, Int. J. Radiat.
29.
M. A. El-Ghazaly, R. M. El-Hazek, and M. T. Khay-
Biol. Relat. Stud. Phys. Chem. Med. 4, 379 (1962).
yal, Int. J. Radiat. Biol. 91 (2), 150 (2015). DOI:
10.3109/09553002.2014.954059.
5. М. В. Васин, Т. С. Львова, В. В. Антипов, и
Б. И. Давыдов, Радиобиология 19 (5), 712 (1979).
30.
Л. В. Королева, М. В. Васин и Т. С. Львова,
6. М. В. Васин, И. Б. Ушаков, Л. В. Королева и В. В.
Радиобиология 21 (3), 426 (1981).
Антипов, Радиац. биол. Радиоэкол. 39 (2--3), 238
31.
W. Ying, Antioxid. Redox Signal. 10 (2), 179 (2008).
(1999).
7. F. B. Benjamin and L. Peyser, Aerosp. Med. 35, 1147
32.
J. H. Lee and S. Y. Kim. J. Biol. Chem. 282 (18), 13385
(1964).
(2007). DOI:10.1074/ jbc.M700303200.
8. О. П. Смирнов, Мед. радиол. 11 (2), 75 (1966).
33.
E. Birben, U. M. Sahiner, C. Sackesen, et al., World Al-
9. G. M. Christensen, L. W. Dahlke, J. T. Griffin, et al.,
lergy Organ. J.
5
(1),
9
(2012).
DOI:
Radiat. Res. 37 (2), 283 (1969).
10.1097/WOX.0b013e3182439613.
10. А. Г. Cвердлов, Ю. Ф. Мартынчик, А. Г. Богатырев
34.
Н. П. Лебкова, Вестн. Росс. акад. мед. наук, № 9, 16
и В. А. Зайкова, Информ. бюлл. Радиобиология 20
(2000).
(1), 3 (1977).
35.
Н. В. Хундерякова, М. В. Захарченко, А. В. Захар-
11. М. В. Васин, Т. С. Львова, В. В. Антипов и др.,
ченко и М. Н. Кондрашова, Биохимия 73 (3), 337
Радиобиология 20 (1), 56 (1980).
(2008).
12. М. В. Васин, Т. С. Львова, Л. В. Королева и др.,
Радиобиология 22 (6), 818 (1982).
36.
E. H. Sarsour, A. L. Kalen, and P. C. Goswami, Anti-
13. A. D. Cornet, A. J. Kooter, M. J. Peters, and Y. M.
oxid. Redox. Signal
20
(10),
1618
(2014). doi:
Smulders, Crit. Care
17
(2),
313
(2013). DOI:
10.1089/ars.2013.5303.
10.1186/cc12554.
37.
Л. В. Королева и М. В. Васин, Радиобиология 27
14. L. Zheng, C. J. Kelly, and S. P. Colgan, Am. J. Physiol.
(6), 834 (1987).
Cell Physiol. 309 (6), C350 (2015). DOI: 10.1152/ajp-
38.
М. В. Васин, В. Ю. Соловьев, В. Н. Мальцев и др.
cell.00191.2015.
Мед. радиол. Радиац. безопасность
63
(6),
71
15. J. F. Turrens, J. Physiol. 552 (Pt 2), 335 (2003).
(2018).
16. A. Gore, M. Muralidhar, M. G. Espey, et al., J. Immu-
notoxicol. 7 (4), 239 (2010).
39.
М. В. Васин, Т. С. Львова, Н. Н. Добров и др.,
DOI: 10.3109/1547691X.2010.492254.
Фармакол. токсикол. 45 (5), 71 (1982).
17. S. Pendyala and V. Natarajan. Respir. Physiol. Neuro-
40.
М. В. Васин, Т. С. Львова и Л. В. Королева,
biol. 174 (3), 265 (2010).
Радиобиология 22 (4), 539 (1982).
DOI: 10.1016/j.resp.2010.09.016.
41.
E. L. Mills, B. Kelly, A. Logan, et al., Cell 167 (2), 457
18. S. J. Ralph, R. Moreno-Sánchez, J. Neuzil, and S. Ro-
(2016). DOI: 10.1016/ j.cell.2016.08.064.
dríguez-Enríquez. Pharm. Res. 28 (11), 2695 (2011).
DOI: 10.1007/s11095-011-0566-7.
42.
S. A. McGrath-Morrow, and J. Stahl, Biochim. Bio-
19. L. Tretter, A. Patocs, and C. Chinopoulos, Biochim.
phys. Acta 1538 (1), 90 (2001).
Biophys. Acta (BBA) - Bioenergetics 1857 (8), 1086
43.
C. E. Helt, R. C. Rancourt, R. J. Staversky, and
(2016).
M. A. O’Reilly, Toxicol. Sci. 63 (2), 214 (2001).
20. J. Dean, D. K. Mulkey, R. A. Henderson, et al., J.
44. R. J. Staversky, P. F. Vitiello, S. C. Gehen, et al., Free
Aтыppl. Physiol. 96 (2), 784 (2004).
Radic. Biol. Med. 41 (4), 601 (2006).
DOI: 10.1152/japplphysiol.00892.2003.
21. L. J. Buccellato, M. Tso, O. I. Akinci, et al., J. Biol.
45.
A. Ludin, S. Gur-Cohen, K. Golan, et al., Antioxid.
Chem. 279 (8), 6753 (2004).
Redox Signal.
21
(11),
1605
(2014). DOI:
DOI: 10.1074/jbc.M310145200.
10.1089/ars.2014.5941.
БИОФИЗИКА том 64
№ 4
2019
РОЛЬ БИОФИЗИЧЕСКИХ МЕХАНИЗМОВ
785
The Role of Biophysical Mechanisms in Effects of 100% Hyperoxia
that Alter Radiosensitivity of the Body
M.V. Vasin* and I.B. Ushakov** ***
*Russian Medical Academy of Continuous Professional Education, Ministry of Health of Russia Federaion,
Barrikadnaya ul. 2/1, Moscow, 123995 Russia
**Burnasyan Federal Medical Biophysical Center, Federal Medical Biological Agency of Russia,
Zhivopisnaia ul. 46, Moscow, 123182 Russia
***Nikiforov All-Russian Center of Emergency and Radiation Medicine, the Ministry of the Russian Federation for Civil
Defense, Emergencies and Elimination of Consequences of Natural Disasters,
ul. Akademika Lebedeva 4/2, St. Petersburg, 194044 Russia
We consider the hypothesis about the mechanism of radiosensibilizing effects of hyperoxia during irradiation
on the gastrointestinal acute radiation syndrome predicting the outcome in the absence of significant damage
to bone marrow. It has been suggested that increased levels of hyperoxia-induced reactive oxygen species
largely contribute to the enhancement of radiation injury to the intestines in the absence of an effect of hy-
peroxia on this process. Our findings underline a role of accumulation of the toxic effects of reactive oxygen
species production induced by repeated hyperoxia during fractionated irradiation that can worsen the acute
radiation syndrome. We also investigated the role of the preliminary impact of daily vibration exposure on the
enhancement of a radiosensibilizing effect of hyperoxia on the gastrointestinal acute radiation syndrome.
Metabolic changes in regulation of energy supply and demand were analysed from the combined effects of
hyperoxia and ionizing radiation exposure. Possible mechanisms of the radiomitigative action of hyperoxia
on the haematopoietic tissue at short-term 100% oxygen breathing before or after radiation exposure of ani-
mals are discussed. The importance of reactive oxygen species as signaling molecules and cell cycle arrest
caused by hyperoxia in promoting the recovery of hematopoietic function after radiation exposure is shown.
Keywords: gamma radiation, normobaric hyperoxia, reactive oxygen species, “oxygen effect”, radiosensitivity, gly-
oxilate shunt, cell division arrest
БИОФИЗИКА том 64
№ 4
2019