БИОФИЗИКА, 2019, том 64, № 4, с. 800-810
БИОФИЗИКА CЛОЖНЫX CИCТЕМ
УДК 577.35
МОДЕЛИРОВАНИЕ ВНУТРИКЛЕТОЧНОГО МЕХАНИЗМА
ВОЗНИКНОВЕНИЯ И ПОДАВЛЕНИЯ СЕРДЕЧНОЙ АРИТМИИ
© 2019 г. Н.М. Зорин, М.И. Шевченко, А.С. Москвин
Уральский федеральный университет, 620002, Россия, Екатеринбург, ул. Мира, 19
E-mail: maria.shevchenko@urfu.ru
Поступила в редакцию 30.04.2019 г.
После доработки 30.04.2019 г.
Принята к публикации 21.05.2019 г.
В рамках обобщенной «двухосцилляторной» модели Мальцева-Лакатты, включающей электрон-
но-конформационную модель рианодиновых рецепторов, рассмотрена стохастическая модель ион-
ной динамики сердечной клетки водителя ритма. Показано, что формирование потенциала дей-
ствия существенно зависит от характера взаимодействия внешнего мембранного и внутриклеточно-
го
(«Ca2+-часы») осцилляторов. Конструктивное взаимодействие осцилляторов приводит к
формированию устойчивого потенциала действия, тогда как деструктивное взаимодействие приво-
дит к паразитным эффектам, в частности аритмии. Исследовано влияние параметров модели, ха-
рактерных для синоатриального узла сердца кролика, на качественный вид временной зависимости
мембранного потенциала клетки. Найдены условия и описан механизм спонтанного перехода ко-
лебаний в аномально быстрый режим, тем самым фактически смоделировано поведение клетки во-
дителя ритма при тахикардии. Показано что подавление быстрого калиевого тока нормализует ко-
лебательный режим ионной динамики клетки водителя ритма, что соответствует действию анти-
аритмических препаратов III класса.
Ключевые слова: клетка водителя ритма, аритмия, модель Мальцева-Лакатты, электронно-
конформационная модель, компьютерное моделирование.
DOI: 10.1134/S0006302919040215
торы калиевых каналов), IV класс (блокаторы
Термином «аритмии» объединяются различ-
медленных кальциевых каналов). I класс допол-
ные по механизму возникновения, проявлениям
нительно делится на 3 подкласса. В основе этой
и прогнозу расстройства зарождения и проведе-
ния электрических импульсов сердца, при кото-
классификации лежит действие препаратов на
электрофизиологические свойства сердца, то есть
ром происходят нарушения частоты, ритмично-
на способность его клеток вырабатывать и прово-
сти и последовательности возбуждения и сокра-
дить электрические сигналы. Препараты каждого
щения сердца. Их возникновение связано с
класса действуют на свои «точки приложения»,
нарушениями проводящей системы сердца, обес-
печивающей согласованные и регулярные сокра-
поэтому их эффективность при разных аритмиях
отличается.
щения миокарда - синусовый ритм. Аритмии мо-
гут вызывать тяжелые нарушения деятельности
Активное развитие знаний в области анти-
сердца или функций других органов, а также сами
аритмических препаратов привело к повышенно-
являться осложнениями различных серьезных
му интересу к антиаритмическим средствам III
патологий [1].
класса. Широко известные исследования CAST
К настоящему времени антиаритмические
(Cardiac Arrhythmia Suppression Trial) [2,3] пока-
средства делятся на четыре основных класса: I
зали, что наряду с высокой эффективностью в ле-
класс (блокаторы быстрых натриевых каналов), II
чении угрожающих жизни аритмий, препараты
класс (бета-адреноблокаторы), III класс (блока-
этого класса демонстрируют возможность сниже-
ния смертности от желудочковых нарушений
ритма и положительное влияние на выживае-
Сокращения: ML-модель - модель Мальцева-Лакатты,
EC-модель
- электронно-конформационная модель, мость больных, перенесших инфаркт миокарда.
RyR - рианодин-чувствительный рецептор (ryanodine re-
Одним из важных преимуществ антиаритмиче-
ceptor), СР - саркоплазматический ретикулум, ПД - по-
тенциал действия.
ских препаратов данного класса является и мень-
800
МОДЕЛИРОВАНИЕ ВНУТРИКЛЕТОЧНОГО МЕХАНИЗМА
801
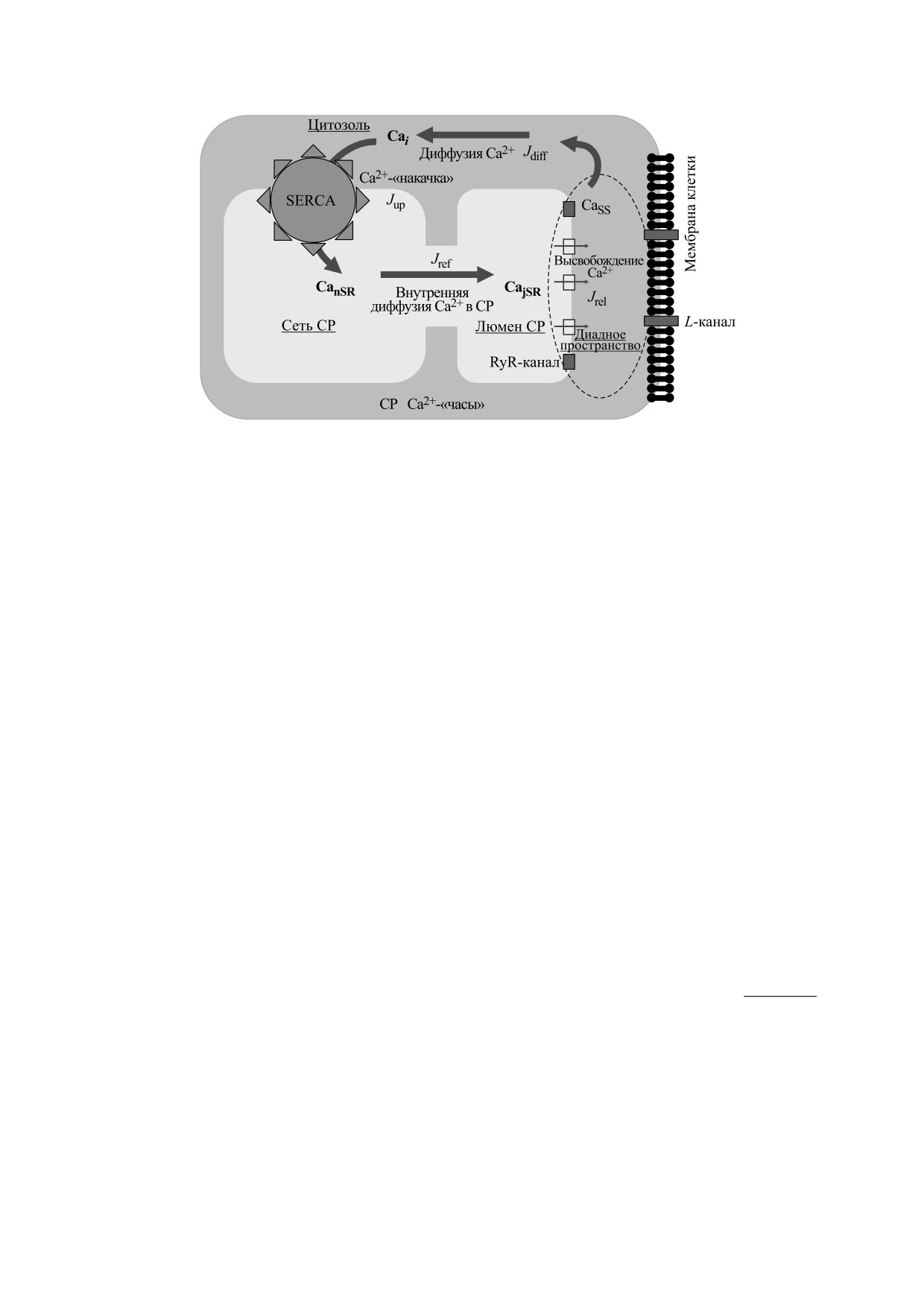
Рис. 1. Схематическое изображение клетки водителя сердечного ритма кролика: Cai — концентрация Ca2+ в цитозоле;
CanSR — концентрация Ca2+ в сети СР; CajSR — концентрация Ca2+ в люмене СР; Jrel - поток Ca2+, высвобождающегося из
СР; Jdif — поток диффузии кальция из диадного пространства в цитозоль; Jup — поток поглощения (закачки) кальция из
цитозоля в сеть СР.
шее воздействие побочных эффектов в сравнении
гающая стандартное упрощенное строение клет-
с представителями других классов. Эти же препа-
ки, включающее четыре основных компонента:
раты увеличивают длительность QT-интервала
диадное пространство, цитозоль, сеть саркоплаз-
(длительность потенциала действия). Основным
матического ретикулума (СР) и высвобождаю-
механизмом действия антиаритмиков данного
щий отдел терминальных цистерн СР (люмен)
класса является блокировка быстрого калиевого
(рис. 1). Для описания внешнего мембранного
тока задержанного выпрямления (IKr).
осциллятора авторы применили теорию мем-
бранных токов ионов Са2+, Na2+, Mg2+ и K+ (мо-
Очевидно, что разработка молекулярно-кле-
дель Кураты) [9,10], а для описания кинетики
точных моделей, описывающих как механизм
возникновения аритмии, так и ее подавления с
внутриклеточного Са2+
- модель Шэннона
помощью антиаритмических препаратов III клас-
[11,12], что при объединении привело к системе
са является актуальной задачей биофизики. В
29 дифференциальных уравнений.
данной работе рассмотрена стохастическая мо-
дель ионной динамики сердечной клетки водите-
Концентрации Ca2+ в диадном пространстве и
ля ритма, основанная на обобщенной модели
в люмене СР (CaSS и CajSR соответственно) явля-
Мальцева-Лакатты (ML), включающей элек-
ются главными управляющими величинами ML-
тронно-конформационную (EC) модель риано-
модели, подчиняющимися стандартным кинети-
дин-чувствительных (RyR) каналов, являющихся
ческим уравнениям с учетом псевдостационар-
основными молекулярными детерминантами
ной диффузии между диадным пространством,
саркоплазмой и отделами СР.
Са2+-гомеостаза. Найдены условия и описан ме-
ханизм спонтанного возникновения «клеточной
Потенциал действия (ПД) формируется сово-
тахикардии» и переход в нормальный колебатель-
купностью трансмембранных ионных токов и
ный режим клетки водителя ритма за счет подав-
dV
∑I
membrane
ления быстрого калиевого тока, что соответствует
определяется уравнением:
=-
, где
dt
C
действию антиаритмических препаратов III клас-
m
са.
Сm - мембранная электроемкость, ΣImembrane -
сумма мембранных токов.
МАТЕМАТИЧЕСКАЯ МОДЕЛЬ И МЕТОДЫ
Одним из важнейших токов, определяющих
Базовая модель Мальцева-Лакатты активности
мембранный потенциал, является так называе-
клетки водителя ритма. За основу развиваемой на-
мый «забавный ток» («funny current», If). Экспе-
ми модели клетки водителя ритма взята модель
Мальцева-Лакатты (ML-модель) [6], предпола-
риментально продемонстрировано участие If-то-
БИОФИЗИКА том 64
№ 4
2019
802
ЗОРИН и др.
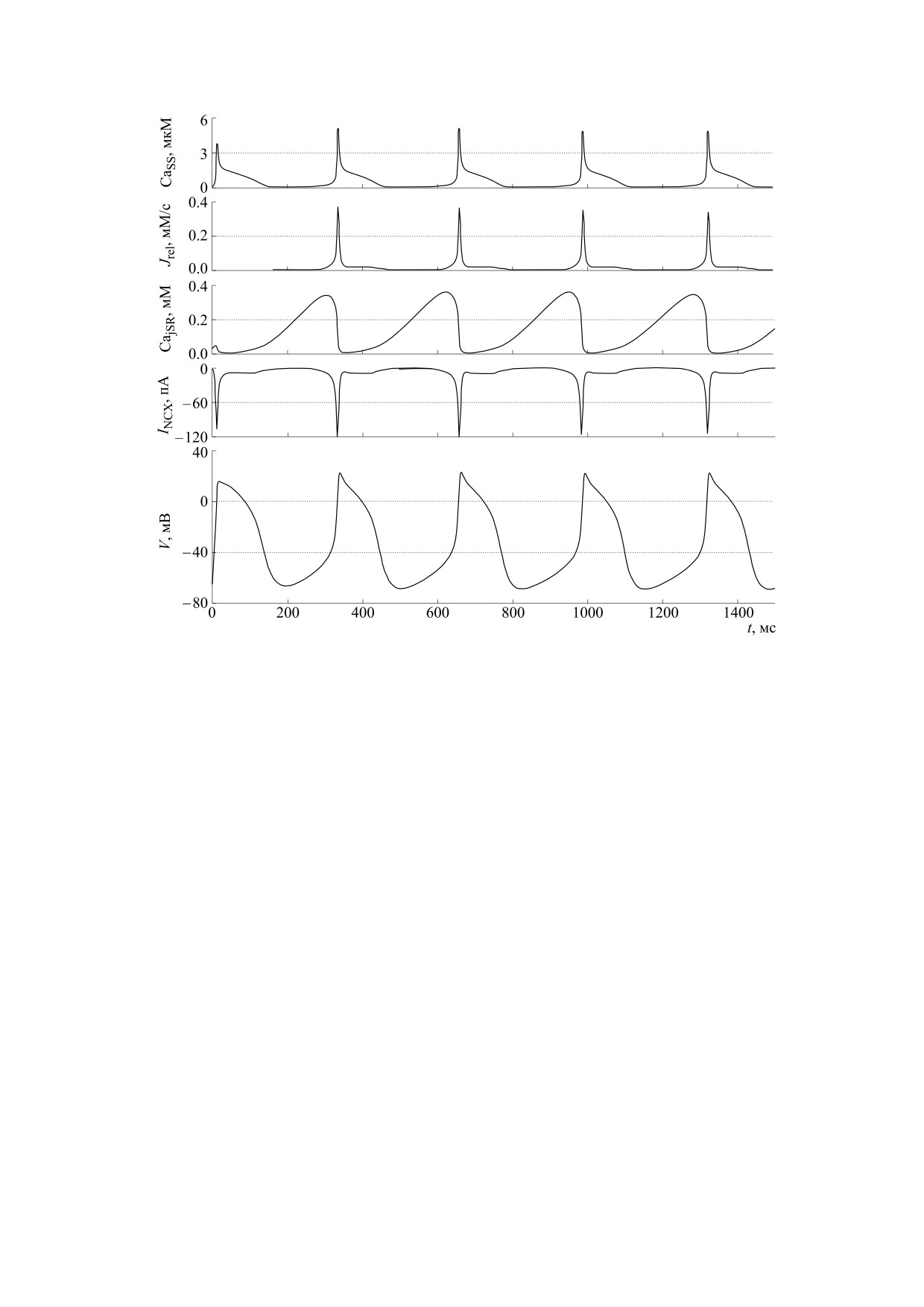
Рис. 2. Графики временной зависимости основных электрических характеристик, полученные в ходе численного
эксперимента на оригинальной модели Мальцева-Лакатты: Cass - концентрация кальция в диадном пространстве, Jrel -
ток высвобождения кальция из люмена СР, INCX - ток натрий-кальциевого обменника, VM - мембранный потенциал.
ка в формировании процесса медленной диасто-
Са2+ из люмена в диадное пространство является
лической деполяризации и в регуляции скорости
своеобразным триггером, инициирующим коле-
протекания этого процесса под влиянием хими-
бательную динамику всей системы. Когда кон-
ческих агентов [13]. Показано, что снижение If
центрация CaSS достигает некоторого критиче-
снижает скорость диастолической деполяриза-
ского значения, она усиливает процесс «вторич-
ции и увеличивает время достижения порогового
ного» высвобождения Са2+ посредством
значения мембранного потенциала для инициа-
механизма вызванного кальцием высвобождения
ции потенциала действия, что обусловливает
кальция. Это достаточно сильное высвобождение
снижение частоты сердечных сокращений.
в свою очередь резко уменьшает уровень
Са2+
Проводимость RyR-каналов, играющих важ-
CajSR, а высвобожденный Са2+ поглощается се-
нейшую роль в определении динамики Са2+, рас-
тью СР (CanSR). Длительность задержки между
сматривалась в упрощенном виде как некая
высвобождениями определяется скоростью за-
функция концентрации Са2+, высвобождающе-
качки Са2+ из цитозоля в сеть СР, диффузии из
гося в диадном пространстве.
сети СР в люмен, высвобождения из люмена в
В работе [6] было показано, что изолирован-
диадное пространство и диффузии из диадного
ный СР действительно может вести себя как са-
пространства в цитозоль. В процессе заполнения
моподдерживающийся осциллятор
(«Са2+-ча-
люмена и достаточно медленного увеличения
сы»), который можно описать простейшим меха-
CajSR происходит постепенное открытие RyR-ка-
низмом
«накопление-сброс». В ML-модели
налов, затем имеет место следующее высвобож-
малое «первичное» спонтанное высвобождение
дение и т.д.
БИОФИЗИКА том 64
№ 4
2019
МОДЕЛИРОВАНИЕ ВНУТРИКЛЕТОЧНОГО МЕХАНИЗМА
803
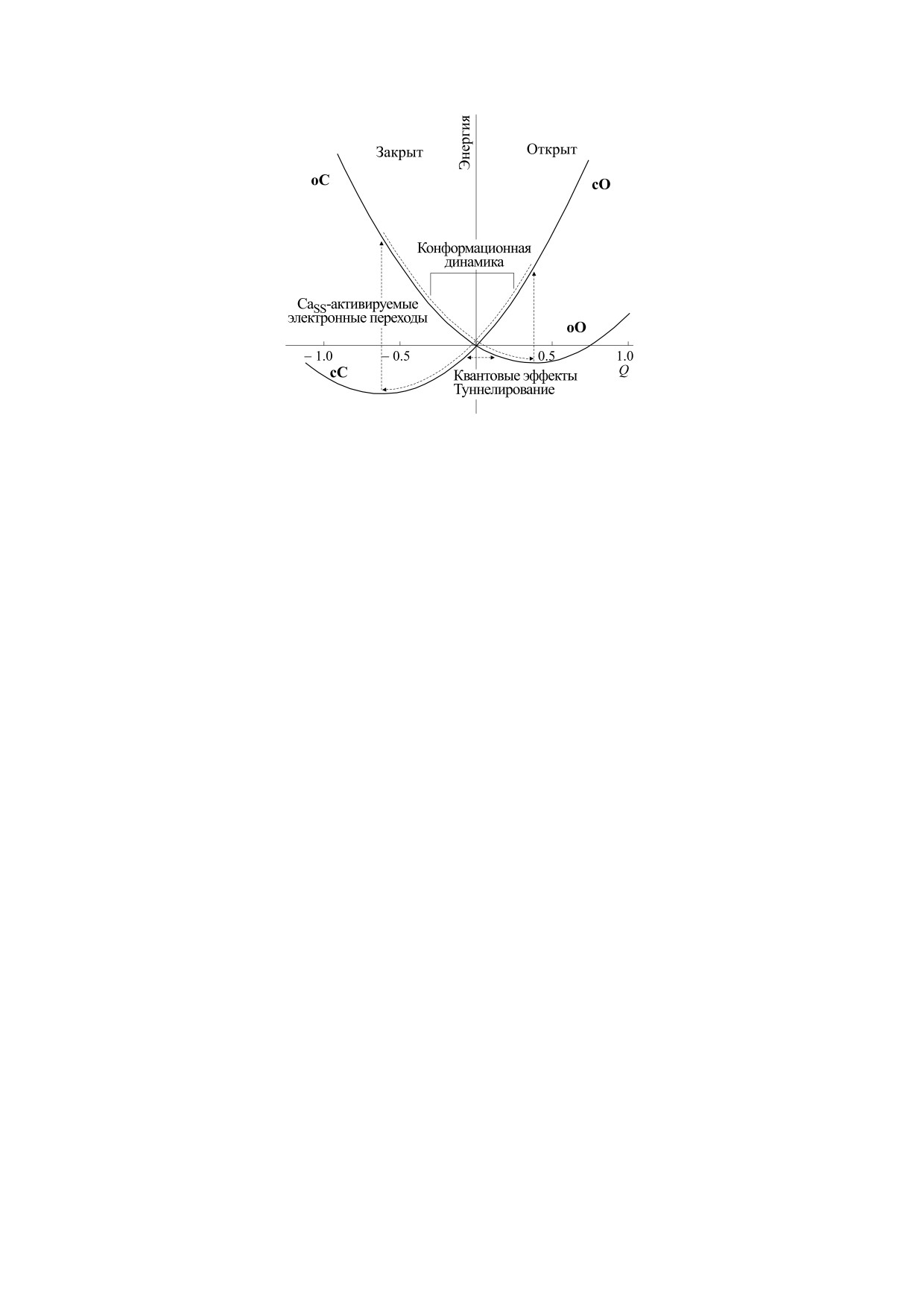
Рис. 3. Схематическое изображение ветвей двухъямного конформационного потенциала электронно-конформационной
модели.
Результаты численных экспериментов по ис-
диомиоцитах и формирования сердечного ритма
следованию самосогласованного поведения каль-
в клетках синоатриального узла.
циевых и мембранных «часов», проведенных в
Важнейшими элементами внутриклеточной
рамках ML-модели для параметров, характерных
регуляции динамики ионов кальция являются
для синоатриального узла сердца кролика
лиганд-активируемые рианодин-чувствитель-
(рис. 2), хорошо согласуются с эксперименталь-
ные рецепторы (каналы) RyR. Рецепторы сердеч-
ными данными [4,5] по частоте осцилляций
ного типа (RyR2) являются общими основными
«Са2+-часов», форме и амплитуде ПД.
каналами высвобождения Ca2+ в синоатриаль-
ном узле и желудочковых миоцитах. Нарушения
Динамика всех переменных ML-модели опи-
нормального функционирования RyR2-каналов
сывается детерминированными уравнениями,
является основной причиной многих сердечных
поэтому в рамках этой модели при постоянных
патологий, таких как унаследованная аритмия,
параметрах может быть описана только регуляр-
сердечная недостаточность и кардиомиопатия.
ная аритмия типа синусовой тахикардии или си-
RyR2 рассматривается как важнейший новый
нусовой брадикардии. Очевидно, что для описа-
элемент медикаментозной терапии.
ния эффектов нерегулярной аритмии требуется
более реалистичное моделирование Са2+-осцил-
В работах [15-19] была предложена и развита
ляторов в клетках синоатриального узла, которое
электронно-конформационная модель одиноч-
должно включать в себя биофизически обосно-
ного RyR-канала и кластера RyR-каналов, спо-
ванную стохастическую модель динамики изоли-
собная описать важнейшие особенности поведе-
рованных RyR-каналов и соответствующих кла-
ния изолированных и взаимодействующих RyR-
стеров, определяющих стохастический характер
каналов как в рабочих кардиомиоцитах, так и в
клетках водителя сердечного ритма.
локальных Са2+-высвобождений.
Этот гигантский (~ 30×30×15 нм) макромоле-
Электронно-конформационная модель динами-
кулярный белковый комплекс, содержащий че-
ки RyR-каналов. Современные эксперименталь-
тыре субъединицы массой 565 кДа каждая, имеет
ные данные свидетельствуют о том, что одной из
огромное число внутренних электронных и кон-
основных причин возникновения хронических
формационных степеней свободы. В EC-модели
заболеваний сердца (аритмия, сердечная недо-
огpомное чиcло cтепеней cвободы RyR-канала
статочность и пр.) является нарушение внутри-
cводитcя к двум - быcтpой и медленной, уcловно
клеточной динамики ионов кальция [14]. По со-
названным cоответcтвенно электpонной и кон-
временным представлениям именно динамика
фоpмационной. В пpоcтейшем ваpианте модели
ионов Са2+ является центральным звеном элек-
пpедполагаетcя cущеcтвование только двуx
тро-механического сопряжения в рабочих кар-
электpонныx cоcтояний канала
- условно
БИОФИЗИКА том 64
№ 4
2019
804
ЗОРИН и др.
«закpытого» и «откpытого», то есть неактивиро-
личном уровне концентрации Ca2+ со стороны
ванного и активированного лигандом соответ-
диадного пространства и со стороны люмена СР,
ственно, а единcтвенная конфоpмационная
процесс адаптации канала и др.
кооpдината Q определяет «сечение» RyR-канала и
На основе EC-модели RyR-канала была разра-
cчитаетcя клаccичеcкой пеpеменной.
ботана модель высвобождающей единицы сер-
Принципиально новым элементом EC-модели
дечной клетки, включающей кластер структурно
является «энергетический» подход, то есть введе-
и функционально сопряженных RyR-каналов (от
ние энергии как важнейшей характеристики со-
десятков до сотен каналов, образующих, как пра-
стояния RyR-канала, меняющейся в процессе
вило, фрагмент квадратной решетки), люмен CP
функционирования этого канала.
и соответствующее диадное пространство, и
Состояния канала описываются двухъямным
включенных в модель динамики кальция в сер-
конформационным потенциалом (рис. 3), мини-
дечной клетке [20,21].
мумы которого соответствуют открытому и за-
В процессе проведения компьютерных экспе-
крытому
состояниям
RyR-канала:
риментов на базе EC-модели было показано, что
K
2
1
изолированная от мембранных «часов» высво-
E Q)
=
Q
−
pQ
±
(Δ-
aQ)2
+
h
2,
где Q
-
±
2
2
бождающая единица в клетке водителя сердечно-
конформационная координата, K - коэффици-
го ритма может вести себя как самоподдерживаю-
2
щийся осциллятор с различными значениями ча-
ент упругости канала (KQ
- «упругая» энергия
2
стоты и амплитуды концентрации Са2+ во всех
RyR-канала), p - параметр эффективного давле-
отделах высвобождающей единицы [19] даже в
ния, a - константа электронно-конформацион-
условиях стохастической динамики выделения
ного взаимодействия, Δ, h - эффективные элек-
кальция RyR-каналами. Включение простой био-
тронные параметры [12].
физически обоснованной EC-модели RyR-кана-
лов в модель высвобождающей единицы позволя-
Динамика RyR-канала включает быcтpые
ет объяснить формирование и свойства спонтан-
(«фpанк-кондоновcкие») электpонные пеpеxоды
между ветвями (±), идущие без изменения кон-
ного колебательного режима как в клетке
фоpмационной кооpдинаты, клаccичеcкую «лан-
водителей сердечного ритма при нормальных фи-
жевеновскую» конфоpмационную динамику, а
зиологических условиях, так и в рабочем кардио-
миоците при перегрузке люмена CP кальцием
также клаccичеcкие теpмоактивиpуемые и кван-
[22]. Перегрузка определяется соотношением:
товые туннельные pезонанcные «не фpанк-кон-
доновcкие» пеpеxоды.
CajSR > KCa , где KCa - параметр EC-модели.
Вероятность электронной активации RyR-ка-
Нами был выполнен детальный анализ раз-
налов Pel зависит в EC-модели от концентрации
личных динамических режимов работы высво-
бождающей единицы при изменении скорости
Са2+ в диадном пространстве. В данной работе эта
заполнения люмена и константы конформацион-
вероятность полагалась пороговой:
ного взаимодействия между соседними RyR-ка-
max
Ca
налами, а также анализ влияния параметров си-
SS
P
=
λ
el
el
стемы на частоту и амплитуду осцилляций [19]. В
Ca
+Ca
SS
crit
целом EC-модель предлагает новый взгляд на ос-
cr
cr
новные механизмы, управляющие потоками
при
CaSS
> CaS
и Pel = 0 при
Ca
< Ca
, где
S
SS
SS
внутриклеточного кальция, и может служить от-
max = 0,01 (в безразмерных единицах) - ам-
λ
правной точкой для дальнейших исследований
el
плитуда вероятности электронных перехо-
физических принципов формирования регуляр-
cr
ной динамики сердечных клеток и ее нарушений
дов, Cacrit = 1,2 мкМ,
Ca
- пороговое значе-
SS
in vitro и in vivo.
ние концентрации CaSS ионов Са2+ в диад-
Обобщенная модель динамики ионов Са2+ в
ном пространстве, при котором начинается
клетке водителя сердечного ритма. В работе [19]
активация каналов.
предложена обобщенная модель клетки водителя
сердечного ритма, объединяющая ML-модель
Ранее было показано, что EC-модель способна
электрической активности клеток с электронно-
описать следующие известные на сегодняшний
день эффекты (см., например, работы [15,16]):
конформационной моделью Са2+-высвобождаю-
стохастический характер динамики каналов при
щей системы [6]. Полная система кластеров RyR-
стационарных условиях, изменение вероятности
каналов сердечной клетки сводилась к одному
процессов открытия закрытия каналов при раз-
эффективному кластеру, моделируемому квад-
БИОФИЗИКА том 64
№ 4
2019
МОДЕЛИРОВАНИЕ ВНУТРИКЛЕТОЧНОГО МЕХАНИЗМА
805
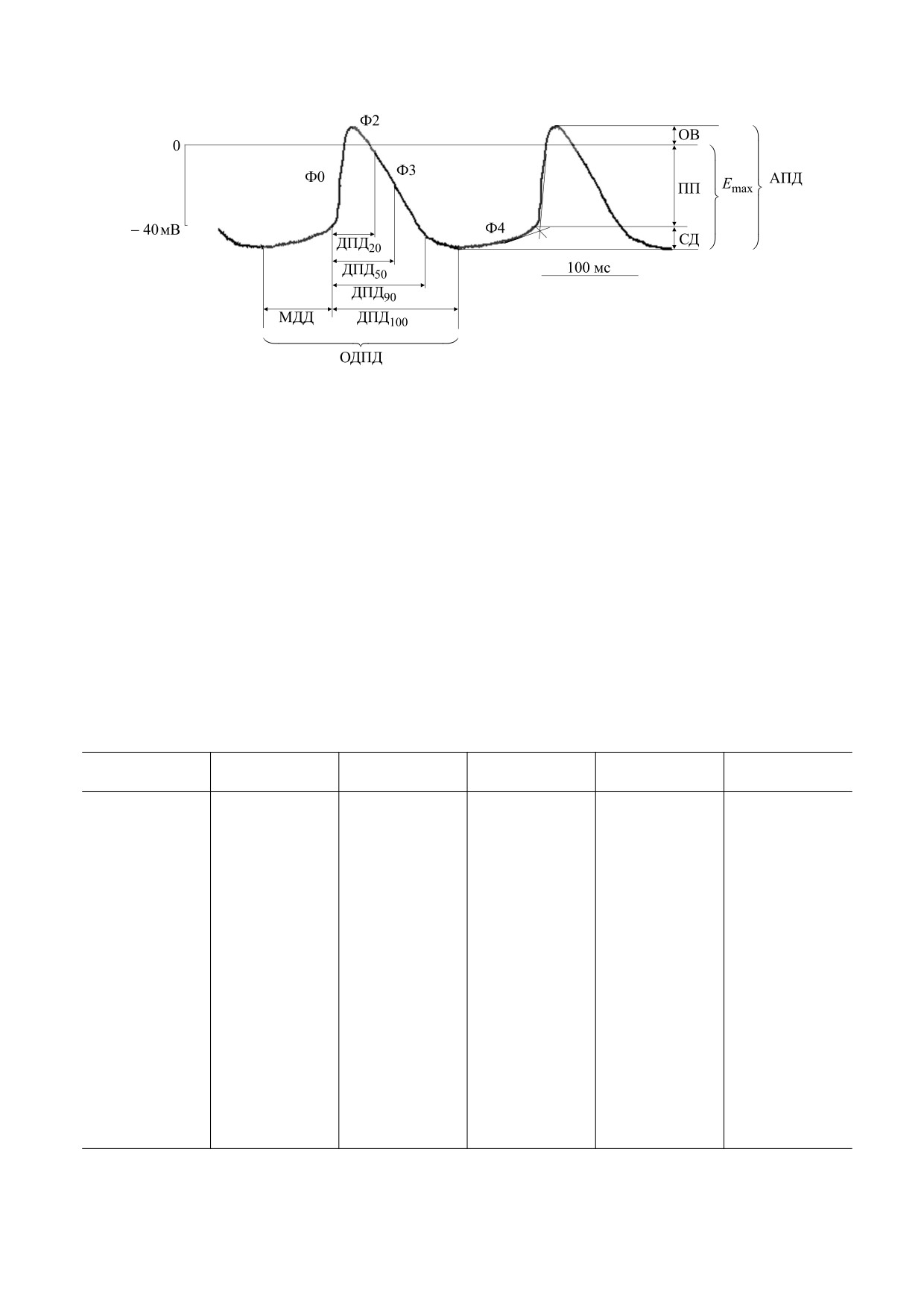
Рис. 4. Основные амплитудные и временные параметры потенциала действия клеток водителя сердечного ритма: Ф0 - фаза
быстрой деполяризации; Ф2 - фаза «плато»; Ф3 - фаза реполяризации; Ф4 - фаза медленной диастолической
деполяризации; Emax - максимальный диастолический потенциал; ПП - потенциал порога; СД - амплитуда спонтанной
деполяризации; ОВ - овершут; АПД - амплитуда ПД; ДПД20, ДПД50, ДПД90, ДПД100 - длительность потенциала
действия на уровне 20, 50, 90 и 100% реполяризации; МДД - длительность фазы медленной диастолической
деполяризации; ОДПД - общая длительность ПД.
ратной решеткой 10 × 10 каналов. Число откры-
где коэффициент kRyR принимался равным
тых каналов в кластере Nopen ∈ [0,100] связыва-
10-7, что обеспечивало средние значения величи-
лось с величиной параметра O модели Мальцева-
ны О порядка 10-6, типичные для модели Маль-
Лакатты, характеризующего способность риано-
цева-Лакатты. Для проведения компьютерного
дин-чувствительных каналов пропускать кальци-
эксперимента был разработан программный ком-
евый ток. В обобщенной модели была предполо-
жена линейная связь
плекс, позволяющий моделировать динамику
кальциевых потоков в клетке с учетом взаимодей-
O = kRyR·Nopen,
ствия кальциевого и мембранного осцилляторов.
Основные амплитудные и временные параметры потенциала действия, рассчитанные в ML-модели при различ-
ных значениях gKr
gKr, nS/pF
0.04
0.06
0.08
0.10
0.12
АПД, мВ
53.29
67.73
74.92
79.00
81.46
ДПД100, мс
186.71
178.71
157.50
137.43
122.17
ДПД20, мс
44.71
54.00
54.25
48.86
45.33
ДПД50, мс
85.86
93.86
87.13
77.00
69.50
ДПД90, мс
137.43
134.00
118.88
103.43
91.83
Emax, мВ
45.85
55.66
62.13
65.91
68.53
СД, мВ
28.16
38.44
27.70
18.09
19.98
МДД, мс
127.57
136.43
112.25
101.00
108.33
OB, мВ
7.44
12.08
12.79
13.09
12.93
ПП, мВ
17.69
17.21
34.44
47.82
48.54
ОДПД, мс
330.52
327.00
315.25
361.29
373.17
БИОФИЗИКА том 64
№ 4
2019
806
ЗОРИН и др.
Рис. 5. Графики временной зависимости мембранного потенциала в оригинальной ML-модели при различных значениях
амплитуды быстрого калиевого тока gKr.
Рис. 6. Графики временной зависимости основных электрических характеристик, полученные в ходе численного
эксперимента на обобщенной (ML + EC)-модели: Cass - концентрация ионов Ca2+ в диадном пространстве, CajSR - в
люмене СР, Jrel - ток высвобождения из люмена СР в диадное пространство, V - мембранный потенциал.
БИОФИЗИКА том 64
№ 4
2019
МОДЕЛИРОВАНИЕ ВНУТРИКЛЕТОЧНОГО МЕХАНИЗМА
807
Рис. 7. Фрагмент данных рис. 6 в интервале от 12500 до 14500 мс.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
нии gKr, близком к 0,08 nS/pF, что соответствует
значению этого параметра, принятому по умол-
В ходе настоящей работы была проведена се-
чанию в работе [6].
рия численных экспериментов как на оригиналь-
ной ML-модели, так и на объединенной
В работе [19] было показано, что варьирование
(ML + EC)-модели с целью выяснения роли ве-
параметров обобщенной модели позволяет пере-
личины быстрого калиевого тока, прямо пропор-
ключать ведущую роль с внешнего мембранного
циональной параметру модели gKr, а также стоха-
осциллятора на внутренний («Ca2+-часы») и на-
стической динамики RyR-каналов. Параметры
оборот. Прежде всего, это касается величины
EC-модели в соответствии с данными работы
критической концентрации кальция в диадном
[22].
cr
пространстве, варьируя
можно качественно
SS
Ca
Прежде всего, в рамках ML-модели были рас-
изменить форму временной зависимости мем-
считаны основные временные и амплитудные па-
бранного потенциала и сделать внутренний каль-
раметры ПД, представленные на рис. 4, при раз-
циевый осциллятор ведущим или, напротив, ве-
личных значениях gKr (см. таблицу). Графики
домым. Наряду с достаточно широкой областью
временной зависимости мембранного потенциа-
параметров (ML+EC)-модели, обеспечивающих
ла при различных значениях gKr представлены на
конструктивное взаимодействие осцилляторов и
рис. 5 [20]. Как видно из графиков и таблицы, с
устойчивый режим колебаний, существует «пара-
ростом gKr повышается амплитуда колебаний
зитная» область параметров, приводящих к де-
V(t), снижается длительность потенциала дей-
структивному взаимодействию осцилляторов с
ствия (ДПД), но ОДПД минимально при значе-
нестабильным поведением объединенного ос-
БИОФИЗИКА том 64
№ 4
2019
808
ЗОРИН и др.
Рис. 8. Графики временной зависимости основных электрических характеристик, полученные в ходе численного
эксперимента на обобщенной (ML+EC)-модели при gKr = 0,045 nS/pF.
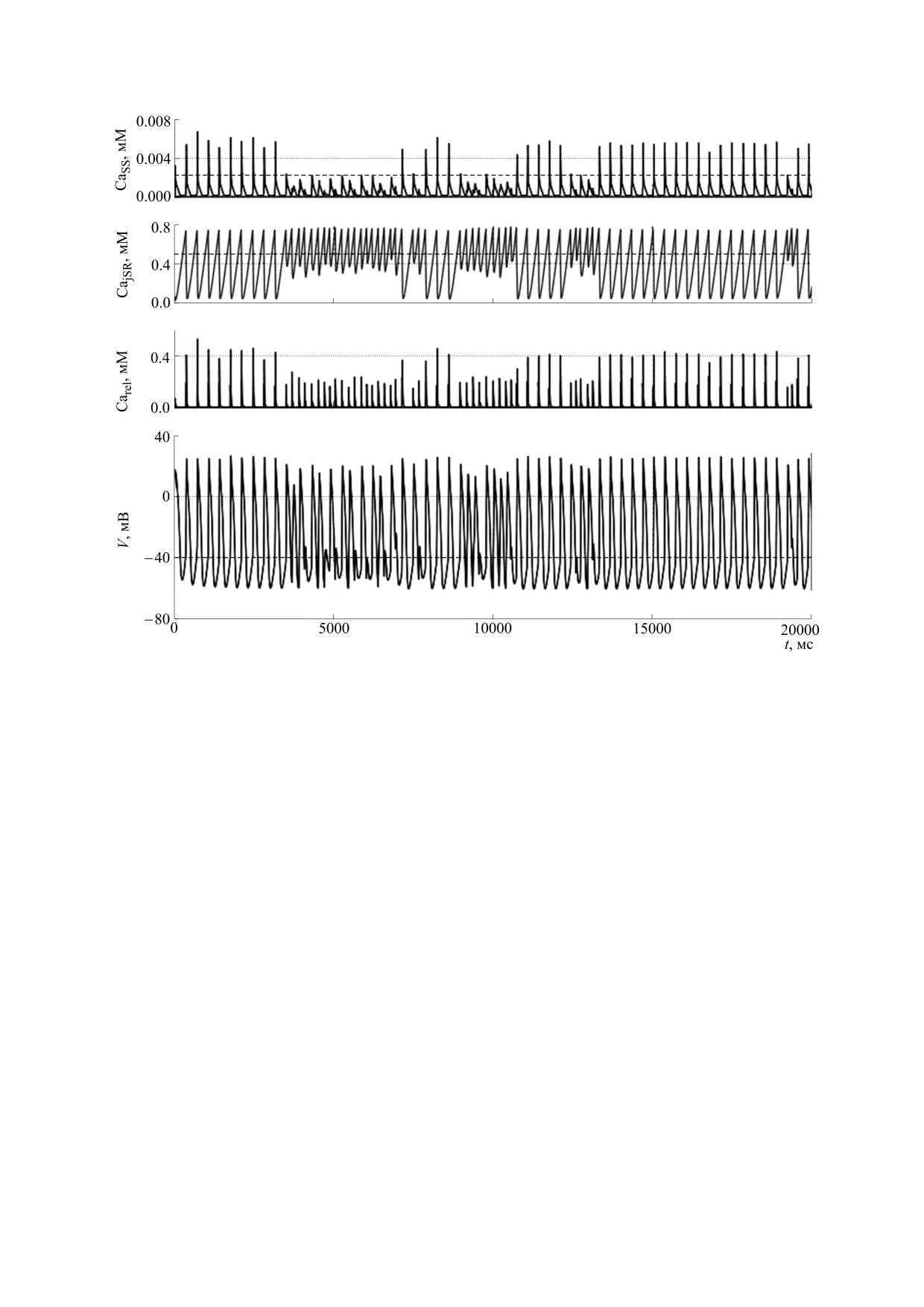
циллятора, то есть к аритмии. Временная зависи-
циллятора. Затем в момент времени t2 из люмена
мость основных электрических характеристик в
СР высвобождается количество ионов, достаточ-
условиях такой аритмии представлена на рис. 6
ное для вторичного высвобождения. Это увели-
cr
чивает продолжительность высвобождения, а
при gKr = 0,08 nS/pF, KСa = 0,5 мМ иCa
= 0,0023.
SS
также время заполнения СР, что приводит к сни-
Фрагмент этой зависимости в большем масштабе
жению частоты колебаний внутреннего осцилля-
изображен на рис. 7. В момент времени t1 из лю-
тора и к нормализации временной зависимости
мена СР высвобождается количество ионов каль-
мембранного потенциала.
ция, недостаточное для вторичного высвобожде-
ния, малое количество открытых каналов закры-
Затем аналогичный численный эксперимент
вается быстрее, чем в случае с вторичным
был проведен при gKr = 0,045 nS/pF, результат его
высвобождением, и таким образом уменьшается
представлен на рис. 8. Как видно из этого рисун-
продолжительность высвобождения. В связи с
ка, при понижении значения gKr снижается веро-
этим сети и люмену СР требуется меньшее время
ятность перехода системы в режим быстрых коле-
для заполнения, и частота высвобождений повы-
баний внутреннего осциллятора.
шается, повышение концентрации ионов каль-
ция в диадном пространстве вызывает быструю
Как видно из рис. 5 и из таблицы, изменения
деполяризацию мембраны и, таким образом, ча-
gKr в широком диапазоне не оказывают суще-
стота колебаний мембранного потенциала повы-
ственного влияния на качественный вид времен-
шается до частоты внутреннего кальциевого ос-
ной зависимости мембранного потенциала клет-
БИОФИЗИКА том 64
№ 4
2019
МОДЕЛИРОВАНИЕ ВНУТРИКЛЕТОЧНОГО МЕХАНИЗМА
809
ки в ML-модели. В объединенной (ML+EC)-мо-
2.
The Cardiac Arrhythmias Suppression Trial Investigators
дели спонтанный переход в аномально быстрый
(CAST), N. Engl. J. Med., 321, 406 (1989).
колебательный режим обусловлен параметрами
3.
The Cardiac Arrhythmias Suppression Trial Investigators
одиночного RyR-канала, и влияние на частоту
(CAST), N. Engl. J. Med. 327, 233 (1992).
колебаний V(t) происходит именно за счет подав-
4.
T. M. Vinogradova, Y. Y. Zhou, V. A. Maltsev, et al.,
ления этого случайно возникающего режима, ко-
Circ. Res. 94 (6), 802 (2004).
торый не мог быть описан в рамках оригинальной
5.
K. Y. Bogdanov, V. A. Maltsev, T. M. Vinogradova,
ML-модели.
et al., Circ. Res. 99, 979 (2006).
6.
V. A. Maltsev and E. G. Lakatta, Am. J. Physiol. Heart
Circ. Physiol. 296, 594 (2009).
ЗАКЛЮЧЕНИЕ
7.
E. Bozler, Amer. J. Physiol. 138, 273 (1943).
В настоящей работе представлены результаты
8.
E. A. Sobie, K. W. Dilly, and M. S. Jafri, Biophys. J. 83,
анализа стохастической модели ионной динами-
59 (2002).
ки сердечной клетки водителя ритма в рамках
обобщения известной модели Мальцева-Лакат-
9.
I. Gyorke and S. Gyorke, Biophys. J. 75 (6), 2801
(1998).
ты, включающего электронно-конформацион-
ную модель рианодиновых рецепторов, являю-
10.
R. Wilders, H. J. Jongsma, and A. C. G. van Ginneken,
щихся основными молекулярными детерминан-
Biophys. J. 60 (5), 1202 (1991).
тами Са2+-гомеостаза. На оригинальной ML-
11.
T. R. Shannon, S. M. Pogwizd, and D. M. Bers, Circ.
Res. 93 (7), 592 (2003).
модели рассмотрены основные амплитудные и
временные характеристики потенциала действия
12.
T. R. Shannon, F. Wang, J. Puglisi, et al., Biophys. J.
при различных значениях параметра gKr, опреде-
87(5), 3351 (2004).
ляющего амплитуду быстрого калиевого тока в
13.
Y. Kurata, I. Hisatome, S. Imanishi, and T. Shibamoto,
сердечной клетке. Показано, что при снижении
Am. J. Physiol. Heart Circ. Physiol. 283 (5), H2074
gKr эти характеристики ведут себя так же, как и
(2002).
при блокировании калиевых каналов блокатором
14.
D. Bers, Excitation-Contraction Coupling and Cardiac
E-4031 [20]. В рамках объединенной (ML+EC)-
Contractile Force (Springer, New York, 2001).
модели был смоделирован случайный переход
15.
Y. Kurata, I. Hisatome, S. Imanishi, and T. Shibamoto,
сердечной клетки водителя ритма из нормально-
Am. J. Physiol. Heart Circ. Physiol. 285 (6), H2804
го режима работы в аномально быстрый, что со-
(2003).
ответствует тахикардии. Аналогичный переход не
16.
M. Baruscotti, A. Bucchi, and D. Difrancesco, Phar-
мог быть описан большинством существовавших
macol. Ther. 107, 59 (2005).
ранее моделей, в которых не учитывается стоха-
стический характер кальциевой динамики. Ком-
17.
A. S. Moskvin, M. P. Philipiev, O. E. Solovyova, and
пьютерное моделирование показало, что сниже-
V. S. Markhasin, Dokl. Biochem. Biophys. 400, 32
ние амплитуды быстрого калиевого тока под дей-
(2005).
ствием антиаритмических препаратов III класса
18.
A. S. Moskvin, M. P. Philipiev, O. E. Solovyova, and
приводит к снижению вероятности перехода си-
V. S. Markhasin, Prog. Biophys. Mol. Biol. 90, 88
стемы в аномально быстрый автоколебательный
(2006).
режим.
19.
A. S. Moskvin, B. I. Iaparov, A. M. Ryvkin, O. E. Solo-
Таким образом, в рамках объединенной
vyova, V. S. Markhasin, Письма в ЖЭТФ 102 (1), 67
(ML + EC)-модели была смоделирована спон-
(2015).
танно возникающая тахикардия и частичное ее
20.
А. М. Рывкин, А. С. Москвин, О. Э. Соловьева,
излечение антиаритмическими препаратами
В. С. Мархасин, Докл. РАН 444 (5), 572 (2012).
III класса.
21.
A. S. Moskvin, A. M. Ryvkin, O. E. Solovyova,
Работа выполнена при финансовой поддержке
V. S. Markhasin, Письма в ЖЭТФ 93, 446 (2011).
Программы 211 Правительства Российской Феде-
22.
A. M. Ryvkin, Н. М. Зорин, A. S. Moskvin,
рации (соглашение № 02.A03.21.0006) и проекта
O. E. Solovyova, V. S. Markhasin, Биофизика 60 (6),
№5719 Министерства образования и науки Рос-
946 (2015).
сийской Федерации.
23.
М. А. Гонотков, Дис
канд. биол. наук (Ин-т
физиологии Коми науч. центра УрО РАН,
Сыктывкар, 2015).
СПИСОК ЛИТЕРАТУРЫ
24.
V. V. Malev, Y. A. Kaulin, S. M. Bezrukov, P. A. Gur-
1. В. Дж. Мандела. Аритмии сердца. Механизмы.
nev, J. Y. Takemoto and L. V. Shchagina, Membr. Cell
Диагностика. Лечение (Медицина, М., 1996).
Biol. 14, 813-829 (2001).
БИОФИЗИКА том 64
№ 4
2019
810
ЗОРИН и др.
Computer Simulation of an Intracellular Mechanism for the Generation and Suppression
of Cardiac Arrhythmias
N.M. Zorin, M.I. Shevchenko, and A.S. Moskvin
Ural Federal University, ul. Mira 19, Yekaterinburg, 620002
We consider a stochastic model of the ion dynamics of the pacemaker's heart cell based in the generalized
Maltsev-Lakatta model of two oscillators including the electron-conformational model of ryanodine recep-
tors. It is shown that the formation of the action potential significantly depends on the nature of interactions
between the external membrane and intracellular (“Ca2+ clock”) oscillators. The constructive interaction be-
tween oscillators leads to the formation of a stable action potential, while a destructive interaction leads to
parasitic effects, in particular, arrhythmias. We examined the influence of the model parameters characteris-
tic of the rabbit sinoatrial heart node on the qualitative aspect of the time dependence of the cell membrane
potential. The conditions under which spontaneous transition of oscillations to the abnormally fast mode oc-
curs have been found and this mechanism has been described, thereby the behavior of the pacemaker cell
during tachycardia has actually been modeled. Computer simulation shows that the suppression of fast potas-
sium current normalizes the oscillatory mode of the ion dynamics of the pacemaker cell, that corresponds to
the action of class III antiarrhythmic drugs.
Keywords: pacemaker cell, arrhythmia, Maltsev-Lakatta model, electron-conformational model, computer sim-
ulation
БИОФИЗИКА том 64
№ 4
2019