БИОФИЗИКА, 2019, том 64, № 4, с. 811-820
БИОФИЗИКА CЛОЖНЫX CИCТЕМ
УДК 616-07
ПРЕЦИЗИОННЫЙ ПОДХОД К ДИАГНОСТИКЕ И ВЫБОРУ ТАКТИКИ
ЛЕЧЕНИЯ ГИПЕРПЛАЗИИ ЭНДОМЕТРИЯ В ПЕРИМЕНОПАУЗЕ
© 2019 г. Е.А. Коган, А.Л. Унанян, В.А. Намиот*, Д.В. Бабурин, С.Н. Удальцов**
Первый Московский государственный медицинский университет имени И.М. Сеченова МЗ РФ,
119991, Москва, ул. Трубецкая, 8/2
*Институт ядерной физики Московского государственного университета имени М.В. Ломоносова,
119991, Москва, Ленинские горы, 1
**Институт физико-химических и биологических проблем почвоведения РАН,
142290, Пущино Московской области, ул. Институтская, 2
E-mail: vnamiot@gmail.com
Поступила в редакцию 19.04.2019 г.
После доработки 19.04.2019 г.
Принята к публикации 30.04.2019 г.
Исследование посвящено выявлению наиболее значимых клинико-анамнестических и молекуляр-
ных факторов риска возникновения, прогрессирования гиперпластических процессов эндометрия
и развития злокачественной трансформации эндометрия у женщин перименопаузального возраста
с учетом статистического анализа. Полученные результаты позволили выявить статистически зна-
чимые факторы риска развития рака эндометрия. С использованием метода бинарной логистиче-
ской регрессии была рассчитана степень риска развития рака и выбрана эффективная тактика веде-
ния больных с гиперпластическими процессами эндометрия в перименопаузе.
Ключевые слова: гиперпластический процесс эндометрия, гиперплазия эндометрия, рак эндометрия,
факторы риска, перименопауза, прогнозирование рака, стволовые клетки.
DOI: 10.1134/S0006302919040227
ного эндометрия остается открытым. Степень
Актуальность проблемы гиперпластических
риска малигнизации различных вариантов ГПЭ
процессов эндометрия (ГПЭ) обусловлена высо-
определяется морфологическим состоянием эн-
кой частотой (10-55%) их встречаемости у жен-
дометрия, вместе с тем отсутствуют четкие крите-
щин, особенно в перименопаузальном возрасте,
рии в оценке степени атипических изменений и
возможности рецидивирования и малигнизации
прогнозировании рака эндометрия [7].
[1-3].
Современный уровень развития молекуляр-
Несвоевременные диагностика и лечение ги-
ной медицины позволил осуществить значитель-
перпластического процесса эндометрия могут
ный прогресс в исследовании особенностей экс-
явиться причиной прогрессирования патологи-
прессии генов, задействованных в онкогенезе и
ческого процесса эндометрия и его злокачествен-
при патологических процессах эндометрия
ной трансформации, что особенно насторажива-
[4,8,9].
ет с учетом неуклонного роста заболеваемости ра-
ком тела матки [4,5]. В России заболеваемость
Понимание новых ключевых патогенетиче-
раком эндометрия за последние 10 лет увеличи-
ских механизмов, вовлеченных в патогенез ГПЭ,
лась с 119,9 до 175,5 случаев на 100 тыс. человек
способствует формированию критериев для со-
населения и составляет 7,1% всех онкологических
здания эффективной модели прогнозирования
больных России [6].
онкопатологии эндометрия, а также выявлению
мишеней для целенаправленного фармакологи-
Однако до настоящего времени вопрос о зло-
ческого воздействия на патологически изменен-
качественной трансформации гиперплазирован-
ные клетки, с целью профилактики рецидивиро-
Сокращения: ГПЭ - гиперпластические процессы эндо-
вания и онкотрансформации.
метрия, CSC - cancer stem cells («раковая стволовая клет-
ка»), ОР - показатель относительного риска развития рака
В настоящее время растет число доказательств
эндометрия.
присутствия раковых стволовых клеток (Cancer
811
812
КОГАН и др.
stem cells - CSC) при большинстве опухолевых
HOXA10 - и определить их патогенетическую
заболеваний и увеличения корреляции их обна-
роль при патологических процессах эндометрия;
ружения с развитием рака, а также наличия ле-
3. Разработать патогенетически обоснованный
карственной устойчивости и рецидивирования
подход к формированию групп повышенного он-
таких опухолей [9-11]. Однако вопросы, связан-
кологического риска на основании анализа сопо-
ные с нарушением дифференцирования стволо-
ставления клинических и молекулярно-биологи-
вых клеток эндометрия, обнаружением CSC и их
ческих показателей гиперпластических процес-
патогенетической роли в прогрессировании па-
сов эндометрия;
тологического процесса и развития рака эндомет-
4. Провести ретроспективный анализ прове-
рия, ждут своего освещения.
денной стандартной терапии гиперпластических
Очевидно, что внедрение в клиническую прак-
процессов эндометрия в сопоставлении с выяв-
тику обследования пациенток с ГПЭ новых им-
ленными степенями риска злокачественной
муногистохимических методов исследования
трансформации эндометрия и обосновать диф-
биоптатов позволит существенно повысить точ-
ференцированный подход к терапии больных с
ность диагностики, эффективность прогнозиро-
гиперпластическими процессами эндометрия в
вания онкопатологии и адекватность выбора ме-
перименопаузальном возрасте.
тода лечения.
Взгляды на тактику лечения больных с ГПЭ
МАТЕРИАЛЫ И МЕТОДЫ
довольно разноречивы. Сложность проблемы со-
В настоящее исследование были включены
стоит в определении оптимального метода тера-
191 пациентка перименопаузального возраста,
пии. Предлагаемые варианты лечения гиперпла-
средний возраст составил 47,3 ± 4,4 года.
зии эндометрия весьма разнообразны, начиная с
выскабливания слизистой полости матки с по-
После гистологического исследования состоя-
следующим динамическим наблюдением и за-
ния эндометрия все обследованные пациентки
канчивая пангистерэктомией [8,12,13].
были разделены на четыре группы в зависимости
от морфологического заключения. В группу 1
Перспективным направлением в решении
(контрольную) вошли 32 женщины без морфоло-
указанных проблем является объективное фор-
гических признаков гиперпластического и опухо-
мирование групп онкологического риска.
левого процессов эндометрия, в группу 2- 81 па-
Изучение индивидуального прогнозирования
циентка с гиперплазией эндометрия без атипии, в
течения заболевания у пациенток с ГПЭ на совре-
группу 3 - 55 женщин с гиперплазией эндомет-
менном этапе приобретает все большее значение
рия с атипией, в группу 4 - 23 пациентки с высо-
в силу необходимости составления на базе научно
кодифференцированной аденокарциномой эн-
обоснованного прогноза - рационального и диф-
дометрия.
ференцированного плана лечения, а также прове-
С целью выявления клинико-анамнестиче-
дения диспансерного наблюдения.
ских особенностей у обследованных больных в
Цель настоящей работы - определить клини-
зависимости от вида патологического процесса
ческое значение иммуногистохимических марке-
эндометрия был проведен тщательный сравни-
ров стволовых клеток у пациенток перименопау-
тельный анализ полученных клинических пока-
зального возраста при гиперпластических про-
зателей в группах пациенток. Для всех клинико-
цессах эндометрия для выбора научно
анамнестических факторов был рассчитан пока-
обоснованной дифференцированной тактики ве-
затель относительного риска (ОР) развития рака
дения больных.
эндометрия. На основании показателей ОР выде-
Поставленные задачи:
лены основные факторы риска малигнизации па-
тологических процессов эндометрия, которые
1. Выявить наиболее значимые клинико-ана-
были выбраны согласно следующим критериям:
мнестические факторы риска возникновения,
высокий показатель ОР (больше 1) и доверитель-
прогрессирования гиперпластических процессов
ный интервал 95% (p < 0,05).
эндометрия и развития злокачественной транс-
формации эндометрия у женщин перименопау-
зального возраста с учетом статистического ана-
РЕЗУЛЬТАТЫ
лиза;
В нашем исследовании анализ наследственной
2. Оценить иммуногистохимические уровни
отягощенности пациенток выявил повышение
экспрессии маркеров полипотентных клеток в
частоты встречаемости злокачественных заболе-
эндометрии - ALDH1A1, Musashi1, Oct4, CD117,
ваний (в том числе и опухолей репродуктивной
БИОФИЗИКА том 64
№ 4
2019
ПРЕЦИЗИОННЫЙ ПОДХОД К ДИАГНОСТИКЕ
813
системы) у родственников первой линии, среди
сти кровотока в аркуатных артериях (Vmax =
пациенток с атипической гиперплазией эндомет-
= 0,35 ± 0,07 м/с, Vmin = 0,17 ± 0,1 м/с). Индекс
рия и раком эндометрия по сравнению с женщи-
резистентности также статистически отличался
нами с гиперплазией без атипии и контрольной
только при раке эндометрия
(0,3
±
0,04)
группы. Наибольшее значение показателя ОР -
по сравнению с аналогичным показателем у
показателя наследственной онкологической отя-
больных первой группы (0,57 ± 0,44). В нашем ис-
гощенности - оказалось у больных 4-й группы
следовании статистически значимый показатель
(ОР = 3,71), а наиболее низкий во 2-й группе
выраженного кровотока имел место у 20 пациен-
(ОР = 0,72, р < 0,05). Согласно литературным дан-
ток (87%) при злокачественных поражениях мат-
ным [14], опухоли половой системы и опухоли
ки (ОР = 9,28), что согласуется с данными других
экстрагенитальной локализации у ближайших
авторов, указывающих на низкий индекс рези-
родственниц встречаются у четверти пациенток с
стентности и выраженный кровоток в эндомет-
заболеваниями эндометрия.
рии как маркер злокачественного процесса [21-
При изучении соматических заболеваний вы-
23].
явлено, что наиболее часто встречающееся сопут-
ствующее заболевание - это гипертоническая бо-
Частота рецидивирования гиперпластических
лезнь (всего 87 случаев или 45,5%), частота кото-
процессов в анамнезе была достоверно выше в
рой возрастает от 1-й группы (6 случаев или
4-й группе (один-два рецидива - 26%, три-четы-
18,8%) к 4-й группе (14 случаев или 61%). Анало-
ре рецидива - 13%), что, вероятно, свидетель-
гичная тенденция к увеличению частоты встреча-
ствует о резистентности гиперплазии к проводи-
емости отмечена при сахарном диабете 2 типа
мой ранее терапии у данной категории больных, а
(всего 30 случаев или 15,7%): в 1-й группе - 2 слу-
также об их высоком пролиферативном потенци-
чая или
6,3%, во
2-й группе
- 11 случаев
але. Показатель ОР (рецидивирование) в 4-й
или 13,6%; в 3-й группе - 10 случаев или 18,2% и в
группе - 12,52, а во 2-й группе - 2,37 (р < 0,05),
4-й группе - 7 случаев или 30,4% (р < 0,05). Из ос-
что подтверждает правильность выбора рециди-
новных экстрагенитальных заболеваний у обсле-
вирования в качестве клинически значимого
дованных больных наиболее высокие уровни ОР
фактора риска развития рака эндометрия. Полу-
имели место при гипертонической болезни
ченные нами показатели частоты рецидивирова-
(ОР = 3,25) и сахарном диабете (ОР = 4,87).
ния гиперпластического процесса согласуются с
данными, представленными в Green-top Guide-
При исследовании частоты ожирения также
line No.67 [24] и свидетельствующими о значи-
отмечена стойкая тенденция к ее увеличению в
тельной частоте рецидивов гиперпластического
ряду от 1-й группы (4 %) к 4-й группе (14 %), по-
процесса эндометрия после проведенного лече-
казатель ОР также оказался наиболее высоким у
ния и возможности наличия базального рака эн-
больных 4-й группы и составил 9,59 (р < 0,05).
дометрия у женщин, не поддающихся терапии и
Полученные нами результаты совпадают с
имеющих рецидивирующее течение гиперпла-
мнением большинства исследователей, свиде-
стического процесса.
тельствующих, что высокую частоту эндокринно-
обменных нарушений следует рассматривать как
При обследовании пациенток в стационаре
патогенетическую основу возникновения ГПЭ и
были обнаружены сопутствующие гинекологиче-
рака эндометрия в перименопаузе [15-17].
ские заболевания. Миома матки и/или аденомиоз
чаще наблюдались в группах с атипической ги-
При изучении репродуктивного анамнеза выяв-
перплазией (30 случаев или 54,5%) и раком тела
лена высокая частота бесплодия в анамнезе у паци-
матки (14 случаев или 61%), что, возможно, обу-
енток с раком тела матки (47,8%). В структуре бес-
словлено взаимостимулирующим влиянием па-
плодия преобладал эндокринный генез - 32 случая
тологических процессов эндо- и миометрия, реа-
(94,1%). Расчет ОР позволил выделить бесплодие в
лизующихся через механизмы межклеточных вза-
качестве клинически значимого фактора риска
имодействий посредством влияния факторов
в развитии рака эндометрия: в 4-й группе - 5,1, а во
роста.
2-й группе - 1,58 (р > 0,05), что подтверждается дан-
ными, полученными другими исследователями, о
Признаки синдрома поликистозных яичников
связи между бесплодием, ановуляцией и риском
наблюдались чаще у пациенток с атипической ги-
развития рака эндометрия [18-20].
перплазией и раком тела матки (16,4% и 21,4% со-
Ультразвуковое исследование с цветовым до-
ответственно) по сравнению с больными 2-й
пплеровским картированием при раке эндомет-
группы (11 случаев или 13,6%). Синдром полики-
рия позволило выявить резкое повышение скоро-
стозных яичников в качестве фактора риска раз-
БИОФИЗИКА том 64
№ 4
2019
814
КОГАН и др.
вития ГПЭ и рака тела матки подтвержден в дру-
Патологические процессы эндометрия еще до
гих исследованиях [9,17,25].
патоморфологических изменений характеризу-
ются нарушением молекулярной архитектоники,
Выявление показателей ОР среди сопутствую-
что требует применения в клинической медицине
щих гинекологических заболеваний подтвердили
новых технологий, с внедрением которых появи-
правомочность выбора сопутствующих миомы
лась необходимость в уточнении и пересмотре
и/или аденомиоза (ОР = 3,9), а также синдрома
ряда концептуальных аспектов, касающихся про-
поликистозных яичников (ОР = 7,22), в качестве
блемы ранней диагностики, лечения и профилак-
клинически значимых факторов риска развития
тики заболеваний эндометрия [30-32].
рака эндометрия.
В связи с этим нами были проведены исследо-
Однако наличие только лишь клинико-ана-
вания по выявлению молекулярно-биологиче-
мнестических факторов прогнозирования рака
ских особенностей патогенеза патологических
эндометрия недостаточно для создания эффек-
процессов эндометрия, при гиперплазии эндо-
тивной прогностической модели, в связи с чем
метрия без атипии, гиперплазии эндометрия с
мы провели исследование по выявлению допол-
атипией, высокодифференцированной адено-
нительных молекулярно-биологических факто-
карциноме, а также в контрольном нормальном
ров риска развития рака эндометрия путем де-
эндометрии.
тального анализа выявленных морфофункцио-
нальных и иммуногистохимических показателей
Правильно выбранная комбинация маркеров
с вышеуказанными клиническими факторами
может отражать патобиологическую сущность ги-
риска.
перпластического процесса эндометрия и в ком-
Для морфологической диагностики всем па-
плексе с традиционным морфологическим мето-
циенткам с подозрением на патологический про-
дом применяться в практической деятельности
цесс эндометрия на первом этапе проводили ас-
врача, расширяя представления о течении заболе-
пирационную биопсию эндометрии, при получе-
вания.
нии отрицательного результата (отсутствии рака
Важно отметить, что опухоль формируется
эндометрия) дополнительно проводили офисную
различными популяциями гетерогенных типов
гистероскопию. Аспирационная биопсия эндо-
клеток, а понимание их происхождения и роли
метрия - адекватный первый шаг при подозре-
является основой для разработки стратегии диа-
нии на патологический процесс эндометрия.
гностики, терапии и профилактики.
По данным Practice Bulletin no. 128 (American
Обращает на себя внимание, что изучение пу-
College of Obstetricians and Gynecologists) [26] при
тей передачи сигналов, участвующих в самооб-
получении отрицательного результата проведен-
новлении и поддержании зрелых стволовых кле-
ной аспирационной биопсии у женщин с подо-
ток, может указывать на происхождение раковых
зрением на гиперпластический процесс или рак
клеток из стволовых [33].
эндометрия целесообразно дальнейшее проведе-
Присутствующие в опухолевой ткани клетки,
ние гидросонографии или гистероскопии.
обладающие свойствами «side population», приня-
Морфологическое исследование биопсийного
то называть раковыми стволовыми клетками
материала (эндометрий) позволило выявить ги-
(Cancer Stem Cells, CSC) [34].
перплазию с атипией и без нее, а также аденокар-
Раковые стволовые клетки определяются как
циному эндометрия. Мы полагаем, что эндомет-
«клетки внутри опухоли, которые обладают спо-
риальная гиперплазия может рассматриваться
собностью к самообновлению и дают начало раз-
как последовательный спектр пролиферативных
личным линиям раковых клеток, составляющих
изменений, постепенно возрастающих в своей
опухоль» [35].
морфологической выраженности от гиперплазии
В настоящее время считается, что CSC играют
без атипии до атипической гиперплазии. Следует
ключевую роль в развитии и прогрессировании
отметить, что вышеуказанной точки зрения при-
рака различных локализаций [34, 36].
держиваются и ряд других авторов [8,27-29].
CSC были описаны для нескольких видов опу-
Основой ранней диагностики патологических
холей человека, включая рак эндометрия [37-39]
пролиферативных процессов эндометрия остает-
ся гистологическое исследование. В то же время
Существуют убедительные данные о том, что
морфологические критерии дифференциальной
лекарственная устойчивость и рецидивирование
диагностики атипической гиперплазии и высоко-
опухолей во многом могут быть обусловлены на-
дифференцированной аденокарциномы эндо-
личием CSC. В связи с этим создание специфич-
метрия разноречивы и во многом субъективны.
ных молекулярных маркеров CSC имеет чрезвы-
БИОФИЗИКА том 64
№ 4
2019
ПРЕЦИЗИОННЫЙ ПОДХОД К ДИАГНОСТИКЕ
815
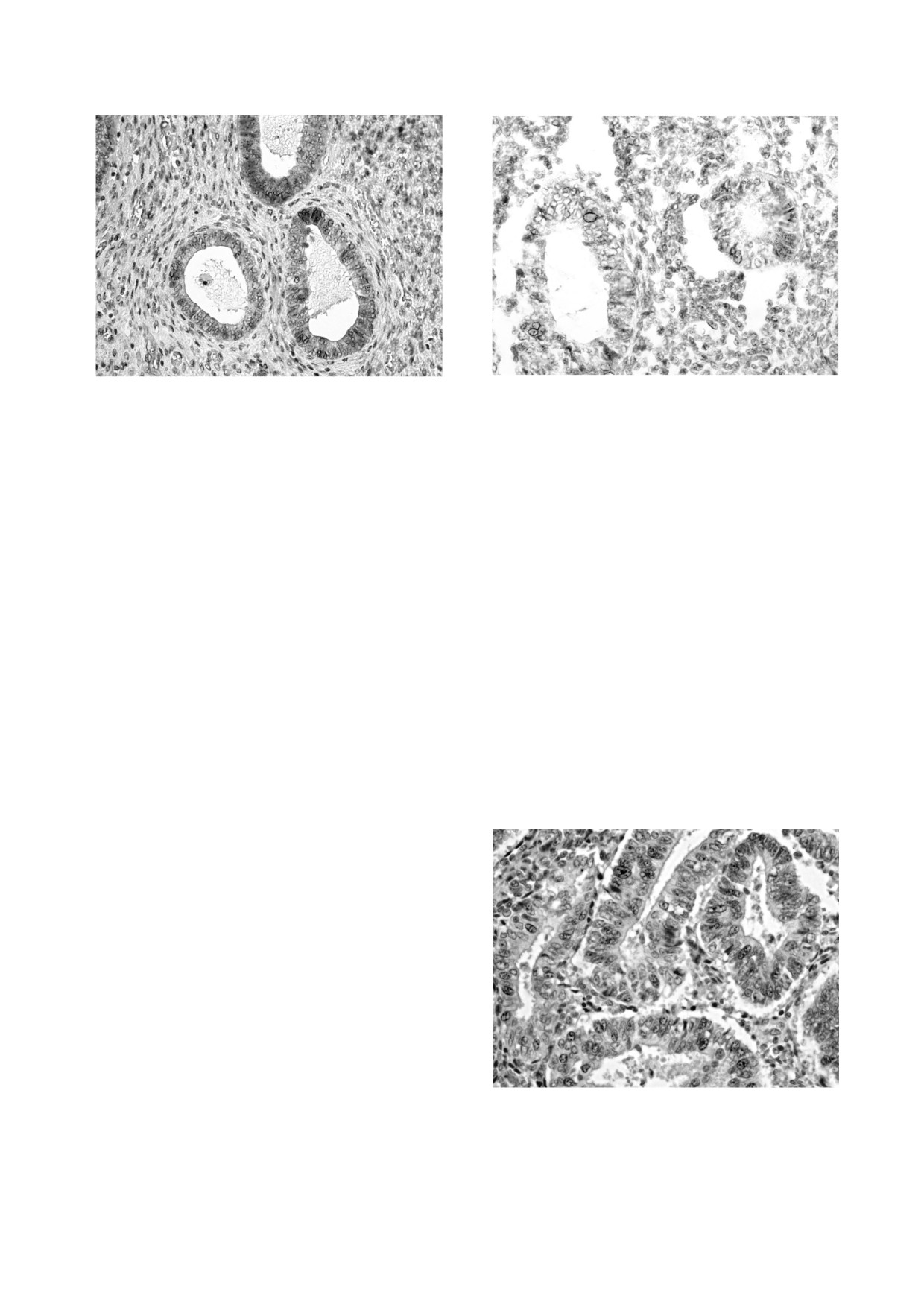
Рис. 1. Иммуногистохимическое окрашивание препа-
Рис. 2. Иммуногистохимическое окрашивание препа-
рата ткани эндометрия (маркер ALDH1A1).
рата ткани эндометрия (маркер Musashi1).
чайно важное значение для выделения этих кле-
го на поверхности ядерной мембраны, рис. 2)
ток и разработки новых подходов к терапии и
стабильно возрастал при появлении клеточной
профилактике опухолевых заболеваний [11,40].
атипии ткани, так, в контрольной группе и при
гиперплазии эндометрия без атипии его уровень
Проведенный нами тщательный анализ совре-
был близок к 0, в группе атипической гиперпла-
менных данных литературы позволил выделить
зии эндометрия в среднем равнялся 4,3% и резко
ряд наиболее перспективных маркеров CSC -
возрастал при раке эндометрия, составляя в
ALDH1A1, MUSASHI1, Oct4, CD117 и HOXA10,
среднем 23%. ОР показателя уровня экспрессии
которые были исследованы в настоящей работе.
Musashi1 - 23.
Согласно данным нашего исследования в тка-
Роль Musashi1 в CSC может быть связана с
ни эндометрия в ряду от простой гиперплазии до
аномальными механизмами клеточного цикла и
рака эндометрия отмечено стабильное возраста-
апоптоза, как было показано в работе [42]. Mu-
ние уровня экспрессии ALDH1A1, наиболее ярко
sashi1 модулирует пути развития клетки и ее апо-
эта тенденция видна в иммуногистохимических
птоза через факторы стволовости Notch-1, Hes-1
препаратах на примере окрашивания эпители-
и p21WAF1/CIP1 в эндометриальной карциноме.
альных ядер (рис. 1). При гиперплазии эндомет-
Эти новые исследования свидетельствуют о Mu-
рия без атипии процент окрашенных ядер состав-
sashi1 как о новой интересной мишени воздей-
ляет менее 0,5%, а по мере прогрессирования кле-
точной и тканевой атипии повышается до 20,2 (в
группе атипической гиперплазии), при раке эн-
дометрия он составляет 18,4%. ОР показателя
уровня экспрессии ALDH1A1 - 18,4.
В одном из исследований была выявлена вы-
сокая активность ALDH сопряженная с плохим
прогнозом при аденокарциноме эндометрия. Вы-
сокое выражение ALDH1 являлось независимым
фактором неблагоприятного прогноза. При вы-
сокой активности ALDH (ALDH-hi) раковый
процесс обладал большим инвазивным ростом, с
высокой антиапоптотической и онкогенной ак-
тивностью, в сравнении с препаратами, в кото-
рых была выявлена его низкая активность (AL-
DH-Lo) [41].
В нашей работе было установлено, что в ис-
следованных препаратах ткани эндометрия уро-
Рис. 3. Иммуногистохимическое окрашивание препа-
вень экспрессии маркера Musashi1 (выявляемо-
рата ткани эндометрия (маркер Oct4).
БИОФИЗИКА том 64
№ 4
2019
816
КОГАН и др.
В ряде других исследований была описана ано-
мальная экспрессия генов Oct4 в карциномах эн-
дометрия [44,45]. В работе, проводившей оценку
экспрессии маркеров стволовости в образцах аде-
нокарциномы эндометрия, была выявлена экс-
прессия Oct4 (42/55, 76,4%). Субпопуляции рако-
вых клеток из всех образцов аденокарциномы
(15/15, 100%), показали способность образовы-
вать новые опухоли, в которых также имелось вы-
ражение Nanog, Oct4 и Sox2, они показывали бо-
лее высокий пролиферативный потенциал и низ-
кий уровень апоптоза, чем дифференцированные
клетки [46].
CD117 (KIT) - цитокиновый рецептор, экс-
прессирующийся на поверхности гематопоэтиче-
Рис. 4. Иммуногистохимическое окрашивание препа-
ских стволовых клеток, а также некоторых других
рата ткани эндометрия (маркер CD117).
клеток, измененные формы рецептора ассоции-
рованы с некоторыми типами рака, являясь ре-
цептором для стволового фактора роста, так на-
ствия и открывают широкие перспективы для те-
зываемого лиганда «c-kit». [47].
рапии рака эндометрия.
Oct4 - белковый транскрипционный фактор,
При проведении окрашивания препаратов эн-
необходимый для поддержания плюрипотентно-
дометрия от пациенток, включенных в наше ис-
сти стволовых клеток [43].
следование, антителами к CD117 (рис. 4) было
выявлено стойкое увеличение уровня экспрессии
В проведенном нами исследовании иммуноги-
этого маркера в ряду от пролиферативного эндо-
стохимическое изучение ткани эндометрия
метрия до рака, фокусы окрашивания присут-
(рис. 3) всех пациенток выявило стабильное уве-
ствовали и в строме, и в сосудах исследованной
личение уровня экспрессии Oct4 в группах срав-
ткани, но наибольшее и статистически значимое
нения. В ядрах эпителия в контрольной группе
возрастание его уровня отмечено в ядрах эпите-
этот показатель составил 0,13%, в группе гипер-
лия (0,67 ± 0,7%, 0,23 ± 0,45%, 18,3 ± 17,3%,
пластического процесса эндометрия без атипии
17,6 ± 2,4% в первой-четвертой группах соответ-
был приближен к 1%, в группе атипической ги-
ственно), в то время как в цитоплазме эпителия
перплазии эндометрия отмечено его резкое воз-
уровень окраски был близок к 0. ОР показателя
растание до 18%, а при раке эндометрия доля
уровня экспрессии CD117 - 17,6.
окрашенных клеток составила в среднем 17,5%.
ОР показателя уровня экспрессии Oct4 - 17,5.
Злокачественные стволовые клетки эндомет-
рия рассматриваются в качестве потенциальной
терапевтической мишени, а маркер CD117 может
быть использован для их идентификации. [48]
В нашем исследовании экспрессия HOXA10 в
тканях эндометрия (рис. 5) была подвержена сле-
дующей тенденции: ее уровень постепенно воз-
растал в ряду от пролиферативного эндометрия к
атипической гиперплазии, несколько снижаясь
при раке. Наиболее выраженные различия в уров-
не экспрессии этого белка были выявлены в ядрах
эпителия: в группе сравнения и при гиперплазии
без атипии экспрессия HOXA10 была близка к ну-
лю, резко возрастая при атипической гиперпла-
зии (20,9 ± 15,3%), а при аденокарциноме про-
цент окрашенных клеток оставался сопоставим с
3-й группой и имел тенденцию к небольшому
Рис. 5. Иммуногистохимическое окрашивание препа-
снижению, составляя в среднем 18,5 ± 7%. ОР по-
рата ткани эндометрия (маркер HOXA10
казателя уровня экспрессии HOXA10 - 18,5.
БИОФИЗИКА том 64
№ 4
2019
ПРЕЦИЗИОННЫЙ ПОДХОД К ДИАГНОСТИКЕ
817
Согласно концептуальной модели CSC гене-
С использованием метода бинарной логисти-
тические изменения, возникающие в эндометри-
ческой регрессии определена вероятность разви-
альных стволовых клетках, расположенных в ба-
тия онкопатологии пациентки по формуле:
зальном слое эндометрия, остаются и передаются
p = 1/(1 + e-z), где е - основание натурального
следующим поколениям клеток, которые могут
логарифма и равно 2,718; z = -49,85 + Х1 +
даже накапливать дополнительные генетические
+ 0,174·Х2 + 0,521·Х3 + 0,387·Х4 + 0,156·Х5 +
+ 1,390·Х6 + 1,114·Х7 + 0,622·Х8 + 0,508·Х9 +
изменения [49] и, как считается, могут лежать в
+ 0,304·Х10 + 0,105·Х11 + 2,083·Х12 + 1,164·Х13 +
основе эндометриального канцерогенеза.
+ 0,637·Х14 + 0,473·Х15 (Х1 - морфотип (1 - ги-
Авторы работы [50] подчеркивают, что отли-
перплазия без атипии, 2 - гиперплазия с атипи-
чия раковых стволовых клеток от родительских
ей), Х2 - ожирение, Х3 - синдром поликистозных
опухолей могут быть объяснены предыдущими
яичников, Х4 - рецидивирование ГПЭ, Х5 - бес-
эпигенетическими изменениями.
плодие (первичное и вторичное), Х6 - ультразву-
ковое исследование с цветовым допплеровским
Важно отметить, что полученные результаты
картированием - низкорезистентный и выра-
иммуногистохимических исследований позволи-
женный кровоток, Х7 - гипертоническая бо-
ли выявить одно из наиболее перспективных на-
лезнь, Х8 - сахарный диабет второго типа, Х9 -
правлений таргетной терапии при патологиче-
сочетанная патология матки (миома и/или адено-
ских процессах эндометрия - терапии, направ-
миоз), Х10 - наследственные онкозаболевания;
ленной на опухолевые стволовые клетки. Укажем
Х11 - ALDH1A1, Х12 - Musashi1, Х13 - Oct4,
Х14 - CD117, Х15 - HOXA10).
также на одно из перспективных направлений
борьбы с патологическими процессами эндомет-
В данной формуле учитывались также данные
рия, разрабатываемых в работах [51,52].
мета-анализа о частоте злокачественной транс-
формации гиперпластических процессов эндо-
В целом направление таргетной терапии при
метрия в пременопаузальном возрасте: Х1 - мор-
заболеваниях эндометрия находится еще на на-
фотип (1 - гиперплазия без атипии, 2 - ком-
чальном этапе развития и диктует необходимость
плексная гиперплазия с атипией).
проведения дальнейших исследований, подтвер-
Для облегчения практического применения
ждающих их эффективность. В то же время оцен-
данной прогностической модели нами был разра-
ка молекулярных показателей в прогнозировании
течения патологических процессов эндометрия
ботан метод компьютерного расчета на основе
требует внедрения уже в настоящее время.
программы Microsoft Excel, показатели в которую
вводятся в соответствии с обнаруженными фак-
Нами с целью повышения эффективности ме-
торами риска (0 - при отсутствии фактора, 1 -
тода прогнозирования риска развития рака эндо-
при его наличии). В итоге мы получаем риск раз-
метрия были проанализированы суммарные кли-
нико-патогенетические показатели.
вития рака эндометрия для конкретной пациент-
ки (низкий или высокий). Низкая вероятность
Изученные иммуногистохимические показа-
развития рака - p = 0,0-0,49, высокая вероят-
тели могут использоваться в качестве ранних про-
ность развития рака - p = 0,5-1,0. Чувствитель-
гностических патогенетических критериев ати-
ность у больных четвертой группы составила 95%.
пии и рака эндометрия.
После проведения статистического анализа
основных клинико-анамнестических и молеку-
Мы полагаем, что на современном этапе опре-
лярных факторов было установлено, что отсут-
деляющее значение в выборе лечебной тактики
ствие сильной корреляции между признаками и
должно иметь морфологическое заключение,
наличие разных комбинаций клинических, диа-
подкрепленное данными молекулярно-биологи-
гностических и молекулярно-биологических дан-
ческих исследований, которые нивелируют воз-
ных позволяет использовать вышеперечислен-
можную ошибку патоморфолога при оценке сте-
ные показатели как факторы риска развития он-
пени тяжести тех или иных морфологических из-
копатологии эндометрия.
менений, а в ряде случаев опережают эти
Были рассчитаны коэффициенты клиниче-
изменения.
ских и иммуногистохимических показателей для
Именно интегральный анализ данных клини-
создания окончательной прогностической мо-
ческого, морфологического и иммуногистохими-
дели.
ческого исследований дает результативную воз-
В результате проведенного многофакторного
можность ранней диагностики и прогнозирова-
анализа нами были получены коэффициенты для
ния характера течения заболевания.
достоверной математической модели, позволяю-
щей прогнозировать риск возникновения рака
Ретроспективный анализ проведенной стан-
эндометрия.
дартной терапии гиперпластических процессов
БИОФИЗИКА том 64
№ 4
2019
818
КОГАН и др.
эндометрия в сопоставлении с выявленными сте-
молекулярной генетики с выявлением ранних
пенями риска злокачественной трансформации
молекулярных и клеточных маркеров, в том числе
эндометрия выявил следующие особенности так-
и ранее выявление опухолевых стволовых клеток.
тики ведения и лечения больных.
В заключение следует отметить, что предло-
Консервативная терапия оказалась эффектив-
женные в настоящем исследовании подходы наи-
ной и не было отмечено рецидивов за все время
более полно соответствуют принципам персона-
наблюдения у 64 из 65 пациенток с ГПЭ без ати-
лизированной медицины, являющейся на сего-
пии с выявленным низким риском злокачествен-
дняшний день наиболее перспективным путем
ной трансформации.
развития современной медицины, где основны-
Консервативная терапия оказалась неэффек-
ми направлениями являются таргетная терапия и
тивной у 14 из 16 женщин с ГПЭ без атипии с вы-
предиктивная медицина, основу которой, в свою
явленным высоким риском малигнизации, в свя-
очередь, составляет индивидуальное прогнозиро-
зи с чем им было рекомендовано оперативное ле-
вание рака, в том числе и рака эндометрия.
чение.
Следует отметить, что в подавляющем боль-
шинстве случаев (n = 51) у женщин с атипической
ВЫВОДЫ
гиперплазией выявлен высокий риск малигниза-
1. Наиболее клинически и статистически зна-
ции и всего четыре случая низкого риска онко-
чимыми факторами риска прогрессирования па-
трансформации процесса. Интересен тот факт,
тологического процесса эндометрия являются
что у двух пациенток с атипической гиперплазией
(по степени значимости): рецидивирование ГПЭ
и выявленным низким риском, которые отказа-
лись от радикальных методов лечения, проведен-
(ОР - 12,52), ожирение (ОР - 9,28), выраженный
ная медикаментозная терапия оказалась эффек-
кровоток и низкий индекс резистентности при
тивной.
ультразвуковом исследовании с цветовым до-
Итак, ретроспективный анализ сопоставления
пплеровским картированием (ОР - 7,22), син-
выявленных групп риска развития злокачествен-
дром поликистозных яичников (ОР - 6,96), бес-
ной трансформации и исходов лечения позволил
плодие (первичное и вторичное) (ОР - 5,1), са-
определить, что ни у одной из пациенток с рас-
харный диабет второго типа (ОР
-
4,87),
считанным низким риском злокачественной
сочетанная патология матки (миома и/или адено-
трансформации патологического процесса эндо-
миоз) (ОР - 3,9), наследственная отягощенность
метрия за все время наблюдения не было выявле-
онкозаболеваниями (ОР - 3,71), гипертониче-
но прогрессирования гистологической картины
ская болезнь (ОР - 3,25);
заболевания в сторону рака: все пациентки были
излечены, а у женщин, подвергшихся оператив-
2. Показатели экспрессии ALDH1A1, Mu-
ному лечению, гистологическая картина соответ-
sashi1, Oct4, CD117, HOXA10 возрастают в ряду от
ствовала той же стадии, что и при первом обраще-
хронического эндометрита до атипической ги-
нии к врачу. У большинства пациенток с высоким
перплазии и аденокарциномы эндометрия, что
риском злокачественной трансформации было
свидетельствует о вовлеченности нарушения
выявлено прогрессирование процесса, либо раз-
дифференцирования стволовых клеток эндомет-
витие рака эндометрия.
рия в прогрессирование патологического процес-
са и злокачественной трансформации эндомет-
РЕЗУЛЬТАТЫ
рия;
Полученные результаты исследования позво-
3. Сочетанное определение клинических и мо-
ляют утверждать, что на современном этапе раз-
лекулярно-биологических особенностей с ис-
вития науки в алгоритм диагностики ГПЭ долж-
пользованием многофакторного анализа мето-
ны быть включены определение уровней имму-
дом бинарной логистической регрессии позволи-
ногистохимических маркеров плюрипотентных
ло разработать способ определения степени
клеток с последующим осуществлением прогно-
риска прогрессирования патологического про-
зирования степени риска развития рака эндомет-
цесса эндометрия и научно обоснованно форми-
рия и соответственно дальнейшего дифференци-
ровать группы пациенток низкой и высокой сте-
рованного подхода к лечению.
пени онкологического риска;
Таким образом, современная стратегия про-
4. Дифференцированный подход к тактике ве-
гнозирования онкопатологии органов репродук-
дения больных с гиперпластическими процесса-
тивной системы - междисциплинарный подход,
ми эндометрия в перименопаузальном возрасте
основанный на использовании данных клиники,
базируется на выявлении степени риска развития
морфологических исследований и результатов
рака эндометрия (низкая, высокая) и соответ-
БИОФИЗИКА том 64
№ 4
2019
ПРЕЦИЗИОННЫЙ ПОДХОД К ДИАГНОСТИКЕ
819
ствующем выборе медикаментозной или хирур-
25.
V. Chandra, J. J. Kim, D. M. Benbrook, et al., J. Gyne-
col. Oncol. 27 (1), e8 (2016).
гической тактики лечения.
26.
26. M. J. Hill, E. D. Levens, and A. H. Decherney,
ACOG Practice Bull. 120, 197 (2012).
СПИСОК ЛИТЕРАТУРЫ
27.
T. J. Clark, D. Neelakantan, and J. K. Gupta, Eur. J.
Obstetrics & Gynecol. and Reprod. Biol. 125 (2), 259
1.
В. И. Киселев, И. С. Сидорова, А. Л. Унанян и др.
(2006).
Гиперпластические процессы органов женской
28.
L. C. Horn, U. Schnurbusch, B. Hentschel, et al., Int.
репродуктивной системы: теория и практика
J. Gynecol. Cancer 14 (2), 348 (2004).
(Медпрактика-М, М., 2011).
29.
B. E. Montgomery, G. S. Daum, and C. J. Dunton,
2.
А. Н. Стрижаков и А. И. Давыдов,
Rev. Obstetrical & Gynecological Survey 59 (5), 368
Доброкачественные заболевания матки (ГЭОТАР-
(2004).
Медиа, М., 2011).
30.
Общая патология человека. Руководство для врачей,
3.
Гинекология: национальное руководство, под ред.
под ред. А. И. Струкова, В. В. Серова и Д. С.
В. И. Кулакова, И. Б. Манухина и Г. М. Савель-
Саркивова (Медицина, М., 1990).
евой (ГЭОТАР-Медиа, М., 2007).
31.
S. P. Ho, K. T. Tan, M. W. Pang, and T. H. Ho, Singa-
4.
Ю. Э. Доброхотова и Л. В. Сапрыкина, Гиперплазия
pore Med. J. 38 (1), 11 (1997).
эндометрия (ГЭОТАР-Медиа, Москва, 2016).
32.
F. H. Igney and P. H. Krammer, Nature Rev. 2 (4), 277
5.
Л. А. Ашрафян и В. И. Киселев, Опухоли
(2002).
репродуктивных органов (этиология и патогенез)
33.
K. Kato, T. Takao, A. Kuboyama, et al., Am. J. Pathol.
(Ди-митрейд График Групп, М., 2007).
176 (1), 381 (2010).
6.
Состояние онкологической помощи населению
34.
P. P. Szotek, R. Pieretti-Vanmarcke, P. T. Masiakos,
России в 2017 г., под ред. А. Д. Каприна, В. В. Ста-
et al., Proc. Natl. Acad. Sci. USA 103 (30), 11154
ринского и Г. В. Петровой (МНИОИ им.
(2006).
П.А. Герцена, М., 2018).
35.
M. F. Clarke, J. E. Dick, P. B. Dirks, et al., Cancer Res.
7.
Р. Р. Сагиндыкова, С. И. Аскольская, Е. А. Коган и
66 (19), 9339 (2006).
В. Д. Чупрынин, Акушерство и гинекология, № 7,
22 (2014).
36.
A. B. Alvero, R. Chen, H. H. Fu, et al., Cell Cycle 8 (1),
158 (2009).
8.
Г. Е. Чернуха, Г. Т. Сухих, В. П. Сметник и др.,
Пробл. репрод. 10 (4), 30 (2004).
37.
R. W. Chan, K. E. Schwab, and C. E. Gargett, Biol. Re-
9.
В. И. Киселев, И. С. Сидорова, А. Л. Унанян и др.,
prod. 70 (6), 1738 (2004).
Гиперпластические процессы органов женской
38.
A. M. Friel, P. A. Sergent, C. Patnaude, et al., Cell Cy-
репродуктивной системы: теория и практика
cle 7 (2), 242 (2008).
(Медпрактика-М, М., 2011).
39.
C. E. Gargett, Aust. N. Z. J. Obstet. Gynaecol. 46 (3),
10.
S. A. Bapat, Reproduction 140 (1), 33 (2010).
250 (2006).
11.
A. Fabian, G. Vereb, and J. Szollosi, Cytometry A 83
40.
S. A. Bapat, Reproduction 140 (1), 33 (2010). DOI:
(1), 62 (2013).
10.1530/REP-09-0389.
12.
А. И. Ищенко, Е. А. Кудрина и И. В. Станоевич,
41.
N. Rahadiani, J.-I. Ikeda, S. Mamat, et al., Cancer Sci.
Врач, № 8, 14 (2008).
102, 903 (2011).
13.
CL Trimble, J Kauderer, R Zaino, et al., Cancer 106,
42.
M. Gotte, B. Greve, R. Kelsch, et al., Int. J. Cancer 129
812 (2006).
(8), 2042 (2011).
14.
E. I. Joensuu, W. M. Abdel-Rahman, M. Ollikainen, et
43.
H. R. Scholer, S. Ruppert, N. Suzuki, et al., Nature
al. Cancer Res. 68, 4597 (2008).
344, 435 (1990).
15.
M. R. Wise, V. Jordan, A. Lagas, et al., Am. J. Obstet.
Gynecol. 214 (6), 689.e1 (2016).
44. Y. Wu, S. Liu, H. Xin, et al., Cancer 117, 3989 (2011).
16. Г. М. Савельева и В. Н. Серов, Предрак эндометрия
45.
S. Peng, N. J. Maihle, and Y. Huang, Oncogene 29,
(Медицина, М., 1980).
2153 (2010).
17. Я. В. Бохман, Руководство по онкогинекологии
46.
X. Zhou, Y. P. Zhou, G. R. Huang, et al., Int. J. Gyne-
(Медицина, Л., 1989).
col. Pathol. 30 (3), 262 (2011).
18. Y. Kuribayashi, K. Nakagawa, R. Sugiyama, et al., J.
47.
C. E. Edling and B. Hallberg, Int. J. Biochem. Cell
Obstet. Gynaecol. Res. 43 (9), 1465 (2017).
Biol. 39 (11), 1995 (2007).
19. J. M. Rubatt, B. M. Slomovitz, T. W. Burke, et al., Gy-
48.
S. Kyo and K. Kato, Semin. Reprod. Med. 33 (5), 341
necol. Oncol. 99 (2), 4726 (2005).
(2015).
20. A. J. Ryan, В. Susil, T. W. Jobling, et al., Cell Tissue
Res. 322, 53 (2005).
49.
S. Kyo, Y. Maida, and M. Inoue, Cancer Lett. 308 (2),
123 (2011).
21. R. Machtinger, J. Korach, A. Padoa, et al., Int. J. Gy-
necol. Cancer 15, 3258 (2005).
50.
N. B. Berry and S. A. Bapat, J. Ovarian Res. 1, 8 (2008).
22. I. V. Stolyarova, B. A. Minko, and B. R. Sirazitdinov, in
DOI:10.1186/1757-2215-1-8.
Materials of 19 Intern. Congr. on AntiCancer Treatment
51.
Е. Н. Бургова, Н. А. Ткачев и А. Ф. Ванин,
(Paris, 2008), pp. 255-256.
Биофизика 57, 105 (2012).
23. И. С. Сидорова, Т. Д. Гуриев, И. Н. Капустина и
52.
A. F. Vanin, E. N. Burgova, and L. V. Adamyan, Austin
др., Медицинская визуализация, № 2, 88 (2001).
J. Reproductive Medicine & Infertility 2, 1019 (2015).
24. I. D. Gallos, M. Alazzam, T. J. Clark, et al., Manage-
ment of Endometrial Hyperplasia (Green-top Guideline
53.
E. N. Burgova, Y. I. Christidis, A. V. Kurkov, et al., Cell
No. 67. RCOG/BSGE Joint Guideline, 2016).
Biochem. Biophys. 77, 89 (2019).
БИОФИЗИКА том 64
№ 4
2019
820
КОГАН и др.
Precision Approach to the Diagnosis and Choice of Tactics in the Treatment
of Endometrial Hyperplasia in Perimenopause
E.A. Kogan*, A.L. Unanyan*, V.A. Namiot**, D.V. Baburin*, and S.N. Udaltsov***
*Sechenov First Moscow State Medical University, Ministry of Health of the Russian Federation,
ul. Trubetskaya 8/2, Moscow, 119991 Russia
**Institute of Nuclear Physics, Lomonosov Moscow State University,
Leninskie Gory 1, Moscow, 119991 Russia
***Institute of Physicochemical and Biological Problems in Soil Science, Russian Academy of Sciences,
ul. Institutskaya 3, Pushchino, Moscow Region, 142290 Russia
This study aims to identify the most significant clinicoanamnestic and molecular risk factors for occurrence
and progression of endometrial hyperplastic processes and the development of endometrial malignant trans-
formation in women going through perimenopause, taking statistical analysis into account. The results of our
work were analyzed and statistically significant risk factors for endometrial cancer were found. The method
of binary logistic regression was used to estimate the risk of developing cancer and the effective management
strategies for patients with endometrial hyperplastic processes in perimenopause were defined
Keywords: endometrial hyperplastic process, endometrial hyperplasia, endometrial cancer, risk factors, perimeno-
pause, cancer prediction, stem cells
БИОФИЗИКА том 64
№ 4
2019